4,7-дигідро-3-арил-4,4′-діоксо-9-карбамідотіопірано-1,2,3-триазолопіримідини і спосіб їх одержання
Номер патенту: 94674
Опубліковано: 25.05.2011
Автори: Десенко Сергій Михайлович, Сірко Світлана Миколаївна, Гладков Євгеній Станіславович, Афанасіаді Людмила Михайлівна
Формула / Реферат
1. 4,7-Дигідро-3-арил-4,4'-діоксо-9-карбамідотіопірано-1,2,3-триазолопіримідини загальної формули І
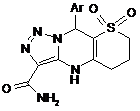 ,
,
де Аr = С6Н5, 4-СН3-С6Н4, 4-Сl-С6Н4, 4-Br-C6H4, 4-F-C6H4, 4-ОСН3-С6Н4, 2-СН3-С6Н4, 2-ОСН3-С6Н4, 2-Сl-С6Н4, 2,4-диОСН3-С6Н3, 2,4-диСl-С6Н3, 4-Br-3-F-C6H3.
2. Спосіб одержання сполук формули І
 ,
,
де Аr = С6Н5, 4-СН3-С6Н4, 4-Сl-С6Н4, 4-Br-C6H4, 4-F-C6H4, 4-ОСН3-С6Н4, 2-СН3-С6Н4, 2-ОСН3-С6Н4, 2-Сl-С6Н4, 2,4-диОСН3-С6Н3, 2,4-диСl-С6Н3, 4-Br-3-F-C6H3,
який відрізняється тим, що проводять конденсацію рівномолярних співвідношень 4-карамоїл-5-аміно-1,2,3-триазолу з тетрагідропіран-3-он-S,S-діоксидом і ароматичними альдегідами в льодяній оцтовій кислоті в умовах ультразвукового опромінювання при температурі 35-40 °С протягом 40-45 хвилин, цільовий продукт виділяють водою.
Текст
1. 4,7-Дигідро-3-арил-4,4'-діоксо-9карбамідотіопірано-1,2,3-триазолопіримідини загальної формули І Ar O O І (13) ДЕРЖАВНИЙ ДЕПАРТАМЕНТ ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ Винахід стосується галузі хімії і являє собою нові похідні азолопіримідинів, а саме 4,7-дигідро-3арил-4,4'-діоксо-9-карбамідотіопірано-1,2,3триазолопіримідини загальної формули І Ar O O N N O S N N H NH2 , I де Аr = С6Н5, 4-СН3-С6Н4, 4-Сl-С6Н4, 4-Br-C6H4, 4-F-C6H4, 4-ОСН3-С6Н4, 2-СН3-С6Н4, 2-ОСН3-С6Н4, 2-Сl-С6Н4, 2,4-диОСН3-С6Н3, 2,4-диСl-С6Н3, 4-Br-3F-C6H3. Складні азотовмісні гетероциклічні сполуки формули І мають фармакофорні фрагменти, що обумовлюють перспективність пошуку речовин з різними видами біологічної активності. Азолопіримідини входять до складу лікарських препаратів, які з успіхом використовуються при лікуванні захворювань, викликаних вірусом ВІЛ, ефективні при лікуванні ендокринної і серцевосудинної систем [Заявка ЕР № 267607, C07D 473/06; Заявка ЕР № 203721, C07D 473/06; Солдатников А. Т. и др. "Основы органической химии лекарственных веществ", Изд. Мир, Москва, 2007]. Ці сполуки проявляють гіпнотичну і алергічну активність, використовуються в урології [Barrow J. С. et al., J. Med. Chem., 43, 2703 (2000); Andersson K. Е. Urology, 50, 74 (1997); Chess-Williams R. et al., Br. (11) , UA NH2 (19) O 94674 N H 3 94674 J. Urol., 83, 1050 (1999)], при лікуванні ангіни, покращують серцевий і церебральний кровообіг [Пат. Японки № 63-1013836 C07D 487/04; А61K 31/505]. Тіазольний фрагмент входить складовою частиною до вітаміну В1 (тіамін), який призначають при порушенні функцій нервової системи. У вигляді тіаміну пірофосфату (кокарбоксилази) використовується при лікуванні склерозу, цукрового діабету і для нормалізації серцевого ритму. Відомий структурний аналог сполук формули І, що заявляються 5,5-діоксо-1,3,4,6,7,8гексагідротіопірано[3,3-d]піримідин-2-он формули II O 4 O C6H5 O S NH O N H , II і спосіб його одержання [Mattew M. Abelman et al., Tetrahedron Letters, 44, 4559-4562 (2003)]. Недоліком структури сполук формули II є те, що можливість хімічної модифікації молекул обмежена тільки введенням функціональних замісників у піримідиновому фрагменті. Спосіб одержання сполуки формули II складається із однієї стадії і здійснюється за схемою: O C6H5 O O S S C6H5OH NH + (NH2)2CO +C6H5CHO O N H . До розчину 23 ммоль сечовини в 30 мл гарячого етанолу додають 23 ммоль бензальдегіду, 15 ммоль тетрагідротіопіран-3-он-S,S-діоксиду і 0,12 мл соляної кислоти. Суміш нагрівають 24 години, охолоджують до кімнатної температури, відфільтровують, промивають ефіром. Одержують 5,5діоксо-4-феніл-1,3,4,6,7,8-гексагідротіопірано[3,2d]піримідин-2-он з виходом 64 %. Загальний час тривалості реакції складає приблизно 26-27 годин. Автори джерела стверджують, що використання соляної кислоти як каталізатора викликає побочні реакції, що зменшують виходи кінцевих продуктів і є недоліком відомого способу одержання сполуки II. Недоліком одержання сполуки формули II також є тривалість технологічного процесу, невисокий вихід кінцевого продукту, використання вогненебезпечних розчинників (діетиловий ефір). O N H N S NH2 N H III де R = 3-Вr-4-F, 3,4-диСl, 3-Cl-4-F, 3-CF3-4-F, 3СН3, 3-ОСН3 і інші, і спосіб його одержання [Drizin J., Holliday M. W. et al., Bioorganic and Med. Chem. Letters, 12, 1481-1484 (2002)]. Спосіб одержання сполук формули III одностадійний і реалізується за схемою: N + + O CHO O Відомий структурний аналог сполук формули І, що заявляються - 9-феніл-5,6,7,9-тетрагідро-4Н-8тіо-1,4,9'a-триазациклопента[b]нафтален-S,Sдіоксо формули III C6H4-R O O S N N R O II N C6H4-R O O S C6H4-R O O S + N N H (A) N N H (B) III Суміш 3-амінопіразолу, тетрагідропіран-3-онS,S-діоксиду і ароматичного альдегіду нагрівають в етиловому спирті. Час проходження реакції, мольні співвідношення і виходи кінцевого продукту автори джерела не зазначають. Одержують суміш двох альтернативних продуктів - 9-феніл-5,6,7,9тетрагідро-4Н-8-тіо-1,4,9'атриазациклопента[b]нафтален-S,S-діоксо (продукт А) і 8-феніл-4,5,6,8-тетрагідро-3Н-7-тіо-1,2,3 триазациклопента[с]нафтален-7,7-діоксо (продукт В), співвідношення яких А : В = 4:1. Продукти А і В розділяють дробовою кристалізацією або хроматографуванням на силікагелі. Недоліком способу одержання сполуки формули III є те, що повністю виключене утворення індивідуального продукту формули III. Виділення аналога продукту формули III шляхом дробової кристалізації або хроматографуванням збільшує 5 94674 тривалість технологічного процесу, зменшує вихід цільового продукту, потребує використання додаткових реагентів і енерговитрат. В основу винаходу поставлено задачу синтезу нових сполук у низці 4,7-дигідро-3-арил-4,4'-діоксо9-карбамідотіопірано-1,2,3-триазолопіримідинів, а також розробки простого і доступного способу одержання таких сполук, що дозволяє підвищити якість кінцевих продуктів реакції. Рішення поставленої задачі забезпечується розробкою нових сполук 4,7-дигідро-3-арил-4,4'діоксо-9-карбамідотіопірано-1,2,3триазолопіримідинів формули І Ar O O N N O S N N H NH2 , І де Аr = С6Н5, 4-СН3-С6Н4, 4-Сl-С6Н4, 4-Br-C6H4, 4-F-C6H4, 4-ОСН3-С6Н4, 2-СН3-С6Н4, 2-ОСН3-С6Н4, 2-Сl-С6Н4, 2,4-диОСН3-С6Н3, 2,4-диСl-С6Н3, 4-Br-3F-C6H3. Рішення поставленої задачі забезпечується також тим, що у способі, що заявляється, одержання сполук, згідно з винаходом, конденсують рівномолярні співвідношення 4-карбамоїл-5-аміно1,2,3-триазолу з терагідропіран-3-он-S,S-діоксидом і ароматичним альдегідом в органічному розчиннику - льодяній оцтовій кислоті, в умовах ультразвукового опромінювання при температурі 35-40 °С протягом 40-45 хвилин, цільовий продукт виділяють водою. Модифікація структури заявлюваних сполук формули І шляхом заміни піразольного фрагмента 1,2,3-триазольним і введення карбамідного замісника у положення 4 молекули 5-аміно-1,2,3триазолу виключає утворення суміші двох альтернативних продуктів і дозволяє одержувати індивідуальні триазолопіримідини. Можливість модифікації хімічної структури сполук формули І варіюванням замісників в альдегідній складовій, яка формує дигідропіримідиновий O H N N фрагмент, відкриває перспективи синтезу великої кількості нових корисних речовин з новими особливостями і використаннями. Введення пептидного фрагмента в 4-положеня 5-аміно-1,2,3-триазолу надає сполукам формули І, що заявляється, подібність білкових структур, що може позначитися на появі нових фізіологічних властивостей у речовин. Вибір реагентів і проведення реакції їх взаємодії у льодяній оцтовій кислоті в умовах ультразвукового опромінювання реакційної маси при невисокій температурі (35-40 °С) дозволяє підвищити чистоту і вихід кінцевих продуктів, забезпечує високу швидкість протікання реакції (40-45 хвилин), що приводить до скорочення тривалості технологічного процесу і зменшенню енергозатрат. У однореакторному способі, що заявляється, одностадійним методом одержують чисті сполуки, що не потребують перекристалізації, з достатньо високим виходом. Однореакторність (процес проходить одночасно в одній хімічній колбі), легкість автоматизації (використання ультразвукового опромінювання) технологічного процесу при низькій температурі проведення реакції це переваги способу одержання сполук формули І, що заявляється. Використання будь-якого із компонентів реакції в більший або менший кількості, ніж рівномолярні співвідношення, приводить до утворення суміші продуктів, які не прореагували. Ультразвукове опромінювання здійснюється за допомогою стандартної ультразвукової бані з додатковим нагрівом, що забезпечує випромінювання на частоті 35-50 кГц. Час протікання реакції складає 40-45 хвилин, що встановлено експериментальним шляхом, причому зменшення часу приводить до значного зниження виходів сполук формули І. Вказаного часу достатньо для повного проходження реакції в умовах ультразвукового опромінювання реакційної маси і утворення цільових продуктів, тому нагрівання більш 45 хвилин недоцільно. Спосіб, що заявляється, здійснюється за схемою: Ar O O S NH2 N 6 N + + ArCHO N N N H O O NH2 Рівномолярну кількість тетрагідропіран-3-онS,S-діоксиду розчиняють у льодяній оцтовій кислоті і додають рівномолярну кількість 4-карамоїл-5аміно-1,2,3-триазолу і ароматичного альдегіду. Суміш витримують в ультразвуковій бані (фірма СЕЛДІ, Україна) протягом 40-45 хвилин при температурі 35-40 °С, після чого додають 10 мл холодної води. Осад, що випадає, відфільтровують, промивають холодним етанолом, сушать. У таблиці 1 надані порівняльні характеристики O O S NH2 способу, що заявляється, і способів-аналогів. У таблиці 2 наведено характеристики сполук, що заявляються. Спосіб одержання сполук формули І, що заявляється, ілюструється наступними прикладами. Приклад 1. Одержання 4,7-дигідро-3-феніл4,4-діоксо-9-карбамідотіопірано-1,2,3триазолопіримідину Розчиняють 1,3 г (8,6 ммоль) тетрагідропіран3-он-S,S-діоксиду в 10 мл льодяної оцтової кисло 7 ти. До розчину додають 1,1 г (8,6 ммоль) 4карамоїл-5-аміно-1,2,3-триазолу і 0,9 г (8,6 ммоль) бензальдегіду. Реакційну масу витримують при температурі 35 °С протягом 40 хвилин в ультразвуковій бані, додають 10 мл води. Осад відфільтровують, промивають холодним етанолом і сушать. Вихідні данні: вихід 1,8 г (63 %), т. пл. 304305°С. Елементний аналіз на вміст: N, %: обчислено 20,28; C15H15N5O3S; знайдено 20,46. S, %: обчислено 9,28; знайдено 9,52. 1 Н ЯМР спектр (400 MHz, DMSO-d6): = 2,26 (m, 2H, CH2), 2,68 (m, 1Н, CH2), 2,94 (m, 1H, CH2), 3,25 (m, 2H, CH2), 6,72 (s, 1H, 9H), 7,33 (m, 5H, Ar), 7,42 (bs, 1H, NH2), 7,78 (bs, 1H, NH2), 9,98 (bs, 1H, NH) ppm. 13 C ЯМР спектр (100 MHz, DMSO-d6): = 18,1, 26,0, 49,9, 54,9, 106,1, 123,4, 127,2, 128,7, 128,8, 135,2, 139,8, 141,6, 162,3 ppm. Приклад 2. Одержання 4,7-дигідро-3-(4метоксифеніл)-4,4-діоксо-9-карбамідотіопірано1,2,3-триазолопіримідину Одержують аналогічно прикладу 1. Для реакції беруть: 1,3 г (8,6 ммоль) тетрагідропіран-3-он-S,Sдіоксиду, 1,1 г (8,6 ммоль) 4-карамоїл-5-аміно1,2,3-триазолу і 1,15 г (8,6 ммоль) 4метоксибензальдегіду. Температура 40 °С, час витримування 45 хвилин. Вихідні данні: вихід 2,3 г (71 %), т. пл. 300301°С. Елементний аналіз на вміст: 94674 8 N, %: обчислено 18,66; C16H17N5O4S; знайдено 18,78. S, %: обчислено 8,54; знайдено 8,87. 1 Н ЯМР спектр (400 MHz, DMSO-d6): = 2,27 (m, 2Н, СН2), 2,67 (m, 1Н, СН2), 2,93 (m, 1Н, CH2), 3,27 (m, 2H, CH2), 3,74 (s, 3Н, СН3), 6,68 (s, 1Н, 9Н), 6,91 (d, 2Н, Аr), 7,26 (d, 2Н, Аr), 7,41 (bs, 1H, NH2), 7,77 (bs, 1Н, NH2), 9,93 (bs, 1H, NH) ppm. 13 C ЯМР спектр (100 MHz, DMSO-d6): = 18,1, 26,0, 50,0, 54,5, 55,1, 106,3, 114,0, 123,3, 128,6, 131,9, 135,1, 141,4, 159,4, 162,3 ppm. Решту прикладів зведено у таблиці 2. Як видно із опису матеріалів винаходу і даних таблиць 1, 2, структура сполук формули І, що заявляється, забезпечує одержання великого набору похідних триазолопіримідинів з високим ступенем чистоти і дозволяє одержувати індивідуальні триазолопіримідини. Спосіб одержання сполук формули І дозволяє: - широко варіювати замісники в Аr радикалі піримідинового фрагмента; - значно зменшити температуру реакції і тривалість технологічного процесу; - підвищити якість сполук формули І, що заявляються, і їх виходи за рахунок проведення реакції в умовах ультразвукового опромінювання. Переваги нових сполук формули І і способу їх одержання розширяють можливості їх потенційного використання як біологічно активних речовин, в медицині і фармакології - як лікарських препаратів, у препаративному органічному синтезі, роблять спосіб простим і доступним, що легко відтворюється як у лабораторії, так і в умовах виробництва. Таблиця 1 №№ п/п 1 2 3 Спосіб одерТемпература Час реакРозчинник Вихід, % жання реакції, °С ції, год Спосіб, що заяльод. 35-40 0,67-0,75 65-88 вляється СН3СООН Спосіб за статтею Mattew M. Abelman et al. етанол 78 26-27 64 Tetrahedron Letters, 44, 4559 (2003) Спосіб за статтею Drizin J. et. al. Bioorgan. and не указаетанол 78 не указано Med. Chem. но Lett., 12, 1481 (2002) Каталізатор відсутній одержують індивідуальні продукти HCl одержують індивідуальні продукти відсутній одержують суміш двох речовин 9 94674 10 Таблиця 2 Сполуки Ar O N №№ п/п N O O S N Т. пл., °С 1 Вихід, % Н ЯМР, (м. ч.) N H NH2 1 1 Аr = С6Н5 304-305 63 2 R = C6H4-OCH3-4 300-301 71 3 R = C6H4-CH3-4 295-296 65 4 R = C6H4-Cl 305-307 77 5 R = C6H4-Br 315-316 85 6 R = C6H4-OCH3-3 310 65 Комп’ютерна верстка А. Крижанівський Н ЯМР спектр (400 MHz, DMSO-d6): = 2,26 (m, 2Н, СН2), 2,68 (m, 1H, СН2), 2,94 (m, 1Н, CH2), 3,25 (m, 2H, CH2), 6,72 (s, 1Н, 9H), 7,33 (m, 5H, Аr), 7,42 (bs, 1Н, NH2), 7,78 (bs, 1H, NH2), 9,98 (bs, 1H, NH) 1 H ЯМР спектр (400 MHz, DMSO-d6): = 2,27 (m, 2H, CH2), 2,67 (m, 1H, CH2), 2,93 (m, 1H, CH2), 3,27 (m, 2H, CH2), 3,74 (s, 3H, CH3), 6,68 (s, 1H, 9H), 6,91 (d, 2H, Ar), 7,26 (d, 2H, Ar), 7,41 (bs, 1H, NH2), 7,77 (bs, 1H, NH2), 9,93 (bs, 1H, NH) 1 H ЯМР спектр (400 MHz, DMSO-d6): = 2,29 (m, 2H, CH2), 2,37 (s, 3H, CH3), 2,48 (m, 2H, CH2), 2,65 (m, 2H, CH2), 6,65 (s, 1H, 9H), 6,98 (d, 2H, Ar), 7,21 (d, 2H, Ar), 7,67 (bs, 1H, NH2), 7,89 (bs, 1H, NH2), 9,57 (bs, 1H, NH) 1 H ЯМР спектр (400 MHz, DMSO-d6): = 2,35 (m, 2H, CH2), 2,56 (m, 2H, CH2), 2,70 (m, 2H, CH2), 6,99 (s, 1H, 9H), 7,80 (d, 2H, Ar), 7,92 (d, 2H, Ar), 7,99 (bs, 1H, NH2), 8,13 (bs, 1H, NH2), 9,48 (bs, 1H, NH) 1 H ЯМР спектр (400 MHz, DMSO-d6): = 2,33 (m, 2H, CH2), 2,54 (m, 2H, CH2), 2,68 (m, 2H, CH2), 6,89 (s, 1H, 9H), 7,78 (d, 2H, Ar), 7,85 (d, 2H, Ar), 7,97 (bs, 1H, NH2), 8,05 (bs, 1H, NH2), 9,34 (bs, 1H, NH) 1 H ЯМР спектр (400 MHz, DMSO-d6): = 2,23 (m, 2H, CH2), 2,66 (m, 1H, CH2), 2,90 (m, 1H, CH2), 3,23 (m, 2H, CH2), 3,71 (s, 3H, OCH3), 6,89 (s, 1H, 9H), 6,93 (m, 1H, Ar), 7,01 (dd, 1H, Ar), 7,25 (dd, 1H, Ar), 7,30 (m, 1H, Ar), 7,38 (bs, 1H, NH2), 7,72 (bs, 1H, NH2), 9,84 (bs, 1H, NH) Підписне Тираж 24 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською4,7-dihydro-3-aryl-4,4'-dioxo-9-carbamidothiopyrano-1,2,3-triazolopyrimidines and a process for the preparation thereof
Автори англійськоюHladkov Yevhenii Stanislavovych, Sirko Svitlana Mykolaivna, Desenko Serhii Mykhailovych, Afanasiadi Liudmyla Mykhailivna
Назва патенту російською4,7-дигидро-3-арил-4,4'-диоксо-9-карбамидотиопирано-1,2,3-триазолопиримидины и способ их получения
Автори російськоюГладков Евгений Станиславович, Сирко Светлана Николаевна, Десенко Сергей Михайлович, Афанасиади Людмила Михайловна
МПК / Мітки
МПК: C07D 513/16
Мітки: 4,7-дигідро-3-арил-4,4'-діоксо-9-карбамідотіопірано-1,2,3-триазолопіримідини, одержання, спосіб
Код посилання
<a href="https://ua.patents.su/5-94674-47-digidro-3-aril-44-diokso-9-karbamidotiopirano-123-triazolopirimidini-i-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">4,7-дигідро-3-арил-4,4′-діоксо-9-карбамідотіопірано-1,2,3-триазолопіримідини і спосіб їх одержання</a>
Попередній патент: Термоелектричний матеріал
Наступний патент: Промисловий парогенератор для нанесення на металеву підкладку покриття із сплаву
Випадковий патент: Спосіб захисту футерівки горна доменної печі









