Спосіб одержання 5-оксо-n-арил-2-арил(метил)-4,5,6,7-тетрагідропіразоло[1,5-а]піримідин-7-карбоксамідів
Номер патенту: 60801
Опубліковано: 25.06.2011
Автори: Руденко Роман Володимирович, Десенко Сергій Михайлович, Афанасіаді Людмила Михайлівна, Комихов Сергій Олександрович
Формула / Реферат
Спосіб одержання заміщених 5-оксо-N-арил-2-арил(метил)-4,5,6,7-тетрагідропіразоло[1,5-а]піримідин-7-карбоксамідів загальної формули:
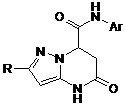 ,
,
де
R = СН3; С6Н5; 4-Сl-С6Н4; 4-F-C6H4; 4-CH3O-C6H4;
Аr = С6Н5; 4-Сl-С6Н4; 2-Сl-С6Н4; 4-СН3О-С6Н4;
2,4-diCH3O-C6H3; 3-F-C6H4; 2-Cl-C6H4; 2-F-C6H4;
2-CH3O-C6H4; 2-CF3-C6H4; 2-СН3О-5-Сl-С6Н3;
4-CH3O-3-Cl-C6H3; 2,5-CH3O-C6H3; 3,4-CH3O-C6H3,
що включає конденсацію 5-амінопіразолу і відповідної дикарбонільної сполуки у рівномолярних кількостях у середовищі оцтової кислоти при кип'ятінні, який відрізняється тим, що як 5-амінопіразол використовують 3-заміщені 5-амінопіразоли формули 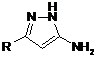 , як дикарбонільну сполуку - N-арилмалеіміди формули
, як дикарбонільну сполуку - N-арилмалеіміди формули 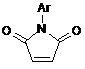 , конденсацію проводять протягом 5-10 хвилин до утворення цільового продукту, а виділення одержаного продукту здійснюють осадженням ацетоном.
, конденсацію проводять протягом 5-10 хвилин до утворення цільового продукту, а виділення одержаного продукту здійснюють осадженням ацетоном.
Текст
Спосіб одержання заміщених 5-оксо-N-арил-2арил(метил)-4,5,6,7-тетрагідропіразоло[1,5а]піримідин-7-карбоксамідів загальної формули: H O N Ar 2 UA (54) СПОСІБ ОДЕРЖАННЯ а]ПІРИМІДИН-7-КАРБОКСАМІДІВ ДО ПАТЕНТУ НА КОРИСНУ МОДЕЛЬ (19) ДЕРЖАВНИЙ ДЕПАРТАМЕНТ ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ видається під відповідальність власника патенту ОПИС 3 60801 [Zi Q. et al., Med. Res. Rev., 20, 231, (2000)], протигрибкова активність [Gupta A.K. et al., Br.J. Dermotol., 149, 296, (2003)] та інші. Відомий спосіб одержання структурного аналога - 5,7-діоксо-4,5,6,7-тетрагідропіразоло[1,5а]піримідин-3-карбонітрилу формули II [Deeb AH, El-Mobayed Medhat et el., Rev. Roumaine de Chimie., 38, №3, 303-309 (1993)]. N O NH + NH2 Et O O O N Et , II Спосіб складається із двох стадій і здійснюється за наступною схемою: N NH 1 год O O , AcOH N H O Et 3 год N N N H N O N O N N N H , 190oC O N 4 O II . На першій стадії нагрівають 5-аміно-1Hпіразоло-4-карбонітрил з діетиловим естером малонової кислоти у розплаві при температурі 190°С протягом 1 години. Одержують етил-3[(4-ціано-1Hпіразол-5-іл)аміно]-3-оксопропіонат з виходом 50%. На другій стадії одержаний продукт циклізують нагріванням його в оцтовій кислоті протягом 3 годин і отримують 5,7-діоксо-4,5,6,7тетрагідропіразоло[1,5-а]піримідин-3-карбонітрил з виходом 45%. Загальний час синтезу складає приблизно 44,5 години. Недоліком відомого способу є тривалий двостадійний процес з виділенням продуктів на кожній технологічній стадії. Конденсація взаємодіючих речовин у розплаві за відомим способом поруч з продуктом, що очікується, - етил-3[(4-ціано-1Hпіразол-5-іл)аміно]-3-оксопропіонатом призводить до утворення іншого продукту – N,N-біс(4-ціано1H-піразол-5-іл)малонаміду з достатньо високим виходом. Таку суміш споріднених за структурою N сполук розділяти дуже важко навіть дрібною кристалізацією. Нестабільність протікання реакції є надто суттєвим недоліком відомого способу. У відсутності розчинника при сплавленні вихідних продуктів при 190°С можуть утворюватися смолисті речовини, що забруднюють основну речовину. Все це також є недоліком відомого способу одержання структурного аналога формули II. Відомий спосіб одержання структурного аналога етил-2-метилтіо-5-оксо-4,5,6,7тетрагідропіразоло[1,5-а]піримідин-3-карбоксилату загальної формули III [Raslan M. A., El-Aal R.M. et al., J. Chin. Chem. Soc., 48, №1, 91-100 (2001)]. N N S N H O O , III Спосіб одержання сполуки формули III реалізується за схемою: N NH S O + NH2 O O O Et N S N H O O O III Суміш етилового естеру 5-аміно-3метилтіопіразол-4-карбонової кислоти і етилового естеру акрилової кислоти нагрівають у піридині 6 годин при температурі кипіння розчинника. Одер O . жують етил-2-метилтіо-5-оксо-4,5,6,7тетрагідропіразоло[1,5-а]піримідин-3-карбоксилат з виходом 62%. 5 60801 Недоліком відомого способу одержання сполуки формули III є тривалий процес із застосуванням токсичного, вогненебезпечного розчинника піридину. Найбільш близьким за технічною суттю до способу, що заявляється, є спосіб одержання структурного аналога формули II, який прийнятий нами за прототип. В основу корисної моделі поставлено задачу розробки простого і доступного способу одержання заміщених 5-оксо-N-арил-2-арил(метил)-4,5,6,7тетрагідропіразоло[1,5-а]піримідин-7-карбоксамідів загальної формули І, у якому за рахунок зміни умов синтезу можна зменшити тривалість процесу, підвищити вихід цільових продуктів. Рішення поставленої задачі забезпечується тим, що у способі одержання заміщених 5-оксо-Nарил-2-арил(метил)-4,5,6,7-тетрагідропіразоло[1,5-а]піримідин-7-карбоксамідів загальної формули І, H O N Ar N R N N H O ,І R=СН3; С6Н5; 4-Сl-С6Н4; 4-F-C6H4; 4-CH3OC6H4; Аr=С6Н5; 4-Сl-С6Н4; 2-Сl-С6Н4; 4-СН3О-С6Н4; 2,4-diCH3O-C6H3; 3-F-C6H4; 2-Cl-C6H4; 2-F-C6H4; 2-CH3O-C6H4; 2-CF3-C6H4; 2-СН3О-5-Сl-С6Н3; 4-CH3O-3-Cl-C6H3; 2,5-CH3O-C6H3; 3,4-CH3OC6H3, що включає конденсацію 5-амінопіразолу і відповідної дикарбонільної сполуки у рівномолярних кількостях у середовищі оцтової кислоти при кип'ятінні, згідно корисної моделі як 5-амінопіразол використовують 3-заміщені 5-амінопіразол формули H N N R NH2 , як дикарбонільну сполуку - N 6 Ar H N Ar R NH + O N O NH2 N , AcOH R Ar N N H I Суміш заміщеного 5-амінопіразолу і відповідного N-арилмалеіміду (рівномолярні кількості) нагрівають в оцтовій кислоті протягом 5-10 хвилин. Після охолодження додають ацетон, відфільтровують осад, що випав, який промивають невели O арилмалеіміди формули , конденсацію проводять протягом 5-10 хвилин до утворення цільового продукту, а виділення одержаного продукту здійснюють осадженням ацетоном. Вибір компонентів і проведення реакції їх взаємодії в умовах, що заявляються, дозволяє підвищити вихід кінцевих продуктів, розширити їх асортимент, значно зменшити енерговитрати, забезпечити високу швидкість протікання реакції, що приводить до значного скорочення тривалості технологічного процесу. В залежності від замісників Аr у піримідиновому фрагменті і R у піразольному, спосіб, що заявляється, дозволяє широко модифікувати хімічну структуру кінцевих продуктів і одержувати значно більший набір потенційних біологічно активних речовин. Суттєвим у способі одержання сполук формули І, що заявляється є зменшення тривалості реакції до 5-10 хвилин у порівнянні зі способомпрототипом (4-4,5 годин), а також збільшення виходів чистих кінцевих продуктів до 62-80% (у способі-прототипі - 45%). Час протікання реакції встановлено експериментально і складає 5-10 хвилин в залежності від арильного замісника. Збільшення часу кип'ятіння реакційної маси недоцільно, оскільки реакція проходить повністю вже за цей короткий проміжок часу і з високими виходами цільових продуктів. 1 Чистоту цих речовин підтверджено спектрами Н ЯМР спектроскопії. Використання компонентів реакції у більшій або меншій кількостях, ніж рівномолярні, приводить до утворення суміші відповідних вихідних речовин і кінцевих продуктів реакції. У таблиці 1 наведено порівняльні характеристики способу, що заявляється і способів одержання сполук формули II, III. У таблиці 2 дано температури топлення, вихо1 ди основних продуктів реакції і їх спектри Н ЯМР. Спосіб одержання заміщених 5-оксо-N-арил-2арил(метил)-4,5,6,7-тетрагідро-піразоло[1,5а]піримідин-7-карбоксамідів здійснюється за схемою: O N N O O . кою кількістю ацетону і сушать при кімнатній температурі. Нижче наведено приклади конкретного виконання синтезу заміщених 5-оксо-N-арил-2 7 60801 арил(метил)-4,5,6,7-тетрагідро-піразоло[1,5а]піримідин-7-карбоксамідів. Приклад 1 Одержання N-(2,4-діметоксифеніл)-2-метил-5оксо-4,5,6,7-тетрагідропіразоло[1,5-а]піримідин-7карбоксаміду. Рівномолярну суміш 0,29 г (3 ммоль) 3-метил5-амінопіразолу і 0,7 г (3 ммоль) N-(2,5диметоксифеніл)малеіміду у 0,5 мл оцтової кислоти нагрівають у пробірці протягом 5 хвилин. Після охолодження додають 10 мл ацетону і залишають реакційну масу на 30 хвилин, після цього фільтрують осад, що випав, промивають невеликою кількістю ацетону, сушать. Вихід продукту складає 0,68 г (68%). Температура топлення 183-184°С. 1 Спектр Н ЯМР (ДМСО-d6) (м.ч.), КССВ J (Гц): 2 3 2.13 (с, 3Н, СН3), 2.80 (дд, JAB = 16.9 Гц, JAX=2.1 3 Гц, 1Н, 6-На), 3.26 (дд, JBX = 7.9 Гц, 1Н, 6-Нb), 3.66 (с, 3Н, СН3О), 3.78 (с, 3Н, СН3О), 5.40 (дд, 1H, 7Нх), 5.47 (с, 1H, 3-Н), 6.60-7.74 (м, 3Harom), 9.45 (уш. с. 1H, NH), 10.74 (уш. с. 1H, NHpyr). Приклад 2 Одержання N,2-діфеніл-5-оксо-4,5,6,7тетрагідропіразоло[1,5-а]піримідин-7-карбоксаміду Реакцію проводять аналогічно прикладу 1. Для реакції беруть: 0,48 г (3 ммоль) 3-феніл-5амінопіразолу і 0,52 г (3 ммоль) N-фенілмалеіміду. Час нагрівання 10 хвилин. Вихід продукту складає 0,64 г (64%). Темпера1 тура топлення 272-273°С. Спектр Н ЯМР (ДМСО2 d6) (м.ч.), КССВ J (Гц): 2.79 (дд, JAB =17.1 Hz, 3 3 JAX=1.9 Гц, 1H, 6-Нa), 3.45 (дд, JBX=7.8 Гц, 1H, 6Нb), 5.31 (дд, 1Н, 7-Нx), 6.07 (с, 1Н, 3-Н), 7.08-7.75 (м, 10Harom), 10.69 (уш. с, 1Н, NH), 10.91 (уш. с, 1Н, NHpyr). Приклад 3 Одержання N-(2-метокси-5-хлорфеніл)-2-(4хлорфеніл)-5-оксо-4,5,6,7-тетрагідропіразоло[1,5а]піримідин-7-карбоксаміду. Реакцію проводять аналогічно прикладу 1. Для реакції беруть: 0,58 г (3 ммоль) 3-(4-хлорфеніл)-5 8 амінопіразолу і 0,72 г (3 ммоль) N-(2-метокси-5хлорфеніл)-малеіміду. Час нагрівання 5 хвилин. Вихід продукту складає 0,98 г (75%). Температура топлення більше 277-278°С. 1 Спектр Н ЯМР (ДМСО-d6) (м.ч.), КССВ J 2 3 (Гц): 2.86 (дд, JAB=17.1 Гц, JAX=1.1 Гц, 1Н, 6-На), 3 3.43 (дд, JBX = 8.1 Гц, 1Н, 6-Нb), 3.78 (с, 3Н, СН3О), 5.60 (дд, 1H, 7-Нх), 6.14 (с, 1Н, 3-Н), 7.04-8.09 (м, 7 Harom), 9.83 (уш. с, 1Н, NH), 11.0 (уш. с, 1H, NHpyr). Решту прикладів наведено у таблиці 2. Як видно із тексту матеріалів, що заявляються, технічне рішення, що пропонується, має наступні переваги: - тривалість синтезу складає 5-10 хвилин (0,08-0,17 год.); - за способом, що пропонується, можна одержувати велику кількість сполук, що заміщені як у піразольному, так і у піримідиновому фрагментах, що дозволяє значно розширити асортимент потенційних біологічно активних речовин; - спосіб, що заявляється, дає можливість синтезувати будь-які кількості кінцевих продуктів, виходячи із кількостей вихідних речовин; - спосіб, що заявляється, дає можливість одержувати чисті цільові продукти, що не потребують додаткової перекристалізації, з високими виходами реакції; - спосіб, що заявляється, менш енергоємний, ніж спосіб-прототип, забезпечує відсутність вогнеі вибухонебезпечних розчинників, дозволяє широко варіювати у молекулі сполуки формули і замісники різної електронної природи та здешевити вартість цільових продуктів. Можливість широкої модифікації структури заміщених 5-оксо-N-арил-2-арил(метил)-4,5,6,7тетрагідро-піразоло[1,5-а]піримідин-7карбоксамідів і синтезу великої кількості сполук за способом, що заявляється, припускає, що спосіб знайде широке застосування як у лабораторії, так і у виробничій практиці. Таблиця 1 Спосіб, що заявляється Спосіб-прототип Спосіб за статтею (Raslan М. А., El-Aal R.M. et al., J. Chin. Chem. Soc., 48, №1, 91-100 (2001)) Кількість Вихід основного проЧас реакції, год. cтадій реакції дукту, % 1 0,08-0,17 62-80 2 4-4,5 45 2 6,0 62 Розчинник Оцтова кислота Оцтова кислота Піридин Таблиця 2 № п/п 1 Сполуки, одержані за способом, що заявляється Т. топ., °С Замісник R Замісник Аr 2 3 4 Вихід, % ЯМР 1Н хімічний зсув, (м. ч.), (КССВ, J (Hz)) 5 6 2.13 (с, 3Н, СН3), 2.80 (дд, 2JAB = 16.9 Гц, 3JAX =2.1 Гц, 1Н, 6-На), 3.26 (дд, 3JBX = 7.9 Гц, 1Н, 6-Нb), 3.66 (с, 3Н, СН3О), 3.78 (с, 3Н, СН3О), 5.40 (дд, 1H, 7-Нх), 5.47 (с, 1H, 3-Н), 6.60-7.74 (м, 3Harom), 9.45 (уш. с. 1H, NH), 10.74 (уш. с. 1H, NHpyr). 2.07 (s, 3Н, СН3), 2.71 (dd, 2JAB=16.8 Hz, 3JAX=1.9 Hz, 1H, 6-Ha), 3.30 (dd, 3JBX=7.6 Hz, 1H, 6-Hb), 3.82 (s, 3H, CH3O), 5.03 (dd, 1H, 7-Hx), 5.42 (s, 1H, 3-H), 7.10-7.76 (m, 3Harom), 10.5 (br. s, 1H, NH), 10.66 (br. s, 1H, NHpyr). 1. CH3 2,5-ди-СН3ОС6H3 183-184 68% 2. CH3 4-СН3О-3-СlС6H3 195-196 62% 9 60801 10 Продовження таблиці 2 1 2 3 4 5 3. СН3 2,4-диСН3ОС6H3 187-188 65% 4. СН3 2-СН3О-С6H4 195-196 62% 5. СН3 2-F-C6H4 191-192 71% 6. СН3 3,4-диСН3ОС6H3 198-199 75% 7. С6Н5 С6Н5 272-273 64% 8. С6Н5 2-Сl-С6Н4 267-268 70% 9. С6H5 3,4-диСН3ОС6H3 257-258 70% 10. 4-СН3О-С6H4 2-СН3О-5-СlС6H3 244-245 69% 11. 4-CH3O-С6Н4 4-Сl-С6Н4 274-275 74% 12. 4-Сl-С6H4 2-СН3О-5-СlС6H3 277-278 80% 13. 4-Сl-С6H4 4-СН3О 260-261 77% 14. 4-Сl-С6H4 3-F 256-257 72% 15. 4-F-С6H4 2-СН3О 250-251 67% 16. 4-F-С6Н4 2-CH3O-5-ClС6H3 263-264 74% Комп’ютерна верстка А. Рябко 6 2.11 (с, 3Н, CH3), 2.75 (дд, 2JAB=16.9 Гц, 3JAX=2.1 Гц, 1H, 6-Ha), 3.25 (дд, 3JBX=7.9 Гц, 1H, 6-Hb), 3.73 (с, 3Н, СН3О), 3.82 (с, 3Н, CH3O), 5.29 (дд, 1Н, 7-Hx), 5.45 (c, 1H, 3-H), 6.5-7.8 (м, 3Harom), 9.32 (уш. с. 1Н, NH), 10.7 (уш. с. 1Н, NHpyr). 2.20 (s, 3H, CH3), 2.76 (dd, 2JAB=16.8 Hz, 3JAX=1.9 Hz, 1H, 6-Ha), 3.28 (dd, 3JBX=7.6 Hz, 1H, 6-Hb), 3.87 (s, 3H, CH3O), 5.24 (dd, 1H, 7-Hx), 5.45 (s, 1H, 3-H), 6.8-8.2 (m, 4Harom), 9.18 (br. s, 1H, NH), 10.68 (br.s, 1H, NHpyr). 2.14 (s, 3Н, СН3), 2.81 (dd, 2JAB=16.6 Hz, 3JAX=2.8 Hz, 1H, 6-Ha), 3.11 (dd, 3JBX=7.6 Hz, 1H, 6-Hb), 5.32 (dd, 1H, 7-Hx), 5.41 (s, 1H, 3-H), 7.1-8.1 (m, 4Harom), 9.92 (br. s, 1H, NH), 10.62 (br. s, 1H, NHpyr). 2.20 (с, 3Н, CH3), 2.75 (дд, 2JAB=16.9 Гц, 3JAX=2.1 Гц, 1Н, 6-Ha), 3.25 (дд, 3JBX=7.9 Гц, 1Н, 6-Hb), 3.71 (с, 3Н, CH3O), 3.81 (с, 3Н, CH3O), 5.24 (дд, 1H, 7-Hx), 5.45 (c, 1H, 3-H), 6.5-7.9 (м, 3Harom), 9.19 (уш. с, 1Н, NH), 10.68 (уш. с, 1Н, NHpyr). 2.79 (дд, 2JAB=17.1 Hz, 3JAX=1.9 Гц, 1H, 6-Нa), 3.45 (дд, 3 JBX=7.8 Гц, 1H, 6-Нb), 5.31 (дд, 1Н, 7-Нx), 6.07 (с, 1Н, 3-Н), 7.08-7.75 (м, 10Harom), 10.69 (уш. с, 1Н, NH), 10.91 (уш. с, 1Н, NHpyr). 2.87 (дд, 2JAB=16.9 Гц, 3JAX=1.1 Гц, 1H, 6-Ha), 3.47 (дд, 3 JBX=7.8 Гц, 1H, 6-Нb), 5.52 (дд, 1Н, 7-Hx), 6.10 (с, 1H, 3-H), 7.16-7.71 (м, 9Harom), 10.01 (уш. с, 1Н, NH), 10.96 (уш. с, 1H, NHpyr). 2.80 (дд, 2JAB=16.9 Гц, 3JAX=1.1 Гц, 1H, 6-Ha), 3.46 (дд, 3 JBX = 7.8 Гц, 1Н, 6-Hb), 5.27 (дд, 1Н, 7-Hx), 6.07 (c, 1H, 3-H), 6.65-7.77 (м, 8Harom), 10.57 (уш. с, 1Н, NH), 10.91 (уш. с, 1H, NHpyr). 2.86 (дд, 2JAB=17.0 Гц, 3JAX=1.1 Гц, 1Н, 6-На), 3.43 (дд, 3 JBX=8.1 Гц, 1Н, 6-Нb), 3.76 (с, 3Н, СН3О), 3.78 (с, 3Н, СН3О), 5.56 (дд, 1Н, 7-Hx), 6.02 (с, 1Н, 3-H), 6.95-8.11 (м, 7Harom), 9.79 (уш. с, 1Н, NH), 10.95 (уш. с, 1H, NH pyr). 2.88 (дд, 2JAB=17.1 Гц, 3JAX=1.5 Гц, 1Н, 6-На), 3.21 (дд, 3 JBX=8.0 Гц, 1Н, 6-Нb), 3.80 (с, 3Н, СН3О), 5.20 (дд, 1H, 7-Нх), 5.89 (с, 1Н, 3-Н), 6.84-7.63 (м, 8Harom), 10.4 (уш. с, 1H, NH), 10.7 (уш. с, 1H, NHpyr). 2.86 (дд, 2JAB=17.1 Гц, 3JAX=1.1 Гц, 1Н, 6-На), 3.43 (дд, 3 JBX=8.1 Гц, 1Н, 6-Нb), 3.78 (с, 3Н, СН3О), 5.60 (дд, 1Н, 7-Нх), 6.14 (с, 1Н, 3-Н), 7.04-8.09 (м, 7Harom), 9.83 (уш. с, 1Н, NH), 11.0 (уш. с, 1Н, NHpyr). 2.82 (дд, 2JAB=16.9 Гц, 3JAX=1.3 Гц, 1Н, 6-На), 3.21 (дд, 3 JBX=7.7 Гц, 1Н, 6-Нb), 3.75 (с, 3Н, СН3О), 5.22 (дд, 1Н, 7-Нx) 5.99 (с, 1Н, 3-Н), 6.7-7.7 (м, 8Harom), 10.15 (уш. с, 1Н, NH), 10.78 (уш. с, 1Н, NHpyr). 2.83 (дд, 2JAB=16.9 Гц, 3JAX=1.2 Гц, 1H, 6-На), 3.24 (дд, 3 JBX=7.9 Гц, 1H, 6-Нb), 5.24 (дд, 1H, 7-Нх), 5.99 (с, 1H, 3-Н), 6.76-7.72 (м, 8Harom), 10.5 (уш. с, 1Н, NH), 10.8(уш. с, 1H, NHpyr). 2.80 (дд, 2JAB=16.8 Гц, 3JAX=1.3 Гц, 1Н, 6-На), 3.31 (дд, 3 JBX=7.8 Гц, 1Н, 6-Нb), 3.66 (с, 3Н, СН3О), 5.42 (дд, 1Н, 7-Нx), 6.01 (с, 1Н, 3-Н), 6.8-8.2 (м, 8Harom), 9.3 (уш. с, 1H, NH), 10.91(уш. с, 1H, NHpyr). 2.85 (дд, 2JAB=17.1 Гц, 3JAX=1.1 Гц, 1H, 6-Ha), 3.20 (дд, 3 JBX=7.9 Гц, 1Н, 6-Hb), 3.70 (с, 3Н, СН3О), 5.48 (дд, 1Н, 7-Нх), 6.02 (с, 1Н, 3-Н), 6.9-8.22 (м, 8Harom), 9.52 (уш. с, 1Н, NH), 10.92 (уш. с, 1Н, NHpyr). Підписне Тираж 24 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of substituted 5-oxo-n-aryl-2-aryl(methyl)-4,5,6,7-tetrahydropyrazolo[1,5-a]pyrimidine-7-carboxamides
Автори англійськоюRudenko Roman Volodymyrovych, Komikhov Serhii Oleksandrovych, Desenko Serhii Mykhailovych, Afanasiadi Liudmyla Mykhailivna
Назва патенту російськоюСпособ получения 5-оксо-n-арил-2-арил(метил)-4,5,6,7-тетрагидропиразоло[1,5-а]пиримидин-7-карбоксамидов
Автори російськоюРуденко Роман Владимирович, Комихов Сергей Александрович, Десенко Сергей Михайлович, Афанасиади Людмила Михайловна
МПК / Мітки
МПК: C07B 41/00, C07B 43/00
Мітки: спосіб, одержання, 5-оксо-n-арил-2-арил(метил)-4,5,6,7-тетрагідропіразоло[1,5-а]піримідин-7-карбоксамідів
Код посилання
<a href="https://ua.patents.su/5-60801-sposib-oderzhannya-5-okso-n-aril-2-arilmetil-4567-tetragidropirazolo15-apirimidin-7-karboksamidiv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 5-оксо-n-арил-2-арил(метил)-4,5,6,7-тетрагідропіразоло[1,5-а]піримідин-7-карбоксамідів</a>
Попередній патент: Електромагнітний клапан
Наступний патент: Спосіб ендоскопічного хірургічного лікування хронічного одонтогенного гаймориту при навності ороантральної фістули
Випадковий патент: Спосіб оконтурювання борта кар'єру









