Заміщені 3-арил-10,11-дигідро-4,10-метанопіразоло[4,3-с][1,5] бензоксазоцин-4(1н)карбонові кислоти та спосіб їх одержання
Номер патенту: 95886
Опубліковано: 12.09.2011
Автори: Мурликіна Марина Володимирівна, Афанасіаді Людмила Михайлівна, Чебанов Валентин Анатолійович, Десенко Сергій Михайлович, Сахно Яна Ігорівна
Формула / Реферат
1. Заміщені 3-арил-10,11-дигідро-4,10-метанопіразоло[4,3-с][1,5]бензоксазоцин-4(1H)карбонові кислоти загальної формули
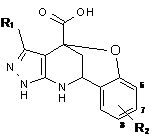 ,
,
де R1=C6H5, 4-CH3O-C6H4, 4-Br-C6H4, 4-Cl-C6H4, 4-C2H5-C6H4; R2=H, 6-CH3O, 8-Cl.
2. Спосіб одержання сполук загальної формули
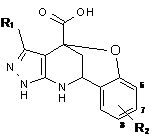 ,
,
де R1=C6H5, 4-CH3O-C6H4, 4-Br-C6H4, 4-Cl-C6H4, 4-C2H5-C6H4; R2=H, 6-CH3O, 8-Cl, що включає конденсацію рівномолярних кількостей аміноазолу, саліцилового альдегіду і сполуки, що містить кетогрупу в органічному розчиннику, який відрізняється тим, що як аміноазол використовують 3-заміщені 5-амінопіразоли, як сполуки, що містять кетогрупу, використовують піровиноградну кислоту, як органічний розчинник - оцтову кислоту, конденсацію проводять в умовах ультразвукового опромінення при кімнатній температурі протягом 45 хвилин - 1,5 години в одну стадію до утворення цільового продукту.
Текст
1. Заміщені 3-арил-10,11-дигідро-4,10метанопіразоло[4,3-с][1,5]бензоксазоцин4(1H)карбонові кислоти загальної формули БЕНЗОКСАЗОЦИН O N N H N H 6 I 7 8 R2 , де R1=C2H5, 4-CHl3O-C6H4, 4-Br-C6H4, 4-Cl-C6H4, 4-C2H5-C6H4 R2=H, 6-CH3O, 8-Cl 3 95886 де R1=C6H5, 4-CH3O-C6H4, 4-Br-C6H4, 4-Cl-C6H4, 4-C2H5-C6H4; R2=H, 6-CH3O, 8-Cl. Сполуки, що заявляються, являють собою складні азотовмісні гетероциклічні системи і мають високу реакційну здатність. Наявність вільної карбоксильної групи припускає можливість модифікації структури, що заявляється, шляхом утворення різних хлорангідридів кислот, амідів, ефірів, амінів. Це розширює можливості використання сполук І як проміжних продуктів (інтермедіатів, білдинг-блоків) у препаративному органічному синтезі при вирішенні важливих практичних задач, в тому числі і в сфері комбінаторної хімії. Наявність фармакофорних фрагментів обумовлює перспективність пошуку у низці сполук формули І речовин з різними видами фізіологічної активності, що робить їх дуже інтересними і корисними з точки зору медичної і фармакологічної хімії. Так, аліфатичні, ароматичні і гетероароматичні похідні піровиноградної кислоти використовуються як прекурсори для неприродних амінокислот, що грають важливу роль у проміжному метаболізмі (обміну речовин) при уремії. Вони також цікаві як інтермедіати (проміжні продукти) в органічному синтезі при розробці інгібіторів ензимів і лікарських препаратів [Busca P., Paradizi F. et al., Org. Biomol. Chem. 2, 2684 (2004)]. Гетероциклічні похідні піразолів широко використовуються як терапевтичні засоби проти гострого і хронічного запалення, ішемічних процесів, призначені для лікування патологічних станів, насамперед ревматоїдного артриту, астми, запалення кишечнику [Пат. РФ 2266901, C07D239/54; А61K31/513]. Багато відомих структур піразольного типу мають високу біологічну активність як кардіоваскулярні аналептики, кардіопротектори і фіб 4 ринолітики [РСТ Int. Patent 8504172, 1985; Jpn. Patent 61263977, 1986]. Сполучення в одній молекулярній системі фрагментів піразолу і похідних піровиноградної кислоти дозволить розширити асортимент нових потенційних лікарських препаратів і біологічно активних речовин з новими властивостями і практичними застосуваннями. Відомий структурний аналог сполук, що заявляються, алкіл 2-метил-4-оксо-3,4,5,6-тетрагідро2H-2,6-метано-1,3,5-бензоксадіазоцин-11карбоксилат загальної формули II O AlkO NH O N H H3C II де Alk=CH3, C2H5 ll O , де Alk=CH3, C2H5, і спосіб його одержання [Nan-Yan Fu et al., Tetrahedron, 58, 4801-4807 (2002)]. Сполуки формули II мають високі температури плавлення (>200 °С), добре розчиняються в етанолі, не розчиняються у воді. Недоліком структури сполуки формули II є неможливість різноманітності структури аналога. Модифікація структури ускладнюється, оскільки є тільки один реакційний центр - NH-гpyпa. Спосіб одержання відомої сполуки формули II складається із однієї стадії і здійснюється за схемою: H3C C2H5OH H2N InBr3 NH2 AlkO Рівномолярні кількості ацетооцтового ефіру, саліцилового альдегіду, сечовини і броміду індію (ІnВr3) нагрівають в етанолі протягом 7 годин. При охолодженні випадає продукт 5-алкоксикарбоніл6-метил-4-(2-гідроксифеніл)-3,4-дигідропіримідин2(1H)-OH, який у присутності каталізатора ІnВr3 (10 мол. %) ізомеризується в алкіл-2-метил-4-оксо3,4,5,6-тетрагідро-2Н-2,6-метано-1,3,5бензоксадіазоцин-11-карбоксилат. Продукт промивають етанолом, сушать у вакуумі. Загальний час синтезу складає приблизно 7-7,5 годин. Авторами одержано лише 2 продукти з виходами 72 і 75 %. До недоліків відомого способу одержання сполук формули II слід віднести тривалість технологічного процесу, використання каталізатора ІnВr3, який дорого коштує. Відомий аналог за хімічною структурою - 5метил-11,12-дигідро-5,11 O H3C H3C . метано[1,2,4]триазоло[1,5с][1,3,5]бензоксадіазоцин формули lll CH3 N N N O N H 7 де R=H, 7-CH3O, 7-C2H5O, lll 8-CH3O, 9-CH3, 9-Cl, 9-Br III 8 R 9 , де R=H, 7-CH3O, 7-C2H5O, 8-CH3O, 9-CH3, 9-Cl, 9-Br, і спосіб його одержання [Gorobets N., Sedash Y. et al., Tetrahedron Lett., 51, 2095-2098 (2010)]. Недоліком структури аналога формули III є обмежені можливості хімічної модифікації їх струк 5 95886 тури, внаслідок хімічної інертності аміноазольного фрагмента та відсутності інших реакційних центрів. N NH + N NH2 H3C Спосіб одержання сполук формули III здійснюється за схемою: CH3 R O CH3 6 O + H OH MW N N N O N H 7 8 R Реакція проходить в одну стадію шляхом взаємодії еквімолярних кількостей 3-аміно-1,2,4триазолу, відповідного заміщеного саліцилового альдегіду і потрійної кількості ацетону в метанолі у присутності каталізатора 4 нормального розчину хлороводневої кислоти (НСl) у діоксані. Процес ведуть при мікрохвильовому опроміненні (максимальна потужність 300 W) при температурі 150 °С протягом 30 хвилин. Реакційну масу охолоджують і витримують при перемішуванні 24 години при кімнатній температурі до повного осадження. Осад відфільтровують, промивають метанолом, ефіром, сушать. Одержують 5-метил-11,12-дигідро-5,11метано[1,2,4]триазоло[1,5-с][1,3,5]бензоксадіазоцин. Виходи складають 33-50 %, загальний час синтезу 24-25 годин. Недоліками відомого способу одержання сполук формули III є тривалість процесу, використання як розчинника токсичної речовини - метанолу, низькі виходи реакції, використання вогненебезпечних розчинників - метанолу, ефіру, діоксану. Сполуки формули III і спосіб їх одержання як найбільш близький за технічною суттю вибрано нами як прототип. В основу винаходу поставлено задачу пошуку нових сполук у низці каркасних сполук азолобензоксазоцинів, а також розробки простого і доступного способу одержання заміщених 3-арил-10,11дигідро-4,10-метанопіразоло[4,3с][1,5]бензоксазоцин-4(1H)карбонових кислот, що дозволяє скоротити тривалість технологічного процесу, виключити застосування отруйних, вогненебезпечних розчинників, підвищити вихід кінцевих продуктів. Рішення поставленої задачі забезпечується розробкою заміщених 3-арил-10,11-дигідро-4,10метанопіразоло[4,3-с][1,5]бензоксазоцин4(1H)карбонових кислот загальної формули І. 9 . Рішення поставленої задачі забезпечується також тим, що у способі одержання сполук загальної формули І, що включає конденсацію рівномолярних кількостей аміноазолу, саліцилового альдегіду і сполуки, що містить кетогрупу, в органічному розчиннику, згідно з винаходом, як аміноазол використовують заміщені 5амінопіразоли, як сполуки, що містить кетогрупу, використовують піровиноградну кислоту, як органічний розчинник використовують оцтову кислоту, конденсацію проводять в умовах ультразвукового випромінювання при кімнатній температурі протягом 45 хвилин - 1,5 години до утворення цільового продукту. Сполука формули І - речовина світло жовтого кольору, термічно стабільна, що розчиняється в сильно полярних розчинниках (диметилфорамід, диметилсульфоксид), погано розчиняється в органічних розчинниках (спиртах, хлороформі), не розчиняється у воді, ефірі, в оцтовій кислоті. Модифікація структури сполук формули І, що заявляються, шляхом конденсації 3-заміщених 5амінопіразолу з піровиноградною кислотою в оцтовій кислоті при ультразвуковому випромінюванні приводить до появи структури сполук формули І з постійним хімічним складом з високими виходами реакції. Експериментальним шляхом установлено, що вибір реагентів і проведення реакції в умовах ультразвукового випромінювання дозволяє одержувати цільові продукти без застосування каталізатора і отруйних розчинників (метанол, діоксан) при кімнатній температурі, підвищити чистоту і вихід сполук формули І, значно зменшити енерговитрати. Тривалість технологічного процесу зменшується за рахунок відсутності витримування реакційної суміші при кімнатній температурі протягом однієї доби до повного осадження (як у прототипі). Можливість видозміни хімічної структури споO OH лук формули І варіюванням замісників в аміноазоR1 льній складовій, а також можливість варіювання структур нових сполук через карбоксильну групу O відкриває перспективи синтезу великого набору N де R1=C2H5, 4-CH3O-C6H4, 4-Br-C6H4, нових корисних речовин з новими властивостями потенційних біологічно активних речовин. N 4-Cl-C6H4, 4-C2H5-C6H4 6 N H I H При проведенні досліджень виявлено оптимаR2=H, 6-CH3O, 8-Cl 7 льний режим синтезу. Так, проведення реакції в умовах, що заявляються, при кімнатній темпера8 R2 ,І турі протягом 45 хвилин - 1,5 години забезпечує де R1=C6H5, 4-CH3O-C6H4, 4-Br-C6H4, 4-Cl-C6H4, високу швидкість реагування всіх компонентів син4-C2H5-C6H4; тезу і приводить відповідно до зменшення триваR2=H, 6-CH3O, 8-Cl. лості технологічного процесу. Збільшення або 7 95886 зменшення часу перебігу реакції є недоцільним, тому що саме цього часу (в залежності від замісників R1) достатньо для утворення сполук формули І з високими виходами. Взаємодія всіх вихідних речовин в оцтовій кислоті в умовах ультразвукового випромінювання при кімнатній температурі дозволяє виділяти цільові продукти вже із реакційної маси чистими, а також сприяє проходженню реакції у необхідному напрямку. Для повного проходження реакції у напрямку, необхідному для утворення сполук формули І, 8 суміш компонентів реакції - амінопіразол : саліциловий альдегід : піровиноградна кислота - беруть у рівномолярному співвідношенні 1:1:1. Застосування будь-якого із компонентів у співвідношенні, меншому або більшому ніж потребується за реакцією, приводить до утворення суміші вихідних, кінцевих продуктів і речовин, що не прореагували, яку важко розділити. Спосіб, що заявляється, проходить в одну стадію і здійснюється за схемою: R1 N N H OH NH2 + R2 O O R1 O OH + H3C O OH US HOAc O N N H N H R2 , де R1=C6H5, 4-CH3O-C6H4, 4-Br-C6H4, 4-Cl-C6H4, 4-C2H5-C6H4; R2=H, 6-CH3O, 8-Cl. Синтез проходить в умовах ультразвукового випромінювання і полягає в тому, що проводять конденсацію 3-заміщених 5-амінопіразолу з саліциловим альдегідом і піровиноградною кислотою в оцтовій кислоті протягом 45 хвилин - 1,5 години до утворення цільового продукту. Ультразвукове випромінювання здійснювалося за допомогою стандартної ультразвукової бані. У таблиці 1 наведено порівняльні характеристики способу, що заявляється, і способів за прототипом і аналогом за структурою. У таблиці 2 надано характеристики сполук, що заявляються, і сполуки, одержаної за прототипом. Приклад 1. Одержання 3-феніл-10,11-дигідро4,10-метанопіразоло[4,3-с][1,5]бензоксазоцин4(1H)карбонової кислоти 0,15 г (0,9 ммоль) 5-аміно-3-фенілпіразолу розчиняють у 2,5 мл оцтової кислоти, додають 0,1 г (0,9 ммоль) саліцилового альдегіду і 0,08 г (0,9 ммоль) піровиноградної кислоти. Суміш поміщають в ультразвукову баню на 1,5 години. Осад, що випадає, відфільтровують, промивають етанолом, сушать. Вихід становить 0,22 г (72 %). Т. пл. 190192 °С. Приклад 2. Одержання 3-(4-хлорфеніл)-10,11дигідро-4,10-метанопіразоло[4,3с][1,5]бензоксазоцин-4(1H)карбонової кислоти Синтез ведуть аналогічно прикладу 1. Для реакції беруть: 0,15 г (0,9 ммоль) 3-хлор-5 амінопіразолу, 0,1 г (0,9 ммоль) саліцилового альдегіду і 0,08 г (0,9 ммоль) піровиноградної кислоти. Суміш опромінюють 45 хвилин. Вихід 0,23 г (80 %). Т. пл. 203-205 °С. Решту прикладів зведено у таблиці 2. Дані матеріалів заявки і таблиці 2 показують, що структура сполук забезпечує одержання широкого набору заміщених 3-арил-10,11-дигідро-4,10метанопіразоло[4,3-с][1,5]бензоксазоцин4(1H)карбонових кислот з високим ступенем чистоти. Спосіб одержання сполук формули І, що пропонується, дозволяє: - значно зменшити тривалість технологічного процесу до 45 хвилин - 1,5 години (прототип 24-25 годин); - збільшити виходи і якість сполук формули І за рахунок проведення реакції при ультразвуковому випромінюванні; - варіювати замісники в піразольній компоненті; - забезпечити відсутність отруйних і вогненебезпечних розчинників. Всі ці переваги нових сполук і способу їх одержання розширюють можливості їх потенційного використання як біологічно активних речовин, в медицині як лікарських препаратів, в препаративному органічному синтезі. Спосіб одержання сполук формули І простий, пройшов апробацію у лабораторних умовах і може легко відтворюватися в умовах виробничої практики. Таблиця 1 Спосіб, що заявляється Спосіб - прототип Спосіб за аналогом Кількість стадій Тривалість проце- Вихід цільових Використання отруйних вогреакції су, год. продуктів, % ненебезпечних речовин 1 45хв.-1,5 72-88 не застосовуються 1 24-25 33-50 метанол, діоксан використовуються каталіза1 7-7,5 72-55 тор ІnВr3 9 95886 10 Таблиця 2 Сполуки, що заявляються O R1 NN п/п OH O N N H Т.пл., С N H Вихід, % 4 190-192 5 72 ЯМР Н, (м.ч.) 1 6 7 8 R1 2 R2 1 1 C6H5 R2 3 H 2 4-СН3О-С6Н4 H 197-199 88 3 4-Вr-С6Н4 H 180-182 82 4 4-Сl-С6Н4 H 203-205 80 5 4-C2H5-С6Н4 Н 206-208 74 6 4-СН3О-С6Н4 8-Сl 218-220 69 7 4-СН3О-С6Н4 6-ОСН3 208-210 74 8 4-Сl-С6Н4 6-ОСН3 214-216 72 9 4-Сl-С6Н4 8-Сl 211-213 81 Комп’ютерна верстка Л.Литвиненко Підписне 6 2,22 (2Н, м, СН2); 4,42 (1H, м, СН); 6,45 (1H, с, NH); 6,78-7,7 (9Н, м, АrН); 12,47 (ус, NH+COOH) 2,21 (2Н, м, СН2); 3,78 (3Н, с, ОСН3); 4,4 (1Н, м, СН); 6,4 (1H, с, NH); 6,8-7,6 (8Н, м, АrН); 12,33 (ус, NH+COOH) 2,19 (2Н, м, СН2); 4,42 (1Н, м, СН); 6,56 (1Н, с, NH); 6,84-7,67 (8Н, м, АrН); 12,21 (ус, NH+COOH) 2,19 (2Н, м, СН2); 4,42 (1H, м, СН); 6,57 (1H, с, NH); 6,84-7,64 (8Н, м, АrН); 12,55 (ус, NH+COOH) 1,19 (3Н, т, СН2СН3); 1,42 (2Н, кв, СН2СН3); 2,2 (2Н, м, СН2); 4,39 (1H, м, СН); 6,43 (1Н, с, NH); 6,83-7,56 (8Н, м, АrН); 12,42 (ус, NH+COOH) 2,2 (2Н, м, СН2); 3,77 (3Н, с, ОСН3); 4,42 (1Н, м, СН); 6,44 (1Н, с, NH); 6,83-7,65 (7Н, м, АrН); 12,17 (ус, NH+COOH) 2,19 (2Н, м, СН2); 3,74 (3Н, с, ОСН3); 3,77 (3Н, с, ОСН3); 4,37 (1Н, м, СН); 6,34 (1Н, с, NH); 6,72-7,74 (7Н, м, АrН); 12,33 (ус, NH+COOH) 2,18 (2Н, м, СН2); 3,74 (3Н, с, ОСН3); 4,4 (1Н,м, СН); 6,5 (1Н, с, NH); 6,73-7,81 (7Н, м, АrН); 12,32 (ус, NH+COOH) 2,2 (2Н, м, СН2); 4,45 (1H, м, СН); 6,59 (1Н, с, NH); 6,86-7,69 (7Н, м, АrН); 12,6 (ус, NH+COOH) Тираж 23 прим. Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted 3-aryl-10,11-dihydro-4,10-methanopyrazolo[4,3-c][1,5]benzoxazocine-4(1h)-carboxylic acids and process for the preparation thereof
Автори англійськоюSakhno Yana Ihorivna, Afanasiadi Liudmyla Mykhailivna, Chebanov Valentyn Anatoliiovych, Desenko Serhii Mykhailovych, Murlykina Maryna Volodymyrivna
Назва патенту російськоюЗамещенные 3-арил-10,11-дигидро-4,10-метанопиразоло[4,3-с][1,5] бензоксазоцин-4(1н)карбоновые кислоты и способ их получение
Автори російськоюСахно Яна Игоревна, Афанасиади Людмила Михайловна, Чебанов Валентин Анатолиевич, Десенко Сергей Михайлович, Мурлыкина Марина Владимировна
МПК / Мітки
МПК: C07D 498/18, C07D 498/08, C07D 231/54, C07D 267/00
Мітки: одержання, кислоти, бензоксазоцин-4(1н)карбонові, спосіб, 3-арил-10,11-дигідро-4,10-метанопіразоло[4,3-с][1,5, заміщені
Код посилання
<a href="https://ua.patents.su/5-95886-zamishheni-3-aril-1011-digidro-410-metanopirazolo43-s15-benzoksazocin-41nkarbonovi-kisloti-ta-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Заміщені 3-арил-10,11-дигідро-4,10-метанопіразоло[4,3-с][1,5] бензоксазоцин-4(1н)карбонові кислоти та спосіб їх одержання</a>
Попередній патент: Полірувальний склад
Наступний патент: Спосіб автоматичного управління завантаженням потоково-транспортної лінії сипких матеріалів
Випадковий патент: Спосіб лікування хворих з ураженням товстої кишки









