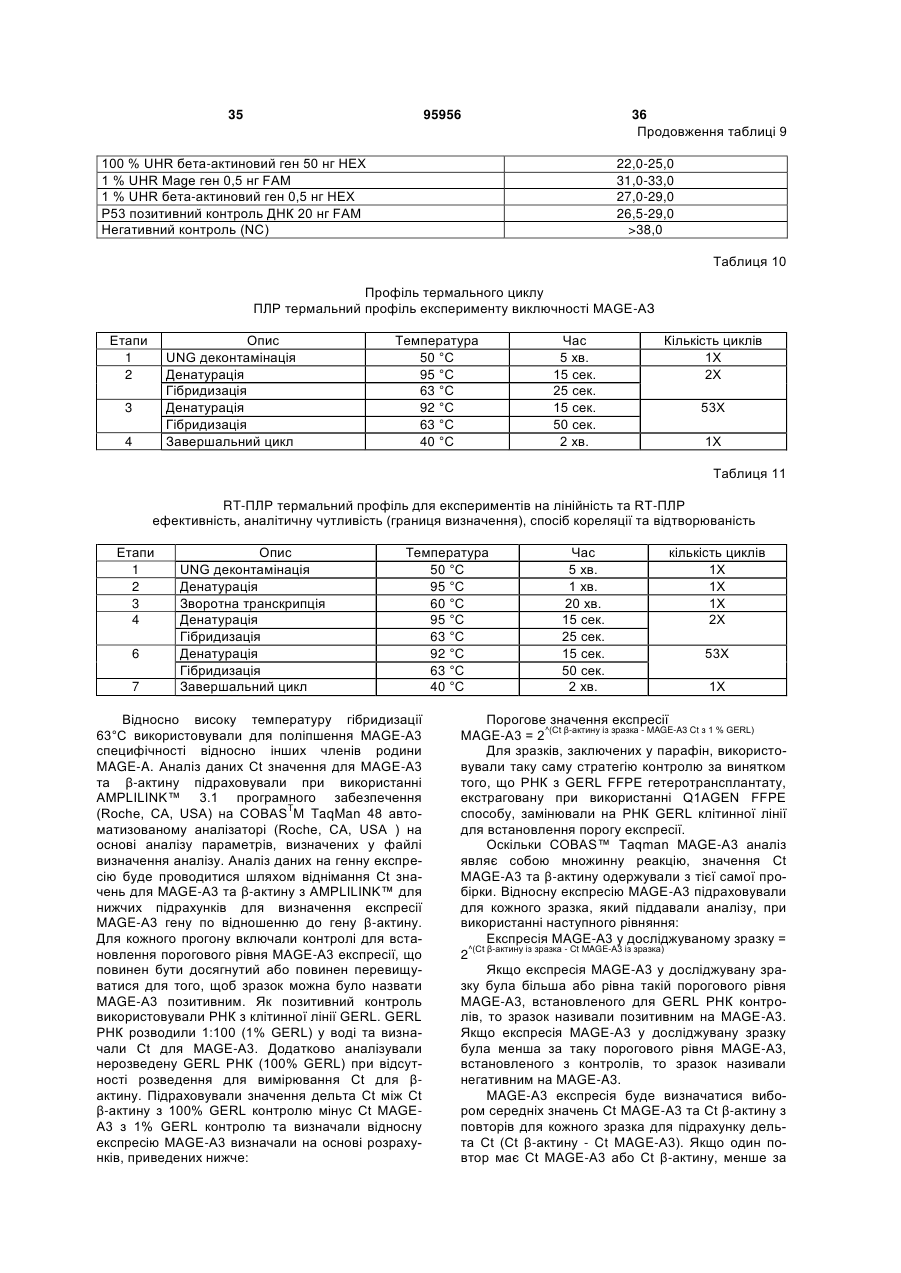
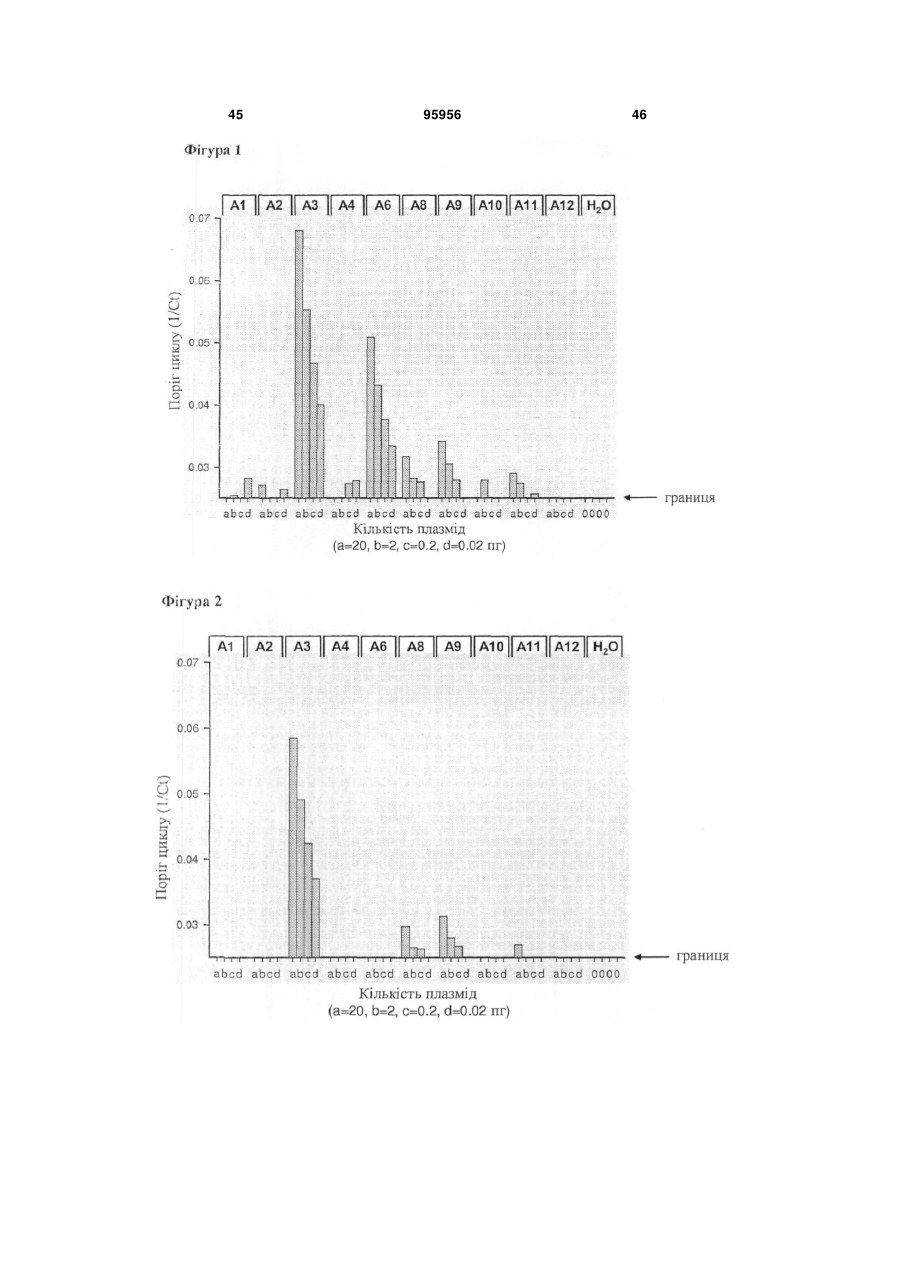
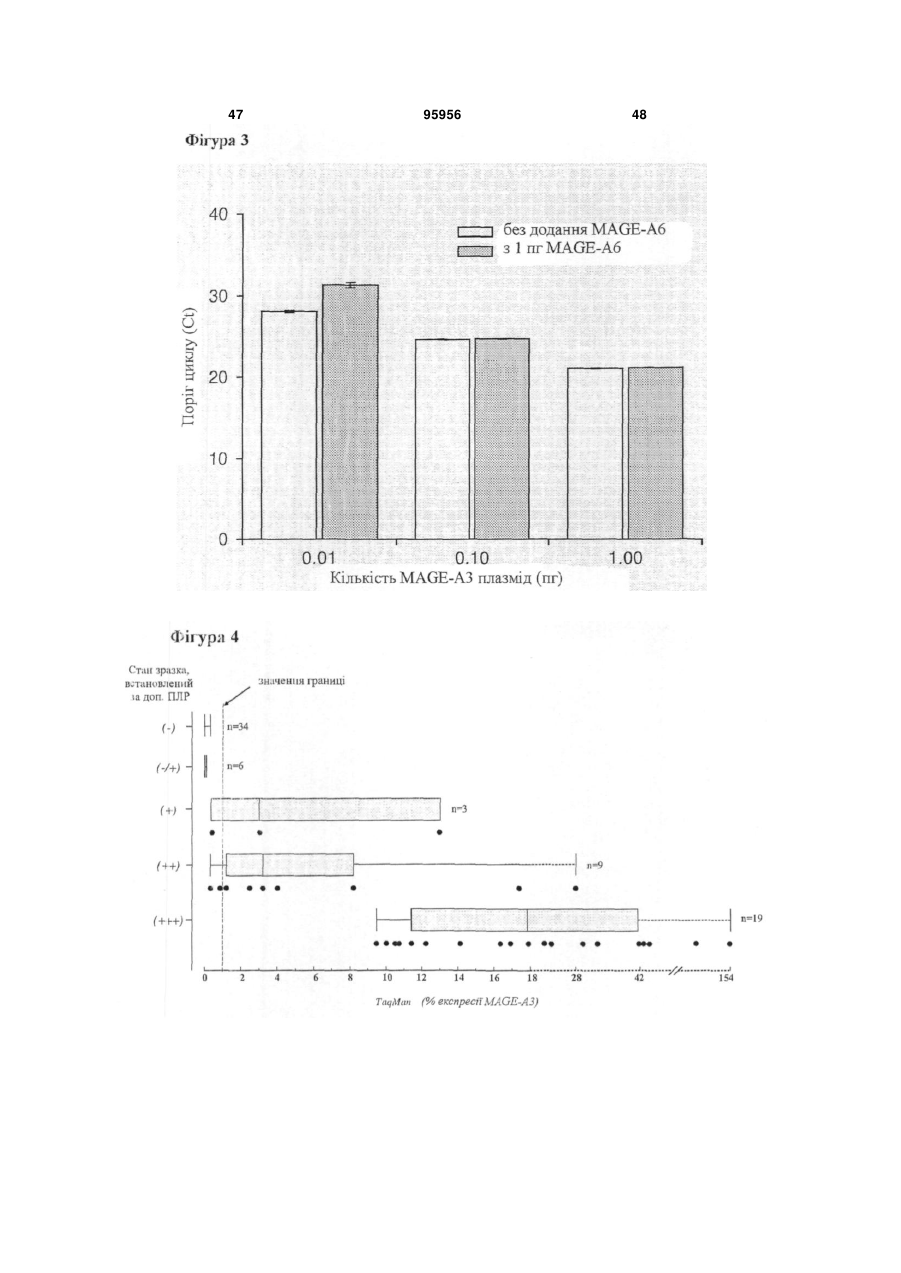
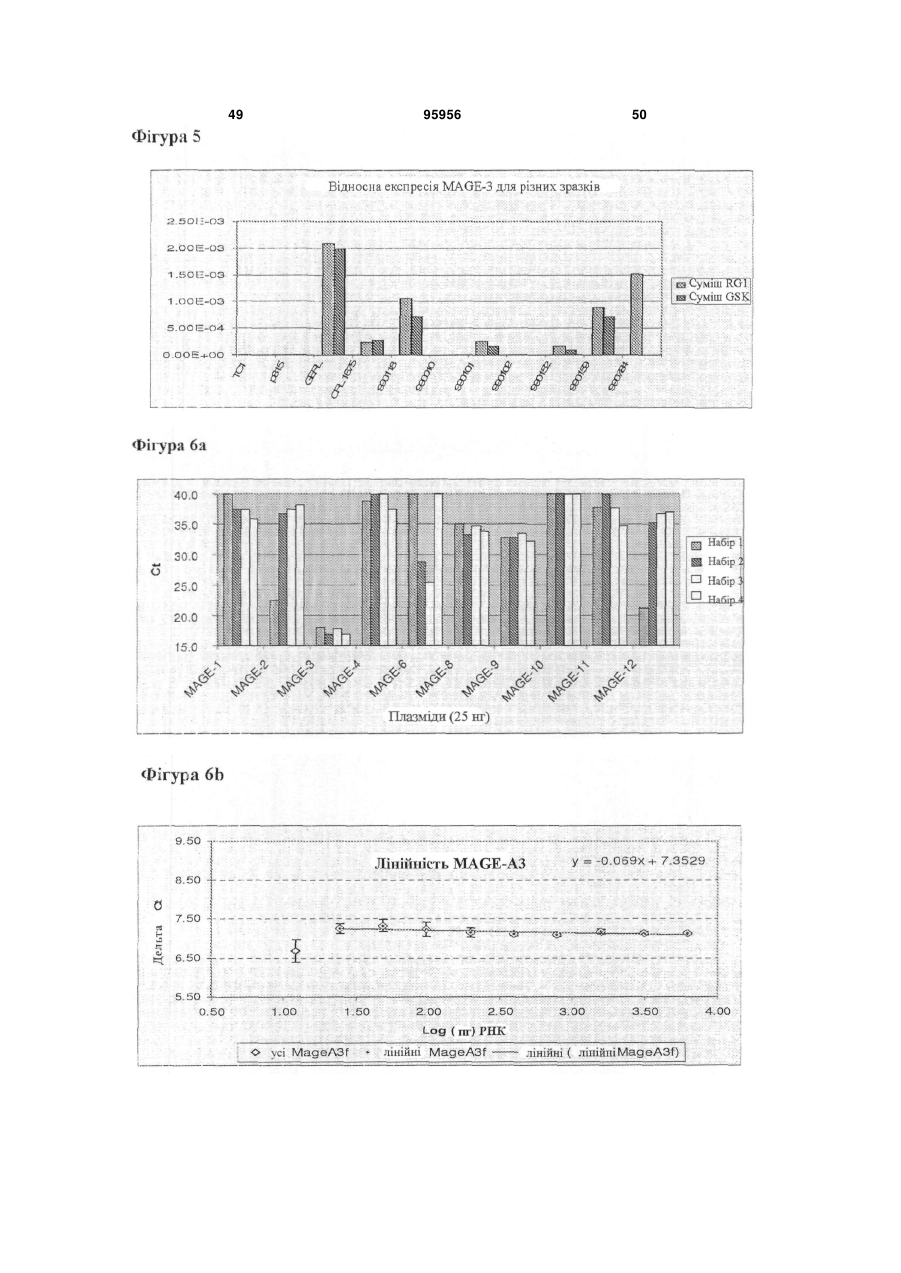
Набір для визначення mage-а3
Номер патенту: 95956
Опубліковано: 26.09.2011
Автори: Бір Ґабрієль Аннмарі, Кох Т'єррі, руселл Олів'є, Стефенс Крейґ Лоуренс, Салонґа Денніс
Формула / Реферат
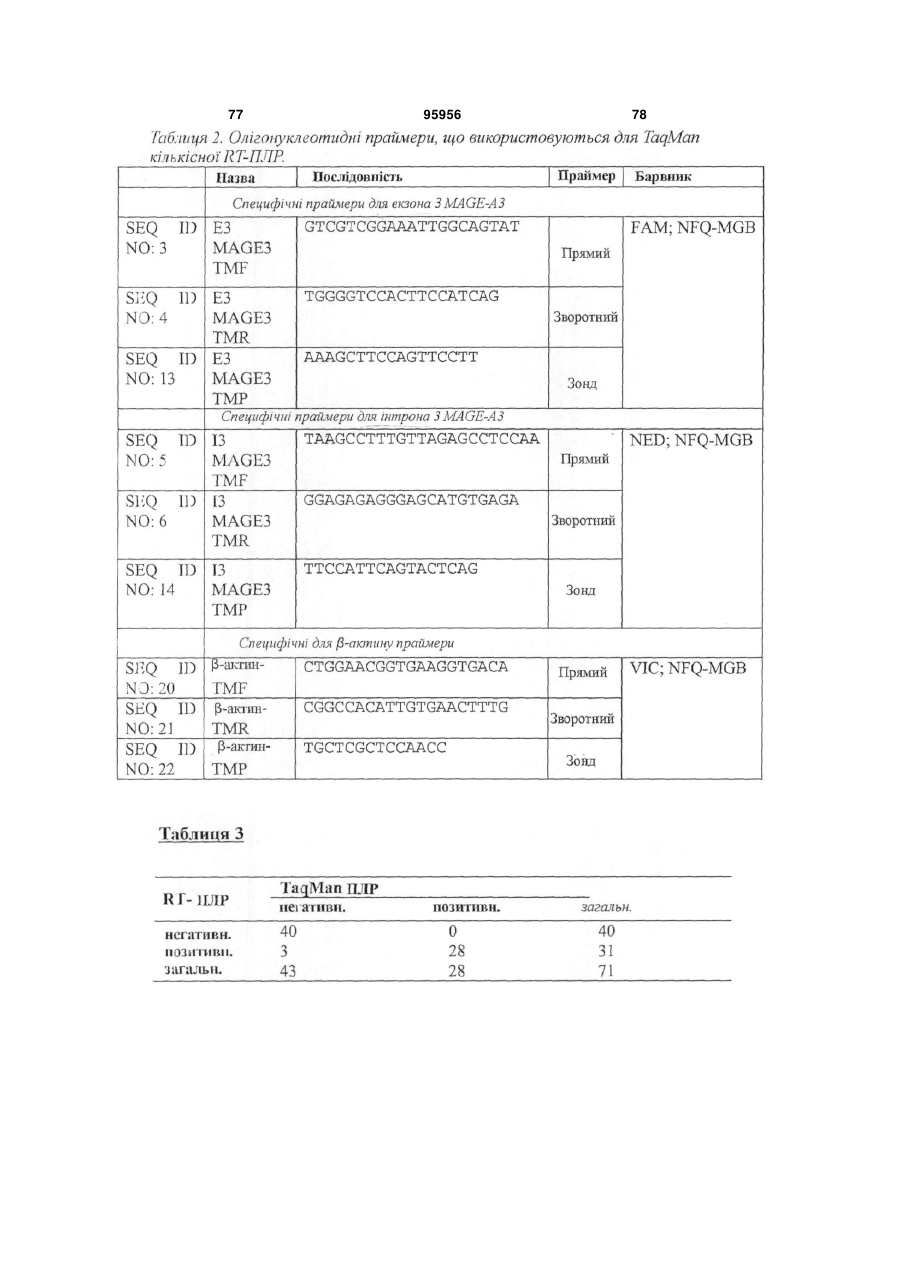
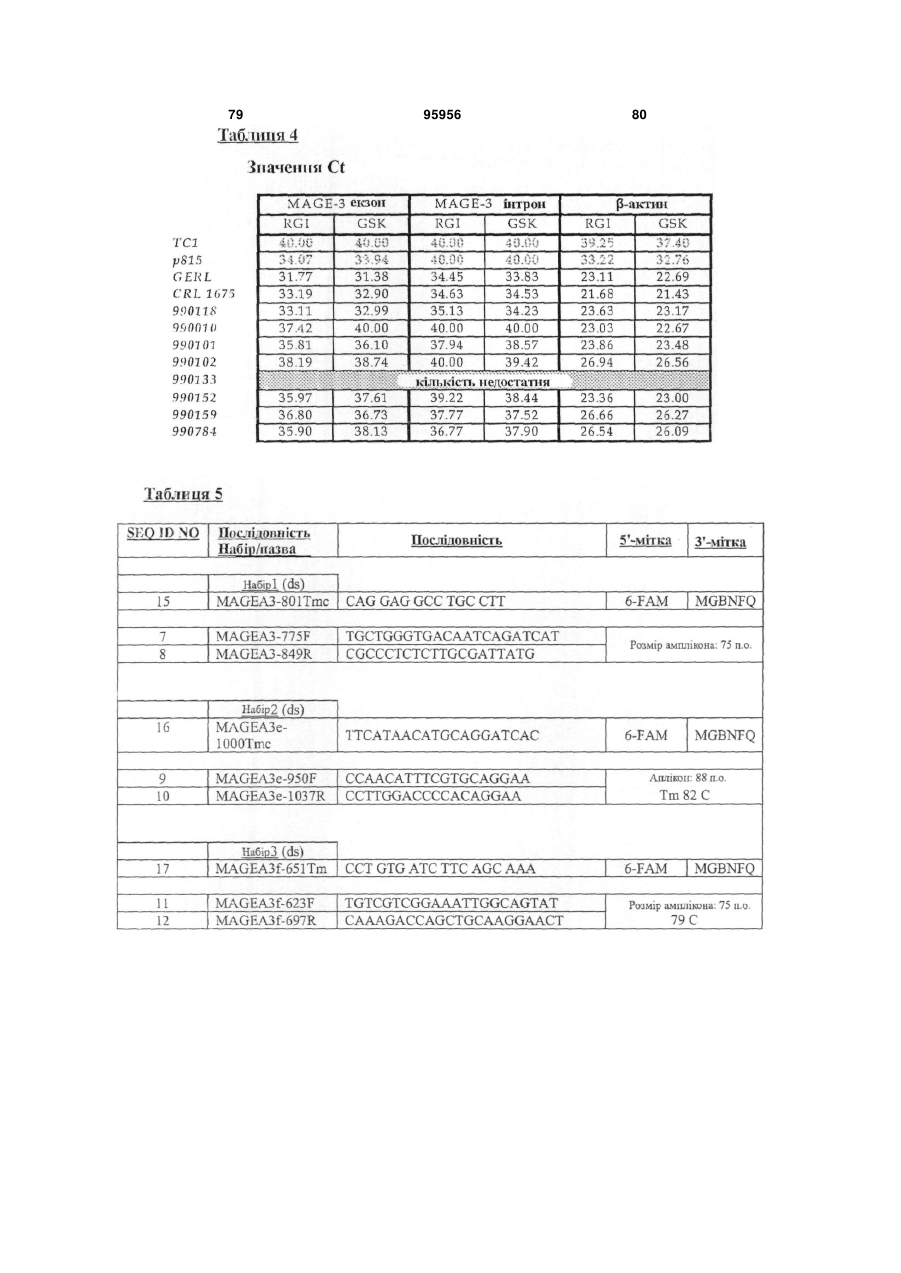
1. Набір для визначення MAGE-А3 у зафіксованому у формаліні та залитому у парафін (FFPE) зразку тканини, що містить набір прямих та зворотніх праймерів у відповідності з SEQ ID NO: 11 та 12 та один зонд, вибраний із зонда, що складається з SEQ ID NO: 53, та зонда, що складається з SEQ ID NO: 17, з флуоресцентним репортерним барвником на 5´-кінці та нефлуоресцентним гасником на 3´-кінці.
2. Набір за п. 1, в якому вказаний зонд складається з SEQ ID NO: 17 з 6-карбоксифлуоресцеїном на 5´- та нефлуоресцентним гасником на 3´-кінці.
3. Спосіб визначення присутності або відсутності MAGE-A3 у FFPE пухлинній тканині, що включає етап контактування ізольованих нуклеотидних послідовностей, одержаних з FFPE зразка пухлини, або таких, що походять з FFPE зразка пухлини, з набором праймерів та зонда згідно з пунктом 1.
4. Спосіб за п. 3, що додатково включає етап ампліфікації нуклеотидної послідовності та визначення у зразку ампліфікованої нуклеотидної послідовності.
5.Cпосіб лікування пацієнта, що включає визначення, чи експресує пухлинна тканина MAGE-A3, при використанні способу згідно з пунктом 3, а потім введення композиції, що включає специфічний для MAGE-A3 імунотерапевтичний засіб, пацієнтові.
6. Cпосіб лікування пацієнта, що є схильним до повторної появи пухлини, яка експресує MAGE-A3, де пацієнт піддавався лікуванню для видалення/лікування пухлинної тканини, яка експресує MAGE-A3, при цьому спосіб включає: визначення, чи експресує пухлинна тканина пацієнта MAGE-A3, при використанні способу згідно з пунктом 3, а потім введення композиції, що включає специфічний для MAGE-A3 імунотерапевтичний засіб, вказаному пацієнтові.
Текст
1. Набір для визначення MAGE-А3 у зафіксованому у формаліні та залитому у парафін (FFPE) зразку тканини, що містить набір прямих та зворо C2 2 (19) 1 3 95956 4 при використанні діагностичного способу, описанонти мають суттєвий ризик розвитку рецидиву. Таго в даній заявці. ким чином, залишається необхідність запобігання Родина MAGE (антиген меланоми) генів була розвитку меланоми та одержання поліпшених респочатку ідентифікована завдяки вичлененню з жимів лікування для метастатичної меланоми та родини цитолітичних лімфоцитів, що походять з допоміжних способів лікування для пацієнтів, які лімфоцитів крові ракових пацієнтів (Van der піддавалися первинному видаленню пухлини. Bruggen та ін., 1991). Родина MAGE генів зараз Рак легень нараховує більше 20 членів та складається з генів Iснує два типи раку легень: не дрібноклітинний MAGE А, В, С та D (Scanlan та ін., (2002) Immunol рак легень (NSCLC) та дрібноклітинний рак легень Rev. 188:22-32; Cnomez та ін., (2001) Cancer Res. (SCLC). Назви просто описують тип клітин, які ви61(14):5544-51). Вони розміщуються на хромосомі явлені у пухлинах. NSCLC включає карциному X (Lucas та ін., 1998 Cancer Res. 58:743-752; Lucas лускатих клітин, аденокарциному, карциному вета ін., 1999 Cancer Res 59:4100-4103; Lucas та ін., ликих клітин та нараховує приблизно 80% ракових 2000 Int J Cancer 87:55-60; Lurquin та ін., 1997 захворювань легень. NSCLC важко піддається Genomics 46:397-408; Muscatelli та ін., 1995 Proc лікуванню, та способи лікування, які є доступними, Natl Acad Sci USA 92:4987-4991; Pold та ін., 1999 мають на меті подовжити період життя якомога Genomics 59 161-167; RognerTa ін., 1995 Genomics більше та послабити симптоми захворювання. 29:725-731) та володіють не до кінця визначеною NSCLC є найбільш загальним типом раку легень функцією (Ohman та ін. 2001 Exp Cell Res. 265(2): та асоціюється з несприятливими виходами. З усіх 185-94). Гени MAGE є високо гомологічними, а NSCLC пацієнтів приблизно 25% мають локорегіочлени родини MAGE-Α володіють, зокрема, 60нарне захворювання під час діагностики та все ще 98% гомологією. MAGE гени не експресуються в підлягають хірургічному видаленню (стадії IB, НА нормальних клітинах, за винятком експресії у спеабо ІІВ згідно з AJCC класифікацією). Проте 50% оматогенії та плаценті (Haas та ін., 1988 Am J цих пацієнтів мають рецидиви протягом двох років Reprod Immunol Microbiol 18:47-51; Takahashi та після повного хірургічного видалення. Таким чиін., 1995 Cancer Res 55:3478-382). ном, існує необхідність у забезпеченні кращого Реактивація генної експресії MAGE при раку способу лікування цих пацієнтів. відбувається завдяки патологічному деметилуванЕкспресія MAGE-A3 ню промотору (De Smeet та ін., 1996 Proc Natl Раніше існував ряд способів, які намагалися Acad Sci USA 93(14)7149-53; De Smeet та ін., 1999 виміряти експресію MAGE-A3 генів як у клітинних Моl Cell Biol. 19(11):7327-35). 12 MAGE-A генів лініях, так і у зразках пухлини. Також використовуваріабельно понадекспресуються при наступних валися напівкількісний спосіб RT-ПЛР (De Plaen та ракових захворюваннях: карцинома перехідних ін., 1994 Immunogenetics 40(5):360-9), інші методиклітин, карцинома стравоходу, меланома, карцики, які базуються на ПЛР, та мікрочіп серійних рознома жовчного та сечового міхура та недрібнокліведень (Zammatteo та ін., 2002 Clinical Chemistry тинна карцинома легень (NSCLC) (Scanlan та ін., 48(1) 25-34). Проте у багатьох цих дослідженнях 2002 Immunol Rev. 183:22-32). Понадекспресія та основна проблема полягала у дуже високій гомоспецифічність MAGE експресії у ракових тканинах логії між членами родини MAGE, що зумовлювало привела до використання білка MAGE-А3 як антипомилкові позитивні результати. Для масштабних гену у ракових вакцинах (Scanlan та ін., 2002 дослідів фази II та III є бажаним аналіз з високою Immunol Rev. 188:22-32). Проте завдяки широкому пропускною здатністю, здатний специфічно іденспектру експресії, що виявляється у ракових пацітифікувати зразки, що екзпресують MAGE-А3, та єнтів, рівень експресії MAGE-А3 повинен бути точзнижувати ймовірність наявності зразків, які є поно оцінений для кожного пацієнта для того, щоб милково виявлені як позитивні. спрямувати вакцинацію на пацієнтів, які єкспреІнша складність виникає при застосуванні фіксукль цей білок. MAGE-А3 часто називають почерсованої у формаліні, заключеної у парафін (FFPE) гово MAGE-3; обидві ці назви використовуються в пухлинною тканиною, що є звичайним способом даній заявці. зберігання пухлинною тканини у клінічних центрах. Меланома Фіксація у формаліні змінює структуру молекул Пацієнти, які мають злоякісну меланому з відРНК у тканині, викликаючи перехресне зв'язування даленим метастазом (стадія IV згідно з класифіката часткову деградацію. Часткова деградація прицією Американського об'єднаного з раку (AJCC)), водить до створення менших шматочків РНК розмають середній період виживання один рік, зі знаміром 100-300 пар основ. Ці структурні зміни РНК ченням довгострокового виживання тільки 5%. роблять складним застосування РНК, екстраговаНавіть стандартна терапія для меланоми IV стадії ної з FFPE тканини, у традиційних методиках діагмає значення терапевтичної відповіді тільки у 8ностики. 25%т пацієнтів, при відсутності впливу на загальКороткий опис малюнків ний час виживання. Пацієнти з регіонарними метаФігура 1; Специфічність MAGE-A3 RT-ПЛР стазами (стадія III) мають середній період вижиTaqMan праймерів у родині членів MAGE-A. вання від двох до трьох років з дуже низькою Фігура 2: Специфічність зонда зв'язувальної можливістю довгострокового виживання, навіть маленької бороздки (Minor Groove Binding) (MGB) після адекватного хірургічного контролю первинноTaqMan RT-ПЛР для експресії MAGE-А3. го та регіонарного метастазів (Balch та ін., 1992 Фігура 3: Специфічність аналізу MAGE-А3 Semin Surg Oncol. 8(6):400-14). Більшість пацієнпраймерів у присутності MAGE-А3 та MAGE-6 платів, які мають стадію І - III меланоми, піддавалися змід. хірургічному видаленню меланоми, проте ці паціє 5 95956 6 Фігура 4: Пухлинна експресія MAGE-А3, як буТаблиця 8: Послідовності COBAS™ TaqMan ло виміряно шляхом кількісної TaqMan ПЛР бета-актинового праймера та зонда Фігура 5: Аналіз експресії MAGE-A3. Таблиця 9: Зразок та контрольний прийнятний Фігура 6а: Специфічність MAGE-А3 праймерів, інтервал Ct для COBAS™ TaqMan сконструйованих для застосування у FFPE тканині. Таблиця 10: COBAS™ TaqMan профіль терФігура 6b: Аналіз лінійності праймерів при відмальної циклізації - термальний профіль ПЛР для мінних кількостях РНК. MAGE-А3 експерименту виключності Фігура 7: Порівняння між аналізом пізнього заТаблиця 11: RT-ПЛР термальний профіль для морожування РНК з аналізом ПЛР FFPE тканини. лінійності та RT-ПЛР ефективност,, аналітична Фігура 8: Відносне порівняння пізнього замочутливість (границя визначення), спосіб кореляції рожування РНК та FFPE на основі MAGE-А3 аната експерименти щодо відтворюваності лізів. Таблиця 12: Ct значення з MAGE-Α плазмідаФігура 9: Нуклеотидна послідовність, що кодує ми при використанні 20, 2, 0,2, 0,02 пг ДНК злитий білок на основі фрагменту ліпопротеїну D, Таблиця 13: Дельта Ct значення стосовно Маgе3 фрагменту та гістидинового хвоста, та її MAGE-А3 для інших MAGE-Α плазмід відповідна амінокислотна послідовність (SEQ ID при використанні 20, 2, 0,2, 0,02 пг ДНК NO:35 та 36). Таблиця 14: Підтвердження експерименту Фігура 10: Злитий білок NS1-MAGE3 та гістиMAGE-А3 виключності диновий хвіст (SEQ ID NO:37) Таблиця 15 та Таблиця 16: Деталі експеримеФігура 11: ДНК, що кодує злитий білок NS 1нтів щодо виключності MAGE-A3 MAGE3-His (SEQ ID NO:38) Таблиця 17: Лінійність Ct MAGE-А3 та β-актину Фігура 12: Злитий білок CLYTA-MAGE3-His та дельта Ct з 10 повторів при 11 рівнях (SEQ ID NO:39) Таблиця 18: Ефективність RT-ПЛР ампліфікаФігура 13: ДНК злитого білка CLYTA-MAGE3ції MAGE-А3 та β-актину His (SEQ ID NO:40) Таблиця 19: Експеримент по підтвердженню Фігура 14: Порівняння послідовностей родини лінійності / ефективності RT-ПЛР MAGE-Α генів для конструювання RT-ПЛР прайТаблиці 20, 21 та 22: Деталі експериментів з мерів та зондів для MAGE-A3 лінійності / ефективності RT-ПЛР Фігура 15: Порівняння MAGE-А3 та MAGE-A6 Таблиця 23: Значення співпадання MAGE-А3 послідовностей для ідентифікації ділянок, що місCt, N = 24 для кожного стану тять цільові послідовності (виділено рамкою) Таблиця 24: Процентне значення співпадання Фігура 16: Класи для напівкількісної MAGE-A3 Ct для MAGE-А3, Ν = 24 для кожного стану RT-ПЛР: приклад того, як п'ять класів можуть бути Таблиця 25: Значення співпадання Ct для βпризначені для проведення напівкількісного аналіактину, Ν = 24 для кожного стану зу MAGE-A3 RT-ПЛР Таблиця 26: Процентне значення співпадання Фігура 17: Графічне порівняння значень Ct, Ct для β-актину, Ν = 24 для кожного стану одержаних за допомогою MAGE-A плазмід при Таблиця 27 Контрольні Ct для MAGE гену FAM використанні 20, 2, 0,2 0,02 пг ДНК Таблиця 28: Контрольні Ct для β-актину Фігура 18: Графічне порівняння значень дельТаблиця 29; та Ct стосовно MAGE-А3 для інших MAGE-Α плазТаблиця 30 та Таблиця 31: Деталі експеримемід при використанні 20, 2, 0,2 0,02 пг ДНК нту з визначення границі Фігура 19: Лінійність FFPE Xenograft GERL Таблиця 32: Заключна перехресна валідація РНК - двократні серійні розведення від 100 до 0,1 зразків нг внесеної РНК Таблиця 33: COBAS та прототип аналізи позиФігура 20: показує графік залежності дельта Ct тивних та негативних результатів за допомогою від log (основа 2) внесеної РНК проти між MAGEпрограми для визначення проценту відповідності А3 та β-актином. Таблиця 34: COBAS та прототип аналізи позиОпис таблиць та послідовностей тивних та негативних результатів за допомогою Таблиця 1: Олігонуклеотидні праймери, що випрограми для визначення проценту відповідності із користовуються для напівпрепаративної MAGE замороженими зразками для визначення суперечRT-ПЛР. ливих результатів Таблиця 2: Олігонуклеотидні праймери, що виТаблиця 35: Експеримент з визначення конткористовуються для TaqMan кількісної RT-ПЛР. ролю Ct гену MAGE Таблиця 3: Порівняння MAGE-А3 напівкількісТаблиця 36: Експеримент з визначення контної ПЛР та кількісної TaqMan ПЛР. ролю Ct гену β-актину Таблиця 4: Порівняння значень Ct та дельта Таблиці 37, 38 та 39: Деталі способу кореляції Ct при використанні ПЛР суміші 1 та ПЛР суміші 2. / експерименту з перехресної валідації Таблиця 5: Олігонуклеотидні праймери, що виТаблиця 40: Прогон 1 - поріг експресії MAGEкористовуються для MGB TaqMan кількісної RTА3 з контролів GERL РНК ПЛР із замороженої тканини Таблиця 41: Прогон 1 - сигнал експресії Таблиця 6: Класи напівкількісної MAGE-A3 RTMAGE-А3 для зразків відтворюваності ПЛР: приклад того, як п'ять класів можуть бути Таблиця 42: Прогон 2 - поріг експресії MAGEпризначені для напівкількісного MAGE-A3 RT-ПЛР А3 з контролів GERL РНК аналізу (відноситься до Фігури 16) Таблиця 43: Прогон 2 - сигнал експресії Таблиця 7: Послідовності COBAS™ TaqMan MAGE-А3 для зразків на відтворюваність MAGE-А3 праймера та зонда Таблиця 44: Підтвердження відтворюваності 7 95956 8 Таблиці 45, 46 та 47: Деталі експериментів з SEQ ID NO:37 - амінокислотна послідовність відтворюваності злитого білка NS1 - MAGE3 - гістидиновий хвіст SEQ ID NO:1 - MAGE3-E2F (праймер для напі(Фігура 10) вкількісного MAGE3 аналізу) (Таблиця 1) SEQ ID NO:38 - нуклеотидна послідовність, що SEQ ID NO:2 - MAGE3-E3R (праймер для напікодує SEQ ID NO:37 (Фігура 11) вкількісного MAGE3 аналізу) (Таблиця 1) SEQ ID NO:39 - амінокислотна послідовність SEQ ID NO:3 - Е3 MAGE3 TMF (прямий прайзлитого білка CLYTA-MAGE3-гістидин (Фігура 12) мер для екзону 3 MAGE-A3) (Таблиця 2) SEQ ID NO:40 - нуклеотидна послідовність, що SEQ ID NO:4 - Е3 MAGE3 TMR (зворотний кодує злитий білок CLYTA-МАGЕ3-гістидиь (Фігура праймер для екзону 3 MAGE-А3; цей праймер є 13) зворотним компліментом послідовності екзону SEQ ID NO:41 - MAGE 1 фрагмент (Фігура 14) MAGE-А3, яку він впізнає) (Таблиця 2) SEQ ID NO:42 - MAGE 2 фрагмент (Фігура 14) SEQ ID NO:5 -13 MAGE3 TMF (прямий прайSEQ ID NO:43 - MAGE 4a фрагмент (Фігура 14) мер для інтрону 3 MAGE-A3) (Таблиця 2) SEQ ID NO:44 - MAGE 7 фрагмент (Фігура 14) SEQ ID NO:6 -13 MAGE3 TMR (зворотний SEQ ID NO:45 - MAGE 8 фрагмент (Фігура 14) праймер для інтрону 3 MAGE-А3; цей праймер є 5ЕЭ ID NO:46 - MAGE 10 фрагмент (Фігура 14) зворотним компліментом послідовності послідовSEQ ID NO:47 - MAGE 11 фрагмент (Фігура 14) ності інтрону MAGE-А3, яку він впізнає) (Таблиця SEQ ID NO:48 - MAGE 12 фрагмент (Фігура 14) 2) SEQ ID NO:49 - MAGE-A6 фрагмент (Фігура SEQ ID NO:7 - MAGEA3-775F (прямий праймер 14) для MAGE-А3) (Таблиця 5) SEQ ID NO:50 - MAGE-А3 фрагмент (Фігура SEQ ID NO:8 - MAGEA3-849R (зворотний 14) праймер для MAGE-А3; цей праймер є зворотним SEQ ID NO:51 - MAGE-А3 фрагмент (Фігура компліментом послідовності MAGE-А3, яку він впі15) знає) (Таблиця 5) SEQ ID NO:52 - MAGE-A6 фрагмент (Фігура SEQ ID NO:9 - MAGEA3e-950F (прямий прай15) мер для MAGE-А3) (Таблиця 5) SEQ ID NO:53 - MAGE-А3 послідовність синтеSEQ ID NO:10 - MAGEA3e-1037R (зворотний тичного зонду MAGEA3F-646MOD (Таблиця 7) праймер для MAGE-А3; цей праймер є зворотним SEQ ID NO:54 - MAGEA3F-646MOD послідовкомпліментом послідовності MAGE-А3, яку він впіність зонду, що містить немодифіковані нуклеотизнає) (Таблиця 5) ди SEQ ID NO:11 - MAGEA3f-623F (прямий прайSEQ ID NO:55 - послідовність β-актинового мер для MAGE-А3) (Таблиця 5) праймера RGI BACT F2 (Таблиця 8) SEQ ID NO:12 - MAGEA3f-697R (зворотний SEQ Ю N0:56 - послідовність β-актинового праймер для MAGE-А3; цей праймер є зворотним праймера RGI BACT R2 (Таблиця 8) компліментом послідовності MAGE-А3, яку він впіSEQ ID NO:57 - послідовність β-актинового зознає) (Таблиця 5) нду HW RGI BACT Η (Таблиця 8) SEQ ID NO:13 - Е3 MAGE3 ТМР (зонд для екВинахідники згідно з даним винаходом удоскозону 3 MAGE3) (Таблиця 2) налили аналіз для ідентифікації пацієнтів, які маSEQ ID NO:14-13 MAGE-А3 ТМР (зонд для інють пухлинну тканину, що експресує MAGE-А3, які трону 3 МАСЕ3) (Таблиця 2) будуть, таким чином, мати переваги від застосуSEQ ID NO:15 - MAGEA3-801Tmc (зонд для вання MAGE-А3-специфічної імунотерапії. MAGE3) (Таблиця 5) В одному втіленні даного винаходу забезпечуSEQ ID NO:16 - MAGEA3e-1000Tmc (зонд для ється праймер, що включає нуклеотидиу послідоMAGE3) (Таблиця 5) вність, вибрану з SEQ ID NO:3-12. У додатковому SEQ ID NO:17 - MAGEA3f-65 ITm (зонд для втіленні забезпечується набір праймерів, що MAGE3) (Таблиця 5) включає один або більше з наступних пар праймеSEQ ID NO:18 - β-актин-Е4Р (праймер βрів: актину) (Таблиця 1) a) SEQ ID NO:3 та 4; SEQ ID NO:19 - β-актин-E6R (праймер βb) SEQ ID NO:5 та 6; актину) (Таблиця 1) c) SEQ ID NO:7 та 8; SEQ ID NO:20 - β-актин-TMF (праймер βd) SEQ ID NO:9 та 10; та актину) (Таблиця 2) e) SEQ ID NO:11 та 12. SEQ ID NO:21 - β-актин-TMR (праймер βУ додатковому аспекті даного винаходу забезактину) (Таблиця 2) печується зонд, що включає нуклеотидну послідоSEQ ID NO:22 - β-актин-ТМР (зонд для βвність, вибрану з SEQ ID NO:13-17, 53 або 54. актину) (Таблиця 2) У додатковому втіленні забезпечується набір, SEQ ID NO 23 - SEQ ID NO:29: імунопепетиди що включає: MAGE3 (і) прямий праймер; SEQ ID NO:30 - SEQ ID NO:34: допоміжні олі(іі) зворотний праймер; та гонуклеотиди (ііі) зонд, SEQ ID NO:35 - нуклеотидна послідовність де компоненти (і), (іі) та (ііі) є здатними до гібзлитого білка фрагмент ліпопротеїну D - фрагмент ридизації з цільовою послідовністю MAGE-А3 при MAGE3 - гістидиновий хвіст (Фігура 9) жорстких умовах, та де принаймні одна цільова SEQ ID NO:36 - амінокислотна послідовність послідовність (і), (іі) або (ііі) відрізняється принайSEQ ID NO:35 (Фігура 9) мні одним нуклеотидом у порівнянні з еквівалент 9 95956 10 ною ділянкою усіх інших нуклеотидних послідовнопраймером або зондом, як описано в даній заявці. стей MAGE А, та де набір є здатним до викорисСпосіб може додатково включати етап визначентання для розрізнення MAGE-А3 та MAGE-A6. ня, чи гібридизується нуклеотидна послідовність з Додатково забезпечується набір, що включає: принаймні одним праймером або зондом при жор(і) прямий праймер; стких умовах, що, таким чином, дає можливість (іі) зворотний праймер; та визначити, чи є пухлинна тканина MAGE-A3 пози(ііі) зонд, тивною. В одному втіленні спосіб може додатково де компоненти (і), (іі) та (ііі) є здатними до гібвключати етап використання in situ гібридизації ридизації з цільовою послідовністю MAGE-А3 при для визначення, чи гібридизується нуклеотидна жорстких умовах, та де принаймні одна цільова послідовність з принаймні одним праймером або послідовність (і), (іі) або (ііі) відрізняється принайзондом. мні одним нуклеотидом у порівнянні з еквівалентСпособи, як описано в даній заявці, можуть ною ділянкою нуклестидної послідовності MAGEвикористовуватися для біологічного зразка, який A6, та де набір є здатним до використання для являє собою заморожену тканин; альтернативно розрізнення MAGE-А3 та MAGE-A6. або додатково, способи, описані в даній заявці, В одному втіленні набір згідно з даним винаможуть проводитися на біологічному зразку, який ходом може включати наступні компоненти: (і) являє собою тканину, що зберігається у парафіні, принаймні один праймер або набір праймерів, як наприклад, являє собою фіксовану у формаліні описано в даній заявці; та (ііі) принаймні один або заключену у парафін тканину (FFPE). зонд, як описано в даній заявці. В одному прикладі Даний винахід додатково забезпечує спосіб лікомпонент (і) включає SEQ ID NO:3 та 4; а компокування пацієнта, що включає визначення, чи екснент (іі) включає SEQ ID NO:13; альтернативно, пресує пухлинна тканина пацієнта MAGE-А3 при компонент (і) включає SEQ ID NO:5 та 6; а комповикористанні способа, як описано в даній заявці, нент (іі) включає SEQ ID NO:14; або компонент (і) та потім введення композиції, що включає імуновключає SEQ ID NO:7 та 8; а компонент (іі) вклютерапію або імунотерапевтичний засіб на основі чає SEQ ID NO:15; або компонент (і) включає SEQ MAGE-А3, як описано в даній заявці, пацієнтові. ID NO:9 та 10; а компонент (іі) включає SEQ ID У додатковому втіленні забезпечується спосіб NO:16; або компонент (і) включає SEQ ID NO:11 та лікування пацієнта, чутливого до рецидиву пухли12; а компонент (іі) включає SEQ ID NO:17; або ни, що експресує MAGE-А3, при цьому пацієнт компонент (і) включає SEQ ID NO:11 та 12; а компіддавався лікуванню для видалення / лікування понент (іі) включає SEQ ID NO:53 або SEQ ID пухлинної тканини, що експресує MAGE-А3, де NO:54. спосіб включає визначення, чи експресує пухлинна У додатковому втіленні даного винаходу затканина пацієнта MAGE-А3 при використанні спобезпечується спосіб визначення присутності або соба, як описано в даній заявці, а потім введення відсутності MAGE-А3 позитивної пухлинної тканикомпозиції, що включає імунотерапію або імунотени, що включає етап контактування ізольованої рапевтичний засіб на основі MAGE-А3, як описано нуклеотидної послідовності, одержаної з біологічв даній заявці, пацієнтові. ного зразка, або такої, що походить від біологічноУ додатковому втіленні даного винаходу заго зразка, принаймні з одним праймером, як опибезпечується застосування композиції, що вклюсано в даній заявці, набором праймерів, як чає імунотерапію або імунотерапевтичний засіб на описано в даній заявці, зондом, як описано в даній основі MAGE-A3, у виробництві лікарського засобу заявці або набором, як описано в даній заявці. для лікування пацієнта, що страждає від пухлини, Інший аспект даного винаходу являє собою яка експресує MAGE-А3, де пацієнт ідентифікуєтьспосіб визначення присутності або відсутності ся як такий, що має пухлинну тканину, яка експреMAGE-А3 позитивної пухлинної тканини, шляхом сує MAGE-А3, при використанні способу, як описааналізу біологічного зразка із праймером, зондом но в даній заявці. або набором праймерів, як описано в даній заявці. Ще в одному додатковому втіленні забезпечуУ додатковому аспекті забезпечується спосіб ється композиція, що включає імунотерапію або діагностики пацієнта, що включає етап контактуімунотерапевтичний засіб на основі MAGE-А3, у вання ізольованої нуклеотидної послідовності, виробництві лікарського засобу для лікування паодержаної з біологічного зразка, або такої, що поцієнта, чутливого до рецидивів пухлини, що ексходить від біологічного зразка, принаймні з одним пресує MAGE-А3, де пацієнт ідентифікується як праймером, як описано ε даній заявці, набором такий, що має пухлинну тканину, яка експресує праймерів, як описано в даній заявці, зондом, як MAGE-А3, при використанні способу, як описано в описано в даній заявці, або набором, як описано в даній заявці. даній заявці, та оцінку, чи експресується MAGE-А3 В одному втіленні забезпечується спосіб лікуу зразку. вання або застосування, як описано в даній заявці, Спосіб може додатково включати етап амплів якому композиція, що включає імунотерапію або фікації нуклеотидної послідовності та визначення у імунотерапевтичний засіб на основі MAGE-А3, зразку ампліфікованої нуклеотидної послідовності. включає MAGE-A3 антиген або його пепетид. В Ще в одному аспекті забезпечується спосіб одному втіленні MAGE-А3 антиген або його пептид визначення присутності або відсутності MAGE-А3 включає або складається з EVDPIGHLY. позитивної пухлинної тканини, що включає контакМAGE-A3 антиген або пептид для застосувантування ізольованої нуклеотидної послідовності, ня у даному винаході може бути злитим або кон'юодержаної з біологічного зразка, або такої, що погованим з білком носія. В одному втіленні білок ходить від біологічного зразка, принаймні з одним 11 95956 12 носія може бути вибраним з білка D, NS1 або є зворотним компліментом до послідовності прайCLytA або їх фрагментів. мера. В одному втіленні даного винаходу композиЄ прийнятним, коли кожний нуклеотид прайція, що включає імунотерапію або імунотерапевтимера або зонда може утворювати водневий зв'ячний засіб на основі MAGE-А3, може додатково зок з відповідним цільовим нуклеотидом. включати ад'ювант. Наприклад ад'ювант може Бажано, коли комплементарність праймера включати один або більше, або комбінацію настуабо зонда із цільовою послідовністю оцінюють пних:: 3D-MPL; солі алюмінію; олігонуклеотиди, що ступенем спарювання основ А:Т та C:G, так, що містять CpG, сапонінвмісні ад'юванти, такі, як аденіновий (А) нуклеотид парується з тиміновим QS21 або ІSCOM; емульсії типу масло-у-воді та (Τ), а гуаніновий (G) нуклеотид парується з цитоліпосоми. В одному втіленні ад'ювант може вклюзиновим (С), або навпаки. У формі РНК Τ може чати 3D-MPL, олігонуклеотиди, що містять CpG та замінюватися на U (урацил). QS21. Якщо, наприклад, інозин використовується в Як використовується в даній заявці, термін універсальних зондах, то комплементарність може «цільова послідовність» являє собою ділянку постакож оцінюватися ступенем взаємодій інозину лідовності нуклеїнової кислоти MAGE-А3 (або (зонд) та цільового нуклеотиду. ДНК, або РНК, наприклад, геномну ДНК, інформаЗгідно з цим даний винахід забезпечує прайційну РНК або їх ампліфіковані варіанти), з якою мер, що включає нуклеотидну послідовність, вибпослідовність зонда або праймера має часткову рану з SEQ ID NO:1-12, як показано у Таблицях 1 (тобто, до деякої міри не співпадає) або повну ідета 2. Термін «праймер» використовується в даній нтичність; незважаючи на те, що зворотний прайзаявці для розуміння будь-якої одноланцюгової мер є зворотним компліментом (або, як вказано олігонуклеотидної послідовності, здатної викорисвище, має деяке неспівпадання) послідовності, яку товуватися як праймер, наприклад, у методиці він впізнає. Цільова послідовність в загальному ПЛР. Таким чином, «праймер» згідно з винаходом випадку відноситься до ділянки MAGE-A3 послідовідноситься до одноланцюгової олігонуклеотидної вності, що відрізняється принаймні одним нуклеопослідовності, що є здатною діяти як точка ініціації тидом у порівнянні з іншою або усіма іншими синтезу подовження продукту праймера, що є сутMAGE-Α нуклеотидними послідовностями. Проте у тєво ідентичним (для прямого праймера) або сутдеяких втіленнях даного винаходу цільова послітєво ідентичним зворотному компліменту (для г довність може для одного або більше праймерів зворотного праймера) ланцю а нуклеїнової кислота зондів бути ідентичною для MAGE-Α нуклеотити, що копіюється. Модель (довжина та специфічдних послідовностей, за умови, що принаймні на послідовність) праймера буде залежати від один або два праймери та зонд, які використовуприроди ДНК та/або РНК мішеней та від умов, при ються, впізнають цільову послідовність, яка відрізяких використовується праймер (таких, як темпеняється між генами, які піддають диференціації. ратура, іонна сила). Таким чином, в одному втіленні специфічний Праймери можуть складатися з нуклеотидної праймер або зонд будуть зв'язуватися з цільовою послідовності, представленої у SEQ ID NO:1-12, MAGE-А3 послідовністю при відсутності неспівпаабо можуть мати 10, 15, 20, 25, 30, 35, 40, 45, 50, дання та зв'язуватися з еквівалентною ділянкою 75, 100 або більше пар основ, які містяться або не подальшої MAGE-Α послідовності, наприклад, помістяться у межах послідовностей SEQ ID NO:1слідовністю МAGE-6, з неспівпаданням однієї або 12, за умови, що вони є прийнятними для специбільше пар основ. фічного зв'язування цільової послідовності у меЦільова послідовність для праймерів або зонжах MAGE-А3 нуклеотидної послідовності при жода згідно з даним винаходом можуть являти собою рстких умовах. У разі необхідності можуть бути послідовність, що має найбільші відмінності (непроведені незначні мождифікації праймерів або співпадання) між двома генами, що дає можлизондів стосовно довжини або послідовності для вість визначати MAGE-А3 з дуже високою специпідтримання специфічності та чутливості, які є фічністю. необхідними при певних обставинах. Зонди та/або В одному втіленні даного винаходу цільові попраймери, приведені в даній заявці, можуть бути слідовності являють собою ділянки, ідентифіковані подовжені у довжину, або довжина може бути у виділеному тексті на Фігурі 15. зменшена, наприклад, на 1, 2, 3, 4 або 5 нуклеотиПрийнятним чином праймер або зонд можуть дів у будь-якому напрямку. бути принаймні на 95% ідентичними цільовій посЯк використовується в даній заявці, термін лідовності по всій довжині праймера або зонда, «жорсткі умови» означає будь-які умови гібридибажано більше, ніж на 95% ідентичними, напризації, які дозволяють праймерам специфічно зв'яклад, на 96%, 97%, 98%, 99%, та найбільш бажано зувати з нуклеотидною послідовністю у межах мають 100% ідентичність по своїй довжині з цільоMAGE-А3 нуклеотидної послідовності, але не з вою послідовністю MAGE-A3. Праймери або зонди будь-якою іншою MAGE нуклеотидною послідовнівинаходу можуть бути ідентичними з цільовою стю. «Специфічне зв'язування» або «специфічна послідовністю в усіх нуклеотидних положеннях гібридизація» зонда з ділянкою MAGE-А3 нуклеопраймера або зонда, або можуть мати 1, 2 або тидної послідовності означає, що праймер або більше неспівпадань, наприклад, в залежності від зонд утворює дуплекс (дволанцюгову нуклеотидну довжини зонда, температури, умов реакції та випослідовність) з частиною цієї ділянки або з цілою мог аналізу. Звичайно, за умови, що зворотний ділянкою при використовуваних експериментальпраймер задовольняє цим вимогам до ділянки, яка них умовах, та що при цих умовах праймер або зонд не утворює дуплекса з іншими ділянками ну 13 95956 14 32 клеотидної послідовності, що є присутньої у зразтимідину. -Фосфор може також використовуватику, який піддається аналізу При цьому є зрозуміся як радіомітка. лим, що праймери та зонди згідно з даним винаВ одному втіленні даного винаходу зонд може ходом, які є призначеними для специфічної включати флуоресцентний репортерний барвник гібридизації у межах ділянки MAGE-А3 нуклеотидна своєму 5'-кінці та барвник для гасіння на своєму ної послідовності, можуть не співпадати повністю 3'-кінці. Флуоренсцентний репортерний барвник із вказаною ділянкою або можуть до значного стуможе включати 6-карбоксифлуоресцеїн (6FAM), а пеня перекриватися із вказаною ділянкою (тобто барвник для гасіння може включати нефлуоресцеформувати дуплекс з нуклестидами як поза вказантний агент для гасіння (NFQ). Необов'язково, біною ділянкою, так і у межах вказаної ділянки). лок зв'язувальної маленької бороздки (MGB™; Є прийнятним, коли специфічна гібридизація Applied Biosystems CA, USA) може додаватися до зонда з цільовою ділянкою нуклеїнової кислоти зонда, наприклад, до 3'-кінця зонда. проходить при «жорстких умовах гібридизації», В одному втіленні може використовуватися таких, як 3 X SSC, 0,1% SDS, при 50°С. Спеціаліст MGB™ Eclipse зонд (Epoch Biosciences, WA, USA). в даній області знає, як варіювати параметри темMGB™ Eclipse зонди мають Eclipse™ темний агент ператури та концентрацію солі так, щоб можна для гасіння та MGB™ залишок, розміщений на 5'було досягти специфічної гібридизації. Умови гібкінці зонда. Флуоресцентний репортерний барвник ридизації та промивання є добре відомими та прирозміщується на 3'-кінці зонда. ведені, наприклад, у Sambrook, та ін., Molecular В одному втіленні праймер та зонд послідовCloning: A Laboratory Manual, Second Edition, Cold ності згідно з даним винаходом можуть містити Spring Harbor, N.Y., (1989) зокрема, глава 11 у цій або включати існуючі в природі нуклеотидні струкроботі. тури або основи, наприклад, аденін (А), цитозин Даний винахід додатково забезпечує набір (С), гуанін (G), тимін (Т) та урацил (U). праймерів, що включає один або більше з наступУ додатковому втіленні синтетичні або модиних пар праймерів: фіковані аналоги нуклеотидних структур або основ можуть включатися у послідовність зонда. Під синтетичними або модифікованими розуміють неіснуНабір 1:SEQ ID NO:3 тa 4 ючу в природі нуклеотидну структуру або основу. Набір 2:SEQ ID NO.5 та 6 Такі синтетичні або модифіковані основи можуть Набір 3:SEQ ID NO:7 та 8 замінювати 1, 2, 3, 4, 5, 6, 7, 8, 9 або усі основи у Набір 4:SEQ ID NO:9 та 10 послідовності зонда. В одному втіленні цитозин Набір 5:SEQ ID NO:11 та 12 може замінений на 5-метил dC, а тимін може бути замінений на 5-пропініл dU. BHQ2 агент для гасінДаний винахід додатково забезпечує зонд, що ня може також включатися у послідовність. включає нуклеотидну послідовність, яка являє Даний винахід додатково забезпечує набір, що собою будь-яку з SEQ ID NO:13-17, 53 або 54. Тевключає наступні компоненти: (і) принаймні один рмін «зонд» використовується в даній заявці для праймер або набір праймерів, як описано в даній позначення будь-якої одноланцюгової олігонуклезаявці; та (іі) принаймні один зонд, як описано в отидної послідовності, здатної до зв'язування з даній заявці. В одному втіленні набір включає нуклеїновою кислотою, та такої, що використовуодин прямий праймер, один зворотний праймер та ється як зонд, наприклад, у ПЛР методиці: Зонди послідовність зонда, яка має цільову послідовність можуть складатися з нуклеотидної послідовності, у межах ділянки, ампліфікованої прямим та зворопредставленої у SEQ ID NO:13-17, 53 або 54, або тним праймерами. У цьому втіленні набір праймеможуть являти собою 5, 6, 7, 8, 9, 10, 11, 12, 13, рів є здатним до ампліфікації частини (амплікона) 14, 15, 16, 17, 18, 19 або 20, 25, 30, 35, 40, 45, 50, послідовності MAGE-А3, а зонд є здатним до гіб75, 100 або більше пар основ, які містяться або не ридизації при жорстких умовах з ампліконом. містяться у межах послідовності SEQ ID NO:13-17, Послідовності MAGE-А3 та MAGE-A6 є високо 53 або 54 за умови, що вони є прийнятними для гомологічними, маючи 98% співпадання своїх нукспецифічного зв'язування з цільовою послідовніслеотидних та 95% співпадання своїх білкових постю у межах MAGE-А3 нуклеотидної послідовності. лідовностей. Для того, щоб специфічно ідентифіВ одному втіленні винаходу, де зонд викорискувати MAGE-А3 послідовності, є необхідним товується у способі у комбінації з парою праймеідентифікувати праймери та зонди, здатні до дирів, ця пара праймерів буде дозволяти проводити ференціації між МАОЕ-А3 та MAGE-A6. ампліфікацію частини або усього MAGE-А3 полінуВ одному втіленні даний винахід забезпечує клеотидного фрагменту, з яким зонди є здатними набір праймерів та/або зондів, які специфічно гібзв'язуватися або з яким зонди імобілізуються на ридизуються із цільовою послідовністю MAGE-А3 твердій підложці. при жорстких умовах, де принаймні одна цільова Праймер та/або зонд може додатково включапослідовність праймера або зонда відрізняється ти маркер, що дозволяє визначати зонд. Приклади принаймні одним нуклеотидом у порівнянні з еквімаркерів, що можуть використовуватися, включавалентною ділянкою усіх інших MAGE A нуклеотиють: флуоресцентні маркери, наприклад, 6дних послідовностей, та де набори є здатними до карбоксифлуоресцеїн (6FAM™), NED™ (Applera розрізнення між MAGE-А3 та MAGE-A6. Corporation), HEX™ або VIC™ (Applied В одному втіленні даний винахід забезпечує Biosystems); TAMRA™ маркери (Applied набір праймерів та/або зонді, які специфічно гібBiosystems, CA, USA); хемілюмінісцентні маркери, ридизуються із цільовою послідовністю MAGE-А3 наприклад, зонди на основі рутенію; та радіоактипри жорстких умовах, де принаймні одна цільова вні мітки, наприклад, тритій у формі тритійованого 15 95956 16 послідовність праймера або зонда відрізняється праймерів послідовностей SEQ ID NO:5 та 6 або принаймні одним нуклеотидом у порівнянні з еквітаких, що включають послідовності SEQ ID NO:5 валентною ділянкою MAGE A6 нуклеотидної поста 6, та зонд послідовності SEQ ID NO:14 або талідовності ,та де набори є здатними до розрізненкий, що включає послідовність SEQ ID NO:14; пару ня між MAGE-А3 та MAGE-A6. праймерів послідовностей SEQ ID NO:7 та 8 або В одному втіленні цільова послідовність притаких, що включають послідовності SEQ ID NO:7 наймні одного праймера або зонда може відрізнята 8, та зонд послідовності SEQ ID NO:15 або татися одним нуклеотидом у цільовій послідовності кий, що включає послідовність SEQ ID NO:15; пару MAGE-А3 у порівнянні з еквівалентною ділянкою праймерів послідовностей SEQ ID NO:9 та 10 або MAGE-A6. У додатковому втіленні цільова послітаких, що включають послідовності SEQ ID NO:9 довність принаймні одного праймера або зонда та 10, та зонд послідовності SEQ ID NO:16 або може відрізнятися двома нуклеотидами у порівтакий, що включає послідовність SEQ ID NO:16; нянні з еквівалентною ділянкою MAGE-A6. та/або пару праймерів послідовностей SEQ ID В одному втіленні набір, що включає два NO:11 та 12 або таких, що включають послідовнопраймери та один зонд, може мати наступні відсті SEQ ID NO:11 та 12, та зонд послідовності SEQ мінності у цільових послідовностях праймерів та ID NO:17 або такий, що включає послідовність зонда: SEQ ID NO:17. (і) цільова послідовність одного з двох прайУ додатковому втіленні даного винаходу замерів або зондів відрізняється одним нуклеотидом безпечується спосіб визначення присутності або між MAGE-А3 та MAGE-A6; відсутності MAGE-А3 позитивної пухлинної ткани(іі) цільова послідовність праймерів або зонда, ни, що включає етап контактування нуклеотидної не згаданого у частині (і), відрізняється одним нукпослідовності, одержаної з біологічного зразка, леотид між MAGE-А3 та MAGE-A6; та або такої, що походить від біологічного зразка, (ііі) цільова послідовність праймера або зонда, принаймні з одним праймером або принаймні з що залишилися, є ідентичною з обома MAGE-А3 одним набором праймерів або зондом, як описано та MAGE-A6; в даній заявці. Під MAGE-A3 позитивною пухлинНаприклад, в одному втіленні набір, що вклюною тканиною розуміють будь-які пухлини або пучає праймер А, праймер В та зонд С, може вклюхлинні клітини, що експресують MAGE-А3 антиген, чати наступні відмінності у цільових послідовносякі були ізольовані від пацієнта. Спосіб, як описано тях: в даній заявці, може використовуватися для ви(і) цільова послідовність праймера А відрізнязначення, чи включає біологічний зразок або чи ється одним нуклеотид між MAGE-А3 та MAGE-A6; складається біологічний зразок з MAGE-А3 пози(іі) цільова послідовність праймера В відрізнятивної пухлинної тканини. ється двома нуклеотидами між MAGE-А3 та Під біологічним зразком розуміють зразок ткаMAGE-A6; нини або клітини, одержані від пухлини, яка була та видалена або ізольована від пацієнта. (ііі) цільова послідовність зонда С є ідентичДодатково забезпечується спосіб діагностики ною обом MAGE-А3 та MAGE-A6. пацієнта, що включає етап контактування нуклеоНаприклад, в одному втіленні набір, що вклютидної послідовності, одержаної з біологічного чає праймер А, праймер В та зонд С, може вклюзразка, або такої, що походить від біологічного чати наступні відмінності у цільових послідовносзразка, принаймні з одним праймером або притях: наймні з одним набором праймерів або зондом, як (і) цільова послідовність праймера А відрізняописано в даній заявці, та оцінку, чи експресується ється двома нуклеотидами між MAGE-А3 та MAGE-А3 у зразку. MAGE-A6; В одному втіленні нуклеотидна послідовність (іі) цільова послідовність праймера В є ідентиявляє собою біологічний зразок або є такою, що чної обом MAGE-А3 та MAGE-A6; та була ізольована із біологічного зразка. (ііі) цільова послідовність зонда С відрізняєтьТермін «одержаний з або такий, що походить ся одним нуклеотидом між MAGE-А3 та MAGE-A6; від», як використовується в даній заявці розуміНаприклад, в одному втіленні набір, що вклюється як такий, що використовується включно. чає праймер А, праймер В та зонд С, може вклюТобто він призначений для охоплення будь-якої чати наступні відмінності у цільових послідовноснуклеотидної послідовності, що була безпосередтях: ньо ізольована із зразка пухлини, або будь-якої (і) цільова послідовність праймера А є ідентинуклеотидної послідовності, що походить від зразчною обом MAGE-А3 та MAGE-A6; ка, наприклад, при використанні зворотної транск(іі) цільова послідовність праймера В відрізнярипції, для одержання мРНК або кДНК. ється одним нуклеотид між MAGE-А3 та MAGE-A6; Спосіб згідно з даним винаходом може додатта ково включати ампліфікацію нуклеотидної послі(ііі) цільова послідовність зонда С відрізняєтьдовності та визначення у зразку ампліфікованої ся двома нуклеотидами між MAGE-А3 та MAGEнуклеотидної послідовності. Альтернативно або A6; додатково, спосіб згідно з даним винаходом може В одному втіленні набір може включати: пару додатково включати контактування ізольованої праймерів послідовностей SEQ ID NO:3 та 4 або або ампліфікованої нуклеотидної послідовності з таких, що включають послідовності SEQ ID NO:3 одним або більше зондами, як описано в даній та 4, та зонд послідовності SEQ ID NO:13 або тазаявці. кий, що включає послідовність SEQ ID NO:13; пару 17 95956 18 В одному втіленні нуклеотидну послідовність і) пари праймерів, що включають SEQ ID ізолюють або очищають із зразка пухлини. При NO:11 та 12; та зонда, що включає SEQ ID NO:53; RT-ПЛР контамінація геномної ДНК може приводита/або ти до помилково позитивних результатів. В одному j) пари праймерів, що включають SEQ ID втіленні геномну ДНК видаляють або суттєво виNO:11 та 12; та зонда, що включає SEQ ID NO:54 даляють зі зразка, який піддається аналізу, або Способи, як описано в даній заявці, є прийнятвключають у способи згідно з даним винаходом. ними для застосування на свіжій тканині, замороСпособи згідно з даним винаходом є прийнятженій тканині, тканині, що зберігається у парафіні, ними для визначення MAGE-A3 позитивної пухта/або тканині, що зберігається в етанолі. Добре линної тканини. В одному втіленні даного винаховідомі процедури екстракції та очистки є доступду MAGE-А3 позитивна тканина може визначатися ними від для ізоляції РНК або ДНК зі зразка (напри використанні in situ гібридизації. Під in situ гібприклад, є описаними у Sambrook та ін., 1989). ридизацією розуміють реакцію гібридизації, яку РНК або ДНК може використовуватися безпосерепроводять при використанні праймера або зонда дньо після екстракції зі зразка або більш бажано згідно з даним винаходом на інтактних хромосопісля етапу ампліфікації полінуклеотиду (напримах, клітинах або тканинах, ізольованих від пацієклад, ПЛР). У специфічних випадках, як напринта, для безпосередньої візуалізації морфологічклад, для аналізів зворот ної гібридизації, може них сайтів специфічної ДНК або РНК бути необхідним зворотно транскрибувати РНК у послідовності. кДНК перед ампліфікацією. У двох останніх випадГібридизації полінуклеотидів може проводитиках полінуклеотид є таким, що «походить від зразся при використанні будь-якого прийнятного спока». собу гібридизації та системи виявлення. Приклади В одному втіленні, в якому зразок являє собою гібридизаційних систем включають традиційні доттканину, що зберігається у парафіні, можуть викоблот гібридизацію, Саузерн блоттінг-аналіз та серистовуватися наступні набори праймерів та зонндвіч-метод. Наприклад, прийнятний спосіб може дів: включати підхід зворотної гібридизації, де типоса) пара праймерів, що включає SEQ ID NO:7 пецифічні зонди імобілізують на твердій підложці у та 8, зонд, який включає SEQ ID NO:15; відомих різних місцях (точках, лініях або інших b) пара праймерів, що включає SEQ ID NO:9 фігурах), та ампліфіковані полінуклеїнові кислоти та 10, та зонд, який включає SEQ ID NO:16; піддають міченню для того, щоб визначити утвос) пара праймерів, що включає SEQ ID NO:11 рення гібридів. Специфічні для MAGE-A3 послідота 12 та зонд, який включає SEQ ID NO:17; вності нуклеїнової кислоти, наприклад, зонд або d) пара праймерів, що включає SEQ ID NO:11 праймер, як описано в даній заявці, можуть піддата 12; та зонд, який включає SEQ ID NO:53; та/або ватися міченню за допомогою злиття біотинуe) пара праймерів, що включає SEQ ID NO:11 стрептавідину з нерадіоактивною системою, що та 12; та зонд, який включає SEQ ID NO:54 розвиває забарвлення. Проте можуть також викоДаний винахід додатково забезпечує спосіб ліристовуватися системи зворотної гібридизації, кування пацієнта, який включає: визначення, чи наприклад, як проілюстровано у Gravitt та ін., експресує пухлинна тканина пацієнта MAGE-А3 (Journal of Clinical Microbiology, 1998, 36(10): 3020при використанні способу, як описано в даній зая3027), зміст цього джерела є введеним у дану заявці, та введення композиції, що включає MAGE-A3 вку як посилання. Стандартні умови гібридизації та антиген, епітоп або похідну антигену, або специфіпромивання є описаними у Kleter тa ін., Journal of чне для MAGE-А3 антитіло, або імуноглобулін, Clinical Microbiology, 1999, 37(8): 2508-2517, та вказаному пацієнтові. Пацієнт може мати пухлинну будуть піддаватися оптимізації при даних обстатканину, що експресує MAGE-А3 (активний набір винах для підтримання специфічності та чутливосзахворювання), або може бути чутливим до рециті, що є необхідними для довжини та послідовності дивів пухлини, що експресує MAGE-А3, де пацієнт зонда(ів) та праймера(ів). піддавався видаленню/лікуванню пухлинної тканиВ одному втіленні спосіб згідно з даним винани, що експресує MAGE-А3 (допоміжний набір). ходом може включати застосування: Даний винахід додатково забезпечує застосуа) пари праймерів, що включають SEQ ID NO:3 вання композиції, що включає MAGE-А3 антиген, та 4; та зонда, що включає SEQ ID NO:13; епітоп або похідну антигену, або специфічне для b) пари праймерів, що включають SEQ ID NO:3 MAGE-А3 антитіло, або імуноглобулін у виробницта 4; та зонда, що включає SEQ ID NO:17 тві лікарського засобу для лікування пацієнта, що с) пари праймерів, що включають SEQ ID NO:3 страждає від пухлини, яка експересує MAGE-А3, та 4; та зонда, що включає SEQ ID NO:53 або є чутливим до рецидивів пухлини, що експреd) пари праймерів, що включають SEQ ID NO:3 сує MAGE-А3, де пацієнт є ідентифікований як та 4; та зонда, що включає SEQ ID NO:54 такий, що має, або такий, що мав пухлинну тканиe) пари праймерів, що включають SEQ ID NO:5 ну, яка експресує MAGE-А3, при використанні діата 6, та зонда, що включає SEQ ID NO:14; гностичного способу, набору, праймера або зонда, f) пари праймерів, що включають SEQ ID NO:7 як описано в даній заявці. та 8, та зонда, що включає SEQ ID NO:15; Композиція, що включає MAGE-А3 антиген, g) пари праймерів, що включають SEQ ID NO:9 епітоп або похідну антигену, може включати та 10 , та зонда, що включає SEQ ID NO:16; MAGE-А3 антиген або його пептид. В одному втіh) пари праймерів, що включають SEQ ID ленні MAGE-А3 антиген або його пептид включає NO:11 та 12, та зонда, що включає SEQ ID NO:17; пептид або складається з пептиду EVDPIGHLY. MAGE-А3 антиген або пептид може бути злитим 19 95956 20 або кон'югованим з білком носія, який може бути зько один до одного: це відбувається у випадку вибраним з білка D, NS1 або CLytA або їх фрагмеінтактних зондів. нтів. Під час та після ампліфікації зонд розкладаВ одному втіленні композиція може додатково ється за допомогою Taq ДНК полімерази, при цьовключати ад'ювант; наприклад, ад'ювант, що му визначають флуоресценцію. включає один або більше, або наступних: 3D-MPL; Для кількісних вимірювань використовується солі алюмінію; олігонуклеотиди, що містять CpG; кількість циклів ПЛР, при яких досягається порогосапонінвмісні ад'юванти, такі, як QS21 або ISCOM; ве значення на рівні 10-кратного стандартного емульсії масло-у-воді та ліпосоми. відхилення від емісії базової лінії Ця кількість цикТаким чином, даний винахід забезпечує клінічлів, що називається порогом циклу (Ct), є обернене застосування способу скринінгу зразків тканини но пропорційною початковій кількості цільової від пацієнтів, що являють собою людей, на присукДНК та дозволяє вимірювати кількість кДНК. По тність або відсутність експресії MAGE-А3. Такі зрасуті, чим більше цільової РНК є присутньою у зразки можуть складатися, наприклад, з вмісту пункзку, тим нижче значення Ct, що одержуюсь. ційної біопсії, зразків хірургічної резекції або Вимірювання, одержані для значення Ct, порітканини лімфатичних вузлів. Наприклад, ці спосовнюють з такими для конститутивного гена. Це би включають одержання зразка біопсії, який невраховує будь-які помилки на основі кількості заобов'язково піддають фракціонуванню шляхом гальної РНК, що додається до кожної реакції звокриптстатичного виготовлення зрізів для збагаченротної транскрипції (на основі поглинання певної ня пухлинних клітин до 80% загальної популяції довжини хвилі), та її якості (тобто, наявності деклітин. У деяких втіленнях нуклеїнові кислоти моградації): жоден з цих параметрів не є надійним жна екстрагувати з цих зразків при використанні для вимірювання кількості вихідного матеріалу. методик, що є добре відомими в галузі техніки. В Таким чином, транскрипти конститутивного гена інших втіленнях нуклеїнові кислоти, екстраговані зі піддаються кількісному аналізу як ендогенний конзразка тканини, можуть бути ампліфіковані при троль. Бета-актин є одним з найбільш використовикористанні методик, добре відомих в області вуваних неспецифічних конститутивних генів, нетехніки. Рівень MAGE-А3 експресії може бути визважаючи на те, що інші також можуть значений та може порівнюватися із статистично використовуватися. прийнятними групами та/або контролями пацієнтів, Ще в одному додатковому втіленні винаходу негативних стосовно MAGE-A3. забезпечується спосіб лікування пацієнта, що В одному втіленні діагностичний спосіб вклюстраждає від пухлини, яка експересує MAGE-А3, чає визначення, чи експресує суб'єкт MAGE-А3 при цьому спосіб включає визначення при застогенний продукт, наприклад, шляхом визначення суванні способу даного винаходу, чи експресує відповідного рівня мРНК та/або рівня білка продукпацієнт MAGE-A3 білок, та подальше введення ту гена. Наприклад, при використанні таких метокомпозиції, що включає MAGE-А3 антиген, антидик, як Нозерн блотінг-аналіз, полімеразна ланцюген, епітоп або похідну антигену, або специфічне гова реакція зі зворотною транскриптазою (RTдля MAGE-А3 антитіло, або імуноглобулін, для ПЛР), напівкількісна RT-ПЛР, кількісна RT-ПЛР, запобігання або полегшення рецидивів захворюTaqMan ПЛР, in situ гібридизація, імунопреципітавання. Пацієнт може спочатку одержувати лікуція, Вестерн блоттінг-аналіз або імуногістохімія. вання таке, як резекція хірургічним шляхом будьЗгідно з цим способом клітини або тканина можуть якої пухлини, або інше лікування за допомогою бути одерждані від суб'єкта, після чого рівень хіміотерапії або променевої терапії. мРНК та/або білка порівнюють з такими для тканиТаким чином, винахід додатково забезпечує ни, що не експресує MAGE-A3. застосування MAGE-специфічної імунотерапії у ТаgМan ПЛР методика виробництві лікарського засобу для лікування паTaq ДНК полімераза володіє 5'-3' екзонуклеазцієнтів, що страждають від пухлини, яка експресує ною активністю. Taqman ПЛР аналіз використовує MAGE-А3, або пацієнтів, які вже одержували лікуцю екзонуклеазну активність для розщеплення вання (хірургічне лікування, хіміотерапію, радіотеподвійно мічених зондів сполучених з комплеменрапію) для видалення або лікування пухлини, що тарними цільовими послідовностями під час ПЛР експресує MAGE-А3, при цьому вказаний пацієнт ампліфікації. був визначений як такий, що має пухлинну тканиКоротко, РНК екстрагують зі зразка та синтену, що експресує MAGE-А3, при використанні діагзують кДНК (зворотна транскрипція). кДНК потім ностичного способу, набору, праймера або зонда додають до ПЛР реакційної суміші, що містить згідно з даним способом. стандартні ПЛР компоненти (див, наприклад, комТаким чином, цей винахід може використовупоненти, що постачаються Roche (CA, USA) для ватися для пацієнтів, що мають форми раку, при Taqman ПЛР. Реакційна суміш додатково містить яких експресується MAGE-А3, такі, як: меланома; зонд, що сполучається з матрицею нуклеотидьої рак молочної залози; рак жовчного або сечового послідовністі між двома праймерами (тобто у меміхура, включаючи карциному перехідних клітин; жах послідовності, ампліфікованої шляхом ПЛР, рак легень, включаючи недрібноклітинну карцино«амплікона»). Зонд включає флуоресцентний рему легень (NSCLC); рак голови та шиї, включаючи портерний барвник на 5'-кінці та барвник для гакарциному стравоходу; карциному лускатих клітин; сіння на 3'-кінці. Барвник для гасіння є здатним рак печінки; множинну мієлому та карциному кигасити репортерну флуоресценцію, але тільки в шечнику. В одному втіленні винахід може використому випадку, коли два барвники знаходяться блитовуватися у лікуванні пацієнтів у допоміжному (післяоперативному) режимі при таких формах 21 95956 22 раку, зокрема, при раку легень та меланомі. Винапохідна білка D може включати перші Nхід також знаходить застосування у лікуванні метермінальні 100-110 амінокислот або приблизно тастатичних форм раку. перші N-термінальні 100-110 амінокислот. В одноІмунотерапія му втіленні білок D або його похідна можуть бути Композиції згідно з даним винаходом, прийняліпідовані, та може використовуватися ліпопротеїн тні для застосування у способах для лікування D: ліпідний хвіст може забезпечувати оптимальну пацієнтів, є такими, що є здатними підвищувати презентацію антигену для клітин, що презентують специфічну для MAGE-А3 імунну відповідь. Компоантиген. зиція буде містити принаймні один епітоп з продуВ одному втіленні MAGE-А3 може являти сокту MAGE-А3 гена. Такий епітоп може бути присубою білок D-MAGE-A3/His, білок злиття, який містнім як пептидний антиген, що є необов'язково тить 432 амінокислотні залишки. Цей злитий білок ковалентно зв'язаним з носієм. Альтернативно, включає амінокислоти 1-109 білка D, ліпопротеїну, можуть використовуватися більші білкові фрагмещо присутнім на поверхні грам-негативної бактерії нти. Проте фрагменти та пептиди для застосуванHaemophilus Influenzae В, 312 амінокислот з ня, коли є прийнятним чином презентовані, повинMAGE-А3 білка (амінокислоти 3-314), спейсер та ні бути здатними підвищувати імунну відповідь полігістидиновий хвіст (His), що може поліпшувати проти MAGE-А3, наприклад, специфічну для очистку злитого білка під час продукційного процеMAGE-А3 імунну відповідь. су, наприклад: Приклади пептидів, що можуть використовуваі) сигнальну послідовність, що складається з тися у даному винаході, включають наступні 18 залишків, та перші 109 залишків процесованого MAGE-А3 пептиди: білка D, сигнальна послідовність відщеплюється від злитого білка під час продукції, залишаючи 109 залишків; SEQ ID NO Пептидна послідовність іі) два неспоріднені залишки (метіонін та аспаSEQ ID NO:23 FLWGPRALV рагінова кислота); SEQ ID NO:24 MEVDPIGHLY ііі) залишки 3-314 нативного MAGE-3 білка; SEQ ID NO:25 VHFLLLKYRA iv) два гліцинові залишки, що функціонують як SEQ ID NO:26 LVHFLLLKYR шарнірна ділянка; SEQ ID NO:27 LKYRAREPVT ν) сім гістидинових залишків. SEQ ID NO:28 ACYEFLWGPRALVETS В альтеративному втіленні описана вище SEQ ID NO:29 TQHFVQENYLEY конструкція за винятком (і) може замінюватися на послідовність, що включає перші N-термінальні В одному втіленні антиген може включати 100-110 амінокислот або приблизно перші NMAGE пептид або білок, зв'язаний з імунологічним термінальні 100-110 амінокислот білка D. злитим білком-партнером, який сприяє експресії. MAGE-3 може експресуватися як білок, злитий MAGE білок може бути таким повної довжини на N-термінальному кінці з білком D, та злитий на MAGE-А3 або може включати фрагмент MAGE3, С-термінальному кінці з послідовністю семи гістинаприклад, амінокислоти 3-314 MAGE3 (загалом динових залишків (гістидиновий хвіст). Білок D 312 амінокислот). являє собою D-зв'язуючий імуноглобулин білок Антиген та партнер можуть бути хімічно кон'ювагою 42 кДа, що розміщується на поверхні грамговані або можуть експресуватися як рекомбінантнегативної бактерії Haemophilus Influenzae В. ний злитий білок. У втіленні, в якому антиген та В іншому втіленні імунологічний партнер злитпартнер експресуються як рекомбінантний злитий тя білка D може замінюватися білком, відомим як білок, це може дозволити підвищити рівні білка, LytA. LytA походить від Streptococcus pneumoniae, що продукується в експресійній системі, порівняно що синтезує N-ацетил-L-аланін амідазу, амідазу з незлитим білком. Так, партнер злиття меже доLytA, (кодується геном LytA (Gene, 43 (1986) стор. помагати у забезпеченні Т-хелперних епітопів 265-272)), аутолізин, що специфічно розкладає (імунологічний партнер злиття), бажано, Тдеякі зв'язки у пептидоглікановому скелеті. Схелперних епітопів, які впізнаються імунною систермінальний домен LytA білка відповідає за афінтемою людини, та/або допомагати з експресії білка ність до холіну або деяких аналогів холіну, таких, (енхансер експресії) з більш високим виходом, ніж як DEAE. Ця властивість була використана для у випадку нативного рекомбінантного білка. В одрозробки експресуючих С-LytA плазмід Е. соlі, коному втіленні партнер злиття може являти собою рисних для експресії злитих білків. Очистка гібридяк імунологічний партнер злиття, так і партнер, що них білків, що містять C-LytA фрагмент на своєму підвищує експресію. амінотермінальному кінці, була описана В одному втіленні винаходу імунологічний (Biotechnology: 10, (1992) стор. 795-798). В одному партнер злиття, що може використовуватися, є втіленні може використовуватися С-термінальна таким, що походить від білка D, поверхневого білчастина молекули. Втілення може використовувака грам-негативної бактерії Haemophilus influenza ти повторювану частину молекули LytA, що виявВ (WO91/18926) або його похідною. Похідна білка лена на С-термінальному кінці, починаючи від заD може включати першу 1/3 білка або приблизно лишка 178. В одному втіленні LytA частина може першу 1/3 білка. В одному втіленні перші 109 завключати залишки 188-305. лишків білка D можуть використовуватися як партВ одному втіленні даного винаходу MAGE-А3 нер злиття для забезпечення MAGE-А3 антигену з білок може включати дериватизований вільний додатковими Т-клітинними епітопами та підвищутіол. Такі антигени були описані в WO 99/40188. вати рівень експресії в Е. соlі (діючи, таким чином, як енхансер експресії). В альтеративному втіленні 23 95956 24 Зокрема, можуть використовуватися карбоксиамісування композиція та виробництво таких рекомбідовані або карбоксиметиловані похідні. нантних аденовірусних векторів детально предВ одному втіленні даного винаходу асоційоваставлено у WO 03/046142. ний з пухлиною антиген включає молекулу MAGEТрадиційні рекомбінантні методики для одерА3-білка D. Нуклеотидна та амінокислотна посліжання послідовності нуклеїнової кислоти та одердовності для цієї молекули є представленими на жання експресійних векторів є описаними у Фігурі 9 (SEQ ID NO:35 та SEQ ID NO:36). Цей анManiatis та ін., Molecular Cloning - A Laboratory тиген та ті, що підсумовані нижче, є описаними Manual; Cold Spring Harbor, 1982-1989. більш детально у WO 99/40188. Для імуногерапевтичних агентів на основі білУ додаткових втіленнях даного винаходу асоків білки згідно з даним винаходом забезпечуютьційований з пухлиною антиген може включати ся або розчинними у рідкій формі, або у ліофілізобудь-які з наступних злитих білків: ваній формі. Злитий білок NS1-MAGE3 та гістидиновий Кожна доза для людини може включати 1 хвіст, наприклад, як показано на Фігурах 10 та 11 1000 мкг білка. В одному втіленні доза може вклю(SEQ ID NO:37 та SEQ ID NO:38); злитий білок чати 30 - 300 мкг білка. CLYTA-MAGE3-гістидин, наприклад, як показано Імунотерапевтичний агент, як описано в даній на Фігурах 12 та 13 (SEQ ID NO:39 та SEQ ID заявці, може додатково включати вакцинний ад'юNO:40). вант та/або імуноностимуляторний цитокін або Додаткове втілення згідно з даним винаходом хемокін. включає застосування імунотерапевтичного агенту Прийнятні вакцинні ад'юванти для застосуванна основі нуклеїнової кислоти, що включає моленя у даному винаході, є комерційно доступними, кули нуклеїнової кислоти, які кодують специфічний такими, як наприклад, неповний та повний ад'юMAGE-А3 антиген, асоційований з пухлиною, як вант Фрейнда (Difco Laboratories, Detroit, МІ); ад'юописано в даній заявці. В одному втіленні даного вант 65 Merck (Merck та Company, Inc., Rahway, винаходу послідовності можуть бути вбудовані у NJ); AS-2 (SmithKline Beecham, Philadelphia, PA); прийнятний експресійний вектор та використовусолі алюмінію, такі, як гель гідроксиду алюмінію ються для ДНК/РНК вакцинації. Мікробні вектори, (алюм) або фосфат алюмінію; солі кальцію, заліза що експресують нуклеїнові кислоти, можуть також або цинку; нерозчинна суспензія ацилованого тивикористовуватися як імунотерапевтичні агенти, розину; ациловані цукри; катіонно та аніонно дещо доставляють за допомогою вектора. риватизовані полісахариди; поліфосфазени; мікПриклади прийнятних вірусних векторів вклюросфери, здатні до біорозкладання; чають ретровірусні, лентівірусні, аденовірусні векмонофосфорил ліпід А та QUIL А. Цитокіни, такі, тори, асоційовані з аденовірусом вектори, вектори як GM-CSF або інтерлейкін-2, -7, або -12, та хемона основі вірусу герпесу, включаючи такі на основі кіни можуть також використовуватися як ад'юванвірусу простого герпесу, вектори на основі альфати. вірусу, вірусу віспи, такі, як, Саnаrурох, та системи У композиціях винаходу може бути бажаним, на основі вірусу вакцини. Методики генного перещоб ад'ювантна композиція індукувала імунну відносу при використанні цих вірусів є відомим спеціповідь переважно Тh1-типу. Високі рівні цитокінів алістові в даній області техніки. Ретровірусні векТh1-типу (наприклад, IFN-γ, TNFα, IL-2 та IL-12) тори, наприклад, можуть використовуватися для мають тенденцію до сприяння індукції опосередстабільної інтеграції полінуклеотиду винаходу у кованих клітинами імунних відповідей на введений хазяйський геном, проте така рекомбінація не є антиген. Згідно з одним втіленням, в якому відпобажаною. Дефектні за реплікацією аденовірусні відь переважно є такою Тh1-типу, рівень цитокінів вектори, на противагу до цього, залишаються епіТh1-типу буде підвищуватися більш в значній мірі, сомальними, та таким чином, дозволяють здійсніж рівень цитокінів Тh2-типу. Рівень цих цитокінів нювати транзієнтну експресію. Вектори, здатні може бути легко оцінений при використанні станнаправляти експресію в клітинах комах (напридартних аналізів. Для огляду родин цитокінів див. клад, бакуловірусні вектори), у клітинах людини, Mosmann та Coffman, Ann. Rev. Immunol. 7:145дріжджів або у бактеріях можуть використовувати173, 1989. ся для одержання значних кількостей MAGE-А3 Згідно з цим прийнятні ад'юванти, що можуть білка, який кодується полінуклеотидами даного використовуватися для індукції відповіді переважвинаходу, наприклад, для застосування у вигляді но Тh1-типу, включають, наприклад, комбінацію субодиничних вакцин або в імуноаналізах. монофосфосерил ліпіду А, такого, як 3-де-ОУ бажаних втіленнях аденовірус, що викорисацилований монофосфосерил ліпід A (3D-MPL) товується як живий вектор, є дефектним мавпячим разом із сіллю алюмінію. 3D-MPL або інші ліганди аденовірусом. Типово, такі вектори містять ЕІ детолоподібного рецептора 4 (TLR4), такі, як аміноалецію та можуть вирощуватися на лініях клітин, що лкіл глюкозамінід фосфати, як розкрито у WO є трансформованими ЕІ геном. Бажані мавпячі 9850399, WO 0134617 та WO 03065806, можуть аденовіруси являють собою віруси, ізольовані від також використовуватися окремо для генерації шимпанзе. Зокрема, С68 (що також є відомим як відповіді Тh1-типу. Pan 9) (див. патент США № 6083 716) та Pan 5, 6 Інші відомі ад'юванти, які можуть переважно та Pan 7 (WO 03/046124) є бажаними для застосуіндукувати імунну відповідь Тh1-типу, включають вання у даному винаході. Таким чином, ці вектори TLR9 антагоністи, такі, як неметиловані олігонукможуть використовуватися для вбудовування гелеотиди, що містять CpG Олігонуклеотиди характерологічного гену даного винаходу, завдяки чому теризуються тим, що CpG динуклеотид є неметигенний продукт може бути експресований. Засто 25 95956 лованим. Такі олігонуклеотиди є добре відомим та є описаними, наприклад, у WO 96/02555. SEQ ID NO:30 SEQ ID NO:31 SEQ ID NO:32 SEQ ID NO:33 SEQ ID NO:34 26 Прийнятні олігонуклеотиди включають: TCC ATG ACG TTC CTG ACG TT TCT CCC AGC GTG CGC CAT ACC GAT GAC GTC GCC GGT GAC GGC ACC ACG TCG TCG TTT TGT CGT TTT GTC GTT TCC ATG ACG TTC CTG ATG CT CpG-вмісні олігонуклеотиди можуть також використовуватися окремо або у комбінації з іншими ад'ювантами. Наприклад, поліпшена система включає комбінацію CpG-вмісного олігонуклеотиду та похідної сапоніну, зокрема, комбінацію CpG та QS21, як розкрито у WO 00/09159 та WO 00/62800. Композиція може додатково включати емульсію масло-у-воді та/або токоферол. Інший прийнятний ад'ювант являє собою сапонін, наприклад, QS21 (Aquila Biopharmaceuticals Inc., Framingham, MA), що може використовуватися окремо або у комбінації з іншими ад'ювантами. Наприклад, поліпшена система втягує комбінацію монофосфосерил ліпіду А та похідної сапоніну, як наприклад, комбінація QS21 та 3D-MPL, як описано у WO 94/00153, або менш реактогенну композицію, в якій QS21 гаситься холестерином, як описано у WO 96/33739. Інші прийнятні композиції включають емульсію масло-у-воді та токоферол. Особливо потужна ад'ювантна композиція, що включає QS21, 3D-MPL та токоферол в емульсії масло-у-воді, є описаною у WO 95/17210. В іншому втіленні ад'юванти можуть бути рецептовані у ліпосомній композиції. Використовувана кількість 3D-MPL в загальному випадку є невеликою, проте в залежності від імунотерапевтичної композиції може знаходитися в інтервалі в 1-1000 мкг на дозу, бажано 1-500 мкг на дозу, та більш бажано від 1 до 100 мкг на дозу. В одному втіленні ад'ювантна система включає три імуностимулятори: CpG олігонуклеотид, 3D-MPL та QS21, представлені або в ліпосомній композиції, в емульсії масло-у-воді, як описано у WO 95/17210. Кількість CpG або імуностимуляторних олігонуклеотидів в ад'ювантах або імунотерапевтичних агентах згідно з даним винаходом в загальному випадку є невеликою, проте в залежності від імунотерапевтичної композиції може знаходитися в інтервалі 1-1000 мкг на дозу, бажано 1-500 мкг на дозу, та більш бажано від 1 до 100 мкг на дозу. Кількість сапоніну для застосування в ад'ювантах згідно з даним винаходом може знаходитися в інтервалі -1000 мкг на дозу, бажано 1-500 мкг на дозу, та більш бажано 1-250 мкг на дозу та найбільш бажано від 1 до 100 мкг на дозу. В загальному випадку кожна доза для людини може включати 0,1-1000 мкг антигену, наприклад, 0,1-500 мкг, 0,1-100 мкг, або від 0,1 до 50 мкг. Оптимальна кількість для конкретного імунотерапевтичного засобу може бути встановлена за допомогою стандартних досліджень, що втягують спостереження за оптимальними імунними відповідями у вакцинованих суб'єктів. Після початкової вакцинації, суб'єкти можуть одержувати одну або декілька бустерних імунізацій, розділених адекватним чином. CpG 1826 CpG 1758 CpG 2006, CpG 7909 CpG 1668 інші прийнятні ад'юванти включають Montanide ISA 720 (Seppic, France), SAF (Chiron, California, United States), ISCOM (CSL), MF-59 (Chiron), Ribi Detox, RC-529 (GSK, Hamilton, MT) та інші аміноалкілглюкозамінід 4-фосфати (AGP). Згідно з цим забезпечується імуногенна композиція для застосування у способі згідно з даним винаходом, що включає антиген, як розкрито в даній заявці, та ад'ювант, де ад'ювант включає один або більше з 3D-MPL, QS21, CpG олігонуклеотиду, поліетиленового етеру або естеру, або комбінацію двох або більше цих ад'ювантів. Антиген в імуногенній композиції може бути представлений в носії на основі емульсії масло-у-воді або вода-у маслі, або у ліпосомній композиції. В одному втіленні ад'ювант може включати один або більше з 3D-MPL, QS21 та імуностимуляторного CpG олігонуклеотиду. В одному втіленні є присутніми усі три імуностимулятори. В іншому втіленні 3D-MPL та Qs21 в емульсії масло-у-воді при відсутності CpG олігонуклеотиду. Композиція для застосування у способі згідно з даним винаходом може включати фармацевтичну композицію, що містить асоційований з пухлиною антиген, як описано в даній заявці, або злитий білок, у фармацевтично прийнятному наповнювачі. У цьому описі та пунктах формули, що йдуть далі, якщо контекст не вимагає іншого, слово «включають» та його варіації, такі, як «включає» та «такий, що включає» будуть передбачати включення вказаного цілого або етапу, або групи вказаних цілих або етапів, але не виключення будьякого іншого цілого або етапу, або групи цілих або етапів. Винахід далі буде описаний з посиланням на наступні, необмежуючі приклади, в яких RT-ПЛР відноситься до полімеразної ланцюгової реакції зі зворотною транскриптазою: ПРИКЛАДИ Приклад 1 Напівкількісна ПЛР - Заморожені зразки тканини Праймери: SEQ ID NO:1 та SEQ ID NO:2 Екстракція РНК: спосіб очистки РНК при використанні рідкого азоту Невеликі шматочки тканини піддавали різкому заморожуванню у рідкому азоті, а потім поміщали у ступку для механічного подрібнення товкачем. 100 мг одержаного порошку додавали до 100 мкл TriPure реагенту для ізоляції, та РНК екстрагували згідно з інструкціями виробника (Qiagen, Venlo, Netherlands). Концентрацію РНК визначали із значення оптичної густини при 260 нм. Напівкількісна ΜAGE-A3 RT-ПЛР Напівкількісну RT-ПЛР проводили так, як описано De Plaen та ін. (Immunogenetics 40:360, 1994). 27 95956 28 Синтез кДНК з 2 мкг загальної РНК проводили в 20 16: на цій фігурі класи визначаються згідно зі смумкл суміші, що містить 1 × буфер для першого гою, що притаманна позитивному контролю, як ланцюга, 0.5 мМ кожного dNTP, 10 мМ дитіотреїпоказано у Таблиці 6, що наведена нижче. толу, 20 од. інгібітора рРНКази, 2 мкМ оліго (dT) 15 та 200 од. M-MLV зворотної транскриптази, протяТаблиця 6 гом 1 години 30 хвилин при 42°С. 50 нг кДНК ампліфікували за допомогою ПЛР в 25 мкл суміші, що РНК позитивний контроль містить праймери, специфічні для MAGE-А3 (SEQ 100 50 10 2 1 0,5 ID NO 1 та 2). 10 мкл аліквоти кожної реакційної Клас +++ ++ + +/суміші розганяли при використанні електрофорезу на агарозному 1% гелі та візуалізували за допомоПриклад 2: Кількісна RT-ПЛР Taqman у реальгою флуоресценції броміду етидію. Розміри ампліному часі - Заморожені зразки тканини конів складали 725 п.о. та 805 п.о., коли мРНК та Кількісна RT-ПЛР Taqman у реальному часі: геномну ДНК (гДНК) піддавали ампліфікації, відпоПриймери: SEQ ID NO:3 та SEQ ID NO:4; Зонд: відно. SEQ ID NO:13 (екзон) Позитивні контролі для напівкількісної MAGEПриймери: SEQ ID NO:5 та SEQ ID NO:6; Зонд: A3 RT-ПЛР: SEQ ID NO:14 (інтрон) У ці експерименти вводили три позитивні конНапівкількісна ПЛР (для порівняльного дослітролі: дження): (і) Клонований фрагмент MAGE-А3 геномної Приймери: SEQ ID NO:1 та SEQ ID NO:2 ДНК додавали до кожної ПЛР реакційної суміші. Матеріали та способи Це забезпечувало фрагмент розміром 805 п.о. (на Пацієнти та збір зразків 80 п.о. більше, ніж фрагмент, одержаний з кДНК), Біопсії, одержані із пухлин стадії IB та II недріякий завжди представлений при відсутності ПЛР бноклітинної карциноми легень (NSCLC), одержуінгібування. Він діяв як позитивний контроль для вали хірургічно. Пацієнтів заносили до списку на перевірки ефективності ПЛР в MAGE-А3 негативдва клінічні дослідження, GSK 249553/004 них зразках; (MAGE3-AS02B-004) та Epidemio-MAGE3-153; па(іі) Для кожного MAGE-А3 аналізу синтез кДНК цієнти підписували згоду та їм пояснювали приропроводили паралельно на пухлинних зразках та на ду та можливі наслідки досліджень. Зразки біопсії РНК, екстрагованій з клітинної лінії «Gerl» мелапоміщали у розчин для стабілізації РНК (РНК-later, номи MZ-2-3.0. Для того, щоб вважатися позитивAmbion, Cambridge, UK) безпосередньо після хіруним зразки повинні давати сигнал при 1% кДНК ргічної резекції та зберігали при -20°С. рівня Gerl клітинної лінії MZ-2-3.0. РНК-later являє собою реагент для зберігання (ііі) ПЛР бета-актину (Таблиця 1) проводили на РНК, що стабілізує та захищає клітинну РНК в інкожному зразку для того, щоб визначити зразки із тактних, незаморожених зразках тканини. РНКсильно деградованою РНК. Якщо сигнал бетаlater виключає необхідність негайного заморожуактину, що генерувався від MAGE-А3 негативного вання зразків у рідкому азоті. пухлинного зразка, був слабше за сигнал, генероЕкстракція РНК: Спосіб очистки РНК при викований від MZ-2-3.0, то кількість циклів доводили до ристанні змішувача та подрібнювача клінічного зразка так, щоб інтенсивність бетаПухлинну тканину видаляли з РНК-later та доактинового амплікона досягала необхідного рівня. давали до реагенту для ізоляції TriPure (Roche, Негативні контролі для напівкількісної MAGEVilvoorde, Belgium). Тканину потім переносили до A3 RT-ПЛР: подрібнювача з мішалкою, що містить вольфрамоУ ці експерименти вводили три негативні контві кульки. Після подрібнення у подрібнювачі з міролі: шалкою загальну клітинну РНК екстрагували мак(і) РНК, екстрагована з культури клітин LB 23симально з 100 мг тканини при використанні 1/2, що є відомою як негативна на MAGE-A3; реагенту TriPure згідно з інструкціями виробника (іі) водний контроль у RT-реакції та (Qiagen, Venlo, Netherlands). Концентрацію РНК (ііі) водний контроль у ПЛР етапах. визначали із значення оптичної густини при 260 Інтерпретація даних нм. Зразок 50 нг мРНК з пухлинного зразка вважаRT-ПЛР аналіз MAGE-А3 TaqMan - заморожевся MAGE-А3 позитивним, коли кількість 725 п.о. на тканина. амплікона була рівною або більшою, ніж кількість кДНК, що відповідає 50 нг загальної РНК, ампамплікона, одержаного при використанні 0,5 нг ліфікували за допомогою ПЛР у 25 мкл суміші, що РНК із РНК, одержаної з Gerl клітинної лінії MZ-2містить TaqMan буфер, 5 мМ МgСІ2, 0,4 мМ dUTP, 3.0 (тобто еквівалентна 0,1% Gerl РНК; див. пози0,2 мМ кожного нуклеотиду, 0,625 од. Ampli Taq тивні контролі). Кількості оцінювали за допомогою Gold ДНК полімерази, 0,05 од. UNG, 0,2 мкМ кожфлуоресценції з використанням броміду етидію. ного олігонуклеотидного праймера та 0,2 мкМ Додавали позитивні та негативні контролі. TaqMan зонда. Використовували специфічні олігоКласи для напівкількісної MAGE-A3 RT-ПЛР: нуклеотидні праймери та зонди (Таблиця 2; SEQ п'ять стандартних класів (De Plaen та ін., 1994) ID 3, 4 та 13 та SEQ ID 5, 6 та 14. Зонди мітили задавали для напівкількісного MAGE-A3 RT-ПЛР барвниками FAM™, NED™ та VIC™ (Applied аналізу. Такі являли собою суб'єктивні вимірюванBiosystems, CA, USA), вони містили залишок маня та були від найнижчого до найвищого ступеня ленької зв'язувальної бороздки (MGB™; також від експресії -, -/+, +, ++, +++. Приклад, як ці класи Applied Biosystems, CA, USA). Додаткові експериможуть бути визначені, представлений на Фігурі 29 95956 30 менти проводили при використанні барвника FAM Створювали таблицю 2 × 2 випадкових резамість NED для специфічних для MAGE зондів. зультатів, одержаних за допомогою напівкількісної Екзон MAGE-А3 та гени бета-актину піддавали RT-ПЛР (праймери послідовностей SEQ ID NO:1 ампліфікації за допомогою кількісної ПЛР при вита SEQ ID NO:2) та Taqman ПЛР у реальному часі користанні TaqMan хімії на системі 7700 або 7900 (праймери послідовностей: SEQ ID NO:3 та SEQ (РЕ Applied Biosystems, Warrington, UK). ПЛР ампID NO:4; зонд: SEQ ID NO:13), при використанні ліфікацію також проводили в інтроні MAGE-A3 геметодик, описаних в даній заявці (Таблиця 3). Нона для перевірки відсутності контамінації геноммінальна шкала змінних містила два значення: ною ДНК. Профіль ампліфікації являв собою 1 позитивне та негативне. Негативні значення вклюцикл 2 хвилини при 50°С, 1 цикл 12 хвилин при чали 0 та суперечливі дані; під суперечливими 95°С, 35 циклів 15 секунд при 95°С та 1 хвилина даними розуміють дані у межах від 0,8% до 1,2% при 60°С. Сигнал флуоресценції, генерований розGerl з напівкількісного RT-ПЛР, та усі результати кладанням TaqMan зонду, визначали у реальному нижчі 1% з TaqMan аналізу. Позитивні значення часі під час усіх етапів елонгації. піддавали класифікації на основі очевидного підПідтвердження RT-ПЛР аналізу TaqMan для рахунку гелевих смуг стосовно експресії бетавизначення специфічності для MAGE-A3 актину для напівкількісного RT-ПЛР способу та Приймери: SEQ ID NO:3 та SEQ ID NO:4; Зонд: включали усі результати 1% з TaqMan аналізу. SEQ ID NO:13 (екзон) - Taqman RT-ПЛР Відповідність між обома способами підраховували Приймери: SEQ ID NO:1 та SEQ ID NO:2 (напіяк кількість подвійних негативних зразків плюс вкількісна ПЛР - для порівняльних досліджень) кількість подвійних позитивних зразків, поділену на Плазміди та клітинні лінії загальну кількість зразків. McNemar аналіз викориВикористовувані плазміди містили кДНК повстовували для порівняння співвідношень невідпоної довжини генів MAGE-A1 (MAGE-1; Genbank відних пар (негативні-позитивні). Підраховували депозитний номер NM 0049881 MAGE-A2 (MAGEдовірчі інтервали (СІ). 2; Genbank депозитний номер L1 89201 MAGE-A3 Оптимізація кількісної TaqMan RT-ПЛР (MAGE-А3; Genbank депозитний номер NM TaqMan RT-ПЛР для MAGE-А3 при викорис005362), MAGE-А4 (MAGE-4; Genbank депозитний танні Sybr зеленого. номер 002362), MAGE-A6 (MAGE-6; Genbank деSybr зелений є компонентом, який зв'язується позитний номер NM 005363), MAGE-A8 (MAGE-8; з ампліконами неселективно при відсутності спеGenbank депозитний номер NM 005364), MAGE-A9 цифічного для послідовності зонда. RT-ПЛР у реа(MAGE-9; Genbank депозитний номер NM 005365), льному часі проводили на клонах генів родини MAGE-A10 (MAGE-10; Genbank депозитний номер MAGE-Α при використанні чотирьох різних розвеNM 021048), MAGE-A11 (MAGE-11; Genbank деподень MAGE-A клонів (20 пг, 2 пг, 0,2 пг та 0,02 пг) зитний номер NM 005366) та MAGE-A12 (MAGE(Фігура 1, де результати показані як 1/СТ на осі Y). 12; Genbank депозитний номер NM 005367). КліПозитивний результат одержували для MAGE-А3 тинні лінії MZ-2-3.0 (MAGE-А3 позитивна) та LB 23при 14 Ct, а значення 16 Ct одержували для 1/2 (MAGE-А3 негативна) були люб'язно надані MAGE-A6 (при 20 пг плазмід). MAGE А4, А8 та А9 професором Thierry Boon, Ludwig institute, показали рівень Ct 30, а інші MAGE гени показали Brussels, Belgium. дуже обмежену експресію при значення Ct 35 та Специфічність MAGE-А3 TaqMan способу анавище. 4 5 лізували при використанні 1 × 10 , 1 × 10 , та 1 × TaqMan RT-ПЛР для Μ AGE-A3 при викорис6 10 копій плазмід, що містять кДНК повної довжини танні зонду, специфічного для послідовності. генів MAGE-A1, 2, 3, 4, 6, 8, 9, 10, 11 та 12. При використанні тих самих MAGE-А3 прайПослідовність порівняння MAGE А генів мерів (SEQ ID 3 та 4), але при наявності зонда (MAGE 1, 2, 3, 4, 6, 8, 9, 10, 11 та 12) в області (SEQ ID NO:13), ефективність розрізнення MAGEсконструйованих MAGE-А3 ПЛР праймерів та зонА3 від А6 аналіз/вали при використанні різних роздів показана на Фігурі 14. Послідовності прямого ведень релевантних клонів родини членів MAGE-Α та зворотного MAGE-А3 праймерів є підкреслени(Фігура 2). Спочатку MAGE-А3 Ct виявляло очікуми; послідовність MAGE-А3 зонда узята у рамку. ване зниження у кожному розведенні. MAGE-A6 Зворотні праймери є комплементарними ділянці клон не показав високого значення 1/Ct, коли випослідовності, яку вони впізнають, тобто А - Т; G користовували зонд, що свідчило про відсутність С; Τ - А та С - G. перехресної реактивності. MAGE-А3 TaqMan RT-ПЛР Позитивні контролі: Додання 1 × 10 MAGE-A6 плазміди до розве(і) фрагмент MAGE-A3 геномної ДНК та (іі) відомі дення MAGE-А3 плазміди, як показано на Фігурі 3, кількості РНК, екстрагованої з Gerl клітинної лінії не мало ніякого впливу на результат титрування MZ-2-3.0 (клітинна лінія меланоми, позитивна MAGE-A3 плазміди. Це показує відсутність конкустсовно MAGE-A3). рентного ефекту MAGE-A6 у присутності MAGE-А3 MAGE-А3 TaqMan RT-ПЛР Негативні контролі: при використанні TaqMan ПЛР. (і) РНК, екстрагована з культури клітин LB 23-1/2, Результати відома як така, що є негативною стосовно MAGEПухлинна експресія Μ AGE-A3, порівняння наА3, (іі) водний контроль у реакції RT, та (ііі) водний півкількісного та кількісного способів контроль на етапах ПЛР. Проводили 40 циклів RTTaqMan-специфічна кількісна ПЛР була додатПЛР. Негативний контроль повинен бути 35. Декова підтверджена у порівнянні зі стандартною які з результатів TaqMan експериментів були напівкількісною RT-ПЛР для MAGE-А3 (при викопредставлені як 1/Ct. ристанні праймерів послідовностей SEQ ID NO:1 Статистика: Порівняння двох ПЛР методик та 2). Використовували 71 зразок пухлин від 31 95956 32 NSCLC пацієнтів для безпосереднього порівняння меланоми) та CRL 1675 (клітинна лінія меланоми). кількісного (при використанні праймерів послідовЗначення Ct були вищими, ніж ті, що очікували для ностей SEQ ID NO:3 та 4 та зонду послідовності замороженої тканини на основі праймерів напівкіSEQ ID NO:13) та напівкількісного способів визналькісної RT-ПЛР MAGE-А3. Значення Ct на рівні чення експресія MAGE-А3 (при використанні 36-37 вважалося верхньою границею чутливості праймерів послідовностей SEQ ID NO:1 та 2). для цілей даних експериментів. Gerl MAGE-А3 Результати показали добру відповідність позитивний контроль був на рівні 31 Ct та перебу95,8% (Таблиця 3) між двома способами з 68/71, вав у межах границі чутливості, але був набагато що знаходяться у відповідності. Кількісний TaqMan нижчим, ніж для напівкількісного RT-ПЛР аналізу. RT-ПЛР та напівкількісний RT-ПЛР аналізи не При використанні цих рівнів праймерів та зонду співпадали у трьох зразках, в яких напівкількісний для MAGE-А3 кількісного аналізу у замороженій RT-ПЛР аналіз завищував позитивність результатканині (Таблиця 2, специфічнні для екзона 3 тів. Проте McNemar виявив симетричний перерозMAGE-А3 праймери послідовностей SEQ ID NO:3 поділ цих трьох результатів (р=0,25), що свідчить та SEQ ID NO:4 та зонд SEQ ID NO:13) можуть не про те, що жодна методика не мала тенденції до бути достатньо чутливими для визначення експренадання більшої кількості суперечливих результасії MAGE-А3 у FFPE зразках пухлини: зразки, що є тів у порівнянні з іншими методиками. При більших позитивними на MAGE-А3, але експресують точному дослідженні було встановлено, що змінMAGE-А3 на низькому рівні, можуть не виявлятиний рівень експресії бета-актину у цих зразках ся. приводив до помилкового позитивного результату Зразки позитивних контролів з FFPE тканини для напівкількісного RT-ПЛР способу. включали у цей експеримент: ТС1 (Маgе3) та Gerl Коробчасту діаграму (Фігура 4) використову(MAGE-А3 позитивний контроль) та CRL 1675. Пували для представлення дисперсії TaqMan ПЛР хлини людини 990118-990784 піддавали аналізу за даних для кожного класу, визначеного для напівкідопомогою Taqman кількісної RT-ПЛР при викорилькісної RT-ПЛР. Незважаючи на те, що відповідстанні праймерів для замороженої тканини посліність двох способів на основі таблиці 2x2 випадкодовностей SEQ ID NO:3 та SEQ ID NO:4 та зонду вих результатів, була відмінною, коробчасті послідовності SEQ ID NO:13 при використанні РНК діаграми виявили деяке перекривання між різними із заключеної у парафін тканини. Результат цього класами, показуючи, що напівкількісна оцінка пованалізу представлений на Фігурі 5. ністю не співпадала з кількісним TaqMan RT-ПЛР Модернізація MAGE-А3 TaqMan праймерів для вимірюванням. Перекривання може виникати з застосування у FFPE тканині причини того факту, що оцінку проводили різні Розмір амплікона для РНКІ з пізніше заморооператори при різних обставинах, що може підвиженої тканини на основі MAGE-A3 аналізу (описащувати варіабельність. В деякій мірі кількісний ний у Прикладі 2), складав більше 100 п.о. Для TaqMan RT-ПЛР аналіз є набагато більш незалежтого, щоб одержати більш чутливі результати для ним від цих факторів та, таким чином, більш відтрозкладеної РНК, що виявляється у FFPE зразках, ворюваним. конструювали нові праймери для зменшення розПРИКЛАД 3: Аналіз тканини, фіксованої у паміру амплікона, для того, щоб підвищити чутлирафіні (FFPE), за допомогою RT-ПЛР вість MAGE-А3 аналізу (Таблиця 5). Для обох анаМАТЕРІАЛИ ТА МЕТОДИ лізів, описаних у Прикладах 2 та З MGB™ РНК екстрагували з FFPE зразків при викорис(зв'язувальна маленька бороздка) зонд використотанні запатентованого способу Response Genetics вували для підвищення специфічності аналізів. Inc., як розкрито у патентах США №№ 6,613,518; MGB зонд зв'язувався у маленькій зв'язувальній 6,610,488; . 6,428,963; 6,248,535, що введені в дабороздці ДНК, утворюючи дуже стабільний дупну заявку як посилання. Альтернативно, РНК може лекс, що приводило до підвищення специфічності бути одержана з тканини, яка заключена у парапраймера. фін, згідно з прийнятним опублікованим способом. Аналіз нових MAGE-А3 праймерів на специфіНаприклад, зрізи тканини можуть видалятися з чність та чутливість парафіну при використанні d-лімонену або іншого Набори нових сконструйованих праймерів літичного буферу та потім промиватися в розчині (Таблиця 5) піддавали аналізу на кДНК членів рона основі етанолу. Зрізи обробляють протеїназою дини Mage-Α (Фігура 6а), де Набір 1 являв собою K протягом ночі, а потім промивають. РНК може праймери: SEQ ID NO:7, SEQ ID NO:8, зонд: SEQ бути очищена при використанні колонкової хромаID NO:15; Набір 2 являв собою праймери: SEQ ID тографії. Taqman RT -ПЛР у реальному часі проNO:9, SEQ ID NC: 10, зонд: SEQ ID NO:16; Набір 3 водили на зразках при використанні послідовносявляв собою праймери: SEQ ID NO:11, SEQ ID тей праймерів SEQ ID NO:3 та SEQ ID NO:4 та NO:12, зонд: SEQ ID NO:17; та Набір 4 являв созонду послідовності SEQ ID NO:13; праймери та бою праймери: SEQ ID NO:3, SEQ ID NO:4, зонд: зонди удосконалювали для застосування у замоSEQ ID NO:13. роженій тканині (див. Приклад 2, вище). Як показано на Фігурі 6а, праймери послідовРЕЗУЛЬТАТИ: Експресія Маgе A3 ностей SEQ ID NO:7 та 8 мали високі рівні Ct для Таблиця 4 показує результати, виражені як MAGE-А3, але також й для Маgе-2 та Маgе-12. значення Ct, для фіксованої у формаліні, заключеПраймери послідовностей SEQ ID NO:9 та 10 мали ної у парафін (FFPE) тканини. Цифри на осі Υ високі рівні Ct для MAGE-А3 та низькі рівні Ct для представляють зразки пухлини людини 990118MAGE -А6, але це було за межами нормального 990784. Позитивні контролі також включали в анаінтервалу експресії MAGE-A3. Праймери послідовліз: ТС1 (Маgе3); Gerl (MAGE-А3 клітинна лінія ностей SEQ ID NO:11 та 12 були менш чутливими, 33 95956 34 ніж такі послідовностей SEQ ID NO:9 та 10. Таким встановлювався на рівні 1% Gerl (позитивний кончином, у даному експерименті праймери послідовтроль) та порівнювали безпосередньо, як виявиностей SEQ ID NO:9 та 10 були вибрані для подалося, існувало деяка невідповідність між двома льшого аналізу на FFPE тканині. Ці праймери посаналізами. Існувало кілька позитивних на MAGEлідовностей SEQ ID NO:9 та 10 піддавали А3 пацієнтів, що не відповідали MAGE-А3 аналізу подальшому аналізу у серійному розведенні РНК, замороженої тканини; це може пояснюватися маквони показали добрий лінійний результат до більш родисекцією пухлинних ділянок, що викликає піднизьких розведень, що дає змогу запропонувати, вищення чистоти пухлинних клітин, які експресущо праймери будуть мати добру чутливість та є ють MAGE-А3. Видалення більшості нормальних прийнятними для цього аналізу (Фігура 6b). клітин, що розводять зразок, спричинювало позиПорівняння аналізів на замороженій тканині з тивний MAGE-А3 результат. Було продемонстро2 результатами на FFPE для MAGE-A3 ване значення R (статистичний критерій для ліПорівнювали 42 зразка FFPE пухлин при виконійної кореляції) 092 між РНК із FFPE тканини та ристанні праймерів послідовностей SEQ ID NO:9, РНК із замороженої пізніше тканини, що дає змогу SEQ ID NO:10 та зонду SEQ ID NO:16 з тим самим передбачити добру кореляцію між двома способааналізом, проведеним на замороженій тканині при ми (Фігура 8) використанні праймерів послідовностей SEQ ID ПРИКЛАД 4 - COBAS™ Taqman MAGE-А3 NO:З, SEQ ID NO:4 та зонду послідовності SEQ ID аналіз NO:13 (Фігура 7). Рівень позитивності аналізу Таблиця 7 Послідовності COBAS™ TaqMan MAGE-А3 праймера та зонда 1M Послідовності праймера СOBAS TaqMan MAGE-A3 MAGEA3f-623F: (HW_MAGΕA3_F; SEQ ID NO:11) 5'-TGTCGTCGGAAATTGGCAGTAT3' MAGEA3f-697R: (НW_MAGEA3_R; SEQ ID NO:12) 5'-CAAAGACCAGCTGCAAGGAACT3' Послідовність COBAS™ ТаqMan MAGE-А3 зонда MAGEA3F-646MOD SEQ ID NO:53 5'-ELFLLLFFLQGLGALFLLFAGFAAAGFLLFP-3' E = FAM репортерний барвник, F = 5-метил dC, Q = BHQ2 гасник, L = 5-пропініл dU, P= фосфат, I = HEX репортер Послідовність MAGEA3F-646MOD зонда включає наступні модифіковані нуклеотиди (SEQ ID NO:54): 5' - TCTTTCCTGTGATCTTCAGCAAAGCTTC 3' Таблиця 8 Послідовності COBAS TaqMan бета-актинового праймера та зонда Послідовності бета-актинового TaqMan праймера RGI_ВАСТ_F2: (SEQ ID NO:55) 5'-GAGCGCGGCTACAGCTT-3' RGI_BACT_R2: (SEQ ID NO:56) 5'-TCCTTAATGTCACGCACGATTT-3' Послідовність TaqMan бета-актинового зонда HW_RGIВАСТ_Н: (SEQ ID NO:57) 5'-4ACCACCAQCGGCCGAGCGGP-3' E = FAM репортерний барвник, F = 5-метил dC, Q = BHQ2 гасник, L = 5-пропініл dU, P = фосфат, I = HEX репортер Таблиця 9 Підтверджений інтервал для СТ зразка та контролю Контролі FFPET зразок Mage гену 50 нг FAM FFPET зразок бета-актинового гену 50 нг HEX 100 % Gerl Mage ген 50 нг FAM 100 % Gerl бета-актиновий ген 50 нг HEX 1 % Gerl Mage ген 0,5 нг FAM 1 % Gerl бета-актиновий ген 0,5 нг HEX 100 % UHR Mage ген 50 нг FAM Підтверджений Ct інтервал 0,95 танні ДНКази. РНК екстрагували з двох FFPE Критерій прийнятності ефективності RT-ПЛР: Xenograft, що мають походження від двох клітинЕфективність MAGE-A3 RT-ПЛР ампліфікації > них ліній. Один Xenograft, що мав назву GERL, 80 % експресував MAGE-А3. Інший Xenograft , що мав Ефективність RT-ПЛР ампліфікації β-актину > назву STAC, не експресував MAGE-А3. РНК з цих 80 % двох Xenograft використовували для комбінаційних Різниця ефективності RT-ПЛР ампліфікації між експериментів для того, щоб проаналізувати 5% MAGE-А3 та β-актином у межах 10% GERL РНК на фоні 95% STAC РНК, 1% GERL РНК Результати лінійності / ефективності RT-ПЛР на фоні 99% STAC РНК та 0,5% GERL РНК на фоні Фігура 20 показує графік log (основа 2) введе99,5% STAC РНК. Ці три різні суміші GERL та ної РНК проти значень Ct для MAGE-А3 та βSTAC РНК піддавали аналізу при чотирьох різних актину. COBAS TaqMan MAGE-А3 Аналіз є лінійрівнях загальної РНК. ним між значеннями введення 100-0,1 нг GERL Процедура: Двадцять чотири результати анаРНК, екстрагованої з FFPE Xenograft, при викорислізу одержували з 4 незалежних серій розведень танні QIAGEN способу на основі R2 значень. сумішей РНК GERL та STAC. Піддавали аналізу R2 значення складали 0,983 для MAGE-А3 та чотири рівні введеної РНК (100, 50, 25 та 12,5 нг). 0,998 для β-актину. Ці значення були вищими виАналізували 6 повтори для кожного рівня. значення R2 > 0,95. Крім того, як Ct MAGE-А3, так і Аналіз: Визначення рівня РНК, при якому > Ct β-актину для усіх 10 повторів на кожному про95% позитивного значення MAGE-А3 одержують аналізованому рівні були нижчі за визначення CV на основі значення Ct у межах затвердженого ін< 5%, як показано у Таблиці 17. тервалу аналізу. Ефективність RT-ПЛР ампліфікації MAGE-А3 Критерій прийнятності: LOD 95% часу на основі останні два рівні введеної РНК не включалися в зниження Ct MAGE-А3 у межах затвердженого лінійний інтервал аналізу. Лінійний інтервал аналіінтервалу аналізу. Результати відповідали критезу при використанні GERL Xenograft РНК складав рію прийнятності для аналітичної чутливості (гра100 нг - 0,39 нг РНК. ниця визначення)). На основі цих даних задовольнявся критерій Експеримент для підтвердження границі виприйнятності для лінійності та ефективності RTзначення. Значення Ct для FAM контролю MAGE ПЛР. гена є представленими у Таблиці 27; Ct для HEX Таблиця 18 показує ефективність RT-ПЛР амконтролю β-актину є представленими у Таблиці пліфікації MAGE-А3 та β-актину; Таблиця 19 являє 28. Контрольні Ct знаходилися у межах затверсобою експеримент по валідації лінійності / RTдженого інтервалу. Експеримент пройшов валідаПЛР ефективності цію. 41 95956 42 Таблиця 29; Таблиця 30 та Таблиця 31 предА3 аналізу та RGI аналізу-прототипу. Дані аналізу ставляють деталі експерименту для підтвердженпредставляли так, як описано у розділі 3, де порог ня границі визначення експресії MAGE-A3 визначали на основі 1% GERL Спосіб кореляції РНК контролю. Мета: Для кореляції та перехресного підтверСпосіб кореляції/результати перехресної валідження COBAS™ TaqMan MAGE-А3 аналізу та дації аналізу-прототипу на зразках FFPET. Зразки РНК екстрагували з 131 NSCLC FFPE Матеріал зразків: Приблизно 120 клінічних клінічних зрізів. 7 зразків мали контамінацію генозразків FFPET адекватної якості піддавали аналізу мною ДНК, більшу за 25% на еонові RGI RT контпри використанні COBAS TaqMan MAGE-А3 аналірольної реакції. Ці зразки виключалися з позитивзу та при використанні аналізу-прототипу. них та негативних за допомогою підрахунків на Процедура: РНК екстрагували при викорисоснові порівняння проценту співпадання. Додаткотанні набору QIAGEN™ RNeasy FFPE з додатково, існувало 6 невизначених результатів з COBAS вим етапом із застосуванням ДНКази. Проводили аналізу та 15 з аналізу прототипу, де жоден із зраодну екстракцію для кожного FFPET зразка, роздізків не мав достатнього матеріалу на основі Ct βляли зразок та одну аліквоту аналізували за допоактину за межами лінійного інтервалу аналізу або могою COBAS TaqMan MAGE-А3 аналізу, а одну експресія MAGE-А3 для зразка була більше пороаліквоту аналізували при використанні аналізу гового значення, але Ct MAGE-А3 знаходилося прототипу. Ідентичні контролі розганяли для кожпоза межами лінійного інтервалу. В результаті ного з аналізів для встановлення порогу експресії цього існувало 117 результатів з COBAS аналізу MAGE-A3. та 108 результатів з аналізу-прототипу з даними, Аналіз: що могли використовуватися для перехресної ваMAGE-А3 сигнал для кожного зразка предсталідацІЇ для порівняння двох різних аналізів (Табвляли як позитивний або негативний на основі лиця 32). Загальна відповідність COBAS аналізу та порогу експресії MAGE-А3, генерованого GERL аналізу-прототипу складала 98/107 або 91,6% РНК контролями. Порівнювали результати двох (Таблиця 33). Позитивний результат при викорисаналізів для встановлення позитивного та негатитанні порівняння проценту відповідності COBAS вного за допомогою порівняння проценту відповіданалізу при застосуванні аналізу-прототипу як ності значень RMS аналізу. «золотого стандарту» складав 59/ 64 або 92,2 %, у Для підрахунку проценту відповідності одертой час як негативний результат при використанні жані раніше при використанні двохетапного аналіпорівняння проценту відповідності складав 39/43 зу RT-ПЛР результати для замороженої тканини або 90,7 % (Таблиця 33). У випадку суперечливих використовували для розділення суперечливих результатів між COBAS аналізом та аналізомрезультатів. прототипом, використовували результати, одерПозитивний за порівнянням проценту відповіжані із зразків замороженої тканини, для розріздності = кількість зразків, що правильно тестували нення суперечливості (Таблиця 34). MAGE-А3 експресію / кількість проаналізованих З 9 зразків із суперечливими результатами між зразків * 100. COBAS аналізом та аналізом-прототипом 7 проНегативний за порівнянням проценту відповіддемонстрували відповідність між COBAS аналізом ності = кількість зразків, що правильно тестували та аналізом заморожених зразків та 2 продемонсвідсутність MAGE-А3 експресії / кількість проаналітрували відповідність між аналізом-прототипом та зованих зразків * 100. аналізом заморожених зразків. В результаті, при Критерії прийнятності: використанні заморожених зразків позитивний реПозитивний за порівнянням проценту відповізультат розрізнення суперечливих даних на основі дності > 85% порівняння проценту відповідності COBAS аналізів Негативний за порівнянням проценту відповідпідвищувався до 63/64 або 98,4%, а негативний на ності > 85% основі порівняння проценту відповідності підвищуПерехресне підтвердження клінічних зрізів з вався до 42/43 або 97,7 % (Таблиця 34). NSCLC клінічного досліду проводили для оцінки Позитивний та негативний на основі порівнянпозитивних та негативних зразків шляхом порівня проценту відповідності COBAS TaqMan MAGEняння проценту відповідності за допомогою А3 аналізу перевищував умову бути більшим або COBAS TaqMan MAGE-А3 аналізу. MAGE-А3 прорівним 85%. Позитивні та негативні результати на тотип RT-ПЛР аналізу використовували як порівоснові порівняння проценту відповідності задовоняння для цих досліджень. У разі виявлення нельняли критерій прийнятності. відповідності між результатами, попередні Спосіб кореляції/перехресне підтвердження результати, одержані з того самого зразка, що й контрольної валідації свіжа заморожена тканина, яка не піддавалася Експеримент по вивченню контролю Ct MAGE ручному приготуванню мікрозрізів, може викорисгену представлений у Таблиці 30; Експеримент по товуватися для розрізнення невідповідного ревивченню контролю Ct гена β-актину представлезультату. ний у Таблиця 31. Контрольні Ct знаходяться у При використанні способу QIAGEN RNeasy межах підтвердженого інтервалу. Експеримент FFPE з етапом перетравлювання ДНКазою РНК пройшов валідацію. екстрагували з 131 FFPE зразка, які піддавали Деталі способу кореляції / перехресного підтручному приготування мікрозрізів. Кожний зразок вердження контрольної валідації представлені у потім розділяли порівну між RMS та RGІ для анаТаблицях 37, 38 та 39. лізу при використанні RMS COBAS TaqMan MAGE 43 95956 44 Відтворюваність рівно або такою, що перевищує порогове значенМета: Продемонструвати відтворюваність та ня, будуть мати позитивний сигнал MAGE-А3 та надійність аналізу на наборах даних, одержаних будуть одержувати лікування. Пацієнти з MAGE-A3 багатьма операторами протягом багатьох днів з експресією, що є нижчою порогового значення різними реагентами та множиною різних інструмебудуть мати негативний a MAGE-A3 сигнал та не нтів. будуть одержувати лікування. Дослідження відтМатеріал зразка: ворюваності аналізу базувалися на сигналі екс12 зразків з NSCLC FFPE клінічних зразків, які пресії MAGE-А3 для кожного зрізу при використанпіддавали ручному приготуванню мікрозрізів, підні наступних рівнянь: давали екстракції при використанні набору Поріг експресії MAGE-A3 = 2^ (Ct β-актину QIAGEN RNeasy FFPE з етапом перетравлювання 100% GERL контролю - Ct MAGE-А3 1% GERL за допомогою ДНКази І ампліфікували / аналізуваконтролю) ли при використанні COBAS TaqMan MAGE-А3 MAGE-А3 Експресія для клінічного зразка =2^ аналізу. (Ct β-актину зразка - Ct MAGE-A3 зразка) Процедура: Крім того, результати аналізу відтворюваності Дослідження включало два повтори на зразок. оцінювали шляхом порівняння кореляції MAGE-А3 Дві партії реагентів аналізували для QIAGEN експресії між двома прогонами за допомогою коеприготування зразків та TaqMan реагентів. фіцієнту кореляції за змішаними моментами ПірЕксперименти проводилися двома різними сона (r). Таблиця 40 та Таблиця 37 показують поріг операторами у два різні дні, при використанні двох MAGE-А3 експресії, одержаний з GERL РНК контрізних COBAS TaqMan 48 аналізаторів. ролів, проаналізованих при використанні прогону 1 Аналіз: та 2 на основі дельта Ct між β-актином та MAGEMAGE-А3 експресію для кожного клінічного А3. Таблиця 41 та Таблиця 43 показують MAGEзразка підраховували із середнього значення двох А3 сигнал для кожного з 12 зрізів, проаналізованих повторностей RT-ПЛР. Крім того, MAGE-А3 сигнал у прогоні 1 та 2. оцінювали для кожної повторності кожного зразка. Таблиця 42 показує Прогін 2 - поріг MAGE-А3 Відтворюваність також базувалася на порівнянні експресії з GERL РНК контролів; Таблиця 43 покаекспресії MAGE-А3 гена, підрахованої із значення зує прогін 2 - сигнал MAGE-А3 експресії для зраздельта Ct між генами MAGE-А3 та β-актину . Поріків аналізу на відтворюваність. вняння між експресією MAGE-А3 зразків, які піддаДля усіх досліджених зразків існувала 100% вали аналізу, проводили при використанні різних кореляція для сигналу MAGE-A3 експресії між партій реагентів, пристроїв, та у різні дні, застосодвома прогонами. Крім того, результати аналізу вуючи кореляцію Пірсона. відтворюваності оцінювали шляхом порівняння Критерій прийнятності: кореляції MAGE-А3 експресії між двома прогонами > 90 % MAGE-А3 значення відповідності між при використанні коефіцієнту кореляції за змішазразками, які є принаймні 3Х границею визначення ними моментами Пірсона (r). Коефіцієнт кореляції для цього аналізу (3% GERL) від одного прогону Пірсона складав 0,987 при порівнянні MAGE-А3 до іншого та у межах повторностей прогонів. експресії між двома різними прогонами. ЗадовольКореляція Пірсона > 90% між зразками нялися критерії прийнятності для відтворюваності. Результати відтворюваності Таблиця 44 показує підтвердження відтворюПоріг експресії MAGE-А3 являє собою рівень ваності; контрольні Ct перебувають у межах підтвідсікання MAGE-А3 експресії, що визначає, чи вердженого інтервалу. Експеримент пройшов вабуде пацієнт одержувати MAGE-А3 специфічну лідацію. Деталі експерименту відтворюваності є імунотерапію. Пацієнти з MAGE-А3 експресією, представленими у Таблицях 45, 46 та 47. 45 95956 46 47 95956 48 49 95956 50 51 95956 52 53 95956 54 55 95956 56 57 95956 58 59 95956 60
ДивитисяДодаткова інформація
Назва патенту англійськоюSet of instruments for determination of mage-a3
Автори англійськоюKoch Therry, Groussel Olivier, Salonga Dennis, Stefens Kreig Laurence, Bir Gabriel Annmari
Назва патенту російськоюНабор для определения mage-а3
Автори російськоюКох Тьерри, Груселл Оливье, Салонга Деннис, Стефенс Крейг Лоуренс, Бир Габриель Аннмари
МПК / Мітки
МПК: A61P 35/00, C12Q 1/68, G01N 33/533, A61K 35/12
Мітки: набір, mage-а3, визначення
Код посилання
<a href="https://ua.patents.su/52-95956-nabir-dlya-viznachennya-mage-a3.html" target="_blank" rel="follow" title="База патентів України">Набір для визначення mage-а3</a>
Попередній патент: Інгібітори зворотної транскриптази віл
Наступний патент: Проникна для пари та водонепроникна підошва для взуття, взуття, виготовлене з такою підошвою, та спосіб виготовлення підошви та взуття
Випадковий патент: Спосіб визначення ступеня кератинізації ясен