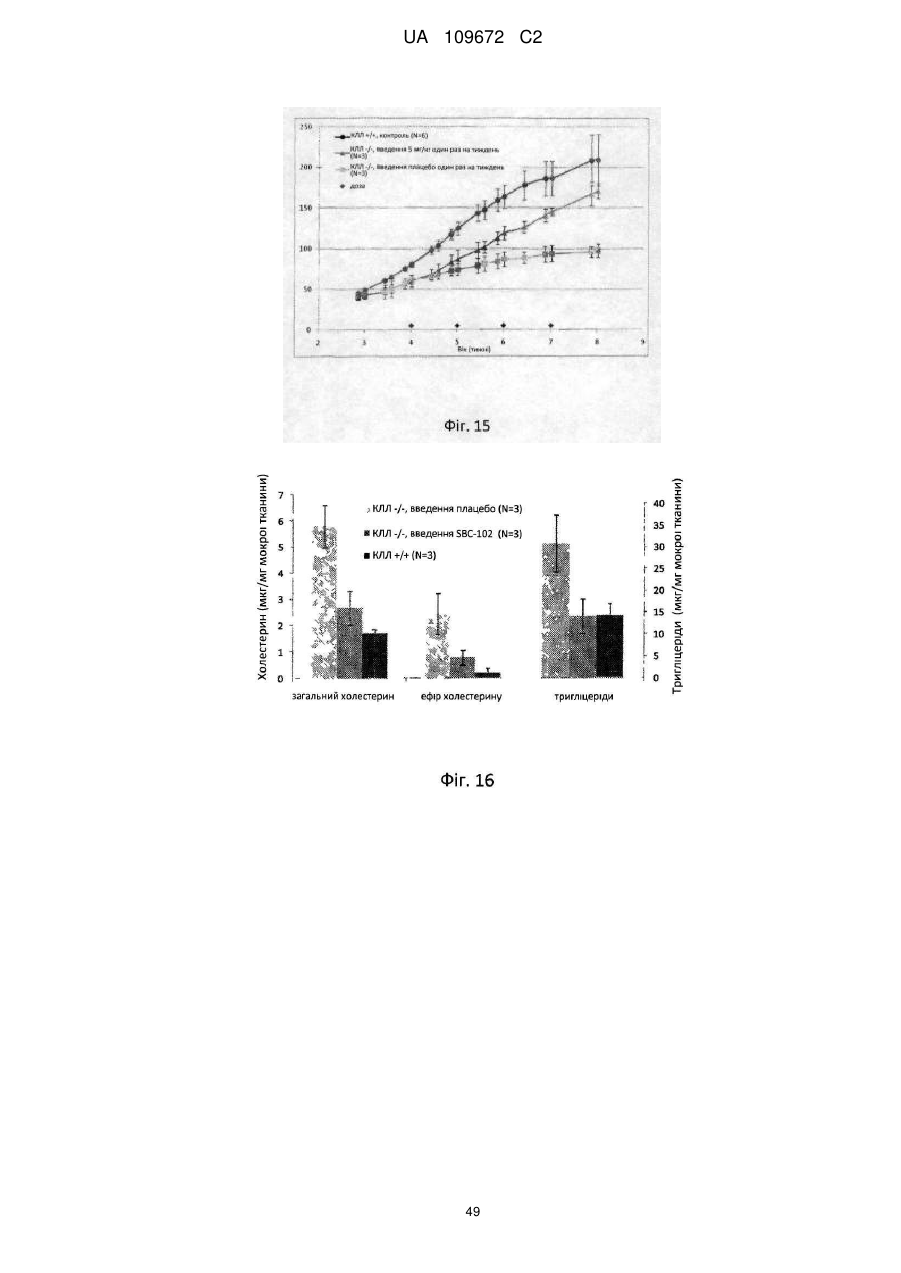
Застосування кислої лізосомної ліпази для лікування дефіциту кислої лізосомної ліпази у хворих
Формула / Реферат
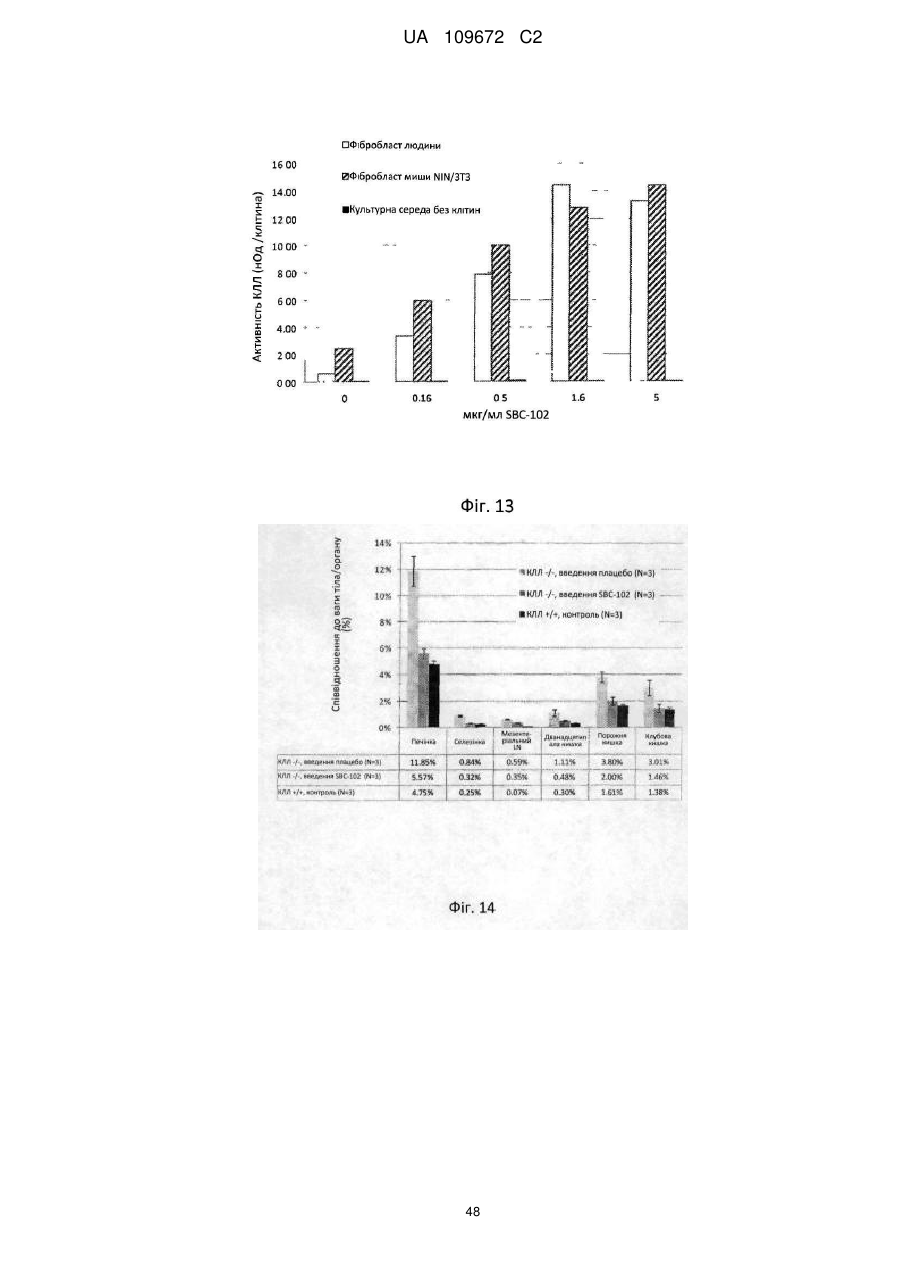
1. Спосіб лікування пацієнта-людини з дефіцитом кислої лізосомної ліпази (КЛЛ), який включає введення зазначеному пацієнту-людині рекомбінантної КЛЛ людини в кількості, ефективній для зниження рівня трансамінази печінки в сироватці або крові до нормального рівня, при цьому зазначену рекомбінантну КЛЛ людини вводять від одного разу кожні 7 днів до одного разу кожні 30 днів і зазначене введення є достатнім для зменшення ураження печінки у зазначеного пацієнта-людини.
2. Спосіб за п. 1, який відрізняється тим, що зазначена трансаміназа печінки вибрана з групи, що складається з сироваткової аспартатамінотрансферази (ACT) і аланінамінотрансферази (АЛТ).
3. Спосіб за п. 1, який відрізняється тим, що зазначена трансміназа печінки являє собою ACT.
4. Спосіб за п. 1, який відрізняється тим, що зазначена трансаміназа печінки являє собою АЛТ.
5. Спосіб за п. 1, який відрізняється тим, що зазначене введення є достатнім для поліпшення гепатомегалії.
6. Спосіб за п. 1, який відрізняється тим, що зазначене введення є достатнім для підвищення рівня сироваткового гемоглобіну.
7. Спосіб за п. 1, який відрізняється тим, що зазначене введення є достатнім для зменшення розмірів печінки.
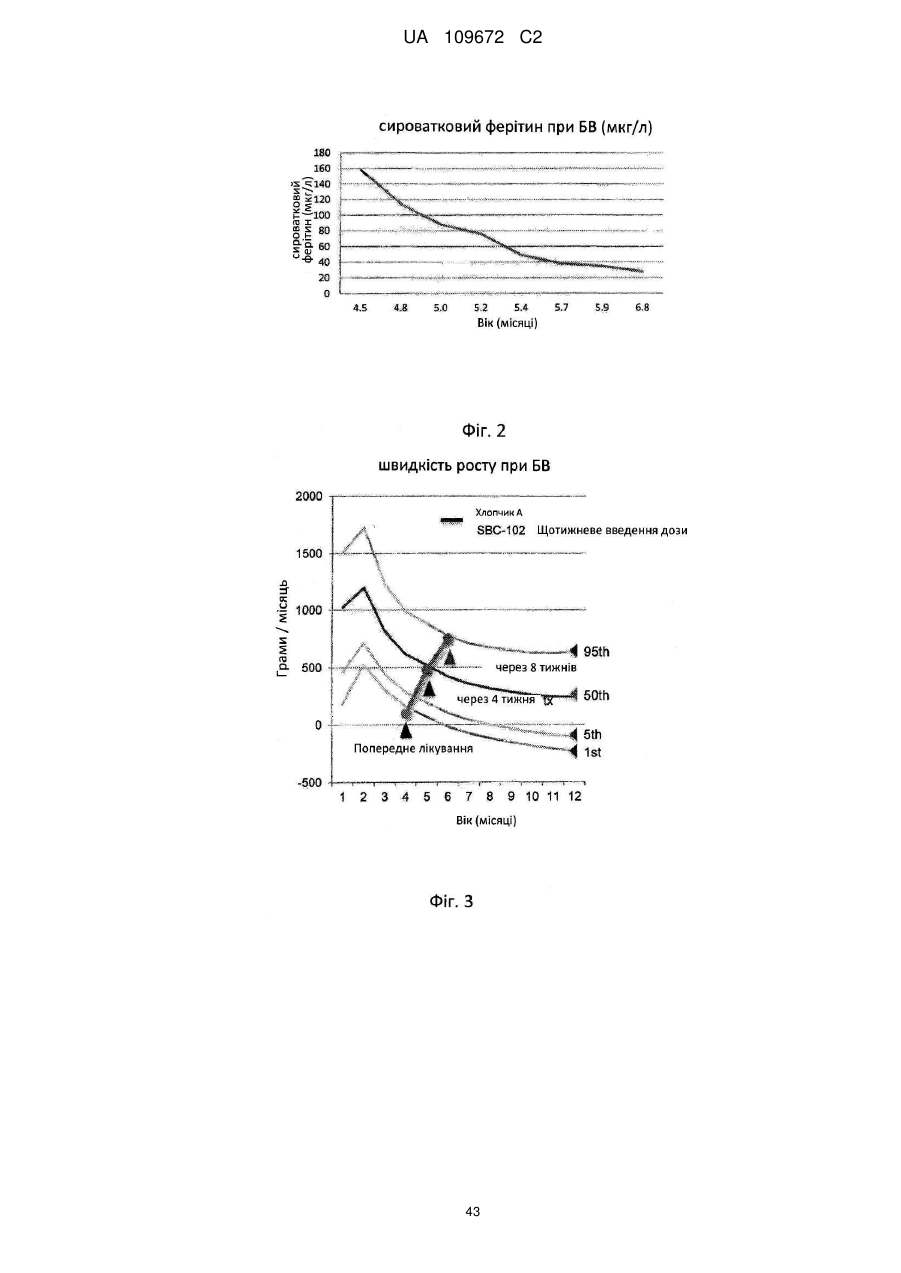
8. Спосіб за п. 1, який відрізняється тим, що зазначене введення є достатнім для зменшення рівня сироваткового феритину.
9. Спосіб за п. 1, який відрізняється тим, що зазначену рекомбінантну КЛЛ людини вводять один раз кожні 7 днів.
10. Спосіб за п. 1, який відрізняється тим, що зазначену рекомбінантну КЛЛ людини вводять один раз кожні 14 днів.
11. Спосіб за п. 1, який відрізняється тим, що зазначений пацієнт-людина страждає на хворобу Вольмана.
12. Спосіб за п. 1, який відрізняється тим, що зазначений пацієнт-людина страждає на хворобу накопичення ефірів холестерину.
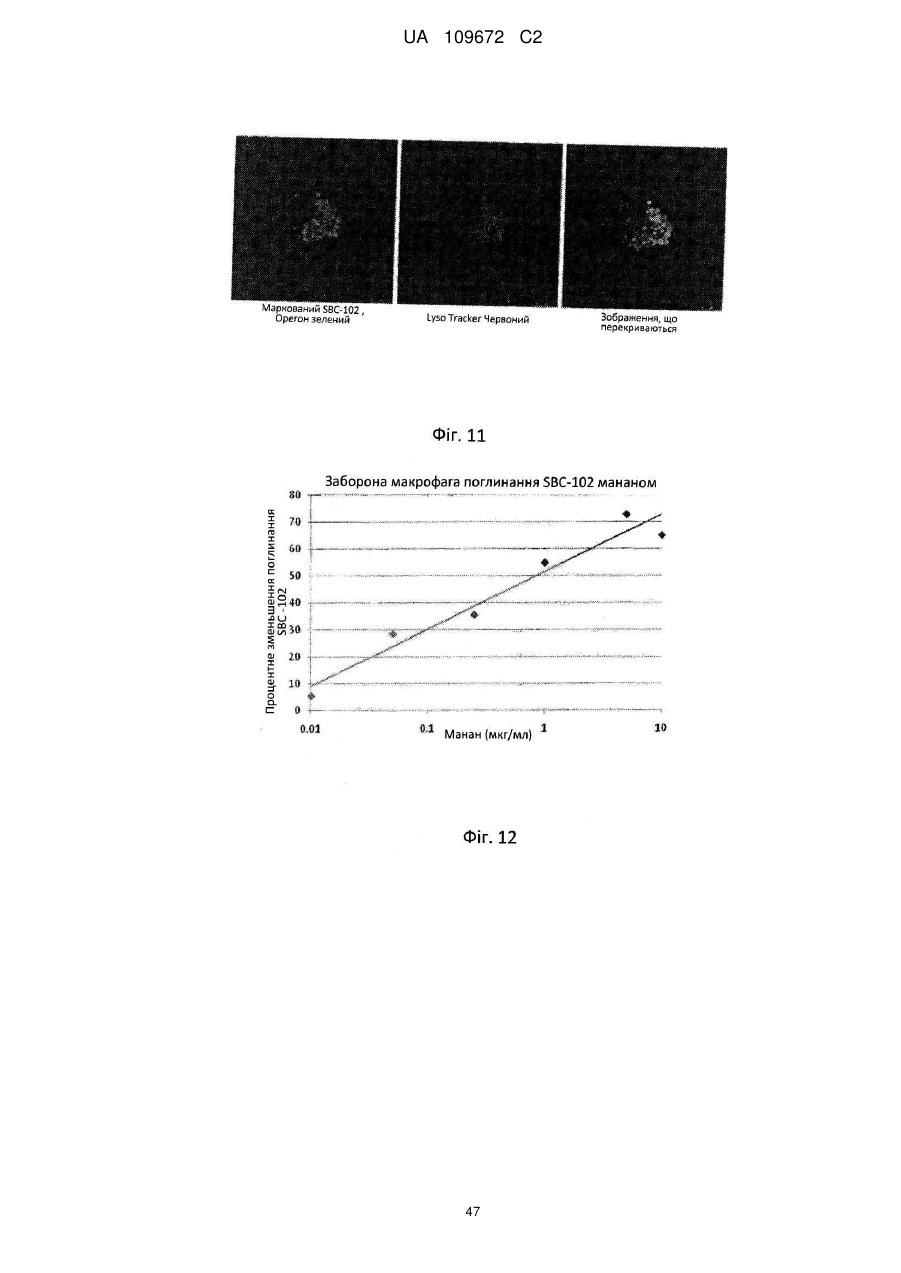
13. Спосіб за п. 1, який відрізняється тим, що зазначена рекомбінантна КЛЛ людини включає щонайменше одну термінальну манозу або щонайменше один термінальний манозо-6-фосфат.
14. Спосіб за п. 1, який відрізняється тим, що зазначена кількість, ефективна для зниження рівня трансамінази печінки в сироватці або крові до нормального рівня, становить 1 мг на кілограм ваги тіла зазначеного пацієнта-людини.
15. Спосіб за п. 1, який відрізняється тим, що період напіввиведення (t1/2) зазначеної рекомбінантної КЛЛ людини в сироватці менше 20 хвилин.
16. Спосіб за п. 1, який відрізняється тим, що період напіввиведення (t1/2) зазначеної рекомбінантної КЛЛ людини в сироватці становить 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16 або 17 хвилин.
17. Спосіб за п. 1, який відрізняється тим, що Сmах зазначеної рекомбінантної КЛЛ людини становить від 200 нг до 800 нг на мл сироватки.
18. Спосіб за п. 1, який відрізняється тим, що Сmах зазначеної рекомбінантної КЛЛ людини становить щонайменше 200 нг на мл сироватки.
19. Спосіб за п. 1, який відрізняється тим, що зазначену рекомбінантну КЛЛ людини вводять внутрішньовенно.
20. Спосіб за п. 19, який відрізняється тим, що зазначену рекомбінантну КЛЛ людини вводять шляхом уливання.
21. Спосіб за п. 20, який відрізняється тим, що зазначене уливання зазначеному пацієнту-людині виконують протягом часу від однієї до чотирьох годин.
22. Спосіб за п. 1, який відрізняється тим, що зазначене введення є достатнім для зниження лімфаденопатії.
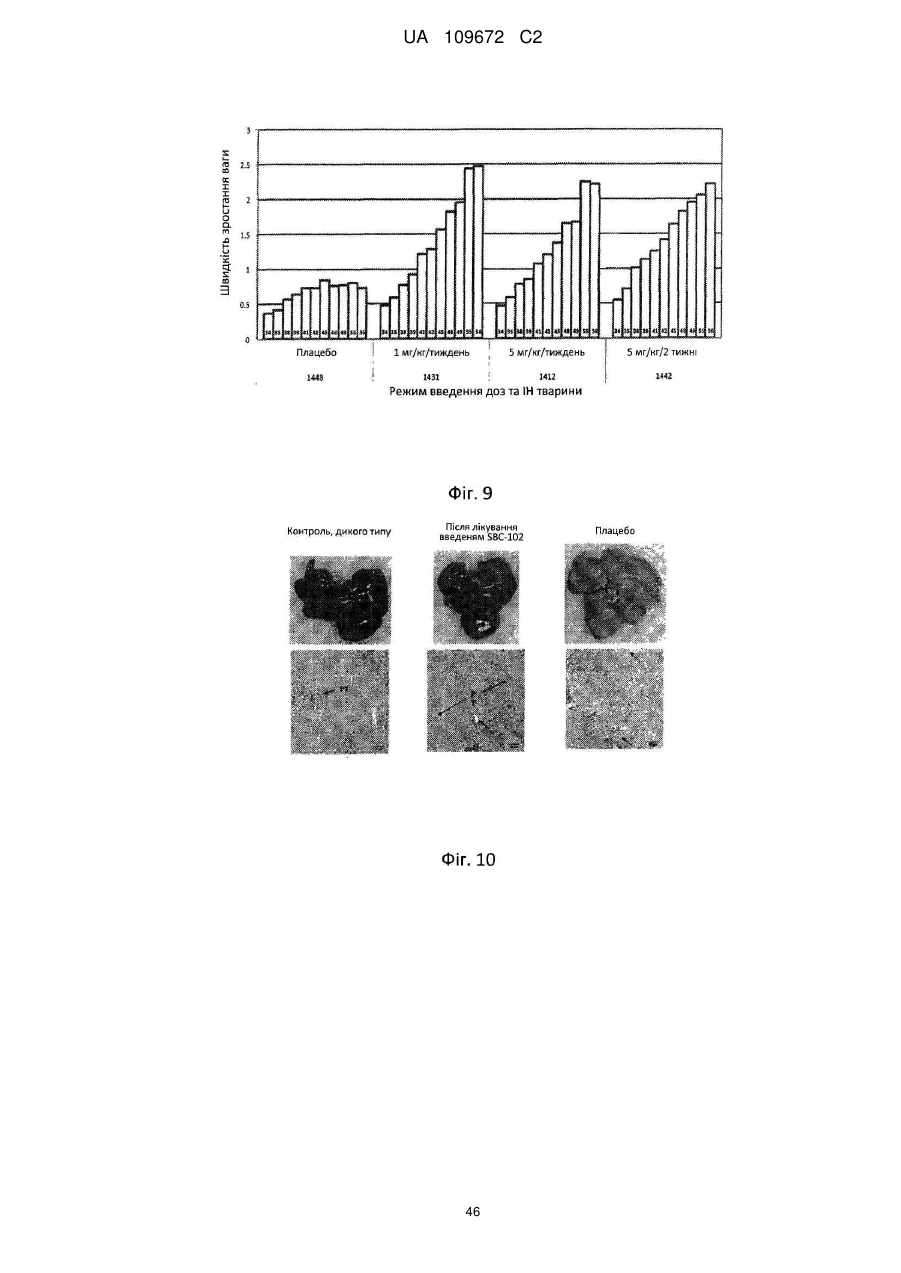
23. Спосіб за п. 1, який відрізняється тим, що вік зазначеного пацієнта-людини менше одного року та зазначене введення достатнє для збільшення швидкості росту зазначеного пацієнта-людини.
24. Спосіб за п. 1, який додатково включає введення другого лікарського засобу.
25. Спосіб за п. 24, який відрізняється тим, що зазначений другий лікарський засіб являє собою засіб, що знижує холестерин.
26. Спосіб за п. 25, який відрізняється тим, що зазначений другий лікарський засіб являє собою статин.
27. Спосіб за п. 25, який відрізняється тим, що зазначений другий лікарський засіб являє собою езетиміб.
28. Спосіб за п. 24, який відрізняється тим, що зазначений другий лікарський засіб являє собою імунодепресант.
29. Спосіб за п. 24, який відрізняється тим, що зазначений другий лікарський засіб являє собою антигістамін.
30. Спосіб за п. 29, який відрізняється тим, що зазначений антигістамін являє собою дифенгідрамін.
31. Спосіб за п. 30, який відрізняється тим, що зазначений дифенгідрамін уводять у кількості від 1 до 5 мг на кілограм ваги тіла зазначеного пацієнта-людини.
32. Спосіб за п. 30, який відрізняється тим, що зазначений дифенгідрамін уводять протягом від 20 до 90 хвилин до зазначеного введення рекомбінантної КЛЛ людини.
Текст
Реферат: ЛІЗОСОМНОЇ (72) Винахідник(и): Куінн Ентоні (US) (73) Власник(и): СІНАДЖЕВА БІОФАРМА КОРП., 128 Spring Street, Suite 520, Lexington, Massachusetts 02421, United States of America (US) (74) Представник: Кістерський Арсеній Леонідович, реєстр. №177 (56) Перелік документів, взятих до уваги експертизою: US 2007/264249 A1, 15.11.2007 H. DU ET AL: "Wolman disease/cholesteryl ester storage disease: efficacy of plantproduced human lysosomal acid lipase in mice", THE JOURNAL OF LIPID RESEARCH, vol. 49, no. 8, 1 January 2008 (2008-01-01), pages 1646-1657, XP55016778 JERRY STEIN ET AL: "Successful treatment of Wolman disease by unrelated umbilical cord blood transplantation", EUROPEAN JOURNAL OF PEDIATRICS, SPRINGER, BERLIN, DE, vol. 166, no. 7, 11 October 2006 (2006-10-11), pages 663-666, XP019517654 PASTORES G M: "Enzyme therapy for the lysosomal storage disorders: Principles, patents, practice and prospects", EXPERT OPINION ON THERAPEUTIC PATENTS 20030801 GB LNKDDOI:10.1517/EOTP.13.8.1157.22960, vol. 13, no. 8, 1 August 2003 (2003-08-01) , pages 1157-1172, XP002667492 ЛІПАЗИ ДЛЯ ЛІКУВАННЯ ДЕФІЦИТУ КИСЛОЇ Винахід стосується способу лікування пацієнта-людини з дефіцитом кислої лізосомної ліпази (КЛЛ), що включає введення зазначеному пацієнту-людині рекомбінантної КЛЛ людини в кількості, ефективній для зниження рівня трансамінази печінки в сироватці або крові до нормального рівня, при цьому зазначену рекомбінантну КЛЛ людини вводять від одного разу кожні 7 днів до одного разу кожні 30 днів і зазначене введення є достатнім для зменшення ураження печінки у зазначеного пацієнта-людини. UA 109672 C2 (12) UA 109672 C2 UA 109672 C2 5 10 15 20 25 30 35 40 45 50 55 РІВЕНЬ ТЕХНІКИ Дефіцит кислої лізосомної ліпази (КЛЛ) являє собою рідкісну лізосомну хворобу накопичення (ЛХН), що характеризується відсутністю розщеплення холестеринового ефіру (ХЕ) і тригліцеридів (ТГ) у лізосомах внаслідок дефіциту ферменту. Дефіцит КЛЛ має схожість із іншими лізосомними хворобами накопичення з акумуляцією субстрату в ряді типів тканин і клітин. За наявності дефіциту КЛЛ акумуляція субстрату є найбільш помітною в клітинах ретикулоендотеліальної системи, включаючи клітини Купфера в печінці, гістіоцити в селезінці й у власній пластинці слизової оболонки тонкої кишки. Ретикулоендотеліальні клітини експресують рецептор глюкозаміну манози / N-ацетилу макрофага (також відомий як рецептор манози макрофага, РММ або CD206), який стимулює зв'язування, включення клітиною речовини і лізосомну інтерналізацію протеїнів з N- ацетилглюкозаміном або завершеними N-гліканами манози, і забезпечує шлях для можливої корекції дефіциту ферменту в цих типах ключових клітин. Дефіцит КЛЛ являє собою мультисистемне захворювання, яке найчастіше проявляється при шлунково-кишкових, печінкових і серцевосудинних ускладненнях і асоціюється зі значною захворюваністю і смертністю. Клінічні наслідки дефіциту КЛЛ виникають внаслідок значущої акумуляції ліпідного матеріалу в лізосомах у ряді тканин і кардинальних порушень у механізмах регулювання холестерину і ліпідного гістіоцитозу, включаючи істотне збільшення синтезу печінкового холестерину. Дефіцит КЛЛ представляє, щонайменше, два фенотипи: хворобу Вольмана (ХВ) і хворобу накопичення ефірів холестерину (ХНЕХ). Хвороба Вольмана, названа так на честь лікаря, який першим її описав, є найбільш агресивним проявом дефіциту КЛЛ. Цей фенотип характеризується шлунково-кишковими й печінковими проявами, включаючи порушення росту, малабсорбцію, стеаторею, значну втрату маси тіла, лімфаденопатію, спленомегалію й гепатомегалію. Хвороба Вольмана швидко прогресує й незмінно призводить до смертельного результату звичайно в перший рік життя. Аналіз історій хвороби показує, що виживання після 12-місячного віку спостерігається надзвичайно рідко для хворих у яких присутнє порушення росту внаслідок важкої форми дефіциту КЛЛ у перший рік життя. За такої найбільш агресивної форми, порушення росту є домінуючою клінічною ознакою і вносить основний вклад у смертність в ранньому віці. Ураження печінки, що проявляється у формі її збільшення й підвищення рівня трансамінази, також є загальним проявом у немовлят. Діагноз хвороби Вольмана встановлюють на підставі як фізичних показників, так і результатів лабораторних аналізів. Немовлят звичайно госпіталізують в перші два місяці життя внаслідок діареї, безперервної блювоти, утрудненнях при годуванні, сповільнення росту, відставання у розвитку. Фізичні показники включають збільшення живота внаслідок гепатомегалії і спленомегалії, а рентгенографічне дослідження часто виявляє кальцифікацію надниркових залоз. Лабораторні дослідження звичайно виявляють підвищені рівні сироваткової трансамінази і відсутність або значне зниження активності ендогенного ферменту КЛЛ. У деяких хворих спостерігаються підвищені рівні холестерину й тригліцеридів у крові. Хворих з дефіцитом КЛЛ також можуть виявляти у більш старшому віці в основному за ураженням печінки і серцевосудинної системи, і цей стан часто називають хворобою накопичення ефірів холестерину (ХНЕХ). При ХНЕХ печінка є сильно ураженою внаслідок значущої гепатомегалії, некрозу клітин печінки, підвищення рівня трансаминази, цирозу і фіброзу печінки. Внаслідок підвищених рівнів ХЕ й ТГ, ураження серцевосудинної системи може характеризуватися гіперліпідемією. Акумуляція жирових відкладань на стінках артерій (атеросклероз) була виявлена у деяких хворих, які страждають ХНЕХ. Відкладання звужують артеріальний просвіт і можуть привести до закупорки судин, підвищуючи ризик серцевосудинних ускладнень, включаючи інфаркт міокарда й інсульт. Однак, не у всіх хворих, що страждають дефіцитом КЛЛ, розвивається атеросклероз. Наприклад, у пацієнтів із хворобою Вольмана спостерігаються інші симптоми, пов'язані із захворюванням, включаючи збільшення печінки й селезінки, лімфаденопатію і порушення усмоктування тонкою кишкою, але ХВ загалом не характеризується виникненням атеросклерозу (The Metabolic and Molecular Bases of Inherited Disease (Метаболічні й молекулярні основи спадкових хвороб) (Scriver, C. R., Beaudet, A. L., Sly, W. S., Valle D., і ін.) 7-е видання, Том 2 с. 2570 McGraw-Hill, 1995). Так само, не у всіх пацієнтів із ХНЕХ спостерігається атеросклероз, див. Di Bisceglie і ін., Hepatology (Гепатологія 11: 764-772 (1990), Ameis і ін., J, Lipid Res. (Дослідження ліпідів) 36: 241-250 (1995). Прояви ХНЕХ дуже відрізняються у різних пацієнтів, і в деяких пацієнтів ця хвороба не діагностується до настання ускладнень у пізньому дорослому віці, у той час як у інших пацієнтів спостерігається порушення функції печінки в ранньому дитячому віці. ХНЕХ асоціюється зі скороченою тривалістю життя й 1 UA 109672 C2 5 10 15 20 25 30 35 40 45 50 55 60 значним погіршенням стану здоров'я. Очікувана тривалість життя людей з ХНЕХ залежить від серйозності ускладнень пов'язаних із захворюванням. На даний час способи лікування хвороби Вольмана дуже обмежені. Немовлятам з гіпертермією і/або ознаками інфекції призначають антибіотики. Може бути призначена стероїдозаміщуюча терапія для лікування недостатності надниркових залоз і спеціальне парентеральне харчування, і поки немає доказів, що ці заходи запобігають настанню смертельного результату, неясно, чи впливають вони будь-яким чином на короткострокове виживання. У серії лікування за допомогою пересадження кісткового мозку чотирьох пацієнтів з дефіцитом КЛЛ, всі четверо померли протягом декількох місяців після пересадження внаслідок ускладнень. Хоча деякий успіх був описаний у наступних історіях хвороби, коефіцієнт смертності залишається високим, і багатьом хворим трансплантація не виконується через їх дуже поганий стан і низьку імовірність виживання під час підготовки до трансплантації. Дуже невелика зареєстрована кількість довгожителів вказує на те, що корекція дефіциту ферменту в гемопоетичних клітинах є достатньою умовою істотного покращення клінічного стану при цьому захворюванні. Звичайно, клінічна підтримка надається через дієтичні обмеження у спробі обмежити накопичення нетранспортабельних ліпідів, що не розкладаються, пов'язанних з гострими проявами захворювання, які приводять до смертельного результату. На даний час час способи лікування фенотипу ХНЕХ зосереджені на симптоматичній терапії через контроль акумуляції ліпідів за допомогою дієти, що виключає продукти з високим вмістом холестерину і тригліцеридів, і пригнічення синтезу холестерину і утворення аполіпопротеїну В через призначення лікарських препаратів, що знижують рівень холестерину (наприклад, статини і холестирамін). Хоча можна спостерігати деяке клінічне покращення, захворювання, що лежить в основі проявів, залишається і розвиток захворювання триває. Було припущено, що ферментозаміщуюча терапія з використанням рекомбінантної КЛЛ може бути життєздатним способом лікування дефіциту кислої лізосомної ліпази й відповідних станів (див. Meyers і ін. (1985) Nutrition Res. (Дослідження харчування) 5(4):423-442; W09811206; і Besley (1984) Clinical Genetics (Клінічна генетика) 26:195-203). Деякі дослідження дефіциту КЛЛ із використанням мишей продемонстрували корекцію деяких відхилень від норми у мишей з -/дефіцитом КЛЛ (КЛЛ ) за введення високих доз (більше 1 міліграма на 1 кілограм маси тіла) рекомбінантної людської КЛЛ один раз у кожні 3 дня (див., наприклад, Grabowski US 2007/0264249). При проведенні попередніх досліджень для корекції відхилень у мишей з дефіцитом КЛЛ передбачалося, що для корекції основних фенотипів потрібні відносно більші кількості й часте введення протеїну рекомбінантної КЛЛ. Також важливо відзначити, що на -/відміну від моделі, що використовує щурів із КЛЛ , яка була спочатку описана Yoshida і Kuriyama (1990) Laboratory Animal Science (Дослідження лабораторних тварин), том 40, с. 486-/489, модель, що використовує мишей із КЛЛ , використовувана в дослідженнях вище, не має близької подібності із ХВ у людей в тому розумінні, що дефіцит КЛЛ у мишей не призводить до порушень росту, які спостерігаються у людей. На сьогоднішній день, екзогенна КЛЛ не призначалася людям, і відсутня ефективна терапія, доступна для лікування дефіциту КЛЛ, включаючи ХВ, ХНЕХ і інші захворювання. Тому, існує гостра необхідність у способах лікування з мінімізованою частотою введення лікарських засобів для підвищення якості життя пацієнтів. Додатково, є бажаним визначення терапевтично ефективних доз для відновлення росту, нормалізації функції печінки, підвищення концентрації КЛЛ у тканинах і підвищення активності КЛЛ у хворих людей. СУТНІСТЬ ВИНАХОДУ Даний винахід заснований на перших клінічних випадках, коли пацієнтам-людям були успішно введені дози екзогенної КЛЛ. Немовля, яке страждало смертельною формою дефіциту КЛЛ (хвороба Вольмана або рання стадія дефіциту КЛЛ), було ефективно вилікуване за допомогою введення екзогенної КЛЛ, і було виконане оцінювання безпечності заміщуючої терапії з використанням ферменту КЛЛ на групі пацієнтів-людей, які страждають пізньою формою дефіциту КЛЛ. Немовляті з раннім початком дефіциту КЛЛ вводили щотижня низькі дози без прояву будь-яких несприятливих явищ або реакцій. Різкі покращення основних показників стану організму і клінічних / лабораторних перевірок ефективності спостерігалися через один-два тижні після початкового введення. Через 4 місяця щотижневого введення доз спостерігалось відновлення нормального росту немовляти і значне покращення всіх показників, які відносяться до дефіциту КЛЛ, включаючи малабсорбцію, гепатомегалію і функцію печінки. Дорослим хворим з пізньою формою захворювання також щотижня вводили дози з невеликою кількістю екзогенної КЛЛ без ознак несприятливих проявів. Таким чином, клінічні дані, зібрані на сьогоднішній день, демонструють, що ферментозаміщуюча терапія з використанням екзогенної КЛЛ даного винаходу забезпечує безпечне і ефективне лікування дефіциту КЛЛ. 2 UA 109672 C2 5 10 15 20 25 30 35 40 45 50 55 60 Відповідно, даний винахід надає способи лікування захворювань або станів, пов'язаних з дефіцитом КЛЛ у пацієнтів-людей, за допомогою введення ефективної кількості екзогенної кислої лізосомної ліпази (КЛЛ). Екзогенна КЛЛ може являти собою рекомбінантну КЛЛ людини, що має структуру N-лінійного глікану, що містить, щонайменше, одну манозу і/або манози-6фосфат. Екзогенна КЛЛ ефективно інтерналізується в лізосому, наприклад, лімфоцитів, макрофагів і/або фібробластів. У деяких варіантах втілення, у пацієнта, що страждає дефіцитом КЛЛ, діагностується хвороба Вольмана (ХВ). В одному варіанті втілення, введення є достатнім для покращення росту пацієнта із ХВ. В одному варіанті втілення введення є достатнім для відновлення нормального росту пацієнта із ХВ. В інших варіантах втілення у людини, яка страждає дефіцитом КЛЛ, діагностується хвороба накопичення ефірів холестерину (ХНЕХ). Способи лікування, відповідно до даного винаходу, можуть застосовуватися до пацієнтів-людей будьякого віку. У цій заявці також надаються способи лікування хворого, що страждає дефіцитом КЛЛ за допомогою ведення йому рекомбінантної КЛЛ людини в ефективній кількості для покращення функції печінки. У деяких варіантах втілення, введення є достатнім для нормалізації результатів досліджень печінки. В одному варіанті втілення введення є достатнім для зниження рівнів печінкових трансаміназ. Наприклад, печінкові трансамінази можуть містити сироваткову аспартатамінотрансферазу (АСТ) і / або сироваткову аланінамінотрансферазу (АЛТ). В одному варіанті втілення введення є достатнім для мінімізації гепатомегалії. В одному варіанті втілення введення є достатнім для зменшення розміру печінки хворого. В одному варіанті втілення введення є достатнім для зниження рівнів феритину сироватки крові. В одному варіанті втілення введення є достатнім для зниження рівнів феритину сироватки крові, включаючи, наприклад, рівні холестеринового ефіру (ХЕ) і / або тригліцеридів (ТГ). Також надається спосіб підвищення активності КЛЛ у хворого з дефіцитом КЛЛ. Такий спосіб включає введення рекомбінантної КЛЛ людини хворому для підвищення активності КЛЛ, яка може бути визначена, наприклад, у лімфоцитах і / або фібробластах. В одному варіанті втілення описується спосіб лікування стану, пов'язаного з дефіцитом КЛЛ, у хворого за допомогою введення ефективної кількості протеїну екзогенної КЛЛ хворому від одного разу кожні 5 днів до одного разу кожні 30 днів. У деяких варіантах втілення хворому, що страждає дефіцитом КЛЛ, вводять дозу від приблизно 0,1 мг до приблизно 50 мг екзогенної КЛЛ на кілограм маси тіла. В одному варіанті втілення хворому вводиться доза від приблизно 0,1 мг до приблизно 10 мг екзогенної КЛЛ на кілограм маси тіла. В одному варіанті втілення хворому вводять дозу від приблизно 0,1 мг до приблизно 5 мг екзогенної КЛЛ на кілограм маси тіла. В одному варіанті втілення доза введення становить від приблизно 0,1 мг/кг/год. до приблизно 4 мг/кг/год. У деяких варіантах втілення хворий лікується з використанням другого лікарського засобу. Другий лікарський засіб може включати, наприклад, засіб для зниження рівня холестерину (наприклад, статин або езетиміб), антигістамінний засіб (наприклад, дифенгідрамін) або імунодепресант. КОРОТКИЙ ОПИС КРЕСЛЕНЬ На Фігурі 1A показані рівні сироваткової аспартатамінтотрансферази (АСТ) у немовлятихлопчика із хворобою Вольмана (тобто, з ранньою формою дефіциту КЛЛ), який одержував щотижня дозу екзогенної КЛЛ (SBC-102) (доза: 0,2 мг/кг (початкове введення; тиждень 0); 0,3 мг/кг (тиждень 1); 0,5 мг/кг (тиждень 2); і 1,0 мг/кг (тижні 3-8)). На Фігурі 1Б показані рівні сироваткової аланінамінотрансферази (АЛТ) у цього ж хворого. Вік хворого під час початкового введення становив 4 місяці й 1 тиждень. На Фігурі 2 показані рівні феритину сироватки крові пацієнта із хворобою Вольмана, який одержував щотижня дозу екзогенної КЛЛ (SBC-102) (доза: 0,2 мг/кг (початкове введення; тиждень 0); 0,3 мг/кг (тиждень 1); 0,5 мг/кг (тиждень 2); і 1,0 мг/кг (тижні 3-8)). Вік хворого при початковому введенні становив 4 місяці й 1 тиждень. Рівні феритину сироватки крові показані з тижня 1 після початкового введення дози на тиждень 0. На Фігурі 3 показана швидкість росту пацієнта із хворобою Вольмана, який одержував щотижня дозу екзогенної КЛЛ (SBC-102) (доза: 0,2 мг/кг (початкове введення; тиждень 0); 0,3 мг/кг (тиждень 1); 0,5 мг/кг (тиждень 2); і 1,0 мг/кг (тижні 3-8)). На Фігурі 4 показаний графік росту пацієнта із хворобою Вольмана (кг, відсотки вікової маси для хлопчиків). На Фігурі 5 показані рівні сироваткової аспартатамінтотрансферази (АСТ) у 41-річного білого чоловіка із ХНЕХ, який одержував щотижневі дози 0,35 мг/кг екзогенної КЛЛ. 3 UA 109672 C2 5 10 15 20 25 30 35 40 45 50 55 60 На Фігурі 6 показані рівні сироваткової (АЛТ) в 41-річного білого чоловіка із ХНЕХ, який одержував щотижневі дози 0,35 мг/кг екзогенного КЛЛ. На Фігурі 7 показані рівні сироваткового альбуміну в 41-річного білого чоловіка із ХНЕХ, який одержував щотижневі дози 0,35 мг/кг екзогенної КЛЛ. На Фігурі 8 показані рівні феритину сироватки крові в 41-річного білого чоловіка із ХНЕХ, який одержував щотижневі дози 0,35 мг/кг екзогенної КЛЛ. На Фігурі 9 показана швидкість збільшення маси тіла у чотирьох щурів-самців однакового віку, кожному з яких вводили екзогенну КЛЛ відповідно до одного з наступних режимів введення: 1 мг на кілограм один раз на тиждень, 5 мг на кілограм один раз на тиждень, 5 мг на кілограм один раз на 2 тижні, або плацебо. Числа в колонках показую вік у днях. На Фігурі 10 показані результати патологічного й гістопатологічного дослідження щура з дефіцитом КЛЛ після лікування екзогенною КЛЛ і щура з дефіцитом КЛЛ після лікування плацебо. Макропатологічне дослідження показало нормалізацію кольору і розміру печінки у щурів після лікування екзогенною КЛЛ. Гістопатологічне дослідження тканини печінки щурів після лікування екзогенною КЛЛ показало по суті нормальну гістологію печінки, що різко відрізняється від значної акумуляції пінистих макрофагів у тварин, яким вводили плацебо. На Фігурі 11 показані співлокалізація рекомбінантної КЛЛ людини (SBC-102) і лізосомного маркера у лізосомах клітин, досліджених способом флуоресцентної мікроскопії з використанням режиму послідовного сканування На Фігурі 12 показана специфічність зв'язку рекомбінантної КЛЛ людини (SBC-102) з рецептором N-ацетилглюкозаміну / манози, оцінювана за допомогою конкурентно-зв'язуючого аналізу з використанням клітинної лінії макрофага, NR8383. На Фігурі 13 показана активність рекомбінантної КЛЛ людини в нормальних клітинах і клітинах з дефіцитом КЛЛ, in vitro. На Фігурі 14 показаний вплив лікування введенням рекомбінантної КЛЛ людини на масу внутрішніх органів щурів з дефіцитом КЛЛ. Розмір органів представлений у відсотках від маси -/+/+ тіла, визначеної у віці 8 тижнів, у щурів КЛЛ і КЛЛ після щотижневого введення середовища або SBC-102 у кількості 5 мг/кг протягом 4 тижнів. На Фігурі 15 показана маса тіла у щурів дикого типу і щурів з дефіцитом КЛЛ після введення -1 середовища або SBC-102 у кількості 5 мг/кг протягом 4 тижнів. Введення доз показане на осі Х ромбиками, починаючи з 4 тижня. На Фігурі 16 показані рівні холестерину, холестеринового ефіру і тригліцеридів в печінці, визначені у віці 8 тижнів у щурів із ХВ і дефіцитом КЛЛ після щотижневого введення -1 середовища або SBC-102 у кількості 5 мг/кг протягом 4 тижнів. На Фігурі 17 показане збільшення маси тіла у відсотках у щурів з дефіцитом КЛЛ. На Фігурі 18 показана маса печінки у відсотках від маси тіла у щурів з дефіцитом КЛЛ після введення SBC-102 протягом 4 тижнів. На Фігурі 19 показані рівні холестеринового ефіру в тканинах щурів з дефіцитом КЛЛ після введення SBC-102 протягом 4 тижнів. ДОКЛАДНИЙ ОПИС ВИНАХОДУ Даний винахід надає способи лікування людини, що страждає хворобою або станом, чутливими до введення екзогенної кислої лізосомної ліпази. Визначення Для зручності, певні терміни, використовувані в описі, прикладах і прикладеній формулі винаходу, формулюються в цій заявці для ілюстрування і визначення значень і меж застосування різних термінів, використовуваних для опису даного винаходу. "КЛЛ", відповідно до використання в даній заявці, відноситься до "кислої лізосомної ліпазі", і два терміни використовуються взаємозамінно в описі. КЛЛ може являти собою протеїн людини, тобто кислу лізосомну ліпазу людини. Термін "SBC-102", відповідно до використання в даній заявці, відноситься до рекомбінантної кислої лізосомної ліпази людини. Термін КЛЛ також відноситься до таких речовин, представлених у літературі, як гідролаза кислого холестерилового ефіру, естераза холестерилу, Ліпаза А, ЛИП А, і естераза стеролу. КЛЛ каталізує гідроліз холестеринових ефірів і тригліцеридів до вільного холестерину, гліцерину і вільних жирних кислот. Таким чином, "активність КЛЛ" може бути виміряна, наприклад, як розщеплення флуорогенного субстрату, 4-метилумбеліферилового олеату (4МУО). Розщеплення 4МУО може бути виявлене, наприклад, за допомогою збудження за довжини хвилі 360 нм і емісії за 460 нм вільного флюорофора, 4-метилумбеліферилу (4МУ). Результати можуть бути представлені у відносних одиницях флуоресценції (ВОФ). Наприклад, кількість субстрату, розщепленого під час 30-хвилинного дослідження за кінцевою точкою, може бути визначена кількісно відносно еталонної кривої 4МУ, і одна одиниця (О) активності може 4 UA 109672 C2 5 10 15 20 25 30 35 40 45 50 55 60 бути визначена як кількість ферменту, необхідного для розщеплення 1 мікромоля 4МУО за хвилину за температури 37 °C. Відповідно, функціональні фрагменти варіантів КЛЛ включають фрагменти, що містять активність КЛЛ, наприклад, здатність гідролізовати ефіри холестерину і / або тригліцериди. Відповідно до використання в даній заявці, "екзогенна КЛЛ" відноситься до КЛЛ, яка природно не виробляється хворим. Наприклад, екзогенна КЛЛ включає протеїн рекомбінантної КЛЛ, який вводиться хворому, протеїн КЛЛ, який виділяється у людини або тварини і вводиться хворому, і протеїн КЛЛ, який виробляється (тобто експресується) у хворого в результаті введення КЛЛ-кодуючої РНК і / або ДНК або іншого лікування, що підвищує експресію протеїну екзогенної КЛЛ. "Внутрішньовенна ін'єкція" часто розглядається як внутрішньовенне струминне введення або болюсне введення дози речовини й відноситься до способу введення, коли шприц приєднують до пристрою доступу до вени, і препарат вводять безпосередньо, звичайно швидко, але іноді до 15 хвилин, якщо введення може привести до подразнення вени або ефекту занадто швидкого введення. Після введення препарату в цей пристрій, необхідні деякі засоби для забезпечення його введення в організм пацієнта. Звичайно, це досягається забезпеченням умови вільного протікання рідкого середовища, що переносить препарат у кров'яне русло. Однак, у деяких випадках, після першого введення використовується друга ін'єкція рідкого середовища, часто називана "промиванням", для полегшення попадання препарату в кров'яне русло. "Внутрішньовенне вливання" відноситься до способу введення, при якому препарат вводиться протягом тривалого періоду часу. Наприклад, препарат може вводитися хворому протягом періоду часу від 1 до 8 годин. Препарат також може вводитися хворому протягом приблизно 1, приблизно 2, приблизно 3, приблизно 4, приблизно 5, приблизно 6, приблизно 7 або приблизно 8 годин. Для здійснення внутрішньовенного вливання може використовуватися крапельниця для введення препарату самопливом або насос для внутрішньовенного вливання. Внутрішньовенне вливання звичайно використовується в тих випадках, коли хворому необхідне введення препарату тільки в певні періоди часу і немає необхідності введення додаткових речовин (наприклад, водяних розчинів, які можуть містити натрій, хлорид, глюкозу або будь-яку їх комбінацію), які відновлюють рівень електролітів, вміст цукру в крові, компенсують втрати води. Термін "пташиний", відповідно до використання в даній заявці, відноситься до будь-яких видів, підвидів або пород організму таксономічного класу птахів, таких як, але обмежуючись ними, кури, індики, качки, гусаки, перепілки, фазани, папуги, в'юрки, яструби, ворони й безкільові птахи, включаючи страусів, ему і казуарів. Термін включає різні відомі породи Gallus gallus, або кур (наприклад, білий леггорн, бурий леггорн, смугастий рок, суссекс, нью-гемпшир, род-айленд, австралорп, мінорка, амрокс, каліфорнійська сіра), також як і породи індиків, фазанів, перепілок, качок, страусів, і інших домашніх птахів, яких звичайно розводять у комерційних кількостях. Термін також включає індивідуальний організм птаха на всіх етапах розвитку, у тому числі на стадії зародка і плоду. Термін "одержаний від домашнього птаха" або "одержаний від птаха" відноситься до композиції або речовини, виробленої або одержаної від домашнього птаха. Термін "домашній птах" відноситься до птахів, які можна утримувати в якості свійських тварин, включаючи, але обмежуючись ними, кур, качок, індиків, перепілок і безкільових птахів. Наприклад, термін "одержаний від домашнього птаха" може відноситись до речовини, одержаної з курки, одержаної з індика і / або одержаної з перепілки. Термін "пацієнт" відповідно до використання в даній заявці, відноситься до будь-якої людини, яка одержує або одержала, або буде одержувати медичну допомогу або лікування, наприклад, відповідно до призначення провайдера медичної допомоги. Термін "терапевтично ефективна доза", відповідно до використання в даній заявці, відноситься до дози (наприклад, кількості й / або інтервалу) лікарського засобу, яка повинна забезпечити намічену терапевтичну реакцію. Терапевтично ефективна доза відноситься до дози, результатом введення якої у порівнянні з відповідним суб'єктом, який не одержав таку дозу, є покращення процесу лікування, виліковування, запобігання або зниження інтенсивності захворювання, розладу або побічного ефекту, або зниження частоти прояву, або попередження захворювання або розладу. Термін також включає, у межах свого застосування, дози, що є ефективними для покращення фізіологічних функцій. Терміни "лікувати", "лікування", і "виліковування" відносяться до способів полегшення, пом'якшення або покращення перебігу захворювання або його проявів, запобігання додаткового симптому, пом'якшення або запобігання причини прояву, що лежить в основі, придушення 5 UA 109672 C2 5 10 15 20 25 30 35 40 45 50 55 60 захворювання або стану, купіювання розвитку захворювання або стану, полегшення захворювання або стану, стимулювання зворотного розвитку захворювання або стану, полегшення стану, викликаного захворюванням або станом або припинення симптому захворювання або стану профілактично і/або після прояву симптому. -1" Відповідно до використання в даній заявці, із зазначенням конкретної дози, "кг , "на кг", «/кг", і "на кілограм" означає "на кілограм маси тіла" ссавця, і ці терміни можуть використовуватися взаємозамінно. Відповідно до використання в даній заявці, термін "поліпептид" призначений для охоплення "поліпептиду" в однині, а також "поліпептидів" у множині, і відноситься до молекули, що складається з мономерів (амінокислот), лінійно зв'язаних амідними зв'язками (також відомими як пептидні зв'язки). Термін "поліпептид" відноситься до будь-якого ланцюга або ланцюгів із двох або більше амінокислот і не відноситься до конкретної довжини продукту. Таким чином, пептиди, дипептиди, трипептиди, олігопептиди, "протеїни", "ланцюги амінокислот" або будь-які інші терміни, використовувані для ланцюга або ланцюгів із двох або більше амінокислот, включені в межі поняття "поліпептид", і термін "поліпептид" може використовуватись замість будь-якого із цих термінів або взаємозамінно. Термін "поліпептид" також призначений для продуктів модифікації поліпетиду після експресії, включаючи без обмеження глікозилювання, ацетилування, фосфорилювання, амідування, дериватизацію відомими захисними / блокувальними групами, протеолітичним розщепленням або модифікацією амінокислот неприродного походження. Поліпептид може бути одержаний із природнього біологічного джерела або одержаний з використанням рекомбінантної технології, але не обов'язково шляхом трансляції із призначеної послідовності нуклеїнової кислоти. Він може генеруватися будь-яким способом, включаючи хімічний синтез. Відповідно до використання в даній заявці, відносна гомологія між двома амінокислотними послідовностями або двома нуклеотидними послідовностями еквівалентна відносній ідентичності двох послідовностей. Відносна ідентичність двох послідовностей є функцією кількості ідентичних позицій, загальних для послідовностей (тобто % гомології = кількість ідентичних позицій / загальна кількість позицій Х 100), враховуючи кількість розривів і довжину кожного розриву, які необхідно ввести для оптимального вирівнювання двох послідовностей. Порівняння послідовностей і визначення відносної ідентичності двох послідовностей може бути здійснене з використанням математичного алгоритму, як описано в прикладах нижче, що не мають обмежувального характеру. Відносна ідентичність двох амінокислотних послідовностей може бути визначена з використанням алгоритму Мейєра і Міллера (E. Meyers і W. Miller (Comput. Appl. Biosci., 4:11-17 (1988)), який був введений у програму ALIGN (версія 2.0), використовуючи вагову таблицю залишку PAM120, коефіцієнт довжини розриву 12 і коефіцієнт розриву 4. На додаток, відносна ідентичність двох амінокислотних послідовностей може бути визначена, використовуючи алгоритм Нідльмана і Ванша (Needleman і Wunsch (J. Моl, Biol. 45:444-453 (1970)), який був введений у програму GAP пакета програмного забезпечення GCG (http://www.gcg.com),використовуючи або матрицю Блоссома 62 або матрицю PAM250 і ваговий коефіцієнт розриву 16, 14, 12, 10, 8, 6, або 4 ваговий коефіцієнт довжини 1, 2, 3, 4, 5, або 6. "Ізольований" поліпептид або фрагмент, варіант або похідний продукт є призначеним поліпептидом, який не знаходиться в природньому середовищі. Конкретний рівень очищення не потребується. Наприклад, ізольований поліпептид може бути добутий із власного або із природнього середовища. Вироблені рекомбінантно поліпептиди й протеїни, експресовані в клітинах-хазяїнах, розглядаються як ізольовані, як розкривається в даній заявці, як власні або рекомбінантні поліпептиди, які були сепаровані, фракціоновані або частково або в основному очищені будь-яким придатним способом. Інші поліпептиди, що розкриваються в даній заявці, являють собою фрагменти, похідні, аналоги або варіанти вищезгаданих поліпептидів і будь-яких їх комбінацій. Терміни "фрагмент", "варіант", "похідна" і "аналог" при звертанні до будь- якого з поліпептидів, що розкриваються в даній заявці, включають будь-які поліпептиди, які зберігають, щонайменше, деяку активність відповідного власного поліпептиду (наприклад, фрагменти, варіанти, похідні й аналоги поліпептидів КЛЛ, які зберігають здатність гідролізувати ефіри холестерину і/або тригліцериди). Фрагменти поліпептидів включають, наприклад, протеолітичні фрагменти, а також фрагменти делецій. Варіанти поліпептиду включають фрагменти, як описано вище, а також поліпептиди зі зміненими амінокислотними послідовностями внаслідок амінокислотних заміщень, видалень або вставок. Варіанти можуть мати природнє або неприродне походження. Варіанти неприродного походження можуть бути вироблені, використовуючи відомі способи мутагенезу. Варіантні поліпептиди можуть включати консервативні або неконсервативні амінокислотні 6 UA 109672 C2 5 10 15 20 25 30 35 40 45 50 55 заміщення, видалення або вставки. Похідні являють собою поліпептиди, які були змінені до появи додаткових властивостей, відсутніх і власних поліпептидів. Приклади включають гібридні білки. Варіантні поліпептиди можуть також іменуватися як "поліпептидні аналоги". Відповідно до використання в даній заявці, "похідна" початкового поліпептиду може містити один або більше залишків, одержаних хімічним способом за допомогою реакції функціональної бокової групи. До "похідних" також відносяться пептиди, що містять одну або більше амінокислотних похідних природнього походження двадцяти стандартних амінокислот. Наприклад, 4-гідроксипролін може бути заміщений проліном; 5-гідроксилізин може бути заміщений лізином; 3- метилгістидин може бути заміщений гістидином; гомосерин може бути заміщений серином; і / або орнітин може бути заміщений лізином. Термін "полінуклеотид" призначений для охоплення нуклеїнової кислоти в однині, а також нуклеїнових кислот у множині, і відноситься до ізольованої молекули або конструкції нуклеїнової кислоти, наприклад, інформаційної РНК (іРНК) або плазмідної ДНК (пДНК). Полінуклеотид може включати традиційний фосфодіефірний зв'язок або нетрадиційний зв'язок (наприклад, амідний зв'язок, такий як виявлений в пептидній нуклеїновій кислоті (ПНК). Термін "нуклеїнова кислота" відноситься до будь-якого одного або більше сегментів нуклеїнової кислоти, наприклад, до фрагментів ДНК або РНК, присутніх у полінуклеотиді. "Ізольована" нуклеїнова кислота або "ізольований" нуклеотид являє собою молекулу нуклеїнової кислоти, ДНК або РНК, яка була добута із власного середовища. Наприклад, рекомбінантний полінуклеотид, що кодує КЛЛ, яка міститься у векторі, розглядається як ізольований для цілей даного винаходу. Додаткові приклади ізольованого полінуклеотиду включають рекомбінантні полінуклеотиди, що містяться в гетерологічних клітинах-хазяїнах, або очищені (частково або в основному) полінуклеотиди в розчині. Ізольовані молекули РНК включають in vivo або in vitro транскрипти РНК полінуклеотидів відповідно до даного винаходу. Ізольовані полінуклеотиди або нуклеїнові кислоти відповідно до даного винаходу додатково включають такі молекули, одержані штучно. На додаток, полінуклеотид або нуклеїнова кислота може бути регуляторним елементом або включати такий елемент, наприклад, промотор, ділянка зв'язування рибосом або термінатор транскрипції. Відповідно до використання в даній заявці, "кодуюча ділянка" являє собою частину нуклеїнової кислоти, що складається з кодонів, трансльованих в амінокислоти. Хоча "стопкодон" (ТАГ, ТГА або ТАА) не транслюється в амінокислоту, він може розглядатися як частина кодуючої ділянки, але будь-які фланкуючі послідовності, наприклад, промотори, ділянки зв'язування рибосом, термінатори транскрипції, інтрони й тощо, не є частиною кодуючої ділянки. Дві або більше кодуючі ділянки відповідно до даного винаходу можуть бути представлені в одній полінуклеотидній конструкції, наприклад, на одиночному векторі, або в окремих полінуклеотидних конструкціях, наприклад, на окремих (різних) векторах. Крім того, будь-який вектор може містити одну кодуючу ділянку, або може включати дві або більше кодуючі ділянки. На додаток, вектор, полінуклеотид або нуклеїнова кислота відповідно до даного винахіду може кодувати гетерологічні кодуючі ділянки, що злилися, або що не злилися з нуклеїновоюислотою, що кодує поліпептид КЛЛ або фрагмент, варіант або похідну від них. Гетерологічні кодуючі ділянки, включають без обмеження спеціальні елементи або мотиви, такі як секреторний сигнальний пептид або гетерологічний функціональний домен. Різні ділянки управління транскрипцією відомі фахівцям у цій галузі техніки. Ці ділянки включають, без обмеження, ділянки управління транскрипцією, що функціонують у клітинах хребетних, такі як, але не обмежувані ними, сегменти промотору й підсилювача із цитомегаловірусу (безпосередній ранній промотор, разом з ітроном-А), вакуолізуючого мавпячого вірусу 40 (ранній промотор) і ретровірусів (таких як вірус саркоми Рауса). Інші ділянки управління транскрипцією включають ділянки, одержані з генів хребетних, такі як актин, білок теплового шоку, гормон росту великої рогатої худоби, β-глобін кролика, а також інші послідовності, здатні управляти експресією гена еукаріотичних клітин. Додаткові придатні ділянки управління транскрипцією включають тканиноспецифічні промотори і підсилювачі, а також лімфокін-індуковані промотори (наприклад, промотори, що індукуються інтерферонами або інтерлейкінами). Подібно цьому, різні елементи управління транскрипцією відомі фахівцям у цій галузі техніки. Ці елементи включають, але не обмежуються ними, ділянки зв'язування рибосом, кодони ініціювання і припинення трансляції, і елементи, одержані з пікорнавірусів (зокрема, із внутрішньої ділянки зв'язування рибосом (ВДЗР), також називаної послідовністю CITE). В інших варіантах втілення винаходу полінуклеотид відповідно до даного винаходу являє собою РНК, наприклад, у вигляді інформаційної РНК (іРНК). 7 UA 109672 C2 5 10 15 20 25 30 35 40 45 50 55 60 Кодуючі ділянки полінуклеотиду і нуклеїнової кислоти, відповідно до даного винаходу, можуть бути зв'язані з додатковими кодуючими ділянками, які кодують секреторні або сигнальні пептиди, що направляють секрецію поліпептиду, кодованого полінуклеотидом відповідно до даного винаходу. Відповідно до гіпотези сигнальної послідовності, протеїни, що секретуються клітинами ссавців, мають сигнальний пептид або секреторну лідерну послідовність, яка відщеплюється від зрілого протеїну після ініціювання експорту зростаючого білкового ланцюга через гранулярний ендоплазматичний ретикулум. Фахівці в цій галузі техніки знають, що поліпептиди, що секретуються клітинами хребетних, звичайно мають сигнальний пептид, злитий з N-кінцем поліпептиду, який відщеплюється від повного або первинного поліпептиду для виробництва секреторного або зрілого виду поліпептиду. У конкретних варіантах втілення, використовується власний сигнальний пептид, наприклад, сигнальний пептид MKMRFLGLVVCLVLWTLHSEG (SEQ ID NO: 2) КЛЛ людини або функціональна похідна цієї послідовності, яка зберігає здатність направляти секрецію функціонально зв'язаного з ним поліпептиду. Альтернативно, може використовуватися гетерологічний сигнальний пептид (наприклад, гетерологічний сигнальний пептид ссавців або птахів), або його функціональна похідна. Наприклад, лідерна послідовність дикого типу може бути заміщена активатором плазміногену тканини людини (ПТЛ) або β- глюкуронідазою миші. Термін "вектор" означає полінуклеотид, що складається з одноланцюгової, дволанцюгової, кільцевої або надспіральної ДНК або РНК. Типовий вектор може складатися з наступних елементів, функціонально зв'язаних, що знаходяться на певних відстанях для забезпечення функціональних експресій гена: точка початкової реплікації, промотор, підсилювач, лідерна послідовність 5' іРНК, ділянка зв'язування рибосом, касета нуклеїнової кислоти, сайти термінації й поліаденілювання, і вибирані маркерні послідовності. Один або більше із цих елементів можуть бути випущені в конкретних застосуваннях. Касета нуклеїнової кислоти може включати сайт рестрикції для вставки послідовності нуклеїнової кислоти, яка повинна бути експресована. У функціональному векторі, касета нуклеїнової кислоти містить послідовність нуклеїнової кислоти, яка повинна бути експресована, включаючи сайти ініціювання трансляції і термінації. У конструкцію може бути додатково включений інтрон, наприклад, 5" у кодуючу послідовність. Вектор будується таким чином, що конкретна кодуюца послідовність розташована у векторі з відповідними регуляторними послідовностями, за такого позиціонування і орієнтації кодуючої послідовності відносно управляючих послідовностей, що кодуюча послідовність зчитується під "управлінням" управляючої або регуляторної послідовності. Бажано, щоб модифікація послідовностей, що кодують конкретний білок, досягла цього кінця. Наприклад, у деяких випадках, може знадобитися модифікувати послідовність таким чином, щоб вона могла бути приєднана до управляючих послідовностей з відповідною орієнтацією, або зберігати рамку зчитування. Управляючі послідовності й інші регуляторні послідовності можуть бути приєднані до кодуючої послідовності перед вставкою у вектор. Альтернативно, кодуюча послідовність може бути клонована безпосередньо у вектор експресії, який уже містить управляючі послідовності й відповідний сайт рестрикції в рамці зчитування з і під регуляторним управлінням управляючих послідовностей. Термін "експресія", відповідно до використання в даній заявці, відноситься до процесу, за допомогою якого ген виробляє біохімічний продукт, наприклад, поліпептид. Процес включає всі прояви функціональної присутності гена в клітині, включаючи, без обмеження, нокдаун гена, також як і перехідну й стійку експресію. Процес включає, без обмеження, транскрипцію гена в інформаційну РНК (іРНК) і трансляцію такої іРНК у поліпептид(и). Експресія гена виробляє "генний продукт". Відповідно до використання в даній заявці, генний продукт може являти собою нуклеїнову кислоту, наприклад, інформаційну РНК, вироблену за допомогою транскрипції гена, або поліпептид, трансльований із транскрипта. Генний продукт, описуваний у даній заявці, додатково включає нуклеїнові кислоти з посттранскрипційними модифікаціями, наприклад, поліаденілюванням або поліпептиди з посттрансляційними модифікаціями, наприклад, метилюванням, глікозилюванням, додаванням ліпідів, асоціюванням з іншими білковими субодиницями, протеолітичним розщепленням, тощо. Відповідно до використання в даній заявці, термін "клітини-хазяїни" відноситься до клітин, що утворюють основний вектор з використанням рекомбінантних ДНК і кодуванням, щонайменше, одного гетерологічного гена. Відповідно до використання в даній заявці, терміни "N-глікан", "олігосахарид", "олігосахаридна структура", "шаблон глікозилювання", "профіль глікозилювання" і "структура глікозилювання" мають в основному одне значення, і кожний з них відноситься до однієї або більшої кількості структур, утворених із цукрових залишків, що приєднуються до глікованих білків. 8 UA 109672 C2 5 10 15 20 25 30 35 40 45 50 55 60 Відповідно до використання в даній заявці, термін "лікарська композиція" відноситься до суміші сполуки, описуваної в даній заявці, з іншими хімічними компонентами, такими як носії, стабілізатори, розріджувачі, диспергатори, суспендуючі речовини, загусники і/або наповнювачі. Пацієнти з недостатньою активністю КЛЛ Без бажання обмежувати винахід лікуванням будь-якого стану або групи станів, винахід включає лікування дефіциту кислої лізосомної ліпази (КЛЛ) у пацієнтів. Відповідно до використання в даній заявці, пацієнтом з дефіцитом КЛЛ є будь-який пацієнт із недостатньою активністю КЛЛ. Недостатня активність КЛЛ у пацієнтів може, наприклад, бути причиною низького рівня РНК, низького рівня білків або низької активності білків. Недостатня активність КЛЛ може бути результатом мутації послідовності, що кодує КЛЛ, регуляторної послідовності КЛЛ, або іншого гена (наприклад, гена, що регулює КЛЛ). Недостатня активність КЛЛ може бути також результатом впливу екологічних факторів. Даний винахід може використовуватися для лікування широкого діапазону станів у суб'єкта або пацієнта. Тому, будь-який стан, який може успішно лікуватися за допомогою застосування екзогенної КЛЛ, відповідно до винаходу, включається в об'єм винаходу. Один варіант втілення винаходу відноситься до лікування лізосомної хвороби накопичення (ЛХН), що є результатом дефіциту кислої лізосомної ліпази, конкретно - хвороби Вольмана (ХВ) і хвороби накопичення ефірів холестерину (ХНЕХ). Без бажання обмежувати винахід будь-якою конкретною теорією або будь-яким окремим механізмом дії, і ХВ і ХНЕХ можуть бути результатом мутацій у локусі КЛЛ і приводять до масивної акумуляції ліпідного матеріалу в лізосомах у ряді тканин, і до значних порушень у холестериновому й ліпідному гомеостатичних механізмах, які можуть бути вилікувані введенням екзогенної КЛЛ у відповідності зі способами даного винаходу. Таким чином, в одному варіанті втілення, дефіцит КЛЛ, який лікується відповідно до винаходу, являє собою ХВ. В іншому варіанті втілення, дефіцит КЛЛ, який лікується відповідно до винаходу, являє собою ХНЕХ. У деяких варіантах втілення, діагноз ХВ і ХНЕХ ґрунтується на генетичному аналізі (наприклад, ідентифікація функціональної мутації в послідовності, що кодує КЛЛ). В інших варіантах втілення діагноз ХВ і ХНЕХ ґрунтується на клінічних даних (наприклад, фізичне обстеження і/або лабораторні тести). У деяких варіантах втілення, екзогенна КЛЛ може використовуватись для лікування ускладнень при різних станах, таких як неалкогольна жирова хвороба печінки (НАЖХП) і неалкогольний стеатогепатит (НАСГ). НАЖХП відноситься до захворювання печінки, що має гістопатологію, подібну до гістопатології захворювання печінки, що виникає внаслідок надмірного споживання алкоголю. Вона характеризується макросудинним ожирінням, що приводить до збільшення печінки. НАЖХП може прогресувати в НАСГ, який відноситься до захворювання печінки, подібного до НАЖХП із додаванням запалення і ушкодження печінки, що може привести до фіброзу і цирозу. У деяких варіантах втілення, екзогенна КЛЛ може використовуватися для лікування станів, що включають панкреатит, наприклад, хронічний панкреатит і/або гострий панкреатит, а також ушкодження підшлункової залози, викликане алкоголем, таке як індукований алкоголем панкреатит. Екзогенна КЛЛ, вироблена будь-яким придатним способом, може використовуватись для лікування хвороб внаслідок ушкодження клітин, викликаного алкоголем, включаючи, але не обмежуючись цим, такі індуковані алкоголем ушкодження клітин, які приводять до акумуляції ліпідних ефірів у тканинах тіла, таких як, але не обмежуючись ними, печінка, селезінка, травний тракт і серцевосудинна тканина. Відповідно до винаходу, малабсорбція також може лікуватися за допомогою введення екзогенної КЛЛ. Екзогенна КЛЛ також є корисною для лікування пацієнтів з танжерською хворобою і спадкоємною гіпоальфаліпопротеїнемією. Танжерська хвороба / спадкоємна гіпоальфаліпопротеїнемія пов'язана з акумуляцією ефірів холестерину в макрофагах і супроводжується гепатоспленомегалією і/або лімфаденопатією разом з низьким рівнем ліпопротеїнів високої щільності (ЛВЩ), які можуть лікуватися за допомогою введення екзогенної КЛЛ. Наприклад, без бажання обмежувати винахід будь- якою окремою теорією або механізмом дії, знижена активність КЛЛ може привести до зниження експресії ABCA1, і навпаки, підвищена активність КЛЛ, одержана при введенні екзогенної КЛЛ пацієнту з танжерською хворобою / спадкоємною гіпоальфаліпопротеїнемією підвищить експресію ABCA1 для подолання впливів гена ABCA1 зі зниженою функціональною активністю в результаті поліморфізму. У деяких варіантах втілення, рівень активності КЛЛ у пацієнта перед лікуванням становить приблизно 1 %, приблизно 2 %, приблизно 3 %, приблизно 5 %, приблизно 10 %, приблизно 15 %, приблизно 20 %, приблизно 30 %, приблизно 40 %, приблизно 50 %, приблизно 60 %, приблизно 70 % або приблизно 80 % від нормального рівня активності КЛЛ. В одному варіанті 9 UA 109672 C2 5 10 15 20 25 30 35 40 45 50 55 60 втілення, рівень активності КЛЛ у пацієнта перед лікуванням становить приблизно 50 % або менше від нормального рівня активності КЛЛ. В одному варіанті втілення, рівень активності КЛЛ у пацієнта перед лікуванням становить приблизно 40 % або менше від нормального рівня активності КЛЛ. У деяких варіантах втілення, рівень активності КЛЛ у пацієнта перед лікуванням становить приблизно 30 % або менше від нормального рівня активності КЛЛ. В деяких варіантах втілення, рівень активності КЛЛ у пацієнта перед лікуванням становить приблизно 20 % або менше від нормального рівня активності КЛЛ. У деяких варіантах втілення, рівень активності КЛЛ у пацієнта перед лікуванням становить приблизно 10 % або менше від нормального рівня активності КЛЛ. У деяких варіантах втілення, рівень активності КЛЛ у пацієнта перед лікуванням становить приблизно 5 % або менше від нормального рівня активності КЛЛ. У деяких варіантах втілення, у пацієнта перед лікуванням не виявляється вимірюваний рівень активності КЛЛ. У деяких варіантах втілення, рівень активності КЛЛ вимірюється у фібробласті, що культивується, одержаному від пацієнта-людини, що страждає дефіцитом КЛЛ. У деяких варіантах втілення, рівень активності КЛЛ вимірюється в лімфоцитах (наприклад, лейкоцитах) пацієнта-людини, що страждає дефіцитом КЛЛ. Лімфоцити включають, але не обмежуються ними, мононуклеари периферичної крові (МНПК). Способи вимірювання описуються, наприклад, в роботах Burton і ін., (1980) Clinica Chimica Acta 101: 25-32, і в Anderson і ін., (1999) Mol. Genet. & Metab., 66: 333-345; обидва джерела включені в дану заявку у всій повноті. Пацієнти з дефіцитом КЛЛ, які одержують лікування за допомогою введення екзогенної КЛЛ, можуть демонструвати ферментну активність фібробластної КЛЛ, яка є нижчою ніж приблизно 30, приблизно 20, приблизно 10, приблизно 5, приблизно 4, приблизно 3, приблизно 2 або приблизно 1 пмоль/мг/хв при вимірюванні з використанням триолеїну як субстрату. Пацієнти з дефіцитом КЛЛ, що одержують лікування за допомогою введення екзогенної КЛЛ, можуть демонструвати ферментну активність лейкоцитної КЛЛ, яка є нижчою ніж приблизно 30, приблизно 20, приблизно 10, приблизно 5, приблизно 4, приблизно 3, приблизно 2 або приблизно 1 пмоль/мг/хв при вимірюванні з використанням триолеїну як субстрату. Пацієнти з дефіцитом КЛЛ, які одержують лікування за допомогою введення екзогенної КЛЛ, можуть демонструвати ферментну активність фібробластної КЛЛ, яка є нижчою ніж приблизно 30, приблизно 20, приблизно 10, приблизно 5, приблизно 4, приблизно 3, приблизно 2 або приблизно 1 пмоль/мг/хв при вимірюванні з використанням олеату холестерину як субстрату. Пацієнти з дефіцитом КЛЛ, якіо одержують лікування за допомогою введення екзогенної КЛЛ, можуть демонструвати ферментну активність лейкоцитної КЛЛ, яка є нижчою ніж приблизно 30, приблизно 20, приблизно 10, приблизно 5, приблизно 4, приблизно 3, приблизно 2 або приблизно 1 пмоль/мг/хв при вимірюванні з використанням олеату холестерину як субстрату. Введення екзогенної КЛЛ Винахід надає способи лікування пацієнтів-людей за допомогою екзогенної КЛЛ, що включають введення екзогенної КЛЛ пацієнту, де введення є достатнім для відновлення росту, покращення функції печінки, зниження ураження печінки, підвищення рівня КЛЛ у тканинах, і/або підвищення активності КЛЛ у пацієнта. Винахід надає ефективні й раніше неохарактеризовані частоти введення (тобто режими введення доз) екзогенної КЛЛ для лікування станів, що являють собою наслідки дефіциту КЛЛ, включаючи ХВ і ХНЕХ, а також раніше неохарактеризовані кількості доз для лікування цих станів. Винахід надає терапевтично ефективну дозу екзогенної КЛЛ, яку необхідно вводити пацієнту від одного разу кожні 5 днів до одного разу кожні 30 днів протягом періоду часу, визначеного фахівцем-практиком в галузі медичних наук. В одному варіанті втілення період часу буде періодом, що дорівнює залишку тривалості життя. В одному варіанті втілення, частота введення дози знаходиться в діапазоні від одного разу кожні 5 днів до одного разу кожні 25 днів. В одному варіанті втілення, частота введення дози знаходиться в діапазоні від одного разу кожні 5 днів до одного разу кожний 21 день. В іншому варіанті втілення, частота введення дози знаходиться в діапазоні від одного разу кожні 7 днів до одного разу кожні 14 днів. Екзогенна КЛЛ може вводитися один раз кожні 5 днів, один раз кожні 6 днів, один раз кожні 7 днів, один раз кожні 8 днів, один раз кожні 9 днів, один раз кожні 10 днів, один раз кожні 11 днів, один раз кожні 12 днів, один раз кожні 13 днів, або один раз кожні 14 днів. У деяких варіантах втілення, екзогенна КЛЛ вводиться приблизно щотижня. В інших варіантах втілення, екзогенна КЛЛ вводиться приблизно один раз на два тижні. В одному варіанті втілення, екзогенна КЛЛ вводиться один раз приблизно кожні 30 днів. Для лікування стану, як правило, кількість екзогенної КЛЛ, що вводиться, може змінюватися залежно від відомих факторів, таких як вік, здоров'я й маса реципієнта, вид одночасного лікування, частота лікування й тощо. Звичайно доза активного інгредієнта може дорівнювати від приблизно 0,01 до приблизно 50 мг на кілограм маси тіла. В одному варіанті втілення, доза 10 UA 109672 C2 5 10 15 20 25 30 35 40 45 50 55 60 екзогенної КЛЛ відповідно до винаходу становить від приблизно 0,1 мг до приблизно 0,5 мг на кілограм маси тіла. В одному варіанті втілення, доза становить від приблизно 0,1 мг до приблизно 5,0 мг на кілограм. В одному варіанті втілення, доза становить від приблизно 0,1 мг до приблизно 5,0 мг на кілограм. В одному варіанті втілення, доза становить приблизно 0,1, приблизно 0,2, приблизно 0,25, приблизно 0,30, приблизно 0,35, приблизно 0,40, приблизно 0,45, приблизно 0,50 мг на кілограм. В одному варіанті втілення, доза становить від приблизно 1 мг до приблизно 5 мг на кілограм. В одному варіанті втілення, доза становить приблизно 1 мг на кілограм. В одному варіанті втілення, доза становить приблизно 3 мг на кілограм. Наприклад, може бути введено 0,1 мг на кілограм маси тіла, 0,2 мг на кілограм маси тіла, 0,3 мг на кілограм маси тіла, 0,4 мг на кілограм маси тіла, 0,5 мг на кілограм маси тіла, 1 мг на кілограм маси тіла, 2 мг на кілограм маси тіла, 3 мг на кілограм маси тіла, 4 мг на кілограм маси тіла, або 5 мг на кілограм маси тіла. В одному варіанті втілення, доза становить від приблизно 1 мг до приблизно 20 мг на кілограм маси тіла. Винахід також включає інші дози при використанні режиму введення доз відповідно до винаходу. Наприклад, відповідно до режиму введення доз згідно з винаходом, пацієнту вводять від приблизно 0,1 мг до приблизно 50 мг на кілограм маси тіла. У деяких варіантах втілення, вводять від приблизно 0,5 до приблизно 50 мг екзогенної КЛЛ, наприклад, пацієнту з хворобою Вольмана у віці від 1 місяця до 24 місяців. В одному варіанті втілення, вік пацієнта становить менше 1 року. В іншому варіанті втілення, вік пацієнта становить менше 2 років. У деяких варіантах втілення пацієнту з хворобою Вольмана вводять приблизно 0,1 мг, приблизно 0,2 мг, приблизно 0,3 мг, приблизно 0,4 мг, приблизно 0,5 мг, приблизно 1 мг, приблизно 2 мг, приблизно 3 мг, приблизно 5 мг, приблизно 10 мг, приблизно 15 мг, приблизно 20 мг, приблизно 25 мг, приблизно 30 мг, приблизно 35 мг, приблизно 40 мг або приблизно 45 мг екзогенної КЛЛ. У деяких варіантах втілення пацієнту з хворобою Вольмана вводять від приблизно 0,5 мг до приблизно 30 мг, від приблизно 0,5 мг до приблизно 20 мг, від приблизно 0,5 мг до приблизно 10 мг, або від приблизно 0,5 мг до приблизно 5 мг. У деяких варіантах втілення, вводять від приблизно 1 мг до приблизно 30 мг, від приблизно 1 мг до приблизно 20 мг, від приблизно 1 мг до приблизно 10 мг, або від приблизно 1 мг до приблизно 5 мг. У деяких варіантах втілення пацієнту з ХНЕХ вводять від приблизно 1 мг до приблизно 350 мг екзогенної КЛЛ. Таким чином, у деяких варіантах втілення, пацієнту з ХНЕХ вводять приблизно 1,5, 10, 25, 50, 75, 100, 125, 150, 175, 200, 225, 250, 275, 300, 325, або 350 мг екзогенної КЛЛ. У деяких варіантах втілення, пацієнту з ХНЕХ вводять від приблизно 5 мг до приблизно 350 мг, від приблизно 5 мг до приблизно 300 мг, від приблизно 5 мг до приблизно 250 мг, від приблизно 5 мг до приблизно 200 мг. У деяких варіантах втілення, від приблизно 10 мг до приблизно 350 мг, від приблизно 10 мг до приблизно пацієнту з ХНЕХ вводять 300 мг, від приблизно 10 мг до приблизно 250 мг, від приблизно 10 мг до приблизно 200 мг вводиться пацієнтові з ХНЕХ. Види комбінованого лікування Лікувальні білки, що розкриваються в даній заявці, можуть бути використані в комбінації з іншими терапевтичними засобами. Винахід надає процедуру, що виконується перед лікуванням, для мінімізації або запобігання будь-яких можливих анафілактичних реакцій, які можуть відбуватись при введенні екзогенної КЛЛ відповідно до винаходу. В одному варіанті втілення, для запобігання можливої анафілактичної реакції пацієнту вводять антагоніст рецептора H-1, також відомий як антигістамінний засіб (наприклад, дифенгідрамін). В одному варіанті втілення, антагоніст рецептора H-1 вводять в дозі від приблизно 1 мг до приблизно 10 мг на кілограм маси тіла. Наприклад, антигістамінний засіб можна вводити в кількості приблизно 5 мг на кілограм. Введення антигістамінного засобу може виконуватись перед введенням екзогенної КЛЛ відповідно до винаходу. В одному варіанті втілення, антагоніст рецептора H-1 вводиться перед введенням екзогенної КЛЛ від приблизно за 10 до приблизно за 90 хвилин, наприклад, від приблизно за 30 до приблизно за 60 хвилин. Антагоніст рецептора H-1 може вводитись з використанням амбулаторної системи, приєднаної до порту судинного доступу. В одному варіанті втілення антигістамінний засіб вводять приблизно за 90 хвилин до введення екзогенної КЛЛ. В одному варіанті втілення, антигістамінний засіб вводять від приблизно 10 до приблизно 60 хвилин перед введенням екзогенної КЛЛ. В іншому варіанті втілення, антигістамінний засіб вводять від приблизно 20 до приблизно 40 хвилин перед введенням екзогенної КЛЛ. Наприклад, антигістамінний засіб може бути введений за 20, 25, 30, 35, або 40 хвилин до введення екзогенної КЛЛ. В одному варіанті втілення, антигістамінний засіб що вводиться, являє собою дифенгідрамін. Може використовуватися будь-який придатний антигістамінний засіб. Такі антигістамінні засоби включають, без обмеження, клемастин, доксиламін, лоратидин, 11 UA 109672 C2 5 10 15 20 25 30 35 40 45 50 55 60 деслоратидин, фексофенадин, фенірамін, цетиризин, ебастин, прометазин, хлорфенамін, левоцетиризин, олопатадин, кветіапін, меклізин, дименгідринат, ембрамін, диметиден і дексхлорфенірамін. В одному варіанті втілення, антигістамінний засіб вводять в дозі від приблизно 0,1 мг до приблизно 10 мг на кілограм маси тіла. В одному варіанті втілення, антигістамінний засіб вводять в дозі від приблизно, 1 мг до приблизно 5 мг на кілограм маси тіла. Наприклад, доза може становити 1 мг, 2 мг, 3 мг, 4 мг або 5 мг на кілограм маси тіла. Антигістамінний засіб може вводитися будь-яким придатним способом. В одному варіанті втілення антигістамінний засіб вводять внутрішньовенно. В іншому варіанті втілення, антигістамінний засіб вводять у фармацевтично прийнятних капсулах. В іншому варіанті втілення, при внутрішньовенному вливанні, імовірність анафілактичної реакції може бути знижена за допомогою введення препаратів з застосуванням протоколу лінійного наростання. У цьому контексті, протокол лінійного наростання відноситься до повільного підвищення швидкості вливання препарату під час вливання для зниження чутливості пацієнта до вливання препарату. Імунодепресанти, такі як, але не обмежуючись ними, антигістаміннні засоби, кортикостероїди, сиролімус, воклоспорин, циклоспорин, метотрексат, направлені антитіла рецептора IL-2, направлені антитіла рецептора T-клітини, направлені антитіла ФНП-альфа або складені білки (наприклад, інфліксимаб, етанерцепт або адалімумаб), антиген 4 цитотоксичних Т лімфоцитів (CTLA-4-Ig) (наприклад, абатацепт), антитіла анти-OX-40 можуть бути також введені перед, під час або після введення екзогенної КЛЛ, наприклад, якщо у пацієнта очікується або була анафілактична реакція або несприятлива імунна реакція. Винахід також охоплює лікування, що включає введення композицій, які містять екзогенну КЛЛ у комбінації з однією або більшою кількістю речовин, що знижують рівень холестерину (наприклад, інгібітори редуктази 3-гідрокси-3-метилглутарил-коферменту A). Приклади таких ® ® речовин, що не носять обмежувальний характер, включають: аторвастатин (Lipitor і Torvast ), ® ® ® ® ® ® флувастатин (Lescol ), ловастатин (Mevacor , Altocor , Altoprev ), правастатин (Livalo , Pitava ), ® ® ® ® ® правастатин (Pravachol , Selektine , Lipostat ), розувастатин (Crestor ), і симвастатин (Zocor , ® Lipex ). Ефекти введення екзогенної КЛЛ Даний винахід передбачає корекцію або нормалізацію проявів, що відносяться до захворювання після лікування шляхом введення екзогенної КЛЛ. Клінічний перебіг (тобто покращення стану) після введення КЛЛ можна контролювати, використовуючи відповідний спосіб або відповідну процедуру. У деяких варіантах втілення, введення екзогенної КЛЛ є достатнім для досягнення значення Cmax від приблизно 200 нг/мл до приблизно 1500 нг/мл. У деяких варіантах втілення, введення екзогенної КЛЛ є достатнім для досягнення значення Cmax від приблизно 200 нг/мл до приблизно 1000 нг/мл. У деяких варіантах втілення, введення екзогенної КЛЛ є достатнім для досягнення значення Cmax від приблизно 200 нг/мл до приблизно 800 нг/мл. У деяких варіантах втілення, введення екзогенної КЛЛ є достатнім для досягнення значення Cmax приблизно 200 нг/мл, приблизно 300 нг/мл, приблизно 400 нг/мл, приблизно 500 нг/мл, приблизно 600 нг/мл, приблизно 700 нг/мл, приблизно 800 нг/мл, приблизно 900 нг/мл, приблизно 1000 нг/мл, приблизно 1250 нг/мл, або приблизно 1500 нг/мл. У деяких варіантах втілення, Cmax досягається під час вливання. У деяких варіантах втілення, введення екзогенної КЛЛ є достатнім для досягнення періоду напіввиведення (t1/2) КЛЛ менше 40 хвилин. У деяких варіантах втілення, введення екзогенної КЛЛ є достатнім для досягнення періоду напіввиведення (t1/2) КЛЛ менше 30 хвилин. У деяких варіантах втілення, введення екзогенної КЛЛ є достатнім для досягнення періоду напіввиведення (t1/2) КЛЛ менше 20 хвилин. У деяких варіантах втілення, введення екзогенної КЛЛ є достатнім для досягнення періоду напіввиведення (t1/2) КЛЛ менше 15 хвилин. У деяких варіантах втілення, введення екзогенної КЛЛ є достатнім для досягнення періоду напіввиведення (t1/2) КЛЛ менше10 хвилин. У деяких варіантах втілення, введення екзогенної КЛЛ є достатнім для досягнення періоду напіввиведення (t1/2) КЛЛ приблизно 6, 7, 8,9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25,30,35 або 40 хвилин. У деяких варіантах втілення, екзогенна КЛЛ підвищує активність КЛЛ у пацієнта. Активність КЛЛ може бути підвищена, наприклад, у печінці, селезінці, лімфатичних вузлах, аорті, лейкоцитах периферичної крові, і / або фібробластах шкіри. У деяких варіантах втілення, активність КЛЛ вимірюється в екстрактах лімфоцитів, ізольованих із зразків крові. Екзогенна КЛЛ може підвищити активність КЛЛ у, щонайменше, приблизно 1,5, приблизно 2, приблизно 2,5, приблизно 3, приблизно 4, приблизно 5, приблизно 6, приблизно 7, приблизно 8, 12 UA 109672 C2 5 10 15 20 25 30 35 40 45 50 55 60 приблизно 9, приблизно 10, приблизно 15 або приблизно 20 разів у порівнянні з активністю перед введенням КЛЛ. Екзогенна КЛЛ може підвищити активність КЛЛ у, щонайменше, приблизно 10, приблизно 11, приблизно 12, приблизно 13, приблизно 14, приблизно 15, приблизно 16, приблизно 17, приблизно 18, приблизно 19, приблизно 20 разів у порівнянні з активністю перед введенням КЛЛ. Активність КЛЛ може бути оцінена, використовуючи способи, відомі в цій галузі техніки, включаючи, наприклад, аналізи, з використанням субстратів 14 14 холестерил [l- C]олеату, триолеїну (гліцерин три [l- C]олеат), р-нітрофеніл міристат або 4-МУО (4 метилумбеліферил олеат). В одному варіанті втілення, об'єм і характеристику органа й тканин і використовують для визначення покращення стану після введення екзогенної КЛЛ відповідно до винаходу. В одному варіанті втілення, клінічний перебіг для функції / ураження печінки після введення екзогенної КЛЛ контролюється в часі за допомогою кількісного визначення трансаміназ крові, таких як аспартатамінтотрансфераза (АСТ) і / або аланінамінотрансфераза (АЛТ), і / або інших біомаркерів, таких як альбумін, лужна фосфатаза і білірубін (прямій і загальний). В одному варіанті втілення, клінічний перебіг контролюється з використанням технології одержання зображення. Наприклад, і без обмеження, технологія одержання зображення може включати ультразвук, КТ-сканування, магніторезонансне зображення і ядерну магніторезонансну спектроскопію. У деяких варіантах втілення, введення екзогенної КЛЛ в дозах, описуваних у даній заявці, є достатнім для відновлення росту і/або збільшення маси тіла пацієнтів-людей. Введення екзогенної КЛЛ також може підвищувати швидкість росту (тобто збільшення маси тіла) немовлят або дітей, що страждають від дефіциту КЛЛ із раннім початком. Наприклад, введення екзогенної КЛЛ може підвищити швидкість збільшення маси тіла, щонайменше, приблизно на 10 %, приблизно на 20 %, приблизно на 30 %, приблизно на 40 %, приблизно на 50 %, приблизно на 60 %, приблизно на 70 %, приблизно на 80 %, приблизно на 90 %, приблизно на 100 %, приблизно на 200 %, приблизно на 300 %, приблизно на 400 % або приблизно на 500 % порівняно із швидкістю росту, спостережуваною перед введенням. У деяких варіантах втілення, введення екзогенної КЛЛ відновлює нормальну швидкість росту у дітей, що страждають від дефіциту КЛЛ із раннім початком (наприклад, хворобою Вольмана), у віці від приблизно 1 місяця до приблизно 24 місяців. Термін "нормальна" у цьому контексті відноситься до нормальної швидкості росту для пацієнтів, що одержали лікування, визначене фахівцемпрактиком в галузі медичних наук. В одному варіанті втілення, наприклад, при лікуванні ХВ і ХНЕХ або інших проявів дефіциту КЛЛ, гепатомегалія значно слабшає при поверненні розміру печінки до розміру, що перевищує нормальний розмір на величину від приблизно 1 % до приблизно 60 %. Термін "нормальний" у цьому контексті відноситься до печінки нормального розміру у пацієнта, що одержав лікування, обумовлене фахівцем-практиком в галузі медичних наук. В одному варіанті втілення, розмір печінки зменшується до величини, що перевищує нормальний розмір на величину від приблизно 1 % до приблизно 50 %. В іншому варіанті втілення, розмір печінки зменшується до величини, що перевищує нормальний розмір на величину від приблизно 1 % до приблизно 40 %. В одному варіанті втілення, розмір печінки зменшується до величини, що перевищує нормальний розмір на величину від приблизно 1 % до приблизно 30 %. В іншому варіанті втілення, розмір печінки зменшується до величини, що перевищує нормальний розмір на величину від приблизно 1 % до приблизно 20 %. В іншому варіанті втілення, розмір печінки зменшується до величини, що перевищує нормальний розмір на величину від приблизно 10 % до приблизно 20 %. Наприклад, розмір печінки може бути на 10 %, 11 %, 12 % 13 % 14 %, 15 %, 16 %, 17 %, 18 %, 19 %, або 20 % більше за нормальний розмір. У ще одному варіанті втілення, розмір печінки зменшується до величини, що перевищує нормальний розмір на величину від приблизно 0 % до приблизно 10 %. Наприклад, розмір печінки може бути на 0 %, 1 %, 2 %, 3 %, 4 %, 5 %, 6 %, 7 %, 8 %, 9 %, або 10 % більше нормального розміру печінки. Лікування за допомогою екзогенної КЛЛ може також покращити функцію печінки. Так, у деяких варіантах втілення, лікування за допомогою екзогенної КЛЛ є достатнім для відновлення нормальної функції печінки і/або нормалізації печінкових тестів. У деяких варіантах втілення, лікування за допомогою екзогенної КЛЛ є достатнім для зниження рівнів печінкових трансаміназ у сироватці крові, наприклад, щонайменше, приблизно на 20 %, приблизно на 30 %, приблизно на 40 %, приблизно на 50 %, приблизно на 60 %, приблизно на 70 %, приблизно на 80 %, і/ або, щонайменше, приблизно на 90 %. В одному варіанті втілення, лікування за допомогою екзогенної КЛЛ є достатнім для зниження рівнів печінкових трансаміназ у сироватці крові, щонайменше, приблизно на 40 %. В одному варіанті втілення, лікування за допомогою екзогенної КЛЛ є достатнім для зниження рівнів печінкових трансаміназ у сироватці крові, 13 UA 109672 C2 5 10 15 20 25 30 35 40 45 50 55 щонайменше, приблизно на 50 %. В одному варіанті втілення, лікування за допомогою екзогенної КЛЛ є достатнім для зниження рівнів печінкових трансаміназ у сироватці крові, щонайменше, приблизно на 60 %. В одному варіанті втілення, лікування за допомогою екзогенної КЛЛ є достатнім для зниження рівнів печінкових трансаміназ у сироватці крові, щонайменше, приблизно на 70 %. В одному варіанті втілення, лікування за допомогою екзогенної КЛЛ є достатнім для зниження рівнів печінкових трансаміназ у сироватці крові, щонайменше, приблизно на 80 %. В одному варіанті втілення, лікування за допомогою екзогенної КЛЛ є достатнім для зниження рівнів печінкових трансаміназ у сироватці крові, щонайменше, на приблизно 90 %. У деяких варіантах втілення, печінкова трансаміназа являє собою аланінамінотрансферазу (АЛТ). В одному варіанті втілення, введення екзогенної КЛЛ є достатнім для зниження рівня сироваткової АЛТ. Наприклад, введення екзогенної КЛЛ може знизити рівень сироваткової АЛТ, наприклад, щонайменше, приблизно на 50 %, 60 %, 70 %, 80 % або 90 %. Рівень сироваткової АЛТ може слугувати для індикації ступеня ураження печінки. Таким чином, даний винахід також розглядає способи зниження ступеня ураження печінки у пацієнта-людини, який страждає дефіцитом КЛЛ, за допомогою введення ефективної кількості екзогенної КЛЛ для зниження рівня сироваткової АЛТ. У деяких варіантах втілення, печінкова трансаміназа являє собою аспартатамінтотрансферазу (АСТ). В одному варіанті втілення, введення екзогенної КЛЛ є достатнім для зниження рівня сироваткової АСТ. Наприклад, введення екзогенної КЛЛ може знизити рівень сироваткової АСТ, наприклад, щонайменше, приблизно на 50 %, 60 %, 70 %, 80 % або 90 %. Рівень сироваткової АСТ може слугувати для індикації ступеня ураження печінки. Відповідно, даний винахід також розглядає спосіб зниження ступеня ураження печінки у пацієнта, що страждає дефіцитом КЛЛ, за допомогою введення ефективної кількості екзогенної КЛЛ для зниження рівня сироваткової АСТ. У деяких варіантах втілення, лікування за допомогою екзогенної КЛЛ може знизити рівень феритину сироватки. Так, у деяких варіантах втілення, лікування за допомогою екзогенної КЛЛ є достатнім для зниження рівня феритину сироватки, наприклад, щонайменше, приблизно на 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, 90 %, або 95 % у порівнянні з рівнем до лікування. В одному варіанті втілення, лікування за допомогою екзогенної КЛЛ є достатнім для зниження рівня феритину сироватки, щонайменше, приблизно на 50 %. В іншому варіанті втілення, лікування за допомогою екзогенної КЛЛ є достатнім для зниження рівня феритину сироватки, щонайменше, приблизно на 60 %. В одному варіанті втілення, лікування за допомогою екзогенної КЛЛ є достатнім для зниження рівня феритину сироватки, щонайменше, приблизно на 70 %. В одному варіанті втілення, лікування за допомогою екзогенної КЛЛ є достатнім для зниження рівня феритину сироватки, щонайменше, приблизно на 80 %. В одному варіанті втілення, лікування за допомогою екзогенної КЛЛ є достатнім для зниження рівня феритину сироватки, щонайменше, приблизно на 90 %. В одному варіанті втілення, лікування за допомогою екзогенної КЛЛ є достатнім для зниження рівня феритину сироватки, щонайменше, приблизно на 95 %. В одному варіанті втілення, наприклад, при лікуванні ХВ і ХНЕХ або інших проявів дефіциту КЛЛ, спленомегалія значно зменшується з поверненням розміру селезінки до розміру, що перевищує нормальний розмір на величину від приблизно 1 % до приблизно 60 %. Термін "нормальний" у цьому контексті відноситься до селезінки нормального розміру у пацієнта, що одержав лікування, визначене фахівцем-практиком в галузі медичних наук. В одному варіанті втілення, розмір селезінки зменшується до величини, що перевищує нормальний розмір на величину від приблизно 1 % до приблизно 50 %. В іншому варіанті втілення, розмір селезінки зменшується до величини, що перевищує нормальний розмір на величину від приблизно 1 % до приблизно 40 %. В одному варіанті втілення, розмір селезінки зменшується до величини, що перевищує нормальний розмір на величину від приблизно 1 % до приблизно 30 %. В іншому варіанті втілення, розмір селезінки зменшується до величини, що перевищує нормальний розмір на величину від приблизно 1 % до приблизно 20 %. %. В іншому варіанті втілення, розмір селезінки зменшується до величини, що перевищує нормальний розмір на величину від приблизно 10 % до приблизно 20 %. Наприклад, розмір печінки може бути на 10 %, 11 %, 12 % 13 % 14 %, 15 %, 16 %, 17 %, 18 %, 19 % або 20 % більше нормального розміру. У ще одному варіанті втілення, розмір селезінки зменшується до величини, що перевищує нормальний розмір на величину від приблизно 0 % до приблизно 10 %. Наприклад, розмір селезінки може бути на 0 %, 1 %, 2 %, 3 %, 4 %, 5 %, 6 %, 7 %, 8 %, 9 % або 10 % більше нормального розміру селезінки. 14 UA 109672 C2 5 10 15 20 25 30 35 40 45 50 55 60 В одному варіанті втілення, введення екзогенної КЛЛ є достатнім для зниження лімфаденопатії (тобто збільшених лімфатичних вузлів). Так, у деяких варіантах втілення, розмір лімфовузлів зменшується до розміру, що перевищує нормальний розмір на величину від приблизно 1 % до приблизно 60 %. Термін "нормальний" у цьому контексті відноситься до лімфатичних вузлів нормального розміру у пацієнта, що одержав лікування, визначене фахівцем-практиком в галузі медичних наук. В одному варіанті втілення, розмір лімфовузлів зменшується до величини, що перевищує нормальний розмір на величину від приблизно 1 % до приблизно 50 %. В іншому варіанті втілення, розмір лімфовузлів зменшується до величини, що перевищує нормальний розмір на величину від приблизно 1 % до приблизно 40 %. В одному варіанті втілення, розмір лімфовузлів зменшується до величини, що перевищує нормальний розмір на величину від приблизно 1 % до приблизно 30 %. В іншому варіанті втілення, розмір лімфовузлів зменшується до величини, що перевищує нормальний розмір на величину від приблизно 1 % до приблизно 20 %. В іншому варіанті втілення, розмір лімфовузлів зменшується до величини, що перевищує нормальний розмір на величину від приблизно 10 % до приблизно 20 %. Наприклад, розмір лімфатичних вузлів може бути на 10 %, 11 %, 12 % 13 % 14 %, 15 %, 16 %, 17 %, 18 %, 19 % або 20 % більше нормального розміру. У ще одному варіанті втілення, розмір лімфатичних вузлів зменшується до величини, що перевищує нормальний розмір на величину від приблизно 0 % до приблизно 10 %. Наприклад, розмір лімфатичних вузлів може бути на 0 %, 1 %, 2 %, 3 %, 4 %, 5 %, 6 %, 7 %, 8 %, 9 % або 10 % більше нормального розміру лімфатичних вузлів. Віншому варіанті втілення, виконується ліпідний аналіз для контролю покращення стану. Наприклад, ліпідний аналіз може бути виконаний для оцінки терапевтичного ефекту екзогенної КЛЛ. Ліпідний аналіз може проводитись для зразка тканини пацієнта (наприклад, зразка крові, зразок біопсії печінки) будь-яким придатним способом, таким як, але не обмежуючись цим, високоефективна рідинна хроматографія, газова хроматографія, масспектроскопія або тонкошарова хроматографія, або будь-яка комбінація цих способів, яку фахівці в даній галузі вважають прийнятною. В одному варіанті втілення, ліпідний аналіз, виконуваний відповідно до винаходу, демонструє рівень загального холестерину, тригліцеридів, ліпопротеїнів низкої щільності, ліпопротеїнів високої щільності й/або ефіру холестерину. В одному варіанті втілення, наприклад, при лікуванні ХВ і ХНЕХ або інших проявів дефіциту КЛЛ, ліпідний аналіз пацієнта, що одержує лікування відповідно до винаходу, показує нормалізацію концентрації ліпідів у печінці, селезінці, кишковому тракті, лімфатичних вузлах і/або аорті, як може бути визначене фахівцем-практиком в галузі медичних наук. Рівень ліпіду може бути оцінений з використанням ліпідного аналізу плазми або ліпідного аналізу тканини. При ліпідному аналізі плазми, може бути відібрана плазма крові, і рівень загального холестерину в плазмі може бути виміряний, використовуючи, наприклад, колорометричний аналіз за допомогою набору COD-PAP (Wako Chemicals), загальні тригліцериди в плазмі можуть бути виміряні, використовуючи, наприклад, набір Triglycerides/GB (Boehringer Mannheim), і/або загальний холестерин у плазмі може бути визначений, використовуючи, набір Cholesterol/HP (Boehringer Mannheim). В ліпідному аналізі тканини, ліпіди можуть бути екстраговані, наприклад, з печінки, селезінки, і/або невеликих зразків кишкового тракту (наприклад, використовуючи спосіб Фольша, представлений в роботі Folch і ін. J. Biol. Chem 226: 497-505 (1957)). Концентрацію загального холестерину в тканині можна виміряти, наприклад, використовуючи O- фталевий альдегід. У деяких варіантах втілення, введення екзогенної КЛЛ є достатнім для покращення поглинання поживних речовин. В одному варіанті втілення, введення екзогенної КЛЛ покращує поглинання поживних речовин, як показують виміряні рівні сироваткового альфа-токоферолу, 25ОН вітаміну D, сироваткового ретинолу, дидегідроретинолу або транстиретину. У деяких варіантах втілення, наприклад, при лікуванні ХВ і ХНЕХ або інших проявів дефіциту КЛЛ, введення екзогенної КЛЛ є достатнім для підвищення рівня сироваткового гемоглобіну (Hb). В одному варіанті втілення, рівень гемоглобіну підвищується, щонайменше на приблизно від 10 % до приблизно 20 % у порівнянні з рівнем, спостережуваним до введення екзогенної КЛЛ. У деяких варіантах втілення, екзогенна КЛЛ може вводитись, використовуючи способи для мінімізації побічних ефектів. Наприклад, введення екзогенної КЛЛ може мінімізувати імунну реакцію на екзогенну КЛЛ. КЛЛ і лікарські композиції, що включають екзогенну КЛЛ Даний винахід розглядає лікування будь-якого із пов'язаних з дефіцитом КЛЛ станів, описаних у даній заявці, і інших станів, що раніше не згадувалися, але які можуть бути покращені при лікуванні. Екзогенна КЛЛ, використовувана відповідно до винаходу, включає рекомбінантну КЛЛ, яка може бути вироблена в будь-якій придатній системі експресії білка, 15 UA 109672 C2 5 10 15 20 25 30 35 40 45 50 55 60 включаючи, без обмеження, клітинну культуру, (наприклад, клітини CHO, клітини COS), бактерії, такі як кишкова паличка, трансгенні тварини, такі як ссавці й птахи (наприклад, курка, качка й індик), і рослинні системи (наприклад, ряска й тютюн). Один аспект винаходу відноситься до рекомбінантної КЛЛ, виробленої відповідно до патенту США № 7524626, виданому 3 жовтня 2006 р.; заявок на патент США № 11/973853, поданої 10 жовтня 2007 р.; № 11/978360, поданої 29 жовтня 2007 р.; і 12/319396, поданої 7 січня 2009 р., розкриття яких включені в дану заявку у всій повноті шляхом посилання. Один аспект винаходу відноситься до рекомбінантної КЛЛ, виробленої відповідно до опису в роботі Du і ін., (2005) Am. J. Hum. Genet. 77: 1061-1074, і Du і ін., (2008) J. Lipid Res., 49: 1646-1657, розкриття яких включені в дану заявку у всій повноті шляхом посилання. В одному корисному варіанті втілення, екзогенна КЛЛ виробляється в яйцепроводі трансгенного птаха (наприклад, трансгенної курки), наприклад, у відповідності зі способом, описаним у заявці PCT/US2011/033699, поданій 23 квітня 2011 р., яка включена в дану заявку у всій повноті шляхом посилання. У деяких варіантах втілення, рекомбінантна КЛЛ виробляється в клітинній лінії птахів. У деяких варіантах втілення, рекомбінантна КЛЛ виробляється в клітинній лінії ссавців (наприклад, людини). В одному варіанті втілення, екзогенна кисла лізосомна ліпаза, використовувана відповідно до винаходу, містить глікани, що мають основний N- ацетилглюкозамін (GlcNAc) і завершені структури манози з N-зв'язками. GlcNAc і завершені глікани манози на екзогенній КЛЛ можуть бути конкретно розпізнані й інтерналізовані макрофагами й фібробластом. Манози-6-фосфат (M6P), який може доставляти білки до рецепторів GlcNAc/манози, які експресуються на клітинах при станах, що виліковуються за допомогою введення екзогенної КЛЛ, також звичайно є присутнім на екзогенній КЛЛ, використовуваної відповідно до винаходу. Звичайно, екзогенна КЛЛ відповідно до винаходу, що описується і розкривається в даній заявці, являє собою КЛЛ людини. В одному варіанті втілення, екзогенна КЛЛ має амінокислотну послідовність, представлену в генетичному банку Genbank RefSeq NM_000235.2). В одному варіанті втілення, зріла екзогенна КЛЛ має наступну амінокислотну послідовність: SGGKLTAVDPETNMNVSEIISYWGFPSEEYLVETEDGYILCLNRIPHGRKN HSDKGPKPVVFLQHGLLADSSNWVTNLANSSLGFILADAGFDVWMGNSR GNTWSRKHKTLSVSQDEFWAFSYDEMAKYDLPASINFILNKTGQEQVYY VGHSQGTTIGFIAFSQIPELAKRIKMFFALGPVASVAFCTSPMAKLGRLPD HLIKDLFGDKEFLPQSAFLKWLGTHVCTHVILKELCGNLCFLLCGFNERN LNMSRVDVYTTHSPAGTSVQNMLHWSQAVKFQKFQAFDWGSSAKNYF HYNQSYPPTYNVKDMLVPTAVWSGGHDWLADVYDVNILLTQITNLVFH ESIPEWEHLDFIWGLDAPWRLYNKIINLMRKYQ (SEQ ID NO:1) У деяких варіантах втілення, екзогенна КЛЛ містить амінокислоти 1-378 SEQ ID NO:1, aмінокислоти 3-378 SEQ ID NO:1, амінокислоти 6-378 SEQ ID NO:1, або амінокислоти 7-378 SEQ ID NO: 1. У деяких варіантах втілення, екзогенна КЛЛ містить суміш із, щонайменше, двох поліпептидів, вибраних із групи, що складається з амінокислот 1-378 SEQ ID NO:1, амінокислот 3-378 SEQ ID NO:1, амінокислот 6-378 SEQ ID NO:1 і амінокислот 7-378 SEQ ID NO:1. У деяких варіантах втілення, екзогенна КЛЛ містить суміш із поліпептидів, що включають амінокислоти 1378 SEQ ID NO:1, поліпептидів, що включають амінокислоти 3-378 SEQ ID NO: 1, і поліпептидів, що включають амінокислоти 6-378 SEQ ID NO: 1. В інших варіантах втілення, екзогенна КЛЛ містить поліпептид, ідентичний амінокислотам 1-378 SEQ ID NO:1, амінокислотам 3-378 SEQ ID NO:1, амінокислотам 6-378 SEQ ID NO:1 або амінокислотам 7-378 SEQ ID NO:1. В інших варіантах втілення, екзогенна КЛЛ містить поліпептид, який, щонайменше, приблизно на 70 %, приблизно на 75 %, приблизно на 80 %, приблизно на 85 %, приблизно на 90 %, приблизно на 95 %, приблизно на 96 %, приблизно на 97 %, приблизно на 98 % або приблизно на 99 % ідентичний амінокислотам 1-378 SEQ ID NO:1, амінокислотам 3-378 SEQ ID NO:1, амінокислотам 6-378 SEQ ID NO:1 або амінокислотам 7-378 SEQ ID NO:1. У деяких варіантах втілення, екзогенна КЛЛ містить поліпептид, що є функціональним фрагментом SEQ ID NO:1 або, щонайменше, приблизно на 70 %, приблизно на 75 %, приблизно на 80 %, приблизно на 85 %, приблизно на 90 %, приблизно на 95 %, приблизно на 96 %, приблизно на 97 %, приблизно на 98 % або приблизно на 99 % є ідентичним функціональному фрагменту SEQ ID NO:1. У деяких варіантах втілення, екзогенна КЛЛ являє собою білок рекомбінантної КЛЛ, описаний у заявці PCT/US2011/033699, поданій 23 квітня 2011 р., яка включена в дану заявку у всій повноті шляхом посилання. Виявлено, що позиції неідентичних амінокислот часто відрізняються за консервативним заміщенням амінокислоти, де амінокислотні залишки заміщуються іншими амінокислотними залишками з подібними хімічними властивостями (наприклад, заряд або гідрофобність) і, тому, 16 UA 109672 C2 5 10 15 20 25 30 35 40 45 50 55 60 не змінюють функціональні властивості молекули. Там де послідовності відрізняються за консервативними заміщеннями, відносна ідентичність послідовності може регулюватись збільшенням для корекції консервативної природи заміщення. Засоби виконання такого регулювання добре відомі фахівцям у цій галузі техніки. Кількісна оцінка консервативного заміщення може бути виконана обчисленням відповідно до, наприклад, алгоритму Мейєра і Міллера, Meyers і Millers, Computer Applic. Biol. Sci. 4:11-17 (1988). Термін "вікно порівняння" відноситься до сегмента суміжних позицій, таких як від приблизно 25 до приблизно 400 позицій, або від приблизно 50 до приблизно 200 позицій, або від приблизно 100 до приблизно 150 позицій, за якими послідовність можна порівняти з еталонною послідовністю з таким же числом суміжних позицій після оптимального вирівнювання двох послідовностей. Способи вирівнювання послідовностей для порівняння добре відомі в цій галузі техніки. Оптимальне вирівнювання послідовностей для порівняння може бути виконане, наприклад, відповідно до алгоритму локальної гомології (Smith і Waterman, Adv. Appl. Math. 2:482 (1981), алгоритму глобального вирівнювання (Needleman і Wunsch, J. Mol. Biol. 48:443 (1970), пошуком способів подібності (Pearson і Lipman, Proc. Natl. Acad. Sci. U.S.A. 85:2444 (1988); Altschul і ін., Nucl. Acids Res. 25:3389-402 (1997), за допомогою комп'ютерного здійснення цих алгоритмів (наприклад, GAP, BESTFIT, FASTA і BLAST у пакеті програмного забезпечення Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Dr., 30 Madison, Wis.), звичайно використовуючи настроювання за замовчуванням, або шляхом ручного вирівнювання і візуального контролю (див., наприклад Current Protocols in Molecular Biology, Ausubel і ін., 1994). Наприклад, пошуки білка BLAST можуть бути виконані, використовуючи програму XBLAST, мітка = 50, довжина слова = 3, для одержання амінокислотних послідовностей, які більш ніж на 80 % ідентичні амінокислотній послідовності SEQ ID NO:1 або її фрагменту. Одним прикладом придатного здійснення алгоритму є PILEUP. PILEUP створює множинне вирівнювання послідовності із групи споріднених послідовностей, використовуючи прогресивні парні вирівнювання. Програма також може будувати дендограму, що показує кластерні співвідношення, використовувані для створення вирівнювання. PILEUP використовує спрощення способу прогресивного вирівнювання Feng і Doolittle, J. Mol. Evol. 35:351-360 (1987). Використовуваний спосіб подібний до способу, описаного у роботі Higgins і Sharp, CABIOS 5:151-3 (1989). Процедура множинного вирівнювання починається з парного вирівнювання двох найбільш подібних послідовностей, що утворюють кластер двох сполучених послідовностей. Цей кластер потім може бути вирівняний з наступною найбільш спорідненою послідовністю або із кластером двох вирівняних послідовностей. Два кластери послідовностей можуть бути вирівняні простим додаванням парного вирівнювання двох індивідуальних послідовностей. Серія таких парних вирівнювань, яка включає послідовності зі зростаючою несхожістю за кожної ітерації, продукує остаточне вирівнювання. У деяких варіантах втілення, поліпептиди екзогенної КЛЛ відповідно до винаходу включають варіанти послідовностей дикого типу. Ці варіанти попадають в один або більше із трьох класів: заміщуючий, інсерційний і делеційний варіанти. Ці варіанти можуть являти собою алельні або міжвидові варіанти природнього походження, або вони можуть бути виготовлені за допомогою сайт-специфічного мутагенезу нуклеотидів у білку, що кодує ДНК. Сайт-специфічний мутагенез може бути виконаний, використовуючи касету або мутагенез ПЛР або інші способи, добре відомі в цій галузі техніки, для виробництва ДНК, що кодує варіант, і, після цього, експресуючи ДНК у рекомбінантній клітинній культурі. Фрагменти цільового білка варіанта, що містять до 100-150 амінокислотних залишків, можуть бути виготовлені за допомогою in vitro синтезу, використовуючи прийняті способи. Таблиці консервативного заміщення, що містять функціонально подібні амінокислоти, добре відомі в цій галузі техніки (Henikoff і Henikoff, Proc. Natl. Acad. Sci. U.S.A. 89:10915-10919 (1992)). Амінокислотні заміщення звичайно виконуються для одиночних залишків. Вставки звичайно виконуються для приблизно від 1 до приблизно 20 амінокислот, хоча значно довші вставки припустимі. Діапазон делецій становить від приблизно 1 до приблизно 20 залишків, хоча в деяких випадках, делеції можуть бути набагато довшими. Заміщення, делеції й вставки або їх будь-які комбінації можуть використовуватися для досягнення остаточної похідної. У деяких варіантах втілення, екзогенна КЛЛ має питому активність, що дорівнює, щонайменше, приблизно 100 О/мг. У деяких варіантах втілення, екзогенна КЛЛ має питому активність, що дорівнює, щонайменше, приблизно 200 О/мг. У деяких варіантах втілення, екзогенна КЛЛ має питому активність, що дорівнює, щонайменше, приблизно 250 О/мг. У деяких варіантах втілення, екзогенна КЛЛ має питому активність від приблизно 100 О/мг до приблизно 1000 О/мг. У деяких варіантах втілення, екзогенна КЛЛ має питому активність від приблизно 100 17 UA 109672 C2 5 10 15 20 25 30 35 40 45 50 55 60 О/мг до приблизно 500 О/мг. У деяких варіантах втілення, екзогенна КЛЛ має питому активність від приблизно 100 О/мг до приблизно 350 О/мг. У деяких варіантах втілення, екзогенна КЛЛ має питому активність від приблизно 200 О/мг до приблизно 350 О/мг. У деяких варіантах втілення, екзогенна КЛЛ має питому активність від приблизно 250 О/мг до приблизно 350 О/мг. У деяких варіантах втілення, екзогенна КЛЛ має питому активність, що дорівнює приблизно 250 О/мг. У деяких варіантах втілення, екзогенна КЛЛ має питому активність, що дорівнює приблизно 275 О/мг. У деяких варіантах втілення, екзогенна КЛЛ має питому активність, що дорівнює приблизно 300 О/мг. КЛЛ людини має 6 потенційних сайтів у своїй амінокислотній послідовності для глікозилювання з N-зв'язками: Asn36, Asn72, Asn101, Asn161, Asn273, і Asn321, як сформульовано в SEQ ID NO: 1. У деяких варіантах втілення, щонайменше, 1, 2, 3, 4, або 5 із сайтів глікозилювання з N-pв'язками глікозилюються. У деяких варіантах втілення, всі шість сайтів глікозилювання глікозилюються. У деяких варіантах втілення, Asn36, Asn101, Asn161, Asn273 і Asn321 глікозилюються. У деяких варіантах втілення, Asn36, Asn101, Asn161, Asn273 і Asn321 глікозилюються, а Asn72 не глікозилюється. У деяких варіантах втілення, N-гліканові структури містять бі-, три й тетраантенальні структури з N- ацетилглюкозаміном(GlcNAc), манозою, і / або маноза-6-фосфатом (M6P). У деяких варіантах втілення, екзогенна КЛЛ містить M6 P-модифіковані N-глікани біля Asn101, Asn161 і Asn273. У деяких варіантах втілення, екзогенна КЛЛ не містить глікани з O-зв'язками. У деяких варіантах втілення, екзогенна КЛЛ не містить сіалову кислоту. У деяких варіантах втілення, екзогенна КЛЛ має профіль глікозилювання, як описано в заявці PCT/US2011/033699, поданій 23 квітня 2011 р., яка включена в дану заявку у всій повноті шляхом посилання. У деяких варіантах втілення, молекулярна маса екзогенної КЛЛ дорівнює приблизно 55 кД. У окремих варіантах втілення, при лікуванні суб'єкта може застосовуватись молекула нуклеїнової кислоти, що кодує екзогенну КЛЛ, наприклад, у векторі. Дози нуклеїнових кислот, що кодують поліпептиди, знаходяться у діапазоні від приблизно 10 нг до 1 г, від 100 нг до 100 мг, від 1 мкг до 10 мг, або 30-300 мкг ДНК на пацієнта. Дози для інфекційних вірусних векторів змінюються від 10 до 100 або більше віріонів на дозу. У деяких варіантах втілення даного винаходу, екзогенна КЛЛ вводиться у відповідності зі способом лікування, який включає: (1) трансформацію або трансфекцію клітини-хазяїна, що імплантується, з нуклеїнової кислотою, наприклад, вектором, який експресує КЛЛ або активним фрагментом, варіантом, або їх похідною; і (2) імплантацію трансформованої клітини-хазяїна в ссавця. У деяких варіантах втілення винаходу, клітина-хазяїн, що імплантується добувають із ссавця, тимчасово культивується, трансформується або трансфекується з ізольованої нуклеїновою кислотою, що кодує екзогенну КЛЛ, і знову імплантується в того ж самого ссавця, з якого її добули. Клітина може бути добута з того ж сайту, де вона була імплантована, але це не є обов'язковим. Такі варіанти втілення, іноді відомі як генна терапія ex vivo, можуть забезпечити безперервну поставку поліпептидів екзогенної КЛЛ, протягом обмеженого періоду часу. У той час як лікувальний білок, передбачений у даному винаході, може рекомбінувати КЛЛ, призначену для введення у початковому видгляді, краще вводити лікувальний білок як частину фармацевтичної композиції. Таким чином, винахід додатково надає фармацевтичні композиції, що включають одержані від птахів глікозильовані лікувальні білки або їх фармацевтично прийнятні похідні разом з одним або більшою кількістю фармацевтично прийнятних носіїв і, додатково, інші лікувальні й/або профілактичні інгредієнти й способи введення таких фармацевтичних композицій. Винахід також надає фармацевтичні композиції, що містять глікозильовані лікувальні білки одержані від ссавців або їх фармацевтично прийнятні похідні разом з одним або більшою кількістю фармацевтично прийнятних носіїв і, додатково, інші лікувальні й/або профілактичні інгредієнти і способи введення таких фармацевтичних композицій. Носій (носії) повинен (повинні) бути "прийнятним (прийнятними)» у розумінні сумісності з іншими інгредієнтами композиції й не бути шкідливими для реципієнтів. Способи лікування пацієнта (наприклад, кількість лікувального білка, що вводиться, частота введення і тривалість лікування) з використанням фармацевтичних композицій відповідно до винаходу можуть бути визначені, використовуючи стандартні методології, відомі лікарям-фахівцям у цій галузі техніки. Фармацевтичні композиції включають композиції, придатні для перорального, ректального, назального, топічного (у тому числі буккального і сублінгвального), вагінального або парентерального введення. Фармацевтичні композиції включають композиції, придатні для введення шляхом ін'єкції, включаючи внутрішнм'язове, підшкірне й внутрішньовенне введення. Фармацевтичні композиції також включають композиції для введення шляхом інгаляції або інсуффляції. Композиції можуть бути, там де це є необхідним, зручно представленими у вигляді одиниць дискретного дозування і можуть бути виготовлені будь-яким зі способів, добре відомих 18 UA 109672 C2 5 10 15 20 25 30 35 40 45 50 55 60 в галузі фармації. Способи виробництва фармацевтичних композицій звичайно включають етап поєднання лікувальних білків з рідкими носіями або остаточно розділеними твердими носіями, або з обома, і потім, за необхідності, додання продукту необхідної форми. Фармацевтичні композиції, придатні для перорального введення, можуть бути зручно представлені у вигляді дискретних одиниць, таких як капсули, облатки або таблетки, кожна з яких містить попередньо визначену кількість активного інгредієнта у вигляді: порошку або гранул; розчину; суспензії; або емульсії. Активний інгредієнт також може бути представлений у вигляді кульки, електуарію або пасти. Таблетки і капсули для перорального введення можуть містити традиційні формотворні засоби, такі як зв'язувальні речовини, наповнювачі, змазуючі речовини, дезінтегруючі речовини або змочувальні речовини. Таблетки можуть бути покриті у відповідності зі способами, добре відомими в цій галузі техніки. Пероральні рідкі препарати можуть мати вигляд, наприклад, водних або масляних суспензій, розчинів, емульсій, сиропів або еліксирів, або можуть бути представлені у вигляді сухого продукту для змішування перед введенням з водою або іншим придатним середовищем. Такі рідкі препарати можуть містити традиційні добавки, такі як суспендуючі речовини, емульгатори, безводні середовища (які можуть включати харчові масла) або консерванти. Лікувальні білки відповідно до винаходу можуть бути також призначені для парентерального введення (наприклад, за допомогою ін'єкції, наприклад, швидкої ін'єкції або безперервного вливання) і можуть бути представлені у вигляді дози в ампулах, попередньо заповнених шприцах, у вигляді контейнерів для вливань невеликого об'єму або пакувань, що містять багато доз, з доданими консервантами. Лікувальні білки можуть вводитись за допомогою, наприклад, підшкірних ін'єкцій, внутрішньом'язових ін'єкцій і внутрішньовенних вливань або ін'єкцій. В одному варіанті втілення, екзогенна КЛЛ вводиться за допомогою внутрішньовенного вливання будь-яким придатним способом. В одному прикладі, екзогенна КЛЛ може вводитись за допомогою внутрішньовенного вливання через периферійну лінію. В іншому прикладі, екзогенна КЛЛ може вводитись за допомогою внутрішньовенного вливання через вставлений периферійно центральний катетер. В іншому прикладі, екзогенна КЛЛ може вводитись за допомогою внутрішньовенного вливання з використанням машини для амбулаторного вливання, приєднаної до порту судинного доступу. В одному варіанті втілення внутрішньовенного вливання, лікарський засіб вводиться протягом періоду часу від 1 до 8 годин, залежно від кількості лікарського засобу, призначеного для вливання, і історії реакцій пацієнта під час попередніх вливань, як визначається лікарем-фахівцем у цій галузі. В іншому варіанті втілення, екзогенна КЛЛ вводиться за допомогою внутрішньовенної ін'єкції. В іншому варіанті втілення, екзогенна КЛЛ може вводитись за допомогою інтраперитонеальної ін'єкції. У ще одному варіанті втілення, екзогенна КЛЛ вводиться за допомогою фармацевтично прийнятної капсули лікувального білка. Наприклад, капсула може являти собою желатинову капсулу з кишковорозчинною оболонкою. У деяких варіантах втілення, лікувальні білки вводяться за допомогою вливання, і вливання може здійснюватися протягом продовженого періоду часу, наприклад, від 30 хвилин до 10 годин. Таким чином, вливання може здійснюватися, наприклад, протягом періоду часу, що дорівнює приблизно 1 годині, приблизно 2 годинам, приблизно 3 годинам, приблизно 4 годинам або приблизно 5 годинам. Вливання також може здійснюватися за різних швидкостей. Так, наприклад, швидкість вливання може дорівнювати від приблизно 1 мл на годину до приблизно 20 мл на годину. У деяких варіантах втілення, швидкість вливання становить від приблизно 5 мл на годину до приблизно 10 мл на годину. В одному варіанті втілення, швидкість вливання становить 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 або 20 мл на годину. В одному варіанті втілення, швидкість вливання становить від 0,1 до 5 мг/кг/год. В одному варіанті втілення, швидкість вливання становить приблизно 0,1, приблизно 0,2, приблизно 0,3, приблизно 0,5, приблизно 1,0, приблизно 1,5, приблизно 2,0, або приблизно 3 мг/кг/год. Лікувальні білки можуть мати такі форми, як суспензії, розчини, або емульсії в масляних або водних середовищах, і можуть містити такі формотворні засоби, як суспендуючі, стабілізуючі й/або диспергуючі речовини. Лікувальні білки можуть застосовуватись у вигляді порошку, одержаного шляхом асептичного виділення стерильної твердої речовини, або шляхом ліофілізації з розчину, для змішування перед використанням із придатним середовищем, наприклад, стерильною апірогенноюводою. Для топічного введення в епідерміс, лікувальні білки можуть мати вигляд мазей, кремів або лосьйонів або трансдермального пластиру. Мазі й креми можуть, наприклад, мати водну або масляну основу з додаванням придатних загусників і/або гелеутворюючих речовин. Лосьйони можуть мати водну або масляну основу і, як правило, також містять один або більше емульгаторів, стабілізаторів, диспергаторів, суспендуючих агентів, загусників або барвників. 19 UA 109672 C2 5 10 15 20 25 30 35 40 45 50 55 Композиції, придатні для топічного введення в ротову порожнину, включають таблетки, що містять активний інгредієнт із ароматною основою, звичайно сахарозою і акацією або трагакантом; пастилки, що містять активний інгредієнт із інертною основою, такою як желатин і гліцерин або сахароза й акація; і рідину для полоскання рота, що містить активний інгредієнт із придатним рідким носієм. Фармацевтичні композиції, придатні для ректального введення, де носієм є тверда речовина, найкраще мають вигляд супозиторіїв з одиничною дозою. Придатні носії включають масло какао й інші продукти, звичайно використовувані в цій галузі техніки, і супозиторії повинні легко виготовлятися із суміші активної композиції з розм'якшеним або розплавленим носієм (носіями) з наступним охолодженням і формуванням у формах. Композиції, придатні для вагінального введення, можуть бути представлені у вигляді песаріїв, тампонів, кремів, гелів, паст, пін або спреїв, що містять добавку до активного інгредієнта, носіїв, відомих у відповідній галузі техніки. Для інтраназального введення, лікувальні білки відповідно до винаходу можуть застосовуватися у вигляді рідкого спрея або дисперсного порошку або у вигляді крапель. Краплі можуть формуватися з водної або неводної основи, яка також включає одну або більше диспергуючих речовин, речовин що розчиняють, або суспендуючих речовин. Рідкі спреї подаються з балонів під тиском. Для інгаляційного введення, лікувальні білки відповідно до винаходу можуть просто доставлятися із инсуфлятора, розпилювача або балона під тиском, або інших засобів придатних для подачі аерозолю. Балони під тиском можуть включати відповідний газ-витискувач, такий як дихлордифторметан, трихлорфторметан, дихлортетрафторетан, діоксид вуглецю або інший придатний газ. У випадку використання аерозолю під тиском, одиниця дози може задаватись за допомогою застосування клапана для подачі необхідної кількості. Для інгаляційного або інсуфляційного введення, лікувальні білки відповідно до винаходу можуть мати вигляд сухої порошкової композиції, наприклад, порошкової суміші композиції і відповідної порошкової основи, такої як лактоза або крохмаль. Порошкова композиція може бути представлена у вигляді одиничних доз, наприклад, капсул або картриджів, або, наприклад, желатинових або блістерних пакувань, з яких порошок може бути введений за допомогою інгалятора або інсуфлятора. За необхідності, можуть застосовуватися описані вище композиції, призначені для безперервного вивільнення активного інгредієнта, . Фармацевтичні композиції відповідно до винаходу, можуть також містити інші активні інгредієнти, такі як антимікробні засоби або консерванти. У деяких варіантах втілення, концентрація екзогенної КЛЛ у фармацевтичній композиції становить від приблизно 0,5 до приблизно 10 мг/мл. У деяких варіантах втілення, концентрація КЛЛ становить від приблизно 1 до приблизно 5 мг/мл. У деяких варіантах втілення, концентрація КЛЛ становить приблизно 1, приблизно 1,5, приблизно 2, приблизно 2,5, приблизно 3, приблизно 3,5, приблизно 4, приблизно 4,5, приблизно 5, приблизно 5,5, приблизно 6, приблизно 6,5, або приблизно 7,5 мг/мл. У деяких варіантах втілення, фармацевтична композиція, що включає екзогенну КЛЛ, додатково містить буфер. Типові буфери включають ацетатні, фосфатні, цитратні й глутаматні буфери. Типові буфери також включають цитрат літію, цитрат натрію, цитрат калію, цитрат кальцію, лактат літію, лактат натрію, лактат калію, лактат кальцію, фосфат літію, фосфат натрію, фосфат калію, фосфат кальцію, малеат літію, малеат натрію, малеат калію, малеат кальцію, тартрат літію, тартрат натрію, тартрат калію, тартрат кальцію, сукцинат літію, сукцинат натрію, сукцинат калію, сукцинат кальцію, ацетат літію, ацетат натрію, ацетат калію, ацетат кальцію, і їх суміші. У деяких варіантах втілення, буфер являє собою дигідрат тринатрійцитрату. У деяких варіантах втілення, буфер являє собою моногідрат лимонної кислоти. У деяких варіантах втілення, фармацевтична композиція містить дигідрат тринатрійцитрату і моногідрат лимонної кислоти. У деяких варіантах втілення, фармацевтична композиція, що включає екзогенну КЛЛ, додатково містить стабілізатор. Типові стабілізатори включають альбумін, трегалозу, цукри, амінокислоти, поліоли, циклодекстрин, солі, такі як хлорид натрію, хлорид магнію і хлорид кальцію, ліопротектори і їх суміші. У деяких варіантах втілення, фармацевтична композиція включає сироватковий альбумін людини. У конкретному прикладі, рекомбінантна КЛЛ людини, одержана відповідно до опису в даній заявці, застосовується у фармацевтичній композиції, де кожний 1 мілілітр містить екзогенну КЛЛ (наприклад, 2 мг КЛЛ), дигідрат тринатрійцитрату (наприклад, 13,7 мг), моногідрат лимонної кислоти (наприклад, 1,57 мг) і сироватковий альбумін людини (наприклад, 10 мг) і урівноважується до кислого рівня рН, що становиь 5,9±0,1. Даний винахід розглядає будь-який 20 UA 109672 C2 5 10 15 20 25 30 35 40 45 50 55 60 спосіб введення, який полегшує введення екзогенної КЛЛ у лізосоми відповідних органів або тканин. ПРИКЛАДИ Наступні конкретні приклади призначені для ілюстрації винаходу я не повинні розглядатися як такі, що обмежують об'єм формули винаходу. Приклад 1 Лікування дефіциту КЛЛ із раннім початком (хвороба Вольмана) за допомогою введення рекомбінантної КЛЛ. Хлопчик в 15-тижневому віці, був направлений у лікарню у зв'язку з недостатнім збільшенням маси тіла від народження (маса при народженні 3,88 кг). Хворий поступив із блювотою, проблемами харчування, з поганим статусом харчування, діареєю, підвищеним здуттям живота і анемією. Поставлений діагноз - хвороба Вольмана. При початковому фізичному обстеженні маса пацієнта становила 5,62 кг, що розміщувало його нижче 5-го процентилю за шкалою залежності маси тіла від віку. Протягом наступних 4 тижнів після початкового обстеження в 15-тижневому віці й перед початковим вливанням в 19тижневому віці, маса тіла пацієнта не збільшувалась. Р озрахункова швидкість росту очікувалась нижче 1-го процентилю за шкалою залежності маси тіла від віку. Живіт був помітно роздутий внаслідок значної гепатомегалії й спленомегалії. Ультразвукове обстеження й КТсканування органів черевної порожнини підтвердили гепатоспленомегалію й двостороннє симетричне збільшення надниркових залоз із кальцифікацією. Рівень сироваткової аланінамінотрансферази (АЛТ) становив 119 О/л (нормальний рівень - 10-50 О/л), а рівень сироваткової аспартатамінтотрансферази (АСТ) - 216 О/л) (нормальний рівень - 10-45 О/л). Перед початком лікування, кількість сироваткового феритину, що є показником запалення, становила приблизно 1500 мкг/л (нормальний рівень - 7-144мкг/л). Перед початком лікування спостерігалась стійка анемія з рівнем гемоглобіну від 7,2 до 8,3 г/дл. В 19-тижневому віці були розпочаті щотижневі внутрішньовенні вливання rhLAL (SBC-102) з початковою дозою 0,2 мг/кг. Була проведена попереднє лікування пацієнта введенням 1 мг/кг дифенгідраміну приблизно за 90 хвилин перед вливанням SBC-102 для запобігання можливих реакцій на вливання. Тривалість вливання становила приблизно 4 години. Вливання добре переносились і у пацієнта були відсутні будь-які небажані явища або пов'язані з вливанням реакції. Друге вливання було проведено пацієнту через сім днів після першого вливання. Пацієнту була введена доза, що становила 0,3 мг/кг SBC-102, протягом приблизно 4 годин без появи ознак небажаних явищ. Протягом двох тижнів після початку лікування у пацієнта спостерігалось помітне покращення загального самопочуття, включаючи підвищення жвавості й сприйнятливості. Діарея й блювота були стабілізовані. Пацієнт почав набирати масу тіла і продемонстрував помітне зниження рівня сироваткових трансаміназ (наприклад, АСТ і АЛТ) в основному до нормальних рівнів (Фігури 1А и 1В). Швидкість росту пацієнта швидко нормалізувалась (Фігури 3 і 4). Здуття живота зменшилось, відповідно до зниження розміру живота. Аналізи функції печінки показали тривалі покращення (Фігури 1А и 1В). При третьому візиті, пацієнт одержав дозу SBC-102 0,5 мг/кг. Вливання виконувалися без небажаних явищ. Клінічний стан продемонстрував безперервне покращення, зі збільшенням маси на 150 г через 7 днів і збільшенням окружності плеча на 1,5 см після початку лікування (Фігури 3 і 4). Тести печінки були стабільні, рівень гемоглобіну підвищився (10-11 г/дл), а рівень феритину продовжував знижуватись (Фігура 2). Рівень лужної фосфатази перед початком лікування був нормальний і становив 137 О/л (нормальний рівень - 110-300 О/л), і підвищився при лікуванні (204 О/л). Цей ефект введення SBC-102 був стійким і підтверджувався спостереженнями для доклінічної моделі захворювання. Починаючи із четвертого вливання, пацієнт почав одержувати щотижневу дозу 1,0 мг/кг. Через два місяці після початку лікування, процес росту пацієнта в основному покращився при оцінній швидкості росту близько до 95-го процентилю. Це покращення росту привело до збільшення маси на 1,25 кг або 2,79 фунтів через 63 дня з масою 7,21 кг, розміщуючи пацієнта на 30 процентилі за шкалою залежності маси від віку (Фігури 3 і 4). Рівні АСТ і АЛТ швидко знизилися після першого вливання. Через три місяці лікування рівні АСТ і АЛТ стали нормальними. На додаток до покращення функції печінки спостерігалось помітне зниження рівня феритину (Фігура 2). Після 4-місячного курсу лікування, шлунково-кишкові симптоми пацієнта вже не проявлялися, і стан харчування пацієнта був відмінним. Пацієнт продовжував набирати масу (Фігури 3 і 4) і демонстрував фізичні ознаки нормальної здорової дитини. Пацієнт продовжував 21 UA 109672 C2 5 10 15 20 нормально переносити вливання без будь-яких реакцій або побічних ефектів. Пацієнт одержав 21-у дозу, що дорівнює 1,0 мг/кг як амбулаторний пацієнт. Приклад 2 Дизайн клінічного дослідження дефіциту КЛЛ із раннім початком SBC-102, рекомбінантна КЛЛ, вироблена в трансгенному півні, вводиться шляхом щотижневого внутрішньовенного вливання. Дослідження призначене для оцінки безпечності, переносності й ефективності двох режимів дозування SBC-102 при щотижневому внутрішньовенному вливанні. При цьому, основні вихідні змінні в цім дослідженні визначають безпечність й переносність SBC-102 дітьми з порушеннями росту внаслідок дефіциту КЛЛ і включають: основні ознаки стану й результати фізичного обстеження; клінічні лабораторні тести; тести на антитіла до лікарських засобів, і застосування відповідних медикаментів. Враховуючи, що порушення росту в дітей є універсальною клінічною ознакою дефіциту КЛЛ / фенотипу Вольмана, успішне лікування цієї хвороби повинне вплинути на порушення росту, спостережуваного у дітей, що страждають дефіцитом КЛЛ. Параметри, що відносяться безпосередньо до росту дитини і стану харчування, оцінюються як вторинні або діагностичні цілі: наприклад, швидкість інкрементального росту, що відноситься до маси; збільшення маси; і швидкість лінійного росту. Це дослідження також вивчає вплив SBC-102 на фармакодинамічні біомаркери; розмір печінки й селезінки, лімфаденопатію; рівень гемоглобіну і тромбоцитів; лабораторні оцінки функції печінки й харчування; розмір живота, середньо-верхня окружність плеча; і окружність голови. Це дослідження також описує попередню фармакокінетику SBC-102 у дітей з порушенням росту внаслідок дефіциту КЛЛ, включаючи значення Cmax для плазми й розрахунковий кліренс. Таблиця 1: Графік оцінювання: спостереження протягом 24 тижнів ПочатТиж- Тиж- Тиж- Тиж- Тиж- Тиж- Тиж- Тиж- Тиж- Тиж- Тиж- Тиж- ТижТиждень ковий день день день день день день день день день день день день день 1 діагноз 2 3 4 6 8 10 12 14 16 18 20 22 24 Оцінки Попереднє вливання Інформована згода Включення / виключення Історія хвороби Зразок для молекулярногенетичного аналізу Спосіб " сухої краплі" Пов'язана із станом здоров'я ЕКГ в 12 відведеннях Фізичне 2 обстеження Тест на 3 вагітність Клінічні лабораторні ±2 дні ±2 дні ±2 ±2 ±2 ±2 ±2 ±2 дні дні дні дні дні дні ±2 дні ±2 ±2 ±2 ±2 ±2 дні дні дні дні дні Х Х Х Х Х Х Х Х Р Х Х Р Х Р Х Х Р Х Р Х Х Р Х Р 22 Х Р Х Р Х Р Х Р UA 109672 C2 Таблиця 1: Графік оцінювання: спостереження протягом 24 тижнів ПочатТиж- Тиж- Тиж- Тиж- Тиж- Тиж- Тиж- Тиж- Тиж- Тиж- Тиж- Тиж- ТижТиждень ковий день день день день день день день день день день день день день 1 діагноз 2 3 4 6 8 10 12 14 16 18 20 22 24 Оцінки Попереднє вливання досліджнення Печінка, ліпід і Гостра фаза Анти SBC-102 Відбір біомаркерів сироватки крові й сечі 6 MRI/MRS живота показники життєво важливих 7 функцій Вливання SBC102 Небажані явища Супутні медикаменти / видилікування Х Х Х ±2 дні ±2 дні ±2 ±2 ±2 ±2 ±2 ±2 дні дні дні дні дні дні Р Р Х Р Х Х Х 15 20 Р Х Х Х Х Р Х Р Р Р Х Х Р Х Р Х Р Х Р Х Х Х Х Х Х Х Х Х Х 9 Х Х Х Х Х Х Х Х Х Х Х Х Х Х 10 Х Х Х Х Х Безперервно Безперервно Попереднє вливання Якість життя, обумовлена станом здоров'я відповідно до віку. 2 Фізичне обстеження буде включати вимірювання маси тіла (ріст тільки при огляді), оцінку розміру печінки й селезінки, лімфаденопатії й артеріальної хвороби. Суб'єктів розподілюють на дві послідовні групи однакового розміру (4 суб'єкта в кожній групі). Дозування змінюється в межах кожної групи й між групами, починаючи із введення дози -1 першому суб'єкту в групі з нижчими дозами (Група 1; початкова доза 0,35 мг∙кг ). Введення доз додатковим суб'єктам у Групі 1 і початок введення доз у групі з вищими дозами (Група 2; -1 початкова доза 1 мг∙кг ) засноване на прийнятній безпечності й переносності попередніми суб'єктами. Група 1 Перші чотири суб'єкти, зареєстровані в дослідженні, складають Групу 1. Перший суб'єкт у -1 групі одержує одноразову дозу 0,35 мг∙кг SBC-102 і, якщо на основі аналізу безпечності затверджується продовження введення доз, протягом, щонайменше, 24 годин після введення -1 дози, одержує другу дозу 0,35 мг∙кг SBC-102 через один тиждень. Після введення суб'єкту другої дози SBC-102, усі доступні дані, що відносяться до безпечності, аналізуються, і ухвалюється рішення щодо прийнятності, тобто можливості підвищення дози для першого -1 суб'єкта до 1 мг∙кг і початку введення дози іншим суб'єктам у Групі 1. Введення доз трьом іншим суб'єктам із Групи 1 здійснюється подібним чином. Якщо аналіз безпечності не гарантує -1 -1 безпечності підвищення дози, що вводиться суб'єкту, з 0,35 мг∙кг до 1 мг∙кг , але демонструє безпечність продовження лікування суб'єкта при введенні початкової дози, суб'єкт може -1 продовжувати одержання дози 0,35 мг∙кг . Якщо будь-який суб'єкт у Групі 1 проявляє 1 10 Р Х Р Х Р Х Р Х Р p 5 ±2 ±2 ±2 ±2 ±2 дні дні дні дні дні Р Х Р Х Р Х Х ±2 дні 23 UA 109672 C2 -1 5 10 15 20 25 30 35 40 45 50 55 60 субоптимальну реакцію на лікування після одержання, щонайменше, 4 доз 1 мг∙кг SBC-102, -1. розглядається додаткове підвищення дози до 3 мг∙кг Група 2 Початок введення доз у Групі 2 здійснюється після повної реєстрації Групи 1 і аналізу -1 безпечності для, щонайменше, 2 суб'єктів, які одержали 2 або більш доз по 1 мг∙кг SBC-102 у Групі 1. Інші 4 суб'єкта залучаються до дослідження і реєструються і одержують дози в Групі 2. -1 Перший суб'єкт у цій групі одержує одноразову дозу 1 мг∙кг SBC-102 і, якщо на основі аналізу безпечності затверджується продовження введення доз протягом, щонайменше, 24 годин після -1 введення дози, одержує другу дозу 1 мг∙кг SBC-102 через один тиждень. Після введення суб'єкту другої дози SBC-102, всі доступні дані, що відносяться до безпечності, аналізуються, і ухвалюється рішення щодо прийнятності, тобто можливості підвищення дози для першого -1 суб'єкта до 3 мг∙кг і початку введення дози іншим суб'єктам у Групі 2. Введення доз трьом іншим суб'єктам із Групи 2 здійснюється подібним чином, з аналізом безпечності. Якщо аналіз -1 безпечності не гарантує безпечність підвищення дози, що вводиться суб'єкту, з 1 мг∙кг до 3 -1 мг∙кг , але показує безпечність продовження лікування суб'єкта при введенні початкової дози, -1 -1 суб'єкт може продовжувати одержувати дозу 1 мг∙кг . Якщо початкова доза 1 мг∙кг не -1 переноситься добре суб'єктом, може розглядатися введення зниженої дози 0,35 мг∙кг . Дослідження складається із приблизно 22 візитів відповідно до графіка: Візит 1 (огляд), Візит 2 (базисна оцінка, початок використання досліджуваного лікарського засобу) до Візит 21 (щотижневе введення досліджуваного лікарського засобу), Візит 22 (закінчення завершеного дослідження). Враховуючи складність і життєву важливість лікування порушення росту з раннім початком внаслідок дефіциту КЛЛ, імовірно, що ці суб'єкти будуть госпіталізовані. Для досліджень будуть залучатися хлопчики й дівчинки з порушенням росту внаслідок дефіциту КЛЛ. Суб'єкти можуть брати участь у дослідженнях за умови відповідності наступним критеріям: (1) батько або юридичний опікун суб'єкта повністю розуміє природу й ціль дослідження, включаючи можливі ризики й побічні ефекти, і дає інформовану згоду / дозвіл до початку виконання будь-яких дослідницьких процедур; (2) хлопчик або дівчинка зі зниженою активністю КЛЛ щодо нормального рівня, документально підтвердженою проведенними лабораторними аналізами, або з задокументованими результатами молекулярно-генетичного дослідження, що підтверджують діагноз дефіциту КЛЛ; і (3) порушення росту з раннім початком у віці молодше 6 місяців. Безпечність Основні пункти безпечності включають виникнення небажаних явищ (НЯ) і реакцій, що відносяться до вливання (РВВ); відхилення від базису основних ознак (кров'яний тиск, частота серцевих скорочень, інтенсивність подиху, температура), результати фізичного огляду і клінічні лабораторні тести (клінічний аналіз крові /гематологія, біохімічне дослідження сироватки крові й аналіз сечі); використання супутніх лікарських засобів / видів лікування; і характеристика антитіл до SBC-102 (АДА), включаючи показник конверсії сироватки, час до конверсії сироватки, титр АДА середнього й пікового імуноглобуліну G (ІgG) і час до титру АДА пікового ІgG. Ефективність Основні пункти ефективності включають: (1) відхилення й / або відносне відхилення від базису розміру печінки й селезінки (за допомогою ультразвукового дослідження) і об'єму печінки й селезінки, і вмісту жирів (за допомогою магніторезонансного зображення [МРЗ]); і (2) відхилення від базису трансамінази сироватки, ліпідів сироватки (загальний холестерин, тригліцериди, ліпопротеїн високої щільності [ЛВЩ]) і ліпопротеїн низької щільності [ЛНЩ]), рівень гемоглобіну й тромбоцитів. Параметри росту, включаючи відхилення від базису у відсотках і z-балах, також оцінюються для суб'єктів молодше 18-річного віку. Ці параметри росту засновані на картах росту Центрів контролю захворювання (ЦКЗ) і включають карти залежності маси від віку (МВ), маси від росту (МР), росту від віку (РВ) і окружності голови від віку (ОГВ) у суб'єктів, чий вік менше 30 місяців, і МВ, статури від віку (СВ; відношення статури до росту) і ваги від статури (ВТ) у суб'єктів, чий вік перевищує або становить від 36 місяців і до 18-річного віку, а також, відповідні індикатори статусу росту, такі як недостатня маса тіла, атрофія й відставання у рості у всіх суб'єктів. Приклад 3 Фізичні оцінки пацієнтів з дефіцитом КЛЛ із раннім початком Пацієнти, клінічно досить стабільні для того, щоб перенести загальну анестезію, повинні розглядатися з погляду можливості використання центрального катетера для довгострокового доступу до судинної системи. У суб'єктів, що піддаються дії загальної анестезії і/або впливу седативних засобів для інших процедур, розглядається базисне магніторезонансне зображення (МРЗ) органів черевної порожнини. У випадку нових процедур, що вимагають загальної 24 UA 109672 C2 5 10 15 20 25 30 35 40 45 50 55 60 анестезії і/або впливу седативних засобів, розглядається контрольне МРЗ, якщо пройшло не менш трьох місяців після першого вливання. Виміряються антропометричні характеристики (маса, ріст, окружність живота, середньо-верхня окружність плеча й окружність голови). Виконується загальне фізичне обстеження. Проводиться повне фізичне обстеження. Обстеження включає оцінку загального вигляду суб'єкта, шкіри, голови, очей, вух, носа й горла, серця, легенів, живота, кінцівок / суглобів і неврологічного стану. Кожне фізичне обстеження також включає наступне: Розмір печінки: виконують клінічне оцінювання розміру печінки (пальпується / не пальпується і сантиметри нижче реберної дуги), правильність (гладка / вузлувата) и чутливість (болісність /безболісність) Розмір селезінки: виконують клінічне оцінювання розміру селезінки (пальпується / не пальпується і сантиметри нижче реберної дуги), правильність (гладка / вузлувата) и чутливість (болісність /безболісність) Лімфаденопатія: виконується оцінка розміру, розміщення і характеру всіх лімфатичних вузлів, що пальпуються. Призначені для обстеження зони включають: головна (потилична, розташована перед вушною раковиною, розташована за вушною раковиною, під підборідна, підщелепна), шийна, ключична, пахвова й інгвінальна. Всі збільшені вузли характеризуються як болісні або безболісні. Фотографія: виконується цифрове зображення суб'єкта в положенні лежачи на спині (повний ріст і збільшене зображення живота). Ультразвукове обстеження й МРЗ печінки / селезінки Ультразвукова ехографія органів черевної порожнини може виконуватися для вимірювання розміру печінки й селезінки. МРЗ органів черевної порожнини може забезпечити краще кількісне визначення об'єму печінки і селезінки, і може розглядатися при початковому візиті й при візиті через, щонайменше, 3 місяці після першого вливання. Показники життєво важливих функцій Показники життєво важливих функцій включають частоту пульсу, інтенсивність подиху, систолічний і діастолічний артеріальний тиск, і загальну температуру тіла (ректально або орально). Оцінка частоти пульсу і кров'яного тиску виконується після того як суб'єкт знаходився в положенні лежачі на спині. Показники життєво важливих функцій виміряють під час всіх візитів протягом дослідження. У дні введення доз, показники життєво важливих функцій записуються перед вливанням, кожні 15 хвилин (± 10) під час вливання і протягом 2 годин після вливання, а потім кожні 30 хвилин (± 15) у період часу з 2 до 4 години після завершення вливання. Приклад 4 Лабораторне оцінювання Наступні лабораторні оцінки виконуються у вигляді діагностичних тестів і для визначення ефективності: 1) Загальний аналіз крові / гематологія: рівень лейкоцитів у крові, рівень еритроцитів у крові, гемоглобін, гематокрит, середній клітинний об'єм (СКО), середній еритроцитарний гемоглобін (СЕГ), середньоклітинна концентрація гемоглобіну (СККГ), рівень тромбоцитів, нейтрофілів, лімфоцитів, моноцитів, еозинофілів, базофілів, мазок периферичної крові для дослідження морфології клітин. 2) Біохімічний аналіз крові: глюкоза, азот сечовини крові, креатинін, натрій, калій, хлорид, кальцій (загальний і іонізований), магній, неорганічний фосфор, загальний білок, лактатдегідрогеназа. 3) Тести функції печінки: АСТ/ сироваткова аспартатамінотрансфераза (САСТ), АЛТ/ сироваткова аланінамінотрансфераза (САЛТ), лужна фосфатаза, гамаглутамінтрансфераза (ГГТ), альбумін, білірубін (прямий, загальний) 4) Антитіла до лікарського препарату: антитіла до SBC-102 5) Аналіз сечі: рівень pH, глюкоза, кетони, кров, білок, нітрит 6) Дослідження коагуляції: лейкоцити (може бути виконане мікроскопічне дослідження, якщо спостерігаються відхилення від норми для крові, нітриту й / або лейкоцитів) 7) Лабораторна оцінка харчування: співвідношення альфа-токоферол сироватки: холестерин, 25ОH вітамін D, сироватковий ретинол, дидегідроретинол, транстиретин, феритин сироватки. 8) Ліпідограмма: загальний холестерин, тригліцериди, ЛВЩ, ЛНЩ 9) Генетичний профіль Послідовності ДНК, включаючи послідовність кодування білка й послідовності, що регулюють транскрипцію гена, стабільність інформаційної рибонуклеїнової кислоти (іРНК) і ефективність трансляції білка, які можуть бути ідентифіковані, включають: 25 UA 109672 C2 5 10 15 20 25 1. Кислу лізосомну ліпазу (ген LIPA) 2. Кодування генів для інших білків, що беруть участь у ліпідній біології, які можуть внести свій внесок і / або модифікувати фенотип дефіциту КЛЛ, наприклад, ABCA1 3. Гени, які можуть модифікувати сприйнятливість до якого-небудь SBC-102 10) Фармакокінетичне оцінювання Для зниження ризику ятрогенної анемії, ФК вибірка може бути обмежена. У порядку важливості, зразки відбираються для визначення наступних параметрів: 1) Cmax і 2) оцінка смертельної концентрації (СК). Збираються зразки для вимірювання сироваткових рівнів SBC102 у день 0 (доза 1) і день 105 (доза 16). У всіх суб'єктів зразки відбираються перед введенням дози (за 30 хвилин до введення дози); через 90(±5) хвилин після початку вливання; і через 110(±5) хвилин після початку вливання. Всі ФК зразки, у моменти часу, що збігаються з оцінкою основних ознак, необхідно відбирати до надування манжети для оцінювання кров'яного тиску (КТ) на руці, де вливання не виконується. ФК зразки в інші моменти часу беруться, щонайменше, через 5 хвилин після здування манжети. Приклад 5 Підготовка дози і вливання SBC-102 надається в скляних флаконах з одноразовою дозою 10 мл у вигляді прозорої -1 рідини. Розчин (загадлом10,5 мл, включаючи 5 % переповнення) має концентрацію 2 мг∙мл . Всі флакони з SBC-102 зберігались за контрольованої температури 2-8 °C. При зберіганні флакони заморожують і захищають від впливу світла. Шприц, що містить препарат SBC-102, розведений в 0,9 % соляному розчині, був підготовлений безпосередньо перед вливанням. Коли шприца з SBC-102, готують заздалегідь, розведений розчин маркірують і використовують протягом 4 годин після приготування. Масаа пацієнта, записана перед введенням дози ранком у день вливання і округлена до 0,1 кг, була використана для обчислення об'єму SBC-102 для кожного вливання. Загальний об'єм вливань, використовуваний при дослідженні, ґрунтується на режимі введення доз, показаному в Таблиці 2. Таблиця 2 Доза 0,35 мг/кг 1 мг/кг 3 мг/кг Об'єм вливання 10 мл 10 мл 20 мл 30 35 Приготування і введення дози необхідно виконувати з використанням стерильних апірогенних одноразових матеріалів, включаючи, але не обмежуючись цим, шприци, голки, перехідні трубки й кран для регулювання потоку рідини. Швидкість вливання повинна встановлюватися на регуляторі потоку таким чином, щоб ввести весь об'єм протягом приблизно 120 хвилин, як показано в Таблиці 3. Таблиця 3 Доза 45 Витрата за хвилину 0,35 мг/кг 1 мг/кг 3 мг/кг 40 Витрата за годину 5 мл 5 мл 10 мл 0,083 мл 0,083 мл 0,167 мл Витрата на кілограм за годину 0,175 мг/кг/год. 0,5 мг/кг/год. 1,5 мг/кг/год. Приклад 6 Небажані явища (НЯ) У випадку спостереження у суб'єктів НЯ або реакцій, що відносяться до вливання (РВВ) із клінічно значущими серцевосудинними, респіраторними або іншими ефектами, вливання необхідно припинити, і суб'єкт повинен одержати лікування для ліквідування анафілкатичної реакції відповідно до посібника з управління серйозними реакціями при вливанні у дітей в віці до 2 років. Лікування може включати внутрішньовенне введення антигістамінних засобів, кортикостероїдів і адреналіну за необхідністю. Для споріднених біологічних продуктів більшість відкладених РВВ проявляється пізніше, ніж через 24 години після вливання. Симптоми включають артралгію, міалгію, симптоми, схожі на симптоми при грипі, головний біль, втому і 26 UA 109672 C2 5 10 15 20 25 30 35 40 45 50 55 60 висип або кропивницю. Відкладені реакції можуть лікуватися анальгетиками або антигістамінами засобами, відповідно до клінічних показань. РВВ класифікуються або як гострі (такі, що проявляються протягом 24 годин після початку вливання), або як відкладені (такі, що проявляються в період від 1 до 6 днів після вливання). Медикаменти і обладнання для лікування реакцій гіперчутливості повинні бути готові для негайного використання у випадку несподіваних несприятливих реакцій гіперчутливості. Ці засоби включають, але не обмежуються цим, кисень, ацетамінофен, антигістамінні засоби (наприклад, дифенгідрамін, парентеральні й пероральні препарати), кортикостероїди, адреналін і апарати для відновлення серцевої діяльності й дихання. У подібних біологічних продуктах, більшість гострих РВВ проявляються протягом 24 годин після вливання (Інструкція з медичного застосування препарату Cerezyme®, VPRIV®, Fabrazyme®). Ознаки можливої гострої РВВ можуть класифікуватися в такий спосіб: від незначних до помірних РВВ: гіперемія, прилив крові, жар і / або озноб, нудота, свербіж, кропивниця, шлунково-кишкові симптоми (блювота, діарея, спазми в животі). Незначні реакції визначаються як самообмежуючі, такі, що спонтанно зникаючі реакції після тимчасового припинення або зниження швидкості вливання. Помірніі реакції визначаються як такі, що не усуваються простими заходами, і вимагають розширеного спостереження й припинення лікування. Тяжкі реакції спричиняють біль у грудях, задишку, хрипи, стридор, зниження артеріального тиску або підвищення артеріального тиску, зупинку дихання, апное, задишку, брадикардію або тахікардію. Якщо будь-яка із описаних вище ознак або симптомів спостерігається під час вливання, і суб'єкт залишається гемодинамічно стабільним, швидкість вливання може бути зменшена (зниження до половини швидкості, використовуваної на початку -1 -1 реакції, наприклад, з 10 мл∙год. до 5 мл∙год. ), а час вливання збільшений. Після усунення реакції, вливання повинне тривати не менше 30 хвилин за зниженої швидкості перед підвищенням швидкості до 75 % від початкової швидкості вливання. Якщо суб'єкт продовжує проявляти ознаки гіперчутливості, доза антигістамінного засобу може бути введена внутрішньом'язово або повільно внутрішньовенно відповідно до посібника з управління серйозними реакціями при вливанні у дітей у віці до 2 років. Приклад 7 Введення рекомбінантної КЛЛ пацієнту-людині з дефіцитом КЛЛ із пізнім початком Основною метою дослідження є оцінка безпечності й переносності SBC-102 у пацієнтів з дисфункцією печінки внаслідок дефіциту КЛЛ із пізнім початком (показники життєво важливих функцій, фізичне обстеження, клінічні лабораторні тести, тести на імуногенність, оцінка несприятливих явищ, супутнього лікування). Вторинною метою є характеристика фармакокінетики SBC-102, доставленого за допомогою внутрішньовенного вливання, після введення єдиних і множинних доз (перед і після вливання, день 0 і 21). Критерії включення до складу суб'єктів з дефіцитом КЛЛ із пізнім початком наступні: 1. Пацієнт повністю розуміє природу і ціль дослідження, включаючи можливі ризики й побічні ефекти, і бажає і здатний відповідати всім процедурам дослідження й надає інформовану згоду; 2. Чоловіки і жінки у віці ≥18 і ≤ 65 років; 3. Знижена активність КЛЛ, підтверджена документально лабораторією, що виконує аналіз, або задокументованими результатами молекулярно-генетичного дослідження, що підтверджує діагноз дефіциту КЛЛ; 4. Доказ ураження печінки на підставі клінічного опису (гепатомегалія) і / або результатів лабораторних тестів (AЛT або AСT ≥ 1,5x ВМН (верхня межа норми); 5. При прийомі статину або езетимібу, пацієнт повинен приймати стабільну дозу, протягом щонайменше, 4 тижнів до обстеження; 6. Всім жінкам необхідно мати негативний результат сироваткового тесту на вагітність при обстеженні і вони не повинні годувати дитину груддю; і 7. Жінки з дітородним потенціалом повинні погодитися застосовувати високоефективний й затверджений спосіб(и) контрацепції протягом всього дослідження і протягом 30 днів після введення останньої дози. Клінічне оцінювання включає фізичне обстеження, аналіз сечі, клінічний біохімічний аналіз крові, КАК/гематологію, реагенти гострої фази, вивчення коагуляції, ЕКГ в 12 відведеннях, антитіла до SBC-102, і ФК для управління Cmax, AUCinf, T1/2, Cl і Vss. -1 -1 -1 Пацієнтам вводять дози 0,35 мг∙кг , 1 мг∙кг або 3 мг∙кг КЛЛ щотижня за допомогою внутрішньовенного вливання протягом 2 годин. Першому суб'єкту вводять дози, і він контролюється на переносність протягом, щонайменше, 24 годин перед введенням доз іншим суб'єктам групи. Кожний суб'єкт залишається стаціонарним пацієнтом протягом 24 годин після першого вливання SBC-102. Суб'єктам продовжують вводити додаткові 3 дози SBC-102 щотижня внутрішньовенно за умови, що переносність і безпечністьа залишаються прийнятними. 27 UA 109672 C2 5 10 15 20 Фармакокінетика ФК дані аналізуються у всіх суб'єктів, включених у дослідження, що одержують, щонайменше, одну дозу досліджуваного препарату, за виключенням всіх даних, на які могло подіяти значне відхилення від основного протоколу. ФК аналізи виконуються з використанням однієї моделі вливання. Наступні ФК параметри визначаються й представляються групою (Cmax, AUCinf, T1/2, Cl і Vss). ФК параметри одинарної й множинної дози порівнюють з використанням даних Візиту 2 і Візиту 6. Запропоноване збільшення дози в цьому дослідженні може бути 3, 4, 5 або 6-кратне, що може дозволити оцінювати початкову безпечність, переносніость і фармакокінетичні параметри -1 у людей в 6-кратному діапазоні доз на базі одиниці виміру мг∙кг . У відповідній доклінічній -1 моделі з використанням щурів, фармакодинамічні ефекти при введенні дози 1 мг∙кг 1 раз -1 -1 щотижня, 3 мг∙кг кожний другий тиждень і 5 мг∙кг один раз щотижня порівнянні. Таким чином, -1 хоча не передбачається, що буде необхідність в дозі вище 3 мг∙кг один раз щотижня, все ж -1 -1 доза вище 3 мг∙кг , така як 4, 5, 6, 7, 8, 9 або 10 мг∙кг може розглядатися залежно від тяжкості захворювання. Дизайн досліджень Враховуючи рідкісністьпацієнтів з таким станом, остаточна кількість для цього дослідження становить 9 оцінюваних суб'єктів. Суб'єкти включаються в три послідовні групи по 3 суб'єкта в кожній групі. Суб'єкти, що входять у групу 1, одержують дози першими, після них - суб'єкти групи 2, а потім в групі 3. Таблиця 4: Графік дослідження дефіциту КЛЛ із пізнім початком: візити, оцінювання й інтервали Попереднє. лікування Оцінки Інформована згода Критерії Включення / виключення Демографічна інформація Результати обстеження здоров'я пацієнта 1 Історія хвороби ЕКГ в 12 відведеннях Фізичне обстеження Основні 3 показники Аналіз сечі Тест на 4 вагітність КАК/Гематологія Біохімічний аналіз крові Показники печінки Ліпідні показники Реагенти Активна фаза Постактивна фаза Візит Візит Візит Візит Візит Візит Візит Візит ТС ТС ТС 2 3 4 5 6 7 7.1 8 (День з- 28 (День (День (День (День (День (День (День (День (День (День (День –до 7) 0) 1) 7±1) 8) 14±1) 15) 21±1) 22) 28±1) 35±1) 52±1) Візит 1 Х Х Х Х Х Х Х Х Х 2 Х Х Х Х 3 Х Х Х р Х Х Х р Х Х р Х Х р 3 Х Х 3 Х Х Х 3 2 Х Х Х Х Х Х Х р Х р Х р Х р Х Х Х Х Х Х р Х р Х р Х р Х р Х р Х р Х Х р Х р Х Х р Х Х р Х Х р Х Х Х р 28 Х Х Х
ДивитисяДодаткова інформація
Автори англійськоюQyinn, Anthony
Автори російськоюКуинн Энтони
МПК / Мітки
МПК: A61P 3/06, A61K 31/397, A61K 31/366, A61K 31/135, A61K 38/46
Мітки: ліпази, дефіциту, застосування, кислої, лікування, лізосомної, хворих
Код посилання
<a href="https://ua.patents.su/53-109672-zastosuvannya-kislo-lizosomno-lipazi-dlya-likuvannya-deficitu-kislo-lizosomno-lipazi-u-khvorikh.html" target="_blank" rel="follow" title="База патентів України">Застосування кислої лізосомної ліпази для лікування дефіциту кислої лізосомної ліпази у хворих</a>
Попередній патент: Удосконалений спосіб ізомеризації альфа-кислот хмелю до ізо-альфа-кислот
Наступний патент: Спосіб визначення геометричних параметрів колових підкранових колій
Випадковий патент: Силовий кабель