Похідні азолу, що мають фунгіцидну або регулюючу ріст рослин активність, і проміжні сполуки для їх отримання
Номер патенту: 27101
Опубліковано: 28.02.2000
Автори: СІМІЗУ Сусуму, САЙСОДЗІ Тосіхіде, ІТО Ацусі, САТО Набуо, Кумазава Сатору, ІКЕДА Сусуму, ЄНАРІ Хіроюкі
Формула / Реферат
1. Производные азола общей формулы (I)
где R1 и R2 - водород или С1-С5-алкил, при условии, что оба одновременно не могут быть водородом;
X - галоген, С1-С5-алкил или фенил;
n=0 - 2;
А - азот или группа -СН-, обладающие фунгицидной или регулирующей рост растений активностью.
2. Производные азола общей формулы (I) по п.1 отличающиеся тем, что R1 и R2 - водород или С1-С3-апкил, при условии, что оба одновременно не могут быть водородом, X - галоген в 4-м положении бензольного кольца, n=1, А - азот или группа -СН-.
3. Производные азола общей формулы (I) по п.1, отличающиеся тем, что R1 и R2 - водород или С1-С3-алкил, при условии, что оба одновременно не могут быть водородом, X - галоген в 4-м положении бензольного кольца, n=1, А - азот.
4. Производные оксирана общей формулы (II)
где R1 и R2 - водород или С1-С5-алкил, при условии, что оба одновременно не могут быть водородом;
X - галоген, С1-С5-алкил или фенил;
n=0 - 2,
в качестве промежуточных продуктов для получения производных азола общей формулы (I).
5. Производные метиленциклопентана общей формулы (III)
где R1 и R2 - водород или С1-С9-алкил, при условии, что оба одновременно не могут быть водородом;
X - галоген, С1-С5-алкил или фенил;
n=0 - 2,
в качестве промежуточных продуктов дня получения производных азола общей формулы (I).
6. Производные циклопентанона общей формулы (IV)
где R1 и R2 - водород или С1-С5-алкил, при условии, что оба одновременно не могут быть водородом;
X - галоген, С1-С5-алкил или фенил;
n=0 - 2,
в качестве промежуточных продуктов для получения производных азола общей формулы (I).
7. Производные сложного эфира циклопентанкарбоновой кислоты общей формулы (V)
где R – С1-С5-алкил; R1 и R2 - водород или С1-С5-алкил при условии, что оба одновременно не могут быть водородом;
X - галоген, С1-С5-алкил или фенил;
n=0 - 2,
в качестве промежуточных продуктов для получения производных азола общей формулы (I).
Текст
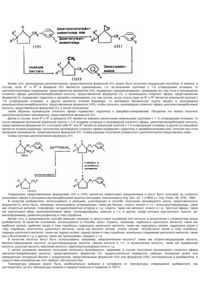
Изобретение касается производного азола, обладающего активностью в борьбе с болезнями растений и рост регулирующей активностью, способов получения азольного производного и промежуточных соединений для получения содержащей азольного производного. В частности изобретение касается 1) производного азола, представленного формулой (I) в которой R1 и R2 представляют собой соответственно С1-С6-алкильную группу или атом водорода; X - атом галогена или алкильную группу с 1-5 атомами углерода или фенильную группу: n - целое число 0 - 2: А - атом азота или СН при условии, что R1 не является Н, если R2 является атомом водорода; 2) способа получения производного азола, представленного формулой (I), включающего следующие .операции: а) (I) взаимодействие сложного ал-кильного эфира 2-оксициклопентанкарбо-новой кислоты с подходящим замещенным галоидным бензилом и взаимодействие полученного таким образом сложного алкильного эфира 1-(замещенный бензил)-2оксоциклопентанкарбоновой кислоты с С1-С5-алкилгалогенидом; (II) взаимодействие сложного алкильного эфира 3-(С1-С5-алкил)-2оксоциклопентанкарбоновой кислоты с замещенным галоидным бензином или (III) взаимодействие 1-(замещенный бензил)-3-(С1-С5алкил)-2-оксоциклопентанкарбоновой кислоты с галоидным С,-С5-алкилом, с получением при этом производного сложного эфира циклопентанкар-боновой кислоты, представленной формулой в которой R' и R2 соответственно представляют собой С1-С5-алкильную группу или атом водорода: R – С1-С5-апкильную группу; X - атом галогена: С1-С5-алкильную группу или фенильную группу и п означает целое число 0-2, при условии, что R1 не является атомом водорода, если R2 является атомом водорода; в) гидролитическое декарбоксилиро-вание полученного таким образом производного сложного эфира циклопентан-карбоновой кислоты с получением при этом производного циклопентанона, представленного формулой в которой R1, R2, X и n соответственно имеют те же значения, определенные для них выше; с) полученное таким образом производное циклопентанона подвергают оксирановой реакции, используя илиды сульфония или оксосульфония, или подвергают метиленциклопентановое производное, полученное таким образом из производного циклопентанона реакций Виттига и представленное формулой в которой R1, R2, X и n соответственно имеют значения, определенные ранее, эпоксидированию, обращая при этом производное циклопентанона в этиленок-сидное производное, представленное формулой в которой R1, R2, X и n соответственно представляют собой те же значения, которые были определены для них ранее, и затем d) взаимодействие полученного эти-леноксидного производного с 1,2,4-триа-золом или амидазолом, представленным формулой где N представляет собой атом водорода или атом щелочного металла и А - атом азота или -СН=, с получением при этом азольного производного, представленного формулой в которой R1 и R2 соответственно представляют собой алкильную группу с 1 - 5 углеродными атомами или атом водорода: X является атомом галогена, алкильной группой с 1 - 5 атомами углерода или фенильной группой; n - целое число 0 - 2 и А - атом водорода или СН при условии, если R' не является атомом водорода, a R2 является атомом водорода, и композиции для использования в полеводстве и садоводстве, обладающей фунгицидной активностью и регулирующей рост растений активностью, которая включает эффективное количество производного азола, представленного формулой (I). Ущерб, причиняемый культурным растениям болезнями растений, огромен, и возникает также проблема загрязнения окружающей среды, обусловленного химикалиями, используемыми в борьбе с болезнями растений. Следовательно, предложение химиката для полеводства и садоводства, который был бы эффективным в борьбе с болезнями растений, имел низкую токсичность по отношению к человеку, зверям, птицам и рыбам и низкую фитоток-сичность к полезным растениям, т.е. сельскохозяйственного химиката, обладающего отличным действием против болезней растений в широком диапазоне, высоко безопасного в обращении и оказывающего незначительное влияние на окружающую среду, является насущной необходимостью. Чтобы удовлетворить эту потребность, были предложены следующие фунгициды для использования в полеводстве и садоводстве. 1) Соединения триазолов или имидазолов, представленные следующей формулой: в которой R' представляет собой -СН=СН-Х, -ОС-X или -СН2-СН2-Х (где X означает атом водорода, алкильную группу, оксиал-кильную группу, алкоксиалкильную группу, циклоалкильную группу, замещенную ариальную группу, которая может быть замещена, аралкильную группу, которая может быть замещена, арилоксиалкиль-ную группу, которая может быть заменена, или гетероциклическую группу, которая может быть замещена); R2 представляет собой алкильную группу, циклоалкильную группу или арильную группу, которая может быть замещена; Z представляет собой атом хлора, цианогруппу или -OR3 (где R3 является атомом водорода, ацетильной группой, алкильной группой, алкенильной группой или аралкильной группой) и Y представляет собой атом азота или СН, и их кислые аддитивные соли и их металлические комплексы. 2) Соединения триазолов или имида-золов, представленные следующей формулой: в которой R представляет собой группу с мостиковой связью: -СН=СН-, -О-, -S-, -NH- или -С(=О)-; X представляет собой атом азота или СН; Y и Z могут быть одинаковыми или отличными друг от друга и соответственно представляют собой атом галогена, алкильную группу, алкок-сигруппу, галоидоалкоксигруппу, гапоидалкильную группу, нитрогруппу, фенильную группу или феноксигруппу, a m и Р соответственно означают 0, 1, 2 или 3, и их кислоту, металлический комплекс и их функциональные производные. 3) Производные 1-оксиэтилазола, представленные следующей формулой: в которой R представляет собой алкильную группу, циклоалкильную группу, которая может быть замещена, или фенильную группу, которая может быть замещена; X - атом азота или СН; Y представляет собой -ОСН2-, -СН2-СН3- или -СН=СН-; Z - атом галогена, алкильную группу, циклоалкильную группу, алкоксиг-руппу, алкилтиогруппу, галогеноалкиль-ную группу, галоидалкоксигруппу, галои-далкилтиогруппу, фенильную группу, которая может быть замещена, феноксигруппу, которая может быть замещена, или фенилалкильную группу, которая может быть замещена, или фенилалкоксигруп-пу, которая может быть защищена, a m означает 0, 1, 2 или 3; их кислые аддитивные соли и металлические комплексы. 4) Соединения циклоалифатических спиртов, представленные следующей формулой: в которой R6 представляет собой незамещенную фенильную группу или замещенную фенильную группу 1-5 группами, выбранными среди групп, включающих атом(ы) галогена, аминогруппу(ы), нитрогруппу(ы), цианогруппу(ы), фенильную группу(ы), галоидофенильную груп-пу(ы), С1-С10-алкильную группу(ы), га-лоидо-С1-С10-алкильную группу(ы), С1-С10-алкоксигруппу(ы), галоидо-С1-С10-алкоксигруппу(ы), С1-С10-алкилтиогруппу(ы), С1-С10-алкилендитиоксигруппу(ы), С1-С10-алкиламиногруппу(ы), и ди-С1-С10-алкиламиногруппы; X представляет собой атом азота или метиновую группу; кольцо А является циклопентановым кольцом, циклогексановым, циклогептановым, индановым, тетрагидронафталиновым или бензоцикло-пентановым кольцом, каждое из перечисленных колец не замещено или замещено в бензольном кольце 1-4 заместителями из числа упомянутых выше (ссылка на выложенную заявку (Кокай) на патент Японии №58-189171 (1983), соответствующую патенту США №4503062 и Европейскому патенту №94146). 5) Триазольные или имидазольные соединения, представленные следующей формулой: в которой W является СН или атом азота; О - замещенной или незамещенной арильной группой, в частности замещенной или незамещенной аралкильной группой, или замещенной или незамещенной алкиль-ной группой: R1, R2, R3, R4, R5, R6, R7 и R8 могут быть одинаковыми или отличными друг от друга и соответственно представляют собой атом водорода, оксигруппу, алкильную группу, циклоалкильную группу, замещенную или незамещенную арал-кильную группу, замещенную или незамещенную фенильную группу или любая из пар радикалов R1 и R2, R3 и R4, R5 и R6 или R7 и R8 представляет собой карбонильную группу (С=0) вместе с соседним углеродным атомом кольца; R9 и R10 могут быть одинаковыми или отличными друг от друга и представляют собой соответственно атом водорода, алкильную группу, циклоалкильную группу, замещенную или незамещенную аралкильную группу или замещенную или незамещенную фенильную группу и означает 0 или 1; их стереоизомеры, их кислые аддитивные соли и их металлические комплексы (ссылка на выложенную заявку (Кокай) на патент Японии № 60-215674 (1985), соответствующую Европейскому патенту № 153797). Французский патент № 2587028, опубликованный 13 марта 1987 г. (соответствует Патенту УВ № 2180236, опубликованный 15 марта 1987 г.), раскрывает ближайший аналог предложенных соединений производное азола следующей формулы: п которой X представляет собой соответственно атом галогена, алкильную группу, фенильную группу, цианогруппу или нит-рогруппу; п - целое число 0-5 и А представляет собой атом азота или СН при условии, что X может быть одинаковым или разным, если п равно 1-5, полезное для подавления болезней растений. Далее изобретение предусматривает синтез многих производных азола и их проверку на полезность в качестве фунгицида для растениеводства и садоводства, который был бы малотоксичным для человека и животных, был бы безопасным в обращении и проявлял высокую эффективность в борьбе с широким спектром болезней растений, и в результате этих исследований было установлено, что производное азола, представленное формулой (I) в которой R1 и R2 соответственно представляют собой С1-С5-алкильную группу или атом водорода: X - атом галогена, С1-С5алкильную группу или фенильную группу; п означает целое число 0-2 и А - атом азота или СН при условии, что R1 не является атомом водорода, если R2 является атомом водорода, не только обладает упомянутыми выше свойствами, но еще и может быть эффективно применено в качестве средства, регулирующего рост растений. На основе установления этих феноменов было создано изобретение. Целью изобретения является производное азола, полезное в качестве активного ингредиента в композиции, применяемой в полеводстве и садоводстве, обладающей активностью в борьбе с болезнями растений и проявляющей активность в регулировании роста растений, способ получения производного азола и композиция, для применения в полеводстве и садоводстве, содержащая в качестве активного ингредиента производное азола, которое обладает высоким действием в борьбе с различными болезнями растений и в то же время является эффективным регулятором роста растений, малотоксичным и безопасным в обращении. В первом аспекте изобретения предусмотрено производное азола, представленной формулой (I) в которой R1 и R2 соответственно представляют собой С1-С5-алкильную группу или атом водорода: X - атом галогена, С1-С5алкильную группу или фенильную группу; п означает целое число 0-2 и А - атом азота или СН при условии, что R1 не является атомом водорода, если R2 является атомом водорода. Вторым аспектом изобретения предусмотрен способ получения производного азола, представленного формулой (I) в которой R' и R2 соответственно представляют собой С1-С5-апкильную группу или атом водорода: X представляет собой атом галогена или алкильную группу,-с 1-5 углеродными атомами или фенильную группу; п - целое число 0-2 и А представляет собой атом азота или СН при условии, что R1 не является атомом водорода, если R2 является атомом водорода, который (способ) включает следующие операций: а) (I) взаимодействие сложного ал-кильного эфира 2-оксоциклопентакарбо-новой кислоты с замещенным галоидным бензилом и взаимодействие полученного таким образом сложного алкильного эфира 1-(замещенный бензил)-2- оксоцикло-пентанкарбоновой кислоты с С1-С5-галои-доалкилом; (II) взаимодействие сложного алкильного эфира 3-(С1-С5-алкил)-2-оксо-циклопентанкарбоновой кислоты с замещенным галоидным бензилом или (111) взаимодействие 1-(замещенный бензил)-3-(С1-С5-алкил)-2оксоциклопентанкарбо-новой кислоты с С1-С5-алкилгалогенидом, получая при этом производное сложного эфира циклопентанкарбоновой кислоты, представленной формулой (V) в которой R1 и R2 соответственно представляют собой алкильную группу с 1-5 углеродными атомами или атом водорода; R алкильной группой с 1 -5 углеродными атомами; X представляет собой атом галогена, алкильную группу с 1-5 углеродными атомами или фенильную группу и п - целое число 0-2 npij условии, что R1 не является атомом водорода, если R2 является атомом водорода, в) гидролитическое декарбоксилирова-ние полученного таким образом производного сложного эфира циклопентанкарбоновой кислоты с получением при этом производного циклопентанона формулы (IV) в которой R', R2, X и п соответственно имеют значения, определенные для них ранее: с) проведение оксирановой реакции полученного таким образом производного циклопентанона с использованием или-дов сульфония или оксосульфония, или эпоксидирование метиленциклопентаново-го производного, полученного из упомянутого выше производного циклопентанона реакция Виттига и представленного формулой (III): в которой R1, R2, X и п соответственно имеют значения, определенные выше, превращая при этом производное циклопентанона в оксирановое производное, представленной формулой (II) где R1, R2, X и п имеют значения, определенные для них ранее, и d) взаимодействие полученного таким образом оксиранового производного с 1,2,4-триазолом или имидазолом, представленным формулой (VI): в которой М представляет собой атом водорода или атом щелочного металла и А представляет собой атом азота или СН. Третьим аспектом изобретения предусмотрена композиция для использования в полеводстве и садоводстве, обладающая фунгицидной активностью и регулирующей рост растений активностью, которая содержит в качестве активного ингредиента азольное производное, представленное формулой (I): в которой R1 и R2 соответственно представляют собой алкильную группу с 1-5 углеродными атомами или атом водорода: X - атом галогена, алкильную группу с 1-5 атомами углерода или фенильную группу; п - целое число 0-2 и А представляет собой атом азота или СН при условии, что R1 не является атомом водорода, если R2 является атомом водорода. Четвертым аспектом изобретения предусматривается этиленоксидное производное для получения производного азола, представленного формулой (I), которое представлено формулой (II) в которой R1 и R2 соответственно представляют алкильную группу с 1 -5 углеродными атомами или атом водорода: X -атом галогена, алкильную группу с 1-5 углеродными атомами или фенильную группу и п означает целое число 0-2 при условии, что R1 не является атомом водорода, если 2 R является атомом водорода. Пятый аспект изобретения предусматривает метиленциклопентановое производное для получения производного азола, представленного формулой (I), которое представлено формулой (III) в которой R1 и R2 соответственно представляют собой алкильную группу с 1-5 углеродными атомами или атом водорода; X - атом галогена, алкильную группу с 1 -5 углеродными атомами или фенильную группу и п означает целое число 0-2 при условии, что R1 не является атомом водорода, если R2 является атомом водорода. В шестом аспекте изобретение предусматривает циклопентановое производное для получения производного азола, представленного формулой (I), представленное формулой (IV) где R1 и R2 соответственно представляют собой С1-С5 алкильную группу или атом водорода; X - атом галогена, С1-С5 алкильную группу или фенильную группу; п - целое число 0-2, при условии, что R1 не является атомом водорода, когда R2 - водород. Седьмой аспект изобретения предусматривает производное сложного эфира циклопентанкарбоновой кислоты для получения производного азола, представленного формулой (I), которое представлено формулой (V): в которой R1 и R2 соответственно представляют собой алкильную группу с 1-5 атомами углерода или атом водорода; R - алкильную группу с 1-5 углеродными атомами; X - атом галогена, алкильную группу с 1-5 углеродными атомами или фенильную группу и п - целое число 0-2 при условии, что R1 не является атомом водорода, если R2 является атомом водорода. Сущность изобретения - новое азоль-ное производное, представленное формулой (I): в которой R1 и R2 соответственно представляют собой алкильную группу с 1-5 углеродными атомами или атом водорода: X - атом галогена, алкильную группу с 1 -5 углеродными атомами или фенильную группу; п - целое число 0-2 и А -атом азота или СН при условии, что R1 не является атомом водорода, если R2 - атом водорода; способе получения азольного производного, представленного формулой (I), каждое из соединений, используемых в качестве промежуточных, а именно ок-сирановом производном, представленном формулой (II), метиленциклопентйновом, представленном формулой (III), циклопен-тановом, представленном формулой (IV), и производном сложного эфира цикло-пентакарбоновой кислоты, представленном формулой (V), и в композиции для использования в полеводстве и садоводстве, содержащей азольное производное формулы (І) в качестве активного ингредиента и обладающей фунгицидной активностью и активностью регулятора роста растений. Физические и химические свойства производного азола, представленного формулой (I), и каждого из промежуточных соединений для получения азольного производного показаны в табл. 1-5. Кроме того, каждое из этих промежуточных соединений является новым соединением. В азольном производном, представленном формулой (I), с точки зрения активности в борьбе с болезнями растений и активности в регулировании роста растений производное азола, в котором R1 является атомом водорода или алкильной группой с 1-4 углеродными атомами; R2 является атомом водорода или алкилом с 1-3 углеродными атомами (оба R1 и R2 не могут представлять собой атомы водорода одновременно); X является атомом галогена, замещающим 4-е положение бензольного кольца; п равно единице и А представляет собой атом азота или СН, предпочтительно и более того, азольное производное, в котором R1 и R2 соответственно представляют собой атом водорода или алкильную группу с 1-3 углеродными атомами (оба R' и R2 не являются атомами водорода одновременно); X представляет собой атом галогена * замещающий 4-е положение бензольногокольца; означает единицу и А представляет собой атом азота, наиболее предпочтительны. Из соединений, приведенных в табл. 1, предпочтительными соединениями являются соединения 1-3, 5, 9-11, 16, 18, 29-32, 37, 38, 42-45, 50, 59, 62, 63, 65 и 69. Производное азола согласно изобретению получают следующим способом. Целевое производное азола, представленное формулой (I), может быть получено взаимодействием этиленоксидно-го производного, представленного формулой (II), с 1,2,4-триазолом или имида-золом, представленным формулой (VI), в присутствии разбавителя: в которой М представляет собой атом водорода или атом щелочного металла и А представляет собой атом азота или СН. Этиленоксидное производное, представленное формулой (II), которое используется в качестве исходного вещества, может быть получено следующим способом, а именно, взаимодействием цикло-пентанона, представленного формулой (IV), с илидом сульфония или оксисуль-фония, например метилидом диметилок-сосульфония или метилидом диметил-сульфония в присутствии разбавителя по методу, описанным в Org. Synt. 49 780968) и в I. Amer. chem. Soc. (1965) 1353; с получением этиленоксидного соединения, представленного формулой (II) (этот метод назван как А-метод). И еще один, отличный от первого метод (названный как В-метОд), согласно которому мети-ленциклопентан, представленный формулой (II), получает из циклопентанона, представленного формулой (IV) реакцией Виттига (Org. Syn. 40, 66 (1966) и I. Org. Chem. 28. (1963), 1128), а затем этиле-ноксидное производное, представленное формулой (II), может быть получено эпок-сидированием из полученного таким образом соединения (Org. Syn. Coll. vol. 4, 552 (1963), 49, 62 (1969). Схема реакций согласно А-методу и В-методу представлена ниже. Способы получения оксиранового производного, представленного формулой (И): Кроме того, производное циклопентанона, представленное формулой (IV), может быть получено следующим способом. А именно, в случае, если R1 и R2 в формуле (IV) являются одинаковыми, т.е. ал-кильными группами с 1-5 углеродными атомами, то циклопентаноновое соединение, представленное формулой (VII), подвергают диалкилированию, превращая его при этом в производное сложного эфира циклопентанкарбоновой кислоты, представленной формулой (V), и производное сложного эфира, представленное формулой (I), подвергают гидролизу и декарбок-силированию, а в том случае, когда только один из R1 и R2 является алкильной группой с 1-5 углеродными атомами, а другой является атомом водорода, то желаемую бензильную группу вводят в производное алкилциклопентанкарбоксилата, представленное формулой (VIII), чтобы получить производное сложного эфира циклопентанкарбоновой кислоты, представленное формулой (V), и затем полученное таким образом производное сложного эфира подвергают гидролизу и декарбок-силированию. Проделав это можно получить циклопентаноновое производное, представленное формулой (IV). Далее в случае, если R' и R2 в формуле (IV) являются взаимно различными алкильными группами с 1 -5 углеродными атомами, то после введения различной алкильной группы с 1-5 атомами углерода в производное сложного эфира, циклопентанкарбоновой кислоты, представленное формулой (V), в которой либо R1 или R2 является алкильной группой с 1-5 углеродными атомами, а другой (оставшийся) является атомом водорода, полученное производное сложного эфира подвергают гидролизу и декарбоксилирова-нию, получая при этом желаемое производное, представленное формулой (IV). Схема реакции получения упомянутого циклопентанона представлена ниже. Схема синтеза циклопентанона формулы (IV) Соединения, представленные формулами (VII) и (VIII), являются известными соединениями и могут быть получены из сложного алкилового эфира 2-оксоцикло-пентанкарбоновой кислоты методами, описанными в Org. Syn. 45, 7 (1965) и I. Org. Chem. 29, 2781, 1964. В качестве разбавителя, используемого в реакциях, участвующих в способе получения производного азола, представленного формулой (I), могут быть, например, использованы углеводороды, такие как бензол, толуол, ксилол и т.п.; галои-доуглеводороды, такие как хлористый метилен, хлороформ, четыреххлористый углерод и т.д.; спирты, такие как метанол, этанол и т.д.; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан и т.п. и другие, среди которых ацетонитрил, ацетон, диметилформамид, диметилсульфоксид и тому подобные. Кроме того, в предложенном способе реакцию проводят в присутствии основания или кислоты в дополнение к упомянутому выше разбавителю. В качестве основания, используемого в способе, могут служить, например, карбонаты щелочного металла, такие как карбонат натрия,карбонат калия и тому подобные; гидроокиси щелочного металла, такие как гидроокись натрия, гидроокись калия и тому подобные; алкоголяты щелочного металла, такие как метилат натрия, этилат натрия, тетрабутилат калия и тому подобные; гидриды щелочного металла, такие как гидрид натрия, гидрид калия и тому подобные; алкильные соединения щелочного металла, такие как н-бутиллитий и т.д. и другие, такие как триэтиламин, пиридин и т.д. В качестве кислоты могут быть использованы, например, неорганические кислоты? такие как хлористоводородная кислота, бромистоводородная кислота, ио-дистоводородная кислота, серная кислота и т.п.; и органические кислоты, такие как муравьиная кислота, уксусная кислота, масляная кислота, паратолуолсульфокис-лота и т.д. С целью ускорения процесса получения азольного производного, например, в случае получения производного сложного эфира циклопентанкарбоновой кислоты, представленного формулой (V), предпочтительно подвергать реакции галоидный алкил или замещенный галоидный бензил с соединением, представленным формулой (VII) или формулой (VIII), растворенным в разбавителе, в присутствии основания как того требуют обстоятельства. Температура реакции может быть необязательно выбрана в интервале от температуры отверждения разбавителя, как растворителя, до его температуры кипения и предпочтительно в пределах 0-100°С. Производное, представленное формулой (IV), может быть получено декарбок-силированием производного сложного эфира циклопентанкарбоновой кислоты, представленного формулой (V) при 80-150°С с неорганической или органической кислотой в течение 224 ч. предпочтительно при перемешивании. Чтобы получить оксирановое производное, представленное формулой (II) в случае применения метода £> предпочтительно добавлять раствор, приготовленный растворением кетона, представленного формулой (IV) в разбавителе (в особенности предпочтителен диметилсульфоксид) к метилиду диметилоксосульфония или к метилиду диметилсульфония, полученному смешением эквивалентного количества основания (например, гидрида натрия) и иодида триметилоксосульфонил или иодида триметилсульфония, и дать прореагировать двум соединениям. В этом случае количество метилида диметилоксосульфония или метилида диметилсульфония, участвующего в реакции, предпочтительно составляет 1,0-2,0 эквивалентных количеств производного цикло-пентанона, представленного формулой (IV). Реакцию предпочтительно проводят в интервале температур 25-100°С и в течение 1-40 ч. В случае получения оксиранового производного методом В производное цик-лопентанона, представленное формулой (IV), добавляют к метилиду трифенилфос-фина (реактив Виттига), приготовленному смешением эквивалентного количества основания (например, гидрида натрия) и га-логенида метилтрифенилфосфония в разбавителе (особенно предпочтителен диметилсульфоксид) и провести реакцию двух соединений в интервале температур 0-100°С и в течение времени 2-10 ч. Образовавшееся производное метиленцикло-пентанона, представленное формулой (III), выделяют, растворяют в разбавителе и подвергают взаимодействию при (10)°С до точки кипения разбавителя, предпочтительно (-10)-(60)°С после добавления перекиси водорода или органической пер-кис-лоты, такой как надуксусная кислота, над-бензойная кислоты, м-хлорнадбензойная кислота и тому подобные. Оксирановое производное (соединение II), полученное из производного циклопентанона, представленное формулой (IV), методом А или методом В, дает следующие стереоизомерные структуры относительно конформации оксирановой группы в 3-положении и замещенной бен-зильной группы в 7-положении 1-оксас-пиро (2,4)-гептана оксиранового соединения, представленного формулой (II) разделение этих изомеров, представленных формулами (Н-А) и (Н-В), может быть проведено, например, хроматографичес-кими методами (тонкослойная хроматог-рафия, колоночная хроматография, высокоэффективная жидкостная хроматография и так далее). Характеристики структуры этих стереоизомеров могут быть найдены, например, спектром ядерного магнитного резонанса. Чтобы получить азольное производное, представленное формулой (I), окси-рановое соединение, представленное формулой (II), добавляют в присутствии основания, требующегося по обстоятельствам, к раствору, приготовленному растворением азольного соединения, представленного формулой (VI), в разбавителе или напротив соль щелочного металла азольного соединения добавляют к раствору, приготовленному растворением оксиранового соединения в разбавителе, и дают прореагировать двум соединениям. Температура реакции может быть необязательно выбрана в интервале отточки отверждения до точки кипения разбавителя, однако на практике предпочтительно проводить реакцию при 0-120°С и более предпочтительно 60-120°С в течение 1-10. ч при перемешивании. После завершения реакции полученную таким образом реакционную смесь охлаждали и экстрагировали органическим растворителем, таким, как этилаце-ттг, хлороформ, хлористый метилен, бензол и т.д. в ледяной воде. После отделения органического слоя, промывки его водой и сушки промытого слоя растворитель отгоняли при пониженном давлении из органического слоя. Полученный таким образом остаток подвергали очистке и таким образом получали целевое соединение. Очистку осуществляли подвергая остаток перекристаллизации, хрома-тографии на силикагеле и тому подобному. Поскольку существуют два изомера, представленные формулами (Н-А) и (Н-В) в оксирановом соединении, являющемся исходным соединением для получения азольного производного, представленного формулой (I), то имеют место следующие стереоизомеры в целевом азольном производном, представленном формулой (I), которое получено реакцией оксиранового соединения, представленного формулой (II) и 1,2,4-триазола или имидазола, представленного формулой (VI): - за воображаемой плоскостью; - на воображаемой плоскости; - перед воображаемой плоскостью. Разумеется, что разделение изомеров, представленных формулами (1-А) и (1-В), может быть выполнено, например, хроматографическими методами. Полезность азольного производного (азолилциклопентанолового производного), представленного формулой (І) в качестве активного ингредиента композиции для полеводства и садоводства, разъясняется далее. (1) Фунгицидное действие на грибковые болезни растений. Производное азола согласно изобретению показывает эффективность в борьбе со следующими болезнями растений в широком диапазоне. Кроме того, азольное производное оказывает не только профилактическое действие, но и также терапевтическое действие на некоторые болезни растений. (2) Активность в регулировании роста растений. По мере выяснения механизма регулирования роста растений растительными гормонами в практику полеводства и садоводства за последние годы входят химикаты, названные регуляторами роста растений. Например, получение бессеменного винограда с помощью гиббереллина, стимулирование укоренения черенков нафталин-уксусной кислотой и использование хлористого 2-хлорэтилтриметиламмония (торговое название ССС) в качестве замедлителя роста пшеницы, известно. Кроме того, применение методов регулирования жизненного цикла растений с использованием регуляторов роста растений распространилось не только на культурные растения, такие как хлебные, злаки, овощные растения, фруктовые деревья и т.д., но также и на садовые растения, такие как цветы и другие и далее на деревья как растения в широком значении, и функция регуляторов роста растений распространилась на стимулирование укоренения, регулирование цветения, плодоношения, увеличение размеров фруктов, промотирование роста, регулирование роста и регуляция метаболизма. Следовательно, использование видов и количеств средств для регулирования роста растений имеет за последние годы тенденцию роста, однако спрос на средства для регулирования роста растений опережает предложения, не стимулированные в таком объеме, как ожидалось. Азольное производное (азолилцикло-пентаноловое производное) согласно изобретению обладает специфическим свойством проявлять различную активность по регулированию роста растений в широких пределах, которое поясняется на следующих примерах: I) ингибирование вегетативного роста растений, в частности ингибирование роста растений в высоту; II) повышение активности и содержания полезного компонента растений и III) активность, регулирующая сроки цветения и сроки созревания растений. Примером использования ингибирую-щей рост активности по пункту I) является ингибирование роста сорняков (гербицид-ная функция) и дерна; предотвращение полегания растений, подверженных полеганию, таких как рисовые растения, ячмень, пшеница и т.д.; применение механического метода регулирования цветения сои культурной и хлопчатника ингибирова-нием роста в высоту; ингибирование зарождения пазушных почек для стимулирования роста листьев табака; облегчение операции обрезки ингибированием роста живых изгородей; увеличение коммерческой ценности растений задержкой их роста и т.д., который можно привести в подтверждение ингибирующей активности. Примером использования активности, увеличивающей содержание полезного компонента растений по пункту II), является улучшение качества сахарной свеклы, сахарного тростника и цитрусовых фруктов увеличенным содержанием сахара; повышение качества зерновых культур и сои за счет увеличения содержания белка и т.д. и примером использования регулирующей активности, касающейся сроков созревания фруктов и сроков цветения по пункту III) является приурочение перевозки свежих фруктов и живых цветов к требованиям сезона и др. Для применения производного азола, представленного формулой (І), в качестве фунгицидного средства и регулятора роста растений само производное или смесь производного и носителя (разбавителя) перерабатывают в порошки, смачивающиеся порошки, гранулы, эмульгирующиеся концентраты, жидкие препараты и т.д. и такие препаративные формы могут быть выгодно применены. Кроме того, возможно добавление вспомогательных средств для достижения эффекта, таких как смачивающие агенты, эмульгаторы, связующие средства, кроме носителя. Поскольку производное азола, представленное формулой (I), содержит 1,2,4-триазольное кольцо или имидазоль-ное кольцо, то азольное производное может быть использовано в форме кислой аддитивной соли или в форме металлического комплекса. Кроме того, поскольку в производном азоле, представленном формулой (I), азолилметильная группа, алкильная группа с 1-5 углеродными атомами и замещенная бензильная группа соответственно находятся в 1-м положении, во 2-м и в 5-м положениях цикло-пентанового кольца, то могут существовать стереоизомеры, такие как геометрические цис- и транс-изомеры и оптические изомеры, и изобретение включает в свой объем каждый из изомеров и смеси !• аждого изомера в возможном отношении. Таким образом предлагаемая композиция для использования в полеводстве и садоводстве, включает и композиции, содержащие отдельный изомер или смесь изомеров в качестве активного ингредиента. Производное азола, представленное формулой (I), обладает высокой активностью в борьбе с болезнями растений и активностью регулятора роста растений и является полезным соединением в качестве активного ингредиента в композиции для полеводства и садоводства. Эффективность изобретения может быть разъяснена на конкретных примерах композиции для пылеводства и садоводства, использующей азольное производное в качестве активного ингредиента, однако изобретение не ограничивается этими примерами. Примеры получения производного азола, представленного формулой (I), и каждого из промежуточных соединений для получения азольного производного. Пример 1. Получение метилового эфира 1-(4-хлорбензил)-3,3-диметил- 2-ок-социклопентанкарбоновой кислоты, промежуточное соединение 156, представленное в табл. 5. В 150 мл безводного бензола добавляли 5,0 г гидрида натрия (полученного промыванием 60% масляного гидрида натрия безводным бензолом) при перемешивании в атмосфере гелия и к смеси добавляли 50 г метилового эфира 1 -(4-хлор-бензил)- 2оксоциклопентанкарбоновой кислоты и смесь перемешивали 40 мин при 80°С. После охлаждения смеси до комнатной температуры к реакционной смеси добавляли 5,0 г гидрида натрия (один эквивалент) и реакционную смесь перемешивали 30 мин при 80°С. После охлаждения реакционной смеси до комнатной температуры к реакционной смеси добавляли 29,4 г йодистого металла (один эквивалент) и реакционную смесь перемешивали 6 ч при 80°С. После охлаждения реакционной смеси ее выливали в смесь уксусной кислоты и воды со льдом и реакционную смесь экстрагировали этилацетатом для получения органического слоя. После промывки полученного таким образом органического слоя водным раствором кислого карбоната натрия, а затем солевым раствором промытый органический слой сушили на безводном сульфате натрия и растворитель из органического слоя отгоняли при пониженном давлении. Полученный таким образом остаток подвергали дистилляции при пониженном давлении и очистке и получали 44,8 г целевого соединения (т.кип. 142-143°С (0,7 мм Нд)). Пример 2. Получение 5-(4-хлорбензил)-2,2-диметил-1 циклопентано-на (промежуточное соединение 133 показано в табл. 4). К 120 мл 47%-й бромистоводородной кислоты добавляли 44,8 г метилового эфира 1-(4-хлорбензил)-3,3-диметил- 2-оксоциклопентанкарбоновой кислоты (соединение 155 показано в табл. 5) и полученную смесь энергично перемешивали 12ч при 100°С. После охлаждения реакционной смеси ее переливали в воду со льдом и смесь экстрагировали этилацетатом для получения органического слоя. После промывания органического слоя водным раствором кислого карбоната натрия и затем водным соляным раствором органический слой сушили на безводном сульфате натрия. Отгонкой растворителя из органического слоя при пониженном давлении получали остаток. После дистилляции полученного остатка при пониженном давлении и очистке получали 31 г целевого соединения (т.кип. 124°С (1 мм Нд)). Пример 3. Получение 5-(4-хлорбензил)-2,2-диметил-1- метиленцикло-пентана (промежуточное соединение 122, табл. 3). К 50 мл безводного диметилсульфок-сида добавляли 3,6 г гидрида натрия (полученного промыванием 60% масляного гидрида натрия безводным бензолом) в атмосфере гелия и полученную смесь перемешивали 30 мин при 70°С. После охл.аж-дения реакционной смеси водой со льдом к ней добавляли 53,6 г бромистого ме-тилтрифенилфосфония и полученную смесь перемешивали 30 мин при охлаждении водой со льдом и затем охлажденную смесь перемешивали при комнатной температуре 10 мин. Затем к смеси добавляли 23,6 г 5-(4-хлорбензил)-2,2-диметил-1 -цикло-пентанона (соединение № 133, табл. 4) и полученную смесь перемешивали 1 ч при комнатной температуре и 30 мин при 70°С для завершения реакции. После охлаждения реакционной смеси ее выливали в воду со льдом и экстрагировали этилацетатом для получения органического слоя. После промывания полученного органического слоя водным солевым раствором промытый органический слой сушили на безводном сульфате натрия и растворитель отгоняли из сушенного органического слоя при пониженном давлении. Из полученной смеси маслянистого вещества и твердого вещества маслянистое вещество экстрагировали н-гексаном и полученный н-гексановый экстракт очищали хроматографией на колонке сили-кагеля и получали 22,1 г целевого соединения. Пример 4. Получение 7-(4-хлорбензил )-4,4-диметил-1 -оксаспиро (2,4) гептана (промежуточное соединение 77 и 78, показанное в табл. 2 и полученное методом А). К 70 мл безводного диметилсульфок-сида добавляли 3 г гидрида натрия (полученного промыванием 60%) масляного гидрида натрия безводным бензолом) при перемешивании диметилсульфоксида в атмосфере гелия и затем в полученную смесь добавляли 27,5 г йодистого триме-тилоксосульфония. После перемешивания смеси при комнатной температуре в течение 30 мин добавляли к смеси раствор 23,6 г 5-(4-циклобензил)-2,2-диметил-1-циклопентанона (соединение 133, табл. 4) в 20 мл безводного диметилсульфоксида в течение 30 мин и всю смесь перемешивали 2 ч при 90°С. После охлаждения реакционной смеси ее выливали в воду со льдом и смесь экстрагировали этилацетатом для получе-( ,ния органического слоя. После промывки' органического слоя водным солевым раствором органический слой сушили на безводном сульфате натрия и растворитель отгоняли при пониженном давлении. Полученный остаток подвергали хроматог-рафии на силикагеле и получали 13,95 г целевого соединения 77 и 1,05 г целевого соединения 78. Пример 5. Получение 7-(4-фторбензил)-4,4-диметил-1 -оксаспиро (2,4) гептана (промежуточное соединение № 81 и № 82, представленные в табл. 2, получены способом В). В 170 мл хлороформа растворяли 17 и 5-(4-фторбензил)-2,2-диметил-1- мети-ленциклопентана (соединение № 124, табл. 3) и к нему добавляли в течение 10 мин 27,1 г м-хлорнадбензойной кислоты, полученную смесь перемешивали 2 ч при комнатной температуре. Далее к смеси добавляли в течение 10 мин 25,4 г гидроокиси кальция и смесь перемешивали при комнатной температуре 30 мин. После фильтрования для отделения твердого вещества хлороформовый слой фильтрата конденсировали и получали бесцветный маслянистый материал. Оставшийся маслянистый продукт подвергали хроматографии на колонке силикагеля и получали при этом 4,5 г очищенного целевого соединения 81 и 8,6 г целевого соединения 82. Пример 6. Получение С-5-(2,4-дихлорбензил)-2,2- диметил-1-(1Н-имида-зол-1-ил-метил)-г-1-циклопентанола (соединение 15 показано в табл. 1). В 18 мл безводного диметилформа-мида добавляли 996 мг гидрида натрия (полученного промыванием 60% масляного гидрида натрия безводным бензолом) в атмосфере гелия при перемешивании. Далее к полученной смеси добавляли 2,83 г 1Н-имидазола и смесь перемешивали при комнатной температуре до превращения выделения пузырьков газа. К полученному раствору по каплям приливали раствор, полученный растворением 5,93 г 7-(0,2-дихлорбензил)-4,4-диметил-1 -оксас-пиро (2,4) гептана (соединение 83, табл. 2) в 10 мл безводного диметилформами-да и полученную смесь перемешивали 2 ч при 80°С. После охлаждения реакционную смесь выливали в ледяную воду и полученную смесь экстрагировали этила-цетатом для получения органического слоя. После промывки органического слоя водой органический слой сушили безводным сульфатом натрия и растворитель отгоняли из органического слоя при пониженном давлении. Полученный остаток подвергали очистке хроматографией на колонке силикаге-ля и далее перекристаллизацией смеси нгексанэтилацетат. В результате получали 2,7 г целевого соединения. Пример 7. Получение 1-5-(4-хлорбензил)-2,2- диметил-1 -(1Н-1,2,4-триа-зол-1-ил-метил)-г-1-циклопентанола (соединение 2, в табл. 1), К 30 мл безводного диметилформа-мида добавляли и растворяли при перемешивании в атмосфере гелия 5,0 г (4-хлорбензил)-4,4диметил-1 -оксаспиро (2,2) гептана (соединение 78, табл. 2) и к полученному раствору медленно добавляли 2,2 г натриевой соли 1Н1,2,4-триазола (чистота 90%, имеется в продаже, поставляется Aldrich Co.). Затем смесь перемешивали 2 ч при 70°С. После охлаждения полученной реакционной смеси ее выливали в воду со льдом и всю смесь экстрагировали эти-лацетатом, чтобы получить органический слой. После промывки органического слоя водой органический слой сушили на безводном сульфате натрия и растворитель отгоняли из осушенного органического слоя при пониженном давлении. Полученный остаток подвергали очистке хроматографией на колонке си-ликагеля и получали 3,1 г целевого соединения. Пример 8. Получение 2-(4-хлорбензил)-5-метил-1 - циклопентанона (промежуточное соединение 137, табл. 4). К 126 мл безводного бензола добавляли 3,04 г гидрида натрия (полученного промыванием 60% масляного гидрида натрия безводным бензолом) и затем 18 г метилового эфира З-метил-2-оксоцикло-пентанкарбоновой кислоты добавляли полученной смеси. После перемешивании смеси в течение 1 ч при комнатной температуре к смеси добавляли 21,5 г хлористого 4-хлорбензила, и полученную смесь нагревали с обратным холодильником 6 ч на масляной бане при 90°С. После охлаждения реакционной смеси ее экстрагировали бензолом и бензоловый слой промывали водным солевым раствором. После сушки бензольного слоя на безводном сульфате натрия растворитель отгоняли из осушенного бензольного слоя при пониженном давлении и получали 33,6 г желтовато-коричневого маслянистого продукта - метилового эфира 1-(4-хлорбензил)-3-метил-2оксоциклопен-танкарбоновой кислоты (промежуточное соединение 160, табл. 5). Без очистки в полученный сложный эфир добавляли 100 мл 47% бромистово-дородной кислоты и образовавшуюся смесь энергично перемешивали 18ч при 110°С. После охлаждения реакционной смеси ее экстрагировали хлористым метиленом и органический слой промывали водным раствором карбоната натрия, и затем водным солевым раствором. Промытый органический слой сушили на безводном сульфате натрия и растворитель отгоняли из органического слоя при пониженном давлении. Полученный остаток очищали дистилляцией при пониженном давлении и получали 17,4 г целевого соединения. Пример 9. Получение метилового эфира 1-(4-хлорбензил)-3-этил- 3-метил-2-оксоциклопентанкарбоновой кислоты (промежуточного соединения 178, табл. 5). К 60 мл безводного тетрагидрофура-на добавляли при перемешивании в атмосфере гелия 1,7 гидрида натрия (полученного промыванием 60% масляного гидрида натрия) и затем к полученной смеси добавляли 18,2 г метилового эфира 1-(4-хлорбензил)- Зметил-2-оксоциклопєнтан-карбоновой кислоты (промежуточное соединение 160, табл. 5) всю смесь перемешивали 2 ч при комнатной температуре. После этого к смеси добавляли по каплям 11,1 г йодистого этила, поддерживая температуру смеси в пределах 20-30°С1 и затем всю смесь перемешивают 1 ч при температуре 20-30°С и в дальнейшем еще 1 ч при 60°С. После охлаждения реакционную смесь выливали в смесь уксусной кислоты и ледяной воды и смесь экстрагировали эти-лацетатом для получения органического слоя. После промывки органического слоя водным раствором кислого карбоната натрия, а затем водным солевым раствором промытый органический слой сушили на безводном сульфате натрия и растворитель отгоняли из осушенного органического слоя при пониженном давлении. Полученный остаток очищали дистилляцией при пониженном давлении и получали 15 г целевого соединения. Пример 10. Получение 4-(4-хлорбензил)-7-метил-1 - оксаспиро-(2,4)-гептана (промежуточное соединение 85, табл. 2). К 37 мл безводного диметил-сульфоксида добавляли при перемешивании в атмосфере гелия 1,44 г гидрида натрия (полученного промывкой 60%) масляного гидрида натрия безводным бензолом) и • к полученной смеси добавляли 13,2 г йодистого триметилоксосульфония и всю смесь перемешивали 30 мин при комнатной температуре. Далее к смеси за 10 мин добавляли раствор 12,2 г 2-(4-хлорбензил )-5-метил-1 - циклопентанона (соединение 137, табл. 4) в 12 мл безводного диметилсульфоксида и полученную смесь перемешивали 4 ч при комнатной температуре. Полученную реакционную жидкость выливали в воду со льдом и смесь экстрагировали хлористым метиленом для получения органического слоя. После промывки водным соляным раствором органический слой сушили на безводном сульфате натрия и растворитель из органического осушенного слоя отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на колонке силикагеля и получали 6,67 г целевого соединения. Кроме того, выделены кроме целевого соединения еще три вида изомеров целевого соединения, а именно 0,15 г промежуточного соединения 86, 0,16 г промежуточного соединения 87 и 0,16 г промежуточного соединения 88 (табл. 2). Пример. 11. Получение 4-(4-хлорбензил)-7-этил-1- оксаспиро (2,4)-геп-тана (промежуточные соединения 93-96, табл. 2). В 100 мл хлороформа растворяли 8,0 г 2-(4-хлорбензил)-5-этил-1 -метилен циклопентане (соединение 129, табл. 3) и в течение 5 мин к полученному раствору добавляли 11,6 г м-хлорнадбензой-ной кислоты и всю смесь перемешивали 2 ч при комнатной температуре. К смеси при охлаждении ледяной водой добавляли 11 г гидроокиси кальция и смесь перемешивали при комнатной температуре 30 мин. Выделившееся твердое вещество изолировали фильтрацией, хлороформовый слой фильтрата концентрировали до получения бесцветного маслянистого продукта. Маслянистое вещество очищали хроматографией на колонке сияикагеля и получали 0,7 г соединения 93; 2,4 г соединения 94; 2,2 г соединения 95 и 2,6 г соединения 96, указанных в названии примера. Пример 12. Получение С-2-(4-хлорбензил)-5 метил-1 -(1Н-1,2,4-триазол-1 -илметил)-г-І-циклопентанола (соединение 16, табл. 1). К 10 мл безводного диметилформамида добавляли 630 мг гидрида натрия (полученного промыванием 60% масляного гидрида натрия безводным бензолом) и затем к смеси добавляли 1,8 г 1Н-1,2,4-триазола и всю смесь перемешивали при комнатной температуре до прекращения выделения пузырьков газа. В полученную реакционную смесь добавляли раствор 3,1 г 4-(4-хлорбензил)-7-метил-1-оксаспиро (2,4) гептана (соединение 85, табл. 2) в 6,2 мл безводного диметилформамида и образовавшуюся смесь перемешивали 1 ч при 80°С. После охлаждения полученной реакционной жидкости ее выливали в воду со льдом и полученную смесь экстрагировали хлористым метиленом для получения органического слоя. После промывки органического слоя водным солевым раствором его сушили на безводном сульфате натрия и растворитель отгоняли из органического слоя при пониженном давлении. Полученный остаток очищали хроматографией на колонке силикагеля и далее перекристаллизацией из смеси н-генсанэтилацетат и получали 2,83 г целевого соединения. Пример 13. Получение С-2(4-хлорбензил)-5- метил-1 -(1 Н-имидазол-1 -илметил)-г-1 -циклопентанола (соединение 17, табл. 1). К 10 мл безводного диметилформамида добавляли 670 мг гидрида натрия (полученного промыванием 60% масляного гидрида натрия и затем добавляли 1Г9 г 1н-имидазола и смесь перемешивали при комнатной температуре до тех пор, пока не осветлела реакционная смесь. Далее к смеси добавляли раствор 3,3 г 4-(4-хлорбензил)-7- метил- 1-оксаспиро (2,4) гептана (соединение 85, табл. 2) в 6,6 мл безводного диметилформамида и смесь перемешивали 1 ч при 80°С. После охлаждения реакционную смесь выливали в воду со льдом и полученную смесь экстрагировали хлористым метиленом для получения органического слоя. После промывки органического слоя водным солевым раствором органический слой сушили на безводном сульфате натрия и отгоняли растворитель из органического слоя при пониженном давлении. Полученный остаток очищали хроматографией на си-ликагеле и далее перекристаллизацией из смеси н-гексан-этилацетат и получали 3,16 г целевого соединения. Примеры получения фунгицидных композиций для применения в полеводстве и садоводстве. Пример 14. Дуст (порошок). Три весовых части азольного производного (соединение 3), 40 вес. ч. глины и 57 вес. ч. талька смешивали и измельчали в порошок для приготовления фунгицидной композиции, применяемой в полеводстве и садоводстве в форме дуста. Приготовленную композицию применяли путем распыления. Пример 15. Смачивающий порошок. Пятьдесят весовых частей производного азола (соединение I), 5 вес. ч. соли лигнинсульфокислоты, 3 вес. ч. алкилсуль-фокислоты и 42 вес. ч. диатомовой земли смешивали и измельчали в порошок для получения смачивающегося порошка. Приготовленную композицию применяли в качестве смачивающегося порошка после разведения водой. Пример 16. Гранулы. Пять вес. ч. азольного производного (соединение 16), 43 вес. ч. бентонита, 45 вес. ч. глины и 7 вес. ч. соли лигнинсульфокислоты гомогенно смешивали и после добавления воды перемешивали, придавали форму гранул на экструзионном грануляторе и сушили для получения композиции в форме гранул. Пример 17. Эмульгйрующий концентрат. Двадцать вес. ч. производного азола (соединение 13), 10 вес. ч. ал-киларилового эфира полиоксиэтилена, 3 вес. ч. монолауратаполиоксиэтиленсорби-тана и 67 вес. ч. ксилола гомогенно смешивали и готовили композицию в форме эмульгирующегося концентрата. Примеры применения фунгицидной композиции для полеводства и садоводства в борьбе против болезней растений. Пример 18. Испытания на эффективность в борьбе с Erysiphe graminis f. sp. tritici на пшенице. На молодые всходы пшеницы в стадии второго листа (вид: Norin № 64, по 16 растений на горшок и 3 горшка на опытной делянке), которые выращивали с использованием неглазурованных горшков диаметром 10 см, наносили по 5 мл на горшок по примеру 15 (разбавленный водой до заранее заданной концентрации). После просыхания на воздухе нанесенного разбавленного концентрата на всходы в горшках наносили разбрызгиванием суспензии летних спор Erysiphe graminis f. sp. tritici, которые собирали на пораженных листьях пшеницы, и горшки выдерживали при 20-24°С в течение 24 ч в условиях высокой влажности и затем горшки оставляли в теплице. На 10-й и 12-й день после заражения распространение заболевания на всходах пшеницы оценивали в соответствии со следующими стандартами и эффективность фунгицидной композиции рассчитывали согласно следующей формуле (экспериментальные стандарты): Данные приведены в табл. 6. Пример 19. Испытание эффективности в борьбе с Sp. Macrotheca fuliginea на огурцах. На растения огурцов в стадии второго листа (сорт: Sagami Hampaku, одно растение в горшке и по 3 горшка на опытной делянке), которые выращивали в неглазурованных горшках диаметром 10 см, наносили по 5 мл на горшок водной суспензии смачивающегося порошка, полученного в примере 15 (разбавленный водой до заранее заданной концентрации). После сушки листьев на воздухе на них наносили с помощью кисти споры Sphacrotheca fuliginea с пораженных болезнью листьев огурцов для заражения опытных растений огурцов, и болезнь была вызвана на растениях, содержавшихся в теплице. Через 9 и 11 дней после заражения исследовали степень заболевания растений огурцов, руководствуясь следующими экспериментальными стандартами, эффективность фунгицидной композиции рассчитывали по следующей формуле (экспериментальные стандарты): Результаты испытаний приведены в табл. 7. Пример 20. Испытание на эффективность против puccinia recondita на пше-•нице. На молодые всходы пшеницы в стадии второго листа (сорт Norin 64; по 16 растений на горшок, по три горшка на опытной делянке), которые выращивали в неглазурованных горшках диаметром 10 см, наносили разбрызгиванием 5 мл на горшок водной суспензии смачивающегося порошка, приготовленного по примеру 15 (разбавленного водой до заранее заданной концентрации). После сушки нанесенного состава на воздухе на всходы в горшках наносили разбрызгиванием суспензию летних спор puccinia recondita, собранных со сморщенных листьев пшеницы, и горшки содержали при 20-23°С в течение 24 ч в условиях высокой влажности, а затем горшки оставляли в теплице. Через 7 и 11 дней после заражения распространенность заболевания на растениях пшеницы исследовали, руководствуясь следующими экспериментальными стандартами, и эффективность фунгицидной композиции рассчитывали согласно следующей формуле, исходя из средней степени заболевания на лист (экспериментальные данные): Результаты испытаний представлены в табл. 8. Пример 21. Испытания на эффективность против Botrytis cinerea на фасоли обыкновенной. На листья фасоли обыкновенной в стадии первого истинного листа (сорт Honkintoki), выращенной в неглазурованных горшках диаметром 10 см наносили по 5 мл на горшок разбавленный эмуль-гирующийся концентрат состава, описанного в примере 15 (разбавленного водой до заранее заданной концентрации) путем разбрызгивания. После просыхания на воздухе нанесенного состава на листья непосредственно приклеивали в центральной части листа растений фасоли обыкновенной круглый срез агара диаметром 4 мм, содержащий грибки Botrytis cinerea, которые предварительно выращивали в течение трех дней при 20°С с использованием агаровой среды с добавлением сахара, содержащей картофельный бульон, и растения выдерживали при 20-22*0 в условиях высокой влажности. На третий день после заражения область обусловленной болезнью пятнистости обработанных таким образом растений сравнивали с состоянием контрольных растений (необработанных) для изучения степени заболевания, руководствуясь следующими экспериментальными стандартами, и эффективность фунгицидной композиции рассчитывали по следующей формуле (экспериментальные стандарты): Результаты испытаний представлены в табл. 9. Пример 22. Испытание эффективности фунгицидной композиции против Cochliobolus miyabeanus на растениях риса. В каждый неглазурованный горшок диаметром 10 см высевали по 16 семян риса (сорт Sasanishiki), и когда рассада риса достигала стадии 4-5 листа, наносили 5 мл 1 горшок водной суспензии смачивающегося порошка, описанного в примере 15 (разбавленного водой до заранее заданной концентрации). После сушки на воздухе обработанных таким образом листьев на них наносили разбрызгиванием суспензии спор Cochliobolus miyabeanus, заранее выращенных для этой цели из расчета 5 мл на горшок. Под микроскопом со 150-кратным увеличением в поле микроскопа находили в суспензии 15 спор грибков. Сразу же после заражения обработанные таким образом горшки оставляли в камере инокулирования на два дня в условиях высокой влажности при 25°С1 после чего их переносили в теплицу для продолжения эксперимента. На пятый день после заражения подсчитывали количество пятен болезни на 10 листьях на каждом горшке и эффективность фунгицидной композиции рассчитывали по следующей формуле: Результаты испытаний представлены в табл. 10. Пример 23. Фунгицидные испытания против некоторых патогенных грибков. Этот пример показывает результаты испытаний фунгицидных свойств азольно-го производного против различных патогенных для растений грибков. Метод испытаний. Соединение растворяли в диме-тилсульфоксиде с тем, чтобы получить раствор с заранее заданной концентрацией, и 0,6 мл полученного раствора тщательно смешивали с 60 мл PAS - культу-ральной среды при 60°С в конической колбе емкостью 100 мл. Полученную смесь выливали в стеклянные чашки для культивирования и отверждали как однородную культуральную среду, содержащую соединение. С другой стороны испытуемые грибки, которые заранее были выращены в однородной культуральной среде, захватывали пробковым сверлом диаметром 4 мм и взятый таким образом кусочек культуральной среды, содержащий испытуемый грибок, инокулировали в однородной культуральной среде, содержащей испытуемое соединение. После прививки полученную культуральную среду, содержащую испытуемое соединение и грибок, выращивали 1 -3 дня при подходящей температуре для роста каждого грибка и рост грибков измеряли по диаметру грибковой колонии. При сравнении роста грибков в приготовленной таким образом культуральной среде с ростом грибков в культуральной среде, не содержащей испытуемого соединения, степень ингибирования роста мицел-ия грибков определяли по следующей формуле: где R - степень ингибирования роста мицелия; dc - диаметр колонии грибка в среде, не содержащей соединения: dt - диаметр колонии грибков в среде, содержащей испытуемое соединение. Результаты оценивали по пятибалльной системе согласно следующим стандартам (см. табл. 11). Степень ингибирования роста мицелия: ' 5 - степень ингибирования роста мицелия не менее 90-100%; 4 - степень ингибирования роста не менее» 70% и не более 90%; 3 гл степень ингибирования роста не менее 40% и не более 70%; 2 - степень ингибирования роста не менее 20% и не более 40%; 1 - степень ингибирования роста мицелия не превышает 20%. Примеры композиций для использования в полеводстве и садоводстве, регулирующих роста растений, содержащий азольное производное в качестве активного ингредиента. Пример 24. Форма смачивающегося порошка.. 50 вес. ч. азольного производного (соединение 3, табл. 1), 5 вес. ч. соли лигнин-сульфокислоты, 3 вес. ч. соли алкилсуль-фокислоты и 42 вес. ч. диатомовой земли смешивали и измельчали в порошок для получения композиции в форме смачивающегося порошка. Композицию использовали после разбавления водой. Пример 25. Форма эмульгирую-щегося концентрата 25 вес. ч. азольного производного (соединение 20, табл. 1), 65 вес. ч. ксилола и 10 вес. ч. алкиларило-вого эфира полиоксиэтилена гомогенно смешивали для получения композиции в форме эмульгирующегося концентрата. Композицию следует использовать после разбавления водой. Пример 26. Форма дуста (порошка). 8 вес. ч. азольного соединения (11, табл. 1). 40 вес. ч. бентбнита, 45 вес. ч. глины и 7 вес. ч. соли лигнинсульфокис^ лоты гомогенно смешивали и придавали форму гранул с помощью экструзионного гранулятора и гранулированный материал сушили для получения композиции в форме дуста (здесь имеет место смешение технологии получения дуста и гранул). Пример 27. Эффекты ограничения роста оастений ооста в высоту. В каждую стеклянную чашку диаметром 8,5 см входили по 10 мл раствора, содержащего каждое из соединений в концентрации 10 мил. долей и высевали по 10 семян риса (сорт Sasanishikt) в стеклянную чашку. Чашки содержали в комнате при 27°С в течение 7 дней, чтобы получить всходы риса и затем измеряли высоту сеянцев, чтобы получить данные, представленные в табл. 12. Как видно из данных табл. 12, каждое из производных азола, привлеченных к этим испытаниям, показало эффект ограничения роста в высоту без какой-либо фитотоксичности. Пример 28. Эмульгирующий концентрат, вес. ч.: Соединение формулы (1) 10 Тензиофикс Gs (торговая марка фирмы Гензия Ко.) 3,5 Тензиофикс Ns (-"-) 6,5 Циклогексаном 15 Ксилол 65 Ингредиенты объединялись и перемешивались, образуя эмульгирующий концентрат. Пример 29. Испытание на эффект подавления Erysiphe graminis f. sp. tritici на пшенице проводили с помощью процедуры, по примеру 18 за исключением применения 5 мл на горшок разбавленного эмульгирующего концентрата, полученного согласно примеру 17, вместо применения 5 мл на горшок водной суспензии смачиваемого порошка. Результаты показаны в табл. 13 (номера соединений, показанные в следующих таблицах, являются номерами, приведенными в табл. 1). Пример 30. Испытание на эффект подавления Puccinia recondita на пшенице. Использовали процедуру по примеру 20 за исключением применения 5 мл на горшок разбавленного эмульгирующего концентрата, полученного согласно примеру 17, вместо применения 5 мл на горшок водной суспензии смачиваемого порошка. Результаты показаны в табл. .14. Пример 31. Испытание на эффект подавления Erysiphe gramimis f. sp. tritici на пшенице. Использовали процедуру примера 18 за исключением применения 5 мл на горшок разбавленного эмульгирующего концентрата, полученного согласно примеру 28, вместо 5 мл на горшок водной суспензии смачиваемого порошка. Результату приведены в табл. 15. Пример 32. Испытания на эффект подавления Puccinia recondita на пшенице. Использовали процедуру примера 20 за исключением применения 5 мл на горшок разбавленного эмульгирующего концентрата, полученного согласно примеру 28, вместо 5 мл водной суспензии смачиваемого порошка. Результаты приведены в табл. 16. Пример 33. Эффект сдерживания высоты растений на растениях риса. Использовали процедуру примера 27 за исключением того, что вводили водные суспензии смачиваемого порошка, полученного согласно примеру 24, в концентрации 10 част./млн. вместо раствора, содержащего каждое из соединений согласно изобретения с концентрацией 10 част./млн. Результаты показаны в табл. 17. Все испытанные соединения не обнаруживали каких-либо признаков токсичности по отношению к растениям риса. Пример 34. Испытание на эффект подавления Puccinia recondita на пшенице проводили с использованием процедуры примера 20, за исключением применения 3 кг/га дуста, приготовленного согласно примеру 14, вместо применения 5 мл на горшок водной суспензии смачиваемого порошка. Результаты приведены в табл. 18. Пример 35. Испытание на эффект подавления Erysiphe graminis f. sp. tritici на пшенице проводили с использованием процедуры примера 18, за исключением применения 3 кг на 1 га дуста, приготовленного согласно примеру 14, вместо применения 5 мл на горшок водной суспензии смачиваемого порошка. Результаты приведены в табл. 19. Пример 36. Испытание гранул на эффект подавления Puccinia recondita на пшенице проводили с использованием процедуры примера 20, за исключением применения 3 кг/га гранул, полученных согласно примеру 16, на молодых сеянцах пшеницы на стадии первого листа, вместо применения 5 мл на горшок водной суспензии смачиваемого порошка на молодых сеянцах пшеницы в стадии второго листа. Результаты показаны в табл. 20. Пример 37. Испытания гранул на эффект подавления Eryciphe graminis f. sp. tritici на пшенице проводили с использованием процедуры примера 18, за исключением применения 3 кг на 1 га гранул, приготовленных согласно примеру 16, на молодых сеянцах пшеницы в стадии 43 27101 44 первого листа, вместо применения 5 мл на горшок водной суспензии смачиваемого порошка на молодых сеянцах пшеницы в стадии второго листа. Результаты приведены в табл. 21. Пример 38. Эффект гранул по сдерживанию роста растений в высоту на растениях риса. Семена растений риса (разновидность САСАНИСИКИ) проращивались в ящике 10 ('и Результаты представлены в табл. 22. Пример 39. Влияние эмульгирую-щего концентрата по сдерживанию роста в высоту на растениях риса. Повторяли процедуру примера 38, но использовали 500 мл на ящик разбавленного эмульги-рующего концентрата, приготовленного в соответствии с-примером 25. Результаты приведены в табл. 23. Пример 40. Эффект дуста по сдерживанию высоты растений на растениях риса. Семена растений риса (разновидность САСАНИСИКИ) опылялись в количестве 0,5 мас.% в расчете на сухой вес семян дустом, приготовленным согласно примеру 26. Обработанные семена проращивались в ящике для выращивания рассады размером 300x600x30 мл и после этого - в теплице в течение 14 дней. Показатели сдерживания высоты растений вычисляли таким же образом, как в примере 38. Результаты показаны в табл. 24. Пример 41. Испытание на эффект подавления Puccinia recondita на пшенице. Названные испытания проводились с использованием процедуры примера 20, за исключением того, что применялось 5 мл на горшок водной суспензии смачиваемого порошка соединения, показанного в табл. 25 и 26, вместо смачиваемого порошка по примеру 15. Пример 42. Испытания на эффект подавления Botrytis cinerea на фасоли обыкновенной проводились с использованием примера 21 за исключением применения 5 мл на горшок водной суспензии Смачиваемого порошка соединения, показанного в табл. 26, вместо смачиваемого порошка по примеру 15. П р и м е р 43. Смачиваемый порошок мае. ч. . Соединения формулы (I) 80 20 25 30 35 40 45 50 55 Синтетическая аморфная двуокись кремния ' 3 Каолинит 13 Алкилнафталинсульфонат натрия 2 Лигнинсульфонат натрия 2 Ингредиенты смешивались с образованием смачиваемого порошка. Пример 44. Дуст маїс. ч. Соединение формулы (I) 1 Каолинит 99 Ингредиенты смешивались и пульве-ризовались с образованием дуста. Пример 45. Эмульгируемый концентрат мас.ч. Соединение формулы (I) 40 Циклогексаном 15 Ксилол 25 Додецилбензолсульфонат натрия 8 Бутилфенолполиэтилен-гликолевый эфир (36 моль окиси этилена) 12 Ингредиенты объединялись и перемешивались с образованием эмульгируемо-го концентрата. Пример 46. Испытания на эффект подавления Puccinia recondita на пшенице проводились с использованием процедуры примера 20, за исключением применения смачиваемого порошка примера 43 вместо смачиваемого порошка, полученного по примеру 15. Результаты показаны в табл. 27. Испытание на эффект подавления Eryciphe graminis f. sp. tritici на пшенице. Названные испытания проводились с использованием процедуры примера 18, за исключением применения смачиваемого порошка, полученного в примере 43, вместо смачиваемого порошка, полученного по примеру 15. Результаты показаны в табл. 28. Эффект сдерживания высоты растений на растениях риса. Семена растений риса (разновидность: САСАНИСИКИ) проращивались в ящиках для выращивания рассады размером 300x600x300 мм до начальной стадии появления зелени. Разбавленный смачиваемый порошок, полученный в примере 43, разбавленный водой до заданной концентрации в количестве 500 мл на ящик равномерно распылялся на сеянцах. Обработанные сеянцы хранились в теплице в течение 14 дней и показатели сдерживания высоты растений вычислялись согласно следующему уравнению. Показатель сдерживания высоты растений, % Результаты показаны в табл. 29, Пример 47. Испытания на эффект подавления Puccinia recondita на пшенице проводили с использованием процедуры примера 20, за исключением того, что применялся порошок, приготовленный в примере 44, вместо смачиваемого порошка, полученного в примере 15. Результаты показаны в табл. 30. Испытания на эффект подавления Erysiphe graminis f. sp. tririci на пшенице проводились с использованием процедуры примера 18, за исключением применения пороаїка, приготовленного по примеру 44, вместо смачиваемого порошка, полученного в примере 15. Результаты показаны в табл. 31. Эффект сдерживания высоты растений на растениях риса при применении дуста. Семена растений риса (разновидность: САСАНИСИКИ) опылялись порошком, полученным в примере 44, в количестве 0,5 мас.% в расчете на сухой вес семян. Обработанные семена проращивались в ящике для выращивания рассады размером 300x600x30 мм и выращивались в теплице в течение 14 дней. Показатели сдерживания высоты растений вычислялись та:?им же образом, как в примере 46. Результаты показаны в табл. 32. Пример 48. Испытания на эффект подавления Puccinia recondita на пшенице проводились с использованием процедуры по примеру 20, за исключением применения эмульгируемого концентрата, приготовленного в примере 45, вместо смачиваемого порошка, полученного в примере 15. Результаты показаны в табл. 33. Испытания на эффект подавления Erysiphe graminis f. sp. tritici на пшенице проводились с использованием процедуры примера 18, за исключением применения эмульгируемого концентрата, полученного в примере 45, вместо смачиваемого порошка, полученного в примере 15. Результаты показаны в табл. 34. Эффект сдерживания роста растений на растениях риса. Семена растений риса (разновидность: САСАНИСИКИ) проращивались в ящиках для выращивания рассады размером 300x600x300 мм до начальной стадии появления зелени. Разбавленный эмульгируе-мый концентрат, полученный в примере 45 (разбавленный водой до заданной концентрации) в количестве 500 мл на ящик равномерно разбрызгивался на сеянцы. Обработанные сеянцы хранились в теплице в течение 14 дней, и вычислялись показатели сдерживания высоты растений таким же образом, как в примере 46. Результаты представлены в табл. 35.
ДивитисяДодаткова інформація
Назва патенту англійськоюAzole derivatives, having fungicidal or plant growth-regulating activity, and intermediate compounds for obtaining thereof
Назва патенту російськоюПроизводные азола, обладающие фунгицидной или регулирующей рост растений активностью, и промежуточные соединения для их получения
МПК / Мітки
МПК: C07C 13/00, C07D 521/00, A01N 43/653, C07C 25/00, C07C 69/716, A01N 43/50, C07C 17/26, C07C 49/697, C07C 45/00, C07C 49/657, C07C 67/00, C07C 17/00, C07D 303/00, C07C 45/67, C07C 1/00, C07D 249/08, C07D 233/60
Мітки: отримання, регулюючу, рослин, активність, ріст, похідні, азолу, проміжні, сполуки, мають, фунгіцидну
Код посилання
<a href="https://ua.patents.su/54-27101-pokhidni-azolu-shho-mayut-fungicidnu-abo-regulyuyuchu-rist-roslin-aktivnist-i-promizhni-spoluki-dlya-kh-otrimannya.html" target="_blank" rel="follow" title="База патентів України">Похідні азолу, що мають фунгіцидну або регулюючу ріст рослин активність, і проміжні сполуки для їх отримання</a>
Попередній патент: Гвинтовий класифікатор
Наступний патент: О-метильні похідні азитроміцину а, що мають антибактеріальну активність, спосіб їх отримання та проміжні сполуки
Випадковий патент: Спосіб боротьби із заболочуванням каскадних водосховищ