Похідні тіазолу та їх застосування
Номер патенту: 96735
Опубліковано: 12.12.2011
Автори: Дефорж Гвенаель, Куаттропані Анна, Ковіні Дейвід, Рюкле Томас, Дорбе Жером
Формула / Реферат
1. Похідне тіазолу за Формулою (І)
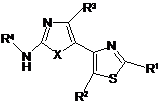 , (I)
, (I)
де R1 вибраний з групи, яку складають -C(O)R5, факультативно заміщений С1-С6-алкіл, факультативно заміщений С2-С6-алкеніл, факультативно заміщений С2-С6-алкініл, факультативно заміщений арил-С1-С6-алкіл, факультативно заміщений гетероарил-С1-С6-алкіл, факультативно заміщений С3-C8-циклоалкіл-С1-С6-алкіл та факультативно заміщений гетероциклоалкіл-С1-С6-алкіл;
R2 вибраний з групи, яку складають Н, галоген, факультативно заміщений С1-С6-алкіл, факультативно заміщений С2-С6-алкеніл та факультативно заміщений С2-С6-алкініл;
R3 вибраний з групи, яку складають Н, галоген, факультативно заміщений С1-С6-алкіл, факультативно заміщений С2-С6-алкеніл та факультативно заміщений С2-С6-алкініл;
R4 вибраний з групи, яку складають -C(O)R6, факультативно заміщений арил, факультативно заміщений гетероарил, факультативно заміщений гетероциклоалкіл та факультативно заміщений С3-С8-циклоалкіл;
R5 вибраний з групи, яку складають Н, гідроксил, факультативно заміщена алкоксигрупа, факультативно заміщена аміногрупа, факультативно заміщений арил, факультативно заміщений гетероарил, факультативно заміщений С3-С8-циклоалкіл та факультативно заміщений гетероциклоалкіл;
R6 вибраний з групи, яку складають Н, факультативно заміщений С1-С6-алкіл, факультативно заміщений С2-С6-алкеніл, факультативно заміщений С2-С6-алкініл, факультативно заміщений арил-С1-С6-алкіл, факультативно заміщений гетероарил-С1-С6-алкіл та факультативно заміщена аміногрупа;
Х вибраний з групи, яку складають S та О;
причому термін "заміщений" означає групи, заміщені 1-5 замісниками, вибраними з групи, яку складають С1-С6-алкіл, С2-С6-алкеніл, С2-С6-алкініл, циклоалкіл, гетероциклоалкіл, С1-С6-алкіларил, С1-С6-алкілгетероарил, С1-С6-алкілциклоалкіл, С1-С6-алкілгетероциклоалкіл, аміногрупа,аміносульфоніл, амоній, ациламіногрупа, амінокарбоніл, арил, гетероарил, сульфініл, сульфоніл, алкоксигрупа, алкоксикарбоніл, карбамат, сульфаніл, галоген, тригалогенметил, ціаногрупа, гідроксил, меркапто-, нітрогрупа;
а також геометричні ізомери, оптично активні форми, наприклад енантіомери, діастереомери та рацемічні форми, а також фармацевтично прийнятні солі цих сполук.
2. Похідне тіазолу за п. 1, де R1 - група -C(O)R5.
3. Похідне тіазолу за п. 1, де R1 вибраний з групи, яку складають факультативно заміщений С1-С6-алкіл, факультативно заміщений С2-С6-алкеніл, факультативно заміщений С2-С6-алкініл, факультативно заміщений арил-С1-С6-алкіл, факультативно заміщений гетероарил-С1-С6-алкіл, факультативно заміщений С3-С8-циклоалкіл-С1-С6-алкіл та факультативно заміщений гетероциклоалкіл-С1-С6-алкіл.
4. Похідне тіазолу за будь-яким із попередніх пунктів, де R2 - Н.
5. Похідне тіазолу за будь-яким із попередніх пунктів, де R3 - факультативно заміщений метил.
6. Похідне тіазолу за будь-яким із попередніх пунктів, де R4 вибраний з групи, яку складають факультативно заміщений арил, факультативно заміщений гетероциклоалкіл та факультативно заміщений С3-С8-циклоалкіл.
7. Похідне тіазолу за будь-яким із пп. 1-5, де R4 - -C(O)R6.
8. Похідне тіазолу за будь-яким із попередніх пунктів, де R5 вибраний з групи, яку складають гідроксил та факультативно заміщена алкоксигрупа.
9. Похідне тіазолу за будь-яким із пп. 1-7, де R5 - факультативно заміщена аміногрупа.
10. Похідне тіазолу за будь-яким із пп. 1-7, де R5 вибраний з групи, яку складають факультативно заміщений арил, факультативно заміщений гетероарил, факультативно заміщений С3-С8-циклоалкіл та факультативно заміщений гетероциклоалкіл.
11. Похідне тіазолу за будь-яким із попередніх пунктів, де R6 вибраний з групи, яку складають факультативно заміщений С2-С6-алкеніл, факультативно заміщений С2-С6-алкініл, факультативно заміщений арил-С1-С6-алкіл та факультативно заміщений С1-С6-алкіл.
12. Похідне тіазолу за будь-яким із пп. 1-10, де R6 - факультативно заміщена аміногрупа.
13. Похідне тіазолу за будь-яким із попередніх пунктів, де Х - S.
14. Похідне тіазолу за будь-яким із попередніх пунктів, де R1 - група -C(O)R5, R2 - Н та R3 - факультативно заміщений метил.
15. Похідне тіазолу за будь-яким із попередніх пунктів, де R1 вибраний з групи, яку складають факультативно заміщений С1-С6-алкіл, факультативно заміщений С2-С6-алкеніл, факультативно заміщений С2-С6-алкініл, факультативно заміщений арил-С1-С6-алкіл та факультативно заміщений гетероарил-С1-С6-алкіл; R2 - Н та R3 - факультативно заміщений метил.
16. Похідне тіазолу за будь-яким із попередніх пунктів, вибране з групи, яку складають:
етил-2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2-карбоксилат;
2'-(ацетиламіно)-N-аліл-4'-метил-4,5'-бі-1,3-тіазол-2-карбоксамід;
N-[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]ацетамід;
2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2-карбонова кислота;
2'-(ацетиламіно)-N-(2-метоксіетил)-4'-метил-4,5'-бі-1,3-тіазол-2-карбоксамід;
2'-(ацетиламіно)-4'-метил-N-(тетрагідрофуран-2-ілметил)-4,5'-бі-1,3-тіазол-2-карбоксамід;
2'-(ацетиламіно)-N-[2-(диметиламіно)етил]-4'-метил-4,5'-бі-1,3-тіазол-2-карбоксамід;
N-[4'-метил-2-(морфолін-4-ілкарбоніл)-4,5'-бі-1,3-тіазол-2'-іл]ацетамід;
N-{4'-метил-2-[(4-метилпіперазин-1-іл)карбоніл]-4,5'-бі-1,3-тіазол-2'-іл}ацетамід;
2'-(ацетиламіно)-N-[3-(диметиламіно)пропіл]-4'-метил-4,5'-бі-1,3-тіазол-2-карбоксамід;
2'-(ацетиламіно)-N-(2-гідроксіетил)-4'-метил-4,5'-бi-1,3-тіазол-2-карбоксамід;
2'-(ацетиламіно)-N-(2-ціаноетил)-4'-метил-4,5'-бі-1,3-тіазол-2-карбоксамід;
2'-(ацетиламіно)-4'-метил-1Н-тетразол-5-іл-4,5'-бі-1,3-тіазол-2-карбоксамід;
4-({[2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2-іл]карбоніл}аміно)бензойна кислота;
3-({[2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2-іл]карбоніл}аміно)бензойна кислота;
2'-(ацетиламіно)-4'-метил-N-[3-(1Н-тетразол-5-іл)феніл]-4,5'-бі-1,3-тіазол-2-карбоксамід;
2'-(ацетиламіно)-N-бензил-4'-метил-4,5'-бi-1,3-тіазол-2-карбоксамід;
2'-(ацетиламіно)-4'-метил-N-пропіл-4,5'-бі-1,3-тіазол-2-карбоксамід;
2'-(ацетиламіно)-4'-метил-N-[4-(1Н-тетразол-5-іл)феніл]-4,5'-бі-1,3-тіазол-2-карбоксамід;
3-({[2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2-іл]карбоніл}аміно)-2-гідроксибензойна кислота;
1-{[2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2-іл]карбоніл}піперидин-3-карбонова кислота;
5-({[2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2-іл]карбоніл}аміно)-2-гідроксибензойна кислота;
N-[4'-метил-2-(2Н-тетразол-5-ілметил)-4,5'-бі-1,3-тіазол-2'-іл]ацетамід;
1-{[2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2-іл]карбоніл}піперидин-4-карбонова кислота;
2'-(ацетиламіно)-N-[3-(5-aміно-1,3,4-тіадіазол-2-іл)феніл]-4'-метил-4,5'-бі-1,3-тіазол-2-карбоксамід;
N-{2-[(3-гідроксипіперидин-1-іл)карбоніл]-4'-метил-4,5'-бі-1,3-тіазол-2'-іл}ацетамід;
N-(2-{[4-(гідроксиметил)піперидин-1-іл]карбоніл}-4'-метил-4,5'-бі-1,3-тіазол-2'-іл)ацетамід;
N-(2-{[4-(2-гідроксіетил)піперидин-1-іл]карбоніл}-4'-метил-4,5'-бi-1,3-тіазол-2'-іл)ацетамід;
N-{2-[(4-гідроксипіперидин-1-іл)карбоніл]-4'-метил-4,5'-бi-1,3-тіазол-2'-іл}ацетамід;
2'-(ацетиламіно)-N-1Н-1,2,3-бензотриазол-5-іл-4'-метил-4,5'-бі-1,3-тіазол-2-карбоксамід;
4-({[2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2-іл]карбоніл}аміно)-2-гідроксибензойна кислота;
4-({[2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2-іл]карбоніл}аміно)-2-фторбензойна кислота;
2'-(ацетиламіно)-N-[3-(5-гідрокси-1,3,4-оксадіазол-2-іл)феніл]-4'-метил-4,5'-бі-1,3-тіазол-2-карбоксамід;
2'-(ацетиламіно)-N-[4-(5-гідрокси-1,3,4-оксадіазол-2-іл)феніл]-4'-метил-4,5'-бі-1,3-тіазол-2-карбоксамід;
N-[2-(гідроксиметил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]ацетамід;
N-(2-метоксіетил)-N'-[4'-метил-2-(морфолін-4-ілкарбоніл)-4,5'-бі-1,3-тіазол-2'-іл]сечовина;
етил-N-({[4'-метил-2-(морфолін-4-ілкарбоніл)-4,5'-бі-1,3-тіазол-2'-іл]аміно}карбоніл)-бета-аланінат;
N-[2-(1,4-дioкca-8-aзаспіро[4.5]дец-8-илкарбоніл)-4'-метил-4,5'-бi-1,3-тіазол-2'-іл]ацетамід;
2'-(ацетиламіно)-N-(2,3-дигідроксипропіл)-4'-метил-4,5'-бі-1,3-тіазол-2-карбоксамід;
N-[4'-метил-2-(морфолін-4-ілкарбоніл)-4,5'-бi-1,3-тіазол-2'-іл]сечовинa;
N-{4'-метил-2-[(3-оксопіперазин-1-іл)карбоніл]-4,5'-бі-1,3-тіазол-2'-іл}ацетамід;
N-{4'-метил-2-[(4-оксопіперидин-1-іл)карбоніл]-4,5'-бі-1,3-тіазол-2'-іл}ацетамід;
N-{2-[(3-гідроксипіролідин-1-іл)карбоніл]-4'-метил-4,5'-бi-1,3-тіазол-2'-іл}ацетамід;
2'-(ацетиламіно)-4'-метил-N-проп-2-ін-1-іл-4,5'-бі-1,3-тіазол-2-карбоксамід;
N-{2-[(4-ацетилпіперазин-1-іл)карбоніл]-4'-метил-4,5'-бі-1,3-тіазол-2'-іл}ацетамід;
N1,N1-димeтил-N2-({[4'-мeтил-2-(мopфoлiн-4-iлкapбoнiл)-4,5'-бi-1,3-тіазол-2'-іл]аміно}карбоніл)гліцинамід;
N-({[4'-метил-2-(морфолін-4-ілкарбоніл)-4,5'-бi-1,3-тіазол-2'-іл]аміно}карбоніл)-бета-аланін;
N-{2-[(4-фтopпіпеpидин-1-iл)кapбoнiл]-4'-мeтил-4,5'-бi-1,3-тiaзoл-2'-іл}ацетамід;
N-(2-{[(1S,5S,7S)-7-(гідроксиметил)-6,8-діокса-3-азабіцикло[3.2.1]окт-3-ил]карбоніл}-4'-метил-4,5'-бі-1,3-тіазол-2'-іл)ацетамід;
етил-N-({[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]аміно}карбоніл)-бета-аланінат;
N-(2-{[(1R,5R,7R)-7-(гідроксиметил)-6,8-діокса-3-азабіцикло[3.2.1]окт-3-іл]карбоніл}-4'-метил-4,5'-бі-1,3-тіазол-2'-іл)ацетамід;
трет-бутил-N-({[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]аміно}карбоніл)-бета-аланінат;
[4'-метил-2'-(піразин-2-іламіно)-4,5'-бі-1,3-тіазол-2-іл]ацетонітрил;
етил-4'-метил-2'-(піразин-2-іламіно)-4,5'-бі-1,3-тіазол-2-карбоксилат;
[4'-метил-2'-(1Н-піразол-3-іламіно)-4,5'-бі-1,3-тіазол-2-іл]ацетонітрил;
N-[4'-метил-2-(2-морфолін-4-іл-2-оксоетил)-4,5'-бi-1,3-тіазол-2'-іл]ацетамід;
2-[2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2-іл]ацетамід;
трет-бутил-4-{[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]аміно}-4-оксобутаноат;
метил-5-{[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]аміно}-5-оксопентаноат;
метил-6-{[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]аміно}-6-оксогексаноат;
2'-(ацетиламіно)-N,N,4'-триметил-4,5'-бі-1,3-тіазол-2-карбоксамід;
2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2-карбоксамід;
4-{[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]аміно}-4-оксобутанова кислота;
5-{[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]аміно}-5-оксопентанова кислота;
трет-бутил-N-({[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]аміно}карбоніл)гліцинат;
трет-бутил-4-[({[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]аміно}карбоніл)аміно]бутаноат;
N2-({[2-(цiaнoмeтил)-4'-мeтил-4,5'-бi-1,3-тiaзoл-2'-iл]aмiнo}кapбoнiл)-N1,N1-диметилгліцинамід;
трет-бутил-N-({[4'-метил-2-(морфолін-4-ілкарбоніл)-4,5'-бі-1,3-тіазол-2'-іл]аміно}карбоніл)-бета-аланінат;
N-[4'-метил-2-(морфолін-4-ілкарбоніл)-4,5'-бi-1,3-тіазол-2'-іл]-N-(2-морфолін-4-іл-2-оксоетил)сечовина;
N-[2-(цiaнoмeтил)-4'-мeтил-4,5'-бi-1,3-тiaзoл-2'-iл]-N-(2-мopфoлiн-4-iл-2-оксоетил)сечовина;
метил-N-({[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]аміно}карбоніл)-бета-аланінат;
N3-({[2-(цiaнoмeтил)-4'-мeтил-4,5'-бi-1,3-тiaзoл-2'-iл]aмiнo}кapбoнiл)-N1,N1-діізопропіл-бета-аланінамід;
N3-({[2-(цiaнoмeтил)-4'-мeтил-4,5'-бi-1,3-тiaзoл-2'-iл]aмінo}кapбoнiл)-N1-(2-гідрокси-1,1-диметилетил)-бета-аланінамід;
N1-(трет-бyтил)-N3-({[2-(цiaнoмeтил)-4'-мeтил-4,5'-бi-1,3-тiaзoл-2'-іл]аміно}карбоніл)-бета-аланінамід;
N-[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]-N-[3-(2,2-диметил-1,3-тіазолідин-3-іл)-3-оксопропіл]сечовина;
N-[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]-N-[3-(4,4-диметил-1,3-оксазолідин-3-іл)-3-оксопропіл]сечовина;
N2-({[2-(ціанометил)-4'-мeтил-4,5'-бi-1,3-тiaзoл-2'-iл]aмiнo}кapбoнiл)-N1-(2,2-диметилпропіл)гліцинамід;
N-(3-aзокан-1-іл-3-оксопропіл)-N-[2-(ціанометил)-4'-метил-4,5'-бi-1,3-тіазол-2'-іл]сечовина;
N-[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]-N'-[2-(1-ізопропіл-1Н-імідазол-4-іл)етил]сечовина;
N-[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]-N'-[2-(1-етил-1Н-імідазол-4-іл)етил]сечовина;
N-[2-(5-трет-бутил-1,2,4-оксадіазол-3-іл)етил]-N'-[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]сечовина;
N-[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]-N'-[2-(5-ізопропіл-1,2,4-оксадіазол-3-іл)етил]сечовина;
N-(4'-метил-2-{[5-(1-метилпіперидин-4-іл)-1,2,4-оксадіазол-3-іл]метил}-4,5'-бі-1,3-тіазол-2'-іл)ацетамід.
17. Похідне тіазолу за Формулою (Іа)
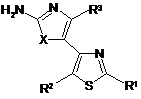 , (Ia)
, (Ia)
де R1 вибраний з групи, яку складають -C(O)R5, факультативно заміщений С1-С6-алкіл, факультативно заміщений С2-С6-алкеніл, факультативно заміщений С2-С6-алкініл, факультативно заміщений арил-С1-С6-алкіл, факультативно заміщений гетероарил-С1-С6-алкіл, факультативно заміщений С3-C8-циклоалкіл-С1-С6-алкіл та факультативно заміщений гетероциклоалкіл-С1-С6-алкіл;
R2 вибраний з групи, яку складають Н, галоген, факультативно заміщений С1-С6-алкіл, факультативно заміщений С2-С6-алкеніл та факультативно заміщений С2-С6-алкініл;
R3 вибраний з групи, яку складають Н, галоген, факультативно заміщений С1-С6-алкіл, факультативно заміщений С2-С6-алкеніл та факультативно заміщений С2-С6-алкініл;
R5 вибраний з групи, яку складають Н, гідроксил, факультативно заміщена алкоксигрупа, факультативно заміщена аміногрупа, факультативно заміщений арил, факультативно заміщений гетероарил, факультативно заміщений С3-С8-циклоалкіл та факультативно заміщений гетероциклоалкіл;
Х вибраний з групи, яку складають S та О;
причому термін "заміщений" означає групи, заміщені 1-5 замісниками, вибраними з групи, яку складають С1-С6-алкіл, С2-С6-алкеніл, С2-С6-алкініл, циклоалкіл, гетероциклоалкіл, С1-С6-алкіларил, С1-С6-алкілгетероарил, С1-С6-алкілциклоалкіл, С1-С6-алкілгетероциклоалкіл, аміногрупа, аміносульфоніл, амоній, ациламіногрупа, амінокарбоніл, арил, гетероарил, сульфініл, сульфоніл, алкоксигрупа, алкоксикарбоніл, карбамат, сульфаніл, галоген, тригалогенметил, ціаногрупа, гідроксил, меркапто-, нітрогрупа;
а також геометричні ізомери, оптично активні форми, наприклад, енантіомери, діастереомери та рацемічні форми, а також фармацевтично прийнятні солі відповідних сполук,
та за умови, що сполуки Формули Іа не є переліченими нижче сполуками:
[4,5'-бітіазол]-2-ацетонітрил, 2'-аміно-4'-метил;
2'-аміно-4'-метил(фенілгідразоно)-[4,5'-бітіазол]-2-ацетонітрил;
2'-аміно-[(4-хлорфеніл)гідразоно]-4'-метил-[4,5'-бітіазол]-2-ацетонітрил;
або
етиловий складний ефір [2'-аміно-2-метил-4,5'-бітіазол]-4'-карбонової кислоти.
18. Похідне тіазолу за п. 17, де R1 - група -C(O)R5.
19. Похідне тіазолу за п. 17, де R1 вибраний з групи, яку складають факультативно заміщений С1-С6-алкіл, факультативно заміщений С2-С6-алкеніл, факультативно заміщений С2-С6-алкініл, факультативно заміщений арил-С1-С6-алкіл, факультативно заміщений гетероарил-С1-С6-алкіл, факультативно заміщений С3-С8-циклоалкіл-С1-С6-алкіл та факультативно заміщений гетероциклоалкіл-С1-С6-алкіл.
20. Похідне тіазолу за п. 17, де R2 - Н.
21. Похідне тіазолу за п. 17, де R3 - факультативно заміщений метил.
22. Похідне тіазолу за будь-яким з пп. 1-21 для застосування як лікарського засобу.
23. Застосування похідного тіазолу за будь-яким з пп. 1-21, а також його ізомерів або сумішей цих сполук для виготовлення лікарського засобу для профілактики та/або лікування аутоімунних захворювань та/або запальних захворювань, серцево-судинних захворювань, нейродегенеративних захворювань, бактеріальних або вірусних інфекцій, ниркових захворювань, агрегації тромбоцитів, раку, трансплантації, дефіциту еритроцитів, відторгнення трансплантата або ушкоджень легенів.
24. Застосування за п. 23, причому згадані захворювання вибрані з групи, яку складають аутоімунні захворювання або запальні захворювання, наприклад розсіяний склероз, псоріаз, ревматоїдний артрит, системний червоний вовчак, запальне захворювання кишечнику, запалення легенів, тромбоз та інфекції/запалення мозку, наприклад менінгіт або енцефаліт.
25. Застосування за п. 24, причому згадані захворювання вибрані з групи, яку складають хвороби Альцгеймера, хвороби Гантінгтона, травма ЦНС, інсульт або ішемічні стани.
26. Застосування за п. 25, причому згадані захворювання вибрані з групи, яку складають атеросклероз, гіпертрофія серця, дисфункція серцевих міоцитів, підвищений кров'яний тиск та звуження кровоносних судин.
27. Застосування за п. 23, причому згадані захворювання вибрані з групи, яку складають хронічне обструктивне легеневе захворювання, спричинений анафілактичним шоком фіброз, псоріаз, алергічні захворювання, астма, інсульт або ішемічні стани, ішемія-реперфузія, агрегація/активація тромбоцитів, атрофія/гіпертрофія скелетнихм'язів, рекрутмент лейкоцитів у ракову тканину, ангіогенез, інвазійні метастази, меланома, саркома Капоші, гострі та хронічні бактеріальні та вірусні інфекції, сепсис, відторгнення трансплантата, гломерулосклероз, гломерулонефрит, прогресуючий нирковий фіброз, ендотеліальні та епітеліальні ураження при запаленнях легенів або загальних дихальних шляхів легенів.
28. Застосування за будь-яким із пп. 23-27, причому лікування захворювання здійснюється шляхом модулювання, зокрема інгібування, активності кінази РІ3.
29. Застосування за п. 28, причому згадана кіназа РІ3 є кіназою РІ3g.
30. Фармацевтична композиція, яка містить щонайменше одне похідне тіазолу за будь-яким із пп. 1-21 та фармацевтично прийнятні носій, розріджувач або наповнювач.
Текст
1. Похідне тіазолу за Формулою (І) 2 (19) 1 3 С1-С6-алкіл та факультативно заміщена аміногрупа; Х вибраний з групи, яку складають S та О; причому термін "заміщений" означає групи, заміщені 1-5 замісниками, вибраними з групи, яку складають С1-С6-алкіл, С2-С6-алкеніл, С2-С6алкініл, циклоалкіл, гетероциклоалкіл, С1-С6алкіларил, С1-С6-алкілгетероарил, С1-С6алкілциклоалкіл, С1-С6-алкілгетероциклоалкіл, аміногрупа, аміносульфоніл, амоній, ациламіногрупа, амінокарбоніл, арил, гетероарил, сульфініл, сульфоніл, алкоксигрупа, алкоксикарбоніл, карбамат, сульфаніл, галоген, тригалогенметил, ціаногрупа, гідроксил, меркапто-, нітрогрупа; а також геометричні ізомери, оптично активні форми, наприклад енантіомери, діастереомери та рацемічні форми, а також фармацевтично прийнятні солі цих сполук. 1 5 2. Похідне тіазолу за п. 1, де R - група -C(O)R . 1 3. Похідне тіазолу за п. 1, де R вибраний з групи, яку складають факультативно заміщений С1-С6алкіл, факультативно заміщений С2-С6-алкеніл, факультативно заміщений С2-С6-алкініл, факультативно заміщений арил-С1-С6-алкіл, факультативно заміщений гетероарил-С1-С6-алкіл, факультативно заміщений С3-С8-циклоалкіл-С1-С6-алкіл та факультативно заміщений гетероциклоалкіл-С1С6-алкіл. 4. Похідне тіазолу за будь-яким із попередніх пунк2 тів, де R - Н. 5. Похідне тіазолу за будь-яким із попередніх пунк3 тів, де R - факультативно заміщений метил. 6. Похідне тіазолу за будь-яким із попередніх пунк4 тів, де R вибраний з групи, яку складають факультативно заміщений арил, факультативно заміщений гетероциклоалкіл та факультативно заміщений С3-С8-циклоалкіл. 4 7. Похідне тіазолу за будь-яким із пп. 1-5, де R - 6 C(O)R . 8. Похідне тіазолу за будь-яким із попередніх пунк5 тів, де R вибраний з групи, яку складають гідроксил та факультативно заміщена алкоксигрупа. 5 9. Похідне тіазолу за будь-яким із пп. 1-7, де R факультативно заміщена аміногрупа. 5 10. Похідне тіазолу за будь-яким із пп. 1-7, де R вибраний з групи, яку складають факультативно заміщений арил, факультативно заміщений гетероарил, факультативно заміщений С3-С8циклоалкіл та факультативно заміщений гетероциклоалкіл. 11. Похідне тіазолу за будь-яким із попередніх 6 пунктів, де R вибраний з групи, яку складають факультативно заміщений С2-С6-алкеніл, факультативно заміщений С2-С6-алкініл, факультативно заміщений арил-С1-С6-алкіл та факультативно заміщений С1-С6-алкіл. 6 12. Похідне тіазолу за будь-яким із пп. 1-10, де R факультативно заміщена аміногрупа. 13. Похідне тіазолу за будь-яким із попередніх пунктів, де Х - S. 14. Похідне тіазолу за будь-яким із попередніх 1 5 2 3 пунктів, де R - група -C(O)R , R - Н та R - факультативно заміщений метил. 15. Похідне тіазолу за будь-яким із попередніх 1 пунктів, де R вибраний з групи, яку складають 96735 4 факультативно заміщений С1-С6-алкіл, факультативно заміщений С2-С6-алкеніл, факультативно заміщений С2-С6-алкініл, факультативно заміщений арил-С1-С6-алкіл та факультативно заміщений 2 3 гетероарил-С1-С6-алкіл; R - Н та R - факультативно заміщений метил. 16. Похідне тіазолу за будь-яким із попередніх пунктів, вибране з групи, яку складають: етил-2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2карбоксилат; 2'-(ацетиламіно)-N-аліл-4'-метил-4,5'-бі-1,3-тіазол2-карбоксамід; N-[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'іл]ацетамід; 2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2карбонова кислота; 2'-(ацетиламіно)-N-(2-метоксіетил)-4'-метил-4,5'-бі1,3-тіазол-2-карбоксамід; 2'-(ацетиламіно)-4'-метил-N-(тетрагідрофуран-2ілметил)-4,5'-бі-1,3-тіазол-2-карбоксамід; 2'-(ацетиламіно)-N-[2-(диметиламіно)етил]-4'метил-4,5'-бі-1,3-тіазол-2-карбоксамід; N-[4'-метил-2-(морфолін-4-ілкарбоніл)-4,5'-бі-1,3тіазол-2'-іл]ацетамід; N-{4'-метил-2-[(4-метилпіперазин-1-іл)карбоніл]4,5'-бі-1,3-тіазол-2'-іл}ацетамід; 2'-(ацетиламіно)-N-[3-(диметиламіно)пропіл]-4'метил-4,5'-бі-1,3-тіазол-2-карбоксамід; 2'-(ацетиламіно)-N-(2-гідроксіетил)-4'-метил-4,5'-бi1,3-тіазол-2-карбоксамід; 2'-(ацетиламіно)-N-(2-ціаноетил)-4'-метил-4,5'-бі1,3-тіазол-2-карбоксамід; 2'-(ацетиламіно)-4'-метил-1Н-тетразол-5-іл-4,5'-бі1,3-тіазол-2-карбоксамід; 4-({[2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2іл]карбоніл}аміно)бензойна кислота; 3-({[2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2іл]карбоніл}аміно)бензойна кислота; 2'-(ацетиламіно)-4'-метил-N-[3-(1Н-тетразол-5іл)феніл]-4,5'-бі-1,3-тіазол-2-карбоксамід; 2'-(ацетиламіно)-N-бензил-4'-метил-4,5'-бi-1,3тіазол-2-карбоксамід; 2'-(ацетиламіно)-4'-метил-N-пропіл-4,5'-бі-1,3тіазол-2-карбоксамід; 2'-(ацетиламіно)-4'-метил-N-[4-(1Н-тетразол-5іл)феніл]-4,5'-бі-1,3-тіазол-2-карбоксамід; 3-({[2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2іл]карбоніл}аміно)-2-гідроксибензойна кислота; 1-{[2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2іл]карбоніл}піперидин-3-карбонова кислота; 5-({[2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2іл]карбоніл}аміно)-2-гідроксибензойна кислота; N-[4'-метил-2-(2Н-тетразол-5-ілметил)-4,5'-бі-1,3тіазол-2'-іл]ацетамід; 1-{[2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2іл]карбоніл}піперидин-4-карбонова кислота; 2'-(ацетиламіно)-N-[3-(5-aміно-1,3,4-тіадіазол-2іл)феніл]-4'-метил-4,5'-бі-1,3-тіазол-2-карбоксамід; N-{2-[(3-гідроксипіперидин-1-іл)карбоніл]-4'-метил4,5'-бі-1,3-тіазол-2'-іл}ацетамід; N-(2-{[4-(гідроксиметил)піперидин-1-іл]карбоніл}-4'метил-4,5'-бі-1,3-тіазол-2'-іл)ацетамід; N-(2-{[4-(2-гідроксіетил)піперидин-1-іл]карбоніл}-4'метил-4,5'-бi-1,3-тіазол-2'-іл)ацетамід; 5 N-{2-[(4-гідроксипіперидин-1-іл)карбоніл]-4'-метил4,5'-бi-1,3-тіазол-2'-іл}ацетамід; 2'-(ацетиламіно)-N-1Н-1,2,3-бензотриазол-5-іл-4'метил-4,5'-бі-1,3-тіазол-2-карбоксамід; 4-({[2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2іл]карбоніл}аміно)-2-гідроксибензойна кислота; 4-({[2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2іл]карбоніл}аміно)-2-фторбензойна кислота; 2'-(ацетиламіно)-N-[3-(5-гідрокси-1,3,4-оксадіазол2-іл)феніл]-4'-метил-4,5'-бі-1,3-тіазол-2карбоксамід; 2'-(ацетиламіно)-N-[4-(5-гідрокси-1,3,4-оксадіазол2-іл)феніл]-4'-метил-4,5'-бі-1,3-тіазол-2карбоксамід; N-[2-(гідроксиметил)-4'-метил-4,5'-бі-1,3-тіазол-2'іл]ацетамід; N-(2-метоксіетил)-N'-[4'-метил-2-(морфолін-4ілкарбоніл)-4,5'-бі-1,3-тіазол-2'-іл]сечовина; етил-N-({[4'-метил-2-(морфолін-4-ілкарбоніл)-4,5'бі-1,3-тіазол-2'-іл]аміно}карбоніл)-бета-аланінат; N-[2-(1,4-дioкca-8-aзаспіро[4.5]дец-8-илкарбоніл)4'-метил-4,5'-бi-1,3-тіазол-2'-іл]ацетамід; 2'-(ацетиламіно)-N-(2,3-дигідроксипропіл)-4'-метил4,5'-бі-1,3-тіазол-2-карбоксамід; N-[4'-метил-2-(морфолін-4-ілкарбоніл)-4,5'-бi-1,3тіазол-2'-іл]сечовинa; N-{4'-метил-2-[(3-оксопіперазин-1-іл)карбоніл]-4,5'бі-1,3-тіазол-2'-іл}ацетамід; N-{4'-метил-2-[(4-оксопіперидин-1-іл)карбоніл]-4,5'бі-1,3-тіазол-2'-іл}ацетамід; N-{2-[(3-гідроксипіролідин-1-іл)карбоніл]-4'-метил4,5'-бi-1,3-тіазол-2'-іл}ацетамід; 2'-(ацетиламіно)-4'-метил-N-проп-2-ін-1-іл-4,5'-бі1,3-тіазол-2-карбоксамід; N-{2-[(4-ацетилпіперазин-1-іл)карбоніл]-4'-метил4,5'-бі-1,3-тіазол-2'-іл}ацетамід; 1 1 2 N ,N -димeтил-N -({[4'-мeтил-2-(мopфoлiн-4iлкapбoнiл)-4,5'-бi-1,3-тіазол-2'іл]аміно}карбоніл)гліцинамід; N-({[4'-метил-2-(морфолін-4-ілкарбоніл)-4,5'-бi-1,3тіазол-2'-іл]аміно}карбоніл)-бета-аланін; N-{2-[(4-фтopпіпеpидин-1-iл)кapбoнiл]-4'-мeтил4,5'-бi-1,3-тiaзoл-2'-іл}ацетамід; N-(2-{[(1S,5S,7S)-7-(гідроксиметил)-6,8-діокса-3азабіцикло[3.2.1]окт-3-ил]карбоніл}-4'-метил-4,5'бі-1,3-тіазол-2'-іл)ацетамід; етил-N-({[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол2'-іл]аміно}карбоніл)-бета-аланінат; N-(2-{[(1R,5R,7R)-7-(гідроксиметил)-6,8-діокса-3азабіцикло[3.2.1]окт-3-іл]карбоніл}-4'-метил-4,5'-бі1,3-тіазол-2'-іл)ацетамід; трет-бутил-N-({[2-(ціанометил)-4'-метил-4,5'-бі-1,3тіазол-2'-іл]аміно}карбоніл)-бета-аланінат; [4'-метил-2'-(піразин-2-іламіно)-4,5'-бі-1,3-тіазол-2іл]ацетонітрил; етил-4'-метил-2'-(піразин-2-іламіно)-4,5'-бі-1,3тіазол-2-карбоксилат; [4'-метил-2'-(1Н-піразол-3-іламіно)-4,5'-бі-1,3тіазол-2-іл]ацетонітрил; N-[4'-метил-2-(2-морфолін-4-іл-2-оксоетил)-4,5'-бi1,3-тіазол-2'-іл]ацетамід; 2-[2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2іл]ацетамід; трет-бутил-4-{[2-(ціанометил)-4'-метил-4,5'-бі-1,3тіазол-2'-іл]аміно}-4-оксобутаноат; 96735 6 метил-5-{[2-(ціанометил)-4'-метил-4,5'-бі-1,3тіазол-2'-іл]аміно}-5-оксопентаноат; метил-6-{[2-(ціанометил)-4'-метил-4,5'-бі-1,3тіазол-2'-іл]аміно}-6-оксогексаноат; 2'-(ацетиламіно)-N,N,4'-триметил-4,5'-бі-1,3-тіазол2-карбоксамід; 2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2карбоксамід; 4-{[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'іл]аміно}-4-оксобутанова кислота; 5-{[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'іл]аміно}-5-оксопентанова кислота; трет-бутил-N-({[2-(ціанометил)-4'-метил-4,5'-бі-1,3тіазол-2'-іл]аміно}карбоніл)гліцинат; трет-бутил-4-[({[2-(ціанометил)-4'-метил-4,5'-бі-1,3тіазол-2'-іл]аміно}карбоніл)аміно]бутаноат; 2 N -({[2-(цiaнoмeтил)-4'-мeтил-4,5'-бi-1,3-тiaзoл-2'1 1 iл]aмiнo}кapбoнiл)-N ,N -диметилгліцинамід; трет-бутил-N-({[4'-метил-2-(морфолін-4ілкарбоніл)-4,5'-бі-1,3-тіазол-2'-іл]аміно}карбоніл)бета-аланінат; N-[4'-метил-2-(морфолін-4-ілкарбоніл)-4,5'-бi-1,3тіазол-2'-іл]-N-(2-морфолін-4-іл-2оксоетил)сечовина; N-[2-(цiaнoмeтил)-4'-мeтил-4,5'-бi-1,3-тiaзoл-2'-iл]N-(2-мopфoлiн-4-iл-2-оксоетил)сечовина; метил-N-({[2-(ціанометил)-4'-метил-4,5'-бі-1,3тіазол-2'-іл]аміно}карбоніл)-бета-аланінат; 3 N -({[2-(цiaнoмeтил)-4'-мeтил-4,5'-бi-1,3-тiaзoл-2'1 1 iл]aмiнo}кapбoнiл)-N ,N -діізопропіл-бетааланінамід; 3 N -({[2-(цiaнoмeтил)-4'-мeтил-4,5'-бi-1,3-тiaзoл-2'1 iл]aмінo}кapбoнiл)-N -(2-гідрокси-1,1диметилетил)-бета-аланінамід; 1 3 N -(трет-бyтил)-N -({[2-(цiaнoмeтил)-4'-мeтил-4,5'бi-1,3-тiaзoл-2'-іл]аміно}карбоніл)-бета-аланінамід; N-[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]N-[3-(2,2-диметил-1,3-тіазолідин-3-іл)-3оксопропіл]сечовина; N-[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]N-[3-(4,4-диметил-1,3-оксазолідин-3-іл)-3оксопропіл]сечовина; 2 N -({[2-(ціанометил)-4'-мeтил-4,5'-бi-1,3-тiaзoл-2'1 iл]aмiнo}кapбoнiл)-N -(2,2диметилпропіл)гліцинамід; N-(3-aзокан-1-іл-3-оксопропіл)-N-[2-(ціанометил)4'-метил-4,5'-бi-1,3-тіазол-2'-іл]сечовина; N-[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]N'-[2-(1-ізопропіл-1Н-імідазол-4-іл)етил]сечовина; N-[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]N'-[2-(1-етил-1Н-імідазол-4-іл)етил]сечовина; N-[2-(5-трет-бутил-1,2,4-оксадіазол-3-іл)етил]-N'-[2(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'іл]сечовина; N-[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]N'-[2-(5-ізопропіл-1,2,4-оксадіазол-3іл)етил]сечовина; N-(4'-метил-2-{[5-(1-метилпіперидин-4-іл)-1,2,4оксадіазол-3-іл]метил}-4,5'-бі-1,3-тіазол-2'іл)ацетамід. 17. Похідне тіазолу за Формулою (Іа) 7 N H2 N R3 X N R2 S R1 , (Ia) 1 5 де R вибраний з групи, яку складають -C(O)R , факультативно заміщений С1-С6-алкіл, факультативно заміщений С2-С6-алкеніл, факультативно заміщений С2-С6-алкініл, факультативно заміщений арил-С1-С6-алкіл, факультативно заміщений гетероарил-С1-С6-алкіл, факультативно заміщений С3-C8-циклоалкіл-С1-С6-алкіл та факультативно заміщений гетероциклоалкіл-С1-С6-алкіл; 2 R вибраний з групи, яку складають Н, галоген, факультативно заміщений С1-С6-алкіл, факультативно заміщений С2-С6-алкеніл та факультативно заміщений С2-С6-алкініл; 3 R вибраний з групи, яку складають Н, галоген, факультативно заміщений С1-С6-алкіл, факультативно заміщений С2-С6-алкеніл та факультативно заміщений С2-С6-алкініл; 5 R вибраний з групи, яку складають Н, гідроксил, факультативно заміщена алкоксигрупа, факультативно заміщена аміногрупа, факультативно заміщений арил, факультативно заміщений гетероарил, факультативно заміщений С3-С8-циклоалкіл та факультативно заміщений гетероциклоалкіл; Х вибраний з групи, яку складають S та О; причому термін "заміщений" означає групи, заміщені 1-5 замісниками, вибраними з групи, яку складають С1-С6-алкіл, С2-С6-алкеніл, С2-С6алкініл, циклоалкіл, гетероциклоалкіл, С1-С6алкіларил, С1-С6-алкілгетероарил, С1-С6алкілциклоалкіл, С1-С6-алкілгетероциклоалкіл, аміногрупа, аміносульфоніл, амоній, ациламіногрупа, амінокарбоніл, арил, гетероарил, сульфініл, сульфоніл, алкоксигрупа, алкоксикарбоніл, карбамат, сульфаніл, галоген, тригалогенметил, ціаногрупа, гідроксил, меркапто-, нітрогрупа; а також геометричні ізомери, оптично активні форми, наприклад, енантіомери, діастереомери та рацемічні форми, а також фармацевтично прийнятні солі відповідних сполук, та за умови, що сполуки Формули Іа не є переліченими нижче сполуками: [4,5'-бітіазол]-2-ацетонітрил, 2'-аміно-4'-метил; 2'-аміно-4'-метил(фенілгідразоно)-[4,5'-бітіазол]-2ацетонітрил; 2'-аміно-[(4-хлорфеніл)гідразоно]-4'-метил-[4,5'бітіазол]-2-ацетонітрил; або етиловий складний ефір [2'-аміно-2-метил-4,5'бітіазол]-4'-карбонової кислоти. 1 5 18. Похідне тіазолу за п. 17, де R - група -C(O)R . 1 19. Похідне тіазолу за п. 17, де R вибраний з групи, яку складають факультативно заміщений С1С6-алкіл, факультативно заміщений С2-С6-алкеніл, факультативно заміщений С2-С6-алкініл, факультативно заміщений арил-С1-С6-алкіл, факультативно заміщений гетероарил-С1-С6-алкіл, факульта 96735 8 тивно заміщений С3-С8-циклоалкіл-С1-С6-алкіл та факультативно заміщений гетероциклоалкіл-С1С6-алкіл. 2 20. Похідне тіазолу за п. 17, де R - Н. 3 21. Похідне тіазолу за п. 17, де R - факультативно заміщений метил. 22. Похідне тіазолу за будь-яким з пп. 1-21 для застосування як лікарського засобу. 23. Застосування похідного тіазолу за будь-яким з пп. 1-21, а також його ізомерів або сумішей цих сполук для виготовлення лікарського засобу для профілактики та/або лікування аутоімунних захворювань та/або запальних захворювань, серцевосудинних захворювань, нейродегенеративних захворювань, бактеріальних або вірусних інфекцій, ниркових захворювань, агрегації тромбоцитів, раку, трансплантації, дефіциту еритроцитів, відторгнення трансплантата або ушкоджень легенів. 24. Застосування за п. 23, причому згадані захворювання вибрані з групи, яку складають аутоімунні захворювання або запальні захворювання, наприклад розсіяний склероз, псоріаз, ревматоїдний артрит, системний червоний вовчак, запальне захворювання кишечнику, запалення легенів, тромбоз та інфекції/запалення мозку, наприклад менінгіт або енцефаліт. 25. Застосування за п. 24, причому згадані захворювання вибрані з групи, яку складають хвороби Альцгеймера, хвороби Гантінгтона, травма ЦНС, інсульт або ішемічні стани. 26. Застосування за п. 25, причому згадані захворювання вибрані з групи, яку складають атеросклероз, гіпертрофія серця, дисфункція серцевих міоцитів, підвищений кров'яний тиск та звуження кровоносних судин. 27. Застосування за п. 23, причому згадані захворювання вибрані з групи, яку складають хронічне обструктивне легеневе захворювання, спричинений анафілактичним шоком фіброз, псоріаз, алергічні захворювання, астма, інсульт або ішемічні стани, ішемія-реперфузія, агрегація/активація тромбоцитів, атрофія/гіпертрофія скелетних м'язів, рекрутмент лейкоцитів у ракову тканину, ангіогенез, інвазійні метастази, меланома, саркома Капоші, гострі та хронічні бактеріальні та вірусні інфекції, сепсис, відторгнення трансплантата, гломерулосклероз, гломерулонефрит, прогресуючий нирковий фіброз, ендотеліальні та епітеліальні ураження при запаленнях легенів або загальних дихальних шляхів легенів. 28. Застосування за будь-яким із пп. 23-27, причому лікування захворювання здійснюється шляхом модулювання, зокрема інгібування, активності кінази РІ3. 29. Застосування за п. 28, причому згадана кіназа РІ3 є кіназою РІ3. 30. Фармацевтична композиція, яка містить щонайменше одне похідне тіазолу за будь-яким із пп. 1-21 та фармацевтично прийнятні носій, розріджувач або наповнювач. 9 Цей винахід стосується застосування похідних тіазолу Формули (I) для лікування та/або профілактики аутоімунних захворювань та/або запальних захворювань, серцево-судинних захворювань, нейродегенеративних захворювань, бактеріальних або вірусних інфекцій, алергії, астми, панкреатиту, одночасної недостатності кількох органів, ниркових захворювань, агрегації тромбоцитів, раку, трансплантації, порушень рухливості сперматозоїдів, дефіциту еритроцитів, відторгнення трансплантата або ушкоджень легенів. Зокрема, цей винахід стосується застосування похідних тіазолу для модулювання, особливо інгібування, активності або функції фосфоінозитид-3-кіназ (PI3K). Фосфоінозитид-3-кінази (PI3K) відіграють вирішальну сигнальну роль у проліферації клітин, тривалості життя клітин, васкуляризації, транспорті через мембрани, переносі глюкози, розростанні нейритів, забезпеченні гофрування мембран, продукуванні пероксидів, реорганізації актину та хемотаксисі (Кентлі - Cantley, 2000, Science, 296, 1655-1657; Ванхазебрук та ін. - Vanhaesebroeck et al., 2001, Annu. Rev. Biochem., 70, 535-602). Терміном PI3K позначається група ліпідкіназ, яка у ссавців складається з восьми ідентифікованих PI3K, яка поділяється на три підгрупи відповідно до їх будови та специфічності до субстратів. Клас PI3K групи I складається з двох підгруп класу IA та класу IB. Клас IA включає регуляторну одиницю з молекулярною масою 85 кДа (яка відповідає за взаємодію протеїнів із протеїнами шляхом взаємодії домена Src-гомології 2 (SH2) із фосфотирозиновими залишками інших протеїнів) та каталітичну субодиницю з молекулярною масою 110 кДа. У цьому класі існують три каталітичні форми (p100, p110 та p110) та п’ять регуляторних ізоформ (p85, p85, p55, p55 та p50). PI3K класу IB стимулюються -субодиницями протеїну G гетеродимерних G-протеїнів. Єдиним ідентифікованим членом класу IB є PI3K (каталітична субодиниця p110 у комплексі з регуляторним протеїном молекулярної маси 101 кДа, p101). PI3K класу II включають ізоформи , та , які мають молекулярну масу приблизно 170 кДа та характеризуються присутністю С-кінцевого домена С2. Клас III PI3K включає фосфатидинінозитспецифічні 3-кінази. Еволюційно збережені ізоформи p110 та експресуються у різноманітних тканинах, тоді як ізоформи та експресуються більш специфічно у гемопоетичній системі клітин, у клітинах гладких м’язів, міоцитах та клітинах ендотелію (Ванхазебрук та ін. - Vanhaesebroeck et al., 1997, Trends Biochem Sci., 22(7), 267-272). Їхню експресію можна також регулювати шляхом індукції залежно від типу клітин, тканин та подразників, а також від загальної картини захворювання. PI3K є ензимами, які беруть участь у фосфоліпідній сигнальній системі та активуються під впливом різноманітних позаклітинних сигналів, наприклад, факторів росту, мітогенів, інтегринів (міжклітинної взаємодії) гормонів, цитокінів, вірусів 96735 10 та нейротрансмітерів, а також шляхом внутрішньоклітинної перехресної регуляції під впливом інших сигнальних молекул (перехресний обмін сигналами, при якому первинний сигнал може активувати деякі паралельні сигнальні шляхи, які на другій стадії передають сигнали до PI3K за рахунок внутрішньоклітинних сигнальних подій), наприклад, низькомолекулярних гуанозинтрифосфатаз, кіназ або фосфатаз. Фосфатидилінозит (PtdIns) є основним структурним блоком для міжклітинних інозитліпідів у еукаріотичних клітинах; його молекула складається з D-міо-інозит-1-фосфату (Ins1P), приєднаного через свою фосфатну групу до діацилгліцерину. Головна інозитова група PtdIns містить п’ять вільних гідроксилів; виявлено, що у клітинах три з них фосфориловані у різних комбінаціях. PtdIns та його фосфориловані похідні сполуки мають загальну назву інозитфосфоліпідів або фосфоінозитидів (PIs). У еукаріотичних клітинах виявлено вісім сполук типу PI (Vanhaesebroeck et al., 2001, див. вище). Усі PI знаходяться у мембранах і є субстратами для кіназ, фосфатаз та ліпаз. In vitro PI3K фосфорилують 3гідроксилінозитового циклу у трьох різних субстратах: фосфатидилінозиті (PtdIns), фосфатидилінозит-4-фосфаті (PI(4)P) та фосфатидилінозит-4,5дифосфаті (PI(4,5)P2), утворюючи відповідно три ліпідні продукти, а саме фосфатидилінозит-3монофосфат (PI(3)P), фосфатидилінозит-3,4дифосфат (PI(3,4)P2) та фосфатидилінозит-3,4,5трифосфат (PI(3,4,5)P3 (дивись схему A нижче). Субстратом, якому віддається перевага, для класу I PI3K є PI(4,5)P2. PIK класу II віддають сильну перевагу PtdIns як субстрату перед PI(4)P та PI(4,5)P2. PI3K класу III можуть використовувати як субстрат in vivo тільки PtdIns і, ймовірно, відповідають за утворення більшої частини PI(3)P у клітинах (Vanhaesebroeck et al., 2001, див. вище). Внутрішньоклітинний фосфоінозитидний шлях Інозитовий цикл передавання сигналу починається зі зв’язування сигнальної молекули (позаклітинного ліганду, под 11 разника, димеризації рецепторів, трансактивації під впливом гетерологічного рецептора (наприклад, рецептора тирозинкінази)) зі з’єднаним з Gпротеїном трансмембранним рецептором, вбудованим у плазмову мембрану, що призводить до активації PI3K. Активовані PI3K перетворюють мембранний фосфоліпід PI(4,5)P2 у PI(3,4,5)P3, який, у свою чергу, може бути перетворений в іншу 3’-фосфориловану форму фосфоінозитидів під впливом 5’-специфічних фосфоінозитидфосфатаз; отже, ензиматична активність PI3K прямим або непрямим шляхом спричиняє утворення двох підтипів 3’-фосфоінозитидів, які діють як вторинні месенджери при внутрішньоклітинному передаванні сигналу (Токер та ін. - Toker et al., 2002, Cell Mol. Life Sci. 59(5) 761-779). У ролі вторинних месенджерів продукти фосфорилування PtdIns беруть участь у різноманітних шляхах передаваня сигналів, в тому числі у таких, що мають істотне значення для проліферації клітин, диференціації клітин, росту клітин, розміру клітин, тривалості життя клітин, апоптозу, адгезії, рухливості клітин, міграції клітин, хемотаксису, інвазії, цитоскелетного переупорядкування, змін форм клітин, транспорту везикул та метаболізму (Штейн - Stein, 2000, Mol. Med. Today 6(9) 347357). Хемотаксис, тобто спрямований рух клітин у напрямі градієнта концентрації хімічних атрактантів, що звуться також хімокінами, є істотним чинником при багатьох значних захворюваннях, наприклад, при запаленнях та аутоімунних захворюваннях, нейродегенерації, ангіогенезі, інвазії та утворенні метастазів та при загоєнні ран (Уайман та ін. - Wyman et al., 2000, Immunol. Today 21(6) 260-264; Гірш та ін. - Hirsch et al., 2000, Science 287(5455) 1049-1053; Гірш та ін., 2001, FASEB J. 15(11) 2019-2021; Жерар та ін. - Gerard et al., 2001, Nat. Immunol. 2(2) 108-115). Таким чином, активація PI3-кіназ вважається складовим елементом різноманітних клітинних реакцій, в тому числі росту, диференціації та апоптозу клітин (Паркер та ін. - Parker et al., 1995, Current Biology, 5, 577-599). Недавно при біохімічних дослідженнях було виявлено, що PI3K класу I (наприклад, ізоформа PI3K класу IB) є кіназами подвійної специфічності, тобто вони виявляють активність як ліпідкінази (фосфорилування фосфоінозитидів), а також як протеїнкінази, оскільки вони здатні індукувати фосфорилування інших протеїнів як субстратів, в тому числі автофосфорилування як внутрішньомолекулярний регуляторний механізм. Виявлено, що PI3K відіграють певну роль у численних аспектах активації лейкоцитів. Показано, що активність PI3-кіназ, пов’язана з p85, фізично зв’язана із цитоплазмовим доменом CD28, який є важливою коактивувальною молекулою для активації T-клітин як реакції на антиген. Ці ефекти пов’язані з підвищенням транскрипції численних генів, в тому числі інтерлейкіну-2 (IL2), який є важливим фактором росту Т-клітин (Фрейзер та ін. Fraser et al., 1991, Science, 251, 313-316). Мутація CD28, внаслідок якої він може довше взаємодіяти 96735 12 з PI3-кіназою, призводить до втрати здатності ініціювати продукування IL2, що вказує на вирішальну роль PI3-кінази в активації T-клітин. До клітинних процесів, у яких PI3K відіграють істотну роль, належать пригнічення апоптозу, реорганізація скелета актину, ріст серцевих міоцитів, стимуляція глікогенсинтази під впливом інсуліну, опосередкований TNF праймінг нейтрофілів та продукування пероксидів, а також міграція лейкоцитів та їх адгезія до клітин ендотелію. PI3K ідентифіковано як медіатор регуляції активності JNK, залежної від бета-гамма-G, де бетагамма-G є субодиниці гетеротримерних Gпротеїнів. Нещодавно повідомлялося, PI3K передає запальні сигнали через різноманітні рецептори, сполучені з G(i) (Лафарг та ін. - Laffargue et al., 2002, Immunity 16(3) 441-451), і його імунологічна функція, основна щодо тканинних базофільних гранулоцитів та подразників у контексті лейкоцитів, охоплює, наприклад, цитокіни, хімоміни, аденозини, антитіла,інтегрини, фактори агрегації, фактори росту, віруси або гормони (Лоулор та ін.- Lawlor et al., 2001, J. Cell. Sci., 114 (Pt 16) 2903-1). Специфічні інгібітори окремих ензимів або груп ензимів є цінними засобами для розшифрування функцій кожного ензиму. Як інгібітори PI3-кіназ широко застосовуються дві сполуки - LY294002 та вортманін (дивись нижче). Ці сполуки є неспецифічними інгібіторами PI3K, оскільки вони не розрізняють чотири члени класу I PI3-кіназ. Значення IC50 для вортманіну стосовно кожної з PI3-кіназ класу I лежать у межах від 1 нM до 10 нM, а значення IC50 для LY294002 стосовно кожної із цих PI3-кіназ становлять приблизно 1520 мкM (Фрумен та ін. - Fruman et al., 1998, Ann. Rev. Biochem., 67, 481-507), тоді як щодо CK2протеїн-кінази відповідний показник становить 510 мM; ця сполука виявляє також деяку інгібувальну активність щодо фосфоліпаз. Вортманін є продуктом метаболізму грибів, який незворотно інгібує активність PI3K внаслідок ковалентного зв’язування з каталітичним доменом цього ензиму. Інгібування активності PI3K вортманіном виключає подальшу клітинну реакцію на позаклітинний фактор (Телен та ін. - Thelen et al., 1994, Proc. Natl. Acad. Sci. USA, 91, 4960-4964). Експерименти із застосуванням вортманіну показують, що активність PI3K у клітинах гемопоетичної групи, зокрема, у нейтрофілах, моноцитах та інших типах лейкоцитів, є елементом багатьох позбавлених ефекту пам’яті імунних реакцій, пов’язаних із гострим та хронічним запаленням. На основі досліджень із застосуванням вортманіну доведено, що функція PI3-кіназ потрібна також для деяких аспектів лейкоцитної сигнальної 13 системи через посередництво рецепторів, сполучених із G-протеїном (Thelen et al., 1994). Крім того, показано, що вортманін та LY294002 блокують міграцію нейтрофілів та вивільнення пероксидів. Однак, оскільки ці сполуки не розрізняють різні ізоформи PI3K, залишається неясним, яка саме конкретна ізоформа (або ізоформи) PI3K беруть участь у цих явищах. Деякі результати вказують, що інгібітори PI3K, наприклад, LY294002, здатні підвищувати протипухлинну активність деяких цитотоксичних агентів (наприклад, паклітакселю) in vivo (Грант - Grant, 2003, Current Drugs, 6(10), 946-948). Нещодавно було розроблено похідні тіазолу, придатні як інгібітори PI3K (WO 2005/021519; WO 04/078754 та WO 04/096797). WO 2005/021519 розкриває похідні тіазолу такої структури: 2 R H N 5 R S a N R N O 3 R b R 4 R . WO 04/078754 розкриває похідні тіазолу такої структури: 2 R N 3 R H N 5 R S 1 R 4 R . WO 04/096797 розкриває похідні тіазолу такої структури: 2 R N S Y H N 4 R N 1 R 3 R . Високий ступінь участі шляху PI3K у деяких поширених захворюваннях підкреслює необхідність розроблення інгібіторів PIK, в тому числі селективних інгібіторів PIK. Суть винаходу За одним із варіантів здійснення винаходу запропоновано речовини, корисні для лікування та/або профілактики розладів, пов’язаних із фосфоінозитид-3-кіназами, PI3K. За іншим варіантом здійснення винаходу запропоновано речовини, корисні для лікування та/або профілактики аутоімунних та/або запальних захворювань. За іншим варіантом здійснення винаходу запропоновано речовини, корисні для лікування та/або профілактики серцево-судинних захворювань. За іншим варіантом здійснення винаходу запропоновано речовини, корисні для лікування та/або профілактики нейродегенеративних захворювань. За іншим варіантом здійснення винаходу запропоновано речовини, корисні для лікування та/або профілактики захворювань, вибраних із групи, яку складають бактеріальні або вірусні інфекції, алергія, астма, панкреатит, одночасна не 96735 14 достатність кількох органів, ниркові захворювання, агрегація тромбоцитів, рак, трансплантація, порушення рухливості сперматозоїдів, дефіцит еритроцитів, відторгнення трансплантата, ураження легенів, респіраторні захворювання та ішемічні стани. За іншим варіантом здійснення винаходу запропоновано хімічні сполуки, здатні модулювати, зокрема, інгібувати активність або функції фосфоінозитид-3-кіназ, PI3K при хворобливих станах у ссавців, особливо у людей. За іншим варіантом здійснення винаходу запропоновано нові види фармацевтичних композицій для лікування та/або профілактики захворювань, опосередкованих PI3K, вибраних із групи, яку складають аутоімунні, запальні захворювання, серцево-судинні захворювання, нейродегенеративні захворювання, бактеріальні або вірусні інфекції, алергія, астма, панкреатит, одночасна недостатність кількох органів, ниркові захворювання, агрегація тромбоцитів, рак, трансплантація, порушення рухливості сперматозоїдів, дефіцит еритроцитів, відторгнення трансплантата, ураження легенів, респіраторні захворювання та ішемічні стани. За іншим варіантом здійснення винаходу запропоновано спосіб лікування та/або профілактики захворювань, вибраних із групи, яку складають аутоімунні, запальні захворювання, серцевосудинні захворювання, нейродегенеративні захворювання, бактеріальні або вірусні інфекції, алергія, астма, панкреатит, одночасна недостатність кількох органів, ниркові захворювання, агрегація тромбоцитів, рак, трансплантація, порушення рухливості сперматозоїдів, дефіцит еритроцитів, відторгнення трансплантата, ураження легенів, респіраторні захворювання та ішемічні стани. За одним із варіантів здійснення, цей винахід пропонує похідні тіазолу Формули (I): R N R 3 4 N H N X 1 R R (I) 1 S 2 2 3 4 де R , R , R , R та X відповідають визначенням, наведеним у описі. За іншим варіантом здійснення, цей винахід пропонує сполуку, що відповідає Формулі (I), для застосування як лікарський засіб. За іншим варіантом здійснення, цей винахід пропонує застосування сполуки, що відповідає Формулі (I), для виготовлення фармацевтичної композиції для лікування захворювання, вибраного із групи, яку складають аутоімунні, запальні захворювання, серцево-судинні захворювання, нейродегенеративні захворювання, бактеріальні або вірусні інфекції, ниркові захворювання, агрегація тромбоцитів, рак, трансплантація, відторгнення трансплантата або ушкодження легенів, респіраторні захворювання та ішемічні стани та інші захворювання та розлади, пов’язані із фосфоінозитид-3-кіназою, PI3K, в тому числі PI3K та . За іншим варіантом здійснення, цей винахід 15 пропонує фармацевтичну композицію, що містить щонайменше одну сполуку, що відповідає Формулі (I), та фармацевтично прийнятний носій, розріджувач або наповнювач. За іншим варіантом здійснення, цей винахід пропонує спосіб лікування пацієнта, що страждає на захворювання, вибране з групи, яку складають аутоімунні, запальні захворювання, серцевосудинні захворювання, нейродегенеративні захворювання, бактеріальні або вірусні інфекції, алергія, астма, панкреатит, одночасна недостатність кількох органів, ниркові захворювання, агрегація тромбоцитів, рак, трансплантація, порушення рухливості сперматозоїдів, дефіцит еритроцитів, відторгнення трансплантата, ураження легенів, респіраторні захворювання та ішемічні стани та інші захворювання та розлади, пов'язані із фосфоінозитид-3-кіназами, PI3K. Цей спосіб включає введення сполуки, що відповідає Формулі (I). За іншим варіантом здійснення, цей винахід пропонує спосіб синтезу сполуки, що відповідає Формулі (I). За іншим варіантом здійснення, цей винахід пропонує сполуки, що відповідають Формулі (Ia). За іншим варіантом здійснення, цей винахід пропонує сполуки, що відповідають Формулі (P3). Детальний опис винаходу У нижченаведених абзацах подано визначення різноманітних хімічних груп, що утворюють сполуки за цим винаходом, призначені для вживання у всьому тексті опису та формулі винаходу, якщо інше подане в явній формі визначення не є більш широким. Термін "C1-C6-алкіл" означає одновалентні алкільні групи, що містять від 1 атому до 6 атомів вуглецю. Цей термін охоплює такі групи, як метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, третбутил, н-гексил тощо. За аналогією, термін "C1-C12алкіл" означає одновалентні алкільні групи, що містять від 1 атому до 12 атомів вуглецю, в тому числі групи "C1-C6-алкіл" та гептил, октил, ноніл, деканоїл, ундеканоїл та додеканоїл, термін "C1C10-алкіл" означає одновалентні алкільні групи, що містять від 1 атому до 10 атомів вуглецю, термін "C1-C8-алкіл" означає одновалентні алкільні групи, що містять від 1 атому до 8 атомів вуглецю, та термін "C1-C5-алкіл" означає одновалентні алкільні групи, що містять від 1 атому до 5 атомів вуглецю. Термін "гетероалкіл" означає C1-C12-алкіл, за варіантом, якому віддається перевага, C1-C6-алкіл, де щонайменше один вуглецевий атом замінений гетероатомом, вибраним з-посеред O, N або S, в тому числі 2-метоксіетил. Термін "арил" означає ненасичену ароматичну карбоциклічну групу з 6-14 вуглецевих атомів, що містить один цикл (наприклад, феніл) або декілька конденсованих циклів (наприклад, нафтил). Термін арил охоплює феніл, нафтил, фенантреніл тощо. Термін "C1-C6-алкіларил" означає арильні групи, що містять C1-C6-алкільний замісник, в тому числі метилфеніл, етилфеніл тощо. Термін "арил-C1-C6-алкіл" означає C1-C6алкільні групи, що містять арильний замісник, в тому числі 3-фенілпропаноїл, бензил тощо. Термін "гетероарил" означає моноциклічну ге 96735 16 тероароматичну або біциклічну чи трициклічну конденсовану гетероароматичну групу. До конкретних прикладів гетероароматичних груп належать факультативно заміщені піридил, піроліл, піримідиніл, фурил, тієніл, імідазоліл, охазоліл, ізохазоліл, тіазоліл, ізотіазоліл, піразоліл, 1,2,3-триазоліл, 1,2,4-триазоліл, 1,2,3-оксадіазоліл, 1,2,4оксадіазоліл, 1,2,5-оксадіазоліл, 1,3,4оксадіазоліл, 1,3,4-триазиніл, 1,2,3-триазиніл, бензофурил, [2,3-дигідро]бензофурил, ізобензофурил, бензотієніл, бензотриазоліл, ізобензотієніл, індоліл, ізоіндоліл, 3H-індоліл, бензимідазоліл, імідазо[1,2-a]піридил, бензотіазоліл, бензоксазоліл, хінолізиніл, хіназолініл, фталазиніл, хіноксалініл, цинолініл, нафтиридиніл, піридо[3,4-b]піридил, піридо[3,2-b]піридил, піридо[4,3-b]піридил, хіноліл, ізохіноліл, тетразоліл, 5,6,7,8-тетрагідрохіноліл, 5,6,7,8-тетрагідроізохіноліл, пуриніл, птеридиніл, карбазоліл, ксантеніл або бензохіноліл. Термін "C1-C6-алкілгетероарил" означає гетероарильні групи, що містять C1-C6-алкільний замісник, в тому числі метилфурил тощо. Термін "гетероарил-C1-C6-алкіл" означає C1C6-алкільні групи, що містять гетероарильний замісник, в тому числі фурилметил тощо. Термін "C2-C6-алкеніл" означає алкенільні групи, які відповідно до варіанта, якому віддається перевага, містять від 2 вуглецевих атомів до 6 вуглецевих атомів та включають щонайменше 1 або 2 алкенільні ненасичені зв’язки. До алкенільних груп, яким віддається перевага, належать етеніл (-CH=CH2), н-2-пропеніл (аліл, -CH2CH=CH2) тощо. Термін "C2-C6-алкеніларил" означає арильні групи, що містять C2-C6-алкенільний замісник, в тому числі вінілфеніл тощо. Термін "арил-C2-C6-алкеніл" означає C2-C6алкенільні групи, що містять арильний замісник, в тому числі фенілвініл тощо. Термін "C2-C6-алкенілгетероарил" означає гетероарильні групи, що містять C2-C6-алкенільний замісник, в тому числі вінілпіридиніл тощо. Термін "гетероарил-C2-C6-алкеніл" означає C2C6-алкенільні групи, що містять гетероарильний замісник, в тому числі піридинілвініл тощо. Термін "C2-C6-алкініл" означає алкінільні групи, які відповідно до варіанта, якому віддається перевага, містять від 2 вуглецевих атомів до 6 вуглецевих атомів та мають щонайменше 1-2 алкінільні ненасичені зв’язки; до алкінільних груп, яким віддається перевага, належать етиніл (-C CH), пропаргіл (-CH2CCH) тощо. Термін "C3-C8-циклоалкіл" означає насичену карбоциклічну групу з 3-8 вуглецевих атомів, що містить один цикл (наприклад, циклогексил) або кілька конденсованих циклів (наприклад, норборніл). Термін "C3-C8-циклоалкіл" охоплює циклопентил, циклогексил, норборніл тощо. Термін "гетероциклоалкіл" означає C3-C8циклоалкільну групу відповідно до наведеного вище означення, в якій до 3 вуглецевих атомів замінені гетероатомами, вибраними з групи, яку складають O, S, NR, де R визначено як водень або метил. Термін "гетероциклоалкіл" охоплює піролі 17 дин, піперидин, піперазин, морфолін, тетрагідрофуран тощо. Термін "C1-C6-алкілциклоалкіл" означає C3-C8циклоалкільні групи, що містять C1-C6-алкільний замісник, в тому числі метилциклопентил тощо. Термін "циклоалкіл-C1-C6-алкіл" означає C1-C6алкільні групи, що містять C3-C8-циклоалкільний замісник, в тому числі 3-циклопентилпропіл тощо. Термін "C1-C6-алкілгетероциклоалкіл" означає гетероциклоалкільні групи, що містять C1-C6алкільний замісник, в тому числі 1-метилпіперазин тощо. Термін "гетероциклоалкіл-C1-C6-алкіл" означає C1-C6-алкільні групи, що містять гетероциклоалкільний замісник, в тому числі 4-метилпіперидил тощо. Термін "карбоксил" означає групу -C(O)OH. Термін "карбокси-C1-C6-алкіл” означає C1-C6алкільні групи, що містять карбоксильний замісник, в тому числі 2-карбоксіетил тощо. Термін "ацил" означає групу -C(O)R, де R охоплює “C1-C12-алкіл”, за варіантом, якому віддається перевага, “C1-C6-алкіл”, “арил”, “гетероарил”, “C3-C8-циклоалкіл”, “гетероциклоалкіл”, “арил-C1C6-алкіл”, “гетероарил-C1-C6-алкіл”, “C3-C8циклоалкіл-C1-C6-алкіл” або “гетероциклоалкіл-C1C6-алкіл”. Термін "ацил-C1-C6-алкіл" означає C1-C6алкільні групи, що містять ацильний замісник, в тому числі ацетил, 2-ацетилетил тощо. Термін "ациларил" означає арильні групи, що містять ацильний замісник, в тому числі 2ацетилфеніл тощо. Термін "ацилокси(група)" означає групу OC(O)R, де R охоплює H, “C1-C6-алкіл”, “C2-C6алкеніл”, “C2-C6-алкініл”, “C3-C8-циклоалкіл”, “гетероциклоалкіл”, “арил”, “гетероарил”, “арил-C1-C6алкіл” або “гетероарил-C1-C6-алкіл”, “арил-C2-C6алкеніл”, “гетероарил-C2-C6-алкеніл”, “арил-C2-C6алкініл”, “гетероарил-C2-C6-алкініл”, “циклоалкілC1-C6-алкіл”, “гетероциклоалкіл-C1-C6-алкіл”. Термін "ацилокси-C1-C6-алкіл" означає C1-C6алкільні групи, що містять як замісник ацилоксигрупу, в тому числі етиловий складний ефір пропіонової кислоти тощо. Термін "алкокси(група)" означає групу -O-R, де R означає “C1-C6-алкіл", або "арил", або "гетероарил", або "арил-C1-C6-алкіл”, або “гетероарил-C1C6-алкіл”. До алкоксигруп, яким віддається перевага, належать, наприклад, метокси-, етокси-, феноксигрупа тощо. Термін "алкокси-C1-C6-алкіл” означає алкоксигрупи, що містять C1-C6-алкільний замісник, в тому числі метоксигрупу, метоксіетил тощо. Термін "алкоксикарбоніл” означає групу C(O)OR, де R означає H, “C1-C6-алкіл", або "арил", або "гетероарил", або “арил-C1-C6-алкіл", або "гетероарил-C1-C6-алкіл", або "гетероалкіл”. Термін "алкоксикарбоніл-C1-C6-алкіл” означає C1-C5-алкільні групи, що містять алкоксикарбонільний замісник, в тому числі 2(бензилоксикарбоніл)етил тощо. Термін "амінокарбоніл” означає групу C(O)NRR’, де кожен із R, R’ означає незалежно від іншого водень, або C1-C6-алкіл, або арил, або ге 96735 18 тероарил, або "арил-C1-C6-алкіл", або "гетероарил-C1-C6-алкіл”, в тому числі N-фенілформамід. Термін "амінокарбоніл-C1-C6-алкіл” означає C1C6-алкільні групи, що містять амінокарбонільний замісник, в тому числі 2-(диметиламінокарбоніл)етил, Nетилацетамід, N,N-діетилацетамід тощо. Термін "ациламіно(група)" означає групу NRC(O)R’, де кожен із R, R’ незалежно від іншого є водень, “C1-C6-алкіл”, “C2-C6-алкеніл”, “C2-C6алкініл”, “C3-C8-циклоалкіл”, “гетероциклоалкіл”, “арил”, “гетероарил”, “арил-C1-C6-алкіл” або “гетероарил-C1-C6-алкіл”, “арил-C2-C6-алкеніл”, “гетероарил-C2-C6-алкеніл”, “арил-C2-C6-алкініл”, “гетероарил-C2-C6-алкініл”, “циклоалкіл-C1-C6-алкіл”, “гетероциклоалкіл-C1-C6-алкіл”. Термін "ациламіно-C1-C6-алкіл” означає C1-C6алкільні групи, заміщені ациламіногрупою, в тому числі 2-(пропіоніламіно)етил тощо. Термін "уреїдо(група)" означає групу NRC(O)NR’R”, де кожен із R, R’, R" незалежно від іншого є водень, “C1-C6-алкіл”, “C2-C6-алкеніл”, “C2C6-алкініл”, “C3-C8-циклоалкіл”, “гетероциклоалкіл”, “арил”, “гетероарил”, “арил-C1-C6-алкіл” або “гетероарил-C1-C6-алкіл”, “арил-C2-C6-алкеніл”, “гетероарил-C2-C6-алкеніл”, “арил-C2-C6-алкініл”, “гетероарил-C2-C6-алкініл”, “циклоалкіл-C1-C6-алкіл”, “гетероциклоалкіл-C1-C6-алкіл”, та де R’ та R”, спільно з атомом азоту, до якого вони приєднані, можуть факультативно утворювати 3-8-членну гетероциклоалкільну групу. Термін "уреїдо-C1-C6-алкіл” означає C1-C6алкільні групи, заміщені уреїдогрупою, в тому числі 2-(N’-метилуреїдо)етил тощо. Термін "карбамат" означає групу -NRC(O)OR’, де кожен із R, R’ незалежно від іншого є водень, “C1-C6-алкіл”, “C2-C6-алкеніл”, “C2-C6-алкініл”, “C3C8-циклоалкіл”, “гетероциклоалкіл”, “арил”, “гетероарил”, “C1-C6-алкіларил” або “гетероарил-C1-C6алкіл”, “арил-C2-C6-алкеніл”, “гетероарил-C2-C6алкеніл”, “арил-C2-C6-алкініл”, “гетероарил-C2-C6алкініл”, “циклоалкіл-C1-C6-алкіл”, “гетероциклоалкіл-C1-C6-алкіл”. Термін "аміно(група)" означає групу -NRR’, де кожен із R,R’ незалежно від іншого є водень, або “C1-C6-алкіл", або "арил", або "гетероарил", або “C1-C6-алкіларил", або "C1-C6алкілгетероарил”, або “циклоалкіл”, або “гетероциклоалкіл”, та де R та R’, спільно з атомом азоту, до якого вони приєднані, можуть факультативно утворювати 3-8-членну гетероциклоалкільну групу. Термін "аміно-C1-C6-алкіл" означає C1-C6алкільні групи, заміщені аміногрупою, в тому числі 2-(1-піролідиніл)етил тощо. Термін "амоній" означає позитивно заряджену + групу -N RR’R”, де кожен із R, R’, R’’ незалежно від інших є “C1-C6-алкіл” або “C1-C6-алкіларил", або "C1-C6-алкілгетероарил”, або “циклоалкіл”, або “гетероциклоалкіл”, та де R та R’, спільно з атомом азоту, до якого вони приєднані, можуть факультативно утворювати 3-8-членну гетероциклоалкільну групу. “Амоній-C1-C6-алкіл” означає C1-C6-алкільні групи, що містять амонієвий замісник, в тому числі 19 1-етилпіролідиній тощо. “Галоген” означає атоми фтору, хлору, брому та йоду. Термін "сульфонілокси(група)" означає групу OSO2-R, де R вибраний з групи, яку складають H, “C1-C6-алкіл”, “C1-C6-алкіл", заміщений галогенами, наприклад, група -OSO2-CF3, “C2-C6-алкеніл”, “C2C6-алкініл”, “C3-C8-циклоалкіл”, “гетероциклоалкіл”, “арил”, “гетероарил”, “арил-C1-C6-алкіл” або “гетероарил-C1-C6-алкіл”, “арил-C2-C6-алкеніл”, “гетероарил-C2-C6-алкеніл”, “арил-C2-C6-алкініл”, “гетероарил-C2-C6-алкініл”, “циклоалкіл-C1-C6-алкіл”, “гетероциклоалкіл-C1-C6-алкіл”. Термін "сульфонілокси-C1-C6-алкіл” означає C1-C6-алкільні групи, заміщені сульфонілоксигрупою, в тому числі 2-(метилсульфонілокси)етил тощо. Термін "сульфоніл" означає групу “-SO2-R“, де R вибраний з групи, яку складають H, “арил”, “гетероарил”, “C1-C6-алкіл”, “C1-C6-алкіл", заміщений галогенами, наприклад, група -SO2-CF3, “C2-C6алкеніл”, “C2-C6-алкініл”, “C3-C8-циклоалкіл”, “гетероциклоалкіл”, “арил”, “гетероарил”, “арил-C1-C6алкіл” або “гетероарил-C1-C6-алкіл”, “арил-C2-C6алкеніл”, “гетероарил-C2-C6-алкеніл”, “арил-C2-C6алкініл”, “гетероарил-C2-C6-алкініл”, “циклоалкілC1-C6-алкіл”, “гетероциклоалкіл-C1-C6-алкіл”. Термін "сульфоніл-C1-C6-алкіл” означає C1-C6алкільні групи, що містять сульфонільний замісник, в тому числі 2-(метилсульфоніл)етил тощо. Термін "сульфініл" означає групу “-S(O)-R”, де R вибраний з групи, яку складають H, “C1-C6алкіл”, “C1-C6-алкіл", заміщений галогенами, наприклад, група -SO-CF3, “C2-C6-алкеніл”, “C2-C6алкініл”, “C3-C8-циклоалкіл”, “гетероциклоалкіл”, “арил”, “гетероарил”, “арил-C1-C6-алкіл” або “гетероарил-C1-C6-алкіл”, “арил-C2-C6-алкеніл”, “гетероарил-C2-C6-алкеніл”, “арил-C2-C6-алкініл”, “гетероарил-C2-C6-алкініл”, “циклоалкіл-C1-C6-алкіл”, “гетероциклоалкіл-C1-C6-алкіл”. Термін "сульфініл-C1-C6-алкіл” означає C1-C6алкільні групи, що містять сульфінільний замісник, в тому числі 2-(метилсульфініл)етил тощо. Термін "сульфаніл" означає групи -S-R, де R означає H, “C1-C6-алкіл”, “C1-C6-алкіл", заміщений галогенами, наприклад, групу -SO-CF3, “C2-C6алкеніл”, “C2-C6-алкініл”, “C3-C8-циклоалкіл”, “гетероциклоалкіл”, “арил”, “гетероарил”, “арил-C1-C6алкіл” або “гетероарил-C1-C6-алкіл”, “арил-C2-C6алкеніл”, “гетероарил-C2-C6-алкеніл”, “арил-C2-C6алкініл”, “алкінілгетероарил-C2-C6”, “циклоалкіл-C1C6-алкіл”, “гетероциклоалкіл-C1-C6-алкіл”. До сульфанільних груп, яким віддається перевага, належать метилсульфаніл, етилсульфаніл тощо. “Сульфаніл-C1-C6-алкіл” означає C1-C6алкільні групи, що містять сульфанільний замісник, в тому числі 2-(етилсульфаніл)етил тощо. Термін "сульфоніламіно(група)" означає групу -NRSO2-R’, де кожен із R, R’ означає незалежно від іншого водень, “C1-C6-алкіл”, “C2-C6-алкеніл”, “C2-C6-алкініл”, “C3-C8-циклоалкіл”, “гетероциклоалкіл”, “арил”, “гетероарил”, “арил-C1-C6-алкіл” або “гетероарил-C1-C6-алкіл”, “арил-C2-C6-алкеніл”, “гетероарил-C2-C6-алкеніл”, “арил-C2-C6-алкініл”, 96735 20 “гетероарил-C2-C6-алкініл”, “циклоалкіл-C1-C6алкіл”, “гетероциклоалкіл-C1-C6-алкіл”. Термін "сульфоніламіно-C1-C6-алкіл” означає C1-C6-алкільні групи, заміщені сульфоніламіногрупою, в тому числі 2-(етилсульфоніламіно)етил тощо. Термін "аміносульфоніл" означає групу -SO2NRR', де кожен із R, R’ означає незалежно від іншого водень, “C1-C6-алкіл”, “C2-C6-алкеніл”, “C2-C6алкініл”, “C3-C8-циклоалкіл”, “гетероциклоалкіл”, “арил”, “гетероарил”, “арил-C1-C6-алкіл” або “гетероарил-C1-C6-алкіл”, “арил-C2-C6-алкеніл”, “гетероарил-C2-C6-алкеніл”, “арил-C2-C6-алкініл”, “гетероарил-C2-C6-алкініл”, “циклоалкіл-C1-C6-алкіл”, “гетероциклоалкіл-C1-C6-алкіл”. Термін "аміносульфоніл-C1-C6-алкіл” означає C1-C6-алкільні групи, що містять аміносульфонільний замісник, в тому числі 2(циклогексиламіносульфоніл)етил тощо. Термін "заміщені або незаміщені": якщо значення терміну не обмежене інакше визначенням конкретного замісника, усі вищезазначені групи, наприклад, “алкеніл“, “алкініл“, “арил“, “гетероарил“, “циклоалкіл”, “гетероциклоалкіл” тощо, можуть бути факультативно заміщені 1-5 замісниками, вибраними з групи, яку складають “C1-C6-алкіл“, “C2-C6-алкеніл“, “C2-C6алкініл“, “циклоалкіл”, “гетероциклоалкіл”, “C1-C6алкіларил“, “C1-C6-алкілгетероарил“, “C1-C6алкілциклоалкіл“, “C1-C6-алкілгетероциклоалкіл“, "аміногрупа", "амоній", “ацил“, "ацилокси-", "ациламіногрупа", “амінокарбоніл“, “алкоксикарбоніл“, "уреїдогрупа", "арил", “карбамат”, “гетероарил“, “сульфініл”, “сульфоніл”, "алкоксигрупа", "сульфаніл", “галоген”, "карбоксил", тригалометил, ціаногрупа, гідроксил, меркапто-, нітрогрупа тощо. Термін "заміщені" означає групи, заміщені 1-5 замісниками, вибраними з групи, яку складають “C1-C6-алкіл“, “C2-C6-алкеніл“, “C2-C6-алкініл“, “циклоалкіл”, “гетероциклоалкіл”, “C1-C6-алкіларил“, “C1-C6-алкілгетероарил“, “C1-C6-алкілциклоалкіл“, “C1-C6-алкілгетероциклоалкіл“, "аміногрупа", "аміносульфоніл", “амоній”, "ациламіногрупа", “амінокарбоніл”, “арил“, “гетероарил“, “сульфініл”, “сульфоніл”, "алкоксигрупа", “алкоксикарбоніл”, “карбамат”, “сульфаніл”, “галоген”, тригалогенметил, ціаногрупа, гідроксил, меркапто-, нітрогрупа тощо. Вислів "фармацевтично прийнятні солі або комплекси" означає солі або комплекси нижчезазначених сполук Формули (I), які зберігають бажану біологічну активність. До необмежувальних прикладів таких солей належать солі кислот, утворені з неорганічними кислотами (наприклад, хлористоводневою кислотою, бромистоводневою кислотою, сірчаною кислотою, фосфорною кислотою, азотною кислотою тощо), та солі, утворені з органічними кислотами, наприклад, оцтовою кислотою, щавлевою кислотою, винною кислотою, бурштиновою кислотою, яблучною кислотою, фумаровою кислотою, малеїновою кислотою, аскорбіновою кислотою, бензойною кислотою, дубильною кислотою, памоєвою кислотою, альгіновою кислотою, поліглутаміновою кислотою, нафталінсульфоновою кислотою, нафталін-дисульфоновою кисло 21 тою та полігалактуроновою кислотою. Згадані сполуки можуть також бути застосовані у формі фармацевтично прийнятних четвертинних солей, відомих фахівцям у цій галузі, до яких конкретно належать четвертинні солі амонію Формули + NR,R’,R” Z , де R, R’, R" незалежно один від одного є водень, алкіл, або бензил, C1-C6-алкіл, C2-C6алкеніл, C2-C6-алкініл, C1-C6-алкіларил, C1-C6алкілгетероарил, циклоалкіл, гетероциклоалкіл, а Z - протиіон, в тому числі хлорид, бромід, йодид, O-алкіл, толуолсульфонат, метилсульфонат, сульфонат, фосфат, або карбоксилат (наприклад, бензоат, сукцинат, ацетат, гліколят, малеат, малат, фумарат, цитрат, тартрат, аскорбат, цинамоат, манделоат та дифенілацетат). Вислів "фармацевтично активне похідне" означає будь-яку сполуку, яка при введенні в організм реципієнта здатна прямо або непрямо виявляти активність, розкриту у цьому описі. Термін "непрямо" також охоплює проліки, які можуть перетворюватися в активну форму лікарського засобу під впливом ендогенних ферментів або метаболізму. На цей час виявлено, що сполуки відповідно до даного винаходу є модуляторами фосфоінозитид-3-кіназ (PI3K), в тому числі PI3K та . Коли фермент фосфоінозитид-3-кіназа (PI3K) інгібований сполукою за цим винаходом, PI3K нездатна виявляти свої ферментні, біологічні та/або фармакологічні ефекти. Сполуки за цим винаходом, таким чином, є корисними при лікуванні та профілактиці аутоімунних захворювань та/або запальних захворювань, серцево-судинних захворювань, нейродегенеративних захворювань, бактеріальних або вірусних інфекцій, алергії, астми, панкреатиту, одночасної недостатності кількох органів, ниркових захворювань, агрегації тромбоцитів, раку, трансплантації, порушення рухливості сперматозоїдів, дефіциту еритроцитів, відторгнення трансплантата або ушкоджень легенів. Загальна Формула (I) відповідно до даного винаходу також охоплює відповідні таутомери, геометричні ізомери, оптично активні форми, наприклад, енантіомери, діастереомери, та рацематні форми, а також фармацевтично прийнятні солі відповідних сполук. До фармацевтично прийнятних солей Формули (I), яким віддається перевага, належать солі кислот, утворені із фармацевтично прийнятними кислотами, наприклад, гідрохлориди, гідроброміди, сульфати або бісульфати, фосфати або гідрофосфати, ацетати, бензоати, сукцинати, фумарати, малеати, лактати, цитрати, тартрати, глюконати, метансульфонати, бензолсульфонати та пара-толуолсульфонати. Сполуки, що відповідають Формулі (I), є корисними для модулювання, особливо інгібування, активності фосфоінозитид-3-кіназ (PI3K). Таким чином, вважається, що сполуки даного винаходу також особливо корисні для лікування та/або попередження захворювань, опосередкованих PI3K, особливо PI3K та/або PI3K . Згадане лікування включає модулювання - особливо інгібування або регулювання за типом зворотного негативного зв'язку - фосфатоінозитид-3-кіназ. 96735 22 Сполуки, що відповідають Формулі (I), придатні для застосування як лікарські засоби. За одним із варіантів здійснення винаходу, запропоновано похідні тіазолу Формули (I): R N R 4 N H 3 N X 1 R R 2 S (I) , 1 де R вибраний з групи, яку складають 5 C(O)R ; факультативно заміщений C1-C6-алкіл, в тому числі ціанометил, гідроксиметил; факультативно заміщений C2-C6-алкеніл; факультативно заміщений C2-C6-алкініл; факультативно заміщений арил-C1-C6-алкіл; факультативно заміщений гетероарил-C1-C6-алкіл, в тому числі тетразолілметил (наприклад, 2H-тетразол-5-ілметил); факультативно заміщений C3-C8-циклоалкіл-C1-C6-алкіл та факультативно заміщений гетероциклоалкіл-C1C6-алкіл; 2 R вибраний з групи, яку складають H; галоген; факультативно заміщений C1-C6-алкіл; факультативно заміщений C2-C6-алкеніл та факультативно заміщений C2-C6-алкініл; 3 R вибраний з групи, яку складають H; галоген; факультативно заміщений C1-C6-алкіл, в тому числі метил; факультативно заміщений C2-C6-алкеніл та факультативно заміщений C2-C6-алкініл; 4 6 R вибраний з групи, яку складають -C(O)R ; факультативно заміщений арил, в тому числі; факультативно заміщений гетероарил, в тому числі піразиніл (наприклад, піразин-2-іл) та піразоліл (наприклад, піразол-3-іл); факультативно заміщений гетероциклоалкіл та факультативно заміщений C3-C8-циклоалкіл; 5 R вибраний з групи, яку складають H; гідроксил; факультативно заміщена алкоксигрупа, в тому числі етоксигрупа; факультативно заміщена аміногрупа, в тому числі аліламін, метоксіетиламін (наприклад, 2-метоксіетиламін), метоксипропіламін (наприклад, 3-метоксипропіламін), гідроксіетиламін (наприклад, 2-гідроксіетиламін), гідроксилпропіламін (наприклад, 2,3-дигідроксипропіламін), ціаноетиламін (наприклад, 2-ціаноетиламін), пропіламін (наприклад, н-пропіламін), проп-2-ініламін, тетрагідрофуранметиламін (наприклад, тетрагідрофуран-2-іл-метиламін), диметиламіноетиламін (наприклад, 2-(диметиламіно)етиламін), диметиламінопропіламін (наприклад, 3(диметиламіно)пропіламін), тетразоліламін (наприклад, 1H-тетразол-5-іламін, 1H-тетразол-3іламін), амінобензойна кислота (наприклад, 4амінобензойна кислота, 3-амінобензойна кислота, 3-аміно-2-гідроксибензойна кислота, 4-аміно-2гідроксибензойна кислота, 4-аміно-2фторбензойна кислота, 5-аміно-2гідроксибензойна кислота), тетразолілфеніламін (наприклад, 3-(1H-тетразол-5-іл)феніламін, 3-(1Hтетразол-3-іл)феніламін, 4-(1H-тетразол-5іл)феніламін, 4-(1H-тетразол-3-іл)феніламін), тіадіазолілфеніламін (наприклад, 3-(5-аміно-1,3,4тіадіазол-2-іл)феніламін), оксадіазолілфеніламін 23 (наприклад, 3-(5-гідрокси-1,3,4-оксадіазол-2іл)феніламін, 4-(5-гідрокси-1,3,4-оксадіазол-2іл)феніламін), бензиламін (наприклад, Nбензиламін), 1H-1,2,3, бензотриазол-5-іламін; факультативно заміщений арил; факультативно заміщений гетероарил; факультативно заміщений C3-C8-циклоалкіл; факультативно заміщений гетероциклоалкіл, в тому числі морфолініл (наприклад, морфолін-4-іл), піперазиніл (наприклад, 4-метилпіперазин-1-іл, 4ацетилпіперазин-1-іл, 3-оксопіперазин-1-іл, піперидиніл (наприклад, 3-(карбонова кислота)піперидин-1-іл, 4-(карбонова кислота)піперидин-1-іл, 4-(гідроксилметил)піперидин-1іл, 3-гідроксипіперидин-1-іл, 4-гідроксипіперидин-1іл, 4-(2-гідроксіетил)піперидин-1-іл, 4фторпіперидин-1-іл, 4-оксопіперидин-1-іл), 1,4діокса-8-азаспіро[4.5]декан-8-іл, 7-(гідроксиметил)6,8-діокса-3-азабіцикло[3.2.1]окт-3-іл, піролідиніл (наприклад, 3-гідроксипіролідин-1-іл); 6 R вибраний з групи, яку складають H; факультативно заміщений C1-C6-алкіл, в тому числі метил; факультативно заміщений C2-C6-алкеніл; факультативно заміщений C2-C6-алкініл; факультативно заміщений арилC1-C6-алкіл; факультативно заміщений гетероарил-C1-C6-алкіл та факультативно заміщена аміногрупа, в тому числі факультативно заміщений C1-C6-алкіламін, наприклад, метоксіетиламін (наприклад, 2-метоксіетиламін), 2-аміно-N,Nдиметилацетамід, 3-амінопропіонова кислота та алкіловий складний ефір 3-амінопропіонової кислоти (наприклад, 3-аміноетиловий складний ефір пропіонової кислоти, трет-бутиловий складний ефір 3-амінопропіонової кислоти); X вибраний з групи, яку складають S та O; а також геометричні ізомери, оптично активні форми, наприклад, енантіомери, діастереомери та рацемічні форми, а також фармацевтично прийнятні солі відповідних сполук. За іншим варіантом здійснення винаходу, за1 пропоновано похідні тіазолу Формули (I), де R 5 група -C(O)R . За іншим варіантом здійснення винаходу, за1 пропоновано похідні тіазолу Формули (I), де R вибраний з групи, яку складають факультативно заміщений C1-C6-алкіл; факультативно заміщений C2-C6-алкеніл; факультативно заміщений C2-C6алкініл; факультативно заміщений арил-C1-C6алкіл; факультативно заміщений гетероарил-C1Приклад № 1 2 3 4 5 6 7 8 9 10 11 12 96735 24 C6-алкіл; факультативно заміщений C3-C8циклоалкіл-C1-C6-алкіл та факультативно заміщений гетероциклоалкіл-C1-C6-алкіл. За іншим варіантом здійснення винаходу, за2 пропоновано похідні тіазолу Формули (I), де R - H. За іншим варіантом здійснення винаходу, за3 пропоновано похідні тіазолу Формули (I), де R метил. За іншим варіантом здійснення винаходу, за4 пропоновано похідні тіазолу Формули (I), де R вибраний з групи, яку складають факультативно заміщений арил, в тому числі факультативно заміщений гетероарил, в тому числі піразиніл (наприклад, піразин-2-іл) та піразоліл (наприклад, піразол-3-іл); факультативно заміщений гетероциклоалкіл та факультативно заміщений C3-C8циклоалкіл. За іншим варіантом здійснення винаходу, за4 пропоновано похідні тіазолу Формули (I), де R 6 вибраний з групи, яку складають групи -C(O)R . За іншим варіантом здійснення винаходу, за5 пропоновано похідні тіазолу Формули (I), де R вибраний з групи, яку складають гідроксил та факультативно заміщена алкоксигрупа. За іншим варіантом здійснення винаходу, за5 пропоновано похідні тіазолу Формули (I), де R факультативно заміщена аміногрупа. За іншим варіантом здійснення винаходу, за5 пропоновано похідні тіазолу Формули (I), де R вибраний з групи, яку складають факультативно заміщений арил; факультативно заміщений гетероарил; факультативно заміщений C3-C8циклоалкіл та факультативно заміщений гетероциклоалкіл. За іншим варіантом здійснення винаходу, за6 пропоновано похідні тіазолу Формули (I), де R вибраний з групи, яку складають факультативно заміщений C1-C6-алкіл, факультативно заміщений C2-C6-алкеніл, факультативно заміщений C2-C6алкініл, факультативно заміщений арил-C1-C6алкіл та факультативно заміщений гетероарил-C1C6-алкіл. За іншим варіантом здійснення винаходу, за6 пропоновано похідні тіазолу Формули (I), де R факультативно заміщена аміногрупа. За іншим варіантом здійснення винаходу, запропоновано похідні тіазолу Формули (I), де X - S. До сполук за винаходом належать, зокрема, сполуки, які складають таку групу: Назва етил-2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2-карбоксилат; 2'-(ацетиламіно)-N-аліл-4'-метил-4,5'-бі-1,3-тіазол-2-карбоксамід; N-[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]ацетамід; 2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2-карбонова кислота; 2'-(ацетиламіно)-N-(2-метоксіетил)-4'-метил-4,5'-бі-1,3-тіазол-2-карбоксамід; 2'-(ацетиламіно)-4'-метил-N-(тетрагідрофуран-2-ілметил)-4,5'-бі-1,3-тіазол-2-карбоксамід; 2'-(ацетиламіно)-N-[2-(диметиламіно)етил]-4'-метил-4,5'-бі-1,3-тіазол-2-карбоксамід; N-[4'-метил-2-(морфолін-4-ілкарбоніл)-4,5'-бі-1,3-тіазол-2'-іл]ацетамід; N-{4'-метил-2-[(4-метилпіперазин-1-іл)карбоніл]-4,5'-бі-1,3-тіазол-2'-іл}ацетамід; 2'-(ацетиламіно)-N-[3-(диметиламіно)пропіл]-4'-метил-4,5'-бі-1,3-тіазол-2-карбоксамід; 2'-(ацетиламіно)-N-(2-гідроксіетил)-4'-метил-4,5'-бі-1,3-тіазол-2-карбоксамід; 2'-(ацетиламіно)-N-(2-ціаноетил)-4'-метил-4,5'-бі-1,3-тіазол-2-карбоксамід; 25 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 96735 26 2'-(ацетиламіно)-4'-метил-N-1H-тетразол-5-іл-4,5'-бі-1,3-тіазол-2-карбоксамід; 4-({[2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2-іл]карбоніл} аміно)бензойна кислота; 3-({[2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2-іл]карбоніл} аміно)бензойна кислота; 2'-(ацетиламіно)-4'-метил-N-[3-(1H-тетразол-5-іл)феніл]-4,5'-бі-1,3-тіазол-2-карбоксамід; 2'-(ацетиламіно)-N-бензил-4'-метил-4,5'-бі-1,3-тіазол-2-карбоксамід; 2'-(ацетиламіно)-4'-метил-N-пропіл-4,5'-бі-1,3-тіазол-2-карбоксамід; 2'-(ацетиламіно)-4'-метил-N-[4-(1H-тетразол-5-іл)феніл]-4,5'-бі-1,3-тіазол-2-карбоксамід; 3-({[2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2-іл]карбоніл}аміно)-2-гідроксибензойна кислота; 1-{[2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2-іл]карбоніл}піперидин-3-карбонова кислота; 5-({[2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2-іл]карбоніл}аміно)-2-гідроксибензойна кислота; N-[4'-метил-2-(2H-тетразол-5-ілметил)-4,5'-бі-1,3-тіазол-2'-іл]ацетамід; 1-{[2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2-іл]карбоніл}піперидин-4-карбонова кислота; 2'-(ацетиламіно)-N-[3-(5-аміно-1,3,4-тіадіазол-2-іл)феніл]-4'-метил-4,5'-бі-1,3-тіазол-2карбоксамід; N-{2-[(3-гідроксипіперидин-1-іл)карбоніл]-4'-метил-4,5'-бі-1,3-тіазол-2'-іл}ацетамід; N-(2-{[4-(гідроксиметил)піперидин-1-іл]карбоніл}-4'-метил-4,5'-бі-1,3-тіазол-2'-іл)ацетамід; N-(2-{[4-(2-гідроксіетил)піперидин-1-іл]карбоніл}-4'-метил-4,5'-бі-1,3-тіазол-2'-іл)ацетамід; N-{2-[(4-гідроксипіперидин-1-іл)карбоніл]-4'-метил-4,5'-бі-1,3-тіазол-2'-іл}ацетамід; 2'-(ацетиламіно)-N-1H-1,2,3-бензотриазол-5-іл-4'-метил-4,5'-бі-1,3-тіазол-2-карбоксамід; 4-({[2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2-іл]карбоніл}аміно)-2-гідроксибензойна кислота; 4-({[2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2-іл]карбоніл}аміно)-2-фторбензойна кислота; 2'-(ацетиламіно)-N-[3-(5-гідрокси-1,3,4-оксадіазол-2-іл)феніл]-4'-метил-4,5'-бі-1,3-тіазол-2карбоксамід; 2'-(ацетиламіно)-N-[4-(5-гідрокси-1,3,4-оксадіазол-2-іл)феніл]-4'-метил-4,5'-бі-1,3-тіазол-2карбоксамід; N-[2-(гідроксиметил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]ацетамід; N-(2-метоксіетил)-N'-[4'-метил-2-(морфолін-4-ілкарбоніл)-4,5'-бі-1,3-тіазол-2'-іл]сечовина; етил-N-({[4'-метил-2-(морфолін-4-ілкарбоніл)-4,5'-бі-1,3-тіазол-2'-іл]аміно}карбоніл)-бетааланінат; N-[2-(1,4-діокса-8-азаспіро[4.5]дец-8-ілкарбоніл)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]ацетамід; 2'-(ацетиламіно)-N-(2,3-дигідроксипропіл)-4'-метил-4,5'-бі-1,3-тіазол-2-карбоксамід; N-[4'-метил-2-(морфолін-4-ілкарбоніл)-4,5'-бі-1,3-тіазол-2'-іл]сечовина; N-{4'-метил-2-[(3-оксопіперазин-1-іл)карбоніл]-4,5'-бі-1,3-тіазол-2'-іл}ацетамід; N-{4’-метил-2-[(4-оксопіперидин-1-іл)карбоніл]-4,5’-бі-1,3-тіазол-2’-іл}ацетамід; N-{2-[(3-гідроксипіролідин-1-іл)карбоніл]-4'-метил-4,5'-бі-1,3-тіазол-2'-іл}ацетамід; 2'-(ацетиламіно)-4'-метил-N-проп-2-ін-1-іл-4,5'-бі-1,3-тіазол-2-карбоксамід; N-{2-[(4-ацетилпіперазин-1-іл)карбоніл]-4'-метил-4,5'-бі-1,3-тіазол-2'-іл}ацетамід; 1 1 2 N ,N -диметил-N -({[4'-метил-2-(морфолін-4-ілкарбоніл)-4,5'-бі-1,3-тіазол-2'іл]аміно}карбоніл)гліцинамід; N-({[4'-метил-2-(морфолін-4-ілкарбоніл)-4,5'-бі-1,3-тіазол-2'-іл] аміно}карбоніл)-бета-аланін; N-{2-[(4-фторпіперидин-1-іл)карбоніл]-4'-метил-4,5'-бі-1,3-тіазол-2'-іл}ацетамід; N-(2-{[(1S,5S,7S)-7-(гідроксиметил)-6,8-діокса-3-азабіцикло[3.2.1]окт-3-іл]карбоніл}-4'-метил4,5'-бі-1,3-тіазол-2'-іл)ацетамід; етил N-({[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]аміно}карбоніл)-бета-аланінат; N-(2-{[(1R,5R,7R)-7-(гідроксиметил)-6,8-діокса-3-азабіцикло[3.2.1]окт-3-іл]карбоніл}-4'-метил4,5'-бі-1,3-тіазол-2'-іл)ацетамід; трет-бутил-N-({[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]аміно}карбоніл)-бета-аланінат; [4'-метил-2'-(піразин-2-іламіно)-4,5'-бі-1,3-тіазол-2-іл]ацетонітрил; етил-4'-метил-2'-(піразин-2-іламіно)-4,5'-бі-1,3-тіазол-2-карбоксилат; [4'-метил-2'-(1H-піразол-3-іламіно)-4,5'-бі-1,3-тіазол-2-іл]ацетонітрил; N-[4'-метил-2-(2-морфолін-4-іл-2-оксоетил)-4,5'-бі-1,3-тіазол-2'-іл]ацетамід; 2-[2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2-іл]ацетамід; трет-бутил-4-{[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]аміно}-4-оксобутаноат; метил-5-{[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]аміно}-5-оксопентаноат; метил-6-{[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]аміно}-6-оксогексаноат; 2'-(ацетиламіно)-N,N,4'-триметил-4,5'-бі-1,3-тіазол-2-карбоксамід; 2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2-карбоксамід; 4-{[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]аміно}-4-оксобутанова кислота; 5-{[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]аміно}-5-оксопентанова кислота; трет-бутил-N-({[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]аміно}карбоніл)гліцинат; трет-бутил-4-[({[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]аміно}карбоніл)аміно]бутаноат; 2 1 1 N -({[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]аміно}карбоніл)-N ,N -диметилгліцинамід; 27 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 96735 28 трет-бутил-N-({[4'-метил-2-(морфолін-4-ілкарбоніл)-4,5'-бі-1,3-тіазол-2'-іл]аміно}карбоніл)-бетааланінат; N-[4'-метил-2-(морфолін-4-ілкарбоніл)-4,5'-бі-1,3-тіазол-2'-іл]-N-(2-морфолін-4-іл-2оксоетил)сечовина; N-[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]-N-(2-морфолін-4-іл-2-оксоетил)сечовина; метил-N-({[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]аміно}карбоніл)-бета-аланінат; 3 1 1 N -({[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]аміно}карбоніл)-N ,N -діізопропіл-бетааланінамід; 3 1 N -({[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]аміно}карбоніл)-N -(2-гідрокси-1,1диметилетил)-бета-аланінамід; 1 3 N -(трет-бутил)-N -({[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]аміно}карбоніл)-бетааланінамід; N-[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]-N-[3-(2,2-диметил-1,3-тіазолідин-3-іл)-3оксопропіл]сечовина; N-[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]-N-[3-(4,4-диметил-1,3-оксазолідин-3-іл)-3оксопропіл]сечовина; 2 1 N -({[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]аміно}карбоніл)-N -(2,2диметилпропіл)гліцинамід; N-(3-азокан-1-іл-3-оксопропіл)-N-[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]сечовина; N-[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]-N'-[2-(1-ізопропіл-1H-імідазол-4іл)етил]сечовина; N-[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]-N'-[2-(1-етил-1H-імідазол-4-іл)етил]сечовина; N-[2-(5-трет-бутил-1,2,4-оксадіазол-3-іл)етил]-N'-[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'іл]сечовина; N-[2-(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]-N'-[2-(5-ізопропіл-1,2,4-оксадіазол-3іл)етил]сечовина; N-(4'-метил-2-{[5-(1-метилпіперидин-4-іл)-1,2,4-оксадіазол-3-іл]метил}-4,5'-бі-1,3-тіазол-2'іл)ацетамід. Сполуки за цим винаходом застосовують як лікарські засоби. Вони можуть бути застосовані для виготовлення лікарського засобу для профілактики та/або лікування аутоімунних захворювань та/або запальних захворювань, серцево-судинних захворювань, нейродегенеративних захворювань, бактеріальних або вірусних інфекцій, алергії, астми, панкреатиту, одночасної недостатності кількох органів, ниркових захворювань, агрегації тромбоцитів, раку, трансплантації, порушення рухливості сперматозоїдів, дефіциту еритроцитів, відторгнення трансплантата або ушкоджень легенів. Відповідно до одного з варіантів здійснення, сполуки Формули (I) корисні для лікування та/або профілактики аутоімунних захворювань або запальних захворювань, наприклад, аутоімунних захворювань або запальних захворювань, наприклад, розсіяного склерозу, псоріазу, ревматоїдного артриту, системного червоного вовчака, запального захворювання кишечнику, запалення легенів, тромбозу або інфекції/запалення мозку, наприклад, менінгіту або енцефаліту. Відповідно до іншого варіанта здійснення, сполуки Формули (I) корисні для лікування та/або профілактики нейродегенеративних захворювань, в тому числі хвороби Альцгеймера, хвороби Гантінгтона, травми ЦНС, інсульту або ішемічних станів. Відповідно до ще одного додаткового варіанта здійснення, сполуки Формули (I) корисні для лікування та/або профілактики серцево-судинних захворювань, наприклад, атеросклерозу, гіпертрофії серця, дисфункції серцевих міоцитів, підвищеного кров'яного тиску або звуження кровоносних судин. Відповідно до ще одного додаткового варіанта здійснення, сполуки Формули (I) корисні для лікування та/або профілактики дефіциту еритроцитів, наприклад, анемії, в тому числі гемолітичної анемії, апластичної анемії та справжньої еритроцитарної анемії. Відповідно до ще одного варіанта здійснення, сполуки Формули (I) корисні для лікування та/або профілактики хронічного обструктивного легеневого захворювання, спричиненого анафілактичним шоком фіброзу, псоріазу, алергічних захворювань, астми, інсульту або ішемічних станів, ішеміїреперфузії, агрегації/активації тромбоцитів, атрофії/гіпертрофії скелетних м'язів, відновлення лейкоцитів у раковій тканині, ангіогенезу, інвазійних метастазів, зокрема, меланоми, саркоми Капоші, гострих та хронічних бактеріальних та вірусних інфекцій, сепсису, трансплантації, відторгнення трансплантата, гломерулосклерозу, гломерулонефриту, прогресуючого ниркового фіброзу, ендотеліальних та епітеліальних уражень при запаленнях легенів або загальних дихальних шляхів легенів. Відповідно до іншого варіанта здійснення винаходу, запропоновано спосіб виготовлення похідних тіазолу за Формулою (I), який включає стадію проведення реакції аміну Формули (Ia) з похідним 6 Формули ClC(O)R у присутності основи, наприклад, піридину, DIEA, TEA, тощо. N H2 N 3 R6C(O)Cl X 2 1 S (Ia) R O N R H N 6 R R N 3 R X N 2 R 1 S (I) R 29 1 2 3 96735 6 де R , R , R , R та X відповідають визначенням, наведеним у описі. Відповідно до іншого варіанта здійснення винаходу, запропоновано спосіб виготовлення похідних тіазолу за Формулою (I), який включає стадію нагрівання аміну Формули (Ia) у мурашиній кислоті або у будь-якому алкілформіаті, із факультативним додатковим розчинником. Відповідно до іншого варіанта здійснення винаходу, запропоновано спосіб виготовлення похідних тіазолу за Формулою (I), який включає стадію проведення реакції аміну Формули (Ia) з похідним 7 8 Формули R R NC(O) у присутності основи, напри7 8 клад, DIEA, TEA тощо, де R та R вибрані з групи, яку складають H; факультативно заміщений C1-C6алкіл, наприклад, метоксіетил (наприклад, 2метоксіетил), (карбонова кислота)алкіл (наприклад, (3-карбонова кислота)етил), (алкіловий складний ефір 3-карбонової кислоти)етил (наприклад, (етиловий складний ефір 3-карбонової кислоти)етил, (трет-бутиловий складний ефір 3карбонової кислоти)етил), амінокарбонілметил (наприклад, N,N-диметиламінокарбонілметил). Відповідно до іншого варіанта здійснення винаходу запропоновано спосіб виготовлення похідних тіазолу за Формулою (I), який включає стадію проведення реакції аміну Формули (Ia) з CDI, з 7 8 подальшим доданням аміну Формули R R NH, де 7 8 R та R вибрані з групи, яку складають H; факультативно заміщений C1-C6-алкіл, наприклад, метоксіетил (наприклад, 2-метоксіетил), (карбонова кислота)алкіл (наприклад, (3-карбонова кислота)етил), (алкіловий складний ефір 3карбонової кислоти)етил (наприклад, (етиловий складний ефір 3-карбонової кислоти)етил, (третбутиловий складний ефір 3-карбонової кислоти)етил), амінокарбонілметил (наприклад, N,Nдиметиламінокарбонілметил). Відповідно до іншого варіанта здійснення винаходу запропоновано спосіб виготовлення похідних тіазолу за Формулою (I), який включає стадію проведення реакції похідного Формули (P3) з амі9 10 ном Формули HNR R , у присутності основи, наприклад, піридину, DIEA, TEA, тощо 4 R H N N 3 R 4 R X N 2 R 1 Cl 3 10 N R N R9 2 S O (Ic) 4 3-бензойна кислота, 2-гідрокси-3-бензойна кислота, 3-гідрокси-4-бензойна кислота, 3-фтор-4бензойна кислота, 4-гідрокси-3-бензойна кислота), тетразолілфеніл (наприклад, 3-(1H-тетразол-5іл)феніл, 3-(1H-тетразол-3-іл)феніл, 4-(1Hтетразол-5-іл)феніл, 4-(1H-тетразол-3-іл)феніл), тіадіазолілфеніл (наприклад, 3-(5-аміно-1,3,4тіадіазол-2-іл)феніл), оксадіазолілфеніл (наприклад, 3-(5-гідрокси-1,3,4-оксадіазол-2-іл)феніл, 4(5-гідрокси-1,3,4-оксадіазол-2-іл)феніл), бензил (наприклад, бензил, 1H-1,2,3, бензотриазол-5-іл; факультативно заміщений арил; факультативно заміщений гетероарил; факультативно заміщений C3-C8-циклоалкіл; 9 10 факультативно група -NR R може утворювати цикл, та може бути вибрана з групи, яку складають заміщений гетероциклоалкіл, в тому числі морфолініл (наприклад, морфолін-4-іл), піперазиніл (наприклад, 4-метилпіперазин-1-іл, 4ацетилпіперазин-1-іл, 3-оксопіперазин-1-іл), піперидиніл (наприклад, (3-карбонова кислота)піперидин-1-іл, (4-карбонова кислота)піперидин-1-іл, 4-(гідроксилметил) піперидин-1іл, 3-гідроксипіперидин-1-іл, 4-гідроксипіперидин-1іл, 4-(2-гідроксіетил) піперидин-1-іл, 4фторпіперидин-1-іл, 4-оксопіперидин-1-іл), 1,4діокса-8-азаспіро[4.5] декан-8-іл, 7(гідроксиметил)-6,8-діокса-3-азабіцикло[3.2.1]окт3-іл, піролідиніл (наприклад, 3-гідроксипіролідин-1іл). Відповідно до іншого варіанта здійснення винаходу запропоновано спосіб виготовлення похідних тіазолу за Формулою (I), який включає стадію відновлення похідного Формули (P3) шляхом додання гідриду, наприклад, три-третбутоксіалюмогідриду літію ((tBuO)3AlHLi). За іншим варіантом здійснення цього винаходу, запропоновано сполуки, що відповідають Формулі (Ia): N H2 N 3 R X N 2 R 1 S R 3 R X R O 2 N HNR9R10 S (P3) H N 30 де R , R , R , R та X відповідають визначен9 10 ням, наведеним у описі, та R та R вибрані з групи, яку складають H; факультативно заміщений C1-C6-алкіл, наприклад, аліл, метоксіетил (наприклад, 2-метоксіетил), метоксипропіл (наприклад, 3метоксипропіл), гідроксіетил (наприклад, 2гідроксіетил), гідроксилпропіл (наприклад, 2,3дигідроксипропіл), ціаноетил (наприклад, 2ціаноетил), пропіл (наприклад, н-пропіл), проп-2ініл, тетрагідрофуранметил (наприклад, тетрагідрофуран-2-іл-метил), диметиламіноетил (наприклад, 2-(диметиламіно)етил), диметиламінопропіл (наприклад, 3-(диметиламіно)пропіл), тетразоліл (наприклад, 1H-тетразол-5-іл, 1H-тетразол-3-іл), бензойна кислота (наприклад, 4-бензойна кислота, Ia , 1 2 3 де R , R , R та X відповідають визначенням, наведеним в описі, та за умови, що сполуки Формули Ia не є переліченими нижче сполуками: [4,5'-бітіазол]-2-ацетонітрил, 2'-аміно-4'-метил (зареєстрована за номером: 299171-15-6); 2'-аміно-4'-метил-(фенілгідразоно)-[4,5'бітіазол]-2-ацетонітрил, (зареєстрована за номером: 299171-18-9); 2'-аміно-[(4-хлорфеніл)гідразоно]-4'-метил[4,5'-бітіазол]-2-ацетонітрил (зареєстрована за номером: 299171-19-0); або етиловий складний ефір 2'-аміно-2-метил-[4,5'бітіазол]-4'-карбонової кислоти, (зареєстрована за номером: 94273-53-7). За додатковим варіантом здійснення цього винаходу запропоновано сполуки, що відповідають Формулі (Ia), вибрані з групи, яку складають: етил-2'-аміно-4'-метил-4,5'-бі-1,3-тіазол-2карбоксилат; та 31 4'-метил-2-(морфолін-4-ілкарбоніл)-4,5'-бі-1,3тіазол-2'-амін. За додатковим варіантом здійснення цього винаходу запропоновано сполуки, що відповідають Формулі (P3): 4 R H N N 3 R X N 2 R Cl S O (P3) , 4 де R , R та R відповідають визначенням, наведеним у описі. За додатковим варіантом здійснення цього винаходу, запропоновано сполуку, що відповідає Формулі (P3): 2'-(ацетиламіно)-4'-метил-4,5'-бі-1,3-тіазол-2карбонілхлорид. Похідні тіазолу, приклади яких наведено у цьому винаході, можуть бути одержані з легкодоступних вихідних матеріалів, застосовуючи описані нижче загальні способи на методики. Мається на увазі, що у випадках, коли вказано типові експериментальні умови або умови, яким віддається перевага (тобто температура проведення реакції, її тривалість, молярні кількості реагентів, розчинники тощо), інші умови експериментів також можуть бути застосовані, якщо не зазначено інше. Оптимальні умови проведення реакцій можуть варіювати залежно від застосовуваних конкретних реагентів або розчинників, але такі умови фахівець у галузі може визначити шляхом проведення звичайних процедур оптимізації. У разі застосування як фармацевтичні препарати, сполуки за цим винаходом, як правило, використовують у формі фармацевтичних композицій. Отже, фармацевтичні композиції, що містять сполуку Формули (I) та фармацевтично прийнятні носій, розчинник або наповнювач, також охоплюються цим винаходом. Фахівцю у галузі відома безліч таких носіїв, розріджувачів та наповнювачів, придатних для виготовлення фармацевтичних композицій. Сполукам за цим винаходом, спільно з прийнятними допоміжними речовинами, носіями, розріджувачами або наповнювачами, може бути надана форма фармацевтичних композицій та дозованих лікарських форм, які можуть бути як у твердій формі, наприклад, таблетки або заповнені капсули, так і у рідкій формі, наприклад, розчини, суспензії, емульсії, еліксири, або капсули, заповнені такими рідинами, усі для перорального застосування, або у формі стерильного розчину для ін’єкцій для парентерального (в тому числі підшкірного застосування). Такі фармацевтичні композиції та одиничні дозовані лікарські форми можуть містити інгредієнти у звичайних пропорціях, з додатковими активними сполуками або діючими речовинами чи без них, та такі одиничні дозовані лікарські форми можуть містити будь-яку придатну ефективну кількість активного інгредієнта, що відповідає діапазону призначених добових доз. Фармацевтичні композиції, що містять похідні тіазолу за цим винаходом, можуть бути одержані 2 3 96735 32 способом, добре відомим у фармацевтичній галузі, та містять щонайменше одну активну сполуку. Як правило, сполуки за цим винаходом застосовують у фармацевтично ефективній кількості. Фактична застосовувана кількість сполуки в типових випадках визначається лікарем-куратором з врахуванням релевантних обставин, в тому числі стану, що підлягає лікуванню, вибраного шляху введення, конкретної використовуваної сполуки, віку, маси, індивідуальної чутливості пацієнта та тяжкості симптомів у пацієнта тощо. Фармацевтичні композиції за цим винаходом можуть бути введені різноманітними шляхами, в тому числі пероральним, ректальним, черезшкірним, підшкірним, внутрішньовенним, внутрішньом’язовим та інтраназальним. Композиції для перорального введення можуть бути виготовлені у формі недозованих рідких розчинів або суспензій або недозованих порошків. Частіше, однак, композиції застосовують у одиничних дозованих формах для полегшення точності дозування. Термін “одиничні дозовані форми” означає фізично дискретні одиниці, придатні як одиничні дози для людей та інших ссавців, причому кожна одиниця містить заздалегідь визначену кількість активної речовини, розраховану на спричинення бажаного терапевтичного ефекту, у поєднанні з прийнятним фармацевтичним наповнювачем. До типових одиничних дозованих форм належать заповнені виміряною кількістю рідких композицій ампули або шприци або гранули, таблетки, капсули тощо у разі твердих композицій. У таких композиціях, похідна тіазолу, як правило, є неосновним компонентом (від приблизно 0,1% до приблизно 50% за масою або за варіантом, якому віддається перевага, від приблизно 1% до приблизно 40% за масою), решту становлять різноманітні наповнювачі або носій та технологічні допоміжні речовини, корисні для утворення бажаної дозованої форми. Рідкі форми, придатні для перорального введення, можуть містити придатні водні або неводні наповнювачі з буферами, супензаторами та диспергаторами, барвниками, ароматизаторами тощо. Тверді форми можуть містити, наприклад, будьякий з перелічених нижче інгредієнтів або сполук подібної природи: в’яжучі, наприклад, мікрокристалічну целюлозу, трагакантову камедь або желатин; наповнювач, наприклад, крохмаль або лактозу, розпушувальну речовину, наприклад, альгінову кислоту, примогель або кукурудзяний крохмаль; змащувальну речовину, стеарат магнію; ковзну речовину, наприклад, колоїдний діоксид кремнію; підсолоджучач, наприклад, сахарозу або сахарин; або ароматизатор, наприклад, перцеву м’яту, метилсаліцилат, або апельсиновий ароматизатор. Придатні для ін’єкцій композиції, як правило, мають за основу придатний для ін’єкцій стерильний сольовий розчин або сольовий розчин з фосфатним буфером, або інші придатні для ін’єкцій носії, відомі в галузі. Як зазначалось вище, похідні тіазолу Формули (I) у таких композиціях як правило, є неосновним компонентом, вміст якого часто лежить в діапазоні від 0,05% до 10% за масою, а решту становить придатний для ін’єкцій носій тощо. 33 Описані вище компоненти для перорального введення або придатні для ін’єкцій композиції є просто ілюстративними. Додаткові матеріали, а також методики виготовлення тощо наведені в Частині 5 довідника Remington’s Pharmaceutical th Sciences, 20 Edition, 2000, Marck Publishing Company, Easton, Pennsylvania, який включено до цього опису шляхом посилання. Сполуки за цим винаходом можуть також бути введені у формах пролонгованого вивільнення або за допомогою систем доставки лікарського засобу пролонгованого вивільнення. Опис типових речовин пролонгованого вивільнення можна знайти у матеріалах, включених у довідник Remington’s Pharmaceutical Sciences. Синтез сполук за винаходом Нові похідні тіазолу, які відповідають Формулі (I), можна одержати з легкодоступних вихідних матеріалів, використовуючи кілька принципів синтезу, із застосуванням методик синтезу як в розчинах, так і в твердій фазі. Нижче описано приклади схем синтезу згаданих сполук. У поданому нижче описі застосовано абревіатури, що мають такі значення: Å (Ангстрем), екв. (еквівалент), год (година), г (грам), M (молярний), МГц (мегагерц), мкл (мікролітр), хв (хвилина), мг (міліграм), мл (мілілітр), мм (міліметр), мілімоль (мілімоль), мM (мілімолярний), нм (нанометр), к.т. (кімнатна температура), BSA (бичачий сироватковий альбумін), CDI (N,N'карбонілдіімідазол), DCC (дициклогексилкарбодіімід), ДХМ (дихлорметан), DIEA (діізопропілетиламін), DMEM (модифіковане за Дюльбекко середовище Ігла), DMF (диметилформамід), EDC (1-(3диметиламінопропіл)-3-етилкарбодіімід, гідрохлорид), РХВЕ (рідинна хроматографія високої ефективності), HOBt (1-гідроксибензотриазол), IHC (імуногістохімія), Ins1P (D-міоінозит-1-фосфат), РХ (рідинна хроматографія), МС (мас-спектрометрія), NBS (N-бромсукцинімід), NIS (N-йодсукцинімід), ЯМР (ядерно-магнітний резонанс), PBS (сольовий розчин із фосфатним буфером), PIs (фосфоінозитиди), PI3K (фосфоінозитид-3-кінази), PI(3)P (фосфатидилінозит-4-фосфат), PI(3,4)P2 (фосфатидилінозит-3,4-дифосфат), PI(3,4,5)P3 (фосфатидилінозит-3,4,5-трифосфат), PI(4)P (фосфатидилінозит-4-фосфат), PI(4,5)P2) (фосфатидилінозит-4,5-дифосфат), PtdIns (фосфатидилінозит), TEA (триетиламін), TFA (трифтороцтова кислота), TFAA (трифтороцтовий ангідрид), THF (тетрагідрофуран), УФ (ультрафіолетовий). Похідні тіазолу, приклади яких наведено у цьому винаході, можуть бути одержані з легкодоступних вихідних матеріалів із застосуванням описаних нижче загальних способів та методик. Мається на увазі, що у випадках, коли вказано типові експериментальні умови або умови, яким віддається перевага (тобто температура проведення реакції, її тривалість, молярні кількості реагентів, розчинники тощо), можна застосовувати також інші експериментальні умови, якщо не вказано інакше. Оптимальні умови проведення реакцій можуть варіювати залежно від застосовуваних конкретних реагентів або розчинників, але такі умови фахівець у галузі може визначити шляхом проведення 96735 34 звичайних процедур оптимізації. У способі, ілюстрованому нижченаведеними 1 2 3 4 5 6 7 8 9 10 схемами, R , R , R , R , R , R , R , R , R , R та X відповідають наведеним вище визначенням. Як правило, похідні тіазолу, які відповідають Формулі (I), можна одержати, використовуючи кілька принципів синтезу, із застосуванням методик синтезу як в розчинах, так і в твердій фазі (Kodomari et al., 2002; Pirrung et al., 2001, згадані вище), як звичайними способами, так і з застосуванням мікрохвильової обробки. Фармацевтично прийнятні солі сполук за цим винаходом легко одержати шляхом проведення реакції кислотних форм із прийнятною основою, як правило, у кількості 1 екв., розчиненою у додатковому розчиннику. До типових основ належать гідроксид натрію, метилат натрію, етилат натрію, гідрид натрію, гідроксид калію, метилат калію, гідроксид магнію, гідроксид кальцію, бензатин, холін, діетаноламін, етилендіамін, меглумін, бенетамін, діетиламін, піперазин та трометамін. Сіль виділяють концентруванням досуха або шляхом додання осаджувача. У деяких випадках, солі можуть бути одержані шляхом змішування розчину кислоти з розчином катіону (етилгексаноат натрію, олеат магнію), застосування розчинника, в якому бажана катіонна сіль осаджується, або навпаки, можуть бути виділені шляхом концентрування та додавання осаджувача. Способи одержання проміжних продуктів сполуки Формули (I) 1 2 3 4 5 6 7 Залежно від природи R , R , R , R , R , R , R , 8 9 10 R , R , R та X, для синтезу сполук Формули (I) можуть бути вибрані різні методики синтезу. Один із принципів синтезу (дивись нижче Схему 1) полягає у проведенні реакції між приблизно еквімолярними кількостями -бромкетону (P1) та алкілтіооксамату, наприклад, етилтіооксамату, або тіоаміду, наприклад, 2-ціанотіоацетаміду (P2), змішаними у розчиннику, причому перевага віддається полярному розчиннику, наприклад, спирту, з одержанням сполуки Формули (I). Температура проведення реакції залежить від природи реагентів (P1) та (P2) і може лежати у межах від -20C до температури кипіння (зі зворотним холодильником). Оптимальним є застосування основи для вловлювання виділеного HBr, наприклад, DIEA або TEA. 4 6 Якщо група R - група -C(O)R , яка відповідає наведеному вище визначенню, для одержання сполук Формули (I) також може бути застосований інший принцип синтезу, представлений нижче на Схемі 2. Він полягає у проведенні реакції між похідним аміну (P1a), та алкілтіооксаматом, наприклад, етилтіооксаматом, або тіоамідом, наприклад, 2-ціанотіоацетамідом (P2) з одержанням відповідного біс-тіазолу або оксазол-тіазолу Формули (Ia). 35 Потім може бути застосована функціоналізація 6 первинного аміну (Ia) групою -C(O)R , яка відповідає наведеному вище в описі визначенню, в умовах, відомих фахівцю у галузі, з одержанням сполук Формули (I). 6 Якщо група -C(O)R є ацилом, то до проміжного продукту (Ia) можна додавати відповідний ацилхлорид або ацилангідрид у присутності основи, наприклад, піридину, DIEA, TEA тощо. Можна додавати також відповідну карбонову кислоту у присутності активувального агента, наприклад, DCC, EDC тощо. 6 Форміл, тобто -C(O)R =-C(O)H, можна вводити шляхом нагрівання проміжного продукту (Ia) у мурашиній кислоті або у будь-якому алкілформіаті у присутності або за відсутності додаткового розчинника. Заміщена сечовина може бути одержана шля7 8 7 8 хом додання ізоціанату R R NC(O), де R та R відповідають наведеному вище визначенню, до проміжного продукту (Ia) у присутності основи, наприклад DIEA, TEA тощо. Шляхом послідовного додавання CDI та заміщеного первинного або вто7 8 риного аміну HNR R до проміжного продукту (Ia) 96735 36 можна також одержати сполуки Формули (I), де 6 7 8 7 8 C(O)R = -C(O)NR R , де R та R відповідають наведеному вище визначенню. 6 7 8 Сполуки Формули (I), де -C(O)R = -C(O)NR R , як визначено вище, можуть бути перетворені в альтернативні сполуки Формули (I), шляхом пере7 8 творення групи -NHC(O)NR R у альтернативну сечовину 7 8 -NHC(O)NR R , застосовуючи придатні способи взаємного перетворення, добре відомі фахівцям у галузі. 1 Залежно від природи R , сполуки Формули (I) можуть бути перетворені в альтернативні сполуки 1 Формули (I) шляхом модифікування групи R , яка відповідає наведеному вище визначенню. 1 1 5 Якщо R є складним ефіром (R = -C(O)R , де 5 R - алкоксигрупа -OAlk, наприклад, етоксигрупа), сполуки Формули (Ib) можуть бути перетворені в амід Форму5 9 10 ли (Ic), де R = -NR R , як визначено вище. Це перетворення може бути досягнуте в одну або дві 9 10 9 стадії, залежно від природи аміну HNR R , де R 10 та R відповідають наведеному вище визначенню (Схема 3, нижче). 37 Для амінів із низькою температурою кипіння, амід (Ic) може бути одержаний шляхом нагрівання в мікрохвильовому реакторі складного ефіру Фор9 10 мули (Ib) з аміном HNR R , використаним як роз9 10 чинник, де R та R відповідають наведеним вище визначенням. Амід (Ic) може бути, як правило, одержаний після витримування протягом 10-30 хв при 80C в мікрохвильовому реакторі. Альтернативна методика полягає в одержанні 5 відповідної карбонової кислоти (Id), де R = OH, у основних умовах, з подальшим утворенням амід9 10 ного зв’язку з аміном HNR R , як визначено вище. Для цієї другої стадії, можуть бути застостовані різні активувальні агенти, наприклад, DCC, EDC, HOBt тощо. Залежно від природи сполучального агента може бути потрібне додання основи, наприклад, TEA або DIEA. Розчинники можуть бути вибрані з-посеред ДХМ, DMF, MeCN або будь-яких розчинників, придатних для такого перетворення. Карбонова кислота (Id) може бути спочатку перетворена у відповідний хлорангідрид (P3), з використанням придатного реагента, наприклад, оксалілхлориду або тіонілхлориду. Шляхом проведення реакції одержаного хлорангідриду з аміном 9 10 HNR R , у присутності основи, наприклад, піридину, DIEA, TEA тощо можна одержати сполуки Фо 1 96735 38 1 5 9 10 рмули (Ic) де R = -C(O)R = -C(O)NR R , як визначено вище. 9 10 Аміни HNR R можуть надходити у продаж із разних джерел або їх можна синтезувати, як це буде докладно описано нижче у Прикладах, із застосованням умов реакцій, відомих фахівцям у галузі. 1 Спирт Формули (Ie) (R = CH2OH) може бути одержаний відновленням проміжного продукту (P3), шляхом додання гідриду, наприклад, тритрет-бутоксіалюмогідриду літію (tBuO)3AlHLi). Від5 повідний альдегід Формули (If), де R1 = C(O)R = C(O)H, може бути одержаний окиснюванням спирту (Ie), застосовуючи умови, відомі фахівцям у галузі, наприклад, окиснювання Сверна (Swern) або Десса Мартина (Dess Martin). 1 Залежно від природи R , для одержання сполуки Формули (I) можуть бути застосовані різні реагенти (P2). 1 5 5 Якщо R - група -C(O)R , де R - заміщена алкоксигрупа, наприклад, етоксигрупа, сполуки Формули (Ib) можуть бути одержані шляхом проведення реакції між приблизно еквімолярними кількостями -бромкетону (P1) та алкілтіооксамату, наприклад, етилтіооксамату (P2a) (дивись нижче Схему 4). Якщо R - заміщений C1-C6-алкіл, наприклад ціанометил, сполуки Формули (I) можуть бути одержані шляхом проведення реакції між приблизно еквімолярними кількостями -бромкетону (P1) та 1 алкілтіоаміду R C(S)NH2, (P2b), наприклад, 2ціанотіоацетаміду (дивись нижче Схему 5). Сполуки Формули (I) можуть бути перетворені у альтернативні сполуки Формули (I). Наприклад, 1 якщо R = CH2CN, сполуки Формули (Ig) можуть бути перетворені у похідні тетразолілметилу, наприклад, 2H-тетразол-5-іл-метил (Ih), із застосуванням умов, відомих фахівцям у цій галузі (дивись наведену нижче Схему 6). Наприклад, сполука Формули (I), де R - група -CH2-тетразоліл, тобто сполука Формули (Ih), може бути одержана шляхом проведення реакції сполуки (Ig) з азидом, наприклад, азидом натрію, у присутності Bu3SnCl (4 екв.) або TMSN3 у присутності каталітичної кількості Bu2SnO (Wittenberger et al., 1993, J. Org. Chem., 58, 4139). 1 39 96735 -бромкетон (P1) може бути одержаний шляхом -бромування кетону (P4) (дивись наведену нижче Схему 7). Можуть застосовуватись різноманітні бромувальні агенти, наприклад, Br2, факультативно в присутності HBr або NBS. 4 Залежно від природи R , вільна група NH може бути спочатку захищена перед проведенням бро 40 мування (дивись наведену нижче Схему 7). Потім групу захисту можна видалити, застосовуючи умови, відомі фахівцю в цій галузі, одержуючи проміжний продукт (P1). PG може бути будь-якою захисною групою, яка може бути легко видалена, наприклад, ацетильною групою. Якщо R - група -C(O)R , -бромкетон (P1c) може бути одержаний у дві стадії, із заміщеного 5-ацил-2амінотіазолу (P5) як показано нижче на Схемі 8. 4 6 Функціоналізацію первинної аміногрупи у спо6 луці (P5) групою -C(O)R , яка відповідає наведеному вище в описі визначенню, можна виконати спочатку, одержуючи сполуку (P4a). 6 Якщо група -C(O)R є ацилом, то до проміжного продукту (P5) можна додавати відповідний аци лхлорид або ацилангідрид у присутності основи, наприклад, піридину, DIEA, TEA тощо. Можна додавати також відповідну карбонову кислоту у присутності активувального агента, наприклад, DCC, EDC тощо. 6 Форміл, тобто -C(O)R = -C(O)H, можна вводи 41 96735 42 ти шляхом нагрівання проміжного продукту (P5) у мурашиній кислоті або у будь-якому алкілформіаті у присутності або за відсутності додаткового розчинника. Заміщена сечовина може бути одержана шля7 8 хом додання ізоціанату R R NC(O) до проміжного продукту (P5) у присутності основи, наприклад 7 8 DIEA, TEA тощо, де R та R відповідають наведеному вище визначенню. Шляхом послідовного додавання CDI та заміщеного первинного або втори7 8 ного аміну HNR R до проміжного продукту (P5) можна також одержати проміжний продукт (P4a), 6 7 8 де -C(O)R = -C(O)NR R , як визначено вище. Спо6 7 8 луки Формули (P4a), де -C(O)R = -C(O)NR R , можуть бути перетворені в альтернативні сполуки Формули (P4a) шляхом перетворення групи 7 8 -NHC(O)NR R у альтернативну сечовину 7 8 7 8 NHC(O)NR R , де R та R відповідають наведеному вище визначенню, із застосуванням придатних способів взаємного перетворення, добре відомих фахівцям у галузі. Після цієї першої стадії ацилування може бути виконане -бромування 5-ацильної групи для одержання проміжного продукту (P1c) (дивись вище Схему 8). Ці дві стадії можна виконувати у зворотній послідовності (дивись вище Схему 8). Спочатку можна виконати бромування проміжного продукту (P5), одержуючи проміжний продукт (P1a). Потім може бути одержаний проміжний продукт (P1c) шляхом 6 введення групи -C(O)R , яка відповідає наведеному вище в описі визначенню, із застосуванням умов реакцій, описаних вище. В обох варіантах синтезу можна застосовувати різноманітні бромувальні агенти, наприклад, Br2, факультативно в присутності HBr або NBS. Проміжні продукти Формул (P4) та (P5) або надходять у продаж із різних джерел, або ж їх можна синтезувати кількома методами, із застосуванням методик синтезу як в розчинах, так і в твердій фазі. Приклади способів синтезу проміжних сполук (P4) та (P5) подано нижче на Схемі 9. Заміщений дикетон (P6) можна галогенувати, використовуючи, наприклад, Br2 для бромування або тіонілхлорид для -хлорування, одержуючи проміжний продукт (P7). Символ "Hal" у формулі проміжного продукту (P7) може означати також тозилоксигрупу, яку можна ввести із застосуванням придатних реагентів, наприклад, гідрокси(тозилокси)йодбензолу. Потім проміжний продукт (P7) можна додати до розчину тіосечовини або сечовини у придатному розчиннику, за варіантом, якому віддається перевага, у полярному розчиннику, наприклад, EtOH, і одержати проміжний продукт (P5). Конкретні умови реакцій, температуру, тривалість тощо можна вибрати залежно від природи X 2 3 та замісників R та R , відповідно до літератури та детального опису у поданих нижче прикладах (Сейд та ін. - Sayed et al., 1999, Heteroatom Chemistry, 10, 385-390). Проміжний продукт (P4) можна безпосередньо одержати шляхом проведення реакції сполуки (P7) з придатною тіосечовиною або сечовиною (P8), 4 заміщеною групою -R , яка відповідає поданому вище визначенню. Тіосечовини або сечовини (P8) або є наявними на ринку, або їх можна одержати, застосовуючи умови реакцій, відомі фахівцям у галузі. Деякі умови описані нижче у прикладах або у Герр та ін. - Herr et al., 2000, Synthesis, 2000, 15691574 та Уїлсон та ін. - Wilson et al., 2001, J. Bioorg. Med. Chem. Lett., 11, 915-918. 3 Якщо R = H, то сполуку (P6a) одержують в одну стадію у формі натрієвої солі шляхом конденсації метилкетону з етилформіатом, як показано нижче на Схемі 10. Потім шляхом прямого бромування одержують проміжний продукт (P7a), відповідно до літератури та детального опису у поданих нижче прикладах. 43 За ще одним загальним способом, сполуки Формули (I) можна перетворювати в альтернативні сполуки Формули (I), застосовуючи придатні способи взаємного перетворення, добре відомі фахівцям у галузі. Якщо вищезазначена сукупність загальних способів синтезу є непридатною для одержання сполук Формули (I) та/або необхідних проміжних продуктів для синтезу сполук Формули (I), то слід застосовувати придатні способи підготовчих синтезів, відомі фахівцям у галузі. Як правило, способи синтезу будь-якої індивідуальної сполуки Формули (I) залежать від конкретних замісників у кожній молекулі та від доступності необхідних проміжних продуктів; такі фактори, знов-таки, можуть враховуватися пересічним фахівцем у галузі. Усі способи введення та відщеплення груп захисту описані у монографіях Косеньського "Групи захисту" (Philip J. Kocienski, in “Protecting Groups”, Georg Thieme Verlag Stuttgart, New York, 1994) та Гріні та Вутса "Групи захисту в органічному синтезі" (Theodora W. Greeneand Peter G.M. Wuts in “Protective Groups in Organic Synthesis”, Wiley rd Interscience, 3 Edition 1999). Сполуки за цим винаходом можна виділяти в поєднанні з молекулами розчинника шляхом кристалізації після випарювання відповідного розчинника. Фармацевтично прийнятні солі сполук Формули (I), які містять основні центри, з кислотами можна одержати звичайним способом. Наприклад, розчин вільної основи можна обробити придатною кислотою, розчиненою або нерозведеною, і відділити утворену сіль або фільтруванням, або випарюванням у вакуумі розчинника, в якому проводили реакцію. Фармацевтично прийнятні солі з основами можна одержати аналогічним способом, шляхом оброблення розчину сполуки Формули (I) придатною основою. Обидва типи солей можна одержувати або перетворювати один в одного, застосовуючи іонообмінні смоли. Нижче цей винахід ілюстровано деякими прикладами, які не слід розглядати як такі, що обмежують обсяг винаходу. Використовують такі наявні на ринку вихідні сполуки: 5-ацетил-2-аміно-4-метилтіазол (Flrochem), 3хлор-2,4-пентандіон (Fluka), 2-амінопіразин (Aldrich), 3-амінопіразол (Aldrich), 2-гідрокси-5нітро-бензойна кислота (Aldrich), 3амінобензонітрил (Aldrich), 4-аміносаліцилова кислота (Aldrich), 3-нітробензойна кислота (Aldrich), 4нітробензойна кислота (Aldrich), етилтіооксамат (Aldrich), аліламін (Fluka), 2-ціанотіоацетамід (Aldrich), 2-метоксіетиламін (Fluka), тетрагідрофурфуриламін (Fluka), 2-диметиламіноетиламін 96735 44 (Fluka), морфолін (Fluka), 1-метилпіперазин (Fluka), N,N-диметил-1,3-пропандіамін (Fluka), етаноламін (Fluka), N-(2-ціаноетил)амін (Lancaster), 5-амінотетразол (Aldrich), 4амінобензойна кислота (Aldrich), 3-амінобензойна кислота (Emkachem), 5-(3-амінофеніл)тетразол (Avocado), бензиламін (Fluka), N-пропіламін (Fluka), гідрохлорид 4-(2H-тетразол-3-іл)аніліну (Asimex), 3-аміносаліцилова кислота (TCI-US), ніпекотинова кислота (Emkachem), ізоніпекотинова кислота (Fluka), 3-гідроксипіперидин (Fluka), 4(гідроксиметил)піперидин (Maybridge), 4піперидинетанол (Aldrich), 4-гідроксипіперидин (Fluka), 5-амінобензотриазол (Aldrich), 4-аміно-2фторбензойна кислота (Apollo), три-третбутоксіалюмогідрид літію (Aldrich), етил-2ізоціанатопропіонат (Aldrich), 1,4-діокса-8азаспіро[4.5]декан (Aldrich), 2,2-диметил-1,3діоксолан-4-метанамін (Aldrich), піперазин-2-он (Aldrich), моногідрат гідрохлориду 4-піперидону (Aldrich), 3-піролідинол (Fluka), пропаргіламін (Fluka), 1-ацетилпіперазин (Aldrich), ацетат гліциндиметиламіду (Chem-Impex), бета-аланін (Aldrich), 4-фторпіперидин (Flrochem), гідрохлорид третбутилового складного ефіру -аланіну (Bachem). (1S,5S,7S)-6,8-діокса-3-азабіцикло[3.2.1]окт-7ілметанол та (1R,5R,7R)-6,8-діокса-3азабіцикло[3.2.1]окт-7-ілметанол синтезують за опублікованою методикою (дивись Гуарна та ін. Guarna et al, 1999, J. Org. Chem., 64, 7347). Дані про РХВЕ, ЯМР та МС, подані у прикладах, описаних нижче, одержано при таких умовах: РХВЕ: методика A: колонка Waters Symmetry C8 504,6 мм, умови: MeCN 0,05% TFA/H2O 0,1% TFA, 5-100% (8 хв), максимальна висота піків на довжинах хвиль 230-400 нм; методика B: колонка C18 BDS 2504,6 мм, SC\243, умови: MeCN/H2O 0,1%TFA, 5-100% (15 хв), максимальна висота піків на довжинах хвиль 230-400 нм; мас-спектри: прилад PE-SCIEX API 150 EX (позитивна хімічна іонізація - APCI та іонізація електронним ударом ESI), рідинна хроматографія з мас-спектроскопією 1 (РХ/МС); H-ЯМР: прилад Bruker DPX-300MHz. Очищення методом препаративної РХВЕ виконується на системі РХВЕ Waters Prep LC 4000, ® обладнаній колонками Prep Nova-Pak HR, C18, розмір зерен сорбенту 6 мкм, діаметр пор 60Å, розміри колонки 4030 мм (кількість речовини до ® 100 мг) або XTerra Prep MS C8, 10 мкм, 50300 мм (до 1 г). Усі операції очищення виконуються при елююванні градієнтом MeCN/H2O з домішкою 0,09% TFA. Напівпрепаративне очищення РХВЕ з оберненою фазою виконуються із застосуванням системи Biotage Parallex Flex, обладнаної колон 45 TM ками Supelcosil ABZ+Plus (25 см21,2 мм, 12 мм); УФ детектування на довжинах хвиль 254 нм та 220 нм; об’ємна швидкість потоку 20 мл/хв (до 50 мг). Аналіз методом ТШХ виконується на пластинах Merck Precoated 60 F254. Очищення флеш-хроматографією виконується на носії SiO2 із застосуванням для елюювання сумішей циклогексан/EtOAc або ДХM/MeOH. Реакції при мікрохвильовому опроміненні проводять в однорежимному мікрохвильовому реакTM торі Emrys Optimiser фірми Personal Chemistry. Проміжний продукт 1: Одержання гідроброміду N-[5-(бромацетил)-4-метил-1,3-тіазол-22 3 іл]ацетаміду (Проміжний продукт (P1), де R - H, R 6 та R - метил та X - S) O N N H S Br HBr O Проміжний продукт 1 Стадія I: N-(5-ацетил-4-метил-1,3-тіазол-22 3 іл)ацетамід (Проміжний продукт (P6), де R - H, R 4 та R - метил та X - S) 5-ацетил-2-аміно-4-метилтіазол (P5) (Flrochem) (12,4 г, 79 ммоль) суспендують у суміші 3:2 THF/ДХM (150 мл). Цю суміш охолоджують до 0°C, та додають піридин (16 мл), після чого краплями додають ацетилхлорид (8,43 мл, 119 ммоль, 1,5 екв.). Цю суміш перемішують 2 год при 0°C. Після завершення ацетилювання реакційну суміш гасять доданням води (70 мл) і розводять EtOAc (100 мл). Одержані дві фази розділяють, і органічну фазу промивають один раз 10% розчином лимонної кислоти. Органічний шар сушать над MgSO4, фільтрують та випарюють. Одержану неочищену масу очищають кристалізацією із суміші EtOAc/циклогексан, і одержують N-(5-ацетил-4метил-1,3-тіазол-2-іл)ацетамід (P6) у вигляді без1 барвного порошку (13,1 г, вихід 83,6%). H ЯМР (DMSO-d6) : 2,17 (s, 3H), 2,47 (s, 3H), 2,56 (s, 3H), + 12,44 (br s, 1H). M (ESI): 197,3; M (ESI): 199,3. РХВЕ (методика A), Rt: 1,7 хв (чистота: 99,7%). Стадія II: N-[5-(бромацетил)-4-метил-1,3тіазол-2-іл]ацетамід, гідробромід. (Проміжний продукт 1) Розчин Br2 (3,35 мл, 65,6 ммоль) у 75 мл діоксану додають краплями до розчину N-(5-ацетил-4метил-1,3-тіазол-2-іл)ацетаміду (P6), одержаного на Стадії I, як описано вище (10,40 г, 52,5 ммоль), у 200 мл діоксану. Одержану суміш нагрівають при 50°C протягом 19 год. Розчин змінює колір із темно-червоного на бежевий, а суміш залишається гетерогенною. Аналіз методом РХВЕ виявляє наявність лише 2,8% вихідного матеріалу. Одержану суспензію фільтрують, промивають сумішшю EtOAc/гексан (1:2, 50 мл) та піддають повітряному сушінню протягом 15 хв, і одержують Проміжний продукт 1 у вигляді бежевої твердої речовини (11,2 г, 60%). Після обробки протягом 5 хв смолою Amberlyst A21 у суміші ДХМ/MeOH її використовують у синтезі біс-тіазолу у формі гідроброміду або вихідної сполуки. 96735 46 H ЯМР (DMSO-d6) : 2,04 (s, 3H), 2,44 (s, 3H), + 4,52 (s, 2H), 12,44 (br s, 1H). M (ESI): 276; M (ESI): 278. РХВЕ (методика A), Rt: 2,2 хв (чистота: 97,4%). Проміжний продукт 2: Одержання гідроброміду 1-(2-аміно-4-метил-1,3-тіазол-5-іл)-2-брометанону 2 3 (Проміжний продукт (P1a), де R - H, R - метил та X - S). 1 N + H3 N S Br O Br Проміжний продукт 2 5-ацетил-2-аміно-4-метилтіазол (P5) (Flrochem) (1,0 г, 6,4 ммоль) суспендують у 48% розчині HBr у воді (20 мл, 6,4 ммоль). Цю суміш нагрівають до 60°C, і додають краплями розчин Br2 (0,262 мл, 5,12 ммоль, 0,8 екв.) у діоксані (20 мл). Цю суміш перемішують при 60°C протягом 3 год. Хід реакції контролюють за допомогою РХ/МС. Після її завершення розчинники випарюють, а воду видаляють шляхом азеотропного дистилювання з толуолом. Одержану тверду речовину перекристалізовують із суміші ізопропанол/Et2O, одержуючи проміжний продукт 2 у вигляді безбарвної твердої речовини (890 мг, вихід 74%). Після обробки протягом 5 хв смолою Amberlyst A21 у суміші ДХМ/MeOH її використовують у синтезі бістіазолу у формі гідроброміду або вихідної сполуки. 1 H ЯМР (DMSO-d6) : 2,46 (s, 3H), 4,50 (s, 3H), 6,90 (br s, 1H), 9,18 (br s, 2H). M (ESI): 234,1; + M (ESI): 236,1. Проміжний продукт 3: Одержання гідроброміду 2-бром-1-[4-метил-2-(піразин-2-іламіно)-1,3-тіазол4 5-іл]етанону (Проміжний продукт (P1), де R - 22 3 піразиніл, R - H, R - метил та X - S). H N N S N Br O N HBr Проміжний продукт 3 Стадія I: Одержання N-піразин-2-ілтіосечовини До розчину тіоціанату амонію (17,8 г, 0,234 моль) у безводному ацетоні (200 мл) при 0C у атмосфері азоту повільно додають бензоїлхлорид (30 г, 0,213 моль) протягом 15 хв. Одержану реакційну суміш перемішують при кімнатній температурі протягом 30 хв та фільтрують. До одержаного фільтрату додають краплями 2амінопіразин (16,2 г, 0,17 моль) та перемішують протягом 3 год при кімнатній температурі. Розчинник видаляють у вакуумі, а залишок розводять у воді. Твердий осад відфільтровують та сушать, одержуючи N-[(піразин-2іламіно)карбонотіоїл]бензамід у вигляді твердої речовини (33 г; 76%). ХТШ: хлороформ/метанол (9/1): Rf - 0,5. Розчин N-[(піразин-2іламіно)карбонотіоїл]бензаміду (25 г, 0,096 моль) у 10% розчині NaOH (200 мл) перемішують при 80°C протягом 20 хв. Одержану реакційну суміш охолоджують, а розчинник видаляють у вакуумі. Утворе 47 ний залишок підкислюють 2M розчином HCl до pH=1, а потім підлуговують гідроксидом амонію. Одержаний твердий осад збирають шляхом фільтрування та сушать відсмоктуванням, одержуючи N-піразин-2-ілтіосечовину у вигляді твердої речо1 вини (12 г; 80%). H ЯМР (DMSO-d6, 300 МГц): 8,24 (br s, 2H), 8,54 (s, 1H), 9,10 (m, 1H), 9,95 (m, + 1H), 10,66 (br s, 1H). M (ESI): 154,9. РХВЕ (методика B), Rt: 3,47 хв (чистота: 98,23%). TLC: хлороформ/метанол (9/1): Rf - 0,25. Т.пл.: 234-235°C. Стадія II: Одержання гідрохлориду 1-[4-метил2-(піразин-2-іламіно)-1,3-тіазол-5-іл]етанону До розчину N-піразин-2-ілтіосечовини (5 г, 0,032 моль) у абсолютному етанолі (50 мл) додають 3-хлор-2,4-пентандіон (4,4 г, 0,032 моль). Одержану суміш нагрівають зі зворотним холодильником протягом 20 год у атмосфері азоту. Реакційну суміш охолоджують до кімнатної температури, а утворений осад відфільтровують, промивають етанолом (25 мл) та сушать відсмоктуванням, одержуючи гідрохлорид 1-[4-метил-2(піразин-2-іламіно)-1,3-тіазол-5-іл]етанону у вигляді злегка забарвленої твердої речовини (7 г; 92%). 1 H ЯМР (DMSO-d6, 300 МГц): 2,47 (s, 3H), 2,57 (s, 3H), 8,21 (s, 1H), 8,41 (s, 1H), 8,48 (s, 1H), 12,2 (br + s, 1H). M (ESI): 234,9. РХВЕ (методика B), Rt: 1,56 хв (чистота: 97,75%). ХТШ: хлороформ/метанол (9/1): Rf - 0,25. Т.пл.: 224-229°C. Стадія III: Одержання N-(5-ацетил-4-метил1,3-тіазол-2-іл)-N-піразин-2-ілацетаміду У пробірці гідрохлорид 1-[4-метил-2-(піразин-2іламіно)-1,3-тіазол-5-іл]етанону (500 мг; 1,85 ммоль; 1 екв.) змішують з оцтовим ангідридом (2,16 мл; 22,90 ммоль; 12,40 екв.). Пробірку закривають та нагрівають при 150°C на масляній бані. Через 15 хв одержана суміш стає жовтою. Реакція протікає до завершення. Розчинники видаляють, а N-(5-ацетил-4-метил-1,3-тіазол-2-іл)-N-піразин-2ілацетамід використовують без додаткового очищення (510,3 мг; кількісний вихід). Стадія IV: гідробромід 2-бром-1-[4-метил-2(піразин-2-іламіно)-1,3-тіазол-5-іл]етанону (Проміжний продукт 3) N-(5-ацетил-4-метил-1,3-тіазол-2-іл)-Nпіразин-2-ілацетамід (511,2 мг; 1,85 ммоль; 1 екв.) розчиняють у AcOH (10 мл). Додають бромистоводневу кислоту (32 мкл; 0,19 ммоль; 0,10 екв.), а потім розчин брому (95 мкл; 1,85 ммоль; 1 екв.) у AcOH (2 мл). Цю суміш перемішують 3 год при кімнатній температурі та 2 год при 60°C. Для завершення реакції додають бром (95 мкл; 1,85 ммоль; 1 екв.) у AcOH (2 мл), та одержану суміш перемішують 4 год при 60°C. Розчинники випарюють, а одержану темно-коричневу тверду речовину суспендують у THF, фільтрують та промивають циклогексаном, одержуючи проміжний продукт 3 у вигляді жовтої твердої речовини (467,7 мг; 64%). Після обробки протягом 5 хв смолою Amberlyst A21 у суміші ДХМ/MeOH її використовують у синтезі біс-тіазолу у формі гідроброміду або вихідної 1 сполуки. H ЯМР (DMSO-d6, 300 МГц) 2,60 (s, 3H), 4,64 (s, 2H), 8,24 (d, J=2,6 Гц, 1H), 8,43 (dd, J=1,5 Гц, J=2,6 Гц, 1H), 8,50 (d, J=1,5 Гц, 1H). + M (ESI): 312,9. РХВЕ (методика A), Rt: 2,80 хв (чистота: 97%). 96735 48 Проміжний продукт 4: Одержання гідроброміду 1-{2-[(1-ацетил-1H-піразол-3-іл)аміно]-4-метил-1,3тіазол-5-іл}-2-брометанону (Проміжний продукт 4 2 3 (P1), де R - 1-ацетил-1H-піразол-3-іл, R - H, R метил та X - S) H N N S N N Br O HBr O Проміжний продукт 4 Стадія I: Одержання N-1H-піразол-3ілтіосечовини До розчину тіоціанату амонію (17,8 г, 0,234 моль) у безводному ацетоні (200 мл) при 0°C у атмосфері азоту додають бензоїлхлорид (30 г, 0,213 моль) протягом 15 хв. Одержану реакційну суміш перемішують при кімнатній температурі протягом 30 хв та фільтрують. До одержаного фільтрату краплями додають 3-амінопіразол (14,1 г, 0,17 моль) та перемішують 3 год при кімнатній температурі. Розчинники видаляють у вакуумі, а одержаний залишок очищають флешхроматографією, використовуючи суміш хлороформ/метанол (9/1) як елюент. N-[(1H-піразол-3іламіно)карбонотіоїл]бензамід виділяють у вигляді + твердої речовини (22 г; 52%). M (ESI): 246,9. ХТШ: хлороформ/метанол (9/1): Rf - 0,45. Розчин N-[(1H-піразол-3іламіно)карбонотіоїл]бензаміду (22 г, 0,089 моль) у 10% розчині NaOH (200 мл) перемішують при 80°C протягом 45 хв. Одержану реакційну суміш охолоджують до кімнатної температури, та розчинники видаляють у вакуумі. Одержаний залишок підкислюють 2M розчином HCl до pH=1, а потім підлуговують гідроксидом амонію. Одержаний продукт екстрагують дихлорметаном (4100 мл). Об’єднані екстракти сушать та випарюють. Твердий залишок очищають флеш-хроматографією, використовуючи суміш хлороформ/метанол (9/1) як елюент. N-1Hпіразол-3-ілтіосечовину виділяють у вигляді твер1 дої речовини (9 г; 75%). H ЯМР (DMSO-d6, 300 МГц): 5,88 (br s, 1H), 7,64 (s, 1H), 8,44 (br s, 1H), 9,02 (br s, 1H), 10,30 (br s, 1H), 12,47 (br s, 1H). РХВЕ (методика B), Rt: 3,88 хв (чистота: 99,4%). ХТШ: хлороформ/метанол (9/1): Rf - 0,2. Т.пл.: 130132°C. Стадія II: Одержання 1-[4-метил-2-(1H-піразол3-іламіно)-1,3-тіазол-5-іл]етанону До розчину N-1H-піразол-3-ілтіосечовини (5 г, 0,0352 моль) у абсолютному етанолі (50 мл) додають 3-хлор-2,4-пентандіон (4,78 г, 0,0352 моль), та одержану суміш нагрівають зі зворотним холодильником протягом 20 год у атмосфері азоту. Реакційну суміш охолоджують до кімнатної температури, а утворений осад відфільтровують, промивають етанолом (25 мл) та сушать із відсмоктуванням, одержуючи бажаний продукт у вигляді гідрохлориду. Його нейтралізують 10% розчином бікарбонату натрію, фільтрують та сушать, одержуючи 1-[4-метил-2-(1H-піразол-3-іламіно)-1,3тіазол-5-іл]етанон у вигляді блідо-коричневої тве 49 рдої речовини (5 г, 64%). 96735 1 H ЯМР (CD3OD, 300 МГц): 2,49 (s, 3H), 2,61 (s, 3H), 6,14 (br s, 1H), 7,62 (br s, 1H). РХВЕ (методика B), Rt: 4,31 хв (чистота: 98,07%). ХТШ: хлороформ/метанол (8/2): Rf= 0,4. Т.пл.: 224-227°C. Стадія III: N-(5-ацетил-4-метил-1,3-тіазол-2-іл)N-(1-ацетил-1H-піразол-3-іл)ацетамід У пробірці 1-[4-метил-2-(1H-піразол-3-іламіно)1,3-тіазол-5-іл]етанон (500 мг; 2,25 ммоль; 1 екв.) змішують з оцтовим ангідридом (2,64 мл; 27,89 ммоль; 12,40 екв.). Пробірку закривають та нагрівають при 150°C на масляній бані. Через 10 хв реакція завершується. Розчинники випарюють, одержуючи N-(5-ацетил-4-метил-1,3-тіазол-2іл)-N-(1-ацетил-1H-піразол-3-іл)ацетамід, який використовують на наступній стадії без додаткового очищення (689,1 мг; кількісний вихід). Стадія IV: гідробромід 1-{2-[(1-ацетил-1Hпіразол-3-іл)аміно]-4-метил-1,3-тіазол-5-іл}-2брометанону (Проміжний продукт 4) N-(5-ацетил-4-метил-1,3-тіазол-2-іл)-N-(1ацетил-1H-піразол-3-іл)ацетамід (689,3 мг; 2,25 ммоль; 1 екв.) розчиняють у AcOH (10 мл) та бромистоводневій кислоті (39 мкл; 0,22 ммоль; 0,10 екв.). Додають краплями розчин брому (115 мкл; 2,25 ммоль; 1 екв.) у AcOH (2 мл). Одержану реакційну суміш перемішують 3 год при кімнатній температурі та 2 год при 60°C. Для завершення реакції додають розчин брому (58 мкл; 1,12 ммоль; 0,50 екв.) у AcOH (2 мл), та одержану суміш перемішують 4 год при 60°C. Її охолоджують до кімнатної температури, а утворений осад відфільтровують, промивають циклогексаном та сушать під зниженим тиском, одержуючи проміжний продукт 4 (695,7 мг; 73%). Після обробки протягом 5 хв смолою Amberlyst A21 у суміші ДХМ/MeOH її використовують у синтезі біс-тіазолу у формі гід1 роброміду або вихідної сполуки. H ЯМР (DMSOd6, 300 МГц) 2,57 (s, 3H), 2,64 (s, 3H), 4,63 (s, 2H), 6,36 (d, J=6 Гц, 1H), 8,35 (d, J=6 Гц, 1H). M (ESI): + 342,96; M (ESI): 344,94. РХВЕ (методика A), Rt: 3,08 хв (чистота: 91,91%). Проміжний продукт 5: Одержання (2-аміно-4метил-[4,5]бістіазоліл-2-іл)ацетонітрилу N H2 N S N S N Проміжний продукт 5 До розчину гідроброміду 1-(2-аміно-4-метил1,3-тіазол-5-іл)-2-бром-етанону - Проміжного продукту 2 (5340 мг; 16,9 ммоль; 1 екв.) у етанолі (150 мл), додають 2-ціанотіоацетамід (1692,2 мг; 16,9 ммоль; 1 екв.). Одержану реакційну суміш перемішують при кімнатній температурі протягом 20 год. Утворений осад відфільтровують, одержуючи Проміжний продукт 5 у вигляді оранжевої твердої речовини (4400 мг; кількісний вихід). Його використовують на наступній стадії без додаткового очищення. 1 H ЯМР (DMSO-d6, 300 МГц) 2,40 (s, 3H), 4,61 (s, 2H), 7,83 (s, 1H), 9,05 (s, 2H), M (ESI): 235,13; + M (ESI): 237,06. РХВЕ (методика A), Rt: 1,30 хв 50 (чистота: 97,79%). Проміжний продукт 6: Одержання N-[2(ціанометил)-4'-метил-4,5'-бі-1,3-тіазол-2'-іл]-1Hімідазол-1-карбоксаміду H N N N N S N O S N Проміжний продукт 6 У колбі місткістю 250 мл у атмосфері Ar триетиламін (0,65 мл; 4,69 ммоль; 1,49 екв.) додають при перемішуванні до суспензії Проміжного продукту 5 (1000 мг; 3,15 ммоль; 1 екв.) та CDI (1372 мг; 8,46 ммоль; 2,68 екв.) у безводному ДХМ (65 мл). Для сприяння розчиненню додають DMF (4 мл). Одержану суміш перемішують при 45°C протягом ночі. Відсутність вихідного матеріалу визначають за допомогою РХВЕ. Одержану реакційну суміш охолоджують до кімнатної температури. Утворений осад виділяють шляхом фільтрування, промивають діетиловим ефіром та сушать у вакуумі, одержуючи Проміжний продукт 6 (822,8 мг; 79%). Його використовують на наступній стадії без додаткового очищення. Проміжний продукт 7: Одержання N-[4'-метил2-(морфолін-4-ілкарбоніл)-4,5'-бі-1,3-тіазол-2'-іл]1H-імідазол-1-карбоксаміду H N N N S N O N O S N O Проміжний продукт 7 Стадія I: етил-2'-аміно-4'-метил-4,5'-бі-1,3тіазол-2-карбоксилат У склянці для мікрохвильової обробки місткістю 20 мл Проміжний продукт 2 (400 мг; 1,27 ммоль; 1 екв.) суспендують у EtOH (7 мл). Додають етилтіооксамат (168,6 мг; 1,27 ммоль; 1 екв.), та одержану суміш нагрівають мікрохвильовим опроміненням при 120°C протягом 15 хв. Реакційну суміш фільтрують, і одержують гідробромід вказаної в заголовку сполуки (201 мг; 45%). Цю сполуку суспендують у суміші 2:1 ДХМ/EtOH (9 мл), та додають смолу Amberlyst A-21 (200 мг; 4,54 ммоль; 3,58 екв.). Після струшування протягом 2 год 30 хв при кімнатній температурі одержану суміш фільтрують, а смолу ополіскують ДХМ та EtOH, одержуючи етил-2'-аміно-4'-метил-4,5'-бі1,3-тіазол-2-карбоксилат, який використовують на наступній стадії без додаткового очищення (146,2 мг; 43%). 1 H ЯМР (DMSO-d6, 300 МГц) 1,30 (t, J=9 Гц, 3H), 2,32 (s, 3H), 4,38 (q, J=9 Гц, 2H), 7,17 (br s, + 2H), 7,82 (s, 1H). M (ESI): 268,17; M (ESI): 270,16. РХВЕ (методика A), Rt: 1,83 хв (чистота: 99,31%). Стадія II: 4'-метил-2-(морфолін-4-ілкарбоніл)4,5'-бі-1,3-тіазол-2'-амін У склянці для мікрохвильової обробки місткістю 5-10 мл до етил-2'-аміно-4'-метил-4,5'-бі-1,3тіазол-2-карбоксилату, одержаного на Стадії I, як 51 описано вище (188 мг; 0,70 ммоль; 1 екв.), додають морфолін (6 мл). Одержаний розчин нагрівають мікрохвильовим опроміненням при 130°C протягом 60 хв. Морфолін видаляють під зниженим тиском, а неочищений продукт очищають препаративною РХВЕ, одержуючи 4'-метил-2-(морфолін-4ілкарбоніл)-4,5'-бі-1,3-тіазол-2'-амін у вигляді солі з TFA (171,7 мг; 58%). 1 H ЯМР (DMSO-d6, 300 МГц) 2,36 (s, 3H), 3,67 (m, 6H), 4,28 (m, 2H), 7,94 (s, 1H), 8,27 (br s, 2H). M + (ESI): 309,04; M (ESI): 311,09. РХВЕ (методика A), Rt: 1,54 хв (чистота: 99,57%). Стадія III: N-[4'-метил-2-(морфолін-4ілкарбоніл)-4,5'-бі-1,3-тіазол-2'-іл]-1H-імідазол-1карбоксамід (Проміжний продукт 7) У склянці місткістю 20 мл у атмосфері Ar додають при перемішуванні триетиламін (51 мкл; 0,37 ммоль; 1,10 екв.) до суспензії 4'-метил-2(морфолін-4-ілкарбоніл)-4,5'-бі-1,3-тіазол-2'-аміну, одержаного на Стадії II, як описано вище (142,4 мг; 0,34 ммоль; 1 екв.), та CDI (54,4 мг; 0,34 ммоль; 1 екв.) у безводному ДХМ (5 мл). Для сприяння розчиненню додають DMF (0,30 мл). Цю суміш перемішують при 45°C протягом ночі. Відсутність вихідного матеріалу визначають за допомогою РХВЕ. Одержану реакційну суміш охолоджують до кімнатної температури. Утворений осад виділяють шляхом фільтрування, промивають діетиловим ефіром та сушать у вакуумі, одержуючи Проміжний продукт 7 (107,1 мг; 79%). Його використовують на наступній стадії без додаткового очищення. Амін 1: Одержання 6-аміно-2,2-диметилбензо[1,3]діоксин-4-ону O O 96735 52 няють у AcOEt (250 мл) та MeOH (80 мл). У атмосфері аргону додають Pd/C 10% (2,8 г). Одержану реакційну суміш уміщують у атмосферу водню (10 бар = 1 МПа). Оскільки реакція екзотермічна, реактор охолоджують на льодяній бані. Через 30 хв відновлення завершується. Розчин фільтрують через целіт та концентрують. Одержану тверду речовину відфільтровують, промивають пентаном та сушать у вакуумі, одержуючи Амін 1 у 1 вигляді жовтої твердої речовини (58,2 г; 90%). H ЯМР (DMSO-d6, 300 МГц) 1,61 (s, 6H), 5,15 (br s, 2H), 6,80 (d, J=9 Гц, 1H), 6,88 (dd, J=9 Гц, J=3 Гц, + 1H), 7,01 (d, J=3 Гц, 1H). M (ESI): 194. РХВЕ (методика A), Rt: 1,93 хв (чистота: 99,52%). Амін 2: Одержання 5-(3-амінофеніл)-1,3,4тіадіазол-2-аміну N H2 N N S NH2 Амін 2 Тіосемікарбазид (455,7 мг; 5 ммоль; 1 екв.) та 3-амінобензонітрил (Aldrich) (590,7 мг; 5 ммоль; 1 екв.) нагрівають у TFA (2,50 мл) при 60C протягом 4 год. Одержана суміш стає густим жовтуватим розчином. Реакційну суміш виливають у крижану воду (15 мл) та нейтралізують насиченим водним розчином NaHCO3. Утворений осад відфільтровують, одержуючи 5-(3-амінофеніл)-1,3,4тіадіазол-2-амін, Амін 2, у вигляді злегка забарвленої твердої речовини (291 мг; 30%). Амін 3: Одержання 7-аміно-2,2-диметил-4H1,3-бензодіоксин-4-ону O O O O NH2 Амін 1 Стадія I: 6-[гідрокси(оксидо)аміно]-2,2диметил-4H-1,3-бензодіоксин-4-он 2-гідрокси-5-нітро-бензойну кислоту (Aldrich) суспендують у TFA (900 мл) та трифтороцтовому ангідриді (300 мл). Ацетон додають частинами протягом 15 хв (300 мл). Одержану суміш повільно нагрівають до 100°C протягом 45 хв. Розчинники випарюють, одержаний неочищений продукт розчиняють у AcOEt, промивають насиченим розчином NaHCO3 (250 мл) та розсолом та сушать над MgSO4. Після випарювання розчинників бажаний продукт кристалізують у суміші AcOEt/Et2O/гептан. Його відфільтровують, промивають гептаном та сушать у вакуумі, одержуючи 6[гідрокси(оксидо)аміно]-2,2-диметил-4H-1,3бензодіоксин-4-он у вигляді бежевої твердої речовини (152,2 г; 82%). РХВЕ (методика A), Rt: 2,94 хв (чистота: 99,86%). Стадія II: 6-аміно-2,2-диметил-4H-1,3бензодіоксин-4-он (6-аміно-2,2-диметил-4H-1,3бензодіоксин-4-он (Амін 1) У автоклаві 6-[гідрокси(оксидо)аміно]-2,2диметил-4H-1,3-бензодіоксин-4-он (75,0 г) розчи NH2 Амін 3 Стадія I: 4-{[(бензилокси)карбоніл]аміно}-2гідроксибензойна кислота До розчину натрій-п-аміносаліцилату (Aldrich) (100 г, 0,65 моль) у 10% водному розчині NaOH (1000 мл) додають 50% (мас.) розчин бензилхлорформіату (670 г, 1,96 моль у толуолі) при 0°C. Одержану суміш перемішують при кімнатній температурі протягом 48 год. За ходом реакції спостерігають за допомогою ЯМР. Одержану реакційну суміш охолоджують до 0°C та підкислюють 10% водним розчином HCl. Одержану тверду речовину відфільтровують, промивають холодною водою та сушать. Її додатково обробляють петролейним ефіром та відфільтровують, і одержують неочищену 4-{[(бензилокси)карбоніл]аміно}-2гідроксибензойну кислоту (128 г, 68%). Стадія II: 7-N-Cbz-аміно-2,2-диметил-4H-1,3бензодіоксин-4-он До суспензії 4-{[(бензилокси)карбоніл]аміно}-2гідроксибензойної кислоти (25 г, 0,087 моль) у TFA (108 мл) додають трифтороцтовий ангідрид (TFAA, 35 мл, 0,249 моль) при кімнатній температурі при 53 перемішуванні. Безводний ацетон (60 мл) додають частинами, на протязі 4 год, та одержану реакційну суміш нагрівають при 60C протягом 24 год. Надлишок TFA та TFAA видаляють у вакуумі, а одержаний неочищений продукт очищають флешхроматографією на силікагелі (оброблений триетиламіном), використовуючи CH2Cl2 як елюент. Виділяють два продукти, 7-N-Cbz-аміно-2,2диметил-4H-1,3-бензодіоксин-4-он (3,5 г) та 7аміно-2,2-диметил-4H-1,3-бензодіоксин-4-он (1,6 г). Стадія III: 7-аміно-2,2-диметил-4H-1,3бензодіоксин-4-он (Амін 3) У автоклаві додають Pd/C (350 мг) до розчину 7-N-Cbz-аміно-2,2-диметил-4H-1,3-бензодіоксин-4ону (3,5 г) у метанолі (250 мл). Одержану реакційну суміш уміщують у атмосферу водню (10 бар=1 МПа) та перемішують 24 год при кімнатній температурі. Реакційну суміш фільтрують через целіт та концентрують, одержуючи 7-аміно-2,2диметил-4H-1,3-бензодіоксин-4-он (1,6 г). Загаль1 ний вихід за ці три стадії становив 20%. H ЯМР (DMSO-d6, 300 МГц) 1,60 (s, 6H), 6,03 (d, J=2 Гц, 1H), 6,30 (dd, J=8 Гц, J=2 Гц, 1H), 6,36 (br s, 2H), + 7,45 (d, J=8 Гц, 1H). M (ESI): 192; M (ESI): 194. РХВЕ (методика A), Rt: 0,95 хв (чистота: 100%). Амін 4: Одержання 5-(3-амінофеніл)-1,3,4оксадіазол-2-олу N H2 N N O OH Амін 4 Стадія I: Метил-3-нітробензоат 3-нітробензойну кислоту (Aldrich) (1 г; 5,98 ммоль; 1 екв.) розчиняють у толуолі (15 мл). Додають краплями триметилсилілдіазометан у толуолі та MeOH (1/1) (9,0 мл; 2 M; 17,95 ммоль; 3 екв.). Розчин перемішують при кімнатній температурі протягом 1,5 год. Розчинники видаляють, одержуючи метил-3-нітробензоат у вигляді жовтого порошку (940,7 мг; 87%). 1 H ЯМР (DMSO-d6) : 3,92 (s, 3H), 7,84 (m, 1H), 8,35 (m, 1H), 8,50 (m, 1H), 8,62 (m, 1H). РХВЕ (методика A), Rt: 1,8 хв (чистота: 99,1%). Стадія II: 3-нітробензогідразид Метил-3-нітробензоат (940,7 мг; 5,19 ммоль; 1 екв.) розчиняють у EtOH (24 мл). Додають гідразингідрат (4,04 мл; 83,09 ммоль; 16 екв.), і одержану суміш перемішують 1 год при кімнатній температурі. Потім її перемішують при 60°C протягом 6 год та при кімнатній температурі протягом ночі. Утворений осад відфільтровують та сушать у вакуумі, одержуючи 3-нітробензогідразид у вигляді злегка забарвленої твердої речовини (815,9 мг; 87%). 1 H ЯМР (DMSO-d6) : 4,62 (s, 2H), 7,76 (m, 1H), 8,24 (m, 1H), 8,36 (m, 1H), 8,63 (s, 1H), 10,15 (s, 1H). Стадія III: 5-(3-нітрофеніл)-1,3,4-оксадіазол-2ол 1,1'-карбонілдіімідазол (641,2 мг; 3,95 ммоль; 1 екв.) додають до охолодженого до 0°C розчину 96735 54 3-нітробензогідразиду (715,9 мг; 3,95 ммоль; 1 екв.) та триетиламіну (822 мкл; 5,93 ммоль; 1,50 екв.) у DMF (30 мл). Одержану реакційну суміш перемішують в інтервалі температур від 0°C до кімнатної температури протягом 4 год. Розчинники видаляють у вакуумі, одержуючи оранжеве масло, яке розчиняють у ДХМ та промивають 0,1 M розчином HCl. Органічну фазу концентрують. Утворений осад відділяють шляхом фільтрування, одержуючи 5-(3-нітрофеніл)-1,3,4оксадіазол-2-ол у вигляді білої твердої речовини 1 (469,9 мг; 58%). H ЯМР (DMSO-d6) : 7,84 (s, 1H), 8,19 (m, 1H), 8,41 (m, 2H), 12,91 (s, 1H). РХВЕ (методика A), Rt: 2,06 хв (чистота: 97,5%). Стадія IV: 5-(3-амінофеніл)-1,3,4-оксадіазол-2ол (Амін 4) У колбі розчиняють 5-(3-нітрофеніл)-1,3,4оксадіазол-2-ол (369,9 мг; 1,79 ммоль; 1 екв.) у MeOH (20 мл) у інертній атмосфері. Додають 10% паладій на деревному вугіллі (190 мг; 0,18 ммоль; 0,10 екв.), та одержану реакційну суміш перемішують 5 хв при кімнатній температурі. Потім суміш уміщують у атмосферу водню під атмосферним тиском. Реакція протікає до завершення через 2 год. Одержану суміш фільтрують через целіт та ополіскують MeOH. Розчинники випарюють у вакуумі, одержуючи Амін 4 у вигляді білого порошку (283,3 мг; 90%). 1 H ЯМР (DMSO-d6) : 5,43 (s, 2H), 6,70 (m, 1H), 6,89 (m, 1H), 7,08 (s, 1H), 7,14 (m, 1H), 12,44 (s, 1H). Амін 5: Одержання 5-(4-амінофеніл)-1,3,4оксадіазол-2-олу H2 N N O N OH Амін 5 Стадія I: Метил 4-нітробензоат 4-нітробензойну кислоту (5 г; 29,92 ммоль; 1 екв.) розчиняють у толуолі (37,5 мл). Додають краплями триметилсилілдіазометан у толуолі та MeOH (1/1) (45 мл; 2 M; 89,76 ммоль; 3 екв.). Одержаний розчин перемішують при кімнатній температурі протягом 2 год. Розчинники видаляють, одержуючи метил-4-нітробензоат у вигляді жовтого порошку (5,42 г; 100%). 1 H ЯМР (DMSO-d6) : 3,90 (s, 3H), 8,19 (d, J=9 Гц, 2H), 8,34 (d, J=9 Гц, 2H). РХВЕ, (методика A), Rt: 2,66 хв (чистота: 98,7%). Стадія II: 4-нітробензогідразид Метил-4-нітробензоат (5,42 г; 29,92 ммоль; 1 екв.) розчиняють у EtOH (120 мл). Додають гідразингідрат (7,27 мл; 149,60 ммоль; 5 екв.), та одержану суміш перемішують 1 год при кімнатній температурі. Потім її перемішують при 60°C протягом 6 год та при кімнатній температурі протягом ночі. Утворений осад відфільтровують та сушать у вакуумі, одержуючи 4-нітробензогідразид у вигляді злегка забарвленої твердої речовини (4,31 г; 79%). 1 H ЯМР (DMSO-d6) : 4,63 (s, 2H), 8,03 (d, J=9 Гц, 2H), 8,23 (d, J=9 Гц, 2H), 10,12 (s, 1H). РХВЕ (методика A), Rt: 0,78 хв (чистота: 100,0%). 55 Стадія III: 5-(4-нітрофеніл)-1,3,4-оксадіазол-2ол 1,1'-карбонілдіімідазол (3,86 г; 23,81 ммоль; 1 екв.) додають до охолодженого до 0°C розчину 4-нітробензогідразиду (4,31 г; 23,81 ммоль; 1 екв.) та триетиламіну (4,95 мл; 35,71 ммоль; 1,50 екв.) у DMF (150 мл). Одержану реакційну суміш перемішують при температурі у діапазоні між 0°C та кімнатною температурою протягом 3,5 год. Розчинники видаляють у вакуумі, одержуючи оранжеве масло, яке розчиняють у ДХМ та промивають 0,1 M розчином HCl. Органічну фазу концентрують. Утворений осад відновлюють шляхом фільтрування, одержуючи 5-(4-нітрофеніл)-1,3,4оксадіазол-2-ол у вигляді білої твердої речовини (4,50 г; 91%). 1 H ЯМР (DMSO-d6) : 8,02 (d, J=9 Гц, 2H), 8,34 (d, J=9 Гц, 2H), 12,92 (s, 1H). M (ESI): 206,3. РХВЕ (методика A), Rt: 2,09 хв (чистота: 98,2%). Стадія IV: 5-(4-амінофеніл)-1,3,4-оксадіазол-2ол (Амін 5) У колбі розчиняють 5-(4-нітрофеніл)-1,3,4оксадіазол-2-ол (4,50 г; 21,72 ммоль; 1 екв.) у MeOH (150 мл) у інертній атмосфері. Додають 10% паладій на деревному вугіллі (2,31 г; 2,17 ммоль; 0,10 екв.), та одержану реакційну суміш перемішують 5 хв при кімнатній температурі. Потім суміш уміщують у атмосферу водню під атмосферним тиском. Реакція протікає до завершення через 2 год. Одержану суміш фільтрують через целіт та ополіскують MeOH. Розчинники випарюють у вакуумі, одержуючи 5-(4-амінофеніл)-1,3,4-оксадіазол1 2-ол у вигляді білого порошку (2,34 г; 61%). H ЯМР (DMSO-d6) : 5,84 (s, 2H), 6,62 (d, J=9 Гц, 1H), 7,62 (d, J=9 Гц, 1H), 12,15 (s, 1H). Амін 6: Одержання N,N-діізопропіл-бетааланінаміду O H2 N N Амін 6 3 Стадія I : N -(трет-бутоксикарбоніл)-N,Nдіізопропіл-бета-аланінамід До суміші діізопропіламіну (280 мкл; 1,99 ммоль; 1 екв.) та boc-бета-аланіну (414,7 мг; 2,19 ммоль; 1,10 екв.) у ДХМ (30 мл), додають триетиламін (829 мкл; 5,98 ммоль; 3 екв.) та йодид 2-хлор-1-метилпіридинію (1527 мг; 5,98 ммоль; 3 екв.). Цю суміш перемішують протягом 2 діб при кімнатній температурі. За ходом реакції спостерігають за допомогою ХТШ (циклогексан/EtOAc, 1:1). Одержану реакційну суміш потім промивають двічі насиченим розчином NH4Cl та двічі насиченим розчином NaHCO3. Органічні шари сушать над Na2SO4, фільтрують та концентрують, і одержують 760 мг оранжевого масла, яке очищають флешхроматографією (градієнт циклогексан/EtOAc, від 9/1 до 1/1 протягом 30 хв). Вказану в заголовку сполуку виділяють у вигляді жовтуватої твердої речовини (511,2 мг; 94%). 1 H ЯМР (DMSO-d6, 300 МГц) 1,16 (d, J=6 Гц, 6H), 1,35 (d, J=9 Гц, 6H), 1,40 (s, 9H), 2,44 (t, J=6 Гц, 2H), 3,37 (t, J=6 Гц, 2H), 3,47 (m, 1H), 3,89 96735 56 + (септет, J=6 Гц, 1H), 5,05 (br s, 1H). M (ESI): 273,33. Стадія II : N,N-діізопропіл-бета-аланінамід (Амін 6) 3 N -(трет-бутоксикарбоніл)-N,N-діізопропілбета-аланінамід, одержаний на Стадії I, як описано вище (100 мг; 0,37 ммоль; 1 екв.), розчиняють у ДХМ (3,20 мл). Додають трифтороцтову кислоту (0,80 мл) при кімнатній температурі. Реакція протікає до завершення через 20 хв (за ходом реакції спостерігають за допомогою ХТШ: циклогексан/етилацетат 1:1), та розчинники випарюють. Додають ДХМ (5 мл) та випарюють двічі, одержуючи Амін 6 у вигляді безбарвного масла (105 мг, кількісний вихід). 1 H ЯМР (DMSO-d6, 300 МГц) 1,21 (d, J=6 Гц, 6H), 1,34 (d, J=6 Гц, 6H), 2,75 (m, 2H), 3,32 (m, 2H), 3,53 (m, 1H), 3,87 (септет., 1H), 7,70 (br s, 3H). Амін 7: Одержання N-(2-гідрокси-1,1диметилетил)-бета-аланінаміду O H2 N N H OH Амін 7 3 Стадія I: N -(трет-бутоксикарбоніл)-N-(2гідрокси-1,1-диметилетил)-бета-аланінамід До суміші 2-аміно-2-метил-1-пропанолу (177,4 мг; 1,99 ммоль; 1 екв.) та boc-бета-аланіну (338,9 мг; 1,79 ммоль; 0,9 екв.) у ДХМ (30 мл) додають триетиламін (0,83 мл; 5,97 ммоль; 3 екв.) та йодид 2-хлор-1-метилпіридинію (1525 мг; 5,97 ммоль; 3 екв.). Цю суміш перемішують протягом 2 діб при кімнатній температурі. За ходом реакції спостерігають за допомогою ХТШ (циклогексан/EtOAc 1:1). Потім одержану реакційну суміш промивають двічі насиченим розчином NH4Cl та двічі насиченим розчином NaHCO3. Органічний шар сушать над Na2SO4, фільтрують та концентрують, і одержують 592 мг оранжевого масла, яке очищають флеш-хроматографією (градієнт циклогексан/EtOAc, від 9/1 до 1/1 протягом 30 хв). Вказану в заголовку сполуку виділяють у вигляді жовтуватої твердої речовини (331,1 мг; 64%). 1 H ЯМР (DMSO-d6, 300 МГц) 1,28 (s, 6H), 1,42 (s, 9H), 2,41 (m, 2H), 3,37 (m, 2H), 3,57 (s, 2H), 5,99 (br s, 1H). Стадія II : N-(2-гідрокси-1,1-диметилетил)бета-аланінамід (Амін 7) 3 N -(трет-бутоксикарбоніл)-N-(2-гідрокси-1,1диметилетил)-бета-аланінамід, одержаний на Стадії I, як описано вище (100 мг; 0,38 ммоль; 1 екв.), розчиняють у ДХМ (3,2 мл). Додають трифтороцтову кислоту (0,8 мл) при кімнатній температурі. Реакція протікає до завершення через 20 хв (ХТШ циклогексан/етилацетат, 1:1), та розчинники видаляють. Додають ДХМ (5 мл) та випарюють двічі, одержуючи Амін 7 у вигляді безбарвного масла (105 мг, кількісний вихід). Амін 8: Одержання N-(трет-бутил)-бетааланінаміду 57 O NH H2 N Амін 8 3 Стадія I : N -(трет-бутоксикарбоніл)-N-(третбутил)-бета-аланінамід До суміші трет-бутиламіну (210 мкл; 2 ммоль; 1 екв.) та boc-бета-аланіну (416,3 мг; 2,20 ммоль; 1,10 екв.) у ДХМ (30 мл) додають триетиламін (832 мкл; 6 ммоль; 3 екв.) та йодид 2-хлор-1метилпіридинію (1533 мг; 6 ммоль; 3 екв.). Цю суміш перемішують протягом ночі при кімнатній температурі. За ходом реакції спостерігають за допомогою ХТШ (циклогексан/EtOAc, 1:1). Потім одержану реакційну суміш промивають двічі насиченим розчином NH4Cl та двічі насиченим розчином NaHCO3. Органічний шар сушать над Na2SO4, фільтрують та концентрують, і одержують 639 мг оранжевого масла, яке очищають флешхроматографією (градієнт циклогексан/EtOAc, від 9/1 до 1/1 протягом 30 хв). Вказаний у заголовку продукт виділяють у вигляді жовтуватої твердої речовини (467,7 мг; 96%). 1 H ЯМР (DMSO-d6, 300 МГц) 1,32 (s, 9H), 1,41 (s, 9H), 2,30 (t, J=6 Гц, 2H), 3,35 (t, J=6 Гц, 2H), 5,13 + (br s, 1H), 5,44 (br s, 1H). M (ESI): 245,3. Стадія II : N-(трет-бутил)-бета-аланінамід (Амін 8) 3 N -(трет-бутоксикарбоніл)-N-(трет-бутил)-бетааланінамід, одержаний на Стадії I як описано вище (100 мг; 0,41 ммоль; 1 екв.), розчиняють у ДХМ (3,2 мл). Додають трифтороцтову кислоту (0,80 мл) при кімнатній температурі. Реакція протікає до завершення через 20 хв (ХТШ циклогексан/етилацетат, 1:1), та розчинники випарюють. Додають ДХМ та випарюють двічі, одержуючи Амін 8 у вигляді безбарвного масла (105 мг, кількісний вихід). Амін 9: Одержання 3-(2,2-диметил-1,3тіазолідин-3-іл)-3-оксопропан-1-амін O H2 N N S Амін 9 Стадія I: трет-бутил-[3-(2,2-диметил-1,3тіазолідин-3-іл)-3-оксопропіл]-карбамат До суміші 2,2-диметилтіазолідину (234,4 мг; 2 ммоль; 1 екв.) та boc-бета-аланіну (416,3 мг; 2,20 ммоль; 1,10 екв.) у ДХМ (30 мл) додають триетиламін (832 мкл; 6 ммоль; 3 екв.) та йодид 2хлор-1-метилпіридинію (1533 мг; 6 ммоль; 3 екв.). Цю суміш перемішують протягом 2 діб при кімнатній температурі. За ходом реакції спостерігають за допомогою ХТШ (циклогексан/EtOAc, 1:1). Потім одержану реакційну суміш промивають двічі насиченим розчином NH4Cl та двічі насиченим розчином NaHCO3. Органічний шар сушать над Na2SO4, фільтрують та концентрують, і одержують 497 мг оранжевого масла, яке очищають флешхроматографією (градієнт циклогексан/EtOAc, від 9/1 до 1/1 протягом 30 хв). Вказаний у заголовку 96735 58 продукт виділяють у вигляді злегка забарвленої твердої речовини (45,5 мг; 8%). 1 H ЯМР (DMSO-d6, 300 МГц) 1,42 (s, 9H), 1,81 (s, 6H), 2,45 (t, J=6 Гц, 2H), 2,97 (t, J=6 Гц, 2H), 3,38 + (m, 2H), 3,82 (t, J=6 Гц, 2H), 5,21 (br s, 1H). M (ESI): 289,2. Стадія II : 3-(2,2-диметил-1,3-тіазолідин-3-іл)3-оксопропан-1-амін (Амін 9) Трет-бутил-[3-(2,2-диметил-1,3-тіазолідин-3іл)-3-оксопропіл]карбамат, одержаний на Стадії I, як описано вище (43,3 мг; 0,15 ммоль; 1 екв.), розчиняють у ДХМ (1,60 мл). Додають при кімнатній температурі трифтороцтову кислоту (0,40 мл). Реакція протікає до завершення через 20 хв (ХТШ циклогексан/етилацетат), та розчинники випарюють. Додають ДХМ (5 мл) та випарюють двічі, одержуючи Амін 9 у вигляді безбарвного масла (45 мг, кількісний вихід). Амін 10: Одержання 3-(4,4-диметил-1,3оксазолідин-3-іл)-3-оксопропан-1-аміну O H2N N O Амін 10 Стадія I : трет-бутил-[3-(4,4-диметил-1,3оксазолідин-3-іл)-3-оксопропіл]карбамат До суміші 4,4-диметилоксазолідину (287 мкл; 2 ммоль; 1 екв.) та boc-бета-аланіну (416,3 мг; 2,2 ммоль; 1,10 екв.) у ДХМ (30 мл) додають триетиламін (832 мкл; 6 ммоль; 3 екв.) та йодид 2хлор-1-метилпіридинію (1533 мг; 6 ммоль; 3 екв.). Цю суміш перемішують протягом 2 діб при кімнатній температурі. За ходом реакції спостерігають за допомогою ХТШ (циклогексан/EtOAc, 1:1). Потім одержану реакційну суміш промивають двічі насиченим розчином NH4Cl та двічі насиченим розчином NaHCO3. Органічний шар сушать над Na2SO4, фільтрують та концентрують, і одержують 760 мг оранжевого масла, яке очищають флешхроматографією (градієнт циклогексан/EtOAc, від 9/1 до 1/1 протягом 30 хв). Вказаний у заголовку продукт виділяють у вигляді злегка забарвленої твердої речовини (420,5 мг; 77%). 1 H ЯМР (DMSO-d6, 300 МГц) 1,41 (s, 9H), 1,46 (s, 6H), 2,29 (t, J=6 Гц, 2H), 3,38 (t, J=6 Гц, 2H), 3,72 + (s, 2H), 4,90 (s, 2H), 5,17 (br s, 1H). M (ESI): 273,23. Стадія II : 3-(4,4-диметил-1,3-оксазолідин-3-іл)3-оксопропан-1-амін (Амін 10) Трет-бутил-[3-(4,4-диметил-1,3-оксазолідин-3іл)-3-оксопропіл]-карбамат, одержаний на Стадії I, як описано вище (100 мг; 0,37 ммоль; 1 екв.), розчиняють у ДХМ (3,20 мл). Додають трифтороцтову кислоту (0,80 мл) при кімнатній температурі. Реакція протікає до завершення через 20 хв (ХТШ циклогексан/етилацетат, 1:1), та розчинники випарюють. Додають ДХМ (5 мл) та випарюють двічі, одержуючи Амін 10 у вигляді безбарвного масла (105 мг, кількісний вихід). Амін 11 Одержання N-(2,2диметилпропіл)гліцинаміду O H2N N H 59 Амін 11 Стадія I : трет-бутил-{2-[(2,2диметилпропіл)аміно]-2-оксоетил}-карбамат До суміші неопентиламіну (174,3 мг; 2 ммоль; 1 екв.) та boc-гліцину (385,4 мг; 2,20 ммоль; 1,10 екв.) у ДХМ (30 мл) додають триетиламін (832 мкл; 6 ммоль; 3 екв.) та йодид 2-хлор-1метилпіридинію (1533 мг; 6 ммоль; 3 екв.). Цю суміш перемішують протягом ночі при кімнатній температурі. За ходом реакції спостерігають за допомогою ХТШ (циклогексан/EtOAc, 1:1). Потім одержану реакційну суміш промивають двічі насиченим розчином NH4Cl та двічі насиченим розчином NaHCO3. Органічний шар сушать над Na2SO4, фільтрують та концентрують, і одержують 946 мг оранжевого масла, яке очищають флешхроматографією (градієнт циклогексан/EtOAc, від 9/1 до 1/1 протягом 30 хв). Вказаний у заголовку продукт виділяють у вигляді жовтуватої твердої речовини (96,7 мг; 20%). 1 H ЯМР (DMSO-d6, 300 МГц) 0,89 (s, 9H), 1,44 (s, 9H), 3,06 (d, J=6 Гц, 2H), 3,76 (m, 2H), 5,11 (br s, + 1H), 6,22 (br s, 1H). M (ESI): 243,5; M (ESI): 245,3. Стадія II : N-(2,2-диметилпропіл)гліцинамід (Амін 11) Трет-бутил-{2-[(2,2-диметилпропіл)аміно]-2оксоетил}карбамат, одержаний на Стадії I, як описано вище (96,7 мг; 0,40 ммоль; 1 екв.), розчиняють у ДХМ (3,20 мл). Додають трифтороцтову кислоту (0,80 мл) при кімнатній температурі. Реакція протікає до завершення через 20 хв (ХТШ циклогексан/етилацетат, 1:1), і розчинники випарюють. Додають ДХМ та випарюють двічі, одержуючи Амін 11 у вигляді безбарвного масла (102,2 мг, кількісний вихід). Амін 12: Одержання 3-азокан-1-іл-3оксопропан-1-аміну O H2 N N Амін 12 Стадія I : трет-бутил-(3-азокан-1-іл-3оксопропіл)карбамат До суміші гептаметиленіміну (254 мкл; 2 ммоль; 1 екв.) та boc-бета-аланіну (416,3 мг; 2,20 ммоль; 1,10 екв.) у ДХМ (30 мл) додають триетиламін (832 мкл; 6 ммоль; 3 екв.) та йодид 2хлор-1-метилпіридинію (1533 мг; 6 ммоль; 3 екв.). Цю суміш перемішують протягом ночі при кімнатній температурі. За ходом реакції спостерігають за допомогою ХТШ (циклогексан/EtOAc, 1:1). Потім одержану реакційну суміш промивають двічі насиченим розчином NH4Cl та двічі насиченим розчином NaHCO3. Органічний шар сушать над Na2SO4, фільтрують та концентрують, і одержують 1,066 г оранжевого масла, яке очищають флешхроматографією (градієнт циклогексан/EtOAc, від 9/1 до 1/1 протягом 30 хв). Вказаний у заголовку продукт виділяють у вигляді жовтуватої твердої речовини (477 мг; 84%). 1 H ЯМР (DMSO-d6, 300 МГц) 1,40 (s, 9H), 1,53 (m, 6H), 1,70 (m, 4 год), 2,49 (t, J=6 Гц, 2H), 3,35 (t, J=6 Гц, 2H), 3,42 (квінтет, J=6 Гц, 4H), 5,32 (br s, + 1H). M (ESI): 285,4. 96735 60 Стадія II : 3-азокан-1-іл-3-оксопропан-1-амін (Амін 12) Трет-бутил-(3-азокан-1-іл-3оксопропіл)карбамат, одержаний на Стадії I, як описано вище (113,8 мг; 0,40 ммоль; 1 екв.), розчиняють у ДХМ (3,20 мл). Додають трифтороцтову кислоту (0,80 мл) при кімнатній температурі. Реакція протікає до завершення через 20 хв (ХТШ циклогексан/етилацетат), та розчинники випарюють. Додають ДХМ та випарюють двічі, одержуючи Амін 12 у вигляді безбарвного масла (119 мг, кількісний вихід). Амін 13: Одержання 2-(1-ізопропіл-1Hімідазол-4-іл)етанаміну N N H2N Амін 13 Стадія I: 7,8-дигідроімідазо[1,5-c]піримідин5(6H)-он: Суміш 2-(1H-імідазол-4-іл)етанаміну (26,8 г; 240,9 ммоль; 1 екв.) та CDI (39,1 г; 240,9 ммоль; 1 екв.) у DMF (401,7 мл) перемішують при 50°C протягом 2 діб. Одержану суміш концентрують до 100 мл, та додають ацетонітрил (200 мл). Утворений осад відфільтровують, промивають ацетонітрилом (250 мл) та сушать у вакуумі, одержуючи вказану в заголовку сполуку, яку використовують на наступній стадії без додаткового очищення (28,3 г; 85%). 1 H ЯМР (DMSO-d6, 300 МГц) 2,87 (m, 2H), 3,34 (m, 2H), 6,78 (d, J=1 Гц, 1H), 8,04 (d, J=1 Гц, 1H), 8,19 (br s, 1H). Стадія II: йодид 2-ізопропіл-5-оксо-5,6,7,8тетрагідроімідазо[1,5-c]піримідин-2-ію До суспензії 7,8-дигідроімідазо[1,5-c]піримідин5(6H)-ону, одержаного на Стадії I, як описано вище (28,18 г; 205,5 ммоль; 1 екв.), у DMF (140,9 мл) додають 2-йодпропан (61,5 мл; 616,4 ммоль; 3 екв.). Одержану реакційну суміш перемішують при кімнатній температурі до утворення червоної супензії. Цю реакційну суміш концентрують, та додають ацетонітрил (200 мл). Утворений осад відфільтровують, промивають ацетонітрилом (250 мл) та сушать у вакуумі, одержуючи вказану в заголовку сполуку, яку використовують на наступній стадії без додаткового очищення (45,95 г, 73%). 1 H ЯМР (DMSO-d6, 300 МГц) 1,49 (d, J=6,5 Гц, 6H), 3,02 (t, J=6,5 Гц, 2H), 3,48 (td, J=2,8 Гц, J=6,5 Гц, 2H), 4,72 (септет, J=6,5 Гц, 1H), 7,83 (d, J=1,5 Гц, 1H), 9,01 (br s, 1H), 9,76 (d, J=1,5 Гц, 1H). Стадія III: 2-(1-ізопропіл-1H-імідазол-4іл)етанамін (Амін 13) Розчин йодиду 2-ізопропіл-5-оксо-5,6,7,8тетрагідроімідазо[1,5-c]-піримідин-2-ію, одержаного на Стадії II, як описано вище (41,12 г; 133,9 ммоль; 1 екв.), у водному розчині хлористоводневої кислоти (411,2 мл; 6 M) перемішують при 100°C протягом 3 діб. Розчинники випарюють, та додають ацетонітрил (200 мл). Утворений осад відфільтровують, промивають ацетонітрилом (250 мл) та сушать у вакуумі, одержуючи Амін 13,
ДивитисяДодаткова інформація
Назва патенту англійськоюThiazole derivatives and use thereof
Автори англійськоюQuattropani Anna, Dorbais Jerome, Covini David, Desforges Gwenaelle, Rueckle Thomas
Назва патенту російськоюПроизводные тиазола и их применение
Автори російськоюКуаттропани Анна, Дорбе Жером, Ковини Дейвид, Дефорж Гвенаэль, Рюкле Томас
МПК / Мітки
МПК: A61K 31/5377, C07D 493/08, C07D 277/56, A61K 31/454, A61K 31/496, A61K 31/553, C07D 417/14, C07D 491/10, A61K 31/427, A61K 31/433, A61P 9/00, C07D 277/46, A61P 25/00, A61K 31/497, C07D 277/48
Мітки: застосування, тіазолу, похідні
Код посилання
<a href="https://ua.patents.su/54-96735-pokhidni-tiazolu-ta-kh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Похідні тіазолу та їх застосування</a>
Попередній патент: Аміноалкіламідометилзаміщені похідні 2-(4-сульфоніламіно)-3-гідрокси-3,4-дигідро-2н-хроман-6-ілу та лікарські засоби, які містять ці сполуки
Наступний патент: Інгібітори pі3k для лікування ендометріозу
Випадковий патент: Спосіб акустичного прогнозування раптових викидів вугілля, породи та газу в підземних виробках












