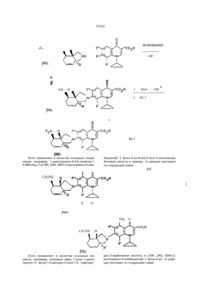
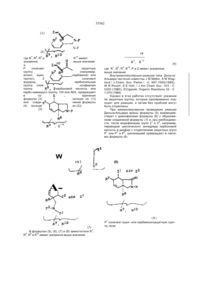
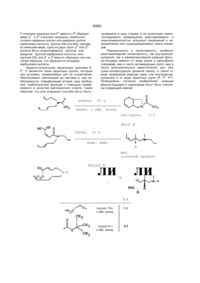
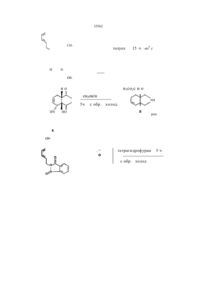
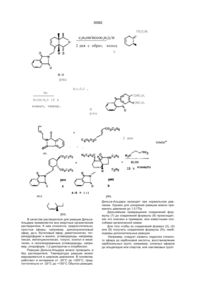
Похідні 7-ізоіндолінілхінолону і 7-ізоіндолінілнафтирідону
Номер патенту: 35562
Опубліковано: 16.04.2001
Автори: Бартел Стефан, КРЕБС Андреас, МЕТЦГЕР Карл-Георг, Мелке Буркхард, Ендерманн Райнер, ПЕТЕРСЕН Уве, Філіппс Томас, ШЕНКЕ Томас, БРЕММ Клаус Дітер
Текст
Производные 7-изоиндолинилхинолона и 7изоиидолинилнафтиридона общей формулы (І) или замещенный одним или двумя атомами фтора, З-оксапроп-2-ил, R2 - водород; R3 - гидроксил или группа O-R11, где R11 означает алкил с 1-4 атомами углерода, R4 - водород, аминогруппа, алкиламиногруппа с 1-4 атомами углерода, диалкиламиногруппа с 1-3 атомами углерода в каждой алкильнои группе, R5 - водород, галоген; R6 - водород, ал кил окси карбон ил с 1-4 атомами углерода в алкильнои части, 12 -N. группа или гид рокси метил, я12 ----- CH2-N R - алкил с 1-4 атомами углерода, незамещенный или замещенный 1-3 атомами фтора, циклоалкил с 3-6 атомами углерода, фенил, незамещенный Изобретение относится к новым производным хинолона и нафтиридона, в частности, к производным 7-изоиндолинилхинолона и 7-изоиндолинилфтиридона общей формулы (I) , (I) где R1ji означает водород, алкил с 1-3 атомами углерода, незамещенный или замещенный гидроксигруппой, алкилоксикарбонил с 1-4 атомами углерода в алкильнои части; R1 означает водород или метил, R7, R8, R9 и R10 означают водород или метил; А означает N или C-R14 где R " означает водород, галоген, метоксигруппа или вместе с R1 может образовывать мостик структуры -О-СН2-СН(СН3)-, ихтаутомеры и солянокислые соли где: R - алкил с 1-4 атомами углерода, незамещенный или замещенный 1-3 атомами фтора, циклоалкил с 3-6 атомами углерода, фенил, незамещенный или замещенный одним или двумя атомами фтора, З-оксапроп-2-ил, R 2 -водород, R3 - гидроксил или группа O-R11, где R11 означает алкил с 1-4 атомами углерода; R4 - водород, аминогруппа, алкиламиногруппа с 1-4 атомами углерода, диалкиламиногруппа с 1-3 атомами углерода в каждой алкильнои группе, R5 - водород, галоген, R5 - водород, алкилоксикарбонил с 1-4 атомами углерода в алкильнои части, О 4 СО Ю Ю 35562 Новые соединения общей формулы (I) можно получать за счет того, что соединение общей формулы (М) 12 -N гид роксим етил, группа ,12 -CH2-N 13 или R 13 гдеR означает водород, алкил с 1-3 атомами углерода, незамещенный или замещенный гидроксигруппой, алкилоксикарбонил с 1-4 атомами углерода в алкильной части, a R13 означает водород или метил; R7, Re, R9 и R10 означают водород или метил; А - N или C-R14, где R14 означает водород, галоген, метоксигруппа или вместе с R1 может образовывать мостик структуры -О-СН2-СН(СНэЬ их таутомерам и солянокислым солям, которые проявляют ценные свойства, в частности, обладают более высокой, по сравнению с известными из европейской заявки ЕР-А-343560 производными хинолона и нафтиридона, антибактериальной активностью, в частности, в грамположительной области Предпочтительными являются соединения общей формулы (І), в которой: R1 означает циклопропил, этил, 2-фторэтил, незамещенный или замещенный одним, двумя или тремя атомами фтора, трет.-бутил или незамещенный или замещенный одним или двумя атомами фтора фенил, З-оксапроп-2-ил, R4 означает водород, аминогруппу; R5 означает водород, фтор, хлор или бром; R6 означает водород, аминогруппу, метиламино-группу, этоксикарбониламиногруппу, аминометил, этоксикарбониламинометил, гид роксим етил, этоксикарбонил. Особенно предпочтительными являются соединения формулы (І), в которой: R означает циклопропил, этил, трет.-бутил или 2,4дифторфенил, R3 означает гидрокси или этокси, R5 означает водород или фтор. (II) где: R , R2, R3, R4, R5 и А имеют указанные выше значения и X означает галоген, в частности, фтор или хлор, подвергают взаимодействию с соединением общей формулы (111) (ill) е: гд R , R , R , R и R имеют указанное выше значение, при необходимости в присутствии средств, связывающих кислоту, и при необходимости имеющиеся защитные группы отщепляют щелочным или кислым гидролизом и полученные соединения выделяют в свободном виде, в виде таутомеров или ссляно-кислых солей. Если применяют в качестве исходных веществ, например, 1-циклопропил~б,7,8-трифтор1,4-дигидро-4-оксо-хинолинкарбоновую кислоту и (1SR, 2RS, 6RS)-2-этoкcикapбoнилaминo-8-aзaбицикло[4.3.0]нон-4-ен, то протекание реакции может быть изображено следующей схемой: 35562 основание 5С2 -HF рац. О И NH 1. Н 2. НоО / ОН Э НС1 рац. НС1 Если применяют в качестве исходных соединений, например, 1-циклопропил-5,6,8-трифтор-1, 4-flMrnApo-7-[(1SR, 2RS, 68Р)-2-метиламино-8-аза бицикло[4 3 0]нон-4-ен-8-ил]-4-оксо-3-хинолинкарбоновую кислоту и аммиак, то реакция протекает по следующей схеме -HF CH3NH F О рац. NH2 О CH3 NH H Если применяют в качестве исходных веществ, например, этиловый эфир 7-хлор-1-циклопропил- 6 - фтор-1,4-дигидро-4-оксо-1,8 - нафтири со2н дин-3-карбоновой кислоты и (1SR, 2RS, 6SR)-2метиламино-8-азэбицикло[4 3 0]нон-4-ен, то реакция протекает по следующей схеме 35562 H3C-NH H со2со2к5 основание -неї н СІ рац. Взаимодействие (II) с (III), при котором CH3NH соединения (II!) могут также использоваться в виде их солей, например, гидрохлоридов, проводится, предпочтительно, в разбавителе, например, диме-тилсульфоксиде, М,№диметилформамиде, N-ме-тил пиррол ид он е, триамиде гексамети л фосфорной кислоты, сульфолане, ацетонитриле, воде, спирте, например, метаноле, этаноле, н-пропаноле, изопропаноле, монометиловом эфире гликоля или пиридине Также могут применяться смеси этих растворителей В качестве связывающего кислоту средства можно применять все обычные неорганические или органические кислотосвязующие. К ним относятся, предпочтительно, гидроокиси щелочных металлов, карбонаты щелочных металлов, органические амины и амидины. Особенно подходящими следует назвать триэтиламин, 1,4-диазабицикло[2 2 2]октан, 1,8-диазабицикло[5 4 0]ундек-7-ен или избыток амина (III) Температура реакции может варьироваться в широком диапазоне В основном, работают при температуре 20-200°С, предпочтительно, 40 юох Взаимодействие можно проводить при нормальном давлении, но также и при повышенном давлении В основном, работают при давлении 1100 бар, предпочтительно 1-10 бар При осуществлении этого способа вводят на 1 моль соединения (II) от 1 до 15 молей, предпочтительно, от 1 до 6 молей соединения (II!) Свободные аминогруппы могут быть во время взаимодействия защищены подходящими аминозащитными группами, например, трет-бутилоксикарбонилом или этоксикарбонилом или быть в виде азометиновых групп, и после окончания реакции освобождаться обработкой подходящей кислотой, например, хлористоводородной или трифторуксусной кислотой, и подходящим основанием, например, натриевой или калиевой щелочью (Т W Greene, Protective Groups in Organic Synthesis, стр 218-288, изд John Willey & Sons, 1981) Получение кислотно-аддитивных солей соединений, согласно изобретению, происходит обы чным образом, например, растворением бетаина в избытке водной кислоты и осаждением соли смешивающимся с водой органическим растворителем, например, метанолом, этанолом, ацетоном, ацетонитрилом Можно также нагревать эквивалентные количества бетаина и кислоты в воде или спирте, например, монометиловом эфире гликоля, и затем упарить досуха или отфильтровать выпавшую соль Под фармацевтически применимыми солями понимают, например, соли соляной кислоты, серной кислоты, уксусной кислоты, глико-левой кислоты, молочной кислоты, янтарной кислоты, лимонной кислоты, винной кислоты, метансульфокислоты, 4-толуолсульфокисло-ты, галактуроновой кислоты, эмбоновой кислоты, глутаминовой кислоты или аспарагиновой кислоты. Щелочные и щелочноземельные соли кислот, согласно изобретению, получают, например, растворением бетаина в недостаточном количестве основания щелочного или щелочноземельного металла, фильтрацией н ера створившегося бетаина и упариванием фильтрата досуха Фармацевтически пригодными являются соли натрия, калия или кальция Обработкой щелочной или щелочноземельной соли подходящей серебряной солью, например, нитратом серебра, получают соответствующие соли серебра Большинство применяемых в качестве исходных соединений формулы (II) являются известными или могут быть получены известными способами Исходные соединения формулы (III) являются новыми Они могут быть получены тем, что подходящие диены с подходящими диенофилами подвергают реакции Дильса-Альдера, которая протекает как внутримолекулярно, так и межмолекулярно, и затем, при необходимости, проводят другие химические реакции для построения пирролидинового кольца и для ведения необходимых для биологической активности заместителей, и в последней операции отщепляют защитные группы у атома азота пирролидина При внутримолекулярном проведении реакции Дильса-Альдера соединения формулы (1) или (2) 35562 (1) N-P N-P (2) 7 8 >8 9 10 где R , R , R и R имеют указанное выше значение ,1Q и Р означает защитную группу (например, аллил, ацил, карбамоил или тритил), Z означает аодород, карбоксильную группу, сложноэфирную группу карбоновой кислоты или карбо-намиднуго группу, CN или N02, превращают в соединения формулы (3) (исходя из (1)) или соединения формулы (4) (исходя из (2)) (3) , R R9, R 10 (4) где R7, R8, R9, R10, Р и Z имеют указанные выше значения Внутримолекулярные реакции типа ДильсаАльдера частично известны J М Mellor, A M Wagland / J Chern Soc Perkm ! -С 997-1005(1989), W R Roush, S E Hall, / J Am Chem Soc -103 - С 5200 (19B0), ECiganek, Organic Reactions 32 - С 1-374 (1984) Однако в этих работах отсутствует указание на защитные группы, которые одновременно подходят для реакции, и затем без проблем могут быть отщеплены При межмолекулярном проведении реакции Дильса-Альдера диены формулы (5) взаимодействуют с диенофилами формулы (6) с образованием соединений формулы (7) и, при необходимости, после модификации групп 21 и Z2, например, переводом циклического ангидрида карбоновой кислоты в диэфир с отщеплением защитных групп Р1 или Р1 и Р2, циклизацией превращают в лактамы формулы (8) W (6) A(8) Р означает ацил- или карбамоилзащитную группу, если 1 (7) В формулах (5), (6), (7) и (8) заместители R7, R8, R9 и R10 имеют указанное выше значение, 35562 Р означает водород или Р1 вместе с Р2 образует имид; Z1 и Z2 означают водород, карбоксил, сложно-эфирные группы или амидные группы карбоновои кислоты, группы СМ или N02, причем, по меньшей мере, одна из двух групп Z1 или Z2 должна быть сложноэфирной группой или амидной группой карбоновои кислоты, или группой CN, или Z и Z2 вместе образуют мостик, таким образом, что образуется ангидрид карбоновои кислоты. Предпочтительными защитными группами Р, Р1, Р являются такие защитные группы, которые при условиях, применяемых для их отщепления, обеспечивают циклизацию до лактама и, при необходимости, этерификацию второй, еще свободной, карбоксильной функции с помощью применяемого в качестве растворителя спирта, таким образом, что все операции способа могут быть О ксилол, проведены в одну стадию, и не происходит неконтролируемого превращения диастереомерно- и знантиомерночистых исходных соединений в неразделимые или труднораэделимые смеси изомеров. Реакционность и селективность, особенно диастереомерная селективность, как внутримолекулярной, так и межмолекулярной реакции Дильса-Альдера зависят от вида диена и диенофила (например, вид и число активирующих групп, вид и число дополнительных заместителей, цис- или транс-конфигурация двойной связи), а также от вида проведения реакции (меж- или внутримолекулярная) и от вида защитных групп (Р, Р1, Р2). Проводимые, согласно изобретению, реакции Дильса-Адьдера и циклизации могут быть пояснены следующей схемой: 20 ч кипяч. с обр. холод. цис:транс 1:1 но 2 с н СНСХз, 15 ч комн. темп. н рац. основной продукт ли ли н5с2о2с н N-P -р н А: В толуол 15ч с обр. холод. 3:2 толуол 6 ч с обр. холод. 4:1 35562 CH Н толуол 15 ч во0 с 0 сн. н3со2с н о но сн3он/н 5ч HN NH с обр. холод. н НО рац к сн4 1 H-,CNH H NH H LiAIH4 н рац. 1)триэтиламин 2)этанол рац. 35562 H О N сн ДИБАГ I) "СН. О СИ н рад. нон 2 с н СН о нон-,с н неї -сн. сн рац. рац. н нон ? с н о н 5 с2 о 2 с н о н н рад. нонгс н Н рац. рац. NH СП БоК?0 N -СИ СН Н нон г с н о рац. н~с—с V-SQ7CI s-o-K 7 c СН-СН к її 1) гидрид диизобутил алюминия 2) ди-трет -бутилдикарбонат СН' f о н рац. 10 35562 О 1. NaN3 2. NH-H2C H СИ PPh3 ' 3. н5с2о H2O/H 4. С Ь НС1 С2Н5О NH рад. 1) трифенилфосфин 2) триэтиламин Большинство исходных соединений формул (1), (2), (5) и (6) являются известными или могут быть получены известными в органической химии способами Соединения формулы (III) могут использоваться как в виде рацематов, так и в виде знантиомерночистых или диастереомерночистых соединений Заявленные соединения формулы (I) проявляют сильную антибиотическую активность и, при незначительной токсичности, обладают широким спектром действия против грамположительных и грам отрицательных микробов, особенно, против эндобактерий, прежде всего, против таких, которые устойчивы к различным антибиотикам, например, пенициллину, цефалоспорину, аминоглюкозидам, сульфамидам, тетрациклину и другим хинолонам Заявленные соединения проявляют хорошую переносимость Благодаря этим ценным свойствам, соединения могут применяться в медицине, а также для консервирования органических и неорганических материалов, в особенности, всех видов органических материалов, например, полимеров, смазочных веществ, красок, волокон, кожи, бумаги и древесины, пищевых продуктов и воды Соединения, согласно изобретению, активны против очень широкого спектра микроорганизмов С их помощью борются с грамположительными и грамотрицательными бактериями и бактериоподобными микроорганизмами, а также с вызываемыми ими болезнями Соединения, согласно изобретению, проявляют сильную активность в отношении покоящихся и резистентных микроорганизмов В случае покоящихся бактерий, т е тех, у которых не наблюдается роста, соединения активны при концентрациях значительно более низких, чем известные соединения Это относится не только к вводимым количествам, но и к скорости умерщвления Такие результаты наблюдались у грамположительных и грамотрицательных бактерий, в частности, у Staphylococcus aureus, Pseudomonas aeruginosa, Enterococcus faecafis и Eschenchia coif Также по отношению к бактериям, значительно менее восприимчивым к веществам, взятым для сравнения, в особенности, к резистентным Staphylococcus aureus, Eachenchia colt, Pseudomonas aeruginosa и Enterococcus faecalis, заявленные соединения проявляют значительное повышение активности Особенно активны соединения по отношению к бактериям и бактериоподобным микроорганизмам Поэтому они особенно пригодны в медицине и ветеринарии для профилактики и химиотерапии локальных и системных инфекций, вызываемых этими возбудителями Также соединения годятся для борьбы с протозоонозом и гельминтозом Кроме того, соединения, по изобретению, пригодны для лечения опухолевых заболеваний Предложенные соединения могут применяться в различных препаративных формах Особенно предпочтительными являются таблетки, драже, капсулы, пилюли, гранулы, суппозитории, растворы, суспензии и эмульсии, пасты, мази, гели, кремы, лосьоны, пудры и аэрозоли Минимальные концентрации торможения (МКТ) определялись способом последовательного разбавления на Iso-sensitest агаре (оксоид) При этом готовили ряд агаровых пластин, которые при двойном разбавлении содержали уменьшающиеся концентрации активного вещества Агаровые пластины прививали с помощью многоточечного инокулятора типа Денлей Для прививки применяли выращенные в течение ночи культуры возбудите 11 35562 невооруженным глазом не наблюдалось никакого роста В нижеследующей таблице приведены значения МКТ некоторых заявленных соединений, в сравнении с 7-(4-амино-1,3-дигидро-изоиндол-2ил)-1-циклопропил-6,8-дифтор-1,4-дигидро-4-оксо3-хинолинкарбоновой кислотой (заявка на европейский патент ЕР-А-343 560, пример 2). ля, которые сначала разбавляли так, чтобы каждая точка прививки содержала около 104 образующих колонию частиц. Привитые агаровые пластины инкубировали при 37°С и, спустя приблизительно 20 часов, считывали рост микроорганизмов. Значение МКТ (мкг/мл) дает самую низкую концентрацию активного вещества, при которой Таблица Значения МКТ (мкг/мил) Пример * 4 6 12 14 19 22 0,5 0,0078 < 0,015 0,0039 0,03 < 0,015 0,03 Klebsieiia sp. 8085 4 0,015 0,03 0,015 0,125 0,03 0,06 Enterobacter cloacae 2427 0,015 0,06 0,015 0,125 0,03 0,125 Morganelia morg. 932 1 0,015 0,015 0,125 0,03 0,125 Providencia sp. 12012 1 0,015 0,03 0,015 0,125 < 0,015 0,125 Micrococcus luteus 9341 0,015 0,06 0,015 0,125 0,06 0,125 Staphylococcus aureus ICB 25701 0,03 0,125 0,015 0,25 0,03 0,125 Staphylococcus aureus 1756 0,03 0,0039 < 0,015 й 0,0019 0,0078 < 0,015 £0,015 Enterococcus faecalis 27 101 0,5 0,15 0,03 0,0078 0,03 128 0,25 0,5 0,25 1 1 2 Е coli Neumann Pseudomonas aerugmosa Walter * соединение для сравнения; 7-(4-амино-1,3-дигидро-изоиндол-2-ил)-1-циклолропил-6,8-дифтор-1,4-дигидро-4-оксо-З-хинолинкарбоновая кислота (ЕР 343560, пример 2) Получение промежуточных продуктов: Пример А 8-азабицикло[4.3.0]нон-2-ен А.1. (Е)-1-бром-2,4-пентадиен творенной в 200 мл воды, дважды экстрагируют по 100 мл метиленхлорид а, сушат над сульфатом натрия, прибавляют 0,1 г 4-гидрокси анизол а, сгущают, перегоняют при 40 мбар Для стабилизации к дистилляту прибавляют 10-20 ч/милл 4-гидроксианизола Выход: 33-35 г (67-72% от теории) Т.кип 77-82°С при 40 мбар. 1 Н-ЯМР (дейтер.хлороформ). S = 6,07-6,48 (м, 2Н); 5,64-6,07 (м, 2Н), 5,00-5,27 (м, 4Н), 3,19-3,36 = =1 ч/милл (м, 4Н). A3. Ы-[(Е)-2,4-пентадиенил]-М-(2-пропенил)ацетамид К 84 г (1,0 моль) находящегося при 0°С 1,4пентадиен-3-ола прикапывают при перемешивании 150 мл (около 1.3 моль) 48%-ной водной бромистоводородной кислоты так, чтобы внутренняя температура не превышала 5аС. После окончания добавления продолжают перемешивать 1 час при комнатной температуре Органическую фазу отделяют и без очистки подвергают дальнейшему превращению. Выход 107-129 г (73-88% от теории) А.2. (Е}-1-(2-пропениламино)-2,4-пентадиен Берут 24,6 г (0,2 моль) (Е)-1-(2-пропениламино)-2,4-пентадиена (целевое соединение по примеру А 2), прикапывают 22,4 г уксусного ангидрида и перемешивают в течение ночи при комнатной температуре Сгущают и применяют дальше в сыром виде. А.4. 8-ацетил-8-азабицикло[4.3.0]нон-2-ен К 22В г (4,0 моль) 1-амино-2-пропена прикапывают при перемешивании 58,8 г (0,4 моль) (Е)-1бром-2,4-пентадиена (целевое соединение по примеру А.1). Путем охлаждения поддерживают внутреннюю температуру в диапазоне 20-30°С, в течение 5 часов перемешивают при комнатной температуре Смесь сгущают при 150 мбар, добавляют 20 г (0,5 моль) гидроокиси натрия, рас 12 35562 N і веса. Выход. 177-200 г (83-94% от теории). Тпл' 118-12ГС (проба перекрист из этанола) 1 Н-ЯМР (дейтер. хлороформ). 6= 7,85 и 7,72 (м, 4Н, арил-Н); 6,2-6,4 (м, 2Н, Н у С-3 и С-4), 5,75 (дт, 1Н, НуС-2, J =14 и 62 Гц); 5,20 (д, 1Н, На у С5, J = 15 Гц), 5,10 (д, 1Н, Н§ у С-5, J = 8 Гц); 4,33 ч/милл (д, 2Н, Н у С-1, J = 6 Гц) Б.2. (Е)-1-амино-2,4-пантадиен СН, 33,1 г (0,2 моль) М-[(Е)-2,4-пентадиенил]-Ы-(2пропенил)-ацетамида (целевое соединение примера А 3) растворяют в 200 мл ксилола, в течение 15 мин пропускают сильный ток азота, прибавляют 0,1 г 4-гидроксианизола, затем нагревают в течение ночи с обратным холодильником. Сгущают и перегоняют в глубоком вакууме Выход 23,1 г (70% от теории, считая на целевое соединение по примеру А 2). Т.кип 88-93°С (0,05 мбар) А.5. 8-азабицикпо[4 3.0]нон-2-ен В 2 л перегонный аппарат с колонкой (10 см) типа Vigreux помещают 400 г бис-(2-аминоэтил)амина и 213 г (1,0 моль) М-[(Е)-2,4-пентадиенил]фталимида (целевое соединение по примеру Б.1) и нагревают до кипения при 60 мбар. Продукт отгоняют в интервале 45-60°С при 60 мбар. Для стабилизации к дистилляту прибавляют 10-20 ч/милл 4-гидроксианизола. Выход: 71-80 г (86-96% от теории) Б.З Этиловый (Е)-4-[(Е)-2 4-пентадиениламино]-2-бутеновой кислоты Н 'N" 16,5 г (0,1 моль) 8-ацетил-8-аэабицикло[4.3.0]нон-2-ена (целевое соединение по примеру А 4) нагревают с обратным холодильником в смеси из 100 мл 45%-ной натриевой щелочи, 50 мл воды и 100 мл 1,2-этандиола в течение 3 часов. После охлаждения экстрагируют четыре раза по 50 мл диэтилового эфира Объединенные органические фазы сушат сульфатом натрия, перегоняют в глубоком вакууме Выход: 6,6 г (54% от теории). Т.кип : 36-44°С при 0,35 мбар. 1 Н-ЯМР (дейтер.хлороформ): ё= 5,79 (м, 1Н), 5,74 (м, 1Н); 3,02-3,17 (м, 2Н); 2,47-2,72 (м, 2Н), 2,06-2,30 (м, 2Н); 1,91-2,06 (м, 2Н), 1,68 (м, 1Н); 1,45 ч/милл (м, 1Н). Пример Б Этиловый эфир (1RS, 2RS, 6SR)-8-a3a6nцикло[4 3.0]нон-4-ен-2-карбоновой кислоты (диастереомер А) и этиловый эфир (1RS, 2RS, 6SR)-8азабицикпо[4 3.0]нон-4-ен-2-карбоновой кислоты (диастереомер В) Б 1 Г^-[(Е)-2,4-пентадиенил]-фталимид Берут 41,6 г (0,5 моль) (Е)-1-амино-2,4-пентадиена {целевое соединение по примеру Б.2) и 50,6 г (0,5 моль) триэтиламина в 250 мл тетрагидрофурана при 0°С и прикапывают 96,5 г (0,5 моль) этилового эфира (Е)-4-бром-2-бутеновой кислоты, растворенного в 250 мл тетрагедрофурана Внутреннюю температуру поддерживают охлаждением льдом ниже 5°С. Перемешивают 5 часов при 0°С, затем - ночь - при комнатной температуре Прибавляют 500 мл трет бутил метилового эфира, затем 500 мл 1 М натриевой щелочи, встряхивают, разделяют фазы, водную фазу экстрагируют один раз 100 мл трет бутил метилового эфира, объединенные органические фазы сушат сульфатом натрия, прибавляют 100 мл толуола и 0,1 г 4-гидроксианизола, сгущают (при этом температура не должна превышать 40°С) Остаток очищают хроматографией на колонке с 1 кг сили кагеля (63-200 мкм) со смесью циклогексана и ацетона (2.1) Перед сгущением снова добавляют 0,1 г 4-гидроксианизола и во время сгущения не превышают температуру 40°С. Выход1 52,7-58,6 г (54-60% от теории), желто ватое масло * Rf = 0,24 1 Н-ЯМР (дейтер.хлороформ)- 5= 6,99 (дт, 1Н, J = 15 и 5,5 Гц); 6,1-6,45 (м, 2Н), 5,98 (д, 1Н, J = =15 Гц), 5,75 (дт, 1Н, J = 15 и 6,5 Гц) 5,18 (д, 1Н, J = 15 Гц), 5,06 (д, 1Н, J = 10 Гц), 4,19 (к, 2Н), 3,42 (дд, 2Н), 3,31 (д, 2Н), 1,29 ч/милл (т, ЗН) Б 4. Этиловый эфир (IRS, 2RS, 6SR)-8-Tper бутилоксикарбонил-8-азабицикло[4.3.0]нон-4-ен-2карбоновой кислоты (диастереомер А) и этиловый эфир (1RS, 2RS, 6SR)-8-TpeT-бутилоксикарбонил8-азабицикло[4 3.0]нон-4-ен-2-карбоновой кислоты Берут 185 г (1,0 моль) фталимида калия в 800 мл диметилформамида, прикапывают при перемешивании 147 г (1,0 моль) (Е)-1-бром-2,4пентадиена (целевое соединение по примеру А.1), при этом внутреннюю температуру поддерживают охлаждением ниже 30°С В течение ночи перемешивают при комнатной температуре Затем смесь выливают при перемешивании в 1,6 л ледяной во-ды, осадок отфильтровывают, промывают водой, сушат при комнатной температуре до постоянного веса 13 35562 (диастереомер В) рац. о сн 3 рац. сн3 сн. в Растворяют 97,5 г (0,5 моль) этилового эфира (Е)-4-[(Е)-2,4-пентадиениламино]-2-бутеновой кислоты (целевое соединение Б 3) в 250 мл толуола Прикапывают 114,5 г (0,525 моль) дитрет-бутилдикарбоната, растворенного в 250 мл толуола, перемешивают В течение ночи при комнатной температуре Затем в течение 15 минут пропускают сильный ток азота, добавляют 0,1 г 4-гидроксианизола, затем нагревают 6 часов с обратным холодильником Сгущают, остаток очищают колоночной хроматографией на 1 кг силикагеля (63200 мкм) со смесью циклогексана и ацетона (8 1) Выход 109-134 (74 - 91% от теории) желтоватого масла, смесь двух диастереомеров А и В в соотношении *4 1 Rf = 0,25 1 Н-ЯМР (дейтер тетрахлоретан, 80°С) 5 = 5,77 (м, 1Н(А) и 1Н(В)), 5,68 (м, 1Н(А) и 1Н(В)), 4,14 (м, 2Н(А) и 2Н(В)), 3,65 (м, 2Н(А) и 1Н(В)), 3,48 (дд, 1Н(В)), 3,27 (ДД, 1Н(В)), 3,00 (м, 1Н(А) и 1Н(В)), 2,85 (дд, 1Н(А)), 2,76 (м, 1Н(В)), 2,60 (м, 1H(A))t 2,25-2,55 (м, ЗН(А) и 4Н(В)), 1,93 (м, 1Н(А)), 1,51 (С, 9Н(В)), -\М (С, 9Н(А)), 1,25 ч/милл (т, ЗН(А) и ЗН(В)) Б 5 Этиловый эфир (1RS, 2RS, 6SR)-8-a3a6nцикло[4 3 0]нон-4-ен~2-карбоновой кислоты (диастереомер А) и этиловый эфир (1RS, 2RS, 6SR)-8азабицикло[4 3 0]нон-4-ен-2-карбоновой кислоты (диастереомер В) рац. \=/\ W : H. C N , Берут 6,0 г (20 ммоль) целевого соединения по примеру Б 4, растворенного в 20 мл диоксана H / При охлаждении прикапывают 20 мл конц соляной кислоты таким образом, чтобы внутренняя температура не превышала 30°С После завершения добавления перемешивают 10 минут, добавляют 40 мл метиленхлорид а и прикапывают при охлаждении льдом 40 мл 20%-ной охлажденной льдом натриевой щелочи Органическую фазу отделяют, водную фазу однократно промывают метиленхлоридом, объединенные органические фазы сушат сульфатом натрия, сгущают Получают 3,0 г сырого продукта, который очищают хроматографией на колонке с 100 г силикагеля смесью циклогексана, этанола и 17%-ного водного аммиака (1 2 01) Выход 0,8 г диастереомера А и 0,8 г диастереомера В Rf = 0,79 целевое соединение по примеру Б 4 0,21 диастереомер В 0,11 диастереомер А 1 Н-ЯМР (детер хлороформ) диастереомер А 5= 5,83 (д, 1Н), 5,69 (м, 1Н). 4,15 (к, 2Н), 3,21-3,38 (м, 2Н), 2,52-2,89 (м, ЗН), 2,212,52 (м, ЗН), 1,95 (м, 1Н), 1,28 ч/милл (т, ЗН) диастереомер В 5= 5,64-5,87 (м, 2Н), 4,16 (к, 2Н), 3,14-3,33 (м, 2Н) 2,86 (дд, 1Н), 2,15-2,74 12 Сгущают, остаток дважды подвергают кипячению с этанолом при перемешивании Этанольные экстракты сгущают, в глубоком вакууме удаляют остатки растворителя. Выход: 2,1 г (продукт содержит остатки хлористого натрия). Rf = 0,20, метиленхлорид/метанол/17%-ныЙ водный аммиак (2.4:1). 1 Н-ЯМР (дейтер. диметилсульфоксид)' 5 = =5,76 (д, 1Н), 5,62 (д, 1Н); 3,47-3,56 (м, 2Н, На у С-7 и На у С-9), 3,32-3,47 (м, 1Н, На у гидроксиметилСН2); 3,23-3,32 (м, 1Н, Не у гидроксиметил-СН2), 2,77 (т, 1Н, Нб у С-9), 2,64 (т, 1Н, Нб у С-7), 2,102,24 (м,2Н, На у С-3 и Н у С-6), 1,77-1,88 (м, 1Н, Нб У С-3); 1,69 (м, 1Н, Н у С-2), 1,40 ч/милп (м, 1Н, Н у С-1). Пример Е (1RS, 2RS, 6SR)-2-3™iOKCHKap6oHnnaMHHOметил-8-азабицикло[4 3 0]нон-4-ен Е.1. (1RS, 2RS, 6SR)-8-TpeT.-6y™iOKCMKap6oнил-2-(4-толуолсульфонилоксиметил)-8 -азабицикло[4 3 0]нон-4-ен (диастереомер А) и (1RS, 2RS, 6SR)-8-TpeT.-6yrHnoKCHKap6oHWi-2 - (4-толуолсульфонилоксиметил) - 8 - азабицикло[4 3 0]нон - 4 - ен (диастереомер В) нон2с н СН, примеру Б 4, 0,12 целевое соединение Аи В Сырой продукт при длительном стоянии затвердевает. Перекристаллизацией из смеси эфира с петролейным эфиром может быть получена диастереомерночистая проба основного диастереомера А н.с рац. н.с 16 35562 Берут 12,7 г (0,05 моль) целевого соединения по примеру Д 1 (сырая смесь диастереомеров А и В) в 25 мл безводного пиридина и охлаждают до 15°С. Порциями прибавляют 11,0 г (0,0575 моль) 4-толуолсульфохлорида так, чтобы внутренняя температура не превышала -5°С После окончания прибавления продолжают перемешивать 2 часа при температуре от -5 до -15°СГ затем 3 часа при комнатной температуре. Прибавляют 5 г льда, перемешивают 5 минут, выливают в 50 мл воды. Осадок отфильтровывают, промывают водой, сушат при 50°С до постоянного веса Выход: 14,4-16,3 г (71-80% от теории) бледнорозового твердого вещества, смесь диастереомеров А и В. Перекристаллизацией из метанола можно получить диастереомерночистую пробу основного диастереомера А. ре, затем медленно прикапывают 150 мл воды, после окончания прибавления продолжают перемешивать 15 минут. При охлаждении прикапывают соляную кислоту (конц соляная кислота/вода 1'3) до установления рН = 3-4 Тетрагидрофуран отгоняют в вакууме при комнатной температуре, реакционный раствор охлаждают до 0°С, выпавший трифенилфосфиноксид отфильтровывают или поглощают метил-трет.-бутиловым эфиром в случае маслянистого продукта. Добавкой 10%-ной натриевой щелочи устанавливают в водной фазе значение рН > 12, дважды экстрагируют по 100 мл метиленхлорида, объединенные экстракты сушат сульфатом натрия, затем прибавляют 6,0 г (0,06 моль) триэтиламина, при перемешивании прикапывают 6,0 г (0,055 моль) этилового эфира хлормуравьиной кислоты, растворенного в 20 мл метиленхлорида. Перемешивают в течение ночи при комнатной темературе, реакционный раствор промывают один раз 100 мл воды, сушат сульфатом натрия и сгущают Получают 23 г сырого продукта, который очищают колоночной хроматографией на 100 г сипнкагеля (63-200 мкм) смесью циклогексане с ацетоном (4:1). Выход: 12,4 г (76% от теории) вязкого масла, смесь диастереомеров А и В Rf= 0,32 диастереомер А 0,29 диастереомер В (циклогексан/ацетон 2:1). Диастереомеры А и В очищают колоночной хроматографией на 250 г силикагеля (35-70 мкм) с смесью циклогексана и ацетона (8.1) Выход- 4,3 г (26% от теории) диастереомера А (вязкое масло) 2,4 г (15% от теории) смешанная фракция 0,6 г (4% от теории) диастереомера В. 1 Н-ЯМР (дейтер тетрахлорэтан; 80°С): Диастереомер А: 5 = 5,75 (д, 1Н, Н у С-5), 5,66 (м, 1Н, Н у С-4); 4,67 (шир, 1Н, NH); 4,08 (к, 2Н, этокси-СНг), 3,62 (шир, 2Н, На у С-7 и На у С-9); 3,19 (шир, 1Н, На у CHa-NH), 3,05 (шир, Нб у СНгNH), 2,96 (дд, 1Н, Не у С-9), 2,81 (дд, 1Н, Нб у С-7); 2,24-2,34 (м, 2Н, На у С-3 и Н у С-6), 1,78-1,94 (м, 2Н, Н у С-2 и Н6 у С-3), 1,54 (м, 1Н, Н у С-1); 1,43 (с, 9Н); 1,22 ч/милл (т, ЗН, этокси-СНз) Диастереомер В 5 = 5,69 (м, 1Н, Н у С-4); 5,57 (м, 1Н, Н у С-5), 4,65 (шир, 1Н, NH); 4,08 (к, 2Н, этокси-СН2), 3,52 (дд, 1Н, На у С-7), 3,41 (дд, 1Н, На у С-9); 3,29 (дд, 1Н, Нб у С-9); 3,24 (дд, 1Н, На у СНг-NH); 3,03-3,12 (м, 2Н, Н6 у С-7 и Н6 у CH2-NH); 2,68 (м, 1Н, Н у С-6), 2,12-2,22 (м, 2Н, Н у С-1 и На у С-3), 1,74-1,87 (м, 2Н, Н у С-2 И Нб у С-3); 1,43 (с, 9Н); 1,22 ч/милл (т, ЗН, этокси-СНз) ЕЗ. (1RS, 2RS, 6S R)-2-этилoкcи карбон ила минометил-8-азабицикло[4 3.0]нон-4-ен Т.пл.: 111-113°С. 1 Н-ЯМР (дейтер. хлороформ): (диастереомер А) 8= 7,79 (м, 2Н, арил-Н), 7,36 (д, 2Н, арил-Н), 5,74 и 5,78 (2д, 1Н, Н у С-5), 5,64 (м, 1Н, Н у С-4), 3,87-3,97 (м, 2Н, тозил-ОСНг); 3,59 и 3,67 (2дд, 1Н, На у С-7); 3,48 (дд, 1Н, На у С-9); 2,78-2,96 (м, 2Н, Нб у С-7 и Нб у С-9), 2,47 (с, ЗН, арил-СН3), 2,22-2,36 (м, 2Н, Н3 у С-3 и Н у С-6), 2,06 (м, 1Н, Н уС-2), 1,80-1,98 (м, 1Н, НбуС-3), 1,59 (м, 1Н, Ну С-1), 1,45 и 1,47 4/милл (2с, 9Н). Е.2. (1RS, 2RS, 6SR)-8-TpeT.-6ytHnoKCHKapбонил-2-этилоксикарбониламинометил-8-азабицикло[4 3 0]нон-4-ен (диастереомер А) и (1RS, 2RS, бSR)-8-тpeт.-бyтилoкcикapбoнил-2-этилoкcикарбониламинометил-8-азабицикло[4.3.0]нон-4-ен (диастереомер В) 20,5 г (0,05 моль) целевого соединения по примеру Е 1 (сырая смесь диастереомеров А и В) и 6,5 г (0,1 моль) азида натрия нагреваютв 100 мл диметилформамида 4 часа при 70°С Реакционный раствор выливают в 200 мл воды, экстрагируют один раз 200 мл петролейного эфира, фазу петролейного эфира промывают 50 мл воды, сушат сульфатом натрия и сгущают при комнатной температуре. Остаток поглощают 80 мл тетрагидрофурана и прикапывают 13,1 г( 0,05 моль )трифенилфосфина, растворенного в 80 мл тетрагидрофурана. После окончания прибавления перемешивают 20 часов при комнатной температу рац. 17 35562 Берут 83,2 г (1,0 моль) (Е)-1-амино-2,4-пентадиена (целевое соединение по примеру Б.2) в 250 мл метил-трет.-бутилового эфира и прибавляют 0,1 г 4-гидроксианизола. Затем прикапывают при внутренней температуре 20-30°С 229,2 г (1,05 моль) ди-трет-бутилдикарбоната в 250 мл метил-трет-бутилового эфира. После окончания прибавления перемешивают 20 часов при комнатной температуре Реакционную смесь сгущают и поглощают в 1 л толуола Прибавляют 103,0 г (1,05 моль) ангидрида малеиновой кислоты и перемешивают 24 часа при внутренней температуре 60°С Осадок отфильтровывают, промывают толуолом и сушат при 50°С до постоянного веса. Выход1 208,2 г (74% от теории) белого кристаллического твердого вещества. Т.пл.- 157-159°С. 1 Н-ЯМР (дейтер. диметилсульфоксид). 5 = =5,81 (м, 1Н, Н у С-4), 5,59 (д, 1Н, Н у С-3); 3,77 (дд, 1Н, На у СНг-NH); 3,44 (м, 2Н, Н у С-1 и Н6 у CH2-NH); 2,94 (м, 1Н, Н у С-2), 2,66 (м, 1Н, Н у С6); 2,16 (м, 1Н, На у С-5); 2,06 (м, 1Н, Нб у С-5); 1,43 ч/милл (с, 9Н). Ж.З. Метиловый эфир (1RS, 2RS, 6SR)-9-OKCO8-азабицикло[4.3.0]нон-4-ен-2-карбоновой кислоты Берут 1,6 г (5,7 ммоль) целевого соединения А по примеру Е 2 в 10 мл метанола, быстро приливают 8 мл концентрированной соляной кислоты и перемешивают 30 минут Разбавляют водой до двойного объема, затем прикапывают 45%-ную натриевую щелочь при перемешивании и охлаждении льдом до установления рН > 12. Четыре раза экстрагируют метиленхлоридом, обьединенные органические фазы сушат сульфатом натрия, остатки растворителя отгоняют в глубоком вакууме. Выход. 0,8 г (63% от теории) вязкого масла. Rf= 0,16 {метиленхлорид, метанол и 17%-ныЙ водный аммиак в соотношении 15:4:0,5. іН-ЯМР (дейтер. хлороформ)1 5= 5,81 (д, 1Н, Н у С-5), 5,67 (м, 1Н, Н у С-4); 5,00 (шир, 1Н, NH); 4,10 (к, 2Н, этокси-СН2), 3,18-3,28 и 3,08 (м, ЗН и м, 1Н, На У С-7, На у С-9, На и Нб у CH2-NH-CO); 2,67 (дд, 1Н, Нб у С-9); 2,53 (дд, 1Н, Нб у С-7); 2,34 (м, 1Н, HayC-3),2,25CM, 1Н, НуС-6); 1,79-1,96 (м, 2Н, Н у С-2 и Н 6 у С-3); 1,50 (м, 1Н, Н у С-1); 1,24 ч/милл (т, ЗН, этокси-СНз). Пример Ж (1RS, 2RS, 63Р)-2-гидроксиметил-8-азабицикло[4 3.0]нон-4-ен Ж.1. (Е)-1-трет.-бутилоксикарбониламино-2,4пентадиен СН Берут 8,3 г (0,1 моль) (Е)-1-амино-2,4-пентадиена (целевое соединение по примеру Б.2) в 50 мл метил-трет.-бутилового эфира и прибавляют 20 мл 4-гидроксианизола Затем прикапывают при внутренней температуре 20-30°С 22,9 г (0,105 моль) ди-трет-бутилдикарбоната, растворенного в 50 мл метил-трет.-бутилового эфира. После окончания прибавления перемешивают 20 часов при комнатной температуре, сгущают, остаток ди-трет.-бутилдикарбоната удаляют в глубоком вакууме при 40°С Выход. 18,9 г (сырой продукт) бесцветного масла Rf ~ 0,25 (смесь циклогексане и ацетона в соотношении 4:1. іН-ЯМР (дейтер хлороформ)1 5 = 6,05-6,43 (м, 2Н, Н у С-3 и С-4); 5,68 (дд, 1Н, Н у С-2, J = 14 и 6 Гц); 5,17 (дд, 1Н, На у С-5, J = 16 Гц), 5,07 (дд, 1Н, Нб у С-5, J = 10 Гц); 4,75 (шир, 1Н, NH); 3,77 (т, 2Н, Ну С-1), 1,45 ч/милл (с, 9Н). Ж 2 (1RS, 2RS, 6SR)-2-TpeT.-6ywiOKCHKap6oнил-7,9-диоксо-8~оксабицикло[4.3 0]нон-3-ен H 2Jr о Берут 83,2 г (1,0 моль) (Е)-1-амино-2,4-пентадиена (целевое соединение по примеру Б.2) в 250 мл тетрагидрофурана и прибавляют 0,1 г 4гидроксианиэола Затем прикапывают при внутренней температуре 20-30°С 229,2 г (1,05 моль) ди-трет.-бутилдикарбоната, растворенного в 250 мл тетрагидрофурана. После окончания прибавления перемешивают 20 часов при комнатной температуре. Прибавляют 103,0 г (1,05 моль) ангидрида малеиновой кислоты и нагревают с обратным холодильником 5 часов. Сгущают и остаток помещают в 500 мл метанола, прибавляют 30 мл п-толуолсульфокислоты, затем снова нагревают с обратным холодильником 5 часов. После охлаждения быстро прикапывают при охлаждении льдом и перемешивании раствор 20 г карбоната натрия в 500 мл воды. Смесь выдерживают еще 30 минут на ледяной бане. Осадок отфильтровывают, промывают небольшим количеством воды, сушат при 50°С до постоянного веса. Выход. 125-148 г (64-76% от теории) белого кристаллического вещества. Тпл.: 190-193°С. 1 Н-ЯМР (дейтер. диметилсульфоксид). 8 = =7,50 (с, 1Н, NH); 5,77 (м, 1Н, Н у С-4); 5,56 (м, 1Н, Н у С-5); 3,60 (С, ЗН, СН3О), 3,42 (дд, 1Н, На у С-7); 3,16 (дд, 1Н, Н у С-1), 3,00 (м, 1Н, Н у С-6); 2,88 (дд, 1Н, Н б у С-7); 2,67 (м, 1Н, Н у С-2); 2,022,18 ч/милл (м, 2Н, На и Не у С-3) Ж.4. (1RS, 2RS, 63Я)-2-гидроксиметил-8-азабицикло[4 3.0]нон-4-ен сн н рад. 18 35562 сн. НОН рад. рац. Берут 19,6 г (0,1 моль) целевого соединения по примеру ЖЗ в 100 мл тетрагидрофура на в среде инертного газа (суспензия) Прикапывают 100 мл (0,15 моль) 1,5 М раствора дииэобутилалюминийгидрида в толуоле при внутренней температуре 10-20°С Полученный прозрачный гомогенный раствор прикапывают к суспензии 1,9 г аланата лития в 50 мл тетрагидрофурана После окончания прибавления перемешивают 15 минут при комнатной температуре, затем 30 минут при нагревании с обратным холодильником После охлаждения добавляют порциями 3,8 г (0,1 моль) аланата лития, затем нагревают 24 часа с обратным холодильником После охлаждения прикапывают последовательно 50 мл воды и 10 мл 1 М раствора натриевой щелочи, отфильтровывают осадок и трижды кипятят с 150 мл этанола Фильтраты ІЛ экстракты объединяют и сгущают Выход 16,4 г (продукт содержит гидроокись лития и алюминия) Rf = 0,3 (смесь метиленхлорид а, метанола и 17%-ного водного аммиака в соотношении 2 4 1) Пример 3 (1RS, 2RS, 65Р?)-2-этилоксикарбониламинометил-8-азабицикло[4 3 0]нон-4-ен 3 1 (1RS, 2RS, 6SR)-8-тpeт-бyтилoкcикapбoнил-2-гидроксиметил-8-азабицикло[4 3 0]нон-4-ен Это соединение получают аналогично примеру Е 1 из целевого соединения по примеру 3 1 Выход 81-83% от теории Тпл 160-162°С 1 Н-ЯМР (дейтер хлороформ) 5= 7,79 (м, 2Н, арил-Н), 7,37 (д, 2Н, арил-Н), 5,67 (м, 1Н, Н у С-4), 5,47 (м, 1Н, Н у С-5), 3,78-3,97 (м, 2Н, тозилОСНг~), 3,13-3,42 (м, ЗН, CH2-N), 2,95 (т, 1Н, СН?N), 2,74 (м, 1Н), 2 54 (м, 1Н), 2 47 (с, ЗН, арилСНз), 2,32 (м, 1Н, Н у С-2), 2,06 (м, 1Н, На у С-3), 1,66-1,83 (м, 1Н, НбуС-3), 1 44ч/милл(с, 9Н) 3 3 (1RS, 2RS, 6SR)-8-TpeT -бутилоксикарбонил - 2 -этилоксикарбониламинометил-8-азабицикло[4 3 0]нон-4-ен рац. СН, Это соединение получают аналогично примеру Е 2 из целевого соединения по примеру 3 2 Сырой продукт очищают колоночной хроматографией на силикагеле (63-200 мкм), смесь циклогек-сана с ацетоном в соотношении 2 1 Выход 76% от теории, прозрачное, вязкое масло Rf= 0,35, циклогексан/ацетон (2 1) 1 Н-ЯМР (дейтер тетрахпорэтан, 80°С) 5 = =5,69 (м, 1Н, Н у С-4), 5,47 (д, 1Н, Н у С-5), 4,59 (шир, 1Н, NH), 4,10 (к, 2Н, этокси-СН2), 3,38 (дд, 1Н), 3,32 (м, 1Н), 3,24 (м,1Н) 3,01-3,08 (м, ЗН}, 2,79 (м, 1Н), 2,47 (м, 1Н), 2,07 (м, 2Н), 1,78 (м, 1Н), 1,42 (с, 9Н), 1,22 ч/милл (т, ЗН, этокси-СН3) 3 4 (1RST 2RS, 63Р)-2-этил о кси карбон ил а мином етил-8-азаби цикл о[4 3 0]нон-4-ен нон 16,4 сырого продукта по примеру Ж 4 (соответствует 0,1 моль целевого соединения по примеру Ж 4) растворяют в 100 мл тетрагидрофурана При внутренней температуре 0-5°С прикапывают 22,9 г (0,105 моль) ди-трет-бутилдикарбоната, растворенного в 100 мл тетрагидрофурана, перемешивают 24 часа при 0°С, затем 24 часа - при комнатной температуре Сгущают, сырой продукт очищают колоночной хроматографией на 250 г силикагеля (63-200 мкм) смесью циклогексана и ацетона в соотношении 2 1 Выход 13,7 г (54% от теории) вязкого масла Rf = 0,21 целевое соединение 0,08 целевое соединение по примеру Ж 4 3 2 (1RS, 2RS, 6SR)-8-TpeT-бутилоксикарбонил-2-(4-толуолсульфонилоксиметил)-8-азабицикло[4 3 0]нон-4-ен О NH -. С2Н5О H рацн Это соединение получают аналогично примеру В 3 из целевого соединения по примеру 3 3 Выход 42% от теории Rf = 0,93 целевое соединение по примеру З З 0,23 целевое соединение Смесь растворителей метиленхлорид/метанол/17%-ный водный аммиак в соотношении 15 4 0,5 19 35562 Пример И (1RS, 2RS, 3RS, 6Э1Ч)-2-этилоксикарбониламино-3-метил-8-азабицикло[4 3 0]нон-4-ен И 1 N-[(2E, 4Е)-2,4-гексадиенил]-фталимид Н3С"" Эти соединения получают аналогично примеру Б 4 из целевого соединения по примеру И 3 Выход 70% от теории, смесь двух диастереомеров А и В в соотношении А В = 4 1 Rf = 0,49 (смесь циклогексана и ацетона в соотношении 2 1) И 5 (1RS, 2RS, 3RS, 6SR)-8-TpeT -бутилоксикарбонил - 3 - метил - 8-азабицикло[4 3 0]нон-4-ен2-карбоновая кислота Это соединение получают аналогично примеру Б 1 из (2Е, 4Е)-1-бром-2,4-гексадиена Выход 77-79% от теории Тпл 114-117 вС (проба перекрист из этанола) 1 Н-ЯМР (дейтер хлороформ) 8= 7,85 (м, 2Н), 7,72 (м, 2Н), 6,25 (дд, 1Н), 6,00 (ддд, 1Н). 5,5-5,8 (м, 2Н), 4,29 (д, 2Н), 1,74 ч/милл (д, ЗН) И 2 (2Е, 4Е)-1-амино-2,4-гексадиен сн5 рац Это соединение получают аналогично примеру Б 2 из целевого соединения по примеру И 1 Т кип 40-70°С при 16-18 мбар Выход 67-83% от теории И 3 Этиловый эфир (Е)-4-[(2Е, 4Е)-2,4-гексадиениламино]-2-бутеновой кислоты 1,17 г (21 ммоль)гидрокиси калия растворяют в 20 мл воды, прибавляют 5,9(19 ммоль) целевого соединения по примеру И 4, растворенного в 20 мл метанола, и нагревают с обратным холодильником 48 часов в среде азота Сгущают, поглощают водой, однократно экстрагируют метиленхлоридом, устанавливают уксусной кислотой рН водной фазы, равное 3-4 Осадок отфильтровывают, промывают водой сушат при комнатной температуре, перекристаллизовывают из смеси циклогексана с ацетоном при соотношении 6 1 Выход 2,25 г (42% от теории) Тпл 189°С 1 Н-ЯМР (дейтер диметилсульфоксид) 8 = =5,77 (д, 1Н), 5,61 (м, 1Н), 3,67 (м, 1Н), 3,54 (м, 1Н), 2,61-2,95 (м, 4Н), 2,30 (м, 1Н), 1,82 (м, 1Н), 1,40 (с, 9Н), 0,90 ч/милл (д, ЗН) И 6 (1RS, 2RS, 3RS, 6SR)-8-TpeT -бутилоксикарбонил - 2 - этилоксикарбониламино - 3 - метил8-азабицикло[4 3 0]нон-4-ен ОС2Н5 Это соединение получают аналогично Б 3 из целевого соединения по примеру И 2 Выход 46% от теории 1Н-ЯМР {дейтер хлороформ) 6= 6,98 (дт, 1Н), 5,9-6,25 (м, ЗН), 5,5-5,8 (м, 2Н), 4,19 (к, 2Н), 3,40 (дд, 2Н), 3,27 (Д 2Н), 1,76 (д, ЗН), 1,29 ч/милл (т, ЗН) И 4 Этиловый эфир (1RS, 2RS, 3RS, 6SR)-8трет -бутилоксикарбонил - 3 - метил - 8 - аэабицикло[4 3 0]нон-4-ен-2-карбоновой кислоты (диастереомер А) и этиловый эфир (1RS, 2RS, 3RS, 6SR)-8-TpeT -бутилоксикарбонил-З-метил-8азабицикло-[4 3 0]нон-4-ен-2-карбоновой кислоты (диастереомер В) сн, с,н3о СН3 Это соединение получают аналогично примеру В 2 из 2,25 г (8 ммоль) целевого соединения по примеру И 5 с той разницей, что кипятят в этаноле 8 часов Продукт очищают колоночной хроматографией на 100 г силикагеля (63-200 мкм) смесью растворителей толуола и уксусного эфира в соотношении 2 1 Выход 1,6 г (59% от теории), про 20 35562 зрачное масло. 'Н-ЯМР (дейтер хлороформ): 5= 5,68 и 5,72 (2д, 1Н); 5,61 (м, 1Н); 4,81 (м, 1Н); 4,0-4,2 (м, ЗН); 3,53 (м), 3,62 (м) и 3,72 (дд, 2Н); 3,08 (т, 1Н), 2,92 (т, 1Н), 2,75 (м, 1Н); 2,47 (м, 1Н); 1,83 (м, 1Н), 1,47 (м, 9Н); 1,25 (м, ЗН), 0,97 ч/милл (д, ЗН) И.7. (1RS, 2RS, 3RS, 6SR)-2-3^OKCHKap6oниламино-3-метил-8-азабицикло[4.3.0]нон-4-ен Берут 150,3 г (0,39 моль) целевого соединения по примеру К.1 в 720 мл этанола и прикапывают при охлаждении льдом 173,3 г (2,9 ноль) этилендиамина. Перемешивают 20 часов при комнатной температуре, сгущают в вакууме, разбавляют водой (около 700 мл). Концентрированной соляной кислотой устанавливают рН = 2-3 и трижды экстрагируют по 500 мл дихлорметана. Органическую фазу сушат над сульфатом натрия и сгущают в вакууме. Разделение диастереомеров происходит хроматографически (растворитель смесь циклогексана с ацетоном в соотношении 1:1) Выход: 36,7 г продукта А (45% от теории) Rf = 0,47 (смесь циклогексана и ацетона 1-1) 37,0 г продукта В (45% от теории) Rf = 0,22 (смесь циклогексана и ацетона 1:1). К.З. (1RS, 2RS, 6RS)-2-rnflpoKCHMeT^-8-a3aбицикло[4 3 0]нон-4-ен С2Н5О Это соединение получают аналогично примеру В.З из 1,6 г (4,7 ммоль) целевого соединения по примеру И.6. Выход: 0,7 г (70% от теории) желтоватого масла. Rf = 0,09 (смесь метиленхлорид а, метанола и 17%-ного водного аммиака при соотношении 15:4:0,5. Пример К (1RS, 2RS, НО- Н2 С 6RS)-2-3TOKCHKap6oHmiaMHHOMe тил-8-азабицикло[4.3.0]нон-4-ен К1. Диэтиловый эфир 3-фталимидометилциклогекс-4-ен-1,2-дикарбоновой кислоты 5,2 г (25 ммоль) этил-ClRS, 2RS, 6RS)-9-OKCO8-азабицикло[4.3.0]нон-4-ен-2-карбоксилата (продукт А из примера К.2) растворяют в среде азота в 50 мл тетрагидрофурана и затем прикапывают 130 мл 1,5 М раствора диизобутилалюминийгидрида (195 ммоль). Раствор нагревают 16 часов с обратным холодильником После окончания взаимодействия прикапывают последовательно 60 мл метанола, 30 мл трет.-бутилметилового эфира и 10 мл воды и отфильтровывают с добавкой тонзила. Остаток на нутче дважды размешивают со смесью этанола, конц аммиака и воды в соотношении 101:1 и снова отфильтровывают Объединенные фильтраты сгущают и сырой продукт очищают хроматографией (растворитель: смесь дихлорметана, метанола и конц. аммиака в соотношении 2 4.1). Выход' 2,7 г (71% от теории). 1 Н-ЯМР (дейтер. диметилсульфоксид) 5,69 (м, 1Н, 4-Н); 5,60 (м, 1Н, 5-Н); 3,39 (дд, 1Н, Юа-Н), 3,26 (дд, 1Н, Юб-Н); 2,97 (м, 2Н, 7а-Н, 9а-Н); 2,63 (м, 1Н, 96-Н), 2,38 (бс,1Н,6-Н), 2,32 (дд, 1Н, 76-Н); 2,06 (м, 1Н, За-Н); 1,95 (м, 1Н, 1-Н), 1,77 (м, 1Н, 36Н); 1,44 ч/милл (м, 1Н, 2-Н). К. 4 (1RS, 2RS, 6RS)-8-TpeT-бутоксикарбо-нил2-гидроксиметил-8-азабицикло[4 3.0]нон-4-ен 10,67 (50 ммоль) М-[(Е)-2,4-пентадиенил]фталимида (целевое соединение по примеру Б.1) и 8,61 г диэтилового эфира фумаровой кислоты нагревают с обратным холодильником а 50 мл толуола два дня Смесь сгущают и осадок хроматографируют на силикагеле (растворитель смесь циклогексана и ацетона в соотношении 8:1). Выход- 14,8г(77%оттеории). Т пл . 80-84°С К 2. Этил-CIRS, 2RS, 6RS)-9-OKCo-8-a3a6nцикло[4.3 0]нон-4-ен-2-карбоксилат(диастереомер А) и 3Tnn-(1RS, 2RS, 6SR)-9-OKCO-8-a3a6n4HKло[4.3.0]нон-4-ен-2-карбоксилат (диастереомер В) EtOOC 21 35562 но н,с - Н2С Это соединение получают аналогично примеру 3 1 из 8,87 г (58 ммоль) соединения по примеру КЗ Выход 11,0 г (75% от теории) Rf = 0,25 (смесь циклогексана и ацетона в соотношении 2 1) К 5 (1RS, 2RS, 6RS)-8-TpeT-6ymnoKCMKap6oнил- 2 -(4-толуолсульфонилоксиметил-8-азабицикло[4 3 0]нон-4-ен Раствор азидосоединения из примера К 6 (21,6 г, 78 ммоль) в 150 мл смеси пиридина с водой при соотношении 5 1 насыщают, при охлаждении льдом, сероводородом и затем выдерживают 20 часов при комнатной температуре После окончания взаимодействия сгущают в вакууме, многократно перегоняют с толуолом и остаток хроматографируют (растворитель смесь циклогексана и ацетона в соотношении 1 1} Выход 11,0 г (66% от теории) Rf= 0,12 (смесь циклогексана и ацетона в соотношении 1 1) К 8 (1RS, 2RS, 6RS)-8TpeT -бутилоксикарбо-нил - 2 (этилоксикарбониламино) - 8 азабицик-ло[4 3 0]нон-4-ен SO, - Н,С Н,С рац. О - НС Это соединение получают аналогично примеру Е 1 из соединения по примеру К 4 Выход 97% от теории Rf = 0,40 (смесь циклогексана и ацетона в соотношении 2 1) Кб (1RS, 2RS, 6Р5)-8-трет-бутилоксикарбонил-2-азидометил-8-азабицикло[4 3 0]нон-4-ен СН, г рац. 3,7 г (15 ммоль) (1RS, 2RS, 6RS)-8-TpeT-бутилоксикарбонил - 2 аминометил - 8- азабицик-ло[4 3 0]нон-4-ена помещают в 40 мл диоксана и 15 мл воды, прибавляют 2,3 г (16 ммоль) карбоната калия и прикапывают 1,75 г (16 ммоль) этилового эфира хлормуравьинои кислоты при комнатной температуре После двухчасового перемешивания сгущают в вакууме, остаток поглощают дихлорметаном (70 мл), дважды обрабатывают встряхиванием с 20 мл воды, сушат над сульфатом натрия и сгущают Сырой продукт очищают хроматографией (смесь циклогексана и воды в соотношении 2 1) Выход 2,8 г (59% от теории) Rf= 0,53 (смесь циклогексана с водой в соотношении 1 1) К 9 (1RS, 2RS, 6RS)-2-(этoкcикapбoнилaминoметил)-8-азабицикло[4 3 0]нон-4-ен Раствор 33 г (0,08 моль) (1RS, 2RS, 6RS)-8трет -бутилоксикарбонил-2-(4-толуолсульфонилоксиметил)-8-азабицикло[4 3 0]нон-4-ена (целевое соединение по примеру К 5) и 15,8 г (0,24 моль) азида натрия перемешивают в 200 мл N.N-диметилформамида при 70°С 40 часов Охлажденный раствор разбавляют водой (500 мл) и трижды экстрагируют по 250 мл петролейного эфира Объединенные органические фазы промывают 5%-ным раствором бикарбоната натрия, сушат сульфатом натрия и сгущают Выход 21,6 г (97% от теории) 1 Н-ЯМР (дейтер хлороформ) 5,71 (м, 1Н, С=СН), 5,58 (м, 1Н, С=СН), 3,61-3,22 (м, 5Н), 3,10 (м, 1Н), 2,70 (бс, 1Н), 2,24 (м, 2Н), 1,91 (м, 2Н), 1,47 ч/милл (с, 9Н, трет -бутил) К 7 (1RS, 2RS, 6RS}-8-TpeT-бутилоксикарбонил-2-аминометил-8-азабицикло[4 3 0]нон-4-ен W о MJO^ "HN- Н 3 NH рац. н 7,6 г (23 ммоль) продукта по примеру Кб помещают в 100 мл смеси метанола с водой в соотношении 1 1 и прибавляют при комнатной температуре 30 мл полуконцентрированной соляной ки 22 35562 слоты. После окончания выделения газа продолжают перемешивать 30 минут, разбавляют ледяной водой (около 100 мл) и устанавливают концентрированной натриевой щелочью рН= 12 Водную фазу четыре раза экстрагируют по 100 мл дихлорметана Экстракты объединяют, сушат сульфатом натрия и сгущают в вакууме Выход- 3,9 г (76% от теории). Rf = 0,45 (смесь дихлорметана, метанола и конц. аммиака в соотношении 2:4:0,1). Пример Л (1RS, 2RS, 6(33)-2-аминометил-8-азабицикло[4.3.0]нон-4-ен-бис-трифторметансульфонат но - н 2 с 2 рац. Продукт по примеру М.1 подвергают превращению аналогично примеру К.4 Выход. 64% от теории Rf = 0,23 (смесь циклогексане и ацетона в соотношении 2:1) МЗ (1RS, 2RS, 6SR)-8-TpeT.-6y™iOKcnKap6oнил-2-(4-толуолсульфонилоксиметил)-8-азабицикло[4 3 0]нон-4-ен H,N- H х 2 CFjCOOH рац. Раствор 2,0 г (8 ммоль) (1RS, 2R8, 6Е5)-8-трет -бутилоксикарбонил - 2 аминометил-8-азаби-цикло[4 3.0]нон-4-ена (продукт по примеру К.7) в 30 мл дихлорметана смешивают с 30 мл три-фторуксусной кислоты и выдерживают 30 минут при комнатной температуре. Растворитель и кислоту отгоняют в присутствии толуола, многократно экстрагируют толуолом. Продукт сушат в вакуумном эксикаторе над смесью гидроокиси калия и пятиокиси фосфора в соотношении 1.1. Выход. 1,5 г коричненвого масла. 1 Н-ЯМР (дейтер. диметилсульфоксид): 5,78 (м, 1Н, С=СН); 5,60 (м, 1Н, ОСИ); 3,34 (м, 2Н); 3,03 (м, 1Н), 2,87 (м, 2Н), 2,73 (м, 1Н), 2,45 (м, 1Н), 2,34 (м, 1Н);2,22(м, 1Н), 1,94ч/милл (м, 2Н). Масс-спектр (бомбардировка быстрыми атомами) М + 1 = 153. Пример М (1RS, 2RS, 6SR)-2-3TOKCHKap6oHHnaMHHoметил-8-азабицикло[4 3.0]нон-4-ен {продукт идентичен соединению по примеру Е) М1 (1RS, 2RS, 65Р)-2-гидроксиметил-8-азабициклоІ4.3.0]нон-4-ен н,с Это соединение получают из продукта по примеру М.2 аналогично примеру Е 1. Выход: 91-98% от теории. Rf= 0,59 (смесь циклогексана и ацетона в соотношении 2:1). М.4. (1RS, 2RS, 63Р)-8-трет.-бутилоксикарбонил-2-азидометил-8-аэабицикло[4 3 0]нон-4-ен рац. Раствор 13,0 г (32 ммоль) продукта, по примеру М 3, в 80 мл М,М-диметилформамида смешивают с 4,15 г (64 ммоль) азида натрия и перемешивают 4 часа при 70°С. Затем прибавляют такое же количество азида натрия и перемешивают еще 6 часов при 100°С Затем обрабатывают, как описано в примере К 6 Выход. 7,0 г (79% от теории) Rf= 0,55 (смесь циклогексана с ацетоном в соотношении 2:1). М.5. (1RS, 2RS, 6SR)-8-TpeT.-6yTWioKcHKap6oнил-2-аминометил-8-азабицикло[4 3.0]нон-4-ен НО - Н2С І 2RS [4 3 0]нон-2-карбоксилат (продукт В из примера К.2) подвергают превращению аналогично примеру К 3 Выход: 75% от теории. Rf = 0,22 (смесь дихлорметана, метанола и конц. аммиака в соотношении 15 4:0,5). М.2 (1RS, 2RS, 6SR)-8-TpeT.-6y™moKCHKap6oнил-2-гидроксиметил-8-азабицикло[4.3.0]нон-4-ен H?N - Н,С 2 г н у .4 рац. 23 о t 35562 Это соединение получают превращением азидосоединения, по примеру М.4, аналогично примеру К. 7 Очищают хроматографией (смесь метанола, дихлорметана и конц. аммиака в соотношении 15:2:0,1) НООС Мл Выход: 75% от теории Rf = 0,12 (смесь метанола, дихлорметана и конц. аммиака в соотношении 15:2 0,1). М.6 (1RS, 2RS, 6SR)-8-TpeT. -бутил о кепка рбонил -2-(этилоксикарбониламинометил)-8-азабицикло[4 3.0]нон-4-ен рац. 8,36 г (40 ммоль) этил-(1 RS, 2RS, 6RS)-9-OKCO8-азабицикло[4 3.0] нон-4-ен-2-карбоксилата (продукт А по примеру К.2) перемешивают с 30 мл воды и 5 г конц. серной кислоты 40 часов при 60°С. При охлаждении выпадает продукт Осадок промывают небольшим количеством холодной воды и сушат в вакуумном сушильном шкафу при 50°С Выход. 4,80 г (66% от теории) іН-ЯМР (дейтер. диметилсульфоксид): 12,35 (с, 1Н, СООН); 7,60 (с, 1Н, лактам-NH); 5,74 (м, 1Н, С=СН ); 5,59 (м, 1Н, С=СН ), 3,45 (дд, 1Н, 7а-Н); 2,95-2,85 (м, 4Н, 1-Н, 2-Н, 6-Н, 76-Н); 2,29 (м, 1Н, За-Н); 2,00 ч/милл (м, 1Н, Зб-Н). Н.2. (1RS, 2RS, 6RS)-2-3TOKCHKap6oHMnaMHHO9-оксо-8-азабицикло(4 3.0]нон-4-ен О С2Н50 рац. 4,3 г (17 ммоль) аминосоединения, по примеру М.5, и 1,9 г (19 ммоль) триэтиламина помещают в 50 мл дихлорметана, прикапывают при 0°С 2,2 г (20 ммоль) этилового эфира хлормуравьиной кислоты, растворенного в 10 мл дихлорметана, и перемешивают 24 часа при комнатной температуре. Раствор смешивают с водой (50 мл) и разделяют фазы. Водную фазу экстрагируют трижды дихлорметаном по 40 мл Органические фазы обьединяют, сушат сульфатом натрия и сгущают. Выход" 5,3 г (96% от теории) іН-ЯМР (дейтер. тетрахлорэтан, 80°С)- 5,79 (ддд, 1Н, С=СН ), 5,58 (м, 1Н, С=СН ); 4,61 (бс, 1Н, карбомат-NH), 4,23 (м, 1Н); 4,12 (к, 2Н, этил-СН2), 3,99 (м, 1Н), 3,20-3,08 (м, 2Н); 2,82 (м, 2Н), 2,25 (м, 2Н), 2,09 (м, 1Н), 1,84 (м, 2Н), 1,42 (с, 9Н, третбутил), 1,37 ч/милл (т. ЗН, этил-СНз) М.7. (1RS, 2RS, 6SR)-2-(3T0KCHKap60HnnaMHнометил)-8-аэабицикло[4 3.0]нон-4-ен Это соединение получают превращением (1RS, 2RS, 6RS)-9-OKCO-8-a3a6H4Htoio[4 3.0]нон-4ен-2-карбоновой кислоты (иелевое соединение по примеру Н 1) аналогично примеру В.2. Выход- 68% от теории Rf = 0,06 (смесь цикпогексана и ацетона в соотношении 1.1) Н.З (1RS, 2RS, 6RS)-2-мeтилaминo-8-aзaбицикло[4 3 0]нон-4-ен О СгН3О рац. HN - Нг С Это соединение получают превращением (1RS, 2RS, 65Н)-8-третбутоксикарбонил-2-(эток-сикарбониламинометил)8-аэабицикло[4.3.0]нон-4-ена, как описано в примере К 9 Выход: количественный. Rf = 0,55 (смесь метанола, дихлорметана и конц. аммиака в соотношении 15 4:0,5) Пример Н (1SR, 2RS,6RS)-2-MeTnnaMHHO-8-a3a6^HKno[4.3.0]нон-4-ен Н.1. (1RS, 2RS, 6РЗ}-9-оксо-8-азабицикло[4 3.0]нон-4-ен-2-карбоновая кислота Целевое соединение получают взаимодействием продукта по примеру Н.2 с 10 эквивалентами диизобутилалюминийгидрида аналогично примеру К.З и обрабатывают, как описано в этом примере Выход' 51% от теории 1 Н-ЯМР (дейтер. хлороформ) 5,72 (м, 1Н, С=СН ), 5,68 (м, 1Н, С=СН ); 3,19-3,10 (м, 2Н), 2,88 (дд, 1Н); 2,60 (дд, 1Н), 2,50 (м, 1Н), 2,44 (с, ЗН, NСНз); 2,33-2,28 (м, 2Н), 2,19 (м, 1Н), 1,89 ч/милл (м, 1Н). 24 35562 Пример О (1SR, 2SR, 6РЭ)-2-метиламино-8-азабицикло[4.3.0]нон-4-ен О.1. (1SR, 2SR, 6РЗ)-9-оксо-8-азабицикло[4.3.0]нон-4-ен -2-карбоновая кислота обработкой, как описано в этом примере. Выход: 81% от теории Л Н-ЯМР (дейтер. хлороформ). 5,72 (м, 1Н, С=СН); 5,50 (м, 1Н, С=СН), 3,04-2,77 (м, 6Н), 2,60 (м, 1Н); 2,49 (с, ЗН, N-CH3); 2,31 (бс, 2Н, 2х NH); 2,25 (м, 1Н); 1,89 ч/милл (м, 1Н). Получение активных соединений: Пример 1 8-азабицикло[4 3 0]нон-2-ен-8-ил)-1-циклопропил-6,8-дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновая кислота рац. Берут 0,2 г конц серной кислоты, 25 мл воды и 25 мл уксусной кислоты при 60"С Небольшими порциями добавляют 9,8 г (50 ммоль) продукта по примеру Е.З. Перемешивают 5 часов при 60DC. Для обработки прибавляют раствор 0,8 г бикарбоната натрия в 10 мл воды и сгущают в вакууме. Остаток суспендируют в 40 мл воды и добавлением конц. натриевой щелочи при охлаждении льдом переводят в раствор. После того, как отфильтровывают нерастворившуюся часть, подкисляют полуконцентрированной соляной кислотой и опять охлаждают до 0°С Выпавший продукт промывают небольшим количеством холодной воды и затем сушат в вакуумном сушильном шкафу при 50°С Выход: 4,8 г (53% от теории). Тпл." 192-1ЭЗ°С О.2. (1RS, 2SR, 6RS)-2-этoкcикapбoнилaминo9-оксо-8-азабицикло[4 3.0]нон-4-ен X * Это соединение получают превращением (1RS, 2SR, 6RS)-9-OKCO-8-a3a6n4HKno[4.3.0]HOH-4ен-2-карбоновой кислоты (целевое соединение по примеру 0 1) аналогично примеру В 2. Выход: 68% от теории Т.пл. 160-164°С. О.З. (1RS, 2RS, 6RS)-2-Me^aMMHO-8-a3a6Hцикло[4.3 0]нон-4-ен рац. Это соединение получают превращением продукта по примеру 0.2 с 10 эквивалентами диизобутилапюминийгидрида аналогично примеру К.З и СОгН 1,4 г (5 ммоль) 1-циклопропил-6,7,8-трифтор1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты, 0,6 г (5 ммоль) 1,4-диазабицикло [2.2.2}октана и 0,8 г (6 ммоль) целевого соединения по примеру А нагревают в смеси 15 мл ацетонитрилэ и 7,5 мл диметилформамида 3 часа с обратным холодильником. После охлаждения прибавляют 25 мл воды и 2,5 мл уксусной кислоты. Осадок отфильтровывают, промывают водой, сушат при 50°С. Выход' 1,8 г (93% от теории). Т.пл/ 224-226°С Элементарный анализ- С21H20F2N2O3. С Н N F Рассчитано: 65,3 5,2 7,3 9,8 Найдено 65,35 5,15 7,25 9,7 Пример 2 (1'RS, 2'RS, 6^)-1-циклопропил-7-(2'-этилоксикарбонил -8'-азабицикло[4 3.0]нон-4'-ен-8'-ил)6,8-дифтор-1,4-дигидро -4-оксо-З-хинол и н карбоновая кислота рац. 0,7 г (2,5 НаСгОаС н ммоль) 1 А циклопропил6,7,8-три-фтор-1,4-дигидро-4-оксо-3хинолинкарбоновой кислоты, 0,3 г (2,5 ммоль) 1,4диазабицикло[2.2 2]-октана и 0,6 г (3 ммоль) соединения А по примеру Б нагревают в смеси 10 мл ацетонитрила и 5 мл диметилформамида в течение 5 часов с обратным холодильником. После охлаждения прибавляют 30 мл воды и 1 мл уксусной кислоты, осадок отфильтровывают, 25 35562 промывают водой, сушат в эксикаторе над гидроокисью калия Выход 0,95 г (83% от теории) Тпл 212-214°С Элементарный анализ C24H24F2N2O5 С N Н F Рассчитано 62,9 5,2 6,1 8,3 Найдено 62,7 5,3 у С-31), 2,63 (м, 1Н> Н у C-6'h 1,96-2,09 (м, 2Н, Н у С-1' и Нб у С-3'), 1,08-1,32 ч/милл (м, 7Н, циклопропил-СНг и этокси-СНз) Пример 4 (1'SR, 2'RS, 6'5Н)-7-(2'-амино-8'-азабицикло[4 3 0]нон-4'-ен-8'-ил) -1 - циклопропил-6,8-дифтор1,4-дигидро-4-оксо-3 -хинолинкарбоновая кислота 6,1 8,3 1 Н-ЯМР (дейтер диметилсульсроксид) 8 = = 8,62 (с, 1Н, НуС-2), 7,72 (Д, 1Н, НуС-5), 5,91 (д, 1Н, Н у С-5'), 5,76 (м, 1Н, Н у С-41), 4,05-4,19 {м, ЗН, этокси-СНг и циклопропил-СН), 3,84 (м, 1Н, CH2N), 3,76 (м, 2Н, CH2N), 3,53 (м, 1Н, CH2N), 2,84 (м, 1Н, Н у С-2'), 2,43-2,58 (М, 2Н, На У С-3' и Н у С61), 2,33 (м, 1Н, Нб у С-31), 1,94 (м, 1Н, Н у С-1'), 1,22 (т, ЗН, этокси-СНз), 1,07-1,26 ч/милл (м, 4Н, циклопропил-СНг) Пример 3 (1'SR, 2'RS, 6^)-1-циклопропил-7-(2"-этилоксикарбониламино- 8'-азабицикло[4 3 0]нон-4'-ен8-ил) - 6,8-дифтор -1,4-дигидро-4-оксо-3-хинолинкарбоновая кислота рац. 2,55 г (5 ммоль) целевого соединения по примеру 3 нагревают в смеси 50 мл 10%-ной калиевой щелочи и 25 мл 1,2-этандиола 3 часа с обратным холодильником После охлаждения прибавляют 50 мл метанола, соляной кислотой (конц соляная кислота с водой в соотношении 1 3) устанавливают рИ = 2-3, энергично перемешивают, снова отфильтровывают, промывают небольшим количеством воды, сушат при 50°С Выход 1,95 г (88% от теории) целевого соединения в виде аддукта с 1 молем соляной кислоты и 0,5 моля воды Т пл > 300°С Элементарный анализ C21H21F2N3O3X HCI х 1/2Н2О С С02Н рац. 2,8 г {10 ммоль) 1-циклопропил-6,7,8-трифтор1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты, 1,1 г (10 ммопь) 1,4-диазабицикло[2 2 2]октана и 2,6 г (12 ммоль) целевого соединения по примеру В нагревают в смеси 30 мл ацетонитрила и 15 мл диметилформамида в течение 3 часов с обратным холодильником После охлаждения прибавляют 45 мл воды и 5 мл уксусной кислоты, осадок отфильтровывают, промывают водой, сушат при 50°С Выход 4,8 г (94% от теории) целевого соединения в виде аддукта с 0,5 моля диметилформамида Тпл 239-245°С Элементарный анализ C24H25F2N3O5 х 1/2 C3H7NO С Рассчитано Найдено 1 Н N F 60,1 5,6 9,6 5,85 9,7 N CI F Рассчитано 56,4 5,2 9,4 8,0 8,5 Найдено 56,1 5,35 9,4 7,45 8,25 1 Н-ЯМР (CF3CO2D) 5 = 9,24 (с, 1Н, Н у С-2), 8,06 (д, 1Н, Н у С-5), 6,03 (д, 1Н, Н у С-51), 5,88 (м, 1Н, Н у С-41), 4,47 (м, 1Н), 4,37 (м, 1Н), 4,22 (м, 2Н), 4,04 (м, 1Н), 3,96 (м, 1Н, Н у С-7791, Н у С-2, циклопропил-СН), 2,99 (м, 1Н, На у С-3'), 2,84 (м, 1Н, Н у С-61), 2,58 (м 1Н, Нв у С-3'), 2,48 (м, 1Н, Н у СТ), 1,57 (м, 2Н, циклопропил-СНг), 1,42 ч/милл (м, 2Н, циклопропил-СНг) Пример 5 (1 SR, 2'RS, 6^)-1-циклопропил-7-(2'-этилоксикарбонилэмино-8'-азабицикло[4 3 0]нон-4'-ен8'-ил)-6-фтор-1,4-дигидро-4-оксо-3-хинолинкарбоновая кислота рац. 7,5 60,35 Н 7,35 Н-ЯМР (дейтер хлороформ) 5= 8,69 (с, 1Н, Н у С-2), 7,75 (д, 1Н, Н у С-5), 5,84 (д, 1Н, Н у С-51), 5,74 (м, 1Н, Н у С-41), 4,15 (м, 2Н, этокси-СН2), 3,874,05 (м ЗН), 3,82 (м, 1Н), 3,64-3,57 (м, 2Н), Н уС7791, НуС-2г, циклопропил-СН), 2,73 (м, 1Н, На А
ДивитисяДодаткова інформація
Назва патенту англійською7-isoindolinylquinolone and 7-isoindolinylphthyridone derivatives
Автори англійськоюPhilipps Thomas, Bartel Stephan, Krebs Andreas, Petersen Uwe, Schenke Thomas, Bremm Klaus-Dieter, Endermann Rainer, Metzger Karl Georg, Mielke Burkhard
Назва патенту російськоюПроизводные 7-изоиндолинилхинолона и 7-изоиндолинилнафтиридона
Автори російськоюФилиппс Томас, Бартел Стефан, Кребс Андреас, Петерсен Уве, Шенке Томас, Бремм Клаус-Дитер, Эндерманн Райнер, Метцгер Карл Георг, Мелке Буркхард
МПК / Мітки
МПК: C07D 491/20, C07D 209/44, A61K 31/435, C07D 498/06, C07D 471/06, A61P 31/04, A61K 31/55, C07D 401/04, A61K 31/535, C07D 215/56, A61K 31/5383, C07D 519/00, C07D 513/04, C07D 495/04, A61K 31/4709, C07D 471/04, C07D 491/18, A61K 31/47, C07D 513/06, A61K 31/54, A61K 31/4375, C07D 513/16
Мітки: 7-ізоіндолінілнафтирідону, 7-ізоіндолінілхінолону, похідні
Код посилання
<a href="https://ua.patents.su/55-35562-pokhidni-7-izoindolinilkhinolonu-i-7-izoindolinilnaftiridonu.html" target="_blank" rel="follow" title="База патентів України">Похідні 7-ізоіндолінілхінолону і 7-ізоіндолінілнафтирідону</a>
Попередній патент: Регенеративний теплообмінник і спосіб його експлуатації
Наступний патент: Похідні n-арилгідразину, спосіб їх одержання, спосіб пригнічення комах та композиція для пригнічення комах
Випадковий патент: Повітряний холодильник