Сполука с-фенілгліцитолу для лікування діабету
Номер патенту: 95635
Опубліковано: 25.08.2011
Автори: Амада Хідеакі, Хасімото Юко, Кобасі Йохеі, Такахасі Хітомі, Івата Юкі, Оі Такахіро, Какінума Хіроюкі
Формула / Реферат
1. Сполука С-фенілгліцитолу, представлена формулою (І), наведеною нижче, або її фармацевтично прийнятна сіль, або її гідрат,
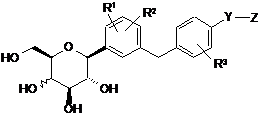 , (I)
, (I)
де
R1 і R2 є однаковими або різними і являють собою атом водню, гідроксильну групу, С1-6алкільну групу, С1-6алкоксигрупу або атом галогену,
R3 є атомом водню, С1-6алкільною групою, С1-6алкоксигрупою або атомом галогену,
Y є С1-6алкіленовою групою, -О-(СН2)n- (n являє собою ціле число, що приймає значення від 1 до 4) або С2-6алкеніленовою групою, за умови, що, коли Z є -NHC(=NH)NH2 або -NHCON(RB)RC, n не дорівнює 1,
Z є -CONHRA, -NHC(=NH)NH2 або -NHCON(RB)RC,
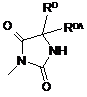 або
або  ,
,
де RA є
С1-6алкільною групою, заміщеною 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи, аміногрупи і карбамоїльної групи,
RB є
(1) атомом водню,
(2) С1-6алкільною групою, що може бути заміщена 1-3 замісниками, вибраними з групи А,
(3) С3-12циклоалкільною групою, що може бути заміщена 1-3 замісниками, вибраними з гідроксильної групи і С1-6гідроксіалкільної групи,
(4) 3-12-членною гетероциклоалкільною групою або 5-13-членною гетероарильною групою, що може бути частково насиченою; кожна з яких містить від одного до трьох циклоутворюючих атомів, вибраних з групи, яка складається з О, N, S, SO2, CO і NR10 (R10 є атомом водню, С1-6алкільною групою, феніл-С1-6алкільною групою або С2-6алкоксикарбонільною групою), і може бути заміщена 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи і С1-6гідроксіалкільної групи, або
(5) С6-13арильною групою, що може бути частково насиченою і може бути заміщена 1 або 2 замісниками, вибраними з гідроксильної групи і С1-6алкільної групи, феніл-С1-6алкільної групи і С1-6алкілсульфонільної групи, кожна з яких може бути заміщена гідроксильною(ими) групою(ами),
де
група А складається з
атома галогену, гідроксильної групи, С1-6алкоксигрупи, яка може бути заміщена гідроксильною(ими) групою(ами), карбоксильною групою, С2-6алкоксикарбонільною групою, карбамоїльною групою, аміногрупою, С1-6алкіламіногрупою, діС1-6алкіламіногрупою, С2-6ациламіногрупою, С1-6алкілтіогрупою, що може бути заміщена гідроксильною(ими) групою(ами);
феноксигрупи,
фенільної групи, яка може бути заміщена 1-3 замісниками, вибраними з групи В (група В складається з гідроксильної групи, атома галогену, С1-6алкоксигрупи, С1-6алкільної групи, яка може бути заміщена гідроксильною(ими) групою(ами), С1-6алкілтіогрупою, тієнільною групою, фенілтіогрупою, що може бути заміщена гідроксильною(ими) групою(ами) або С1-6гідроксіалкільною(ими) групою(ами) і піперидиногрупою, що може бути заміщена гідроксильною(ими) групою(ами) або С1-6гідроксіалкільною(ими) групою(ами));
С3-12циклоалкільної групи, яка може бути заміщена 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи і С1-6гідроксіалкільної групи;
3-12-членної гетероциклоалкільної групи або 5-13-членної гетероарильної групи, яка може бути частково насиченою; кожна з яких містить від одного до трьох циклоутворюючих атомів, вибраних з групи, яка складається з О, N, S, SO2, CO і NR10 (R10 є атомом водню, С1-6алкільною групою, феніл-С1-6алкільною групою або С2-6алкоксикарбонільною групою), і може бути заміщена 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи і С1-6гідроксіалкільної групи, і
-CONRВ1RВ2, де RВ1 і RВ2 разом з атомом азоту, до якого вони приєднані, утворюють 5-6-членну гетероциклоалкільну групу, що може містити як ще один циклоутворюючий атом атом кисню, атом азоту або атом сірки, і може бути заміщена 1 або 2 замісниками, вибраними з групи, яка складається з С1-6алкільної групи, яка може бути заміщена гідроксильною(ими) групою(ами), С2-6алкоксикарбонільною групою і феніл-С1-6алкільною групою,
RС є
атомом водню, С1-6алкільною групою, що може бути заміщена 1 або 2 замісниками, вибраними з групи, яка складається з гідроксильної групи, діС1-6алкіламіногрупи, С2-6алкоксикарбонільної групи і С1-6алкоксигрупи або С3-12циклоалкільної групи, яка може бути заміщена гідроксильною(ими) групою(ами); і
RB і RС разом з атомом азоту, до якого вони приєднані, можуть утворювати 3-12-членну гетероциклоалкільну групу або 5-13-членну гетероарильну групу, що може бути частково насиченою; кожна з яких може містити 1 або 2 циклоутворюючі атоми, вибрані з О, N, NR11, S, SO2 і CO, і яка може бути заміщена 1 або 2 замісниками, вибраними з групи, яка складається з гідроксильної групи, С2-6алкоксикарбонільної групи, карбамоїльної групи, С2-6ацил(С1-6алкіл)аміногрупи, діС1-6алкіламінокарбонільної групи, піролідинільної групи, морфоліногрупи, піролідин-1-ілкарбонільної групи, С1-6алкільної групи, яка може бути заміщена 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи, піролідин-1-ільної групи, фенільної групи і С2-6алкоксикарбонільної групи, і фенільної групи, яка може бути заміщена 1-3 замісниками, вибраними з групи, яка складається з С1-6алкільної групи, С1-6алкоксигрупи і атома галогену,
де R11 є атомом водню, С2-6ацильною групою, фенільною групою, що може бути заміщена гідроксильною(ими) групою(ами), піридильною групою, фурилкарбонільною групою, оксоланілкарбонільною групою, С2-6алкоксикарбонільною групою або С1-6алкільною групою, що може бути заміщеною 1 або 2 замісниками, вибраними з групи, яка складається з гідроксильної групи, фенільної групи, діС1-6алкіламіногрупи, морфоліногрупи і піролідин-1-ілкарбонільної групи, і
RD є атомом водню або С1-6алкільною групою, що може бути заміщеною 1 або 2 замісниками з групи, яка складається з гідроксильної групи, С3-12циклоалкільної групи, фенільної групи, яка може бути заміщена гідроксильною(ими) групою(ами), піридильною групою, С2-6алкоксикарбонільною групою, імідазолільною групою і 1-бензилімідазолільною групою, і RDA є атомом водню або С1-6алкільною групою.
2. Сполука С-фенілгліцитолу за п. 1, яка є сполукою С-фенілглюциту, представленою Формулою (II), наведеною нижче, або її фармацевтично прийнятною сіллю, або її гідратом,
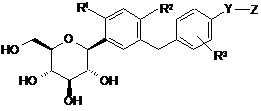 , (II)
, (II)
де R1, R2, R3, Y і Z є такими ж, як визначено у п. 1.
3. Сполука С-фенілгліцитолу або її фармацевтично прийнятна сіль, або її гідрат за п. 2, в якій R1 є атомом водню, гідроксильною групою, С1-4алкільною групою або С1-4алкоксигрупою, і R2 є С1-4алкільною групою або атомом галогену.
4. Сполука С-фенілгліцитолу за п. 2 або 3 або її фармацевтично прийнятна сіль, або її гідрат, де R3 є атомом водню.
5. Сполука С-фенілгліцитолу або її фармацевтично прийнятна сіль, або її гідрат за п. 3 або 4, в якій Y є С1-6алкіленовою групою або -О-(СН2)n- (n являє собою ціле число від 2 до 4), і Z є -NHCON(RB)RC, де RB і RC визначені у п. 1.
6. Сполука С-фенілгліцитолу або її фармацевтично прийнятна сіль, або її гідрат за п. 3 або 4, в якій
Y є С1-6алкіленовою групою або -О-(СН2)n- (n являє собою ціле число, що приймає значення від 2 до 4), і Z є -NHCON(RB)RC,
де
RB є
(1) С1-6алкільною групою, що може бути заміщена 1-3 замісниками, вибраними з групи А,
(2) С3-12циклоалкільною групою, що може бути заміщена 1-3 замісниками, вибраними з гідроксильної групи і С1-6гідроксіалкільної групи,
(3) 3-12-членною гетероциклоалкільною групою або 5-13-членною гетероарильною групою, що може бути частково насиченою; кожна з яких містить від одного до трьох циклоутворюючих атомів, вибраних з групи, яка складається з О, N, S і NR10 (R10 є атомом водню, С1-6алкільною групою, феніл-С1-6алкільною групою або С2-6алкоксикарбонільною групою), і може бути заміщена 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи і С1-6гідроксіалкільної групи, або
(4) С6-13арильною групою, що може бути частково насиченою і може бути заміщена 1 або 2 замісниками, вибраними з гідроксильної групи і С1-6алкільної групи, феніл-С1-6алкільної групи і С1-6алкілсульфонільної групи, кожна з яких може бути заміщена гідроксильною(ими) групою(ами),
в яких
група А складається з
атома галогену, гідроксильної групи, С1-6алкоксигрупи, яка може бути заміщена гідроксильною(ими) групою(ами), С2-6алкоксикарбонільною групою, карбамоїльною групою, діС1-6алкіламіногрупою, С1-6алкілтіогрупою, що може бути заміщена гідроксильною(ими) групою(ами),
феноксигрупи, тієнільної групи, бензотієнільної групи, фурильної групи,
фенільної групи, яка може бути заміщена 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи, атома галогену, С1-6алкоксигрупи, С1-6алкільної групи, яка може бути заміщена гідроксильною(ими) групою(ами), С1-6алкілтіогрупою, фенілтіогрупою, що може бути заміщена гідроксильною(ими) групою(ами), або С1-6гідроксіалкільною(ими) групою(ами) і піперидиногрупою, що може бути заміщена гідроксильною(ими) групою(ами), або С1-6гідроксіалкільною(ими) групою(ами),
С3-12циклоалкільної групи, яка може бути заміщена 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи і С1-6гідроксіалкільної групи;
3-12-членної гетероциклоалкільної групи, що містить від одного до трьох циклоутворюючих атомів, вибраних з групи, яка складається з О, N, S і NR10 (R10 є атомом водню, С1-6алкільною групою, феніл-С1-6алкільною групою або С2-6алкоксикарбонільною групою), і може бути заміщена 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи і С1-6гідроксіалкільної групи; і
4-С1-6алкілпіперидин-1-ілкарбонільної групи,
RС є атомом водню, і
RВ і RС разом з атомом азоту, до якого вони приєднані, можуть утворювати піперидинову групу, що може бути заміщена піролідинільною групою або С1-6алкільною групою, що заміщена діС1-6алкіламіногрупою або піролідин-1-ільною групою, або тіоморфоліновою групою, або декагідроізохіноліновою групою.
7. Сполука С-фенілгліцитолу або її фармацевтично прийнятна сіль, або її гідрат за будь-яким з пп. 2-4,
в якій
Y є С1-6алкіленовою групою,
Z є -CONHRA,
де
RA є С1-6алкільною групою, заміщеною 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи і карбамоїльної групи.
8. Сполука С-фенілгліцитолу або її фармацевтично прийнятна сіль, або її гідрат за будь-яким з пп. 2-4, де
Y є С1-6алкіленовою групою, і
Z є -NHC(=NH)NH2.
9. Сполука С-фенілгліцитолу або її фармацевтично прийнятна сіль, або її гідрат за будь-яким з пп. 2-4, в якій
Y є С1-6алкіленовою групою, і
Z є
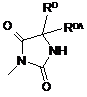 ,
,
RD є С1-6алкільною групою, що заміщена С3-12циклоалкільною групою або фенільною групою; і RDA є атомом водню або С1-6алкільною групою.
10. Сполука С-фенілгліцитолу за п. 1, яка є сполукою С-фенілгалацитолу, представленою формулою (III), наведеною нижче, або її фармацевтично прийнятною сіллю, або її гідратом,
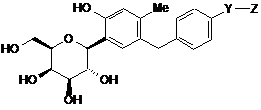 , (ІІІ)
, (ІІІ)
де
Y є С1-6алкіленовою групою, і
Z є -CONHRA,
де
RA являє собою С1-6алкільну групу, заміщену 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи і карбамоїльної групи.
11. Сполука С-фенілгліцитолу за п. 1, яка є сполукою С-фенілглюциту, представленою формулою (IV), наведеною нижче, або її фармацевтично прийнятною сіллю, або її гідратом,
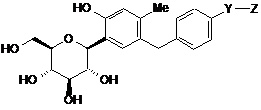 , (IV)
, (IV)
де
Y є С1-6алкіленовою групою, і
Z є -CONHRA1, -NHC(=NH)NH2 або -NHCORВ1,
де
RA1 є С1-6алкільною групою, заміщеною 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи, аміногрупи, карбамоїльної групи, і
RВ1 є
С1-6алкіламіногрупою, що може бути заміщена 1-3 гідроксильними групами, або 4-С1-6алкілпіперазин-1-ілкарбонільною групою, або 4-С1-6алкілпіперазин-1-ільною групою.
12. Сполука С-фенілгліцитолу за п. 11 або її фармацевтично прийнятна сіль, або її гідрат, в якій
Yє С1-6алкіленовою групою,
Z є -CONHRA1 або -NHC(=NH)NH2, або
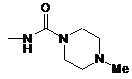 ,
,
де
RA1 являє собою С1-6алкільну групу, заміщену 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи, аміногрупи і карбамоїльної групи.
13. Сполука С-фенілгліцитолу за п. 11 або її фармацевтично прийнятна сіль, або її гідрат, в якій
Y є С1-6алкіленовою групою, і
Z є -CONHRA1,
де RA1 є С1-6алкільною групою, заміщеною 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи, аміногрупи і карбамоїльної групи.
14. Сполука С-фенілгліцитолу за п. 11 або її фармацевтично прийнятна сіль, або її гідрат, в якій
Y є С1-6алкіленовою групою, і
Z є -NHC(=NH)NH2.
15. Сполука С-фенілгліцитолу за п. 11 або її фармацевтично прийнятна сіль, або її гідрат, в якій
Y є С1-6алкіленовою групою, і
Z є -NHCORВ1 (де RВ1 є С1-6алкіламіногрупою, заміщеною 1-3 гідроксильними групами, або 4-С1-6алкілпіперазин-1-ілкарбонільною групою, або 4-С1-6алкілпіперазин-1-ільною групою).
16. Сполука С-фенілгліцитолу за п. 11 або її фармацевтично прийнятна сіль, або її гідрат, в якій
Y є С1-6алкіленовою групою, і
Z представляють формулою
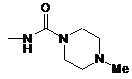 .
.
17. Фармацевтичний препарат, що містить сполуку С-фенілгліцитолу за будь-яким з пп. 1-16 або її фармацевтично прийнятну сіль, або її гідрат як активний інгредієнт.
18. Фармацевтичний препарат за п. 17, що є інгібітором активності натрійзалежного співпереносника 1 глюкози (SGLT1) і активності натрійзалежного співпереносника 2 глюкози (SGLT2).
19. Фармацевтичний препарат за п. 17, що є профілактичним або терапевтичним засобом від цукрового діабету.
Текст
1. Сполука С-фенілгліцитолу, представлена формулою (І), наведеною нижче, або її фармацевтично прийнятна сіль, або її гідрат, R1 R2 Y Z 3 групою, аміногрупою, С1-6алкіламіногрупою, діС1С2-6ациламіногрупою, С16алкіламіногрупою, 6алкілтіогрупою, що може бути заміщена гідроксильною(ими) групою(ами); феноксигрупи, фенільної групи, яка може бути заміщена 1-3 замісниками, вибраними з групи В (група В складається з гідроксильної групи, атома галогену, С16алкоксигрупи, С1-6алкільної групи, яка може бути заміщена гідроксильною(ими) групою(ами), С16алкілтіогрупою, тієнільною групою, фенілтіогрупою, що може бути заміщена гідроксильною(ими) групою(ами) або С1-6гідроксіалкільною(ими) групою(ами) і піперидиногрупою, що може бути заміщена гідроксильною(ими) групою(ами) або С16гідроксіалкільною(ими) групою(ами)); С3-12циклоалкільної групи, яка може бути заміщена 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи і С1-6гідроксіалкільної групи; 3-12-членної гетероциклоалкільної групи або 5-13членної гетероарильної групи, яка може бути частково насиченою; кожна з яких містить від одного до трьох циклоутворюючих атомів, вибраних з гру10 10 пи, яка складається з О, N, S, SO2, CO і NR (R є атомом водню, С1-6алкільною групою, феніл-С16алкільною групою або С2-6алкоксикарбонільною групою), і може бути заміщена 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи і С1-6гідроксіалкільної групи, і В1 В2 В1 В2 -CONR R , де R і R разом з атомом азоту, до якого вони приєднані, утворюють 5-6-членну гетероциклоалкільну групу, що може містити як ще один циклоутворюючий атом атом кисню, атом азоту або атом сірки, і може бути заміщена 1 або 2 замісниками, вибраними з групи, яка складається з С1-6алкільної групи, яка може бути заміщена гідроксильною(ими) групою(ами), С2групою і феніл-С16алкоксикарбонільною 6алкільною групою, С R є атомом водню, С1-6алкільною групою, що може бути заміщена 1 або 2 замісниками, вибраними з групи, яка складається з гідроксильної групи, діС16алкіламіногрупи, С2-6алкоксикарбонільної групи і С1-6алкоксигрупи або С3-12циклоалкільної групи, яка може бути заміщена гідроксильною(ими) групою(ами); і B С R і R разом з атомом азоту, до якого вони приєднані, можуть утворювати 3-12-членну гетероциклоалкільну групу або 5-13-членну гетероарильну групу, що може бути частково насиченою; кожна з яких може містити 1 або 2 циклоутворюючі атоми, 11 вибрані з О, N, NR , S, SO2 і CO, і яка може бути заміщена 1 або 2 замісниками, вибраними з групи, яка складається з гідроксильної групи, С26алкоксикарбонільної групи, карбамоїльної групи, С2-6ацил(С1-6алкіл)аміногрупи, діС1групи, піролідинільної 6алкіламінокарбонільної групи, морфоліногрупи, піролідин-1-ілкарбонільної групи, С1-6алкільної групи, яка може бути заміщена 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи, піролідин-1-ільної групи, фенільної групи і С2-6алкоксикарбонільної групи, і фенільної групи, яка може бути заміщена 1-3 95635 4 замісниками, вибраними з групи, яка складається з С1-6алкільної групи, С1-6алкоксигрупи і атома галогену, 11 де R є атомом водню, С2-6ацильною групою, фенільною групою, що може бути заміщена гідроксильною(ими) групою(ами), піридильною групою, фурилкарбонільною групою, оксоланілкарбонільною групою, С2-6алкоксикарбонільною групою або С1-6алкільною групою, що може бути заміщеною 1 або 2 замісниками, вибраними з групи, яка складається з гідроксильної групи, фенільної групи, діС16алкіламіногрупи, морфоліногрупи і піролідин-1ілкарбонільної групи, і D R є атомом водню або С1-6алкільною групою, що може бути заміщеною 1 або 2 замісниками з групи, яка складається з гідроксильної групи, С312циклоалкільної групи, фенільної групи, яка може бути заміщена гідроксильною(ими) групою(ами), піридильною групою, С2-6алкоксикарбонільною групою, імідазолільною групою і 1DA бензилімідазолільною групою, і R є атомом водню або С1-6алкільною групою. 2. Сполука С-фенілгліцитолу за п. 1, яка є сполукою С-фенілглюциту, представленою Формулою (II), наведеною нижче, або її фармацевтично прийнятною сіллю, або її гідратом, R1 R2 Y Z O HO R3 HO OH OH , (II) 1 2 3 де R , R , R , Y і Z є такими ж, як визначено у п. 1. 3. Сполука С-фенілгліцитолу або її фармацевтич1 но прийнятна сіль, або її гідрат за п. 2, в якій R є атомом водню, гідроксильною групою, С12 4алкільною групою або С1-4алкоксигрупою, і R є С1-4алкільною групою або атомом галогену. 4. Сполука С-фенілгліцитолу за п. 2 або 3 або її 3 фармацевтично прийнятна сіль, або її гідрат, де R є атомом водню. 5. Сполука С-фенілгліцитолу або її фармацевтично прийнятна сіль, або її гідрат за п. 3 або 4, в якій Y є С1-6алкіленовою групою або -О-(СН2)n- (n являє B C собою ціле число від 2 до 4), і Z є -NHCON(R )R , B C де R і R визначені у п. 1. 6. Сполука С-фенілгліцитолу або її фармацевтично прийнятна сіль, або її гідрат за п. 3 або 4, в якій Y є С1-6алкіленовою групою або -О-(СН2)n- (n являє собою ціле число, що приймає значення від 2 до B C 4), і Z є -NHCON(R )R , де B R є (1) С1-6алкільною групою, що може бути заміщена 1-3 замісниками, вибраними з групи А, (2) С3-12циклоалкільною групою, що може бути заміщена 1-3 замісниками, вибраними з гідроксильної групи і С1-6гідроксіалкільної групи, (3) 3-12-членною гетероциклоалкільною групою або 5-13-членною гетероарильною групою, що може бути частково насиченою; кожна з яких містить від одного до трьох циклоутворюючих атомів, 10 вибраних з групи, яка складається з О, N, S і NR 5 10 (R є атомом водню, С1-6алкільною групою, фенілС1-6алкільною групою або С26алкоксикарбонільною групою), і може бути заміщена 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи і С16гідроксіалкільної групи, або (4) С6-13арильною групою, що може бути частково насиченою і може бути заміщена 1 або 2 замісниками, вибраними з гідроксильної групи і С16алкільної групи, феніл-С1-6алкільної групи і С16алкілсульфонільної групи, кожна з яких може бути заміщена гідроксильною(ими) групою(ами), в яких група А складається з атома галогену, гідроксильної групи, С16алкоксигрупи, яка може бути заміщена гідроксильною(ими) групою(ами), С2-6алкоксикарбонільною групою, карбамоїльною групою, діС16алкіламіногрупою, С1-6алкілтіогрупою, що може бути заміщена гідроксильною(ими) групою(ами), феноксигрупи, тієнільної групи, бензотієнільної групи, фурильної групи, фенільної групи, яка може бути заміщена 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи, атома галогену, С16алкоксигрупи, С1-6алкільної групи, яка може бути заміщена гідроксильною(ими) групою(ами), С16алкілтіогрупою, фенілтіогрупою, що може бути заміщена гідроксильною(ими) групою(ами), або С16гідроксіалкільною(ими) групою(ами) і піперидиногрупою, що може бути заміщена гідроксильною(ими) групою(ами), або С16гідроксіалкільною(ими) групою(ами), С3-12циклоалкільної групи, яка може бути заміщена 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи і С1-6гідроксіалкільної групи; 3-12-членної гетероциклоалкільної групи, що містить від одного до трьох циклоутворюючих атомів, 10 вибраних з групи, яка складається з О, N, S і NR 10 (R є атомом водню, С1-6алкільною групою, фенілС1-6алкільною групою або С26алкоксикарбонільною групою), і може бути заміщена 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи і С16гідроксіалкільної групи; і 4-С1-6алкілпіперидин-1-ілкарбонільної групи, С R є атомом водню, і В С R і R разом з атомом азоту, до якого вони приєднані, можуть утворювати піперидинову групу, що може бути заміщена піролідинільною групою або С1-6алкільною групою, що заміщена діС16алкіламіногрупою або піролідин-1-ільною групою, або тіоморфоліновою групою, або декагідроізохіноліновою групою. 7. Сполука С-фенілгліцитолу або її фармацевтично прийнятна сіль, або її гідрат за будь-яким з пп. 2-4, в якій Y є С1-6алкіленовою групою, A Z є -CONHR , де A R є С1-6алкільною групою, заміщеною 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи і карбамоїльної групи. 95635 6 8. Сполука С-фенілгліцитолу або її фармацевтично прийнятна сіль, або її гідрат за будь-яким з пп. 2-4, де Y є С1-6алкіленовою групою, і Z є -NHC(=NH)NH2. 9. Сполука С-фенілгліцитолу або її фармацевтично прийнятна сіль, або її гідрат за будь-яким з пп. 2-4, в якій Y є С1-6алкіленовою групою, і Zє RD O RDA N NH O , є С1-6алкільною групою, що заміщена С312циклоалкільною групою або фенільною групою; і DA R є атомом водню або С1-6алкільною групою. 10. Сполука С-фенілгліцитолу за п. 1, яка є сполукою С-фенілгалацитолу, представленою формулою (III), наведеною нижче, або її фармацевтично прийнятною сіллю, або її гідратом, HO Me Y Z D R O HO HO OH OH , (ІІІ) де Y є С1-6алкіленовою групою, і A Z є -CONHR , де A R являє собою С1-6алкільну групу, заміщену 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи і карбамоїльної групи. 11. Сполука С-фенілгліцитолу за п. 1, яка є сполукою С-фенілглюциту, представленою формулою (IV), наведеною нижче, або її фармацевтично прийнятною сіллю, або її гідратом, HO Me Y Z O HO HO OH OH , (IV) де Y є С1-6алкіленовою групою, і A1 В1 Z є -CONHR , -NHC(=NH)NH2 або -NHCOR , де A1 R є С1-6алкільною групою, заміщеною 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи, аміногрупи, карбамоїльної групи, і В1 R є С1-6алкіламіногрупою, що може бути заміщена 1-3 гідроксильними групами, або 4-С1-6алкілпіперазин1-ілкарбонільною групою, або 4-С16алкілпіперазин-1-ільною групою. 7 12. Сполука С-фенілгліцитолу за п. 11 або її фармацевтично прийнятна сіль, або її гідрат, в якій Y є С1-6алкіленовою групою, A1 Z є -CONHR або -NHC(=NH)NH2, або O N H N N Me , де A1 R являє собою С1-6алкільну групу, заміщену 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи, аміногрупи і карбамоїльної групи. 13. Сполука С-фенілгліцитолу за п. 11 або її фармацевтично прийнятна сіль, або її гідрат, в якій Y є С1-6алкіленовою групою, і A1 Z є -CONHR , A1 де R є С1-6алкільною групою, заміщеною 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи, аміногрупи і карбамоїльної групи. 14. Сполука С-фенілгліцитолу за п. 11 або її фармацевтично прийнятна сіль, або її гідрат, в якій Y є С1-6алкіленовою групою, і Z є -NHC(=NH)NH2. Даний винахід стосується сполуки Сфенілгліцитолу, яка має інгібуючу активність стосовно натрій-залежного співпереносника 1 глюкози (SGLT1) і натрій-залежного співпереносника 2 глюкози (SGLT2). Коли людина хвора на цукровий діабет, рівень глюкози у крові натщесерце складає 126 мг/дл або більше. Навіть якщо вміст глюкози у крові натщесерце попадає у межі норми, є люди, які після прийому їжі демонструють рівень глюкози у крові, такий як 140-200 мг/дл. У такої людини діагностують порушену толерантність до глюкози (яка позначається надалі як "IGТ"). Вважали, що ризик серцево-судинного розладу можна знизити, уповільнюючи виникнення цукрового діабету з IGTстану. Для підтвердження цього була одержана деяка кількість додаткових даних. Наприклад, у результаті вивчення Da Qing IGT і цукрового діабету, проведеного у Китаї у 1997 р, повідомляли, що прогресуючий розвиток IGT до цукрового діабету II типу істотно придушують дієтою і фізичним навантаженням (див., Pan XR, et al., Diabets Care, vol 20, p. 534, 1997). Медикаментозне лікування є ефективним у випадку, коли вводять інгібітор αглюкозидази, акарбозу, яка інгібує гідроліз олігосахариду, з уповільненням абсорбції глюкози з тонкої кишки і придушує розвиток IGT до цукрового діабету II типу і, крім того, значно придушує виникнення артеріальної гіпертензії. Це повідомлення наведене у документі J.-L. Chiasson, et al., Lancent, vol. 359, p. 2072, 2002. З наведеного вище випливає, що істотним для придушення виникнення цукрового діабету, є кон 95635 8 15. Сполука С-фенілгліцитолу за п. 11 або її фармацевтично прийнятна сіль, або її гідрат, в якій Y є С1-6алкіленовою групою, і В1 В1 Z є -NHCOR (де R є С1-6алкіламіногрупою, заміщеною 1-3 гідроксильними групами, або 4-С16алкілпіперазин-1-ілкарбонільною групою, або 4С1-6алкілпіперазин-1-ільною групою). 16. Сполука С-фенілгліцитолу за п. 11 або її фармацевтично прийнятна сіль, або її гідрат, в якій Y є С1-6алкіленовою групою, і Z представляють формулою O N H N N Me . 17. Фармацевтичний препарат, що містить сполуку С-фенілгліцитолу за будь-яким з пп. 1-16 або її фармацевтично прийнятну сіль, або її гідрат як активний інгредієнт. 18. Фармацевтичний препарат за п. 17, що є інгібітором активності натрійзалежного співпереносника 1 глюкози (SGLT1) і активності натрійзалежного співпереносника 2 глюкози (SGLT2). 19. Фармацевтичний препарат за п. 17, що є профілактичним або терапевтичним засобом від цукрового діабету. троль IGT шляхом дієтотерапії, фізичного навантаження і шляхом медикаментозного лікування. Проте, коли хворий страждає на цукровий діабет, постійний контроль рівня глюкози у крові стає необхідним. Цукровий діабет лікують, в основному, дієтичним харчуванням і фізичним навантаженням; однак, коли за допомогою такої терапії не досягають адекватного ефекту, необхідно застосовувати медикаментозне лікування. Натрій-залежний співпереносник 1 глюкози (SGLT1) з високою частотою експресується на епітелії тонкої кишки ссавця. Відомо, що SGLT1 функціонує залежно від натрію і відіграє роль в активному транспорті глюкози або галактози у тонкій кишці. Тому, якщо можна пригнічувати споживання глюкози з їжі, то IGТ можна запобігати або лікувати. Базуючись на цій концепції, повідомляли про похідне піразолу, що інгібує активність SGLT1 (див., WO 2002/098893, 2004/014932,2004/018491,2004/019958,2005/12116 1 і 2004/050122). Більш того, натрій-залежний співпереносник 2 глюкози (SGLT2) з високою частотою експресується у нирці. Глюкоза, будучи відфільтрована нирковим клубочком, повторно абсорбується за допомогою SGLT2 (див., Е. М. Wright, Am. J. Physiol. Renal. Physiol., vol. 280, p. F10, 2001). Коли інгібітор SGLT2 вводять хворому на діабет щуру, екскреція глюкози у сечу полегшується, стимулюючи гіпоглікемічну дію. Виходячи з цього, специфічний інгібітор SGLT2 розглядали як молекулу-мішень, яка служить терапевтичним засобом для лікування цукрового діабету (див., G. Toggenburger, et al. Biochem. Biophys. Acta., vol. 688, p. 557, 1982). У 9 95635 цих обставинах, дослідження були спрямовані на інгібітор SGLT2, і були запропоновані різні типи похідних О-арилглікозиду (див., публікацію ЕР патентної заявки № 0850948А1 і публікацію міжнародної заявки WO 2001/068660). Відповідно, якщо можливе одночасне інгібування активності SGLT1 і SGLT2, то може бути запропонований новий тип терапевтичного засобу для лікування цукрового діабету, який має не тільки високий пригнічувальний вплив на рівень глюкози після прийому їжі, обумовлений інгібуванням SGLT1, але також і наростаючу гіпоглікемічну дію, обумовлену інгібуванням SGLT2. Дотепер повідомляли про похідне Сфенілглікозиду, яке має селективну інгібуючу активність стосовно SGLT2 (див., публікацію міжнародної заявки WO 2001/027128), однак, не повідомляли про похідне С-фенілглікозиду, яке сильно інгібує як SGLT1, так і SGLT2. Метою даного винаходу є одержання сполуки С-фенілгліцитолу, яку припустимо розглядають як новий тип фармацевтичного агента для лікування цукрового діабету, що здатний до інгібування активності і SGLT1, і SGLT2, який має не тільки пригнічувальний вплив на абсорбцію глюкози з травного тракту, але також і вплив на екскрецію глюкози з сечею. Для досягнення зазначеної вище мети автори даного винаходу провели ряд інтенсивних досліджень. У результаті, вони знайшли, що сполука Сфенілгліцитолу, яка утворюється введенням визначеного бічного ланцюга у кінцеву ділянку аглікону, має чудову інгібуючу дію на активність SGLT1 і активність SGLT2. На основі цієї знахідки був виконаний даний винахід. Сполука С-фенілгліцитолу за даним винаходом (яка надалі позначається як "сполука за винаходом") буде розглянута нижче. На підставі даного винаходу виявилося можливим запропонувати нову сполуку Сфенілгліцитолу, здатну інгібувати як активність SGLT1, так і активність SGLT2. Перший варіант здійснення даного винаходу (варіант здійснення винаходу 1) стосується сполуки С-фенілгліцитолу наведеної нижче формули або її фармацевтично прийнятної солі, або її гідрату: (I) де 1 2 R і R однакові або різні, і являють собою атом водню, гідроксильну групу, С1-6 алкільну групу, С1-6 алкоксигрупу або атом галогену, R є атомом водню, С1-6 алкільною групою, С1-6 алкоксигрупою або атомом галогену, Υ є С1-6 алкіленовою групою, -О-(СН2)n- (n є цілим числом, що приймає значення від 1 до 4) або С2-6 алкеніленовою групою, за умови, що коли Ζ є B C NHC(=NH)NH2 або -NHCON(R )R , n не дорівнює 1, 10 A Ζ є -CONHR , B C NHCON(R )R , A -NHC(=NH)NH2 або де R є С1-6 алкільною групою, заміщеною 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи, аміногрупи і карбамоїльної групи, B R є (1) атомом водню, (2) С1-6 алкільною групою, що може бути заміщена 1-3 замісниками, вибраними з групи А, (3) С3-12 циклоалкільною групою, що може бути заміщена 1-3 замісниками, вибраними з гідроксильної групи і С1-6 гідроксіалкільної групи, (4) (3-12)-членною гетероциклоалкільною групою або (5-13)-членною гетероарильною групою, яка може бути частково насиченою; кожна з яких містить від одного до трьох циклоутворюючих атомів, вибраних з групи, яка складається з О, N, 10 10 S, SO2, CO і NR (R є атомом водню, С1-6 алкільною групою, феніл-С1-6 алкільною групою або С2-6 алкоксикарбонільною групою), і може бути заміщена 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи і С1-6 гідроксіалкільної групи, або (5) С6-13 арильною групою, що може бути частково насиченою і може бути заміщена 1 або 2 замісниками, вибраними з гідроксильної групи і С1-6 алкільної групи, феніл-С1-6 алкільною групою і С1-6 алкілсульфонільною групою, кожна з яких може бути заміщена гідроксильною(ими) групою(ами), де група А складається з атома галогену, гідроксильної групи, С1-6 алкоксигрупи, яка може бути заміщена гідроксильною(ими) групою(ами), карбоксильною групою, С2-6 алкоксикарбонільною групою, карбамоїльною групою, аміногрупою, С1-6 алкіламіногрупою, діС1-6 алкіламіногрупою, С2-6 ациламіногрупою, С1-6 алкілтіогрупою, яка може бути заміщена гідроксильною(ими) групою(ами); феноксигрупи, фенільної групи, яка може бути заміщена 1-3 замісниками, вибраними з групи В (Група В складається з гідроксильної групи, атома галогену, С1-6 алкоксигрупи, С1-6 алкільної групи, яка може бути заміщена гідроксильною(ими) групою(ами), С1-6 алкілтіогрупою, тієнільною групою, фенілтіогрупою, яка може бути заміщена гідроксильною(ими) групою(ами) або С1-6 гідроксіалкільною(ими) групою(ами), і піперидиногрупою, що може бути заміщена гідроксильною(ими) групою(ами) або С1-6 гідроксіалкільною(ими) групою(ами)), С3-12 циклоалкільної групи, яка може бути заміщена 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи і С1-6 гідроксіалкільної групи, (3-12)-членної гетероциклоалкільної групи або (5-13)-членної гетероарильної групи, яка може бути частково насиченою; кожна з яких містить від 11 одного до трьох циклоутворюючих атомів, вибраних з групи, яка складається з О, N, S, SO2, CO і 10 10 NR (R є атомом водню, С1-6 алкільною групою, феніл-С1-6 алкільною групою або С2-6 алкоксикарбонільною групою), і може бути заміщена (1-3) замісниками, вибраними з групи, яка складається з гідроксильної групи і С1-6 гідроксіалкільної групи, і B1 B2 B1 B2 -CONR R , де R і R разом з атомом азоту, до якого вони приєднані, утворюють (5-6)членну гетероциклоалкільну групу, що може містити як інший циклоутворюючий атом, атом кисню, атом азоту або атом сірки і може бути заміщена 1 або 2 замісниками, вибраними з групи, яка складається з С1-6 алкільної групи, яка може бути заміщена гідроксильною(ими) групою(ами), С2-6 алкоксикарбонільною групою і феніл С1-6 алкільною групою, С R є атомом водню, С1-6 алкільною групою, що може бути заміщена 1 або 2 замісниками, вибраними з групи, яка складається з гідроксильної групи, діС1-6 алкіламіногрупи, С2-6 алкоксикарбонільної групи і С1-6 алкоксигрупи, або С3-12 циклоалкільної групи, яка може бути заміщена гідроксильною(ими) групою(ами), і В С R і R разом з атомом азоту, до якого вони приєднані, можуть утворювати (3-12)-членну гетероциклоалкільну групу або (5-13)-членну гетероарильну групу, що може бути частково насиченою; кожна з яких може містити 1 або 2 циклоутворюю11 чих атоми, вибраних з О, N, NR , S, SO2 і CO, і яка може бути заміщена 1 або 2 замісниками, вибраними з групи, яка складається з гідроксильної групи, С2-6 алкоксикарбонільної групи, карбамоїльної групи, С2-6 ацил(С1-6 алкіл)аміногрупи, ді-С1-6 алкіламінокарбонільної групи, піролідинільної групи, морфоліногрупи, піролідин-1-іл-карбонільної групи, С1-6 алкільної групи, яка може бути заміщена 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи, піролідин-1-ільної групи, фенільної групи С2-6 алкоксикарбонільної групи, і фенільної групи, яка може бути заміщена 1 -3 замісниками, вибраними з групи, яка складається з С1-6 алкільної групи, С1-6 алкоксигрупи і атома галогену, 11 де R є атомом водню, С2-6 ацильною групою, фенільною групою, що може бути заміщена гідроксильною(ими) групою(ами), піридильною групою, фурилкарбонільною групою, оксоланілкарбонільною групою, С2-6 алкоксикарбонільною групою або С1-6 алкільною групою, що може бути заміщена 1 або 2 замісниками, вибраними з групи, яка складається з гідроксильної групи, фенільної групи, діС1-6 алкіламіногрупи, морфоліногрупи і піролідин-1ілкарбонільної групи, і D R є атомом водню або С1-6 алкільною групою, що може бути заміщена 1 або 2 замісниками з групи, яка складається з гідроксильної групи, С3-12 циклоалкільної групи, фенільної групи, яка може бути заміщена гідроксильною(ими) групою(ами), піридильною групою, С2-6 алкоксикарбонільною групою, імідазолільною групою і 1DA бензилімідазолільною групою, і R є атомом водню або С1-6 алкільною групою. 95635 12 У даному винаході пропонують наведені нижче інші варіанти здійснення винаходу 2-19: 2. Сполука С-фенілгліцитолу, яка є сполукою С-фенілглюциту, представленою формулою (II), наведеною нижче, або її фармацевтично прийнятною сіллю, або її гідратом, (II) 1 2 3 де R , R , R , Υ і Ζ визначені у формулі (І). 3. Сполука С-фенілгліцитолу або її фармацевтично прийнятна сіль, або її гідрат за формулою 1 (II), де R є атомом водню, гідроксильною групою, 2 С1-4 алкільною групою або С1-4 алкоксигрупою, і R є С1-4 алкільною групою або атомом галогену. 4. Сполука С-фенілгліцитолу за варіантом здійснення винаходу 2 або 3, або її фармацевтич3 но прийнятна сіль, або її гідрат, де R є атомом водню. 5. Сполука С-фенілгліцитолу або її фармацевтично прийнятна сіль, або її гідрат за варіантом здійснення винаходу 3 або 4; де Υ є С1-6 алкіленовою групою або -О-(СН2)n- (n являє собою ціле B C B C число від 2 до 4), і Ζ є -NHCON(R )R , де R і R визначені для формули (І). 6. Сполука С-фенілгліцитолу або її фармацевтично прийнятна сіль, або її гідрат за варіантом здійснення винаходу 3 або 4, де Υ є С1-6 алкіленовою групою або -О-(СН2)n- (n являє собою ціле число від 2 до 4), і Ζ є B C NHCON(R )R , де B R є (1) С1-6 алкільною групою, що може бути заміщена 1-3 замісниками, вибраними з групи А, (2) С3-12 циклоалкільною групою, що може бути заміщена 1-3 замісниками, вибраними з гідроксильної групи і С1-6 гідроксіалкільної групи, (3) (3-12)-членною гетероциклоалкільною групою або (5-13)-членною гетероарильною групою, що може бути частково насиченою; кожна з яких містить від одного до трьох циклоутворюючих атомів, вибраних з групи, яка складається з О, N, S 10 10 і NR (R є атомом водню, С1-6 алкільною групою, феніл-С1-6 алкільною групою або С2-6 алкоксикарбонільною групою) і може бути заміщена 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи і С1-6 гідроксіалкільної групи, або (4) С6-13 арильною групою, що може бути частково насиченою і може бути заміщена 1 або 2 замісниками, вибраними з гідроксильної групи, і С1-6 алкільної групи, феніл-С1-6 алкільної групи С1-6 алкілсульфонільної групи, кожна з яких може бути заміщена гідроксильною(ими) групою(ами), в яких група А складається з: атома галогену, гідроксильної групи, С1-6 алкоксигрупи, яка може бути заміщена гідроксильною(ими) групою(ами), С2-6 алкоксикарбонільною групою, карбамоїльною групою, діС1-6 алкіламіног 13 рупою, С1-6 алкілтіогрупою, що може бути заміщена гідроксильною(ими) групою(ами), феноксигрупи, тієнільної групи, бензотієнільної групи, фурильної групи, фенільної групи, яка може бути заміщена 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи, атома галогену, С1-6 алкоксигрупи, С1-6 алкільної групи, яка може бути заміщена гідроксильною(ими) групою(ами), С1-6 алкілтіогрупою, фенілтіогрупою, що може бути заміщена гідроксильною(ими) групою(ами), або С1-6 гідроксіалкільною(ими) групою(ами) і піперидиногрупою, що може бути заміщена гідроксильною(ими) групою(ами) або С1-6 гідроксіалкільною(ими) групою(ами), С3-12 циклоалкільної групи, яка може бути заміщена 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи і С1-6 гідроксіалкільної групи, (3-12)-членної гетероциклоалкільної групи, що містить від одного до трьох циклоутворюючих атомів, вибраних з групи, яка складається з О, N, S 1 1 і NR (R є атомом водню, С1-6 алкільною групою, феніл-С1-6 алкільною групою або С2-6 алкоксикарбонільною фупою); і яка може бути заміщена 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи і С1-6 гідроксіалкільної групи; і 4-С1-6 алкілпіперидин-1-ілкарбонільної групи, С R є атомом водню, і B C R і R разом з атомом азоту, до якого вони приєднані, утворюють піперидинову групу, яка може бути заміщена піролідинільною групою або С1-6 алкільною групою, що заміщена діС1-6 алкіламіногрупою або піролідин-1-ільною групою або групою тіоморфоліну або групою декагідроізохіноліну. 7. Сполука С-фенілгліцитолу або її фармацевтично прийнятна сіль, або її гідрат за будь-яким з варіантів здійснення винаходу 2-4, де Υ є С1-6 алкіленовою групою, A Ζ є -CONHR , де A R є С1-6 алкільною групою, заміщеною 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи і карбамоїльної групи. 8. Сполука С-фенілгліцитолу або її фармацевтично прийнятна сіль, або її гідрат за будь-яким з варіантів здійснення винаходу 2-4, де Υ є С1-6 алкіленовою групою, і Ζ є -NHC(=NH)NH2. 9. Сполука С-фенілгліцитолу або її фармацевтично прийнятна сіль, або її гідрат за будь-яким з варіантів здійснення винаходу 2-4, де Υ є С1-6 алкіленовою групою, і Zє D R є С1-6 алкільною групою, що заміщена С3-12 циклоалкільною групою або фенільною групою; і DA R є атомом водню або С1-6 алкільною групою. 10. Сполука С-фенілгліцитолу за варіантом здійснення винаходу 1, яка є сполукою С 95635 14 фенілгалацитолу, представленою формулою (III), наведеною нижче, або її фармацевтично прийнятною сіллю, або її гідратом, (III) де Υ є С1-6 алкіленовою групою, і A Ζ є -CONHR , де A R є С1-6 алкільною групою, заміщеною 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи і карбамоїльної групи. 11. Сполука С-фенілгліцитолу за варіантом здійснення винаходу 1, яка є сполукою Сфенілглюциту, представленою формулою (IV), наведеною нижче, або її фармацевтично прийнятною сіллю, або її гідратом (IV) де Υ є С1-6 алкіленовою групою, і A1 В1 Ζ є -CONHR , -NHC(=NH)NH2 або –NHCOR , де R є С1-6 алкільною групою, заміщеною 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи, аміногрупи і карбамоїльної групи, і B1 R є С1-6 алкіламіногрупою, що може бути заміщена 1-3 гідроксильними групами, або 4-С1-6 алкілпіперазин-1-ілкарбонільною групою, або 4-С1-6 алкілпіперазин-1-ільною групою. 12. Сполука С-фенілгліцитолу за варіантом здійснення винаходу 11 або її фармацевтично прийнятна сіль, або її гідрат, в яких Υ є С1-6 алкіленовою групою, A1 Ζ є -CONHR або -NHC(=NH)NH2, або де A1 R є С1-6 алкільною групою, заміщеною 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи, аміногрупи і карбамоїльної групи. 13. Сполука С-фенілгліцитолу за варіантом здійснення винаходу 11 або її фармацевтично прийнятна сіль, або її гідрат, в яких Υ є С1-6 алкіленовою групою, і A1 Ζ є -CONHR , A1 де R є С1-6 алкільною групою, заміщеною 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи, аміногрупи і карбамоїльної групи. 15 14. Сполука С-фенілгліцитолу за варіантом здійснення винаходу 11 або її фармацевтично прийнятна сіль, або її гідрат, в яких Υ є С1-6 алкіленовою групою, і Ζ є -NHC(=NH)NH2. 15. Сполука С-фенілгліцитолу за варіантом здійснення винаходу 11 або її фармацевтично прийнятна сіль, або її гідрат, в яких Υ є С1-6 алкіл еновою групою, і B1 B1 Ζ є -NHCOR (де R є С1-6 алкіламіногрупою, заміщеною 1-3 гідроксильними групами або 4-С1-6 алкілпіперазин-1-ілкарбонільною групою, або 4-С16 алкілпіперазин-1-ільною групою). 16. Сполука С-фенілгліцитолу за варіантом здійснення винаходу 11 або її фармацевтично прийнятна сіль, або її гідрат, в яких Υ є С1-6 алкіленовою групою, і Ζ представлений формулою 17. Фармацевтичний препарат, який як активний інгредієнт містить сполуку С-фенілгліцитолу за будь-яким з варіантів здійснення винаходу 1-16 або її фармацевтично прийнятну сіль, або її гідрат. 18. Фармацевтичний препарат за варіантом здійснення винаходу 17, який є інгібітором активності натрій-залежного співпереносника глюкози 1 (SGLT1) та інгібітором активності натрій-залежного співпереносника глюкози 2 (SGLT2). 19. Фармацевтичний препарат за варіантом здійснення винаходу 17, що є профілактичним або терапевтичним засобом для лікування або запобігання цукровому діабету. Терміни, використовувані у даному винаході, будуть визначені наведеним нижче чином. Термін "С1-6 алкільна група" означає лінійну або розгалужену алкільну групу, що має від 1 до 6 атомів вуглецю. Приклади її можуть включати метильну групу, етильну групу, н-пропільну групу, ізопропільну групу, н-бутильну групу, ізобутильну групу, трет-бутильну групу, втор-бутильну групу, нпентильну групу, трет-пентильну групу, нгексильну групу та ізогексильну групу. Термін "С1-6 алкоксигрупа" означає лінійну або розгалужену алкоксигрупу, що має від 1 до 6 атомів вуглецю. З них, С1-4 алкоксигрупа є переважною. Приклади С1-4 алкоксигрупи можуть включати метоксигрупу, етоксигрупу, пропоксигрупу, ізопропоксигрупу, н-бутоксигрупу, ізобутоксигрупу і третбутоксигрупу. Термін "атом галогену" означає атом фтору, атом хлору, атом брому або атом йоду. Термін "С1-6 алкіленова група" означає двовалентну групу, одержувану видаленням атома водню від атома вуглецю С1-6 алкільної групи. Приклади лінійної алкіленової групи можуть включати метиленову групу, етиленову групу, триметиленову групу, тетраметиленову групу, пентаметиленову групу і гекса-метиленову групу. Термін "С2-6 алкеніленова група" означає двовалентну групу, утворену видаленням атома водню від атома вуглецю С2-6 алкенільної групи. Приклади лінійного алкенілену можуть включати 95635 16 вініленову (етеніленову групу), пропеніленову групу, бутеніленову групу, пентеніленову групу і гексеніленову групу. Термін "С1-6 алкільна група, заміщена 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи, аміногрупи і карбамоїльної групи" означає лінійну або розгалужену С1-6 алкільну групу, в якій від 1 до 3 атомів водню С1-6 алкільної групи заміщені, принаймні, одним членом групи, яка складається з гідроксильної групи, аміногрупи і карбамоїльної групи. Приклади її можуть включати гідроксиметильну групу, гідроксіетильну групу, 2-гідрокси-1,1-диметилетильну групу, 1,3дигідрокси-2-метилпропан-2-ільну групу, 1,3дигідрокси-2-гідроксиметилпропан-2-ільну групу, карбамоїлметильну групу і 2-карбамоїлетильну групу. Термін "С3-12 циклоалкільна група" означає циклічну алкільну групу, що має від 3 до 12 атомів вуглецю, і включає моноциклічні-, біциклічні- і спіровуглеводні. Приклади моноциклічного вуглеводню можуть включати циклопропільну групу, циклобутильну групу, циклопентильну групу, циклогексильну групу, циклогептильну групу і циклооктильну групу. Приклади біциклічного вуглеводню можуть включати адамантильну групу, біцикло[2.2.1]гептильну групу і біцикло[2.2.2]гептильну групу. Приклади спіровуглеводнів можуть включати спіро[3.4]октильну групу і спіро[4.5]деканільну групу. Термін "(3-12)-членна гетероциклоалкільна група, що містить від одного до трьох циклоутворюючих атомів, вибраних з групи, яка складається 10 з О, N, NR , S, SO2 і СО" означає визначену вище С3-12 циклоалкільну групу, в якій від 1 до 3 метиленових груп або метинових груп заміщені атомом(ами), вибраним(и) з групи, яка складається з 10 О, N, NR , S, SO2 і CO. Приклади її можуть включати оксанільну групу, 2-оксооксанільну групу, 1,3діоксанільну групу, піролідинільну групу, піперидиногрупу, 2-піперидильну групу, 4-піперидильну групу, піперазинільну групу, морфоліногрупу, тіоморфоліногрупу, хінуклідинільну групу, декагідроізохінолінільну групу, декагідрохінолінільну групу, Термін "(5-13)-членна гетероарильна група, що може бути частково насиченою; і яка містить від одного до трьох циклоутворюючих атомів, виб10 раних з групи, яка складається з О, N, NR , S, SO2 і CO", означає (5-13)-членний ненасичений моноциклічний, дициклічний або трициклічний гетероцикл; і може включати фурильну групу, імідазолільну групу, тієнільну групу, піридильну групу, бензотієнільну групу, 2,3-дигідробензофуранільну групу, 2,3-дигідро-1Н-бензо[dе]ізохінолінільну групу, 2,3-дигідро-1Н-індолільну групу, 2,3-дигідро1H-ізоіндолільну групу і 2,3,4,9-тетрагідро-1Н-bкарболінільну групу. Термін "С6-13 арильна група, що може бути частково насиченою" означає ненасичений моноциклічний, біциклічний або трициклічний вуглеводневий цикл, що має від 6 до 13 атомів вуглецю. 17 Приклади її можуть включати фенільну групу, нафтильну групу, флуоренільну групу, 1,2,3,4тетрагідронафтильну групу, інданільну групу. Термін "(5-6)-членна гетероциклоалкільна груB1 B2 па, яку утворюють R і R разом з атомом азоту, до якого вони приєднані, і яка може містити атом кисню, атом азоту або атом сірки як ще один циклоутворюючий атом" може включати піперидиногрупу, піперазиногрупу, морфоліногрупу, тіоморфоліногрупу. Термін "феніл С1-6 алкільна група" означає лінійну або розгалужену С1-6 алкільну групу, що заміщена фенільною групою. Приклади її можуть включати бензильну групу і фенілетильну групу. Термін "С2-6 алкоксикарбонільна група" визначає структуру, що складається з лінійної або розгалуженої С1-5 алкоксигрупи і карбонільної групи, переважною є С2-5 алкоксикарбонільна група. Приклади її можуть включати метоксикарбонільну групу, етоксикарбонільну групу, пропоксикарбонільну групу, ізопропоксикарбонільну групу, нбутоксикарбонільну групу і третбутоксикарбонільну групу. Термін "С1-6 алкілтіогрупа" визначає структуру, що складається з лінійної або розгалуженої С1-6 алкільної групи і однієї тіогрупи (-S-). Переважною є С1-6 алкілтіогрупа. Приклади С1-6 алкілтіогрупи включають метилтіогрупу, етилтіогрупу і пропілтіогрупу. Термін "С1-6 алкіламіногрупа" визначає структуру, що складається з лінійної або розгалуженої С1-6 алкільної групи і аміногрупи. Приклади її можуть включати метиламіногрупу і етиламіногрупу. Термін "діС1-6 алкіламіногрупа" визначає структуру, що складається з двох лінійних або розгалужених С1-6 алкільних груп і аміногрупи. Приклади її можуть включати диметиламіногрупу і діетиламіногрупу. Термін "С2-6 ацильна група" означає лінійну або розгалужену аліфатичну ацильну групу, що містить від 2 до 6 атомів вуглецю. Приклади включають ацетильну групу, пропіонільну групу, півалоїльну групу, бутирильну групу, ізобутирильну групу і валерильну групу. Термін "С2-6 ациламіногрупа" визначає структуру, що складається з С2-6 ацильної групи і аміногрупи; і переважною є ацетиламіногрупа. Термін "С2-6 ацил(С1-6 алкіл)аміногрупа" визначає структуру, що складається з С2-6 ацильної групи, С1-6 алкільної групи і аміногрупи. Термін "діС1-6 алкіламінокарбонільна група" визначає структуру, що складається з діС1-6 алкіламіногрупи і карбонільної групи. Термін "С1-6 гідроксіалкільна група" означає С16 алкільну групу, що заміщена, принаймні, однією гідроксильною групою. Приклади включають гідроксиметильну групу, 1-гідроксіетильну групу, 2гідроксіетильну групу, 3-гідроксипентильну групу і 2-гідрокси-2-метилбутильну групу. Термін "(3-12)-членна гетероциклоалкільна група або (5-13)-членна гетероарильна група, яку B С можуть утворювати R і R разом з атом азоту, до якого вони приєднані; і кожна з яких може містити 1 або 2 циклоутворюючих атоми, вибраних з О, N, 11 NR , S, SO2 і CO" означає (3-12)-членну гетероци 95635 18 клоалкільну групу або (5-13)-членну гетероарильну групу, визначену вище. Термін "фармацевтично прийнятна сіль" означає сіль лужного металу, лужноземельного металу, амонію, алкіламонію, або сіль мінеральної кислоти або органічної кислоти. Приклади її можуть включати натрієву сіль, калієву сіль, сіль кальцію, амонійну сіль, алюмінієву сіль, сіль триетиламонію, ацетат, пропіонат, бутират, форміат, трифторацетат, малеат, тартрат, цитрат, стеарат, сукцинат, етилсукцинат, лактобіонат, глюконат, глюкогептонат, бензоат, метансульфонат, етансульфонат, 2-гідроксіетансульфонат, бензолсульфонат, п-толуолсульфонат, лаурилсульфат, малат, аспартат, глутамат, адипат, сіль цистеїну, сіль N-ацетилцистеїну, гідрохлорид, гідробромат, фосфат, сульфат, гідройодат, нікотинат, оксалат, пікрат, тіоціанат, ундеканоат, сіль поліакрилату і сіль карбоксивінілового полімеру. Термін "гідрат" означає фармацевтично прийнятний гідрат сполуки за винаходом або її сіль. Сполука за винаходом або її сіль, піддаючись впливу повітря або перекристалізації, поглинає вологу, у результаті, вона необов'язково містить гігроскопічну воду або перетворюється у гідрат. Такий гідрат може бути включений у «гідрат» за даним винаходом. Деякі сполуки за винаходом і їх проміжні сполуки, які мають хіральний центр, можуть бути присутніми у формі діастереомеру або енантіомеру. Більш того, деякі сполуки за винаходом і проміжні сполуки можуть бути присутніми у вигляді кетоенольного таутомеру. Більш того, деякі сполуки за винаходом і їх проміжні сполуки можуть бути присутніми у вигляді геометричного ізомеру (Ε, Ζ форма). Тому, всі ізомери і їх суміші, зазначені вище, включені у сполуку за винаходом і її проміжну сполуку. Зокрема, у сполуці, що представляється формулою (І), стерична конфігурація гідроксильної групи у 4-положенні глюкозної частини являє собою або R-форму, або S-форму, що позначають хвилястою лінією. Переважні приклади сполуки за винаходом будуть наведені нижче. У формулі (І), переважними положеннями, що 1 2 заміщаються R і R , є положення, показані у формулі (II). R переважно є атомом водню, гідроксильною групою, С1-4 алкільною групою і С1-4 алкоксигрупою, більш переважні гідроксильна група і С1-4 алкоксигрупа, і ще більш переважні гідроксильна група і метоксигрупа. 2 R , переважно, є гідроксильною групою, С1-6 алкільною групою, атомом галогену, більш переважно, С1-4 алкільною групою і атомом галогену; ще більш переважно метильною групою і атомом хлору. 3 У формулі (І) або (II), R переважно є атомом водню, С1-4 алкільною групою і атомом галогену, більш переважно, атомом водню, метильною групою і атомом фтору і, найбільш переважно, ато3 мом водню. Коли R не є атомом водню, переважно, заміщення в орто-положенні бензильної частини формули (І) або (II). 19 У формулі (І) або (II), Y, переважно, може бути С1-4 алкіленовою групою, -О-(СН2)2- або С2-4 алкеніленовою групою, більш переважно, С1-3 алкіленовою групою, або -О-(СН2)2-, і ще більш переважно, С1-3 алкіленовою групою. Коли Ζ є B C NHCON(R )R , Y, найбільш переважно, є -(СН2)2-. B C B У формулі (І) або (II), де Ζ є -NHCON(R )R , R С і R переважно являють собою наведені нижче (i)(v) варіанти здійснення винаходу. (і) R є атомом водню, і R є С1-6 алкільною групою, яка може бути заміщена 1, 2 або 3 замісниками, вибраними з групи А. Група А тут являє собою атом галогену, гідроксильну групу, С1-6 алкоксигрупу, що може бути заміщена гідроксильною(ими) групою(ами), С2-6 алкоксикарбонільною групою, карбам оїльною групою, діС1-6 алкіл аміногрупою, С2-6 ацил аміногрупою, С1-6 алкілтіогрупою, що може бути заміщена гідроксильною(ими) групою(ами), феноксигрупою, фурильною групою, тієнільною групою, бензотієнільною групою, 2,3дигідробензофуранільною групою, фенільною групою, що може бути заміщена 1-3 замісниками, вибраними з групи В (група В складається з гідроксильної групи, атома галогену, С1-6 алкоксигрупи, С1-6 алкільної групи, яка може бути заміщена гідроксильною(ими) групою(ами), С1-6 алкілтіогрупою, фенілтіогрупою, яка може бути заміщена гідроксильною(ими) групою(ами) або С1-6 гідроксіалкільною(ими) групою(ами), піперидиногрупою, що може бути заміщена гідроксильною(ими) групою(ами) або С1-6 гідроксіалкільною(ими) групою(ами)), С3-12 циклоалкільну групу, яка може бути заміщена 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи і С1-6 гідроксіалкільної групи, (3-12)-членну гетероциклоалкільну групу, що містить від одного до трьох циклоутворюючих атомів, вибраних з групи, яка складається з О, N, S 10 10 і NR (R є атомом водню, С1-6 алкільною групою, феніл-С1-6 алкільною групою або С2-6 алкоксикарбонільною групою), і може бути заміщена 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи і С1-6 гідроксіалкільної групи; і 4-С1-6 алкілпіперидин-1-ілкарбонільну групу. Більш переважні приклади групи А включають гідроксильну групу, метоксигрупу, етоксигрупу, С3-6 циклоалкільну групу (циклопропільну групу, циклобутильну групу, циклопентильну групу, циклогексильну групу), яка може бути заміщена 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи і С1-6 гідроксіалкільної групи, метоксикарбонільної групи, карбамоїльної групи, диметиламіногрупи, ацетиламіногрупи, метилтіогрупи, фенільної групи, 4-гідроксифенільної групи, 4-метилтіофенільної групи, 3-метоксифенільної групи, 3,4-диметоксифенільної групи, феноксигрупи, 2-(гідроксиметилфенілтіо)фенільної групи, тієнільної групи, фурильної групи, бензотієнільної групи, 2,3-дигідробензофуранільної групи, 4метилпіперазин-1-ілкарбонільної групи, 1піролідинільної групи, 1,3-діоксан-2-ільної групи, 2оксанільної групи і піперидиногрупи. С В (іі) R є атомом водню і R є С3-12 циклоалкільною групою, що може бути заміщена 1, 2 або 3 95635 20 замісниками, вибраними з гідроксильної групи і С16 гідроксіалкільної групи. С3-12 Циклоалкільна група тут переважно є циклопропільною групою, циклобутильною групою, циклопентильною групою, циклогексильною групою, циклогептильною, циклооктильною групою, адамантильною групою, біцикло[2.2.1]гептильною групою, біцикло[2.2.2]гептильною групою, більш переважно, циклопентильною групою, циклогексильною групою, біцикло[2.2.1]гептильною групою або адамантильною групою. С B (iii) R є атомом водню. R є (3-12)-членною гетероциклоалкільною групою або (5-13)-членною гетероарильною групою, яка може бути частково насиченою; і кожна з яких містить від одного до трьох циклоутворюючих атомів, вибраних з групи, 10 10 яка складається з О, N, S і NR (R є атомом водню, С1-6 алкільною групою, феніл-С1-6 алкільною групою або С2-6 алкоксикарбонільною групою); переважно, піролідинільною групою, піперидильною групою і хінуклідинільною групою, більш переважно, піролідинільною групою, 4-піперидильною групою, в якій атом азоту заміщений феніл-С1-6 алкільною групою або С2-6 алкоксикарбонільною групою, і ще більш переважно, 3-(1бензил)піролідинільною групою, 4-(1бензил)піперидильною групою, або 4-(1етоксикарбоніл)піперидильною групою. С В (iv) R є атомом водню. R є (6-13)-членною арильною групою (С6-13 арильною групою), що може бути заміщена 1 або 2 замісниками, вибраними з гідроксильної групи і С1-6 алкільної групи, фенілС1-6 алкільної групи і С1-6 алкілсульфонільної групи, кожна з яких може бути заміщена гідроксильною(ими) групою(ами) або (6-13)-членною арильною групою, що є частково насиченою, яка може бути заміщена 1 або 2 гідроксильними групами. Тут термін "(6-13)-членна арильна група" включає фенільну групу або нафтильну групу; і термін "(613)-членна арильна група, що є частково насиченою" включає флуоренільну групу, 1,2,3,4тетрагідронафтильну групу або інданільну групу. B Переважним з них є R , що є фенільною групою, заміщеною феніл-С1-6 алкільною групою або флуоренільною групою, 1,2,3,4тетрагідронафтильною групою або інданільною групою, кожна з яких може бути заміщена 1 або 2 гідроксильними групами. (ν) Як інший переважний приклад, B C R і R разом з атомом азоту, до якого вони приєднані, утворюють (3-12)-членну гетероциклоалкільну групу, яка може містити 1 або 2 циклоут11 11 ворюючих атоми, вибраних з О, N, S і NR (R є С1-6 алкільною групою, що може бути заміщена діС1-6 алкіламіногрупою) і яка може бути заміщена 1 або 2 замісниками, вибраними з піролідинільної групи і С1-6 алкільної групи, яка може бути заміщена замісником, вибраним з групи, яка складається з гідроксильної групи і піролідин-1-ільної групи. Приклади (ν) варіанта здійснення винаходу включають піперидиногрупу, 4метилпіперидиногрупу, 2-декагідроізохінолінільну групу, тіоморфоліногрупу, 4-[2-(піролідин-1іл)етил]піперидиногрупу, 4-(піролідин-1іл)піперидиногрупу, 3-декагідрохінолінільну групу, 21 95635 4-[2-(N,N-диметиламіно)етил]піперазин-1-ільну групу і 3-гідроксиметилпіперидиногрупу. A A У формулі (І) або (II), де Ζ є -CONHR , R , переважно, є C1-6 алкільною групою, заміщеною 1-3 замісниками, вибраними з групи, яка складається з гідроксильної групи і карбамоїльної групи. 11 12 Зазначимо, що у формулі R і R можуть бути однаковими або різними і являють собою атом водню, бензил оксигрупу, метоксиметоксигрупу, (С1-6 алкіл)3SiO-, С1-6 алкільну групу, С1-6 алкоксиг1 рупу або атом галогену, Y являє собою одинарний зв'язок або С1-4 алкіленову групу; інші згадані позначення визначені вище. (1) Стадія 1 (Реакція Хека) Сполуку (ІА) і олефіноцтову кислоту (IB) у присутності паладієвого каталізатора, фосфінового ліганду і відповідної основи піддають взаємодії за реакцією Хека, для того, щоб синтезувати сполуку (lС). Приклади використовуваного тут паладієвого каталізатора можуть включати ацетат паладію, тетракіс(трифенілфосфін)паладій, дибензиліденацетонпаладій, біс(трифеніл-фосфін)паладійхлорид і паладій/активоване вугілля. Приклади фосфінового ліганду можуть включати трифенілфосфін і трис(2-метилфеніл)фосфін. Приклади основи включають триетиламін, Ν,Ν-діізопропілетиламін, карбонат калію, карбонат кальцію, карбонат цезію і трет-бутилат калію. Приклади розчинника, використовуваного у цій реакції, можуть включати ацетонітрил, толуол і тетрагідрофуран. Температура реакції складає від 0°С до температури кипіння розчинника. Однак, використовувати мікрохвильову піч необов'язково. (2) Стадія 2. Перетворення до амідної групи Сполуку (lС) піддають реакції конденсації з A аміном (R NH2) з відщепленням води і одержанням сполуки (ID). Переважні приклади розчинника, використовуваного у реакції, включають хлороформ, дихлорметан і Ν,Ν-диметилформамід. Переважні приклади конденсуючого агента у реакції конденсації з відщепленням води включають Ν,Ν'дициклогексилкарбодіімід (DCC), N-етил-N'-(3 22 Способи одержання сполуки (І) за винаходом будуть описані нижче. СПОСІБ ОДЕРЖАННЯ 1 Сполука (І) за винаходом, де Υ є С2-6 алкіленовою групою або С2-6 алкеніленовою групою, і Ζ A являє собою -CONHR , може бути синтезована за наведеним нижче способом. диметиламінопропіл)карбодіімід гідрохлорид (WSC), 1,1'-карбонілдіімідазол (CDI) і WSC/1гідроксибензотриазол моногідрат. Температура реакції тут складає 0°С-60°С. (3) Стадія 3. Відновлення і зняття захисту Каталітичне гідрування сполуки (ID), одержуваної вище, здійснюють в атмосфері водню, використовуючи такий каталізатор, як паладій на активованому вугіллі, гідроксид паладію або платинапаладій на активованому вугіллі. У цьому способі, для одержання сполуки (І) за винаходом, відновлення олефіну і дебензилування можна здійснювати одночасно. Із зазначених вище каталізаторів, паладій на активованому вугіллі або гідроксид паладію є переважними. Приклади використовуваного у цій реакції розчинника можуть включати метанол, етанол, 2-пропанол, етилацетат, оцтову кислоту і розчинник з їх сумішей. Температура реакції знаходиться в інтервалі від кімнатної температури до температури кипіння розчинника; однак, кімнатна температура є переважною. Альтернативно, при дебензилуванні можна використовувати кислоту Льюїса, таку як BF3-Et2O, BCl3, BCl3·Me2S, BBr3, AlCl3, CF3COOH або ТfОН. Приклади розчинника, використовуваного у цій реакції, можуть включати хлороформ, дихлорметан, ацетонітрил, діетиловий ефір, тетрагідрофуран, диметилсульфід і анізол. З них, переважно використовувати CF3COOH, ТfOН або етандитіол у диметилсульфіді. Температура реакції переважно знаходиться в інтервалі від -78°С до 40°С. СПОСІБ ОДЕРЖАННЯ 2 Сполука (І) за винаходом, де Υ є С2-6 алкіленовою групою або С2-6 алкеніленовою групою, і Ζ є B C NHC(=NH)NH2 або -NHCON(R )R , може бути синтезована наведеним нижче способом. Зазначимо, 23 1 95635 24 B C що у формулі Z являє собою гуанідиногрупу, захищену бензилоксикарбонільною групою або NHCON(R )R , a інші згадані позначення аналогічні визначеним вище. (4) Стадія 4. Реакція Хека Сполука (ІА) і аліламін (IE) за реакцією Хека, описаною на стадії 1, можуть бути перетворені у сполуку (IF). (5) Стадія 5. Відновлення і зняття захисту У сполуці (IF), одержаній вище, знімають захист каталітичним гідруванням або кислотою Льюїса, як описано на стадії 3, з одержанням сполуки (І) за винаходом, де Ζ являє собою гуанідиногрупу або уреїдогрупу. СПОСІБ ОДЕРЖАННЯ 3 Сполука (І) за винаходом, де Υ є одинарним зв'язком або С1-6 алкіленовою групою і Ζ є NHCON(R )R , також може бути синтезована наведеним нижче способом. 13 14 Зазначимо, що R і R формули можуть бути однаковими або різними і можуть являти собою атом водню, бензилоксигрупу, С1-6 алкільну 1 групу, С1-6 алкоксигрупу або атом галогену. Ρ являє собою метоксиметильну групу, тетрагідропіранільну групу або (С1-6 алкіл)3Sі-, а інші згадані позначення аналогічні визначеним вище. Проміжна сполука (llВ) або проміжна сполука (IIF), де Υ являє собою одинарний зв'язок або С1-6 алкіленову групу, також можуть бути синтезовані способом, аналогічним описаному для стадій 34-36, наведених нижче. B C 25 (6) Стадія 6 Ариллітієвий реагент може бути одержаний з проміжної сполуки (llА) (яка може бути синтезована відповідно до опису, наведеного у WO 06/073197) за допомогою використання металоорганічного реагенту, такого як н-бутиллітій, вторбутиллітій або трет-бутиллітій. Його піддають реакції конденсації з δ-лактоном (X) з одержанням сполуки (llВ). Приклади розчинника, використовуваного у цій реакції, можуть включати тетрагідрофуран, діетиловий ефір і толуол. Температура реакції знаходиться в інтервалі від 80°С до кімнатної температури, і, переважно, від -78°С до -25°С. (7) Стадія 7. Відновлення гідроксильної групи Сполуку (llВ) і Et3SiH, i-Pr3SiH, t-BuMe2SiH або Ph2SiHCl піддають взаємодії у присутності кислоти Льюїса для відновлення гідроксильної групи. Приклади кислоти Льюїса, використовуваної у цій реакції, можуть включати BF3-Et2O, CF3COOH, ІnСl3, ТіСl4, TMSOTf, п-толуолсульфокислоту і метансульфонову кислоту. Приклади розчинника включають хлороформ, дихлорметан, толуол, тетрагідрофуран, ацетонітрил і розчинник, що являє собою їх суміші. Переважний розчинник, що є сумішшю, який містить ацетонітрил, такий як сумішацетонітрил/хлороформ, суміш ацетонітрил/дихлорметан, суміш ацетонітрил/тетрагідрофуран і суміш ацетонітрил/тетрагідрофуран/толуол. Температура реакції тут знаходиться в інтервалі від -60°С до 25°С і, переважно, від -30°С до 25°С. У зазначеній вище реакції, в залежності від 1 температури реакції, захисну групу Р необов'язково видаляють. У цьому випадку необов'язково 1 одержують сполуку (llС), з якої Р видалена. (8) Стадія 8. Гідроліз 1 Після стадії 7, захисна група Р може бути видалена при використанні хлористоводневої кислоти, сірчаної кислоти, моногідрату птолуолсульфокислоти, піридиній-птолуолсульфокислоти, піридину-фтористого водню, H-Bu4NF і т.п. Приклади розчинника, використовуваного у цій реакції, можуть включати метанол, етанол, 2-пропанол, хлороформ, дихлорметан, толуол, тетрагідрофуран, ацетонітрил, діізопропіловий ефір, воду і розчинник, що 1 являє собою їх суміші. Коли Р є метоксиметильною групою, переважною кислотою є хлористоводнева кислота і переважним розчинником є метанол, діізопропіловий ефір, толуол або тетрагідрофуран. І більш переважним є розчинник, що являє собою суміш, яка містить метанол, таку як суміш метанол/толуол, суміш метанол/діізопропіловий ефір або суміш метанол/толуол/діізопропіловий ефір. Температура реакції відрізняється, в залежності від використовуваного розчинника або кислоти, однак, вона знаходиться в інтервалі від 0°С до 100°С і, переважно, від 0°С до 80°С. (9) Стадія 9. Реакція заміщення Сполуку (llС), де Υ є С1-6 алкіленовою групою, а реагент (IID) піддають конденсації в умовах реакції Міцунобу (Org. reactions, Vol. 42, p. 335), 95635 26 використовуючи азореагент і фосфін, щоб одержати сполуку (llЕ). Приклади фосфіну, що може бути використаний у реакції Міцунобу, можуть включати трифенілфосфін, три-н-бутилфосфін, три-третбутилфосфін, тритолілфосфін і дифеніл-2піридилфосфін. З них, трифенілфосфін дифеніл2-піридилфосфін є переважними; і трифенілфосфін є більш переважним. Приклади азореагенту включають діетилазодикарбоксилат, діізопропілазодикарбоксилат, дитретбутилазодикарбоксилат, 1,1'-азо-біс(N,Nдиметилформамід) і 1,1'(азодикарбоніл)дипіперидин. З них діетилазодикарбоксилат і діізопропілазодикарбоксилат є переважними. Приклади розчинника включають тетрагідрофуран, діоксан, толуол, метиленхлорид, хлороформ, ацетонітрил, етилацетат, диметилсульфоксид і Ν,Ν-диметилформамід і, переважно, тетрагідрофуран і толуол. Температура реакції, переважно, знаходиться в інтервалі від 20°С до кімнатної температури. (10) Стадія 10. Видалення фталіміду Сполуку (llЕ) і гідразингідрат або метилгідразин піддають взаємодії у відповідному розчиннику для одержання аміну (IIF). Переважні приклади використовуваного тут розчинника включають метанол, етанол, тетрагідрофуран, воду і розчинник, що являє собою їх суміші. Температура реакції знаходиться в інтервалі від кімнатної температури до 100°С і, переважно, від кімнатної температури до 60°С. Одержаний амін (IIF) може бути очищений за допомогою утворення солі з мінеральною кислотою або органічною кислотою, як вказувалося вище. Приклади солі, переважно використовуваної для очищення, включають гідрохлорид, метансульфонат, етансульфонат, 2гідроксіетансульфонат, бензолсульфонат і птолуолсульфонат; і, більш переважно, бензолсульфонат. (11) Стадія 11. Утворення сечовини Сполука (IIF) може бути синтезована за допомогою реагенту карбонілювання і NH(R )R для синтезу сполуки (IIG). Приклади реагенту карбонілювання включають 1,1'-карбонілдіімідазол, пнітрофенілхлорформіат і трифосген. У цій реакції, переважно, може бути використана така основа як триетиламін, або піридин Nметилморфолін. Приклади використовуваного тут розчинника включають хлороформ, дихлорметан, тетрагідрофуран, Ν,Ν-диметилформамід і диметилсульфоксид. Може бути використаний змішаний розчинник. Переважні приклади змішаного розчинника включають суміш хлороформ/Ν,Νдиметилформамід, суміш хлороформ/диметилсульфоксид і суміш тетрагідрофуран/N,N-диметилформамід. Температура реакції знаходиться в інтервалі від кімнатної температури до 80°С. При низькій швидкості реакції температуру можна підвищити. (12) Стадія 12. Зняття захисту У сполуці (IIG), одержаній вище, знімають захист каталітичним гідруванням або кислотою 27 95635 28 Льюїса, як описано для стадії 3, щоб одержати сполуку (І) за винаходом, де Ζ є уреїдогрупою. СПОСІБ ОДЕРЖАННЯ 4 Сполука (І) за винаходом, де Ζ є уреїдогрупою, може бути синтезована після захисту гідроксильної групи у глюкозній частині ацильною групою, такою як ацетильна група. (13) Стадія 13. Захист аміногрупи Аміногрупусполуки (IIF) захищають за допомогою захисної групи, стійкої до каталітичного гідрування, наприклад, трет-бутилкарбонатом (Вос) або 9-флуоренілметилкарбонатом (Fmoc). Сполуку (IIF), (Вос)2О і Fmoc-Cl залишають для взаємодії у розчиннику, такому як хлороформ, дихлорметан, тетрагідрофуран або діоксан у присутності відповідної основи, щоб одержати сполуку (IIJ). Переважні приклади основи включають карбонат натрію, гідрокарбонат натрію, карбонат калію, гідроксид калію, гідрид натрію, піридин і триетиламін. (14) Стадія 14. Зняття бензильної захисної групи Зняття захисту у сполуці (IIJ), одержаній вище, здійснюють каталітичним гідруванням, описаним для стадії 3, з одержанням сполуки (IIK). (15) Стадія 15. Ацилювання Гідроксильну групу сполуки (IIK) захищають ацильною групою, такою як ацетильна група, щоб одержати сполуку (IIL). Сполуку (IIK), оцтовий ангідрид, півалоїлхлорид, бензоїлхлорид і так далі залишають для взаємодії у розчиннику у присутності відповідної основи, щоб одержати сполуку (IIL). Приклади розчинника, використовуваного у реакції, включають хлороформ, дихлорметан, діоксан, етилацетат, тетрагідрофуран і Ν,Ν-диметилформамід. Переважні приклади основи включають триетиламін, колідин і піридин. Як каталізатор можна використовувати 4диметиламінопіридин. Температура реакції, пе реважно, знаходиться в інтервалі від 0°С до кімнатної температури. (16) Стадія 16. Зняття захисту У сполуці (IIL) знімають захисну групу аміногрупи, щоб одержати сполуку (llМ). При захисній групі Вос, сполуку (IIL) залишають для взаємодії з хлористоводневою кислотою або трифтороцтовою кислотою у такому розчиннику як дихлорметан, хлороформ або діоксан, або без використання розчинника. Для випадку групи Fmoc, сполуку (IIL) залишають для взаємодії, переважно, з піперидином або морфоліном в Ν,Νдиметилформаміді. (17) Стадія 17. Утворення сечовини Сполука (IIN) може бути синтезована зі сполуки (llМ) способом, аналогічним способу, використовуваному на стадії 11, описаній вище. (18) Стадія 18. Зняття захисту Ацильну групу сполуки (IIN) видаляють у лужних умовах, щоб одержати сполуку (І) за винаходом. Приклади лугів можуть включати метилат натрію, гідроксид натрію, гідроксид літію, карбонат калію, карбонат цезію і триетиламін. Переважні приклади розчинника включають метанол, етанол і водний метанол. СПОСІБ ОДЕРЖАННЯ 5 Сполука (І) за винаходом, де Υ є -О-(СН2)n- і Ζ B C є -NHCON(R )R , може бути синтезована наведеним нижче способом. Зазначимо, що на схемі 2 Y є С2-4 алкіленовою групою, а інші згадані позначення аналогічні визначеним вище. 29 (19) Стадія 19 Сполука (IIP) може бути одержана аналогічно до способу одержання 3, стадія 6 зі сполуки (llО) (яка може бути синтезована відповідно до опису, наведеного у WO 06/073197) і сполуки (X). (20-21) Стадія 20 і Стадія 21 У сполуці (IIP) відновлюють гідроксильну гру1 пу і знімають захисну групу Р , способом, аналогічним способу, наведеному у способі одержання 3, стадії 7 і 8, щоб одержати сполуку (IIQ). (22) Стадія 22 Сполуку (IIQ) і реагент (IIR) залишають для взаємодії у присутності основи, щоб одержати сполуку (IIS). Переважні приклади основи, використовуваної тут, можуть включати карбонат натрію, карбонат калію, гідроксид калію, гідрид натрію, піридин, триетиламін. Приклади використовуваного у цій реакції розчинника можуть включати діоксан, ацетонітрил, толуол, диметоксіетан, тетрагідрофуран, Ν,Νдиметилформамід. Температура реакції тут, переважно, знаходиться в інтервалі від 20°С до 100°С. 95635 30 (23) Стадія 23 У сполуці (IIS) знімають фталімідну групу способом, аналогічним способу, наведеному у способі одержання 3, стадії 10, щоб одержати сполуку (llТ). (24) Стадія 24 Сполука (ІIU) може бути одержана зі сполуки (llТ) способом, аналогічним способу одержання 3, стадії 11. (25) Стадія 25 У сполуці (ІIU) знімають захист методом, аналогічним методу, наведеному у способі одержання 3, стадії 12, щоб одержати сполуку (І) за винаходом, де Υ є -О-(CH2)n-. СПОСІБ ОДЕРЖАННЯ 6 Сполука (І) за винаходом, де Υ є -О-(СН2)n- і Ζ A є -CONHR може бути синтезована також наведеним нижче способом. Зазначимо, що на схемі 3 Y є С1-4 алкіленовою групою, L1 являє собою відхідну групу, таку як атом галогену, МеSО2О- і так далі, а інші згадані позначення аналогічні визначеним вище. 31 95635 32 (26) Стадія 26 Сполуку (IIQ) і сполуку (IIV) залишають для взаємодії у присутності основи, щоб одержати сполуку (IIW). Переважні приклади основ, використовуваних тут, можуть включати гідрид натрію, карбонат натрію, карбонат калію, карбонат цезію, н-бутиллітій. Переважні приклади розчинника, використовуваного у цій реакції, можуть включати тетрагідрофуран, діетиловий ефір, Ν,Νдиметилформамід, ацетон, ДМСО (DMSO). Температура реакції тут знаходиться в інтервалі від 0°С до 60°С. (27) Стадія 27 У сполуці (IIW) знімають захист методом, аналогічним методу, наведеному у способі одержання 3, стадії 12, щоб одержати сполуку (І) за A винаходом, де Υ є -О-(СН2)n- і Ζ є -CONHR . СПОСІБ ОДЕРЖАННЯ 7 Сполука (І) за винаходом, де Ζ є гетероциклоалкільною групою, такою як 2,4діоксоімідазолініл, може бути синтезована наведеним нижче способом. Зазначимо, що на схемі N R є гідроксильною групою, С1-4 алкоксигрупою або фенільною групою, а інші згадані позначення аналогічні визначеним вище. (28) Стадія 28 A B Сполуку (llМ) піддають конденсації з R R NH, наприклад, аміном, що має карбонільну групу в αположенні, таким як 2-аміноацетофенон або амінокислота, методом, аналогічним методу, наведеному у способі одержання 4, стадії 17, щоб одержати сполуку (llХ). (29) Стадія 29. Зняття захисту в основних умовах У сполуці (llХ) знімають захист ацетильною групою і одночасно піддають бічний ланцюг спо луки (llХ) внутрішньомолекулярній циклізації, щоб одержати сполуку (І) за винаходом, де Ζ є гетероциклоалкільною групою, визначеною вище. Використовувана тут основа, переважно, є метилатом натрію, а розчинник, переважно, є метанолом або етанолом. СПОСІБ ОДЕРЖАННЯ 8 Сполука (І) за винаходом, де Υ являє собою одинарний зв'язок, метиленову групу або -O(CH2)n-, a Z є -NHC(=NH)NH2, може бути синтезована наведеним нижче способом. 33 95635 34 (30) Стадія 30. Введення гуанідиногрупи Сполуку (IIF) або сполуку (ІІТ), одержані на стадії 38 або стадії 23, піддають взаємодії з реагентом (llА1), щоб одержати сполуку (llΑ2). Переважні приклади розчинника, використовуваного у цій реакції, можуть включати тетрагідрофуран, Ν,Ν-диметилформамід, метанол, етанол, ізопропанол, етилацетат, толуол. Температура реакції тут знаходиться в інтервалі від кімнатної температури до температури кипіння розчинника. (31) Стадія 31 У сполуці (ІІА2) знімають захист методом, аналогічним методу, наведеному для стадії 12 способу одержання 3, щоб одержати сполуку (І) за винаходом, де Υ являє собою одинарний зв'язок, метиленову групу або -О-(СН2)n- і Ζ є NHC(=NH)NH2. Способи одержання проміжних сполук для одержання сполуки (І) будуть описані нижче. Спосіб одержання проміжної сполуки (ІА) Спосіб одержання проміжної сполуки (ІА), необхідної для одержання сполуки (І) за винаходом, 1 буде описаний нижче. Зазначимо, що D являє собою Li або MgBr (MgBr2). Інші згадані позначення аналогічні позначенням, визначеним вище. (32) Стадія 32 Реагент ариллітію може бути одержаний з проміжної сполуки (lllА) (яка може бути синтезована, відповідно до викладеного у WO 06/073197) при використанні такого металорганічного реагенту, як н-бутиллітій, втор-бутиллітій або третбутиллітій. Реагент ариллітію піддають конденсації з δ-лактоном (Х), щоб одержати сполуку (lllВ). Приклади розчинника, використовуваного у цій реакції, можуть включати тетрагідрофуран, діетиловий ефір і толуол. Температура реакції знаходиться в інтервалі від -80°С до кімнатної температури і, переважно, в інтервалі від -78°С до -25°С. (33) Стадія 33. Кислотний гідроліз Ацетальну групу сполуки (lllВ) піддають гідролізу, використовуючи хлористоводневу кислоту і моногідрат п-толуолсульфокислоти і так далі, щоб одержати сполуку (llІС). Переважні приклади розчинника, використовуваного тут, включають тетрагідрофуран, етанол, метанол, воду і їх суміші. Температура реакції знаходиться в інтервалі від 4°С до кімнатної температури; кімнатна температура є переважною. Час реакції змінюється в залежності від температури реакції, і складає від 1 години до 24 годин. (34) Стадія 34 Сполуку монолітієвого реагенту (ІllЕ) можна одержати зі сполуки (IIID), використовуючи один еквівалент н-бутиллітію, втор-бутиллітію або трет-бутиллітію відносно сполуки (IIID). Приклади 35 95635 36 розчинника, використовуваного у цій реакції, можуть включати тетрагідрофуран, діетиловий ефір і толуол. Температура реакції знаходиться в інтервалі від -80°С до кімнатної температури і, переважно, в інтервалі від -78°С до -25°С. Час реакції переважно складає від 5 хвилин до 30 хвилин. Більш того, реактив Гріньяра (ІllЕ) також можна одержати, використовуючи один еквівалент металевого магнію. Приклади розчинника, використовуваного у цій реакції, можуть включати тетрагідрофуран, діетиловий ефір і диглім. Потім, реагент (ІllЕ) додають до проміжної сполуки (llІС), щоб одержати сполуку (IIIF). Температура реакції знаходиться в інтервалі від -80°С до кімнатної температури і, переважно, в інтервалі від -78°С до -25°С. (35) Стадія 35. Відновлення гідроксильної групи. Сполука (ІА) може бути синтезована зі сполуки (IIIF) методом, аналогічним методу стадії 7, наведеної вище. Спосіб одержання проміжної сполуки (llВ) або (IIF) Проміжну сполуку (llВ) або (IIF), описану вище, можна синтезувати іншим шляхом, показаним нижче (36) Стадія 36 Сполука (IVC) або (IVD) може бути синтезована зі сполуки (IVA) або (IVB) методом, аналогічним методу стадії 34, наведеної вище. (37) Стадія 37. Відновлення гідроксильної групи Проміжна сполука (llВ) може бути синтезована зі сполуки (IVC) методом, аналогічним методу стадії 7, наведеної вище. Більш того, η проміжна сполука (IVE) може бути синтезована зі сполуки (IVD). (38) Стадія 38 Сполуку (IVE) обробляють хлористоводневою кислотою або трифтороцтовою кислотою у хлороформі або дихлорметані для видалення тритильної (Тr) захисної групи аміногрупи, так щоб у результаті могла бути синтезована проміжна сполука (IIF). Температура реакції тут, переважно, знаходиться в інтервалі від 0°С до кімнатної температури. Сполука за винаходом інгібує як активність SGLT1, так і активність SGLT2, які залучені до процесу придушення поглинання глюкози з травного тракту, і до процесу екскреції глюкози з сечею, відповідно. Через інгібування SGLT1, сполука за винаходом здатна лікувати цукровий діабет і зменшувати IGT, перешкоджаючи тим самим розвитку цукрового діабету. Через інгібування SGLT2, сполука за винаходом може перешкоджати реабсорбції цукру і видаляти надлишковий цукор з організму, щоб тим самим лікувати цукровий діабет. Таким чином, сполука за даним винаходом здатна коректувати гіперглікемію без виснаження панкре атичних β клітин, внаслідок токсичності глюкози, і поліпшувати інсулінорезистентність. Тому, сполука за даним винаходом може бути використана як інгібітор SGLT1 і як інгібітор SGLT2. Даний винахід пропонує фармацевтичний препарат для запобігання або лікування захворювань або станів, які можна полегшити інгібуванням активностей SGLT1 і SGLT2, наприклад, цукрового діабету, захворювань, пов'язаних з цукровим діабетом, і ускладнень, викликаних цукровим діабетом. Термін "цукровий діабет", використовуваний тут, включає цукровий діабет 1-го типу і цукровий діабет 2-го типу та інші типи цукрового діабету специфічної етіології. Приклади терміну "захворювання, пов'язані з цукровим діабетом", використовуваного тут, можуть включати ожиріння, гіперінсулінемію, аномальний вуглеводний метаболізм, гіперліпідемію, гіперхолестеринемію, гіпертригліцеридемію, аномальний ліпідний метаболізм, артеріальну гіпертензію, застійну серцеву недостатність, набряк, гіперурикемію і подагру. Термін "ускладнення цукрового діабету", використовуваний тут, можна класифікувати як гострі ускладнення і хронічні ускладнення. Приклади, охоплювані терміном "гострі ускладнення", можуть включати гіперглікемію (наприклад, кетоацидоз) та інфекційні захворювання (наприклад, шкірні інфекції, інфекції м'яких тканин, інфекції системи жовчних проток, респіраторні інфекції та інфекції сечових шляхів). 37 Приклади, охоплювані терміном "хронічні ускладнення", можуть включати мікроангіопатію (наприклад, нефропатію, ретинопатію), артеріосклероз (наприклад, атеросклероз, інфаркт міокарда, церебральний інфаркт, оклюзійне ураження артерій нижніх кінцівок), невропатію (наприклад, сенсорні нерви, рухові нерви, вегетативні нерви), гангрену стопи і так далі. Приклади основних ускладнень включають діабетичну ретинопатію, діабетичну нефропатію і діабетичну невропатію. Сполуки за винаходом також можуть бути використані у комбінації з яким-небудь лікарським засобом (який надалі позначається тут просто як "супутній лікарський засіб"), таким як діабетичні лікарські засоби, лікарські засоби проти діабетичних ускладнень, протиліпідемічні лікарські засоби, гіпотензивні лікарські засоби, лікарські засоби проти ожиріння, діуретичні лікарські засоби і лікарські засоби, що знижують зсілість крові, які підпорядковуються іншому механізму дії, ніж інгібування активності SGLT1 і SGLT2. Очікується, що при об'єднанні сполуки за даним винаходом з іншими лікарськими засобами відбудеться посилення впливу і зниження дози сполуки. У цьому випадку не обмежують час введення сполуки за винаходом і супутнього лікарського засобу. Вони можу бути введені пацієнту одночасно або у різний час. Більш того, сполука за винаходом і супутній лікарський засіб можуть бути введені як два незалежних препарати, кожний з яких містить активний інгредієнт. Або вони можуть бути введені як єдиний препарат, що містить у вигляді активного інгредієнта обидва засоби. Доза супутнього лікарського засобу може бути вибрана, базуючись, відповідно, на клінічно використовуваному дозуванні. Співвідношення компонентів у суміші сполуки за винаходом і супутнього лікарського засобу може бути відповідно вибране з врахуванням особливості пацієнта, якому вводять ліки, шляху введення, захворювання, що піддається лікуванню, прояву захворювання і комбінації. Наприклад, якщо пацієнт, якому вводять ліки, є людиною, супутній лікарський засіб може бути використаний у кількості від 0,01 до 100 масових частин відносно 1 масової частини сполуки за винаходом. Зазначимо, що приклади діабетичних лікарських засобів можуть включати інсулінові препарати (наприклад, препарати тваринного інсуліну, екстрагованого з підшлункової залози великої рогатої худоби і свиней; препарати людського інсуліну, генетично синтезованого при використанні Escherichia coli або дріжджів; інсулін-цинк; суміш протамін/інсулін-цинк, інсуліновий фрагмент або похідне (наприклад, INS-1), оральний інсуліновий препарат); модифікатор інсулінорезистентності, (наприклад, піоглітазон або його сіль (переважно, гідрохлорид), розиглітазон або його сіль (переважно малеат), ривоглітазон (CS-011)(R-119702), сипоглітазар (ТАK-654), метаглідазен (МВХ-102), навеглітазар (LY-519818), МХ-6054, балаглітазон (NN-2344), Т-131 (АМГ131); агоніст PPARγ, антагоніст PPARγ, подвійний агоніст PPARγ/α; інгібітор αглюкоцидази (наприклад, воглібоза, акарбоза, міглітол, еміглітат); бігуанідний агент (наприклад, 95635 38 феноформін, метформін, буформін або їх солі (наприклад, гідрохлорид, фумарат, сукцинат)); стимулятор секреції інсуліну (сульфоніл сечовина (наприклад, толбутамід, глібенкламід, гліклазид, хлорпропамід, толазамід, ацетогексамід, глікопірамід, глімепірид, гліпізид, глібузол, репаглінід, сенаглінід, натеглінід, мітиглінід або гідрати їх кальцієвих солей); агоніст GPR40, антагоніст GPR40, агоніст GLP-1 рецептора (наприклад, GLP-1, агент GLP-1MR, ліралітид (NN-2211), екзенатид (АС2993) (екзендин-4), екзенатид LAR, ВІМ-51077, Aib (8, 35) hGLP-1(7, 37)NH2, CJC-1131, AVE0010, GSK-716155); агоніст аміліну (наприклад, прамлінтид); інгібітор фосфотирозинфосфатази (наприклад, ванадат натрію); інгібітор дипептидилпептидази IV (наприклад, сполуки, описані у WO 02/038541, NVP-DPP-278, РТ-100, Р32/98, вілдагліптин (LAF-237), P93/01, ситагліптин (МK-431), саксагліптин (BMS-477118), SYR-322, МР-513, Т6666, GRC-8200); агоніст β3 (наприклад, AJ-9677, AZ40140); інгібітор гліконеогенезу (наприклад, інгібітор глікогенфосфорилази, інгібітор глюкоза-6фосфатази, антагоніст глюкагону, інгібітор фруктоза-1,6-бісфосфатази); інгібітор SGLT (співпереносника натрій-глюкози) (наприклад, сполуки, описані у WO04/014931, WO04/089967, WO06/073197, Т1095, сергліфлозин (GSK-869682), GSK-189075, KGT-1251, KGT-1681, KGA-2727, BMS-512148, AVE2268, SAR7226); інгібітор 11β-гідроксистероїддегідрогенази (наприклад, сполуки, описані у WO 06051662, BVT-3498, INCB13739); агоніст GPR119 (наприклад, PSN-632408, APD-668), адипонектин або його агоніст; інгібітор ІKK (наприклад, AS2868), активатор АМРK; модифікатор лептинорезистентності; агоніст рецептора соматостатину; активатор глюкокінази (наприклад, Ro-28-1675), інгібітор панкреатичного ферменту ліпази (наприклад, орлістат, ATL-962), та інгібітор DGAT-1. Приклади лікарських засобів для лікування діабетичних ускладнень можуть включати інгібітор альдозоредуктази (наприклад, толрестат, епалрестат, зенарестат, зополрестат, міналрестат, фідарестат, СТ-112); нейротрофічний фактор і лікарський засіб, що стимулює його, (наприклад, NGF, NT3, BDNF, продукування нейротрофіну/стимулятора секреції); стимулятор реактивації нервової системи (наприклад, Y-128); інгібітор РKС (наприклад, рубоксистауринмезилат, LY-333531); інгібітор вікових змін (наприклад, ALT946, пімагедин, піратоксатин, N-фенацилтіазолбромід (ALT766), ALT-711, ЕХО-226, піридорин, піридоксамін); агент видалення активного кисню (наприклад, тіоктова кислота); церебральний судинорозширювальний агент (наприклад, тіаприд, мексилетин); агоніст соматостатинового рецептора (наприклад, ВІМ 23190) та інгібітор кінази-1 (ASK-1), що регулює сигнал апоптозу. Приклади гіполіпідемічних лікарських засобів можуть включати такі сполуки як статини (наприклад, правастатин, симвастатин, ловастатин, аторвастатин, флувастатин, ітавастатин, розувастатин, пітавастатин або їх солі (наприклад, натрієва сіль, кальцієва сіль)); інгібітор скваленсинтази (наприклад, ТАK-475); сполуки фібратів (наприклад, бензафібрат, клофібрат, симфібрат, клінофібрат); 39 інгібітор АСАТ (наприклад, авазиміб), ефлюсиміб), аніонообмінну смолу (наприклад, холестирамін); пробукол, нікотиновий лікарський засіб (наприклад, нікомол), ніцеритрол), етилікосапентат, стерин рослинного походження (наприклад, соєвий стерин), γ-оризанол); інгібітор СЕТР (наприклад, торсетрапіб, JTT-705, JTT-302, FM-VP4) і супресор абсорбції холестерину (наприклад, езетимід). Приклади гіпотензивного засобу можуть включати інгібітор ангіотензин-перетворюючого ферменту (наприклад, каптоприл, еналаприл, делаприл); антагоніст ангіотензину II (наприклад, кандесартан, силексетил, лозартан, епросартан, валсартан, телмісартан, ірбесартан, тазосартан, азилсартан (ТАK-536)); антагоніст кальцію (наприклад, манідипін, ніфедипін, амлодипін, ефонідипін, нікардипін), агент, що відкриває калієві канали, (наприклад, левкромакалім, L-27152, AL0 671, NIP-121) і клонідин. Приклади лікарських засобів, які перешкоджають ожирінню, можуть включати лікарський засіб проти ожиріння центральної дії (наприклад, дексфенфлурамін, фенфлурамін, фентермін, сибутрамін, амфепрамон, дексамфетамін, мазіндол, фенілпропаноламін, клобензорекс); антагоніст МСН рецептора (наприклад, сполуки, описані у WO 06/035967, SB-568849; SNAP-7941, Т-226296); антагоніст нейронентиду Υ (наприклад, СР-422935); антагоніст канабіноїдного рецептора (наприклад, римонабант (SR-141716), SR-147778); антагоніст греліну; інгібітор 11β-гідроксистероїддегідрогенази (наприклад, BVT-3498, INCB13739)); інгібітор панкреатичного ферменту ліпази (наприклад, орлістат, ATL-962); інгібітор DGAT-1; агоніст β3 (наприклад, AJ-9677, AZ40140), пептидергічний лікарський засіб, що знижує апетит (наприклад, лептин, CNTF (нейротрофічний фактор циліарного тіла); агоніст холіцистокініну (наприклад, лінтитрипт, FPL-15849); агент пригнічення харчування (наприклад, Р-57). Приклади діуретичних лікарських засобів можуть включати похідне ксантину (наприклад, теобромінсаліцилат натрію, теобромінсаліцилат кальцію); тіазидний препарат (наприклад, етіазид, циклопентіазид, трихлорметіазид, гідрохлортіазид, гідрофлуметіазид, бентилгідрохлортіазид, пенфлутіазид, політіазид, метиклотіазид); антиальдостер оновий препарат (наприклад, спіронолактон, триамтерен); інгібітор карбоангідрази (наприклад, ацетазоламід, хлорбензолсульфонамідний препарат (наприклад, хлорталідон, мефрусид, індапамід, азосемід, ізосорбід, етакринову кислоту, піретанід, буметанід і фуросемід. Приклади антитромботичних лікарських засобів можуть включати гепарин (наприклад, гепариннатрій, гепарин-кальцій, далтепарин-натрій, AVE5026), варфарин (наприклад, варфарин-калій); антитромботичний агент (наприклад, аргатробан, ксимелагатран, дабігатран, одипрасил, лепірудин, бівалірудин, дезирудин, ART-123, ідрапаринукс, SR-123781, AZD-0837, МСС-977, TGN-255, TGN167, RWJ-58436, LB-30870, МРС-0920, пегмузирудин, Org-426751); тромболітичний засіб (наприклад, урокіназа, тизокіназа, альтеплаза, натеплаза, монтеплаза, памітеплаза); інгібітор агрегації 95635 40 тромбоцитів (наприклад, тиклепідин гідрохлорид, цилостазол, етилікозапентат, берапрост-натрій, сарпогрелат гідрохлорид); інгібітор фактора Ха (наприклад, фондапаринукс, BAY-59-7939, DU176b, YM-150, SR-126517, апіксабан, разаксабан, LY-517717, MLN-102, октапарин, отаміксабан, EMD-503982, ТС-10, CS-3030, AVE-3247, GSK813893, KFA-1982); інгібітор карбоксипептидази В плазми (або, відомий як [TAFIa], інгібітор фібринолізу, що активується активною формою тромбіну), такий як AZD-9684, EF-6265, MN-462. Фармацевтичний препарат за даним винаходом може бути введений системно або місцево через оральний шлях введення або парентеральний шлях введення (наприклад, через пряму кишку, підшкірно, внутрішньом'язово, внутрішньовенно, черезшкірно). Для використання як фармацевтичний препарат, сполука за даним винаходом може бути складена у вигляді будь-якої необхідної дозованої форми, вибраної з твердих композицій, рідких композицій та інших композицій, що відповідають призначенню. Фармацевтичний препарат за даним винаходом може бути одержаний шляхом змішування сполуки за даним винаходом з фармацевтично прийнятним(и) носієм(ями). Більш конкретно, сполука за даним винаходом може бути доповнена широко застосовуваними ексципієнтами, розріджувачами, зв'язувальними речовинами, дезінтегруючими агентами, агентами для покриттів, агентами, що покривають цукром, регуляторами рН, солюбілізаторами, водними або неводними розчинниками і так далі; потім, використовуючи стандартні методики, формують таблетки, пігулки, капсули, гранули, порошки, розчини, емульсії, суспензії, розчини для ін'єкцій і так далі. Крім того, сполука за даним винаходом перед складанням може бути модифікована з утворенням сполуки включення з, наприклад, α-, β- або γциклодекстрином або метильованим циклодекстрином. Доза для дорослих сполуки за даним винаходом буде варіювати, в залежності від захворювання або симптому, що піддається лікуванню, маси тіла, віку, статі і шляху введення. Але вона попадає в інтервал від 0,1 до 1000 мг/кг маси/день, переважно, 0,1-200 мг/кг маси/день, і більш переважно, 0,1-10 мг/кг маси/день. Вона може бути введена за один раз або розділена на декілька разів на день. ДОВІДКОВІ ПРИКЛАДИ Одержання проміжних сполук, необхідних для одержання сполук за даним винаходом, буде показано нижче з посиланнями на наведені нижче довідкові приклади. ДОВІДКОВИЙ ПРИКЛАД 1 Одержання 2-[4-(бензилокси)-5-бром-2метилфеніл]-1,3-діоксолану (1) Одержання метилфеніл]етанону 1-[4-(бензилокси)-2 41 До розчину 4'-гідрокси-2'-метил ацетофенону (3,06 г, 20 ммоль) в Ν,Ν-диметилформаміді (20 мл) додавали карбонат калію (3,66 г, 26,4 ммоль), бензилбромід (2,7 мл, 22,4 ммоль) і h-Bu4NI (0,75 г, 2,03 ммоль); і суміш перемішували 14 годин при кімнатній температурі. До реакційного розчину, охолодженого у льоді, додавали насичений розчин хлориду амонію і потім воду і етилацетат, щоб відділити органічний шар. Органічний шар промивали 20% водним розчином тіосульфату натрію і насиченим сольовим розчином, і сушили безводним сульфатом магнію. Осушник відфільтровували і розчинник випарювали при зниженому тиску. Одержаний таким чином залишок очищали колонковою хроматографією на силікагелі (суміш гексан:етилацетат = від 8:1 до 6:1), щоб одержати зазначену у назві сполуку (5,05 г, кількісно) у вигляді безбарвного порошку. 1Н ЯМР (300 МГц, ХЛОРОФОРМ-D) δ м.ч. 2,55 (с, 3Н) 2,57 (с, 3Н) 5,11 (с, 2Н) 6,78-6,86 (м, 2Н) 7,30-7,47 (м, 5Н) 7,75 (дд, J=7,93, 1,09 Гц, 1Н). (2) Одержання 4-(бензилокси)-5-бром-2метилбензойної кислоти До розчину в ацетоні (300 мл) 1-[4(бензилокси)-2-метилфеніл]етанону (20,9 г, 87,1 ммоль) додавали водний розчин (100 мл) NaBr (9,86 г, 95,9 ммоль), воду (200 мл) і Оксон (зареєстрований товарний знак, оксон-хлорангідрид надсірчаної кислоти, (Aldrich) (59,0 г, 95,9 ммоль); і суміш перемішували 2,5 години при кімнатній температурі. До реакційного розчину, охолодженого у льоді, додавали водний розчин (50 мл) сульфіту натрію (20 г), потім воду і етилацетат, щоб відділити органічний шар. Органічний шар промивали 20% водним розчином сульфіту натрію і насиченим сольовим розчином, і сушили безводним сульфатом магнію. Осушник відфільтровували і розчинник випарювали при зниженому тиску, щоб одержати суміш (27,2 г) 1-[4-(бензилокси)-5-бром2-метилфеніл]етанону і 1-[4-(бензилокси)-3-бром2-метилфеніл]етанону. До суміші додавали 5% водний розчин (300 мл, 255 моль) гіпохлориту натрію і водний розчин (10 мл) гідроксиду калію (4,80 г, 85,3 ммоль), перемішували при 120°С одну годину, охолоджували до кімнатної температури і фільтрували осаджену нерозчинну речовину. До цієї нерозчинної речовини додавали 2 Μ хлористоводневу кислоту і одержану суміш екстрагували етилацетатом. Органічний шар промивали 2 Μ хлористоводневою кислотою і насиченим сольовим розчином, і сушили безводним сульфатом магнію. Осушник відфільтровували і розчинник випарювали при зниженому тиску. Одержаний таким чином залишок промивали метанолом, щоб одержати зазначену у назві сполуку (16,6 г, 59%, 2 стадії) у вигляді безбарвного порошку. 1Н ЯМР (300 МГц, DMSO-D6) δ м.ч. 2,45-2,57 (м, 3Н) 5,28 (с, 2Н) 7,18 (с, 1H) 7,31-7,54 (м, 5Н) 8,03 (с, 1H) 12,83 (уш.с, 1Н). ESI (електророзпилювальна іонізація) m/z=319(М-Н), 321(М+2-Н). (3) Одержання 2-[4-(бензилокси)-5-бром-2метилфеніл]-1,3-діоксолану До суспензії 4-(бензилокси)-5-бром-2метилбензойної кислоти (16,6 г, 51,7 ммоль) у 95635 42 хлороформі (80 мл) додавали оксалілхлорид (5 мл, 56,9 ммоль) і Ν,Ν-диметилформамід (6 крапель); і суміш перемішували одну годину при кімнатній температурі. Потім реакційний розчин концентрували, щоб одержати 4-(бензилокси)-5-бром2-метилбензоїлхлорид. Потім до суспензії у хлороформі (60 мл) Ν,Ο-диметилгідроксиламін гідрохлориду (5,55 г, 56,9 ммоль) і триетиламіну (15 мл, 103 ммоль), охолодженої у льоді, по краплях додавали розчин у хлороформі (60 мл) 4(бензилокси)-5-бром-2-метилбензоїлхлориду, і суміш перемішували одну годину при кімнатній температурі. До реакційного розчину, охолодженого у льоді, додавали воду і хлороформ, щоб відділити органічний шар. Органічний шар промивали насиченим водним розчином бікарбонату натрію і насиченим сольовим розчином, і сушили безводним сульфатом магнію. Осушник відфільтровували і розчинник випарювали при зниженому тиску, щоб одержати 4-(бензилокси)-5-бром-N-метоксиN-метилбензамід. До розчину у тетрагідрофурані (150 мл) 4-(бензилокси)-5-бром-N-метокси-Nметилбензаміду додавали при -10°С алюмогідрид літію (1,96 г, 51,7 ммоль) і суміш перемішували одну годину при тій же температурі. До реакційного розчину додавали 1 Μ хлористоводневу кислоту і потім етилацетат, щоб відділити органічний шар. Органічний шар промивали 1 Μ хлористоводневою кислотою, насиченим водним розчином бікарбонату натрію і насиченим сольовим розчином, і сушили безводним сульфатом магнію. Осушник відфільтровували і розчинник випарювали при зниженому тиску, щоб одержати 4-(бензилокси)-5бром-2-метилбензальдегід. До розчину у толуолі (120 мл) 4-(бензилокси)-5-бром-2метилбензальдегіду додавали етиленгліколь (30 мл, 517ммоль) і моногідрат птолуолсульфокислоти (0,50 г, 2,58 ммоль) і нагрівали 1,5 години в апараті Діна-Старка до температури кипіння розчинника. До реакційного розчину додавали етилацетат, щоб відділити органічний шар. Органічний шар промивали водою, насиченим водним розчином бікарбонату натрію і насиченим сольовим розчином, і сушили безводним сульфатом магнію. Осушник відфільтровували і розчинник випарювали при зниженому тиску. Одержаний таким чином залишок очищали колонковою хроматографією на силікагелі (суміш гексан:етилацетат = 5:1). На додаток, залишок додатково очищали колонковою хроматографією на силікагелі NH типу (хлороформ), щоб одержати зазначену у назві сполуку (12,8 г, 71%, 3 стадії) у вигляді безбарвного порошку. 1H ЯМР (300 МГц, ХЛОРОФОРМ-D) δ м.ч. 2,34 (с, 3Н) 3,92-4,19 (м, 4Н) 5,15 (с, 2Н) 5,87 (с, 1Н) 6,74 (с, 1Н) 7,27-7,51 (м, 5Н) 7,72 (с, 1Н). ДОВІДКОВИЙ ПРИКЛАД 1-2 Одержання 2-[4-(бензилокси)-5-бром-2метилфеніл]-1,3-діоксолану До суспензії у метанолі (3,75 мл) 4(бензилокси)-2-метилбензальдегіду (0,50 г, 2,21 ммоль), охолодженої у льоді, додавали гідробромід пербромпіридинію (1,06 г, 3,32 ммоль); і суміш перемішували 30 хвилин. Реакційну суміш перемішували 2,5 години при кімнатній температурі. До 43 реакційного розчину додавали 20% розчин Na2SO3, воду і етилацетат. Одержану суміш екстрагували етилацетатом. До органічного шару додавали 1 Μ хлористоводневу кислоту (20 мл) і суміш перемішували 5 хвилин. Органічний шар відділяли, промивали насиченим водним розчином бікарбонату натрію і насиченим сольовим розчином, і сушили безводним сульфатом магнію. Осушник відфільтровували, розчинник випарювали при зниженому тиску, щоб одержати 1,03 г залишку. До розчину залишку у толуолі (7,0 мл) додавали етиленгліколь (1,89 мл, 33,9 ммоль), птолуолсульфонат піридинію (43 мг, 0,170 ммоль) і нагрівали 14 годин до температури кипіння розчинника за допомогою апарату Діна-Старка. Після охолодження реакційного розчину, органічний шар промивали насиченим водним розчином бікарбонату натрію і насиченим сольовим розчином, і сушили безводним сульфатом магнію. Осушник відфільтровували, розчинник випарювали при зниженому тиску. Одержаний таким чином залишок перекристалізовували з суміші гексан/етилацетат (10:1), щоб одержати сполуку, зазначену у назві (748 мг, 63%). ДОВІДКОВИЙ ПРИКЛАД 2 Одержання (1S)-1,5-ангідро-2,3,4,6-тетра-Обензил-1-[2-(бензилокси)-5-(4-бромбензил)-4метилфеніл]-D-глюциту (1) Одержання 2,3,4,6-тетра-О-бензил-1-С-[2(бензилокси)-5-(1,3-діоксолан-2-іл)-4-метилфеніл]D-глюкопіранози До розчину у тетрагідрофурані (36 мл) 2-[4(бензилокси)-5-бром-2-метилфеніл]-1,3-діоксолану (5,82 г, 16,6 ммоль) в атмосфері азоту при -78°С по краплях додавали 2,67 Μ розчин н-бутиллітію у гексані (6,40 мл, 16,6 ммоль), і суміш перемішували 30 хвилин при тій же температурі. Потім по краплях додавали розчин у тетрагідрофурані (18 мл) 2,3,4,6-тетра-O-бензил-D-глюконо-1,5-лактону (8,16 г, 15,1 ммоль) і суміш перемішували 20 хвилин при тій же температурі. До реакційного розчину додавали насичений водний розчин хлориду амонію і одержану суміш екстрагували етилацетатом. Органічний шар промивали насиченим водним розчином хлориду амонію і насиченим сольовим розчином, і сушили безводним сульфатом магнію. Осушник відфільтровували і розчинник випарювали при зниженому тиску. Одержаний таким чином залишок очищали колонковою хроматографією на силікагелі (суміш гексан:етилацетат = від (3:1) до (2:1)) щоб одержати зазначену у назві сполуку (10,7 г, 87%) у вигляді жовтої маслянистої речовини. 1Н ЯМР (300 МГц, ХЛОРОФОРМ-D) δ м.ч. 2,40 (с, 3Н) 3,65-3,86 (м, 3Н) 3,89-4,21 (м, 8Н) 4,45-4,69 (м, 4Н) 4,78-5,03 (м, 5Н) 5,91 (с, 1H) 6,71 (с, 1H) 6,97 (дд, J=7,31, 2,18 Гц, 2Н) 7,10-7,37 (м, 23Н) 7,81 (с, 1H). 95635 44 (2) Одержання 2,3,4,6-тетра-О-бензил-1-С-[2(бензилокси)-5-форміл-4-метилфеніл]-Dглюкопіранози До розчину у тетрагідрофурані (80 мл) 2,3,4,6тетра-О-бензил-1-С-[2-(бензилокси)-5-(1,3діоксолан-2-іл)-4-метилфеніл]-D-глюкопіранози (10,6 г, 13,0ммоль), охолодженого у льоді, додавали 6 Μ хлористоводневу кислоту (80 мл), і суміш перемішували 14 годин при кімнатній температурі. До реакційного розчину додавали льодяну воду і одержану суміш екстрагували етилацетатом. Органічний шар промивали насиченим водним розчином бікарбонату натрію і насиченим сольовим розчином; і сушили безводним сульфатом магнію. Осушник відфільтровували і розчинник випарювали при зниженому тиску. Одержаний таким чином залишок очищали колонковою хроматографією на силікагелі (суміш гексан:етилацетат = 2:1), щоб одержати зазначену у назві сполуку (10,2 г, кількісно) у вигляді жовтої маслянистої речовини. 1Н ЯМР (300 МГц, ХЛОРОФОРМ-D) δ м.ч. 2,66 (с, 3Н) 3,60-3,72 (м, 2Н) 3,74-3,82 (м, 1Н) 4,01 (т, J=9,09 Гц, 1Н) 4,07-4,20 (м, 3Н) 4,40-4,61 (м, 5Н) 4,71-5,05 (м, 5Н) 6,70 (с, 1H) 6,87 (д, J=6,68 Гц, 2Н) 7,06-7,40 (м, 23Н) 8,07 (с, 1H) 10,06 (с, 1H). (3) Одержання 2,3,4,6-тетра-О-бензил-1-С-[2(бензилокси)-5-[(4-бромфеніл)(гідрокси)метил]-4метилфеніл]-D-глюкопіранози До розчину 1,4-дибромбензолу (6,20 г, 26,1 ммоль) у тетрагідрофурані (80 мл) при -78°С в атмосфері азоту по краплях додавали 2,67 Μ розчин н-бутиллітію у гексані (10,5 мл, 26,1 ммоль), і суміш перемішували 15 хвилин при тій же температурі. Потім по краплях додавали розчин 2,3,4,6тетра-О-бензил-1-С-[2-(бензилокси)-5-форміл-4метилфеніл]-D-глюкопіранози (10,0 г, 13,0 ммоль) у тетрагідрофурані (20 мл) і суміш перемішували 30 хвилин при тій же температурі. До реакційного розчину додавали насичений водний розчин хлориду амонію, і одержану суміш екстрагували етилацетатом. Органічний шар промивали насиченим сольовим розчином і сушили безводним сульфатом магнію. Осушник відфільтровували і розчинник випарювали при зниженому тиску. Одержаний таким чином залишок очищали колонковою хроматографією на силікагелі (суміш гексан:етилацетат = 2:1). До того ж, залишок додатково очищали колонковою хроматографією на силікагелі ΝΗ типу (суміш гексан:етилацетат = 1:1), щоб одержати жовту маслянисту сполуку, зазначену у назві (5,50 г, 46%), у вигляді діастереомерної суміші. 1Н ЯМР (300 МГц, ХЛОРОФОРМ-D) δ м.ч. 2,21 (с, 3Н) 3,54-3,82 (м, 3Н) 3,98-4,23 (м, 4Н) 4,36-4,64 (м, 4Н) 4,75-5,06 (м, 5Н) 5,83-5,86 (м, 1Н) 6,71 і 6,73 (кожен с, 1Н) 6,89-7,44 (м, 29Н) 7,67 і 7,71 (кожен с, 1H). (4) Одержання (1S)-1,5-ангідро-2,3,4,6-тетраО-бензил-1-[2-(бензилокси)-5-(4-бромбензил)-4метилфеніл]-D-глюциту До розчину в ацетонітрилі (60 мл) 2,3,4,6тетра-О-бензил-1-С-[2-(бензилокси)-5-[(4бромфеніл)(гідрокси)метил]-4-метилфеніл]-Dглюкопіранози (5,50 г, 5.96 ммоль) додавали в атмосфері азоту при -10°С Et3SiH (2,90 мл, 17,8 ммоль) і BF3-Et20 (1,90 мл, 14,9 ммоль), і суміш 45 перемішували 15 хвилин при тій же температурі; і при кімнатній температурі суміш перемішували 2,5 години. До реакційного розчину, охолодженого у льоді, додавали насичений водний розчин бікарбонату натрію і одержану суміш екстрагували етилацетатом. Органічний шар промивали насиченим сольовим розчином і сушили безводним сульфатом магнію. Осушник відфільтровували і розчинник випарювали при зниженому тиску. Одержаний таким чином залишок очищали колонковою хроматографією на силікагелі (суміш гексан:етилацетат = від (15:1) до (10:1)), щоб одержати зазначену у назві сполуку (2,70 г, 51%) у вигляді блідо-жовтої маслянистої речовини. 1Н ЯМР (300 МГц, ХЛОРОФОРМ-D) δ м.ч. 2,17 (с, 3Н) 3,53-3,63 (м, 1H) 3,68-3,91 (м, 7Н) 4,00 (д, J=11,04 Гц, 1Н) 4,39-4,95 (м, 8Н) 5,01 (с, 2Н) 6,75 (с, 1Н) 6,86-6,97 (м, 4Н) 7,10-7,35 (м, 24Н) 7,367,46 (м, 2Н). ДОВІДКОВИЙ ПРИКЛАД 3 Одержання (1S)-1,5-ангідро-2,3,4,6-тетра-Обензил-1-[2-(бензилокси)-5-[4-[(1Е)-3карбоксипроп-1-ен-1-іл]бензил]-4-метилфеніл]-Dглюциту До розчину в ацетонітрилі (8,8 мл) (1S)-1,5ангідро-2,3,4,6-тетра-О-бензил-1-[2-(бензилокси)5-(4-бромбензил)-4-метилфеніл]-D-глюциту (780 мг, 0,876 ммоль) додавали вінілацетат (184 мг, 2,14 ммоль), ацетат паладію(ll) (20 мг, 0,0890 ммоль), три-О-толілфосфін (54 мг, 0,177 ммоль) і триетиламін (0,64 мл, 4,38 ммоль) і піддавали взаємодії при 120°С протягом 20 хвилин, використовуючи мікрохвильову піч, виробництва Biotage. Реакційний розчин випарювали при зниженому тиску. Одержаний таким чином залишок очищали колонковою хроматографією на силікагелі (суміш гексан:етилацетат = 5:1; суміш хлороформ:метанол = 40:1), щоб одержати зазначену у назві сполуку (681 мг, 87%) у вигляді помаранчево-жовтої аморфної речовини. 1Н ЯМР (600 МГц, ХЛОРОФОРМ-D) δ м.ч. 2,17 (с, 3Н) 3,25 (д, J=5,50 Гц, 2Н) 3,53-3,84 (м, 6Н) 3,84-3,95 (м, 2Н) 4,00 (д, J=10,55 Гц, 1Н) 4,43 (д, J=10,55 Гц, 1Н) 4,50 (д, J=11,92 Гц, 1Н) 4,57-4,65 (м, 2Н) 4,80-4,93 (м, 4Н) 4,99 (с, 2Н) 6,12-6,22 (м, 1Н) 6,42 (д, J=15,59 Гц, 1H) 6,74 (с, 1H) 6,89-7,03 (м, 4Н) 7,11-7,47 (м, 26Н). ESI m/z=893(M-H). ДОВІДКОВИЙ ПРИКЛАД 4 Одержання (1S)-1-[5-[4-(2-аміноетил)бензил]2-(бензилокси)-4-метилфеніл]-1,5-ангідро-2,3,4,6тетра-О-бензил-D-глюциту 95635 46 (1) Одержання 2,3,4,6-тетра-О-бензил-1-С-[2(бензилокси)-5-[гідрокси[4-[2(тритиламіно)етил]феніл]метил]-4-метилфеніл]-Dглюкопіранози До розчину 2-(4-бромфеніл)-Nтритилетанаміну (0,814 г, 1,84 ммоль) у тетрагідрофурані (3 мл) в атмосфері азоту при -78°С по краплях додавали 2,66 Μ розчин у гексані нбутиллітію (0,69 мл, 1,84 ммоль) і суміш перемішували 30 хвилин при тій же температурі. Потім по краплях додавали розчин у тетрагідрофурані (3 мл) 2,3,4,6-тетра-О-бензил-1-С-[2-(бензилокси)-5форміл-4-метилфеніл]-D-глюкопіранози (0,670 г, 0,876 ммоль) і суміш перемішували 30 хвилин при тій же температурі. До реакційного розчину додавали воду і одержану суміш екстрагували етилацетатом. Органічний шар сушили безводним сульфатом магнію. Осушник відфільтровували і розчинник випарювали при зниженому тиску. Одержаний таким чином залишок очищали колонковою хроматографією на силікагелі ΝΗ типу (хлороформ), щоб одержати сполуку, зазначену у назві (0,634 г, 64%), у вигляді жовтої маслянистої речовини. 1Н ЯМР (300 МГц, ХЛОРОФОРМ-D) δ м.ч. 2,12-2,22 (м, 3Н) 2,30-2,43 (м, 2Н) 2,65-2,76 (м, 2Н) 3,64-3,84 (м, 3Н) 3,99-4,22 (м, 4Н) 4,42-4,65 (м, 5Н) 4,75-5,04 (м, 5Н) 5,83-5,91 (м, 1 Η) 6,67-6,72 (м, 1H) 6,88-7,43 (м, 44Н). (2) Одержання (1S)-1,5-ангідро-2,3,4,6-тетраО-бензил-1-[2-(бензилокси)-4-метил-5-[4-[2(тритиламіно)етил]бензил]феніл]-D-глюциту До розчину в ацетонітрилі (6 мл) 2,3,4,6-тетраО-бензил-1-С-[2-(бензилокси)-5-[гідрокси[4-[2(тритиламіно)етил]феніл]метил]-4-метилфеніл]-Dглюкопіранози (0,638 г, 0,565 ммоль) в атмосфері азоту при 0°С додавали Et3SiH (0,27 мл, 1,695 ммоль) і BF3-Et2O (1,58 мл, 1,24 ммоль), і суміш перемішували 30 хвилин при тій же температурі. До реакційного розчину, охолодженого у льоді, додавали насичений водний розчин бікарбонату натрію і одержану суміш екстрагували етилацетатом. Органічний шар сушили безводним сульфатом магнію. Осушник відфільтровували і розчинник випарювали при зниженому тиску. Одержаний таким чином залишок очищали колонковою хроматографією на силікагелі (суміш гексан:етилацетат = 9:1), щоб одержати зазначену у назві сполуку (0,402 г, 59%) у вигляді блідо-жовтої маслянистої речовини. 1Н ЯМР (300 МГц, ХЛОРОФОРМ-D) δ м.ч. 2,16 (с, 3Н) 2,36 (т, J=6,84 Гц, 2Н) 2,68 (т, J=6,84 Гц, 2Н) 3,52-3,65 (м, 1Н) 3,67-3,92 (м, 7Н) 4,00 (д, J=10,88 Гц, 1Н) 4,37-4,67 (м, 5Н) 4,78-5,06 (м, 5Н) 6,73 (с, 1Н) 6,83-7,01 (м, 5Н) 7,05-7,45 (м, 40Н). (3) Одержання (1S)-1,5-ангідро-2,3,4,6-тетраО-бензил-1-[5-[4-(2-аміноетил)бензил]-2(бензилокси)-4-метилфеніл]-D-глюциту До розчину у хлороформі (1S)-1,5-ангідро2,3,4,6-тетра-О-бензил-1-[2-(бензилокси)-4-метил5-[4-[2-(тритиламіно)етил]бензил]феніл]-D-глюциту (0,402 г, 0,336 ммоль) при кімнатній температурі додавали трифторацетат (0,5 мл) і суміш перемішували 3 години при тій же температурі. До реакційного розчину додавали етанол і потім розчин 47 ник випарювали при зниженому тиску. Одержаний таким чином залишок очищали колонковою хроматографією на силікагелі NH типу (суміш гексан:етилацетат = 4:6; суміш хлороформ:метанол = 20:1), щоб одержати зазначену у назві сполуку (0,296 г, кількісно) у вигляді безбарвної маслянистої речовини. 1Н ЯМР (300 МГц, ХЛОРОФОРМ-D) δ м.ч. 2,20 (с, 3Н) 2,65 (т, J=6,84 Гц, 2Н) 2,89 (т, J=6,84 Гц, 2Н) 3,52-3,95 (м, 8Н) 4,00 (д, J=10,72 Гц, 1H) 4,38-4,67 (м, 5Н) 4,81-5,04 (м, 5Н) 6,74 (с, 1Н) 6,88-7,45 (м, 30Н). ДОВІДКОВИЙ ПРИКЛАД 5 Одержання дибензил[(2)(аліламіно)метиліліден]біскарбамату До розчину у тетрагідрофурані (4,3 мл) аліламіну (250 мг, 4,38 ммоль) додавали Ν,Ν'бісбензилоксикарбоніл-1-гуанілпіразол (1,98 г, 5,25 ммоль) і суміш перемішували протягом ночі при кімнатній температурі. Реакційний розчин упарювали при зниженому тиску. Одержаний таким чином залишок очищали колонковою хроматографією на силікагелі (суміш гексан:етилацетат = 4:1), щоб одержати зазначену у назві сполуку (1,45 г, 90%) у вигляді безбарвного порошку. 1Н ЯМР (300 МГц, ХЛОРОФОРМ-D) δ м.ч. 4,03-4,12 (м, 2Н) 5,11-5,28 (м, 6Н) 5,81-5,96 (м, 1Н) 7,23-7,43 (м, 10Н) 8,35-8,45 (м, 1Н) 11,76 (с, 1Н). ESI m/z=368(M+H). ДОВІДКОВИЙ ПРИКЛАД 6 Одержання N-аліл-4-метилтперазин-1карбоксаміду До розчину у хлороформі (70 мл) аліламіну (400 мг, 7,00 ммоль) додавали триетиламін (1,31 мл, 9,45 ммоль) і 4-нітрофенілхлорформіат (1,62 г, 8,06 ммоль), і суміш перемішували протягом ночі при кімнатній температурі. До цього реакційного розчину додавали 1-метилпіперазин (771 мг, 7,70 ммоль) і суміш перемішували протягом ночі при кімнатній температурі. Реакційний розчин випарювали при зниженому тиску. До одержаного таким чином залишку додавали етилацетат і осаджену нерозчинну речовину відфільтровували. Фільтрат концентрували і одержаний таким чином залишок очищали колонковою хроматографією на силікагелі NH типу (суміш гексан:етилацетат = 5:1; етилацетат) і колонковою хроматографією на силікагелі (етилацетат, суміш хлороформ:метанол = від (20:1) до (5:1)), щоб одержати зазначену у назві сполуку (1,38 г, кількісно) у вигляді безбарвного порошку. 1Н ЯМР (300 МГц, DMSO-D6) δ м.ч. 2,16 (с, 3Н) 2,18-2,26 (м, 4Н) 3,23-3,31 (м, 4Н) 3,59-3,68 (м, 2Н) 4,95-5,12 (м, 2Н) 5,72-5,87 (м, 1Н) 6,63 (т, J=5,44 Гц, 1Н). ESI m/z=206(M+Na). 95635 48 ДОВІДКОВИЙ ПРИКЛАД 7 Одержання трет-бутил[3-(бута-3еноїламіно)пропіл]карбамату До розчину вінілацетату (500 мг, 5,81 ммоль) у хлороформі (58 мл) додавали трет-бутил N-(3амінопропіл)карбамат (2,02 г, 11,6 ммоль), 1гідроксибензотриазол (0,86 г, 6,39 ммоль) і WSC (1,56 г, 8,13 ммоль); і суміш перемішували протягом ночі при кімнатній температурі. До реакційного розчину додавали воду і одержану суміш екстрагували хлороформом. Органічний шар промивали насиченим водним розчином хлориду амонію і насиченим сольовим розчином, і сушили безводним сульфатом магнію. Осушник відфільтровували і розчинник випарювали при зниженому тиску. Одержаний таким чином залишок очищали колонковою хроматографією на силікагелі (суміш гексан:етилацетат = 1:1; етилацетат), щоб одержати зазначену у назві сполуку (1,32 г, 94%) у вигляді безбарвного порошку. 1Н ЯМР (300 МГц, ХЛОРОФОРМ-D) δ м.ч. 1,44 (с, 9Н) 1,52-1,71 (м, 2Н) 3,01 (д, J=6,99 Гц, 2Н) 3,09-3,23 (м, 2Н) 3,30 (кв, J=6,37 Гц, 2Н) 4,89 (с, 1H) 5,14-5,31 (м, 2Н) 5,83-6,06 (м, 1Н) 6,21 (с, 1H). ESI m/z=265(M+Na). ДОВІДКОВИЙ ПРИКЛАД 8 Одержання N-аліл-N'-(2-гідрокси-1,1диметилетил)сечовини До розчину аліламіну (1,5 г, 26,3 ммоль) у хлороформі (60 мл) додавали триетиламін (4,9 мл, 35,5 ммоль) і при 4°С додавали 4нітрофенілхлорформіат (6,09 г, 30,2 ммоль); і суміш перемішували одну годину. До реакційного розчину додавали при тій же температурі розчин у хлороформі (3 мл) 2-аміно-2-метилпропанолу (2,58 г, 28,9 ммоль); і суміш перемішували протягом ночі при кімнатній температурі. Реакційний розчинник випарювали при зниженому тиску. Одержаний таким чином залишок очищали колонковою хроматографією на силікагелі (етилацетат), щоб одержати зазначену у назві сполуку (4,0 г, 88%) у вигляді жовтої маслянистої речовини. 1Н ЯМР (300 МГц, ХЛОРОФОРМ-D) δ мл. 1,26 (с, 6Н) 3,55 (с, 2Н) 3,71-3,80 (м, 2Н) 4,85-5,08 (м, 2Н) 5,08-5,24 (м, 2Н) 5,77-5,91 (м, 1Н). ESI m/z=195(M+Na). ДОВІДКОВИЙ ПРИКЛАД 9 Одержання 1-бензилокси-2-бром-5-метил-4-[4[2-(метоксиметокси)етил]бензил]бензолу До розчину у тетрагідрофурані (1 л) 1-бром-4[2-(метокси-метокси)етил]бензолу (50,2 г, 0,205 моль) по краплях додавали в атмосфері азоту при -78°С 2,6 Μ розчин н-бутиллітію у гексані (78,8 мл, 0,205 моль); і суміш перемішували 15 хвилин при тій же температурі. Потім протягом години по кра 49 плях додавали розчин у тетрагідрофурані (150 мл) 4-бензилокси-5-бром-2-метилбензальдегіду (56,9 г, 0,195 моль), і суміш перемішували 30 хвилин при тій же температурі. До реакційного розчину додавали насичений водний розчин хлориду амонію і одержану суміш екстрагували етилацетатом. Органічний шар промивали насиченим водним розчином хлориду амонію і насиченим сольовим розчином, і сушили безводним сульфатом магнію. Осушник відфільтровували і розчинник випарювали при зниженому тиску, щоб одержати [4(бензилокси)-5-бром-2-метилфеніл][4-[2(метоксиметокси)етил]феніл]метанол. Потім до розчину у хлороформі (1л) [4(бензилокси)-5-бром-2-метилфеніл][4-[2(метоксиметокси)етил]феніл]метанолу (102 г), охолодженого у льоді, додавали Et3SiH (46,7 мл, 0,293 моль) і BF3-Et2O (29,7 мл, 0,243 моль); і суміш перемішували 15 хвилин при тій же температурі. До реакційного розчину, охолодженого у льоді, додавали насичений водний розчин бікарбонату натрію і нагрівали до кімнатної температури. Одержану суміш екстрагували етилацетатом, промивали насиченим сольовим розчином і потім органічний шар сушили безводним сульфатом магнію. Осушник відфільтровували і розчинник випарювали при зниженому тиску. Одержаний таким чином залишок очищали колонковою хроматографією на силікагелі NH типу (суміш гексан:етилацетат = від (19:1) до (9:1)), щоб одержати зазначену у назві сполуку (60 г, 68%) у вигляді блідо-жовтої маслянистої речовини. 1H ЯМР (300 МГц, ХЛОРОФОРМ-D) δ мл. 2,16 (с, 3Н) 2,87 (т, J=6,99 Гц, 2Н) 3,28 (с, 3Н) 3,75 (т, J=6,99 Гц, 2Н) 3,85 (с, 2Н) 4,61 (с, 2Н) 5,12 (с, 2Н) 6,77 (с, 1H) 7,03 (д, J=8,08 Гц, 2Н) 7,15 (д, 2Н) 7,26 (д, J=3,57 Гц, 1Н) 7,30-7,45 (м, 3Н) 7,47 (д, 2Н). ДОВІДКОВИЙ ПРИКЛАД 10 Одержання (1S)-1,5-ангідро-2,3,4,6-тетра-Обензил-1-[2-(бензилокси)-5-[4-(2гідроксіетил)бензил]-4-метилфеніл]-D-глюциту До розчину у тетрагідрофурані (150 мл) 1бензилокси-2-бром-5-метил-5-[4-[2(метоксиметокси)етил]бензил]бензолу (13,0 г, 28,5 ммоль) в атмосфері азоту при -78°С по краплях додавали 2,6 Μ розчин н-бутиллітію у гексані (11, 0 мл, 28,5 ммоль); і суміш перемішували 15 хвилин при тій же температурі. Потім по краплях додавали розчин у тетрагідрофурані (30 мл) 2,3,4,6тетра-О-бензил-D-глюконо-1,5-лактону (14,0 г, 26,0 ммоль) і суміш перемішували 15 хвилин при тій же температурі. До реакційного розчину додавали насичений водний розчин хлориду амонію і одержану суміш екстрагували толуолом. Органічний шар промивали насиченим водним розчином хлориду амонію і насиченим сольовим розчином, і сушили безводним сульфатом магнію. Осушник відфільтровували і розчинник випарювали при зниженому тиску, щоб одержати 26,0 г залишку. 95635 50 Залишок розчиняли в ацетонітрилі (70 мл) і тетрагідрофурані (70 мл). До цього розчину, охолодженого у льоді, додавали Еt3SіН (2,90 мл, 17,8 ммоль) і BF3-Et2O (1,90 мл, 14,9 ммоль), і суміш перемішували одну годину при тій же температурі. До реакційного розчину, охолодженого у льоді, додавали насичений водний розчин бікарбонату натрію і нагрівали до кімнатної температури. До цього розчину додавали воду (70 мл) і одержану суміш екстрагували толуолом. І потім органічний шар промивали насиченим сольовим розчином і сушили безводним сульфатом магнію. Розчинник випарювали при зниженому тиску, щоб одержати 27,0 г залишку. Залишок розчиняли в ізопропіловому ефірі (140 мл). Потім до цього розчину додавали 2пропанол (140 мл) і 6 Μ хлористоводневу кислоту (140 мл); і реакційну суміш 2 години перемішували при 80°С. Після охолодження суміші до кімнатної температури до суміші додавали воду (70 мл). Одержану суміш екстрагували толуолом. Потім органічний шар промивали насиченим водним розчином бікарбонату натрію і насиченим сольовим розчином, і сушили безводним сульфатом магнію. Розчинник випарювали при зниженому тиску. Одержаний таким чином залишок очищали колонковою хроматографією на силікагелі (суміш гексан:етилацетат = від (9:1) до (7:3)), щоб одержати зазначену у назві сполуку (12,0 г, 54%) у вигляді блідо-жовтої маслянистої речовини. 1H ЯМP (300 МГц, ХЛОРОФОРМ-D) δ м.ч. 2,20 (с, 3Н) 2,78 (т, J=6,53 Гц, 2Н) 3,54-3,64 (м, 1Н) 3,68-3,88 (м, 8Н) 3,93 (уш.с, 2Н) 4,00 (д, J=10,72 Гц, 1Н) 4,42 (д, J=10,72 Гц, 1Н) 4,50 (д, 1H) 4,564,66 (м, 2Н) 4,81-4,95 (м, 3Н) 5,00 (с, 2Н) 6,75 (с, 1Н) 6,92 (д, J=7,77 Гц, 2Н) 7,02 (с, 4Н) 7,10-7,35 (м, 22Н) 7,36-7,44 (м, 2Н). ESI m/z=873 (M+NH4). ДОВІДКОВИЙ ПРИКЛАД 11 Одержання (1S)-1-[5-[4-(2-аміноетил)бензил]2-бензилокси-4-метилфеніл]-1,5-ангідро-2,3,4,6тетра-О-бензил-D-глюциту До розчину у тетрагідрофурані (140 мл) (1S)1,5-ангідро-2,3,4,6-тетра-О-бензил-1-[2(бензилокси)-5-[4-(2-гідроксіетил)бензил]-4метилфеніл]-D-глюциту (12,0 г, 14,0 ммоль), трифенілфосфіну (5,51 г, 21,0 ммоль) і фталіміду (2,27 г, 15,4 ммоль) протягом 3 хвилин при 0°С в атмосфері азоту додавали 40% розчин у толуолі діізопропілазодикарбоксилату (11,1 мл, 21,0 ммоль). Цей реакційний розчин перемішували при кімнатній температурі 30 хвилин і потім туди додавали метанол (70 мл). Потім додавали моногідрат гідразину (6,79 мл, 140 ммоль) і реакційну суміш 3 години перемішували при 60°С. Після охолодження суміші до кімнатної температури додавали 2 Μ водний розчин гідроксиду натрію (100 мл) і одержану суміш екстрагували толуолом. Органічний шар промивали 2 Μ водним розчином гідроксиду 51 натрію (100 мл) і насиченим сольовим розчином, і сушили безводним сульфатом магнію. Розчинник випарювали при зниженому тиску, щоб одержати 22,7 г залишку. Залишок розчиняли у метанолі (140 мл), туди додавали розчин у метанолі (50 мл) моногідрату бензолсульфонової кислоти (2,51 г, 14,0 ммоль); і суміш 15 хвилин перемішували при кімнатній температурі. Цю суміш упарювали при зниженому тиску, щоб одержати аморфну сполуку. До одержаного таким чином залишку аморфної сполуки додавали 2-пропанол (230 мл) і метанол (90 мл); і суміш нагрівали до температури кипіння розчинника, щоб розчинити залишок. Цю суміш охолоджували до кімнатної температури і залишали на 15 годин. Одержаний таким чином кристал фільтрували, щоб одержати безбарвну сполуку, зазначену у назві (9,89 г, 70%). 1Н ЯМР (300 МГц, ХЛОРОФОРМ-D) δ м.ч. 2,12 (с, 3Н) 2,72-2,85 (м, 2Н) 2,89-3,05 (м, 2Н) 3,54-3,63 (м, 1Н) 3,68-3,89 (м, 8Н) 3,99 (д, J=10,57 Гц, 1Н) 4,39-4,53 (м, 2Н) 4,56-4,65 (м, 2Н) 4,82-4,94 (м, 3Н) 4,98 (с, 2Н) 6,72 (с, 1H) 6,79-6,85 (м, 2Н) 6,87-6,96 (м, 4Н) 7,06-7,44 (м, 25Н) 7,75-7,90 (м, 4Н). ДОВІДКОВИЙ ПРИКЛАД 12 Одержання (1S)-1-[5-[4-(2-аміноетил)бензил]2-ацетокси-4-метилфеніл]-1,5-ангідро-2,3,4,6тетра-О-ацетил-D-глюциту (1) Одержання (1S)-1-[5-[4-(2-третбутоксикарбоніламіноетил)бензил]-2-ацетокси-4метилфеніл]-1,5-ангідро-2,3,4,6-тетра-O-ацетил-Dглюциту До розчину у хлороформі (100 мл) (1S)-1-[5-[4(2-аміноетил)бензил]-2-(бензилокси)-4метилфеніл]-1,5-ангідро-2,3,4,6-тетра-О-бензил-Dглюцитбензол-сульфонової кислоти (10,7 г, 10,6 ммоль), охолодженого у льоді, в атмосфері азоту додавали триетиламін (2,22 мл, 15,9 ммоль) і дитрет-бутилдикарбонат (2,78 г, 12,7 ммоль); і суміш перемішували 30 хвилин при тій же температурі. До реакційного розчину додавали воду і суміш нагрівали до кімнатної температури. Потім одержану суміш екстрагували етилацетатом. Органічний шар промивали 1 Μ хлористоводневою кислотою і насиченим сольовим розчином, і сушили безводним сульфатом магнію. Осушник відфільтровували і розчинник випарювали при зниженому тиску, щоб одержати 11,8 г залишку. Залишок розчиняли в етилацетаті (50 мл) і метанолі (100 мл). І туди додавали 20% гідроксид паладію (2,50 г), і суміш 2,5 години перемішували в атмосфері водню при кімнатній температурі. Реакційний розчин фільтрували через целіт і розчинник випарювали при зниженому тиску, щоб одержати залишок. Цей залишок розчиняли у піридині (100 мл). До цього розчину додавали в атмосфері азоту оцтовий ангідрид (6,01 мл, 63,6 ммоль) і Ν,Νдиметиламінопіридин; і суміш перемішували про 95635 52 тягом ночі при кімнатній температурі. Після цього туди додатково додавали оцтовий ангідрид (4,00 мл, 42,4 ммоль) і суміш перемішували 2 години при тій же температурі. До реакційного розчину додавали воду, одержану суміш екстрагували етилацетатом. Органічний шар промивали 3 Μ хлористоводневою кислотою, насиченим водним розчином бікарбонату натрію і насиченим сольовим розчином, і сушили безводним сульфатом магнію. Осушник відфільтровували і розчинник випарювали при зниженому тиску, щоб одержати залишок. Одержаний таким чином залишок розчиняли, додаючи туди етилацетат, і, щоб одержати кристал, додавали гексан. Одержаний таким чином кристал фільтрували, щоб одержати зазначену у назві сполуку (5,58 г, 74%) у вигляді безбарвного порошку. 1Н ЯМР (300 МГц, ХЛОРОФОРМ-D) δ м.ч. 1,43 (с, 9Н) 1,77 (с, 3Н) 2,00 (с, 3Н) 2,04 (с, 3Н) 2,07 (с, 3Н) 2,19 (с, 3Н) 2,35 (с, 3Н) 2,75 (т, J=6,92 Гц, 2Н) 3,28-3,42 (м, 2Н) 3,75-3,83 (м, 1Н) 3,92 (с, 2Н) 4,08 (дд, J=12,43, 2,18 Гц, 1H) 4,30 (дд, J=12,36, 4,74 Гц, 1Н) 4,54 (т, 1H) 5,14-5,23 (м, 1Н) 5,25-5,37 (м, 2Н) 6,87 (с, 1Н) 7,02 (д, 2Н) 7,10 (д, 2Н) 7,16 (с, 1Н). ESI m/z=731(M+NH4). (2) Одержання (1S)-1-[5-[4-(2аміноетил)бензил]-2-ацетокси-4-метилфеніл]-1,5ангідро-2,3,4,6-тетра-О-ацетил-D-глюциту До розчину у хлороформі (80 мл) (1S)-1-[5-[4(2-тpeт-бутоксикарбоніламіноетил)бензил]-2ацетокси-4-метилфеніл]-1,5-ангідро-2,3,4,6-тетраО-ацетил-D-глюциту додавали трифтороцтову кислоту (23 мл) і суміш перемішували 1,5 години при кімнатній температурі. Розчинник випарювали при зниженому тиску, щоб одержати залишок. Одержаний таким чином залишок розбавляли хлороформом, промивали насиченим водним розчином бікарбонату натрію і насиченим сольовим розчином. Цей розчин сушили безводним сульфатом магнію. Осушник відфільтровували і розчинник випарювали при зниженому тиску, щоб одержати зазначену у назві сполуку (4,67 г, кількісно) у вигляді безбарвного порошку. 1H ЯМP (300 МГц, ХЛОРОФОРМ-D) δ мл. 1,77 (с, 3Н) 2,00 (с, 3Н) 2,04 (с, 3Н) 2,07 (с, 3Н) 2,19 (с, 3Н) 2,35 (с, 3Н) 2,67 (т, 2Н) 2,85-3,07 (м, 2Н) 3,753,84 (м, 1Н) 3,92 (с, 2Н) 4,08 (дд, J=12,36, 2,10 Гц, 1H) 4,30 (дд, J=12,36, 4,59 Гц, 1Н) 4,53 (т, 1H) 5,135,23 (м, 1Н) 5,24-5,36 (м, 2Н) 6,86 (с, 1H) 7,02 (д, 2Н) 7,11 (д, 2Н) 7,17 (с, 1H). ESI m/z=614(M+H). ДОВІДКОВИЙ ПРИКЛАД 13 Одержання (1S)-1,5-ангідро-2,3,4,6-тетра-Обензил-1-[2-(бензилокси)-5-(4-гідрокси-2метилбензил)-4-метилфеніл]-D-глюциту До розчину у тетрагідрофурані (15 мл) 1-бром4-метоксиметокси-2-метилбензолу (0,80 г, 3,46 ммоль) по краплях додавали в атмосфері азоту при -60°С 2,6 Μ розчин у гексані н-бутиллітію (1,33 53 мл, 3,46 ммоль) і суміш 15 хвилин перемішували при тій же температурі. Потім по краплях додавали розчин у тетрагідрофурані (6 мл) 2,3,4,6-тетраО-бензил-1-С-[2-(бензилокси)-5-форміл-4метилфеніл]-D-глюкопіранози (1,10 г, 1,44 ммоль) і суміш перемішували 15 хвилин при тій же температурі. До реакційного розчину додавали насичений водний розчин хлориду амонію і нагрівали до кімнатної температури. Потім одержану суміш екстрагували етилацетатом. Органічний шар промивали насиченим сольовим розчином і сушили безводним сульфатом магнію. Осушник відфільтровували і розчинник випарювали при зниженому тиску, щоб одержати 1,7 г маслянистої речовини. Потім маслянисту речовину розчиняли в ацетонітрилі (10 мл) і хлороформі (10 мл). До цього розчину додавали при 4°С Et3SiH (0,92 мл, 5,76 ммоль) і BF3Et2O (0,46 мл, 3,60 ммоль). Реакційний розчин 30 хвилин перемішували при тій же температурі і суміш перемішували 30 хвилин при кімнатній температурі. До реакційного розчину додавали насичений водний розчин бікарбонату натрію. І леткі речовини випарювали при зниженому тиску. Залишок екстрагували етилацетатом. Органічний шар промивали насиченим сольовим розчином і сушили безводним сульфатом магнію. Осушник відфільтровували і розчинник випарювали при зниженому тиску. Одержаний таким чином залишок очищали колонковою хроматографією на силікагелі (суміш гексан:етилацетат = 3:1), щоб одержати зазначену у назві сполуку (420 мг, 35%) у вигляді блідо-жовтої маслянистої речовини. 1Н ЯМР (300 МГц, ХЛОРОФОРМ-D) δ м.ч. 2,17 (с, 3Н) 2,22 (с, 3Н) 3,49-3,59 (м, 1H) 3,63-3,84 (м, 6Н) 3,97 (д, J=11,04 Гц, 1Н) 4,31-4,50 (м, 3Н) 4,524,68 (м, 3Н) 4,79-4,92 (м, 4Н) 5,02 (с, 2Н) 6,37 (дд, J=8,32, 2,41 Гц, 1H) 6,55 (д, J=2,49 Гц, 1H) 6,66 (д, J=8,24 Гц, 1Н) 6,78 (с, 1H) 6,88-6,97 (м, J=5,21, 4,43 Гц, 2Н) 7,01 (с, 1H) 7,10-7,50 (м, 23Н). ESI m/z=858 (M+NH4), 839 (М-Н). ДОВІДКОВИЙ ПРИКЛАД 14 Одержання (1S)-1,5-ангідро-2,3,4,6-тетра-Обензил-1-[2-(бензилокси)-5-[4-[2-(1,3-діоксо-1,3дигідро-2Н-ізоіндол-2-іл)етокси]-2-метилбензил]-4метилфеніл]-D-глюциту До розчину в Ν,Ν-диметилформаміді (5,0 мл) (1S)-1,5-ангідро-2,3,4,6-тетра-О-бензил-1-[2(бензилокси)-5-(4-гідрокси-2-метилбензил)-4метилфеніл]-D-глюциту (340 мг, 0,40 ммоль) і N-(2брометил)фталіміду (1,02 г, 4,0 ммоль) додавали карбонат калію (553 мг, 4,0 ммоль) і h-Bu4NI (14 мг, 0,038 ммоль). Реакційну суміш перемішували 3,5 години при 80°С. Після охолодження суміші до кімнатної температури туди додавали воду і одержану суміш екстрагували етилацетатом. Органічний шар промивали насиченим сольовим розчином, сушили безводним сульфатом магнію. 95635 54 Осушник відфільтровували і розчинник випарювали при зниженому тиску, щоб одержати залишок. Одержаний таким чином залишок очищали колонковою хроматографією на силікагелі (суміш гексан:етилацетат = 3:1), щоб одержати зазначену у назві сполуку (60 мг, 15%) у вигляді блідо-жовтої маслянистої речовини. 1H ЯМР (300 МГц, ХЛОРОФОРМ-D) δ мл. 2,17 (с, 3Н) 2,18 (с, 3Н) 3,49-3,60 (м, 1H) 3,63-3,85 (м, 6Н) 3,89-4,19 (м, 5Н) 4,34-4,52 (м, 3Н) 4,53-4,65 (м, 3Н) 4,75-4,93 (м, 3Н) 5,01 (с, 2Н) 6,44 (дд, J=8,55, 2,64 Гц, 1Н) 6,60-6,71 (м, 2Н) 6,77 (с, 1Н) 6,88-6,97 (м, 2Н) 7,05 (с, 1H) 7,13-7,45 (м, 23Н) 7,66-7,72 (м, 2Н) 7,80-7,88 (м, 2Н). ДОВІДКОВИЙ ПРИКЛАД 15 Одержання (1S)-1-[5-[4-(2-аміноетокси)-2метилбензил]-2-(бензилокси)-4-метилфеніл]-1,5ангідро-2,3,4,6-тетра-О-бензил-D-глюциту До розчину (1S)-1,5-ангідро-2,3,4,6-тетра-Обензил-1-[2-(бензилокси)-5-[4-[2-(1,3-діоксо-1,3дигідро-2Н-ізоіндол-2-іл)етокси]-2-метилбензил]-4метилфеніл]-D-глюциту (60 мг, 0,059 ммоль) у тетрагідрофурані (0,8 мл) і метанолі (0,2 мл) додавали моногідрат гідразину (30 мг, 0,59 ммоль) і реакційну суміш одну годину перемішували при 65°С. Після охолодження суміші до кімнатної температури, туди додавали 2 Μ водний розчин гідроксиду натрію і одержану суміш екстрагували етилацетатом. Органічний шар промивали насиченим сольовим розчином і сушили безводним сульфатом магнію. Розчинник випарювали при зниженому тиску, щоб кількісно одержати сполуку, зазначену у назві. 1Н ЯМР (300 МГц, ХЛОРОФОРМ-D) δ м.ч. 2,21 (с, 3Н) 2,22 (с, 3Н) 3,03 (т, J=4,74 Гц, 2Н) 3,50-3,62 (м, 1H) 3,65-3,83 (м, 6Н) 3,88 (т, J=4,74 Гц, 2Н) 3,98 (д, J=10,88 Гц, 1Н) 4,34-4,51 (м, 3Н) 4,55-4,65 (м, 3Н) 4,77-4,93 (м, 3Н) 5,02 (с, 2Н) 6,43-6,51 (м, 1Н) 6,66-6,72 (м, 2Н) 6,78 (с, 1Н) 6,91-6,98 (м, 2Н) 7,06 (с, 1Н) 7,11-7,45 (м, 23Н). 3 На додаток, сполука (І), в якій R являє собою метоксигрупу або атом фтору, може бути синтезована при використанні як вихідної речовини 1бром-2-метокси-4-метоксиметоксибензолу або 1бром-2-фтор-4-метоксиметоксибензолу за способом довідкових прикладів 13-15. ДОВІДКОВИЙ ПРИКЛАД 16 Одержання 4-(бензилокси)-5-бром-2хлорбензальдегіду До розчину у хлороформі (300 мл) 2-хлор-4гідроксибензонітрилу (14,0 г, 91,2ммоль) при -50°С в атмосфері азоту по краплях додавали 0,95 Μ розчин у гексані діізобутилалюмогідриду (307 мл, 291 ммоль) і суміш 1,5 години перемішували при тій же температурі. Температуру розчину підвищували до кімнатної температури і суміш додатково 55 перемішували 3 години. Потім реакційний розчин охолоджували у льоді і туди по краплях додавали метанол. До реакційного розчину додавали 3 Μ хлористоводневу кислоту і одержану суміш екстрагували етилацетатом. Органічний шар промивали насиченим водним розчином бікарбонату натрію і насиченим сольовим розчином, і сушили безводним сульфатом магнію. Осушник відфільтровували і розчинник випарювали при зниженому тиску, щоб одержати 7,25 г залишку. Залишок розчиняли у метанолі (140 мл). До цього розчину, охолодженого у льоді, в атмосфері азоту додавали пербромпіридину гідробромід (16,3 г, 50,9 ммоль) і суміш перемішували 4 години. До реакційного розчину додавали 20% розчин Na2SO3 і одержану суміш екстрагували етилацетатом. Органічний шар промивали 3 Μ хлористоводневою кислотою, насиченим водним розчином бікарбонату натрію і насиченим сольовим розчином, і сушили безводним сульфатом магнію. Осушник відфільтровували і розчинник випарювали при зниженому тиску. Одержаний таким чином залишок очищали колонковою хроматографією на силікагелі (суміш гексан:етилацетат = 3:1), щоб одержати 6,17 г безбарвного порошку. Цей порошок розчиняли в ацетоні (260 мл). До цього розчину в атмосфері азоту додавали бензилбромід (3,45 мл, 28,8 ммоль) і карбонат калію (4,70 г, 34,1 ммоль), і суміш 4,5 години перемішували при 50°С. Реакційний розчин охолоджували до кімнатної температури і потім фільтрували через целіт. Розчинник випарювали при зниженому тиску. Одержаний таким чином залишок очищали колонковою хроматографією на силікагелі (суміш гексан:етилацетат = 10:1), щоб одержати зазначену у назві сполуку (2,02 г, 6,9%), у вигляді безбарвного порошку. 1Н ЯМР (300 МГц, ХЛОРОФОРМ-D) δ м.ч. 5,23 (с, 2Н) 6,97 (с, 1Н) 7,32-7,50 (м, 5Н) 8,15 (с, 1Н) 10,27 (с, 1Н). ESI m/z=325 (M+H). ДОВІДКОВИЙ ПРИКЛАД 17 Одержання [4-(бензилокси)-5-бром-2хлорфеніл][4-[2(метоксиметокси)етил]феніл]метанолу До розчину у тетрагідрофурані (6 мл) 1-бром4-[2-(метокси-метокси)етил]бензолу (1,52 г, 6,20 ммоль) при -78°С в атмосфері азоту по краплях додавали 2,6 Μ гексанового розчину н-бутиллітію (2,38 мл, 6,20 ммоль) і суміш перемішували 10 хвилин при тій же температурі. Потім протягом 10 хвилин по краплях додавали розчин у тетрагідрофурані (6 мл) 4-(бензилокси)-5-бром-2хлорбензальдегіду (2,02 г, 6,20 ммоль) і суміш перемішували 30 хвилин при тій же температурі. До реакційного розчину додавали насичений водний розчин хлориду амонію і одержану суміш екстрагували етилацетатом. Органічний шар промивали насиченим водним розчином хлориду амонію і насиченим сольовим розчином, і сушили безводним сульфатом магнію. Осушник відфільтровува 95635 56 ли, розчинник випарювали при зниженому тиску. Одержаний таким чином залишок очищали колонковою хроматографією на силікагелі (суміш гексан:етилацетат = 10:1), щоб одержати зазначену у назві сполуку (750 мг, 25%) у вигляді безбарвної маслянистої речовини. 1H ЯМP (300 МГц, ХЛОРОФОРМ-D) δ м.ч. 2,24 (д, J=3,57 Гц, 1H) 2,89 (т, J=6,92 Гц, 2Н) 3,27 (с, 3Н) 3,75 (т, J=6,84 Гц, 2Н) 4,60 (с, 2Н) 5,12 (с, 2Н) 6,09 (д, J=3,57 Гц, 1H) 6,91 (с, 1Н) 7,15-7,51 (м, 9Н) 7,80 (с, 1Н). ESI m/z=508 (M+NH4). ДОВІДКОВИЙ ПРИКЛАД 18 Одержання 1-(бензилокси)-2-бром-5-хлор-4-[4[2-(метоксиметокси)етил]бензил]бензолу До розчину у хлороформі (8 мл) [4(бензилокси)-5-бром-2-хлорфеніл][4-[2(метоксиметокси)етил]феніл]метанолу (750 мг, 1,53 ммоль), охолодженого у льоді, додавали Et3SiH (367 мл, 2,30 ммоль) і BF3-Et2O (232 мл, 1,83 ммоль); і суміш перемішували одну годину при тій же температурі. До цього розчину, охолодженого у льоді, додавали насичений водний розчин бікарбонату натрію і нагрівали до кімнатної температури. Одержану суміш екстрагували етилацетатом, промивали насиченим сольовим розчином і сушили безводним сульфатом магнію. Осушник відфільтровували і розчинник випарювали при зниженому тиску. Одержаний таким чином залишок очищали колонковою хроматографією на силікагелі (суміш гексан:етилацетат = 4:1), щоб одержати зазначену у назві сполуку (290 мг, 40%) у вигляді безбарвної маслянистої речовини. 1Н ЯМР (300 МГц, ХЛОРОФОРМ-D) δ м.ч. 2,88 (т, J=7,15 Гц, 2Н) 3,28 (с, 3Н) 3,75 (т, J=6,99 Гц, 2Н) 3,97 (с, 2Н) 4,61 (с, 2Н) 5,12 (с, 2Н) 6,96 (с, 1Н) 7,10 (д, 2Н) 7,17 (д, 2Н) 7,28-7,50 (м, 6Н). ESI m/z-492 (M+NH4). ДОВІДКОВИЙ ПРИКЛАД 19 Одержання 2,3,4,6-тетра-О-бензил-1-С-[2(бензилокси)-4-хлор-5-[4-[2(метоксиметокси)етил]бензил]феніл]-Dглюкопіранози До розчину у тетрагідрофурані (3 мл) 1(бензилокси)-2-бром-5-хлор-4-[4-[2(метоксиметокси)етил]бензил]бензолу (290 мг, 0,609 ммоль) в атмосфері азоту при -78°С по краплях додавали 2,6 Μ розчин у гексані н-бутиллітію (234 мл, 0,609 ммоль) і суміш перемішували 5 хвилин при тій же температурі. Потім по краплях додавали розчин 2,3,4,6-тетра-О-бегоил-Dглюконо-1,5-лактону (328 мг, 0,609 ммоль) у тетрагідрофурані (3 мл) і суміш перемішували одну годину при тій же температурі. До реакційного розчину додавали насичений водний розчин хлориду амонію і одержану суміш екстрагували етилацета 57 том. Органічний шар промивали насиченим водним розчином хлориду амонію і насиченим сольовим розчином, і сушили безводним сульфатом магнію. Осушник відфільтровували і розчинник випарювали при зниженому тиску. Одержаний таким чином залишок очищали колонковою хроматографією на силікагелі (суміш гексан:етилацетат = 3:1), щоб одержати зазначену у назві сполуку (124 мг, 22%) у вигляді безбарвної маслянистої речовини. 1Н ЯМР (300 МГц, ХЛОРОФОРМ-D) δ м.ч. 2,85 (т, J=6,99 Гц, 2Н) 3,28 (с, 3Н) 3,60 (с, 5Н) 3,94-4,02 (м, 3Н) 4,04-4,15 (м, 3Н) 4,43-4,61 (м, 6Н) 4,71-4,97 (м, 5Н) 6,89 (с, 3Н) 7,37 (с, 27Н) 7,50 (с, 1Н). ESI m/z=952 (M+NH4). ДОВІДКОВИЙ ПРИКЛАД 20 Одержання (1S)-1,5-ангідро-2,3,4,6-тетра-Обензил-1-[2-(бензилокси)-4-хлор-5-[4-(2гідроксіетил)бензил]феніл]-D-глюциту До розчину 2,3,4,6-тетра-O-бензил-1-С-[2(бензилокси)-4-хлор-5-[4-[2(метоксиметокси)етил]бензил]феніл]-Dглюкопіранози в ацетонітрилі (0,5 мл) і тетрагідрофурані (0,5 мл) (124 мг, 0,133 ммоль), охолодженого у льоді, додавали Et3SiH (63,6 мкл, 0,400 ммоль) і BF3-Et2O (40,4 мкл, 0,320 ммоль), і суміш перемішували 1,5 години при тій же температурі. Суміш перемішували 4,5 години при кімнатній температурі. До реакційного розчину, охолодженого у льоді, додавали насичений водний розчин бікарбонату натрію і одержану суміш екстрагували етилацетатом. Органічний шар промивали насиченим сольовим розчином і сушили безводним сульфатом магнію. Осушник відфільтровували і розчинник випарювали при зниженому тиску, щоб одержати 119 мг залишку. Залишок розчиняли в ізопропіловому ефірі (0,7 мл). Потім до цього розчину додавали 2пропанол (0,7 мл) і 6 Μ хлористоводневу кислоту (0,7 мл); і реакційну суміш 3 години перемішували при 80°С. Після охолодження суміші до кімнатної температури, до суміші додавали воду і одержану суміш екстрагували етилацетатом. Потім органічний шар промивали насиченим водним розчином бікарбонату натрію і насиченим сольовим розчином, і сушили безводним сульфатом магнію. Розчинник випарювали при зниженому тиску. Одержаний таким чином залишок очищали колонковою хроматографією на силікагелі (суміш гексан:етилацетат = 7:3), щоб одержати зазначену у назві сполуку (79,1 мг, 68%) у вигляді безбарвної маслянистої речовини. 1H ЯМР (600 МГц, ХЛОРОФОРМ-D) δ м.ч. 2,77 (т, J=6,42 Гц, 2Н) 3,52-3,60 (м, 1H) 3,64-3,82 (м, 7Н) 3,92-3,99 (м, 3Н) 4,03 (д, 1Н) 4,41-4,51 (м, 2Н) 4,544,64 (м, 2Н) 4,82-4,89 (м, 3Н) 4,91-4,97 (м, 2Н) 6,86 (д, J=7,34 Гц, 2Н) 6,90 (с, 1Н) 7,02-7,06 (м, 2Н) 7,06-7,10 (м, 2Н) 7,13 (т, J=7,34 Гц, 2Н) 7,15-7,20 (м, 3Н) 7,20-7,33 (м, 17Н) 7,36 (д, J=7,79 Гц, 2Н). 95635 58 ESI m/z=892 (M+NH4). ДОВІДКОВИЙ ПРИКЛАД 21 Одержання (1S)-1-[5-[4-(2-аміноетил)бензил]2-(бензилокси)-4-хлорфеніл]-1,5-ангідро-2,3,4,6тетра-О-бензил-D-глюциту До розчину у тетрагідрофурані (2,0 мл) (1S)1,5-ангідро-2,3,4,6-тетра-О-бензил-1-[2(бензилокси)-4-хлор-5-[4-(2гідроксіетил)бегоил]феніл]-D-глюциту (79,0 мг, 0,090 ммоль), трифенілфосфіну (53,1 мг, 0,203 ммоль) і фталіміду (23,9 мг, 0,162 ммоль), охолодженого у льоді, в атмосфері азоту додавали 40% розчин діізопропілазодикарбоксилату у толуолі (386 мл, 0,203 ммоль). Після перемішування реакційного розчину при кімнатній температурі протягом 1,5 години, додавали метанол (1 мл). Потім додавали моногідрат гідразину (або гідразингідрат) (43,7 мл, 0,90 ммоль) і реакційну суміш 3 години перемішували при 60°С. Після охолодження суміші до кімнатної температури, туди додавали 2 Μ водний розчин гідроксиду натрію і одержану суміш екстрагували етилацетатом. Органічний шар промивали насиченим сольовим розчином і сушили безводним сульфатом магнію. Розчинник випарювали при зниженому тиску. Одержаний таким чином залишок очищали колонковою хроматографією на силікагелі (суміш хлороформ:метанол = 9:1), щоб одержати зазначену у назві сполуку (39,2 мг, 50%) у вигляді безбарвної маслянистої речовини. 1Н ЯМР (300 МГц, ХЛОРОФОРМ-D) δ м.ч. 2,68 (т, 2Н) 2,83-2,96 (м, 2Н) 3,52-3,61 (м, 1Н) 3,62-3,86 (м, 5Н) 3,99 (т, J=10,57 Гц, 3Н) 4,41-4,67 (м, 5Н) 4,81-4,92 (м, 3Н) 4,95 (с, 2Н) 6,88 (д, J=5,60 Гц, 3Н) 6,97-7,43 (м, 28Н). ESI m/z=874 (M+H). ДОВІДКОВИЙ ПРИКЛАД 22 Одержання 5-бром-2-хлорбензальдегіду До суспензії у хлороформі (157 мл) 5-бром-2хлорбензойної кислоти (18,5 г, 78,5 ммоль) додавали Ν,Ν-диметилформамід (0,5 мл) і туди при кімнатній температурі по краплях додавали оксалілхлорид (8,1 мл, 94,2 ммоль). Цей реакційний розчин перемішували 30 хвилин і потім концентрували при зниженому тиску. Одержаний таким чином залишок розчиняли у хлороформі (157 мл) і при 0°С по краплях додавали до суспензії Ν,Οдиметилгідроксиламіну гідрохлориду (9,19 г, 94,2 ммоль) і триетиламіну (26,3 мл, 188 ммоль) у хлороформі. Цей реакційний розчин перемішували 30 хвилин при тій же температурі і потім промивали водою, насиченим водним розчином бікарбонату натрію і насиченим сольовим розчином, і органічний шар сушили безводним сульфатом магнію. Осушник відфільтровували і розчинник випарюва 59 ли при зниженому тиску, щоб одержати 24,0 г залишку. Одержаний таким чином залишок розчиняли у тетрагідрофурані (157 мл) і туди при 0°С поступово додавали алюмогідрид літію (1,19 г, 29,0 ммоль). Після цього реакційний розчин охолоджували до 0°С і туди поступово додавали 2 Μ хлористоводневу кислоту, і суміш 30 хвилин перемішували при кімнатній температурі. Органічний шар промивали насиченим водним розчином бікарбонату натрію і потім насиченим сольовим розчином, і сушили безводним сульфатом магнію. Осушник відфільтровували і розчинник випарювали при зниженому тиску. Одержаний таким чином залишок перекристалізовували зі змішаного розчину етилацетаттексан (1:9), щоб одержати зазначену у назві сполуку (11, 3 г, 65%) у вигляді безбарвних кристалів. 1Н ЯМР (300 МГц, ХЛОРОФОРМ-D) δ м.ч. 7,35 (д, J=8,47 Гц, 1Н) 7,65 (дд, J=8,47, 2,56 Гц, 1Н) 8,04 (д, J=2,56 Гц, 1Н) 10,41 (с, 1Н). ДОВІДКОВИЙ ПРИКЛАД 23 Одержання (5-бром-2-хлорфеніл)[4-[2(метоксиметокси)етил]феніл]метанолу Здійснюючи спосіб довідкового прикладу 17, в якому 5-бром-2-хлорбензальдегід використовували замість 4-(бензилокси)-5-бром-2хлорбензальдегіду, одержували зазначену у назві сполуку (4,55 г, 63%) у вигляді безбарвної маслянистої речовини. 1Н ЯМР (300 МГц, ХЛОРОФОРМ-D) δ м.ч. 2,89 (т, J=6,99 Гц, 2Н) 3,26 (с, 3Н) 3,74 (т, J=6,99 Гц, 2Н) 4,59 (с, 2Н) 6,11 (с, 1H) 7,13-7,39 (м, 6Н) 7,82-7,84 (м, 1Н). ДОВІДКОВИЙ ПРИКЛАД 24 Одержання 5-бром-2-хлор-4-[4-[2(метоксиметокси)етил]бензил]бензолу Триетиламін (105 мл, 0,756 ммоль) додавали до розчину у хлороформі (1,4 мл) (5-бром-2хлорфеніл)[4-[2(метоксиметокси)етил]феніл]метанолу (0,265 г, 0,687 ммоль). I при 0°С туди по краплях додавали метансульфонілхлорид (58,5 мкл, 0,756 ммоль); і суміш 2 години перемішували при тій же температурі. До реакційного розчину додавали воду і одержану суміш двічі екстрагували етилацетатом. Органічний шар промивали насиченим сольовим розчином і органічний шар сушили безводним сульфатом магнію. Осушник відфільтровували і розчинник випарювали при зниженому тиску, щоб одержати залишок. До розчину у хлороформі (3,4 мл) одержаного таким чином залишку і Et3SiH (165 мкл, 1,03 ммоль) додавали BF3-Et2O (104 мкл, 0,824 ммоль) при 0°С, і суміш перемішували одну годину при тій же температурі. Цей реакційний розчин промивали насиченим водним розчином бікарбонату натрію 95635 60 (двічі) і потім насиченим сольовим розчином; і органічний шар сушили безводним сульфатом магнію. Осушник відфільтровували і розчинник випарювали при зниженому тиску. Одержаний таким чином залишок очищали колонковою хроматографією на силікагелі (суміш гексан: етилацетат = 9:1), щоб одержати блідо-жовтий неочищений продукт (41 мг). ESI m/z=386 (M+NH4). ДОВІДКОВИЙ ПРИКЛАД 25 Одержання 2,3,4,6-тетра-О-бензил-1-С-[4хлор-3-[4-[2-(метоксиметокси)етил]бензил]феніл]D-глюкопіранози Неочищений продукт зазначеної у назві сполуки (1,07 г) одержували у вигляді безбарвної маслянистої речовини способом, наведеним в опорному прикладі 19, в якому замість 1-(бензилокси)2-бром-5-хлор-4-[4-[2-(метоксиметокси)етил]бензил]бензолу використовували 5бром-2-хлор-4-[4-[2-(метоксиметокси)етил]бензил]бензол. ESI m/z=846 (M+NH4). ДОВІДКОВИЙ ПРИКЛАД 26 Одержання (1S)-1,5-ангідро-2,3,4,6-тетра-Обензил-1-[4-хлор-3-[4-(2-гідроксіетил)бензил]феніл]-D-глюциту Неочищений продукт зазначеної у назві сполуки (0,262 г) одержували у вигляді безбарвної маслянистої речовини за способом довідкового прикладу 20, в якому замість 2,3,4,6-тетра-O-бензил-1С-[2-(бензилокси)-4-хлор-5-[4-[2(метоксиметокси)етил]бензил]феніл]-Dглюкопіранози використовували 2,3,4,6-тетра-Oбензил-1-С-[4-хлор-3-[4-[2(метоксиметокси)етил]бензил]феніл]-Dглюкопіранозу. ESI m/z=786 (M+NH4). ДОВІДКОВИЙ ПРИКЛАД 27 Одержання (1S)-1-[3-[4-(2-аміноетил)бензил]4-хлорфеніл]-1,5-ангідро-2,3,4,6-тетра-О-бензилD-глюциту Неочищений продукт зазначеної у назві сполуки (0,230 г) одержували у вигляді блідо-жовтої маслянистої речовини за способом довідкового прикладу 21, в якому (1S)-1,5-ангідро-2,3,4,6-тетра-Обензил-1-[4-хлор-3-[4-(2-гідроксі
ДивитисяДодаткова інформація
Назва патенту англійськоюC-phenyl glycitol compound for the treatment of diabetes
Автори англійськоюKakinuma Hiroyuki, Kobashi Yohei, Hashimoto Yuko, Oi Takahiro, Takahasi Hitomi, Amada Hideaki, Iwata Yuki
Назва патенту російськоюСоединение с-фенилглицитола для лечения диабета
Автори російськоюКакинума Хироюки, Кобаси Йохеи, Хасимото Юко, Ои Такахиро, Такахаси Хитоми, Амада Хидеаки, Ивата Юки
МПК / Мітки
МПК: C07D 309/12, A61K 31/351, C07D 405/10, A61P 3/10
Мітки: сполука, діабету, лікування, с-фенілгліцитолу
Код посилання
<a href="https://ua.patents.su/57-95635-spoluka-s-fenilglicitolu-dlya-likuvannya-diabetu.html" target="_blank" rel="follow" title="База патентів України">Сполука с-фенілгліцитолу для лікування діабету</a>
Наступний патент: Поліпшені димери sgp130fc
Випадковий патент: Спосіб керування переключенням пальників ванної регенеративної скловарної печі












