Спосіб одержання сполуки платини (іі) з дезоксирибонуклеіновою кислотою, яка має імуностимулюючу та протипухлинну дію
Номер патенту: 10347
Опубліковано: 25.12.1996
Автори: Майданевич Надія Миколаївна, Трохименко Олена Петрівна, Волченскова Іліма Іліодорівна, Шалімов Сергій Олександрович, Кейсевич Людвіг Владіславович
Формула / Реферат
Способ получения соединения платины (II) с дезоксирибонуклеиновой кислотой, обладающего иммуностимулирующим и противоопухолевым действием, путем взаимодействия соединения платины (II) с ДНК в присутствии хлорида и цитрата натрия при температуре плавления ДНК, отличающийся тем, что в качестве соединения платины (II) используют тетрахлороплатинит калия, предварительно растворенный в водно-солевом растворе содержащем, мас. %:
хлорид аммония 0,150-0,170
хлорид калия 0,060-0,080
ацетат калия 0,260-0,290
дистиллированная вода остальное
при концентрации тетрахлороплатинита калия в растворе 0,270-0,290 мас. %,рН реакционной смеси 5,50-5,80; ионной силе 0,060-0,070 и молярном соотношении нуклеотида (фосфора) ДНК платины, хлорида натрия и цитрата натрия равном 1:1,7:0,75.
Текст
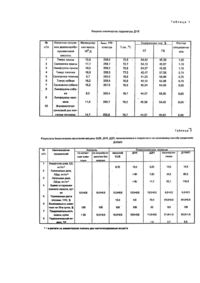
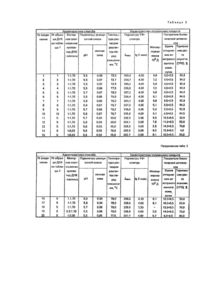
Изобретение относится к способам получения биологически активных соединений, в частности к биологически активным комплексным соединениям платины, которые могут найти применение в качестве основы при создании препаратов, эффективных для химиотерапии опухолей. Наиболее близким по технической сущности к изобретению является способ получения соединения платины (II) с дезоксирибонуклеиновой кислотой (сокращенно полиплатиллен) эмпирической формулы где n = 2100 ± 100, а μ-ДНК-мостиковый полианион дезоксирибонуклеиновой кислоты эмпирической формулы Полиплатиллен стимулирует противоопухолевый иммунитет и проявляет направленное противоопухолевое действие. Способ получения полиплатиллена заключается во взаимодействии ДДП с дезоксирибонук-ле-иновой кислотой (ДНК) при нагревании до 78,0 ± 0,5°С в водной среде, в которой процесс проводится в присутствии хлорида натрия и цитрата натрия при мольном соотношении цисдихлородиамминплатины, ДНК (в расчете на нуклеотид (фосфор) ДНК), хлорида натрия и цитрата натрия равном 6 : 4 : 30 : 3, в течение 15-20 минут. Однако полиплатиллен характеризуется недостаточно высокой эффективностью, что выражается в относительно высокой токсичности, недостаточно высоком уровне противоопухолевой активности, оцениваемом по продолжительности жизни животных, а также относительно низком показателе широты терапевтического действия, определяемом терапевтическим индексом ТИ. β основе изобретения положена задача разработки способа получения соединения платины (II) с ДНК, обладающего более высоким уровнем противоопухолевой активности при сохранении иммунологической активности и снижении токсичности, путем изменения параметров способа и состава исходных компонентов. В заявляемом способе в качестве соединения платины (II) использовали тетрахлороплатинит калия, синтезированный из платинохлористоводородной кислоты по методике (Справочник. Синтез комплексных соединений металлов платиновой группы. // М. Наука. - 1964. - С. 29) и высокомолекулярную ДНК, выделенную из различных тканей млекопитающих по методике (Трохименко Е.П., Кейсевич Л.В., Пеньковская Н.П., Лозинский Н.О., Середа А.Г. Способ выделения дезоксирибонуклеино-вой кислоты. // А.С. СССР, № 1081171 от 22,11.1983) с физико-химическими параметрами, представленными в таблице 1. Комплексное соединение платины с ДНК получают путем взаимодействия ДНК в присутствии хлорида натрия и цитрата натрия при температуре плавления ДНК с тет-рахлороплатинитом калия в водно-солевом растворе, содержащем, мас.%: при рН реакционной смеси 5,50-5,80, ионной силе 0,06-0,07 и молекулярном соотношении нуклеотида (фосфора) ДНК, платины, хлорида натрия и цитрата натрия равном 1 : 1.7:7.5:0,75. В заявляемом решении использовались перекристаллизованные химические реактивы ХЧ: хлорид аммония, хлорид калия, ацетат калия, хлорид натрия, цитрат натрия трехзамещенный. Получаемый продукт взаимодействия тетрахлороплатинита калия с ДНК (далее ДНКМП) представляет собой полимерное соединение со средневязкостной молекулярной массой (измеренной на вискозиметре Гепплера), изменяющейся в пределах от 5,0 ± 0,5 до 7,0 ± 0,7 миллионов дальтонов в зависимости от источников ДНК. Предлагаемое соединение ДНКМП в литературе не описано. В НИИ лексредств оно зарегистрировано21.02.90 г. №9653190 под названием "Дезоксирибонуклеиновая кислота, модифицированная тетрахлороплатинитом калия". Выполненные нами спектрофотометри-ческие исследования показывают, что в результате смешения водно-солевых растворов ДНК и тетрахлороплатинита калия при температуре плавления ДНК, рН 5,50-5,80, ионной силе 0,06-0,07 и соотношении Ρ : Pt 1 : 1,70 компоненты вступают во взаимодействие с образованием нового химического соединения. УФ-спектр этого соединения в зависимости от источника ДНК изменяется в пределах от 264,7 +0,1 нм до 267,2 +_0,1 нм. Максимальный молярный коэффициент экстинкции в расчете на один моль нуклеотида ДНК для соединения ДНКМП имеет значение Ід Емакс. = 4,00 +_0,01 л . моль^-1 . см^-1; а для свободной ДНКІд Емакс. = 3,85+.0,01 л . моль ^-1 . см^-1. Поскольку УФ-спектр обусловлен азотистыми основаниями ДНК, батохромный сдвиг максимума поглощения у соединения ДНКМП по сравнению со свободной ДНК указывает на то, что ДНК связывается с солью платины путем образования химических связей ковалентного типа, в которых участвуют атомы платины и донорные атомы основания ДНК. Уменьшения величины длинноволнового смещения УФ-максимума поглощения, Dλ = 6,8 ± 0,2 нм, у соединения ДНКМП по сравнению с аналогичной величиной Δλ= 8,2 ± 0,2 нм у полиплатиллена свидетельствует, что в среднем ковалентные связи между платиной и основаниями ДНК в заявляемом соединении менее прочные, чем в полиплатиллене. Сопровождающий это связывание гиперхромный эффект, составляющий около 30%, свидетельствует о сильных конформационных изменениях двойной спирали ДНК при ее взаимодействии с тетрахлороплатинитом калия. Из реакционной смеси, в которой образуется заявляемое соединение, была осаждена ДНК. Анализ на содержание платины отделенной от маточника ДНК и самого маточника показал, что практически все количество металла, взятого для реакции, связывается с ДНК. Водно-солевые растворы ДНКМП устойчивы на воздухе при комнатной температуре в течение не менее месяца, а в герметически закупоренной склянке при +5°С способны храниться без изменения свойств не менее одного года. Растворы соединения ДНКМП представляют собой слабо опалесцирующую жидкость светло-желтого цвета, которая имеет плотность r20 = 0,9995 г/см^3 и характеристическую вязкость в пределах от 45,5 ± 5 до 63,0 ± 7 см^3/г. Способность соединения ДНКМП стимулировать противоопухолевый иммунитет определяли по его влиянию на клеточный иммунитет, на котором главным образом базируется противоопухолевый иммунитет. Воздействие соединения ДНКМП на клеточный иммунитет оценивали по времени отторжения аллотрансплантата кожи. Крысам линии Вистар весом 150-200 г в область спины трансплантировали кожный лоскут размером 2x3 см, взятый от крыс линии Август. Сразу же после трансплантации кожного лоскута животным под кожу бедра инокулировали 2 х 10^8 клеток, перевиваемого штамма эритромиелоза Швеца. Животных делили на группы по 10 особей в каждой. В период логарифмической фазы роста опухоли, то есть на 4-6 сутки после инокуляции опухоли, животным начинали вводить внутрибрюшинно, трехкратно, равными частями с интервалами в 24 часа вакцину БЦЖ, ДНК, ДДП, полиплатиллен или соединение ДНКМП. Вакцину БЦЖ вводили в физиологическом растворе, а остальные вещества в водно-солевых растворах. Время отторжения кожного лоскута фиксировали по изменению его температуры, цвета, упругости. Результаты испытаний приведены в таблице 2, из которой видно, что время отторжения кожного лоскута у интактных животных составляет 9,5 суток, у нелеченных опухоленосителей оно увеличивается на 5,5 суток, что свидетельствует о снижении клеточного иммунитета организма в условиях опухолевого роста. Введение опухоленосителям вакцины БЦЖ, ДНК и ДДП уменьшает время отторжения кожного лоскута по сравнению с нелеченными опухоленосителями на 3,0, 2,5 и 1,5 суток соответственно. Полиплатиллен и заявляемое соединение ДНКМП уменьшает время отторжения кожного лоскута на 3,5 суток по сравнению с интактными животными и на 9.0 суток по сравнению с нелеченными опухоленосителями. Из сравнения полученных результатов следует, что введение полиплатиллена и заявляемого соединения в значительной степени стимулирует клеточный иммунитет опухоленосителя, чего не удается достигнуть при введении вакцины БЦЖ, свободный ДНК или ДДП. Таким образом, заявляемое соединение ДНКМП по способности стимулировать клеточный иммунитет, который отвечает за реакции, стимулирующие противоопухолевый иммунитет хозяина, не уступает полиплатиллену. Направленное противоопухолевое действие предлагаемого соединения ДНКМП оценивали в сравнении с контролем, а также в сравнении с противоопухолевой активностью вакцины БЦЖ, ДНК, ДДП и полиплатиллена. Опыты проводили на белых беспородных крысах весом 150-200 г, которым под кожу бедра инокулировали 2 x 10^8 - 2 x 10^10 клеток эритромиелоза Швеца. Лечение животных проводили по той же схеме и в те же сроки, как и при исследовании показателей клеточного иммунитета. Противоопухолевую активность веществ оценивали по степени торможения роста опухоли (ТРО, %), по выживаемости животных на 10-е сутки после инокуляции опухолевых клеток (ВЖ, %) и по увеличению продолжительности жизни животных (ПЖЖ, сутки). Расчеты производились по следующим формулам: где Vkoн. и Von. - объем опухоли в контрольной и опытной группах соответственно; где А - число животных, выживших на 10-е сутки после инокуляции опухолевых клеток; N - число животных в группе. ПЖЖ определяли по числу суток, прошедших от момента перевивки опухоли до гибели последнего животного в данной группе. Полученные результаты приведены в таблице 2. Как видно из таблицы 2, вакцина БЦЖ тормозит рост опухоли всего на 12,0 %, но обеспечивает 100 % выживаемость животных и такую же, как в контроле, продолжительность жизни, а именно 15 суток. При применении ДНК степень торможения роста опухоли оказывается еще ниже - все-го4%, хотя при 100% выживаемости на 10-е сутки, продолжительность жизни животных увеличивается до 18 суток. Комплекс ДДП тормозит рост опухоли значительно более эффективно, чем вакцина БЦЖ и ДНК. Как вещество с направленным противоопухолевым действием, оно обеспечивает 70 % ТРО, однако при введении ДДП выживаемость и продолжительность жизни животных падает даже по сравнению с контролем: выживаемость на 20 %, продолжительность жизни - на четверо суток. Полиплатиллен и соединение ДНКМП тормозят рост опухоли на 94 % и обеспечивают 100 % выживаемость животных и увеличивают продолжительность их жизни до 21 и 26 суток соответственно. Сравнительный анализ данных позволяет заключить, что полиплатиллен и соединение ДНКМП по эффективности терапевтического действия существенно превосходят вакцину БЦЖ, ДДП и ДНК. По величине торможения роста опухоли и выживаемости животных полиплатиллен и ДНКМП сопоставимы. В то же время по такому показателю, как продолжительность жизни полученное по заявляемому способу соединение ДНКМП превосходит полиплатиллен, так как леченные им животные живут на 5 суток больше. В таблице 2 представлены также результаты испытаний токсичности полиплатиллена и ДНКМП на нелинейных мышах весом 30 + 2 г. Препараты вводили троекратно, внутрибрюшинно с интервалами 2 часа. В расчете на элементарную платину суммарные дозы составляли для ДДП: 5,25, 10,5, 12,0 мг/кг; для полиплатиллена: 10,5, 21,0,42,0,52,1 мг/кг; для ДНКМП: 14,6,29,2, 58,4,80,2,115,0 мг/кг. Токсичность характеризовали дозой, вызывающей гибель 50 % животных, ЛД50, и 100 % животных, ЛД100. Количество погибших животных отмечали через каждые 24 - 48 часов. Токсическую дозу рассчитывали по методике (Фармакопея СССР, изд. It. вып. 1, Общие методы анализа, // Л. Медицина. - 1987. - 333 с). Летальную дозу, ЛДіоо, определяли экспериментально. Установлено, что для ДДП ЛД50 - 7,33 мг/кг, а ЛД100 = 11,7 мг/кг; для полиплатиллена ЛД50 = 39,2 мг/кг, ЛД100 =52,1 мг/кг; для ДНКМП ЛД50 - 80,2 мг/кг, ЛД100 = 115,0 мг/кг. Из сравнения приведенных результатов следует, что токсичность соединения ДНКМП в 2 раза ниже, чем у полиплатиллена. Вследствие этого соотношение между токсической и эффективно действующей дозами ТИ = ЛД50/ЭД для предлагаемого соединения выше, чем у известного. Так, для ДНКМП ТИ = 5,0, а для полиплатиллена ТИ = 3,7, Ниже приведены примеры конкретного выполнения способа получения соединения ДНКМП. Пример 1. На спектрофотометре Specord M 40 определяют по методике (Каталог №32338а, Спектрофотометр Specord Μ 40 UV VIS Carl Zeiss lena, DDK, 1985) температуру плавления ДНК образца № 1 (см. таблицу 1) с точностью + 0,1°С. В 75 мл стандартного водно-солевого раствора 0,1 SSC растворяют при комнатной температуре 0,100 г (0,296 ммолей в расчете на нуклеотид) дезок-сирибонуклеиновой кислоты и нагревают этот раствор до температуры плавления ДНК (72,5°С). В 75 мл водно-солевого раствора, содержащего 0,150 мас.% хлорида аммония, 0,060 мас.% хлорида калия и 0,260 мас.% ацетата калия, растворяют при комнатной температуре 0,216 г (0,521 ммоль в расчете на платину) тетрахлороплатинита калия, нагревают этот раствор до 72,5°С и смешивают с раствором ДНК. Получают реакционную смесь с рН 5,5 и ионной силой 0,06, которую охлаждают до комнатной температуры. Пример 2. Опыт проводят как в примере 1, только вместо ДНК образца №1 берут ДНК образца № 2, а тетрахлороплатинит калия растворяют в водно-солевом растворе, содержащем 0,170 мас.% хлорида аммония, 0,080 мас.% хлорида калия и 0,290 мас.% ацетата калия. Пример 3. Опыт проводят как в примере 1, только вместо ДНК образца № 1 берут ДН К образца № 3, а тетрахлороплатинит калия растворяют в растворе, содержащем 0,160 мас.% хлорида аммония, 0,070 мас.% хлорида калия, 0,280 мас.% ацетата калия. Результаты всех опытов сведены в таблице 3, где приведены параметры УФ-спектров, молекулярная масса и показатели биологической активности продуктов взаимодействия ДНК с солью платины в зависимости от способа их получения. Способы получения охарактеризованы следующими параметрами, природой используемой ДНК, соотношением компонентов - нуклеотид ДНК: Pt, рН и ионной силой реакционной смеси, а также температурой растворов реагентов перед их смешением. Из таблицы 3 (опыты №№ 1-10) видно, что природа используемой ДНК практически не влияет на биологические свойства соединений ДНКМП. Независимо от источника выделения ДНК, получают соединение с параметрами УФспектров. lмакс, изменяющимися в пределах от 264,70 ± 0,1 до 267,2 ± 0,1 нм, lgE=4,00 и молекулярной массой, варьируемой от 5 до 7 миллионов дальтонов, которые характеризуются оптимальными показателями биологической активности. Порядок смешения реагентов существенно влияет на свойства полученного соединения. Так, если растворы реагентов смешать при комнатной температуре, а затем смесь нагреть до температуры плавления ДНК, то не удается получить соединения с указанными выше физико-химическими параметрами и с высокими показателями биологической активности (опыт № 11). Температура растворов реагентов перед их смешением играет важную роль, так как влияет на свойства получаемого продукта. Например, если растворы перед смешением нагреть до 20, 50 или 95°С (опыты № 1213), то не удается получить продукт с необходимым набором физико-химических параметров и высоким уровнем биологических показателей. Опытным путем установлена закономерность изменения величины торможения роста опухоли в зависимости от температуры растворов реагентов перед их смешением. Наивысший уровень противоопухолевой активности соединения достигается в интервале температур, соответствующем температуре плавления образцов ДНК. Из опытов №№ 14-20 следует, что для получения необходимых физико-химических параметров и оптимальных биологических показателей у соединения ДНКМП, необходимо также строго соблюдать соотношение компонентов, рН и ионную силу реакционной смеси. В отсутствие тетрахлороплатинита калия и хлорида аммония или при их уменьшении содержания в реакционной смеси, а также при отклонении от рН 5,5-5,8 и ионной силы 0,06-0,07 получаются продукты, у которых физико-химические параметры отклоняются от выше указанных пределов, характерных для целевого соединения ДНКМП, а показатели биологической активности ухудшаются (опыты №№ 14-17). Такая же картина наблюдается при отсутствии или уменьшении содержания в реакционной смеси дезоксирибонуклеиновой кислоты (опыты №№ 18-19). Не удается достигнуть оптимальных биологических показателей также при избытке тетрахлорплатинита калия (опыт № 20). Выбор содержания ДНК о исходном растворе 0,1 SSC и фоновых составляющих - 0,015 Μ хлорида натрия и 0,0015 Μ цитрата натрия - обусловлен растворимостью ДНК. Выбор содержания тетрахлороплатинита калия и хлорида аммония в водно-солевом растворе обусловлен содержанием ДНК в растворе 0,1 SSC и необходимостью соблюдать указанное соотношение реагентов. Фоновые составляющие: хлорид калия, уксуснокислый калий и их содержание в растворе тетрахлороплатинита калия обусловлены необходимостью поддерживать в реакционной смеси рН в пределах 5,5-5,8 и ионную силу 0,06-0,07 для предотвращения гидролиза соли платины, который имеет место в водном растворе в отсутствии солевого фона. Выбор солей обусловлен требованиями, предъявляемыми к фармацевтическому растворителю, и осуществлен опытным путем. Содержание солей в реакционной смеси можно варьировать в пределах: для хлорида аммония 0,0750,080 мас.%. для хлорида калия 0,030-0,040 мас.%, для ацетата калия - 0,130-0,145 мас.%. Приведенные данные позволяют заключить, что введение во взаимодействие дезоксирибонуклеиновой кислоты с молекулярной массой не менее 8,5 χ 10 дальто-нов в стандартном водно-солевом растворе 0,1 SSC с тетрахлорплатинитом калия в водно-солевом растворе хлорида аммония, хлорида калия и ацетата калия при температуре плавления ДНК и при соблюдении рН 5,5-5,8, ионной силы 0,06-0,07 с последующим охлаждением реакционной смеси до комнатной температуры, позволяет получить соединение ДНКМП с вышеописанными физико-химическими параметрами и биологическими свойствами. Отклонение от вышеуказанных параметров способа получения не дает возможности получить целевое соединение с вышеуказанным набором свойств. Заявляемые параметры способа обеспечивают получение целевого соединения, характеризуемого описанными свойствами. Это соединение способно одновременно стимулировать противоопухолевый иммунитет и проявлять направленное противоопухолевое действие при высоком уровне активности и сравнительно низкой токсичности. По таким показателям, как стимулирование противоопухолевого иммунитета, торможение роста опухоли и выживаемость животных, полученное по предлагаемому способу соединение сопоставимо с известным веществом, но выгодно отличается от него по таким показателям как токсичность, продолжительность жизни животных и терапевтический индекс, и тем самым превосходит известные биологически активные вещества. Выявленный комплекс полезных свойств делает это соединение перспективным в качестве основы для создания препаратов, эффективных для химиотерапии опухолей.
ДивитисяДодаткова інформація
Назва патенту англійськоюA process for preparation of platinum compounds (ii) and deoxyribonucleic acid, which has immunostimulating and antitumor action.
Автори англійськоюVolchenkova Ilima Iliodorivna, Volchenskova Ilima Iliodorivna, Shalimov Serhii Oleksandrovych, Keisevych Liudvih Vladyslavovych, Trokhymenko Olena Petrivna, Maidanevych Nadiia Mykolaivna
Назва патенту російськоюСпособ получения соединения платины (іі) з дезоксирибонуклеиновой кислотой, обладающий иммуностимулирующим и противоопухолевым действием.
Автори російськоюВолченскова Илима Илиодоровна, Шалимов Сергей Александрович, Кейсевич Людвиг Владиславович, Трохименко Елена Петровна, Майданевич Надежда Николаевна
МПК / Мітки
МПК: C07F 15/00, A61P 35/00, A61K 31/225
Мітки: протипухлинну, має, одержання, платини, кислотою, спосіб, яка, дезоксирибонуклеіновою, дію, іі, імуностимулюючу, сполуки
Код посилання
<a href="https://ua.patents.su/6-10347-sposib-oderzhannya-spoluki-platini-ii-z-dezoksiribonukleinovoyu-kislotoyu-yaka-maeh-imunostimulyuyuchu-ta-protipukhlinnu-diyu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання сполуки платини (іі) з дезоксирибонуклеіновою кислотою, яка має імуностимулюючу та протипухлинну дію</a>
Попередній патент: Спосіб виробництва прискорювача визрівання винних дистилятів з деревини дуба
Наступний патент: Спосіб дистанційного визначення вмісту хлорофілу в листках монокультури рослин
Випадковий патент: Спосіб кислотної дії у видобувній свердловині