Спосіб підвищення імуногенності ліпосомальних вакцин
Номер патенту: 108884
Опубліковано: 10.08.2016
Автори: Мартинов Артур Вікторович, Сидоренко Тетяна Адиківна, Волянський Андрій Юрійович, Ігумнова Наталя Іванівна, Давидова Тетяна Володимирівна, Романова Олена Анатоліївна, Погоріла Марина Сергіївна
Формула / Реферат
1. Спосіб збільшення ефективності ліпосомальних вакцин через підвищення їх імуногенності, який відрізняється тим, що до ліпосомальної мембрани вводять гідрофобний мідь-порфириновий комплекс.
2. Спосіб за п. 1, який відрізняється тим, що масове співвідношення мідь-порфиринового комплексу в ліпосомальній мембрані до концентрації фосфоліпідів становить від 1:2 до 1:1000.
Текст
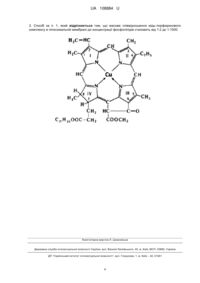
Реферат: Спосіб збільшення ефективності ліпосомальних вакцин через підвищення їх імуногенності, до ліпосомальної мембрани вводять гідрофобний мідь-порфириновий комплекс. UA 108884 U (12) UA 108884 U UA 108884 U 5 10 15 20 25 30 35 40 45 50 55 60 Корисна модель належить до фармацевтичної галузі та біотехнології та стосується збільшення ефективності ліпосомальних вакцин через підвищення їх імуногенності. Ліпосомальні вакцини визнані одними з найкращих за показниками імуногенності та безпечності серед відомих вакцинних препаратів. Відповідно, розробка нових ліпосомальних вакцин з підвищеною імуногенністю є актуальною задачею сучасної медицини та фармації. Відомо, що використання вакцин є безпечним та ефективним методом захисту великих популяцій тварин (в т.ч. людей) проти різноманітних інфекційних захворювань. Імунізація проти вірусів та мікроорганізмів є звичайно нешкідливою та ефективною і забезпечила значну частину збільшення тривалості життя осіб у розвинутих країнах. Проте, може виявитись ряд шкідливих побічних ефектів, у залежності від природи вакцини та конкретного імуногенну. Недостатня інактивація інтактного вірусу у минулому призводила до ненавмисного інфікування замість захисту після вакцинації. У деяких випадках імунізація інтактними організмами, такими як вірус грипу, може прискорити розвиток аутоімунних захворювань, спрямованих проти нормальних тканин, таких як синдром Гійєна-Барре. Оскільки процедури ефективної вакцинації часто вимагають багатократних імунізацій, ці небажані події можуть знизити ефективність вакцини і погіршити ставлення громадськості до процедури вакцинації. Нещодавно були проведені випробування сучасних молекулярно-біологічних методик з метою забезпечення поліпшення безпечності та ефективності нових препаратів вакцин. Зокрема, використання антигенів на основі простих пептидів для індукування специфічних імунізаційних реакцій знаходиться у центрі уваги багатьох досліджень. Ця стратегія є привабливою, оскільки вона має потенціал щодо забезпечення імунологічної специфічності, більш суворого контролю виробничих процесів, та усунення більшості вторинних джерел матеріалів чи забруднень, асоційованих з продукуванням імунітету. Однак, використання очищених протеїнів чи пептидних фрагментів для вакцинації залежить від доставки матеріалу до ділянки імунізації за допомогою ефективного носія антигену. Потенційно, одним з найбезпечніших носіїв були комплекси вакцин на ліпідній/ліпосомній основі. Ліпосоми вже давно визнані як комерційно життєздатна технологія, оскільки вони знижують токсичність лікарських засобів, збільшують час циркуляції у кровотоці, і змінюють біорозподіл та фармакокінетику молекул лікарського засобу. При введенні in vivo ліпосоми циркулюють у крові й видаляються фагоцитарною системою моноцитів/макрофагів, особливо у печінці, селезінці, лімфатичних вузлах та тканинах легенів. Здатність ліпосом впливати на характер розподілу антигенів дає можливість припустити, що ліпосомальний імуноген буде максимально експонованим для імунної системи. Досі були проведені випробування кількох систем на ліпідній основі, включаючи пептиди, кон'юговані з ліпідами, реконституцію цілих субодиниць протеїнів у присутності ліпідів, та асоціацію протеїнів з попередньо утвореними ліпосомами. Хоч було показано, що ці методики є імунологічно активними, технічні труднощі, асоційовані з великомасштабним виробництвом протеїнів та їх ліпідних носіїв, а також вартісні обмеження роблять їх менш привабливими для промислового виробництва. Отже, для використання потенціалу, пов'язаного зі застосуванням ліпосом у розробці вакцин, потрібна вдосконалена система чи підхід до одержання протеїнових антигенів. Згідно з втіленням цього винаходу, пропонується спосіб збільшення ефективності ліпосомальних вакцин через підвищення їх імуногенності шляхом введення до ліпосомальної мембрани гідрофобно компоненту мідь-порфиринового комплексу, де масове співвідношення мідь-порфиринового комплексу в ліпосомальній мембрані до концентрації фосфоліпідів становить від 1:2 до 1:1000. Відоме застосування імуногенної композиції білкових антигенів вірусу герпесу Зостер в ліпосомальній формі для попередження або зменшення інтенсивності оперізуючого герпесу та/або постгерпетичної невралгії (Патент України 94900 від 25.06.2011, Бюл. № 12, 2011). В Патенті запропоновано декілька різноманітних ад'ювантів. Недоліком прототипу є різке падіння титру захисних антитіл протягом місяця після вакцинації. Це пов'язано з недостатнім часом для контакту клітин імунної системи з вакцинними антигенами та швидким руйнуванням та інактивацією ліпосом. Розкриття корисної моделі. Згідно з даною корисною моделлю, поставлена задача розробити спосіб збільшення ефективності ліпосомальних вакцин шляхом підвищення їх імуногенності. Поставлена задача вирішується шляхом введення до ліпосомальної мембрани гідрофобного компоненту мідь-порфиринового комплексу (Фіг.), де масове співвідношення мідьпорфиринового комплексу в ліпосомальній мембрані до концентрації фосфоліпідів становить від 1:2 до 1:1000. Отриманий спосіб може бути використаний в фармації та медицині для розробки нових ліпосомальних вакцин для профілактики та лікування найпоширеніших хвороб людини. 1 UA 108884 U 5 10 15 20 25 30 35 40 45 50 Приклад 1. Отримання ліпосом з антигенами грипу проводять таким чином: в 20-мл скляний стакан, що містить 10 мл розчину на фосфатному буфері по 15 мг/мл грипозних антигенів (гемаглютиніни НІ та нерамінідази N3 з вакцини ''Інфлювак'' 2012 року випуску), вносять 500 мг фосфатилхолінових ліпосом у ліофілізованому вигляді (препарат Ліпін), перемішують до однорідності, поступово вприскують 0,2 мл 5 % розчину мідь-порфирину (отриманий з евкаліптового хлорофілу). Отриманий розчин обробляють ультразвуком при 44 кГц 3 хвилини та далі використовують для вакцинації тварин (варіант В1). Дані, що ілюструють імуногенність ліпосом наведені у прикладі 3. Приклад 2. Отримання ліпосом з антигенами грипу проводять таким чином: в 20-мл скляний стакан, що містить 10 мл розчину на фосфатному буфері по 15 мг/мл грипозних антигенів (гемаглютиніни НІ та нерамінідази N3 з вакцини ''Інфлювак'' 2012 року випуску), вносять 500 мг фосфатилхолінових ліпосом у ліофілізованому вигляді (препарат Ліпін), перемішують до однорідності, поступово вприскують 0,2 мл 5 % спиртового розчину мідь-порфирину (отриманий з евкаліптового хлорофілу) та 1 % розчину холестерину. Отриманий розчин обробляють ультразвуком при 44 кГц 3 хвилини та далі використовують для вакцинації тварин (варіант В2). Дані, що ілюструють імуногенність ліпосом наведені у прикладі 3. Приклад 3. Дослідження імуногенності отриманого вакцинного препарату у порівнянні з немодифікованими вакцинними антигенами. Експеримент проводився на 192 безпородних білих мишах вагою 20-22 г. Для дослідження вибрано моновалентні протипандемічні вакцини з актуальними штамами вірусів грипу: В1, В2, субодиничний субстрат вакцини МоноГрипол (люб'язно наданий для експерименту НДІ вакцин і сироваток, Санкт-Петербург, Росія). Склад білків дослідних вакцин вивчали за допомогою біоаналізатора ''Agilent-2100''. SDS-PAGE (sodium dodecyl sulfate polyacrylamide gel electrophoresis) являє собою метод поділу та ідентифікації білкових сумішей за рахунок електрофорезу в поліакриламідному гелі в присутності детергенту - додецилсульфата натрію в модифікації Леммлі. Імуногенність вакцин оцінювали з використанням реакції гальмування гемаглютинації (РГГА) зі специфічними антигенами, яка дозволяє виявити противірусні антитіла в сироватці крові. Тварин імунізували у першу добу і потім на 14-у добу у в/ч дозі 0,3 мл, формували групи, використовуючи вакцини В1, В2, субстрат вакцини МоноГрипол. Контрольній групі вводилася в/ч стерильна вода для ін'єкцій у дозі 0,3 мл на першу та 14-у добу. У кожну з груп входило по 24 тварин, яких виводили з експерименту шляхом декапітації під ефірним наркозом з отриманням сироватки крові: 50 % на 14 добу та 50 % на 30 добу. З отриманих сироваток крові, після видалення неспецифічних інгібіторів ГА, готували двократне розведення в лунках планшету, починаючи від 1:10 до 1: 640 в об'ємі 0,2 мл. До кожного розведення сироватки додавали 0,2 мл робочої дози антигену (4 AT). Потім поміщали в шейкер і після перемішування залишали на 30 хв при температурі 20±2 °С, додавали в кожну лунку 0,4 мл 1 % суспензії курячих еритроцитів, знову перемішували в шейкері з подальшою витримкою при тій же температурі протягом 45 хв, після чого проводилося врахування результатів реакції. При присутності специфічних антитіл в сироватці спостерігалося гальмування аглютинації еритроцитів. За титр сироватки брали те граничне розведення (terminum fetura), яке викликало повне гальмування ГА. Гальмування ГА свідчить про відповідність типу антигену і взятої сироватки, а відсутність гальмування про невідповідність. Для визначення похибки показників використовували t-критерій Ст'юдента. Розбіжність вважали достовірним при рівні значущої ρ менше 0,05. За допомогою біоаналізатора ''Agilent-2100'' визначено кількість протеїнів, їхсумарну масу та процентне співвідношення в кожній з досліджених вакцин. Всі взяті в дослідження препарати відповідали нормативам Європейської Фармакопеї за загальною кількістю білка. Субодиничні вакцини В1 і В2 містить по 2 білкових компонента. Молекулярна маса білкових фрагментів склала 15 KDa та 50 KDa. Результати дослідження імуногенності вакцинних препаратів представлені в таблиці. 55 2 UA 108884 U Таблиця 1 Титри специфічних антитіл до вірусу A (H1N1), (H3N2) та вірусу В після одноразової та бустерної імунізації ліпосомальними кандидатами в вакцинні препарати В1 та В2 та субодиничним субстратом вакцини МоноГрипол Вакцинні препарати (n=11) субстрат вакцини МоноГрипол В1 В2 Контроль Вакцинні препарати (n=11) субстрат вакцини МоноГрипол В1 В2 Контроль Вакцинні препарати (п=11) субстрат вакцини МоноГрипол В1 В2 Контроль 5 10 15 20 25 Вірус А (Н1N1) Перша імунізація Друга (бустерна) імунізація Частота даного Частота даного Титр антитіл Титр антитіл титру в групі, % титру в групі, % 1:80 56 1:120 67 1:80 60 1:160 78 1:120 80 1:260 94 1:0 100 1:0 100 Вірус A (H3N2) Перша імунізація Друга (бустерна) імунізація Частота даного Частота даного Титр антитіл Титр антитіл титру в групі, % титру в групі, % 1:40 65 1:120 74 1:80 70 1:360 78 1:120 80 1:360 96 1:0 100 1:0 100 Вірус В Перша імунізація Друга (бустерна) імунізація Частота даного Частота даного Титр антитіл Титр антитіл титру в групі, % титру в групі, % 1:80 56 1:120 67 1:80 68 1:260 78 1:120 80 1:360 94 1:0 100 1:0 100 З таблиці видно, що відзначено приріст гомологічних антитіл до вірусу A(H1N1) після проведення імунізації вакциною В1 в 8 разів (60 % піддослідних тварин перше введення) і в 16 разів (78 % після другого введення) (табл. 1). Після першої вакцинації В2 гомологічні антитіла у 80 % зросли у 12 разів, а друга вакцинація підняла цей показник в 26 разів у 94 % вакцинованих тварин. Субстрат МоноГрипол також дав достатній рівень синтезу AT (перша - в 8 разів у 56 % тварин, друга - в 12 раз у 67 % тварин). Приріст гомологічних антитіл до вірусу A(H3N2) після проведення імунізації вакциною В1 в 8 разів (70 % піддослідних тварин перше введення) і в 36 разів (78 % після другого введення) (табл. 1). Після першої вакцинації В2 гомологічні антитіла у 80 % зросли у 12 разів, а друга вакцинація підняла цей показник в 36 разів у 96 % вакцинованих тварин. Субстрат МоноГрипол також дав достатній рівень синтезу AT (перша - в 4 разів у 65 % тварин, друга - в 12 раз у 74 % тварин). Рівень антитіл до вірусу В після проведення імунізації вакциною В1 збільшився в 8 разів (68 % піддослідних тварин перше введення) і в 26 разів (78 % після другого введення) (табл.1). Після першої вакцинації В2 гомологічні антитіла у 80 % зросли у 12 разів, а друга вакцинація підняла цей показник в 36 разів у 94 % вакцинованих тварин. Субстрат МоноГрипол також дав достатній рівень синтезу AT (перша - в 8 разів у 56 % тварин, друга - в 12 раз у 67 % тварин). Таким чином, В2 володіє значно більшою імуногенністю у порівнянні з В1. Дані про імуногенність обох досліджених вакцин відповідають вимогам до вакцин зазначеного типу. Джерела інформації: Патент України 94900 від 25.06.2011, Бюл. № 12, 2011 ФОРМУЛА КОРИСНОЇ МОДЕЛІ 1. Спосіб збільшення ефективності ліпосомальних вакцин через підвищення їх імуногенності, який відрізняється тим, що до ліпосомальної мембрани вводять гідрофобний мідьпорфириновий комплекс. 3 UA 108884 U 2. Спосіб за п. 1, який відрізняється тим, що масове співвідношення мідь-порфиринового комплексу в ліпосомальній мембрані до концентрації фосфоліпідів становить від 1:2 до 1:1000. Комп’ютерна верстка Л. Ціхановська Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 4
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A61K 47/40, A61K 39/00
Мітки: імуногенності, спосіб, ліпосомальних, підвищення, вакцин
Код посилання
<a href="https://ua.patents.su/6-108884-sposib-pidvishhennya-imunogennosti-liposomalnikh-vakcin.html" target="_blank" rel="follow" title="База патентів України">Спосіб підвищення імуногенності ліпосомальних вакцин</a>
Попередній патент: Набір засобів для лікування та профілактики захворювань
Наступний патент: Спосіб йодування лікарських трав
Випадковий патент: Виливок із напівспокійної й киплячої сталі