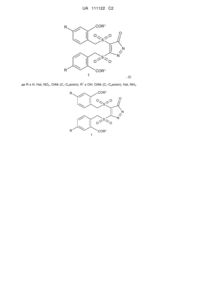
Спосіб одержання піразолонового циклу
Номер патенту: 111122
Опубліковано: 25.03.2016
Автори: Воловенко Юліан Михайлович, Шишкіна Олена Олегівна, Кісіль Андрій Іванович
Формула / Реферат
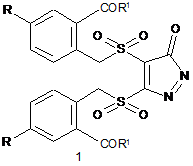
Спосіб одержання піразолонового циклу загальної формули 1, який включає розчинення сполуки формули 2

в нітратній кислоті або оброблення нітратною кислотою в органічному розчиннику з утворенням сполуки формули 1:
 ,
,
де R є Н, Hal, NO2, OAlk (С1-С6алкіл); R1 є ОН, OAlk (С1-С6алкіл), Hal, NH2.
Текст
Реферат: Спосіб одержання піразолонового циклу формули (І) стосується галузі органічної хімії, зокрема хімії гетероциклічних сполук та може бути використаний в біології, хімії та медицині для створення фармацевтичних препаратів таких як анальгетики і який включає нітрування ізотіохроман-4-он-2,2-діоксиду за допомогою нітратної кислоти з одержанням сполуки формули UA 111122 C2 (12) UA 111122 C2 COR1 R O S O O N S O R N O COR1 1 , (І) 1 де R є Н, Hal, NO2, OAlk (С1-С6алкіл); R є ОН, OAlk (С1-С6алкіл), Hal, NH2. COR1 R O O O S N O R 1 S COR1 N O UA 111122 C2 Даний винахід стосується галузі органічної хімії, зокрема хімії гетероциклічних сполук, а саме принципово нового способу отримання піразолонового циклу на прикладі формули 1 COR1 R O S O O N O R S N O COR1 1 , 1 де R є H, Hal, NO2, OAlk (C1-C6алкіл); R є OH, OMe, OAlk (C1-C6алкіл), Hal, NH2. Винахід може бути використаний в біології, хімії та медицині для створення фармацевтичних препаратів групи анальгетиків. Похідні піразолонового циклу використовуються в медицині як анальгетики. Наприклад: анальгін, амідопірин, феназон, пропіфеназон, фенілбутазон [1]. Сульфони є важливим класом сполук завдяки широкому спектру біологічної дії [2]. Для відомих способів синтезу піразолонового циклу необхідне використання фрагменту N-N (гідразини, гідразиди, діазоалкани та інш.) [3-5]. Загальні недоліки всіх цих методів полягають в необхідності використовувати високотоксичні діазоалкані, гідразин та його похідних, додаткові заходи для введення сульфонового замісника в 4 та 5 положення піразолонового циклу. Відомі способи синтезу піразолонового циклу супроводжуються утворенням побічних продуктів, що значно знижує виходи продуктів реакцій. Найбільш близького аналогу до винаходу, що заявляється, за сукупністю ознак авторами не знайдено. В основу винаходу поставлена задача створити принципово новий спосіб синтезу невідомих раніше похідних піразолонового ряду в одну стадію, без утворення побічних продуктів, що дозволить збільшити вихід цільової сполуки. Поставлена задача вирішується нітруванням ізотіохроман-4-он-2,2-діоксиду за допомогою нітратної кислоти. Запропоновано механізм протікання реакції, для підтвердження якого було розроблено чотири методики синтезу піразолонового циклу. Застосування нового способу синтезу невідомих раніше похідних піразолонового циклу підвищує вихід цільової сполуки, усуває необхідність використовувати високотоксичні речовини та додаткові заходи для введення сульфонового замісника в 4 та 5 положення піразолонового циклу. При нітруванні сульфону 2 в умовах HNO3/AcOH/25 °C було синтезовано похідні піразолону 1 (Варіант 1) з виходом 78 % (Схема 1). Схема 1 COR1 R O O R S O O і або іі, або ііі S 2 O N R=H, F O O R 1 і: 65 % HNO3, RCOOH (R: Me, Et, CF3, CH3CH(Br); ii: 50 % HNO3, AcOH або димляча HNO3, AcOH iii: 65 % HNO3, нагрівання 1 S COR1 N O UA 111122 C2 Структура 2,2'-[(3-оксо-3Н-піразол-4,5-діїл)біс(сульфонілметилен)]-дибензойної кислоти та її флуорозаміщеної похідної 1 була доведена за допомогою сучасних фізико-хімічних методів дослідження будови сполук. Для встановлення механізму протікання принципово нового одностадійного способу синтезу піразолонового циклу було виконано ряд досліджень. Оскільки присутність атомів нітрогену в структурі 1 в деякій мірі зрозуміла, то наявність додаткового атому вуглецю викликало подив. Було висловлено припущення, що додатковий вуглець походить з оцтової кислоти при її окисненні. Для визначення цього припущення оцтова кислота, як розчинник, була замінена на декілька інших карбонових кислот (пропіонову, трифлуороцтову та 2-бромопропіонову кислоти), але продукт реакції був однаковий (Схема 1), (Варіант 1). Таким чином, додатковий вуглець надходить від третьої молекули сульфону 2, а не від карбонової кислоти. Для підтвердження цієї гіпотези було проведено реакцію з використанням нітратної кислоти як реагенту і розчинника. Нагрівання розчинів ізотіохроман-4-он-2,2-діоксидів 2 в 65 % нітратній кислоті протягом 2-5 хвилин приводить до піразолону 1 з виходом 77-92 % (Варіант 2). Реакція супроводжується виділенням газу. Наступне завдання для встановлення механізму, яке було успішно вирішено, полягало в тому, щоб дослідити вплив концентрації нітратної кислоти на швидкість перебігу реакції та на вихід цільового продукту. Встановлено, що при використанні оцтової кислоти як розчинника, заміна 65 % нітратної кислоти на димлячу значно уповільнює швидкість реакції з 7 днів до 2 місяців та зменшує вихід продукту реакції (Варіант 3). У той же час, при використанні 50 % нітратної кислоти (Варіант 4), реакція протікає набагато швидше (4 дні) але вихід цільового продукту також зменшується. Таким чином, можна припустити, що у формуванні піразолону 1 приймає участь вода. Враховуючи вищевикладене, було запропоновано механізм цієї реакції на прикладі незаміщеного ізотіохроман-4-он-2,2-діоксиду (Схема 2). Схема 2 O COOH OH R NO2 HNO3 SО2 O , HNO3 HO COOH S O SO2 HNO3 NO2 O N O NO2 S O O 4 3 2 COOH COOH COOH S O2 O NO 2 O S S O O NO2 COOH O S O NO2 HNO3 NO2 O O NO2 S -HNO3 O OH NO2 S O COOH COOH O S HOH O COOH 5 COOH COOH COOH S O2 NO2 O S O O S HNO3 O O S HOH NO2 -H2O S COOH O COOH O CO 2H O 2N O CH3 O S O NO2 -SO2 NO2 O NO2 O O COOH COOH COOH S COOH O O O O S N S N O O O OH N -H2O O H COOH S COOH 1 2 S COOH 6 O S N O O O N=O NO2 O UA 111122 C2 Так, на першій стадії, відбувається нітрування ізотіохроманону 2 з утворенням нітрофенолу 3 та подальшим розкриттям тіопіранового циклу з наступним нітруванням активованої метиленової групи та приєднанням другої молекули інтермедіату 4. Можна допустити, що наступним кроком є приєднання третьої молекули інтермедіату 4 по подвійному зв'язку проміжної сполуки 5 з одночасним відщепленням молекули води. При стабілізуванні молекули за рахунок елімінування 2-метил-5-нітробензойної кислоти утворюється проміжна сполука 6. Формування 2-метил-5-нітробензойної кислоти є результатом узгодженої орієнтації замісників в 2-метилбензойній кислоті, яка була виділена в процесі протікання реакції. Під дією SO2, як відновника, відбувається часткове відновлення нітрогруп та реакція, яка схожа на конденсацію Кневенагеля, з утворення сполуки 1. Щоб підтвердити, запропонований механізм в момент синтезу до горла колби підносили вологий фільтрувальний папір з спиртовим розчином йоду. Знебарвлення йоду на фільтрувальному папері (J2→2J-) вказує, що виділяється сульфітний ангідрид (SO2), який окиснюється до сульфат-іону при відновленні нітрогруп. Наявність сульфат-іонів було доведено за допомогою якісної реакції з хлоридом барію. Ще одним доказом запропонованого механізму є наявність 2-метил-5-нітробензойної кислоти у фільтраті, яку було ідентифіковано шляхом порівняння спектральних даних з даними літератури [6]. Одержаний продукт має достатню чистоту для подальшого використання. Винахід підтверджується наступними прикладами, які ілюструють, але не обмежують об'єм даного винаходу. Методики синтезу 2,2'-[(3-оксо-3H-піразол-4,5-диіл)біс(сульфонілметилен)]дибензойної кислоти та її флуорозаміщеної похідної (1) Варіант 1: До розчину ізотіохроман-4-он-2,2-діоксиду 2 (1 ммоль) в карбоновій кислоті (2 мл) додавали 65 % HNO3 (6,6 ммоль). Реакційну суміш залишали на 7-30 днів при кімнатній температурі. Осад фільтрували, промивали полярним розчинником, висушували. Карбонова кислота СН3СООН СН3СН2СООН CF3COOH СН3СН(Вr)СООН Час реакції, дні 7 8 30 17 Вихід, % 78 50 69 32 Варіант 2: Ізотіохромен-4-он-2,2-діоксид 2 (1 ммоль) розчиняли в 65 % нітратній кислоті (22,1 ммоль). Реакційну суміш нагрівали впродовж 5 хвилин та охолоджували до кімнатної температури. Осад фільтрували, промивали полярним розчинником, висушували. Вихід похідної піразолону 1 складав 77-92 %. Варіант 3: До розчину ізотіохроман-4-он-2,2-діоксиду 2 (1 ммоль) в оцтовій кислоті (2 мл) додавали НNO3 (димляча) (7.2 ммоль). Реакційну суміш залишали на 2 місяці при кімнатній температурі. Осад фільтрували, промивали полярним розчинником, висушували. Вихід похідної піразолону 1 складав 49 %. Варіант 4: Ізотіохроман-4-он-2,2-діоксид 2 (1 ммоль) розчиняли в оцтовій кислоті (2 мл), додавали 50 % HNO3 (6.2 ммоль) та залишали реакційну суміш при кімнатній температурі на 4 дні. Осад фільтрували, промивали полярним розчинником, висушували. Вихід похідної піразолону 1 складав 81 %. R=Н: Т.пл. 229-230 °C;1Н ЯМР, м. ч.: δ 5.58 (с, 4Н, СН2), 7.53-7.59 (м., 4Н, АrН), 7.65 (т., J=7.0 Гц, 2Н, АrН), 7.94 (д., J=7.8 Гц, 1Н, ArH), 7.97 (д., J=7.8 Гц, 1Н, АrН), 13.44 (розш. с, 2Н, ОН); 13С ЯМР, м.ч.: 59.39, 60.52, 114.75, 127.09, 127.88, 130.32, 130.44, 131.56, 131.64, 131.83, 132.16, 133.07, 135.25, 135.27, 155.16, 168.72, 168.84; ІЧ, см-1: 3457ОН, 1689С=О, 1630С=О, 1352SO2(acим.), 1132SO2(cим.). Вираховано для C19H14N2O9S2: С, 47.70; Н, 2.95; N, 5.85; S, 13.40. Знайдено: С, 48.03; Н, 3.27; N, 6.01; S, 13.78. R=F: T.пл. 226-228 °C; 1Н ЯМР, м. ч.: δ 5.50 (с, 2Н, СН2), 5.51 (с, 2Н, СН2), 7.36 (м., 2Н, АrН), 7.61-7.69 (м., 4Н, АrН); 13С ЯМР, м. ч.: 58.00, 59.14, 113.68, 117.61 (2JC-F=49 Гц), 117.84 (2JCF=55 Гц), 119.01 (2JC-F=39 Гц), 119.23 (2JC-F=45 Гц), 122.79, 123.64, 133.30, 133.74, 136.63, 136.70, 136.78, 154.18, 161.00 (1JC-F=99 Гц), 163.74 (1JC-F=96 Гц), 166.80, 166.92; ІЧ, см-1: 3458ОН, 1687С=О, 1632 С=О, 1355SO2(асим.), 1138SО2(сим.). Вираховано для C19H12F2N2O9S2: С, 44.36; Н, 2.35; N, 5.45; S, 12.47. Знайдено: С, 44.21; Н, 2.49; N, 5.51; S, 12.33. Заявлений принципово новий одностадійний спосіб синтезу невідомих раніше похідних піразолонового циклу дозволяє отримати цільовий продукт з високим виходом за рахунок відсутності побічних реакцій. Крім того, нема необхідності використовувати високотоксичні 3 UA 111122 C2 сполуки та додаткові заходи для введення сульфонового замісника в 4 та 5 положення піразолонового циклу. У той жечас спосіб синтезу піразолонового циклу, що патентується, розширює ряд існуючих потенційно біологічно активних похідних піразолону, що можуть бути використані для створення фармацевтичних препаратів. Джерела інформації: 1. R.N. Brogden, Pyrazolonederivatives. Drugs, 1986, 32, Suppl. 4:60-70. 2. N.S. Simpkins, Sulfonesinorganicsynthesis. Pergamon, Oxford, 1993, 381. 3. M.B. Smith, J. March, March's advanced organic chemistry, fifthed., John Wiley & Sons: New York, 2001, p. 1192. 4. S. Singh, K. Husain, F. Athar, A. Azam, Eur. J. Pharm. Sci, 2005, 25, 255. 5. С Dohutia, P. P. Kaishap, D. Chetia, Int. J. Pharm. Pharm. Sci, 2013, 5, 86. 6. S. Gobbi, A. Cavalli, M. Negri, K.E. Schewe, F. Belluti, L. Piazzi, R.W. Hartmann, M. Recanatini, A. Bisi, J. Med. Chem., 2007, 50, 3420. ФОРМУЛА ВИНАХОДУ Спосіб одержання піразолонового циклу загальної формули 1, який включає розчинення сполуки формули 2 O R S O O 2 в нітратній кислоті або оброблення нітратною кислотою в органічному розчиннику з утворенням сполуки формули 1: COR1 R O S O O N O R 1 S N O COR1 , 1 де R є Н, Hal, NO2, OAlk (С1-С6алкіл); R є ОН, OAlk (С1-С6алкіл), Hal, NH2 Комп’ютерна верстка Г. Паяльніков Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 4
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for synthesis of pyrazolone cycle
Автори англійськоюShyshkina Olena Olehivna, Kysil Andrii Ivanovych, Volovenko Yulian Mykchaylovich
Назва патенту російськоюСпособ получения пиразолонового цикла
Автори російськоюШишкина Елена Олеговна, Кисель Андрей Иванович, Воловенко Юлиан Михайлович
МПК / Мітки
МПК: C07D 231/24, C07D 231/10, C07D 231/08
Мітки: одержання, піразолонового, спосіб, циклу
Код посилання
<a href="https://ua.patents.su/6-111122-sposib-oderzhannya-pirazolonovogo-ciklu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання піразолонового циклу</a>
Попередній патент: Спосіб отримання зміцненого покриття на поверхнях деталей із кольорових сплавів
Наступний патент: Застосування комбінованого терапевтичного засобу для лікування риніту
Випадковий патент: Барабан шахтної підйомної машини