Рутенієвий комплекс та спосіб його одержання, проміжна сполука та спосіб її одержання, спосіб проведення реакцій метатезису та замикання циклу
Формула / Реферат
1. Сполука формули 1
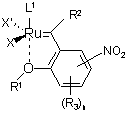 , 1
, 1
у якій Х та X' означають галоген;
R1 означає С1-С5-алкіл;
R2 означає Н;
R3 означає Н;
n означає 3;
L1 означає Р(R11)3, де R11 означає С3-С8-циклоалкіл,
або ліганд формули 6а
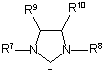 , 6a
, 6a
у якій
R7 та R8 означають феніл, необов'язково заміщений 1-3 групами, незалежно вибраними з С1-С6-алкілів;
R9 та R10 означають Н.
2. Сполука за п. 1, яка відрізняється тим, що є сполукою формули 1а
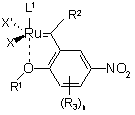 , 1a
, 1a
у якій L1, X, X', R1, R2, R3 та n мають значення, що вказані в п. 1.
3. Сполука за п. 1 або п. 2, яка відрізняється тим, що
L1 означає РСу3 або ліганд формули 6а;
Су означає циклогексил;
Х та X' кожен означає атом хлору.
4. Сполука за будь-яким з пп. 1-3, яка відрізняється тим, що
L1 означає ліганд формули 6а; та
R7 та R8 означають 2-метилфеніл, 2,6-диметилфеніл або 2,4,6-триметилфеніл.
5. Сполука за будь-яким з пп. 1-4, яка відрізняється тим, що
R1 означає ізопропіл;
R2 означає Н.
6. Сполука формули 2
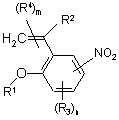 , 2
, 2
у якій R1 означає С1-С5-алкіл;
R2 означає Н;
R3 означає Н;
R4 означає Н;
m означає 2;
n означає 3.
7. Сполука за п. 6 формули 2, яка відрізняється тим, що є сполукою формули 2а
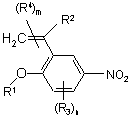 2а,
2а,
у якій R1, R2, R3, R4, m та n мають значення, що вказані в п. 6.
8. Сполука за п. 6 або 7, яка відрізняється тим, що
R1 означає ізопропіл.
9. Спосіб одержання сполуки за будь-яким з пп. 1-5, який відрізняється тим, що проводять реакцію сполуки формули 2 або 2а за будь-яким з пп. 6-8 з рутенієвим комплексом загальної формули 5
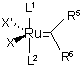 , 5
, 5
у якій L1 та L2, Х та X' мають значення, що зазначені в п. 1;
R5 означає Н, С1-С20-алкіл;
R6 означає феніл.
10. Спосіб за п. 9, який відрізняється тим, що реакцію проводять у присутності солі міді (І).
11. Спосіб одержання проміжної сполуки формули 2 або 2а за будь-яким з пп. 6-8, який відрізняється тим, що включає стадії:
а) алкілування сполуки формули 3
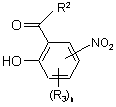 3
3
реагентом формули R1Z (9) з одержанням проміжної сполуки формули 4
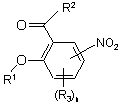 4
4
та
б) реакцію проміжної сполуки формули 4 з агентом олефінування формули
 10
10
з одержанням сполуки загальної формули 2
 , 2
, 2
де R1, R2, R3, R4, m та n формул 2а, 3, 4, 9 та 10 мають значення, вказані в будь-якому з пп. 6-8;
W означає відхідну групу, яка прийнятна для реакцій олефінування; та
Z означає атом галогену.
12. Спосіб проведення реакції метатезису, який включає контактування двох сполук, що містять подвійний зв'язок С=С, або однієї сполуки, що містить щонайменше два подвійні зв'язки С=С, з каталізатором, який відрізняється тим, що каталізатор включає сполуку за будь-яким з пп. 1-5.
13. Спосіб проведення реакції замикання циклу або перехресного метатезису, який відрізняється тим, що включає контактування діалкенільної сполуки з сполукою за будь-яким з пп. 1-5.
Текст
Даний винахід стосується рутенійкарбенових комплексів формули 1, їх синтезу та їх практичного застосування як каталізатори для реакцій метатезису різних типів. За останні декілька років у використанні метатезису олефінів в органічному синтезі було досягнуто великого прогресу. Були створені деякі рутенійкарбенові комплекси, що діють як (перед)каталізатори, які мають високу активність у різних реакціях метатезису, а також широку сумісність з рядом функціональних груп. Це сполучення характеристик є основою для можливості застосування таких (перед)каталізаторів в органічному синтезі. Більш того, для практичного застосування, особливо в промисловому масштабі, дуже необхідно, щоб ці рутенієві комплекси були стабільними впродовж більш тривалого періоду часу в умовах термічного навантаження та щоб їх можна було зберігати, очищати та використовува ти без атмосфери захисних газів. Рутенієві комплекси з вищезгаданими характеристиками відомі з літератури [див. J.Am.Chem.Soc. 2000, 122, 8168-8179 або Tetrahedron Lett. 2000, 41, 9973-9976]. Однак було встановлено, що краща стабільність пов'язана із зниженою каталітичною активністю. Таке обмеження було знайдено, наприклад, у (перед)каталізатора формули А [див. Angew.Chemie Int.Ed. 2002, 114, 832]. Далі, були описані (перед)каталізатори формул В та С, що мають підвищену каталітичну активність порівняно з активністю (перед)каталізатора формули А. Каталізатори А, В та С містять ізопропоксигрупу, що утворює з атомом металу хелат. Причиною підвищеної активності систем В та С є просторове утр уднення, викликане присутністю в орто-положенні до ізопропоксигрупи фенільної або (заміщеної) нафтильної групи [Angew.Chemie Int.Ed. 2002, 114, 832-834; Angew.Chemie Int.Ed. 2002, 114, 2509-2511]. Було встановлено, що рутенієві комплексні (перед)каталізатори загальної формули 1, що містять ароматичну нітрогрупу, мають набагато більш високу каталітичну активність у порівнянні з активністю відомих високоактивних рутенієвих комплексів та що одночасно з цим такі комплекси є термічно стабільними та стабільними на повітрі. Даний винахід стосується нових рутенієвих комплексів формули 1, до їх синтезу, синтезу всіх проміжних продуктів та застосування комплексів формули 1 як каталізатори або як передкаталізатори у якій L1 означає нейтральний ліганд; X та X' означають аніонні ліганди; R1 означає -С1-С5алкіл або -С5-С6циклоалкіл; R2 означає Н, -С1-С2оалкіл, -С2-С20алкеніл, -С2-С20алкініл або арил; R3 означає –С1-С6алкіл, -С1-С6алкоксі або арил, де арил може бути заміщений -С1-С6алкілом або -С1С6алкокси; n означає 0, 1, 2 або 3. Сполуки формули 1 за даним винаходом можна використовувати для каталізу реакцій метатезису олефінів, що включають, хоча ними їхній список не обмежений, метатезисну полімеризацію з розкриттям циклу (МПРЦ), метатезис замикання циклу (МЗЦ), деполімеризацію ненасичених полімерів, синтез телехелатних полімерів, метатезис "ен-в-ін" та синтез олефінів. Інший варіант виконання даного винаходу стосується нових похідних 2-алкокси-5-нітростиролу формули 2, що є проміжними продуктами для одержання комплексів 1, у якій R1, R2, R 3 та п мають значення зазначені вище, та R4 означає -С1-С20алкіл; m означає 0, 1 або 2; часткова формула являє алкіленову груп у, у якій один або обидва водневих атома в метиленовому радикалі можна замінити групою R4. Відповідно вона включає наступні алкіленові групи: Ще одним об'єктом винаходу є спосіб одержання нових похідних 2-алкокси-5-нітростиролу формули 2, у якій: заміщений 2-гідрокси-5-нітробензальдегід 3 алкілують за допомогою R1Z, де R1 має значення, що зазначене для формули 1, a Z являє собою групу, що відходить, яка вибрана з атомів галогену, С1-С6алкілS(О)-О-, С1-С 6фторалкіл-S(О)-О-, арил-S(О)-О- та арил-S(О)2-О-. Потім заміщений 2-алкокси-5-нітробензальдегід формули 4 обробляють агентом олефінування формули у якій R4 та m мають значення, що зазначені для формули 2, a W являє собою групу, що відходить, яка прийнятна для реакцій олефінування, з одержанням сполуки формули 2, Далі можна проводити реакцію сполуки 2 з рутенієвим комплексом формули 5 з одержанням рутенієвого комплексу формули 1, у якій L1 та L2 означають нейтральні ліганди; R5 означає Н, -С1-С20алкіл, -С2-С20алкеніл, -С2-С20алкініл або арил; R6 означає арил, вініл або аленіл; а X та X' означають аніонні ліганди. Потім можна проводити необов'язкову реакцію одержаної сполуки формули 1 з іншим нейтральним лігандом L1 для заміщення того нейтрального ліганду L 1, що міститься в сполуці формули 1, та, таким чином, одержання іншої сполуки формули 1. Сполуки, що представлені в даному описі, можуть мати центри асиметрії. Сполуки за даним винаходом, що містять асиметрично заміщений атом, можна виділяти в оптично активних або рацемічних формах. У даній області техніки добре відомо, як одержати оптично активні форми, зокрема розділенням рацемічних форм або синтезом з оптично активних вихідних матеріалів. У сполуках, що представлені у даному описі, можуть також бути багато геометричних ізомерів олефінів, та всі такі стабільні ізомери розглядаються як такі, що охоплюються обсягом даного винаходу. Геометричні цис- та транс-ізомери сполук за даним винаходом описані та можуть бути виділенні у формі суміші ізомерів або як виділені ізомерні форми. В усіх випадках, якщо не зазначена конкретна стереохімічна або ізомерна форма, передбачаються всі хіральні, діастереоізомерні, рацемічні форми та всі геометричні за своєю будовою ізомерні форми. На Фіг. наведений графік, на якому зіставлені швидкості циклізації 2-аліл-2-(2-метилаліл)діетилмалонату, якщо використовують рутенієвий каталізатор відповідно до даного винаходу та якщо використовують відомий рутенієвий каталізатор. Поняттям, смисл яких у даному описі конкретно не розкритий, слід надавати ті значення, які їм звичайно надає фахівець у даній області техніки з врахуванням опису та контексту. Однак у всі х випадках, якщо не зазначене інше, наступні поняття, що використовуються в даному описі мають зазначений смисл та супроводжуються прикладеними до них наступними умовними позначеннями. У групах, радикалах або залишках, що наведені нижче, число вуглецевих атомів часто зазначене перед назвою групи; так, наприклад, -С1-С6алкіл означає алкільну гр упу або радикал, що містить від 1 до 6 вуглецевих атомів. В усіх випадках, якщо нижче не зазначене інше, у всіх наведених формулах та групах використовують традиційні визначення термінів та вказується звичайна стійка валентність атомів. Поняття "заміщений", що використовується в даному описі, означає, що будь-який один або декілька водневих атомів при атомі, що називається, заміщені з вибором із зазначеного ряду за умови, що природна валентність цього атома, що називається, не перевищена та що заміщення приводить до утворення стабільної сполуки. Поняття "арил", що використовується в даному описі або самостійно, або в сполученні з назвою іншого замісника, означає будь-яку ароматичну монокарбоциклічну систему або ароматичні полікарбоциклічні системи. Так, наприклад, поняття "арил" включає фенільну або нафтильну циклічну систему. Поняття "атом галогену", що використовується в даному описі, означає галоїдний замісник, що вибраний з атомів фтору, хлору, брому та йоду. Поняття "-С1-С20алкіл", що використовується в даному описі або самостійно, або в сполученні з назвою іншого замісника, означає ациклічні, прямоланцюгові або розгалужені алкільні замісники, які містять від одного до двадцяти вуглецевих атомів. Поняття "-С1-С5алкіл" та "-С1-С6алкіл", що використовуються в даному описі, мають таке ж значення, як вищезгадане поняття, але передбачає вміст меншого числа вуглецевих атомів, а точніше максимум п'яти або шести вуглецевих а томів. Поняття - С1-С20алкіл, -С1-С5алкіл та -С1-С6алкіл можуть включати конкретно метил, етил, пропіл, бутил, гексил, 1-метилетил, 1-метилпропіл, 2-метилпропіл та 1,1диметилетил. Поняття "-С2-С20алкеніл", що використовується в даному описі або самостійно, або в сполученні з назвою іншого замісника, означає ациклічні, прямоланцюгові або розгалужені алкенільні замісники, що містять від двох до двадцяти вуглецевих атомів та щонайменше один подвійний зв'язок. Поняття "-С2-С6алкеніл", що використовується в даному описі, має таке ж значення, як вищезазначене поняття, але передбачає вміст меншого числа вуглецеви х атомів, а точніше максимум шести вуглецеви х атомів. Поняття -С1-С20алкеніл та – С1-С6алкеніл можуть включати конкретно вініл та аленіл. Поняття "-С2-С20алкініл", що використовується в даному описі або самостійно, або в сполученні з назвою іншого замісника, означає ациклічні, прямоланцюгові або розгалужені алкінільні замісники, що містять від двох до двадцяти вуглецевих атомів та щонайменше один потрійний зв'язок. Поняття "-С2-С6алкініл", що використовується в даному описі, має при цьому таке ж значення, як вищезгадане поняття, але передбачає вміст меншого числа вуглецевих атомів, а точніше максимум шести вуглецеви х атомів. Поняття "-С5-С6циклоалкіл", що використовується в даному описі або самостійно, або в сполученні з назвою іншого замісника, означає циклоалкільний замісник, що містить п'ять або шість вуглецевих атомів, та конкретно включає циклопентил та циклогексил. Поняття "-С1-С6алкокси", що використовується в даному описі або самостійно, або в сполученні з назвою іншого замісника, означає замісник –С1-С6алкіл-О-, у якого алкіл має наведені вище значення, що містить до шести вуглецевих атомів. Алкокси включає метоксі, етокси, пропокси, 1-метилетокси, бутокси та 1,1диметилетокси. Додаткові варіанти Кращі сполуки формули 1а, у якій L1, X, X', R 1, R2 , R3 та n мають такі ж значення, як зазначено вище. Більш кращими є сполуки загальної формули 1 або 1а, у якій L1 означає P(R11)3, а кожен R11 незалежно означає -С1-С6алкіл, -С3-С8циклоалкіл або арил; або L1 означає ліганд формули 6а, 6b, 6с або 6d у якій R7 тa R8 кожен незалежно означає Н, -С1-С20алкіл, -С2-С20алкеніл або феніл, де феніл необов'язково заміщений однією - трьома групами, незалежно вибраними з -С1-С6алкілу, -С1-С6алкокси та атома галогену; окремо R9 та R10 кожен незалежно означає Н, -С1-С20алкіл, -С2-С20алкеніл або феніл, де феніл необов'язково заміщений однією - трьома групами, незалежно вибраними з -С1-С6алкілу, -С1-С6алкокси та атома галогену, або R9 та R10 разом з вуглецевими атомами, до яких вони приєднані, поєднуються з утворенням карбоциклічного 3-8-членного кільця; Υ та Υ' означають атоми галогену. Особливо кращими є сполуки, у яких R7 та R8 кожен незалежно означає Н, -С1-С6алкіл, -С2-С6алкеніл або феніл, де феніл необов'язково заміщений однією - трьома групами, незалежно вибраними з –С1-С6алкілу, -С1-С6алкокси та атома галогену; R9 та R10 кожен незалежно означає Н, -С1-С6алкіл, -С2-С6алкеніл або феніл, де феніл необов'язково заміщений однією - трьома групами, незалежно вибраними з –С1-С6алкілу, -С1-С6алкокси та атома галогену, або R9 та R10 разом з вуглецевими атомами, до яких вони приєднані, поєднуються з утворенням карбоциклічного 5-7-членного кільця. Найбільш кращими є сполуки загальної формули 1 або 1 а, у якій R1 означає ізопропільну гр упу; і/або R2 означає Н, -С1-С6алкіл або арил, зокрема R2 означає водневий атом; і/або X та X' означають атоми галогену, зокрема хлору; і/або L1 означає Р(циклогексил)3; або L1 означає групу формули 6а, 6b, 6с або 6d; і/або R7 та R8 означають 2-метилбензол, 2,6-диметилбензол або 2,4,6-триметилбензол; і/або n означає 0. Додатковими варіантами є сполуки формули 1 або 1а, у якій: R1 означає ізопропіл; R2 означає Н; n означає 0; X та X' кожний означає атом хлору; a L1 означає ліганд формули 6а: у якій кожний з R7 та R8 означає 2,4,6-триметилфеніл; та R9 та R10 кожний означає Н. Кращі сполуки формули 2а, у якій R1, R2, R3, R 4, m та n мають такі ж значення, як зазначено вище. Більш кращі сполуки загальної формули 2 або 2а, у якій R1 означає ізопропільну гр упу і/або R2 означає Н, -С1-С6алкіл або арил, зокрема R2 означає водневий атом; і/або R4 означає –С1-С6алкіл, зокрема метил або етил; і/або n означає 0 і/або m означає 0. Іншими варіантами є сполуки формули 2 або 2а, у якій: R1 означає ізопропіл; R2 означає Н; m означає 0 та n означає 0. Більш того, кращий спосіб одержання комплексів формули 1 або 1а, у якому проводять реакцію сполуки загальної формули 2 або 2а з рутенієвим комплексом формули 5 у якій L1 та L2 означають нейтральні ліганди; R5 означає Н, -С1-С20алкіл, -С2-С20алкеніл, -С2-С20алкініл або арил; R6 означає арил, вініл або аленіл; а X та X' означають аніонні ліганди; необов'язково в присутності іншого нейтрального ліганду L1. Більш кращий вищезгаданий синтез рутенієвого комплексу формули 1, якщо процес проводять у присутності солі міді, зокрема CuCl; і/або в галоїдованому або ароматичному розчиннику, бажано вибраному з метиленхлориду, хлороформу, бензолу, толуолу, ксилолу, мезитилену та їх сумішей; і/або при температурі від 0 до 100°С, зокрема при температурі від 10 до 80°С, більш конкретно при температурі від 20 до 60°С; і/або впродовж періоду часу від 1 до 24год., зокрема від 1 до 10год., більш конкретно від 1 до 4год. Найбільш кращий вищезгаданий синтез рутенієвого комплексу, у якому реакцію проводять в одній посудині шляхом змішування ліганду формули 6а, 6b, 6с або 6d із твердим комплексом формули 5, де обидва ліганди L1 та L2 є фосфінами формули P(R11)3, у якій R11 має такі ж значення, як зазначено вище, та наступного додавання ліганду формули 2 або 2а. Один кращий варіант вищезгаданого синтезу рутенієвого комплексу полягає в одержанні in situ лігандів загальної формули 6а, 6b, 6с та 6d зі стабільних солей формул 7а, 7b, 7с та 7d у яких аніон вибирають з форміатного, ацетатного, трифторацетатного та інших кислотних залишків, атома галогену та [BF4]-. Отже, у кращому варіанті проводять реакцію солі у формі суспензії в розчинниках, таких як аліфатичні й ароматичні вуглеводні, краще в гексані, із сильною основою, що вибрана з гідридів та алкоголятів лужних металів та лужноземельних металів, краще з трет-пентаноляту калію, трет-амілату калію та трет-бутаноляту калію. Після цього реакцію продовжують додаванням твердого комплексу формули 5, у якій обидва ліганди L1 та L2 є фосфінами формули P(R11)3, та наступним додаванням ліганду формули 2 або 2а з одержанням сполуки загальної формули 1 або 1а. Більш того, кращий спосіб одержання проміжних продуктів, що включає стадії а) алкілування сполуки загальної формули 3 реагентом формули R1Z (9) з одержанням проміжного продукту формули 4 та б) реакції сполуки 4 з агентом олефінування формули 10 з одержанням сполуки загальної формули 2 у яких R1 , R2, R3, R4, m та n формул 2а, 3, 4, 9 та 10 мають значення, зазначені вище, W означає групу, що відходить, яка є прийнятною для реакцій олефінування, а Ζ означає атом галогену, -С1-С6алкіл-S(О)-О-, -С1-С 6фторалкіл-S(О)-О-, арил-S(O)-O- або арил-S(O)2-O-. Більш кращий спосіб, у якому вищезгадану стадію а) здійснюють в апротонному розчиннику, зокрема вибраному з ДМФ, ДМСО, ацетону, ацетонітрилу, етилацетату, простого гліколевого ефіру, метанолу, етанолу та їх сумішей, більш конкретно розчинник являє собою ДМФ; або в двофазовій системі розчинників, що містить міжфазовий каталізатор; або у присутності каталізатора, причому, зокрема, каталізатор вибирають з Cs 2CO2, CsF, четвертинних амонієвих солей, краун-ефірів та криптандів, більш конкретно Cs 2CO3; або у присутності карбонату лужного металу або гідроксиду лужного металу, зокрема вибраного з Na2CO3, K2CO3, Li2CO3 , Cs 2CO3, NaOH, KОН, LiOH, CsOH; або впродовж періоду часу від 1 до 24год., зокрема від 8 до 24год., більш конкретно від 16 до 24год. при температурі від 0 до 150°С, зокрема при температурі від 10 до 100°С, більш конкретно при температурі від 20 до 80°С. Виходячи зі сполуки 4, сполуку 2 одержують відповідно до умов Теббе, Віттіга, Віттіга-Хорнера, ВіттігаХорнера-Еммонса або Петерсона, але кращий спосіб, у якому вищезгадану стадію б) здійснюють у розчиннику, вибраному зі спиртів, гліколевих ефірів та циклічних простих ефірів, а кращий ТГФ; або W означає групу, що відходить, яка прийнятна для реакцій олефінування відповідно до Теббе, з титановим реагентом Теббе або відповідно до Віттіга, з фосфонійілідним реагентом Віттіга, більш конкретно групу, що відходить, вибрану з PPh3 або ТіСр2, де Ph означає заміщений або незаміщений феніл, а Ср означає заміщений або незаміщений циклопентадієнільний аніон, який можна знайти після реакції в його окисленій формі. Іншим кращим варіантом виконання винаходу є спосіб проведення реакцій метатезису всі х типів, включаючи контактування олефіну з каталізатором загальної формули 1 або 1а, зокрема якщо реакція метатезису являє собою реакцію замикання циклу або перехресного метатезису. Наступні приклади призначені для ілюстрації різних варіантів виконання даного винаходу, тому їх не можна сприймати як такі, що обмежують яким-небудь чином обсяг даного винаходу. Приклад 1 4.1. У суспензію порошкоподібного безводного карбонату калію, що перемішують, (1,1г, 8ммоль), каталітично ефективної кількості карбонату цезію (521мг, 40 мольних %) та сполуки 3.1 (668мг, 4ммоль) у сухому ДМФ (25мл) вводили нерозбавлений 2-йодпропан (0,8мл, 8ммоль). Реакційну суміш перемішували впродовж 24 год. при кімнатній температурі (КТ), а потім під вакуумом випарювали розчинник. Залишок виливали у воду (50мл) та екстрагували трет-ВuОМе (4 рази по 25мл). Об'єднані органічні шари промивали розсолом, сушили Mg2SO 4 та випарювали досуха. Сирий продукт очищали з використанням хроматографії в колонці із силікагелем (циклогексан/ЕtOАс 8:2), одержуючи 2-ізопропокси-5-нітробензальдегід 4.1 у вигляді низькоплавкої твердої речовини (850мг, 86%-ий вихід). ІЧ (KВr): n [см -1]=3115, 2991, 2942, 1679, 1609, 1526, 1348, 1284, 1111, 950, 832, 748, 667; 1 Н-ЯМР (500МГц, CDCI3, δ [част./млн]): 1,48 (d, 6H, J=6,1Гц), 4,85 (q, 1Н, J=6,1Гц), 7,10 (d, 1H, J=9,2Гц), 8,39 (dd, 1H, J=2,9, 9,2Гц), 8,69 (d, 1H, J=2,9Гц), 10,41 (s, 1H); 13 С-ЯМР (125МГц, CDCI3, δ [част./млн]): 21,8, 72,6, 113,6, 124,7, 125,12, 130,4, 141,1, 164,3, 187,8; MC (El): m/z 209 (10, [M]+.), 167 (100), 137 (18), 120 (11), 93 (7), 75 (3), 65 (10), 53 (4); MCBP (El) розрах. для [М]+ (C10H11O 4N): 209,0688; виявл.: 209,0686. 2.I. У суспензію, що перемішують, Ph3PCH3Br (932мг, 2,53ммоль) у сухому ТГФ (20мл) при -78°С повільно послідовно додавали розчин BuLi в гексані (1,8мл, 2,7ммоль, 1,5М) та розчин сполуки 4.1 у сухому ТГФ (2мл). Після цього реакційній суміші давали нагрітися до КТ та перемішували впродовж ще 10год. Після спливу цього часу додавали насичений розчин NH4CI (2мл) та трет-ВuОМе (100мл). Нерозчинний матеріал відфільтровували й одержаний розчин випарювали під вакуумом. Сирий продукт очищали хроматографією в колонці на силікагелі (з використанням циклогексану/ЕtOАс 8:2), одержуючи 2-ізопропокси-5-нітростирол 2.I у вигляді блідо-жовтого масла (236мг, 63%-ий вихід). ІЧ (плівка): n [см -1]=3088, 2982, 2967, 1627, 1607, 1583, 1516, 1341, 1271, 1107, 950, 742см -1; 1 Н-ЯМР (500МГц, CDCI3 , δ [част./млн]): 1,41 (d, 6H, J=6,0Гц), 4,71 (q, 1Н, J=6,0Гц), 5,40 (dd, 1H, J=0,5, 11,2Гц), 5,87 (dd, 1H, J=0,5, 17,7Гц), 6,91 (d, 1H, J=9,1Гц), 7,00 (dd, 1H, J=11,2, 17,7Гц), 8,12 (dd, 1H, J=2,8, 9,1Гц), 8,36 (d, 1H, J=2,8Гц); 13 С-ЯМР (125МГц, CDCI3, δ [част./млн]): 21,9, 71,5, 112,2, 116,8, 122,4, 124,5, 128,1, 130,1, 141,0, 159,9; MC (El): m/z 207 (4, [M]+.), 165 (59), 148 (100), 135 (4), 118 (96), 104 (2), 90 (15), 65 (8), 63 (7), 51 (4); MC (ESI): m/z 230 ([M+Na]+); MCBP (ESI): m/z розрах. для [M+Na]+(C 11H13O3NNa): 230,0788; виявлен.: 230,0776. Приклад 2 В аргоновій атмосфері карбеновий комплекс формули 5.II, у якій L2 означає ліганд NHC формули 6a.II (153мг, 0,18ммоль), та безводний CuCl (18мг, 0,18ммоль) поміщали в тр убку Шленка. Потім додавали сухий дезоксигенованого СН2Сl2 (10мл), після чого розчин сполуки 2.I (38мг, 0,18ммоль) у СН 2Сl2 (4мл). Суспензію, що утворилася, перемішували при 30°С впродовж 1год., потім її концентрували під вакуумом та очищали хроматографією в колонці з силікагелем (циклогексан/EtOAc 5:2). Після видалення розчинника та промивання невеликою кількістю сухого н-пентану комплекс 1.II, у якого мез означає мезитильну груп у, одержували у вигляді зеленої мікрокристалічної твердої речовини (100мг, 83%-ий вихід). Rf: 0,30 (гексан/ЕtOАс 8:2); 1 H-ЯМP (500МГц, CD2Cl2, δ [част./млн]): 16,42 (s, 1Н), 8,46 (dd, 1H, J=9,1, 2,5Гц), 7,80 (d, 1Н, J=2,5Гц), 7,10 (s, 4H), 6,94 (d, 1H, J=9,1Гц), 5,01 (септ., 1H, J=6,1Гц), 4,22 (s, 4H), 2,47 (2s, 18H), 1,30 (d, 6H, J=6,1Гц); 13 С-ЯМР (125МГц, CD2Cl2, δ [част./млн]): 289,1, 208,2, 156,8, 150,3, 145,0, 143,5, 139,6, 139,3, 129,8, 124,5, 117,2, 113,3, 78,2, 52,0, 21,3, 21,2, 19,4; ІЧ (KBr): n [см -1]=2924, 2850, 1606, 1521, 1480, 1262, 1093, 918, 745; МС (ESI): m/z 636 [М-Сl]+; MCBP(EI): m/z розрах. для C31H37N3 O3Ru: [М+.] 671,1255, виявлен.: 671,1229; Елементний аналіз, розрах.: (%) для C31H37N3O 3Ru (671,63): С 55,44, Η 5,55, Ν 6,26; виявлен.: С 55,35, Η 5,70, Ν 6,09. Приклад 3 В аргоновій атмосфері карбеновий комплекс формули 5.III (164,6мг, 0,20ммоль) поміщали в трубку Шленка. Потім додавали сухий дезоксигенований СН 2Сl2 (15мл), після чого розчин сполуки 2.I (50мг, 0,24ммоль) у СН2Сl2 (5мл). Суспензію, що утворилася, перемішували при 40°С впродовж 1год., а потім її концентрували під вакуумом та очищали хроматографією в колонці з силікагелем (циклогексан/EtOAc 5:2). Після видалення розчинників та промивання невеликою кількістю сухого н-пентану комплекс 1.III одержували у вигляді коричневої мікрокристалічної твердої речовини (95мг, 70%-ий вихід). 1 Н-ЯМР (500МГц, CDCI3, δ [част./млн]): 1,26-2,35 (m, 39H), 5,33-5,40 (m, 1H), 7,18 (d, J=5Гц, 1H), 8,54 (d, J=5Гц, 1H), 8,60 (s, 1H), 17,38 (d, J=5,0Гц, 1Н); 13 С-ЯМР (125МГц, CDCI3, δ [част./млн]): 22,1, 26,2, 27,7 (d, J=24Гц), 30,1, 35,8 (d,J=10Гц), 78,2, 113,2, 117,6, 124,2, 143,3, 157,0, 273,2; ІЧ (СН2Сl2, плівка): n [см -1]=2930 (s), 2852 (s), 1604 (m), 1575 (m), 1521 (s), 1476 (m), 1447 (m), 1379 (w), 1342 (s), 1275 (s), 1241 (m), 1205 (w), 1181 (w), 1136 (m), 1095 (s), 1049 (w), 1005 (w), 951 (m), 918 (s), 851 (m), 830 (m), 789 (m), 745 (s), 656 (m), 606 (m), 518 (m); MCBP (El): m/z розрах. для C28H44O 3N(35)Cl2P(102)Ru (M+): 645,14794; виявлен.: 645,14706. Приклад 4 Сіль 7.IV (152мг, 0,388ммоль) суспендували в аргоновій атмосфері в трубці Шленка в н-гексані (7мл). Після цього додавали трет-амілату калію, СН3СН2С(СН3)2О-K+ (0,22мл, 0,372ммоль, 1,7Μ розчин у толуолі) та одержаний блідо-жовтий мутний розчин перемішували при КТ впродовж 30хв. Потім додавали твердий рутенієвий комплекс формули 5.III (255мг, 0,310ммоль) та суспензію, що утворилася, кип'ятили зі зворотним холодильником впродовж 30хв. В одержану коричнево-рожеву суспензію при КТ додавали розчин сполуки 2.I (83,5мг, 0,403ммоль) у СН2Сl2 (7мл) та твердий CuCl (33,8мг, 0,341ммоль). Одержану суміш витримували при 40°С впродовж 1 год. Суміш, що утворилася, концентрували під вакуумом та очищали хроматографією в колонці з силікагелем (циклогексан/ЕtOАс 5:2). Після видалення розчинника та промивання невеликою кількістю сухого н-пентану комплекс 1.II одержували у вигляді зеленої мікрокристалічної твердої речовини (149мг, 72%-ий вихід). Аналітичні дані добре узгоджувалися з тими, котрі одержували раніше (див. приклад 2). Приклад 5 Одержання комплексу 1.V аналогічно прикладу 2 приводило до утворення зеленої мікрокристалічної твердої речовини (40%-ий вихід). ІЧ (KВr): n [см -1]=2924 (s), 2853 (s), 1608 (m), 1523 (m), 1483 (s), 1343 (s), 1267, 1010 (w), 905 (s), 826 (m), 745 (m). MC (El): m/z 643 (3), 322 (4), 304 (100), 289 (11), 246 (5), 181 (12), 159 (12), 158 (12), 105 (8), 77 (15), 43 (58). MC (LSIMS) m/z 644 (M+H+). Процеси з використанням сполуки загальної формули 1 як каталізатор для реакції метатезису відповідно в синтезах сполук, що містять подвійний зв'язок С=С і/або інші функціональні групи , протікають з несподівано великим успіхом. Отже, описані нижче нові (перед)каталізатори формули 1 перевершують, очевидно, інші, що порівнюються з ними відомі високоактивні рутенієві каталізатори, особливо в тому, що стосується їх активності. Внаслідок цього для кращого виходу продукту, в порівнянні з таким, що досягається за допомогою комплексів, що звичайно використовують та які себе зарекомендували, потрібні зменшені кількості каталізатора, більш низькі реакційні температури та зменшена тривалість реакції. Цю перевагу каталізаторів формули 1 показують наступні приклади 6-10. Приклад 6 Метатезисні реакції замикання циклу, що каталізуються сполуками формули 1.II (див. приклад 2) У розчин дієну S1 (210мг, 0,75ммоль) у СН2Сl2 (35мл) при 0°С додавали розчин каталізатора 1.II (5мг, 1 мольний %) у СН2Сl2 (2мл). Після перемішування при 0°С впродовж додаткової години під вакуумом видаляли розчинник та залишок очищали з використанням хроматографії в колонці з силікагелем (циклогексан/ЕtOАс 8:2), одержуючи сполуку Р1 (186мг, 99%-ий вихід) у ви гляді безбарвної твердої речовини. ІЧ (KВr): n [см -1]=3030, 2942, 2899, 2855, 1657, 1596, 1450, 1332, 1286, 1162, 910, 816, 712; 1 Н-ЯМР (200МГц, CDCI3, δ [част./млн]): 2,28 (m, 4Н), 2,39 (s, ЗН), 3,25 (m, 4H), 5,72 (m, 2H), 7,25 (d, 2H, J=8,2Гц), 7,64 (d, 2H, J=8,2Гц); 105 (2), 91 (19), 96 (16), 77 (1), 65 (13), 42 (100); 13 С-ЯМР (50МГц, CDCI3, δ [част./млн]): 21,5, 29,948,2, 126,9, 129,5, 130,1, 136,2, 142,9; МС (El): m/z 251 (5, [М]+) 223 (2), 184 (6), 155 (4), МСВР (El) m/z розрах. для [М]+ (C 13H17O2NS): 251,0980; виявлен.: 2251,0979. Приклад 7 Реакції перехресного метатезису, що каталізуються сполуками формули 1.II (див. приклад 2) У розчин індолу, що перемішують, S2 (77,8мг, 0,36 моль) та метилакрилату S2b (92,9мг, 1,1ммоль) у сухому СН 2Сl2 (15мл) додавали розчин каталізатора 1.II (12,1мг, 5 мольних %) у СН2Сl2 (5мл). Суміш, що утворилася, перемішували при КТ впродовж 2год. Під вакуумом видаляли розчинник та залишок очищали з використанням хроматографії в колонці з силікагелем (циклогексан/ЕtOАс 8:2), одержуючи сполуку (Е)-Р2 (186мг, 99%-ий вихід) у вигляді жовтої кристалічної твердої речовини. ІЧ (KBr): n [см -1]=3364, 2953, 2904, 1707, 1655, 1504, 1324, 1215, 750см -1; 1 Н-ЯМР (500МГц, CDCI3, δ [част./млн]): 2,42 (s, 3Н), 3,61 (dd, 2Н, J=1,7, 6,0Гц), 3,70 (s, 3Н), 5,74 (dt, 1Н, J=1,7, 15,7Гц), 7,09 (dt, 1H, J=6,0, 15,7Гц), 7,42 (d, 1H, J=8,8Гц), 7,98 (dd, 1H, J=2,0, 8,8Гц), 8,24 (d, 1H, J=2,0Гц), 8,51 (широкий s, 1H); (38), 199 (11), 189 (15), 175 (15), 168 (53), 154 (18), 143 (31), 127 (12), 115 (12), 84 (17); 13 С-ЯМР (125МГц, CDCI3, δ [част./млн]): 12,0, 26,7, 51,5, 107,2, 108,8, 115,4, 117,5, 121,4, 133,2, 133,6, 138,9, 142,6, 146,7, 167,0; MC (El): m/z 274 (100, [M]+.), 259 (75), 242 (63), 215 MCBP (El): m/z розрах. для [М]+. (C 14H14 O4N2): 247,0954; виявлен.: 274,0959. Елементний аналіз, розрах. (C14H 14O 4N2): С, 61,31, Η, 5,14; Ν, 10,21; виявлен.: С, 61,05, Η, 5,22; Ν, 10,09. Приклад 8 Вивчення швидкості циклізації оброблюваної речовини S3 (2-аліл-2-(2-метилаліл)діетилмалонат), при використанні каталізатора 1.II. У трубку Шленка при температурі 25°С поміщали розчин дієну S3 (100мг, 0,4ммоль) в СН2Сl2 (20мл) та додавали розчин каталізатора 1.II (2,6мг, 0,004ммоль, 1 мольний %) в СН2Сl2 (1мл). Приготовлену суміш перемішували впродовж ще 18год. при тій же температурі. Ступінь перетворення розраховували за даними ГХ (реакцію в аліквотах реакційної суміші відразу ж гасили додаванням розрахункової кількості 1Μ розчину етилвінілового ефіру й аналізували за допомогою ГХ). Отримані результати представлені на Фіг. у вигляді кривій 10 (♦). Вивчення швидкості циклізації оброблюваної речовини S3 (2-аліл-2-(2-метилаліл)діетилмалонат) повторювали з використанням каталізатора А. Експеримент проводили в ідентичних наведеним вище умовах, за винятком того, що кількість каталізатора А збільшували до 2,5 мольного %. Отримані результати представлені на Фіг.1 у вигляді кривій 2 (·). Приклад 9 Порівняння ефективності каталізаторів 1.II та С у реакції перехресного метатезису. Умова а) каталізатор 1.II (1 мольний %), КТ, 30хв, ви хід: 95%; б) каталізатор С (2,5 мольний %), КТ, 20хв., вихід: 91%. У розчин олефіну S4, що перемішують, (107мг, 0,5ммоль) та метилакрилату S2b (86мг, 1ммоль) у СН2Сl2 (10мл) додавали розчин каталізатора 1.II (3,4мг, 1 мольний %) у СН2Сl2 (2мл). Далі суміш, що утворилася перемішували при кімнатній температурі впродовж 30хв. Під зниженим тиском видаляли розчинник та залишок очищали з використанням хроматографії в колонці з силікагелем (циклогексан/ЕtOАс 8:2). Продукт Р4 одержували у формі суміші (E)- та (Z)-ізомерів у співвідношенні 95:5 (130мг, 95%-ий вихід) у вигляді безбарвного масла. Відповідно до даних у Angew.Chemie 2002, 114, 2509-2511, при проведенні аналогічної реакції каталізатор формули С забезпечує одержання продукту Р4 з виходом 91%. Приклад 10 Порівняння ефективності каталізаторів 1.II та А у реакції перехресного метатезису. Умова а) каталізатор 1.II (5 мольних %), КТ, 30хв), ви хід: 87%; б) каталізатор А (8 мольних %) КТ, 6год., вихід: 79%. У розчин діетилалілмалонату S5, що перемішують, (100мг, 0,5ммоль) та S5a (53мг, 1ммоль) у СН2Сl2 (5мл) додавали розчин каталізатора 1.II (16,8мг, 5 мольних %) у СН2Сl2 (5мл). Розчин, що утворився, перемішували при кімнатній температурі впродовж 30хв. Під зниженим тиском видаляли розчинник та залишок очищали з використанням хроматографії в колонці з силікагелем (циклогексан/ЕtOАс 8:2). Продукт Р5 одержували у формі суміші (Е)- та (Z)-ізомерів у співвідношенні 1:2 (98мг, 87%-ий вихід) у вигляді безбарвного масла. Відповідно до Synlett 2001, 430-431, при проведенні аналогічної реакції каталізатор А забезпечує одержання продукту Р5 з ви ходом 79%.
ДивитисяДодаткова інформація
Назва патенту англійськоюRuthenium complex and method for its synthesis, intermediate and method for synthesis thereof, method for metathesis and for ring-closing metathesis reactions
Назва патенту російськоюКомплекс рутения и способ его получения, промежуточное соединение и способ его получения, способ проведения реакций метатезиса и замыкания кольца
МПК / Мітки
МПК: C07C 205/00, C07F 15/00, C07C 201/00
Мітки: циклу, сполука, проведення, комплекс, проміжна, одержання, рутенієвий, спосіб, реакцій, замикання, метатезису
Код посилання
<a href="https://ua.patents.su/9-79018-ruteniehvijj-kompleks-ta-sposib-jjogo-oderzhannya-promizhna-spoluka-ta-sposib-oderzhannya-sposib-provedennya-reakcijj-metatezisu-ta-zamikannya-ciklu.html" target="_blank" rel="follow" title="База патентів України">Рутенієвий комплекс та спосіб його одержання, проміжна сполука та спосіб її одержання, спосіб проведення реакцій метатезису та замикання циклу</a>
Попередній патент: Комбінована установка деасфальтизації залишкових нафтових фракцій та генерації електроенергії
Наступний патент: Спосіб вилучення індію зі сплаву індій-олово та пристрій для його реалізації
Випадковий патент: Спосіб монтажу каркаса багатоповерхового будинку












