Спосіб отримання культури “бородатих” коренів рослин artemisia dracunculus l.
Номер патенту: 116312
Опубліковано: 10.05.2017
Автори: Дуплій Володимир Павлович, Дробот Катерина Олександрівна, Матвєєва Надія Анатоліївна, Шаховський Анатолій Михайлович
Формула / Реферат
Спосіб отримання культури "бородатих" коренів рослин Artemisia dracunculus L., який включає підготовку суспензії Agrobacterium rhizogenes; відокремлення листків від асептичних рослин; поранення листових експлантів; інокуляцію експлантів суспензією агробактерій; кокультивування експлантів із A. rhizogenes на базовому середовищі; елімінацію агробактерій та індукцію "бородатих" коренів на базовому середовищі, доповненому антибіотиками, який відрізняється тим, що суспензію агробактерій готують не використовуючи центрифугування та ресуспендування; експланти відокремлюють та пошкоджують їх поверхні одним інструментом - скальпелем; інокуляцію експлантів проводять суспензією A. rhizogenes зменшеного об'єму (30 мкл) безпосередньо із флакона для вирощування бактерій; листові експланти кокультивують із агробактерією, збільшений час (чотири доби) на середовищі, що містить вдвічі зменшену концентрацію макросолей; елімінацію агробактерій та індукцію "бородатих" коренів проводять на такому ж середовищі, доповненому лише одним антибіотиком - цефотаксимом у концентрації 500 мг/л.
Текст
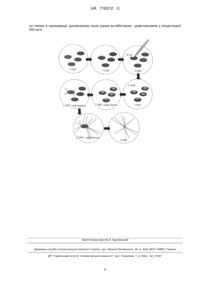
Реферат: Спосіб отримання культури "бородатих" коренів рослин Artemisia dracunculus L. включає підготовку суспензії Agrobacterium rhizogenes, відокремлення листків від асептичних рослин, поранення листових експлантів, інокуляцію експлантів суспензією агробактерій, кокультивування експлантів із A. rhizogenes на базовому середовищі, елімінацію агробактерій та індукцію "бородатих" коренів на базовому середовищі, доповненому антибіотиками. Суспензію агробактерій готують не використовуючи центрифугування та ресуспендування. Експланти відокремлюють та пошкоджують їх поверхні одним інструментом – скальпелем. Інокуляцію експлантів проводять суспензією A. rhizogenes, зменшеного об'єму (30 мкл) безпосередньо із флакона для вирощування бактерій. Листові експланти кокультивують із агробактерією, збільшений час (чотири доби) на середовищі, що містить вдвічі зменшену концентрацію макросолей. Елімінацію агробактерій та індукцію "бородатих" коренів проводять на такому ж середовищі, доповненому лише одним антибіотиком - цефотаксимом у концентрації 500 мг/л. UA 116312 U (12) UA 116312 U UA 116312 U 5 10 15 20 25 30 35 40 45 50 55 60 Корисна модель належить до біотехнології та генетичної інженерії, зокрема способу отримання культури "бородатих" коренів рослин естрагону (Artemisia dracunculus L.), яка призначена для використання у біотехнології рослин. "Бородатими" коренями називають корені, отримані внаслідок генетичної трансформації рослин за допомогою Agrobacterium rhizogenes, яка є ґрунтовою бактерією, що викликає захворювання широкого кола дводольних рослин. Причиною виникнення хвороби є перенесення, стабільна інтеграція в геном рослини-хазяїна та експресія частини ДНК (Т-ДНК) онкоплазміди pRi бактерії A. rhizogenes. Отримані після трансформування агробактеріями in vitro "бородаті" корені мають ряд специфічних рис: інтенсивний гормононезалежний ріст, відсутність позитивного геотропізму, високий ступінь галуження [1]. "Бородаті" корені накопичують вторинні метаболіти або запасні сполуки, властиві для того чи іншого виду рослин [2-4], причому вміст у них таких сполук може бути вищий за вміст в коренях нетрансформованих рослин. Культуру "бородатих" коренів вважають джерелом біологічно активних сполук. Генетична трансформація за допомогою A. rhizogenes є зручним способом зміни рослинного геному через те, що бактерія може переносити не тільки власну Т-ДНК онкоплазміди pRi, а ще й Т-ДНК бінарних векторів із селективними та цільовими генами [5]. Використовуючи A. rhizogenes та "бородаті" корені, отримують сполуки, що синтезуються рослинами у природних умовах, а також рекомбінантні сполуки фармакологічного призначення. Для таких генетично трансформованих коренів відзначають швидкі ріст і накопичення біомаси. Технологія їх культивування in vitro є маловитратною, адже трансформовані корені ростуть на середовищі без регуляторів росту, зі зменшеним вмістом макро- та мікроелементів, не вимагають освітлення та вирощуються у біореакторах [6]. Такі особливості привертають увагу до культури "бородатих" коренів як продуцентів ряду сполук, у тому числі таких, що мають лікувальні властивості. Artemisia dracunculus (естрагон) - багаторічна трав'яниста рослина родини Айстрових. Рослини містять каротин, алкалоїди, ефірну олію, флавоноїди, аскорбінову кислоту [7]. Ефірні олії естрагону виявляють протигрибкову активність [8]. Екстракти з естрагону мають протимікробну активність, зокрема проти Pseudomonas aeruginosa, Shigella spp, Listeria monocytogenes, Esherichia coli [9]. Такі екстракти застосовують для лікування ряду захворювань, оскільки вони мають антидіабетичні властивості та здатні зв'язувати вільні радикали [10-11]. Раніше для отримання культури "бородатих" коренів рослин роду Artemisia використовували такі види як А аnnua, A. vulgaris, A.absinthium [12-14]. Найбільш близьким до запропонованого є спосіб отримання культури "бородатих" коренів Artemisia аnnua L. шляхом генетичної трансформації, який включає центрифугування нарощеної бактеріальної культури A. rhizogenes протягом 10 хвилин при 7000 g, відбір супернатанту; додавання до осаду, який містить бактерії, 5 мл свіжого середовища того ж складу, що і для вирощування бактерій; ресуспендування бактерій; відрізання листових експлантів від асептично вирощених рослин; пошкодження поверхні експлантів стерильною металевою голкою; занурення експлантів у отриману на попередніх етапах бактеріальну суспензію; інкубацію в ній протягом 5 хвилин; перенесення експлантів на поверхню агаризованого живильного середовища MS [15]; культивування на ньому протягом 48 годин; елімінацію агробактерії та індукцію "бородатих" коренів на середовищі MS, доповненому 500 мг/л цефотаксиму та 500 мг/л ампіциліну [16]. Недоліком відомого способу є те, що він не перевірявся на придатність для отримання "бородатих" коренів Artemisia dracunculus L., за його використання збільшується робочий час, необхідний для отримання "бородатих" коренів, включаючи час на центрифугування, ресуспендування бактерій, відбирання супернатанту, цей спосіб потребує додаткового обладнання та інструментів (центрифугу, пробірки для центрифуги, голку), а також збільшує витрати реактивів за рахунок використання ампіциліну та середовища MS, що має повний склад макросолей. Задачею корисної моделі є вдосконалення способу отримання культури "бородатих" коренів рослин Artemisia dracunculus, який забезпечує зменшення кількості необхідних операцій і витрат реактивів (центрифугування бактеріальної суспензії, ресуспендування бактерій, відбирання супернатанту, використання ампіциліну, повного складу макросолей MS в середовищах), а також зменшення потреби в обладнанні та інструментах (центрифуга, пробірки для центрифуги, голка). Поставлена задача вирішується тим, що способом Agrobacterium rhizogenes опосередкованої трансформації здійснюється отримання культури "бородатих" коренів рослин Artemisia dracunculus L. що включає: відрізання від вирощених в асептичних умовах рослин 1 UA 116312 U 5 10 15 20 25 30 35 40 45 50 55 60 листових експлантів скальпелем, поранення їх тим же інструментом, інокуляцію експлантів суспензією A. rhizogenes (30 мкл), кокультивування експлантів із агробактерією чотири доби на агаризованому середовищі 1/2MS, що має половинний склад макросолей MS, елімінацію агробактерій та індукцію "бородатих" коренів на такому ж середовищі, але доповненому 500 мг/л цефотаксиму; згідно з запропонованою корисною моделлю, інокуляцію експлантів проводять суспензією Agrobacterium rhizogenes, зменшений об'єм (30 мкл) якої із флакона для вирощування наносять безпосередньо на експланти, поверхню яких пошкоджують скальпелем, не використовуючи центрифугування, ресуспендування, експланти кокультивують із агробактерією збільшений час (чотири доби), елімінацію агробактерій та індукцію "бородатих" коренів проводять без застосування ампіциліну, середовище для кокультивування експлантів із агробактерями та середовище для їх елімінації мають половинний вміст макросолей. Суть корисної моделі пояснюється прикладом та кресленням, на якому зображено схему генетичної трансформації та отримання культури "бородатих" коренів Artemisia dracunculus L. Приклад виконання способу Рослинний матеріал. Для уведення рослин A. dracunculus у стерильну культуру використовували метод поверхневої стерилізації насіння. Насіння стерилізували протягом 1 хв. у 70 % етанолі, 1-10 хвилин у розчині комерційного препарату "Білизна" (НПФ "Біолайт", Україна) та тричі промивали стерильною дистильованою водою (60 хв.). Після стерилізації насіння пророщували у чашках Петрі на агаризованому середовищі 1/2MS - середовище Мурасіге та Скуга (MS) [15] зі зменшеним удвічі вмістом макросолей. Отримані проростки культивували при 16-годинному світловому фотоперіоді та температурі 24 °C на тому самому середовищі. Рослини розмножували шляхом живцювання, культивуючи їх на агаризованому живильному середовищі 1/2MS. Agrobacterium rhizogenes - опосередкована трансформація. Для агробактеріальної трансформації використовували листки культивованих in vitro рослин A. dracunculus. Листки відрізали та робили на них надрізи скальпелем, наносили на кожний по 30 мкл бактеріальної суспензії, переносили на поверхню агаризованого середовища 1/2МС. Через 4 доби експланти переносили на середовище 1/2MS, до якого було додано 500 мг/л цефотаксиму для елімінації бактерій та індукції "бородатих" коренів. Бактеріальний штам. В роботі використовували дикий агропіновий штам A. rhizogenes A4. Аналіз за допомогою полімеразної ланцюгової реакції (ПЛР). Наявність rolВ гена агробактерій визначали за допомогою ПЛР. Геномну ДІЖ виділяли із асептичних коренів ЦТАБметодом. Сумарну ДНК із агробактерій, яку використовували як позитивний контроль в ПЛР, екстрагували за методикою [17]. ПЛР геномної ДНК проводили на ампліфікаторі Mastercycler personal 5332 (Eppendorf). Реакційна суміш складалася з однократного ПЛР-буфера із сульфатом амонію, 0,2 мкМ відповідних праймерів, 200 мкМ кожного з дезоксинуклеотидтрифосфатів, 0,5 од. Taq-полімерази, 10-50 нг ДНК-проби. Загальний об'єм реакційної суміші складав 20 мкл. При цьому використовували праймери, специфічні до 1 кодуючої частини гена rolB (5'-atggatcccaaattgctattccttccacga-3',5'-ttaggcttctttcttcaggtttactgcagc-3 , 780 п.н.). Умови ампліфікації: первинна денатурація - 94 °C, 3 хв., потім 30 циклів амліфікації (94 °C, 30 сек. - 62 °C, 30 сек. - 72 °C, 30 сек.), кінцевий синтез - 72 °C, 3 хв. Фрагменти ДНК, отримані в результаті полімеразної ланцюгової реакції, аналізували за допомогою електрофорезу в 1,5 %ному агарозному гелі в трис-ацетатній буферній системі. Результати. В результаті експериментів встановлено можливість ефективного застосування пропонованого способу для отримання культури "бородатих" коренів рослин A. dracunculus. Початок формування коренів на листових експлантах спостерігали вже через 7-10 діб після трансформації. Частота трансформації (кількість експлантів, на яких формувалися корені) становила 20 % при використанні дикого штаму А4. Відібрані лінії коренів за морфологією відповідали фенотипу "бородатих" коренів та росли на середовищі без додавання регуляторів росту (гормононезалежний ріст). Методом ПЛР підтверджено наявність у отриманих після трансформації коренях rolB гена A. rhizogenes. Таким чином, запропонований спосіб отримання культури бородатих" коренів рослин Artemisia dracunculus за допомогою Agrobacterium rhizogenes дає такі переваги: можливість отримання "бородатих" коренів виду A. dracunculus, зменшення кількості процедур, що веде до скорочення робочого часу, зменшення витрат реактивів, зменшення переліку необхідного обладнання та інструментів. Джерела інформації: 1. Giri A. Transgenic hairy roots: recent trends and applications / A. Giri, M. Narasu // Biotechnol. Adv. - 2000. - Vol. 18, № 1. - P. 1-22 2 UA 116312 U 5 10 15 20 25 30 35 40 45 2. Chashmi N.A. Differential production of tropane alkaloids in hairy roots and in vitro cultured two accessions of Atropa belladonna L. under nitrate treatments / N.A. Chashmi, M. Sharifi, F. Karimi, H. Rahnama // Z. Naturforsch. - 2010. - Vol. 65, № 5-6. - P. 373-379. 3. Bulgakov V.P. Engineering high yields of secondary metabolites in Rubia cell cultures through transformation with rol genes / V.P. Bulgakov, Y.N. Shkryl, G.N. Veremeichik // Meth. Моl. Biol. 2010. - Vol. 643, №1. - P. 229-242. 4. Wang C.T. Overexpression of G10H and ORCA3 in the hairy roots of Catharanthus roseus improves catharanthine production / C.T. Wang, H. Liu, X.S. Gao, H.X. Zhang // Plant Cell Rep. 2010. - Vol. 29, № 8. - P. 887-894 5. A simple and general method for transferring genes into plants / R.B. Horsch, J.E. Fry, N.L. Hoffmann [et al.] // Science. - 1985. - Vol. 227, № 4691. - P. 1229-1231 6. Huang Т.К., McDonald K.A. Bioreactor systems for in vitro production of foreign proteins using plant cell cultures / Т.К. Huang, K.A. McDonald // Biotechnol Adv. - 2012. - Vol. 30, № 2. - P. 3983409 7. Obolskiy D., Pischel I., Feistel В., Glotov N., Heinrich M. Artemisia dracunculus L. (Tarragon): A Critical Review of Its Traditional Use, Chemical Composition, Pharmacology, and Safety // J. Agric. Food Chem. - 2011. - Vol. 59, - P. 11367-11384 8. Meepagala К.M, Sturtz G., Wedge D.E. Antiflingal constituents of the essential oil fraction of Artemisia dracunculus L. Var. dracunculus. // J Agric Food Chem. - 2002. - Vol. 50, - P. 6989-6992 9. Benli M, Kaya L, Yigit N. Screening antimicrobial activity of various extracts of Artemisia dracunculus L. // Cell Biochem Funct. - 2007. - Vol. 25, - P. 681-686 10. Govorko D., Logendra S., Wang Y., Esposito D., Komarnytsky S., Ribnicky D., Poulev A., Wang Z., Cefalu W. Т., Raskin I. Polyphenolic compounds from Artemisia dracunculus L. inhibit PEPCK gene expression and gluconeogenesis in an H4IIE hepatoma cell line. // Am J Physiol Endocrinol Metab. - 2007. - Vol.293, - P.E1503-1510 11. Parejo I., Viladomat F., Bastida J., Rosas-Romero A., Flerlage N., Burillo J., Codina C. Comparison between the radical scavenging activity and antioxidant activity of six distilled and nondistilled mediterranean herbs and aromatic plants. // J Agric Food Chem. - 2002. - Vol. 50, - P. 6882-6890 12. Sujatha G., Zdravkovic-Korac S., Calic D., Flamini G., Ranjitha Kumari B.D. High-efficiency Agrobacterium rhizogenes-mediated genetic transformation in Artemisia vulgaris: Hairy root production and Essential oil analysis // Industrial Crops and Prod. - 2013. - 44, №1. - P. 643-652. 13. Giri A., Ravindra ST., Dhingra V., Narasu M.L. Influence of different strains of Agrobacterium rhizogenes on induction of hairy roots and artemisinin production in Artemisia annua // Curr. Sci. 2001. - 81, №4. - P.378-382. 14. Nin S., Bennici A., Roselli G., Mariotti D., Schiff S., Magherini R. Agrobacterium-mediated transformation of Artemisia absinthium L. (wormwood) and production of secondary metabolites // Plant Cell Reports. - 1997. - Vol. 16, - P. 725-730 15. Murashige Т., Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue cultures // Physiol. Plant. - 1962. - 15. - P. 473-497. 16. Ahlawa S., Saxena P., Ram M., Alam P., Nafis Т., Mohd A., Abdin M. Z. Influence of Agrobacterium rhizogenes on induction of hairy roots for enhanced production of artemisinin in Artemisia annua L. plants // African Journal of Biotechnology. - 2012. - Vol. 11. - P. 8684-8691. прототип 17. Армитидж Ф., Уолден Р., Дрейпер Дж. Выделение тотальных препаратов нуклеиновых кислот из A. tumefaciens В кн. Генная инженерия растений. М: Мир, 1991. - С. 76-78. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 50 55 60 Спосіб отримання культури "бородатих" коренів рослин Artemisia dracunculus L., який включає підготовку суспензії Agrobacterium rhizogenes; відокремлення листків від асептичних рослин; поранення листових експлантів; інокуляцію експлантів суспензією агробактерій; кокультивування експлантів із A. rhizogenes на базовому середовищі; елімінацію агробактерій та індукцію "бородатих" коренів на базовому середовищі, доповненому антибіотиками, який відрізняється тим, що суспензію агробактерій готують не використовуючи центрифугування та ресуспендування; експланти відокремлюють та пошкоджують їх поверхні одним інструментом скальпелем; інокуляцію експлантів проводять суспензією A. rhizogenes зменшеного об'єму (30 мкл) безпосередньо із флакона для вирощування бактерій; листові експланти кокультивують із агробактерією, збільшений час (чотири доби) на середовищі, що містить вдвічі зменшену концентрацію макросолей; елімінацію агробактерій та індукцію "бородатих" коренів проводять 3 UA 116312 U на такому ж середовищі, доповненому лише одним антибіотиком - цефотаксимом у концентрації 500 мг/л. Комп’ютерна верстка А. Крулевський Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 4
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C12N 1/20, C12N 15/00, C12N 5/10, C12R 1/01, C12N 1/00, A01H 4/00
Мітки: культури, dracunculus, бородатих, рослин, artemisia, коренів, отримання, спосіб
Код посилання
<a href="https://ua.patents.su/6-116312-sposib-otrimannya-kulturi-borodatikh-koreniv-roslin-artemisia-dracunculus-l.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання культури “бородатих” коренів рослин artemisia dracunculus l.</a>
Попередній патент: Залізничний переїзд
Наступний патент: Пристрій діагностування зносу частин ударно-спускового механізму вогнепальної зброї
Випадковий патент: Ділянка формування заготівок машини безперервного лиття