Спосіб одержання n-[2-(4-фторфеніл)-1-метил]-етилn-метил-n-пропініламіну у вигляді рецемату або lізомеру, або їх солей
Номер патенту: 3471
Опубліковано: 27.12.1994
Автори: Йожеф Кнолл, Карой Можоліч, Єва Шомфаі, Єва Сіньєї, Золтан Терек, Золтан Ечері
Формула / Реферат
Формула изобретения
Способ получения N-[2-(4-фторфенил)-1-метил]-этил-N-метил-N-пропиниламина формулы
в виде рацемата или L-изомера или их солей путем конденсации 2-фенил изопропилпроизводного общей формулы
где А - NHCH3, с соединением B-R, где В - галоид;
R - СН2С = СH или СН2СВr = СН2 в случае, если R - СН2СВr = СН2, полученный продукт подвергают дегидро-галлоидированию и целевой продукт выделяют в виде рацемата, L-изомера, в свободном виде или в солевой форме.
Текст
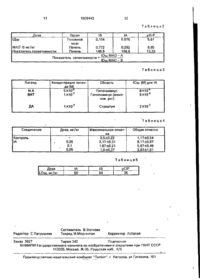
Изобретение касается замещенных аминов, в частности получения N-[2 ^-фторфенил)-! -метил]этил-Ы-метил-!\Ьп рог иниламина, обладающего антидепрессивным действием, что может быть использовано s медицине Цель - создание нового более активного вещества указанного класса Синтез ведут конденсацией соединений 4F-C6H4-CH2-CH(CH3)-NH СНз и B-R. где В = галоид, R = СНг-С = СН-. СН2~СВг = СНг В случае когда R = СН2СВг= СНг, полученный продукт подвергают дегидрогалоидированию и целевой продукт выделяют в виде рацемата L-изомера, свободном виде или в виде нужной соли Новые соединения менее токсичны, более активны и более селективны в части ингибирования субстрата МАО-В при испытании in vitro на гомогенате крысиного мозга и печени 5 табл Изобретение относится к способу получения новых соединений Ы-[2-(4-фторфенил)-1-метил]-этил-Ы-метил-Ы-пропиниламина в виде рацемата или L-изомера, или их солей Указанные соединения обладают антидепрессивным действием, являясь при этом ингибитором поглощения биогенных аминов и, в силу указанных свойств, могут найти применение в медицине. П р и м е р ! В 45 мл толуола растворяют 8,28 г (0,0495 моль) (±) 1М-метил-[2-(4-фторфенил)-1-метил]-этиламина К раствору добавляют 0,078 г бензилтриэтиламмоний хлорида, а затем по каплям при перемешивании в течение 5 мин параллельно добавляют 6,48 г (0 0545 моль) бромистого пропаргила и раствор 2,17 г (0,0543 моль) гидроокиси натрия в 7,5 мл воды Температуру реакционной смеси повышают от 23 до 26°С Реакционную смесь перемешивают при 26 - 28°С в течение 20 ч после чего смесь разделяют на две фазы толуольный слой высушивают над безводным сульфатом натрия и выпаривают Остаток перегоняют при 80 - 82°С (0 1 мм рт ст ) Получают 5,05г(±)-І\!-метил-М-пропинил-[2-(4-фторфе Цель изобретения - выявление в ряду N-фенилизопропилалкиламинов новых соединений, обладающих более высокой антиделрессантной активностью в сочетании с избирательным ингибирующим МАОВ эффект действием ON О 1609443 нил)-1-метил] этиламина, по 2 0 = 1,5050. Хлоргидрат плавится при 132 138°С (из этанола и эфира). Вычислено, %\ С 65,59; Н 7, П 9, N 5,79; С1 14,66; F7.85. Ci 3 Hi 7 NCiF. Найдено, %: С 65,00; Н 6,97; N 5,95; CI 14,90; F 3,01. 20 5 П р и м е р 2. В 35 мл ацетона растворя- 10 ют 3,38 г (0,022 моль) (±)-!Ч-метил-[2-(4.фторфенил)~1-метил}-этиламина, после чего добавляют 19 г (0,14 моль) карбоната калия, а затем по каплям при перемешивании ' в течение 10 мин прибавляют 2,95 г (0,025 15 моль) перегнанного бромистого пропаргила. Температура смеси повышается от 22 до 25°С. Реакционную смесь нагревают при 55°С в течение 3 ч 30 мин при перемешивании. Реакционную смесь оставляют на ночь, 20 фильтруют, промывают трижды, каждый раз с помощью 25 мл ацетона, и ацетоновый фильтрат выпаривают. Остаток перегоняют при 2 мм рт.ст. Таким образом получают 2,28 г (±УН-метил-М-пропинил-{2-(4-фтор- 25 фенил)-1-метил]-этиламина с выходом 51,7%, т.кип: 120 - 122°С (2 мм рт.ст.) n D 2 0 = 1.5050. при 169 - 171°С [] =-6,2° (этанол, с = р ( -2,4); [а]о 2 0 = -10,98° '«зода, с - 2,9). П р и м е р 5. Водный раствор 10 г (0,028 моль) дигидратя (-)-тэртрата (-)-Ы-метил-[2-(4-фторфенил)-1-метил]-этиламинз (т.пл. 88-91 °С) подщелачивают 40%-ным водним раствором гидроокиси натрия (рН 12 - 13). Раствор экстрагируют хлористым метиленом и хлористометиленовый экстракт высушивают над сульфатом натрия. К указанному хлористометиленовому раствору прибавляют 22,5 г (0,916 моль) карбоната калия, после чего по каплям добавляют 60%-ный раствор 5,96 г пропаргила бромистого в толуоле. Реакционную смесь перемешивают при комнатной температуре в течение 5 ч, фильтруют и фильтрат экстрагируют сначала четырежды 25 мл 20%-ной уксусной кислоты каждый раз, а после этого четырежды 25 мл 10%-ной соляной кислоты каждый раз. Экстракты водной соляной кислоты подщелачивают 40%-ным раствором гидроокиси натрия и экстрагируют хлористым метиленом. Хлористометиленовый раствор высушивают и в раствор вводят газообразный хлористый водород. При добавлении петролейного'эфира получают 2,38 г хлоргидрата (-)-М-метил-Ы-пропинил-[2-(4фторфенилИ-метил]-этиламина. Т.пл. 168 — 170°С[аЬ 5 0 = ; -10,89 о (вода,с = 2,5). Выход: 47,1%. П р и м е р 3. В 310 мл ацетона раство- 30 ряют 30,97> (0,197 моль).(±ИМ-метил-[2-(4: фторфенил)-1-метил]-этиламина, после чего добавляют 174, 5 г (1,26 моль) карбоната П р и м е р 6. Из 10 г (0,028 моль) дигидкалия, а затем по каплям при перемешиварата (-)-тартрата (-)-Ы-метил-[2-(4-фторфении в течение 20 мин прибавляют 68%-ный нил)-1-метил]~этиламина освобождают толуольный раствор бромистого пропарги- 35 основание по примеру 5, после чего хлорила (39,7 г, 0,227 моль). Температуру смеси стометиленовый раствор выпаривают. Осповышают от 26 до 40°С. Реакционную таток растворяют в 60 мл ацетона, " смесь перемешивают при 55°С в течение добавляют 22,5 г (0,16 моль) карбоната ка6 ч 30 мин, фильтруют, промывают ацето^ лия и по каплям прибавляют 60%-ный расном и ацетоновый фильтрат выпаривают. 40 твор 5,96 г бромистого пропаргила в Остаток перегоняют при 0,6 мм рт.ст. Таким толуоле. Реакционную смесь перемешивают образом, получают 16,25 г (±)-Г\1-метил-Г\|при комнатной температуре в течение 3 чч пропинил-[2-(4-фторфенил) -1-метил] -этилэфильтруют и выпаривают. Остаток раствомина с выходом 41,2% и т.кип. 90 -92°С. ряют в толуоле и экстрагируют 10%-ной со45 ляной кислотой. Водно-кислотный экстракт П р и м е р 4. В 60 мл ацетона растворяподщелачивают 40%-ным. раствором гидроют 7,4 г (0,0443 моль) (-)-|\1-метил-[2-(4-фтор0 окиси натрия до рН 12 - 13 и экстрагируют фенил)-1-метил]-зтиламина ( [ а ]о = >-3,44 толуолом. Толуольный раствор высушивают этанол), после чего прибавляют 28,9 г (0,21 и подкисляют 31 %-ным этанольным раствомоль) карбоната калия, а затем по каплям 50 ром хлористого водорода до рН 3. Выпадапри перемешивании добавляют 60%-ный ющий в осадок кристаллический продукт раствор 7,56 г (0,045 моль) бромистого профильтруют, промывают холодным ацетоном паргила в толуоле. Реакционную смесь пеи высушивают. Таким образом получают ремешивают при 35 - 40°С в течение 3 - 4ч, 2,05 г продукта, который идентичен с соедифильтруют, промывают ацетоном и ацето55 нением, полученным по примеру 5. Выход новый фильтрат выпаривают, Остаток пере40,6%. гоняют при 2 мм. рт.ст. Таким образом получают 3,3 г (-)-М-метил-№~пропинил-[2-(4ф70рфенилУ-1-метил}-этиламина ст.кип. 120 — 122°С, по = 1,5052. Хлоргидрат плавится П р и м е р 7. К 10 г (0,028 моль) основа'ния 43 дигидрата (-)-тартрата (-)-Ы-метил-{2(4-фторфенил)-1-метил]-этиламинэ 1609443 В 35 мл этанола растворяют 2,5 г укаприбавляют раствор 7,5 г гидроокиси назанного продукта, после чего добавляют трия в 25 мл воды и 17 мл толуола. Смесь 5 мл 50%-ного раствора гидроокиси калия. перемешивают в течение 30 мин. Фазы разРеакционную смесь кипятят с обратным ходеляют и водный слой экстрагируют трижды 5 лодильником в течение 16 ч и выпаривают. толуолом, каждый раз по 6 мл. Остаток обрабатывают водой и экстрагируют бензолом. После высушивания бенПолученный таким образом толуольный зольный раствор подкисляют этанольным раствор прибавляют к раствору 1,37 г гидраствором хлористого водорода. Выпадаюроокиси натрия, 0,04 г бензилтриэтиламмоний хлорида и 5 мл воды. К смеси по каплям 10 щий в осадок продукт реакции фильтруют и добавляют 4,1 г бромистого пропаргила и высушивают. Таким образом получают 2,2 г реакционную смесь перемешивают при хлоргидратэ (±)-Ы-мет'ил-М-пропинил-[2-(4комнатной температуре в течение 15 ч. Фафторфенил)-1-метил]-этиламина, т.пл. 131 зы разделяют, толуольный слой экстрагиру133°С. ют дважды, каждый раз по 7 мл 5%-ной 15 П р и м е р Ю . 1.53 г (0,00916 моль) уксусной кислоты и дважды, каждый раз по (±)-|\]-метил-[2-(4-фторфенил}-1 -метил]- эти10 мл 10%-ной соляной кислоты. Водно-кисламина и 1,46 г (0,00973 моль) D-винной кислотный экстракт подщелачивают добавлелоты растворяют в 15 мл этанола. нием 40%-ного раствора гидроокиси натрия Полученную смесь охлаждают до -10°С и и после этого экстрагируют толуолом. После 20 кристаллируют в течение 6 - 8 ч. Кристалливысушивания толуольный раствор подкисческий продукт фильтруют и промывают холяют до рН 3 31% ным этанольным растволодным этанолом В результате получают ром хлористого водорода. Кристаллический 1,15 г соли, т.пл 88-94°С. продукт фильтруют, промывают холодным Полученную соль (0,5 г) суспендируют в ацетоном и высушивают. Таким образом по25 3,2 мл воды и добавляют 1,3 мл 10%-ного лучают 2,72 г продукта, который идентичен с раствора гидрооксида натрия после чего соединением, полученным по примеру 5. полученную смесь экстрагируют эфиром. П р и м е р 8. Из 10 г (0,028 моль) Объединенную органическую фазу сушат дигидрата (-)-тартрата (-)-!Ч-метил-[2-(4над сульфатом натрия и упаривают. В рефторфенил)-1-метил]-этиламина освобож- 30 зультате получают (-)-Ы-метил-Ы-Т2-(4-фтордают свободное основание. К высушенному фенил)-1-метил]-этиламин, [a ]D = -0,632° толуольному раствору прибавляют 24,7 г (этанол). (0,17 моль) карбоната калия, после чего по П р и м е р 11. Повторяют методику каплям добавляют 60%-ный раствор 8,66 г примера 5, используя в качестве исходного (0,08 моль) бромистого пропаргила в толуо- 35 0,05 моль (-)-!М-метил-[2-(4-зминофенил)-1ле. Реакционную смесь перемешивают при метил]-этил амина. комнатной температуре и фильтруют. ТолуВ качестве основного вещества получаольный фильтрат экстрагируют дважды кажют 5,2 г (-)-М-метил-[2-(4-фторфенил)-1-медый раз по 7 мл 5%-ной уксусной кислоты и тил]-этиламина.Т кип. 88~90°С 10 мм Нд.ст дважды каждый раз по 1Q мл 10%-ной соля- 40 [ afc = -3,48 (этанол), который реагировал ной кислоты. Водно-кислотный экстракт обс бромистым пропаргилом, причем обработрабатывают согласно примеру 7. Таким ку проводят согласно методике примера 9. образом получают 2,6 г продукта, который В результате получают 3,1 г (-)-М-метил-Г\Іидентичен с соединением, полученным сопропинил-[2- (4-фторфенил)-1-метил]-этилагласно примеру 5. 45 мина. Т кип. 120 - 122°С (2 мм Нд.ст [п]о 2 0 = П р и м е р 9. К раствору 6,0 г (0,036 моль) = 1,5052. Гидрохлорид имеет температуру (±)-Ы-метил-[2-(4-фторфенил)-1-метил]- этиплавления 169 - 171 °С, [ a]D 2 0 = -6,2° (эталамина и 60 мл ацетона добавляют 33,6 г нол, с = 2,4), [ a]D 2 0 - -10,98° (вода, с= 2,9). (0,24 моль) карбоната калия, после чего по Синтезированные в результате предлакаплям при 25 - 30°С и перемешивании 50 гаемого способа соединения испытывают прибавляют7,45 г(0,037моль)2,3-дибромпна фармакологическую активность. ропена в течение 20 - 25 мин Реакционную смесь кипятят с обратным холодильником в Используются следующие обозначения: течение 6 ч, фильтруют и упаривают Оста1А = х/юргидрат {±)-ГЧ-метил-М-{2-пропинил}ток перегоняется под вакуумом при 4 - 5 мм 55 2-(4-фторфенил)-1-метил]-этиламина; рт.ст. Таким образом получается 6 52 (±)-NЇВ = хлоргидрат(-)-М-метил-1М-[(2-пропиметил-1\1-(2-бром-оопенил-3)-[2-(4 фторфенил)-2-(4-фторфенил)-1-метил]-этиламина; нил)-1-метил]-эп. амина с выходом 63,3% pCIP = хлоргидрат (±)-1М-метил-1М-[(2-проТ.кип. 142-143°С, п о 2 0 = 1.5234. пинил)-2-(4-хлорфенил)-1-метил]-этиламина; 1609443 8 pBrP = хлоргидрат (±)-Ы-метил-Ы-[(2са, ммоль-литр: NaCl 111, КС! 4,7, СаСІг 2,52. пропинил) -2~(4-брОмфенил) -1 -метил]-этилаMgSO4 1,64, №НСОз25, КН2РО4 1.2. глюкомина за 11. Кровеносный сосуд очищен от соединительной ткани и спираль шириной 1,5 мм 1. Моноамин-оксидазу (МАО) ингибиторная активность. 5 вырезалась из ткани. Полученный таким об1-.1 Ин витро испытания, разом сегмент кровеносного сосуда помещен в 5 мл баню с органом, содержащей 1.1.1. Измеренные в гомогенизате голораствор Кребса, через который пропускают вного мозга и печени крыс, освобожденном газовую смесь, состоящую из 95% Ог - 5% от клеточного ядра. И Субстраты: МАО-В: С-РЕА; 0,2 мМ; 10 СОг, и который термостатировался при специфическая активность 0,5/ІСІ/МЛ; МАО37°С. Механическая активность зарегистрирована на полуизометрическом компенсогА: С-5НТ: 5,0 мМ: специфическая активрафе, используя 1 г заранее установленного ность 0,25/г Сі/мл. груза. Вывод: 1А является более активным и более селективным ингибитором МАО типа 15 Поглощение тирамина ингибировэно на В, чем рСІР и п-ВгР при испытании In vitro указанном препарате соединением 1В в зана гомогенате крысиного мозга и печени. висимости от дозы 1СБО = 4.5x10"5 М. При этом соединения рСІР и рВгР не проявляют 1.1.2, Измеренные на митохондрии гоингибирующего действия. ловного мозга крысы, 20 Вывод. 1А ингибирует поглощение тиМетод, Из головного мозга крыс-самцов рамина в терминалы норадренергического вида СРУ весом 200 - 250 г митохондрии нерва в палочке легочной артерии кролика, получены следующим образом: после обезтогда как рСІР и рВгР не оказывают этого главливания гомогенизат ткани получен в действия. 0,25 М сахарозе. Он центрифугирован в течение 15 мин при 9000 об. и осадок был 25 Результаты ингибирования поглощения внесен в 0,25 М сахарозу. биогенных аминов приведены в-табл.3, NA: Н-норадренэлин; 5НТ: Н-5-окситСубстраты: МАО-А: 6x10"" М 5НТ; МАОриптамин; ДА: Н-допамин. В:2х10' 5 МРЕА. Вывод. 1А является активным ингибитоРезультаты: значения ІС50(М) соедине30 ром поглощения биогенных аминов. Опрения 1А: МАО-А: 5х10~5; МАО-В: 3x10~3. деление МАО-В активности In vivo у кошки Вывод: 1А проявляет'себя как очень акпутем измерения эффекта внутривенно вветивный и селективный ингибитор МАО типа денного фенилэтиламина (ФЭН). В при испытании in vitro на митохондриях Метод. крысиного мозга. ФЭА выделяет норадреналин из терми1.2. Ин виво испытания, оцененные в 35 налов нервов мигающей мембраны в колигомогенизате головного мозга и печени честве, зависящем от дозы. Поскольку ФЭА крыс, освобожденном от клеточного ядра. является специфическим субстратом для Метод: крысы обработаны подкожно МАО-В в печени, селективные ингибиторы различными дозами веществ и спустя 4 ч 40 этого фермента усиливают действия ФЭА, после введения вещества органы извлечены как показывает сдвиг влево кривой ответа и МАО-активность определена так, как это на дозу после введения МАО-В ингибитора. раскрыто в 1.1.1. Результаты приведены в табл.2. . Результаты. 1Ав дозе 0,1 или 0,25 мг/кг После обработки, которая длилась в течение 21 дней (каждодневная доза 0,25 45 значительно усиливает эффект ФЭА в этом мг/кг, подкожно, соединения 1А) МАО-В инопыте и сдвигает влево кривые ответа на гибирование составляло 92 - 94%, выражендозу. ное в процентах от контроля, а МАО-А Вывод. 1А является очень активным сеингибирование 0%. лективным ингибитором МАО-В ин виво у Вывод. 1Аи 1В являются селективными 50 кошки. МАО-В ингибиторами, ин виво они проявляПовышение дозы ФЭА индуцирующего ют большую активность, чем р ВгР. стереотипное поведение. Ингибиторная активность поглощения Результаты приведены в табл.4. . тирамина на легочных артериях кроликов. Активность, вызываемая ФЭА при дозе Для опытов использованы кролики обоих 55 40 мг/кг, усиливается соединением 1А при полов и весом 2 - 4 кг. Кролики были умердозах 0,5 - 0.25 мг/кг подкожно в зависимощвлены ударом в шею и сердце немедленно сти от дозы. изъято и помещено в продуваемый кислороИспытания центральной нервной систедом раствор Кребса. Состав раствора Кребмы. Испытание модифицированного вздра 1^09443 10 гиаания. Соединение 1А не ингибирует ре В табл.5 указаны значения /IDso для исфлекса уклонений у крыс при дозе 15 мг/кг пытанных соединений. Метаболическая норма. Соединение 1А Из табп,5 видно, что соединения, попри дозе 5 мг/кг не повышает метаболизма лученные в условиях описываемого спосо(обмена веществ) у крыс. ба,менее токсичны чем pCIP. Испытание активности на потребление Благодаря высокому специфическому пищи. спектру фармакологической активности соединения могут быть использованы в каИспытания проведены после 96 ч голочестве антидепрессанта путем противодейдания крыс (п = 10 — 13). Когда соединение 1А вводится подкож- 10 ствия связанному с возрастом ослаблению функции чернополосатого донаминэргичено при дозе 5 мг/кг, то главным образом, ского нейрона, улучшить "качество жизни" одночасовое потребление пищи значительстарых людей. но понижено, а когда были использованы более высокие дозы (10 - 15 мг/кг, подкожно), пятичасовое потребление пищи было 15 Формула изобретения значительно понижено. Действие на каталепсию. Способ получения №-[2-(4-фторфенил)-1Кататонил, индуцируемая тетрабеназиметил]-этил-Ы-метил-Ы-пропиниламина ном при дозе 3 мг/кг, ингибируется в завиформулы симости от дозы обоих соединений 1А и 1В 20 ED50-1A-2.6мг/кг; ED50-1В = 2,9 мг/кг. Испытание сексуальной активности крыс-самцов. На инертных крыс-самцов соединение 1А оказывает сильное, длительно продолжающее с т іулирующее действие. Возбуждающая похоть активность от одной единичной дозы (0,1 и 0,25 мг/кг соответственно) значительно увеличивает количество эякуляций (внезапных извержений семенной жидкости) з а 2 4 ч и 2 - 3 и 4 недель, соответственно, после введения соединения 1А, относительно контроля. Токсичность. Испытания проведены на самцах и самках крыс-альбиносов вида СГУ весом 100- 120 г. Соединения введены внутривенно и животные были под наблюдением в течение 48 ч. 25 а виде рацемата или L-изомера или их солей путем конденсации 2-фенил изопропилпроизводного общей формулу СН7-СН-А СН 30 где А - ННСНз, с соединением B-R, где В - галоид; 35 R - СН2С = СН или СН2СВг = СНг в случае, если R - СНгСВг = СНг, полученный продукт подвергают дегидрогаллоидировению и целевой продукт выделяют в виде рацемата, L-изомера, в 40 свободном виде или в солевой форме. 1э б л и ц а 1 Доза Орган Головной мозг iCso Печень МАО-В (М) Показатель Печень селективности IB 4 .57X10'8 1.19X10 8 238,38 _| IA pCIP рВгР 4,17X1 О*8 1.19X10 г 580,67 1.48Х10 7 1Х10"7 43,47 3 .98Х1О"7 1,64X10 7 51,28 КО 1С50 М^ - А Показатель селективности = -.-^ 'СБО МЛ О - В 11 1609443 12 Таблица2 Доза ІД50 МАО'-В мг/кг Показатель селективности Орган Головной мозг Печень Печень Показатель селектив IB рВгР 5,61 [А 0,104 0,076 0,772 0,292 148,8 168,6 ID50MA0-A IDsn МАО - В 8,85 13,33 ТаблицаЗ Лиганд NA 5НТ Концентрация лиганда (М) 5X10 1X10 •7 ДА 1X10 -7 Область (М)для ІА ІСБО Гипоталамус Гиппокампус (аммонов рог) 8X10 6X10 2X10 -7 Стриатум Таблица4 Контроль Доза, мг/кг Максимальная отмет Соединение 0,5±0,22 2,17±0,31 1,67±0,21 1,0±0,37 ка 0,25 IA Общая отметка 0,1 0,05 1,17+0,54 8,17 ±0,87 5,67±0,49 2,83±1,01 Таблицйб Доза LD50, мг/кг Редактор С Патрушева IA 60 IB 64 Составитель В.Волкова Техред М.Моргентал pCIP 35 Корректор Л.Патай Заказ 3627 Тираж 342 Подписное ВНИИПИ Государственного комитета по изобретениям и открытиям при ГКНТ СССР 113035, Москва, Ж-35, Раущская наб., 4/5 Производственно-издательский комбинат "Патент", г Ужгород, ул Гагарина, 101
ДивитисяДодаткова інформація
Автори англійськоюEcsery Zoltan, KNOLL JOZSEF, SOMFAI EVA, Szinnyei Eva, Mozsolics Karoly
Автори російськоюЗолтан Эчери, Йожеф Кнолл, Ева Шомфаи, Ева Синьеи, Карой Можолич
МПК / Мітки
Мітки: одержання, вигляді, солей, n-[2-(4-фторфеніл)-1-метил]-етилn-метил-n-пропініламіну, спосіб, lізомеру, рецемату
Код посилання
<a href="https://ua.patents.su/6-3471-sposib-oderzhannya-n-2-4-ftorfenil-1-metil-etiln-metil-n-propinilaminu-u-viglyadi-recematu-abo-lizomeru-abo-kh-solejj.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання n-[2-(4-фторфеніл)-1-метил]-етилn-метил-n-пропініламіну у вигляді рецемату або lізомеру, або їх солей</a>
Попередній патент: Спосіб загальної культивації кукурудзи і сорго для виробництва силосу
Наступний патент: Спосіб отримання 3-вінілцефалоспоринів чи їх фармацевтично припустимих солей
Випадковий патент: Стабілізатор напруги