Спосіб оцінки захисного рівня протитуляремійного клітинного імунітету
Формула / Реферат
Спосіб оцінки захисного рівня протитуляремійного клітинного імунітету, що включає виділення клітин периферійної крові людини, їх співкультивування з антигеном та оцінку результатів, який відрізняється тим, що використовують пул лейкоцитів і тромбоцитів периферійної крові, щеплених живою туляремійною вакциною, та співкультивують з живими бактеріями вакцинного штаму протягом 1-24 годин, препарати фіксують і фарбують через 1-3, 7 і 24 годин, досліджують структурно-функціональні зміни і кооперативні взаємодії різних типів клітин імунної системи та природної резистентності та встановлюють наявність захисного рівня клітинного імунітету за ступенем антигенспецифічної бласттрансформації та відсутності репродукції вакцинного штаму, а величину алергічного компоненту - за ступенем цитодеструктивних змін клітин і характером їх кооперативних взаємодій.
Текст
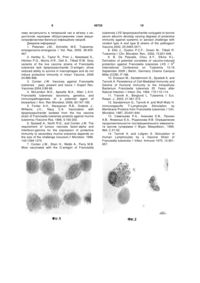
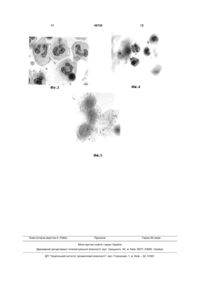
Спосіб оцінки захисного рівня протитуляремійного клітинного імунітету, що включає виділення клітин периферійної крові людини, їх співкультивування з антигеном та оцінку результатів, який відрізняється тим, що використовують пул лейкоцитів і тромбоцитів периферійної крові, щепле 3 його захисний рівень, недостатньо досліджені механізми імунопатогенезу туляремії та протективного (захисного) імунітету, що ускладнює не тільки створення нових вакцин, але і науковообгрунтоване використання уже існуючих ЖТВ [3, 4]. Переважну більшість робіт виконано на моделі перебігу туляремії у мишей in vivo та in vitro[5, 6, 7, 8, 9]. До основних недоліків цієї моделі відносяться: - використання штаму LVS (live vaccine strain), вірулентного для мишей, але атенуйованого для людини; - відсутність у мишей субпопуляції V 9 V 2T лімфоцитів, що секретують спектр цитокінів, важливих для здійснення антимікробної функції; - короткочасність тривалості життя мишей. Протитуляремійний імунітет у людини менше досліджений. Показано, що після перенесеної інфекції формується тривалий клітинний імунітет, асоційований з Т-лімфоцитами, а у вакцинованих ЖТВ тривало зберігаються антигенспецифічні Тлімфоцити [10, 11]. Роль та значення інших типів клітин імунної системи та природної резистентності в імунопатогенезі туляремії та імунітеті вивчені недостатньо [4]. Практично не досліджені стан специфічного клітинного імунітету та можливість посилення його алергічного компоненту у ревакцинованих ЖТВ людей. Більшість методів оцінки специфічного клітинного імунітету у хворих на туляремію та вакцинованих ЖТВ базується на визначенні ступеня бласттрансформації лімфоцитів в присутності різних антигенів - мембранних білків та ліпополісахаридів (ЛПС) туляремійних мікробів [10, 12, 13]. Недоліки вище наведених аналогів є такі: - використання однієї популяції клітин - лімфоцитів периферійної крові (ПК) поза їх природним мікрооточенням іншими фермовими елементами крові; - застосування антигенів, а не живих туляремійних бактерій, як це має місце при природному зараженні; - неможливість оцінити міжклітинні взаємодії та спектр клітин, що приймають участь в імунній відповіді, величину алергічного компоненту. Відомий спосіб визначення антигеиспецифічної бласттрансформації лімфоцитів вакцинованих LVS [14], який є найбільш близьким аналогом (прототипом) по суті технічного рішення. Спосіб здійснювали наступним чином. Пул лімфоцитів виділяли з ПК осадженням желатиною, промивали та ресуспендували в культуральному середовищі з 15% сироватки людини. Лімфоцити інкубували з убитими бактеріями вакцинного штаму протягом 6 днів при 37°С Потім клітини мітили протягом 6 годин (14С) тимідином та визначали величину включення, або після шестиденного співкультивування наносили на предметні скельця, фарбували за Гімза і підраховували число бластів. Було встановлено, що лімфоцити вакцинованих ЖТВ людей відповідають підвищеним синтезом ДНК, інтенсивність якого варіювала у різних індивідуумів, а також збільшенням числа лімфобластів при оптимальній дозі антигену. 49725 4 До недоліків прототипу можна віднести: - використання радіоактивних елементів; - тривалість дослідження (6 днів); - культивування лімфоцитів у відсутності інших типів клітин ПК; - неможливість визначення просторової локалізації і кооперативних взаємодій різних типів клітин ПК в імунній відповіді, величини алергічного компоненту, а також захисного рівня специфічного імунітету. В основу запропонованого способу поставлена задача удосконалити методологію оцінки захисного рівня клітинного імунітету у щеплених ЖТВ людей шляхом моделювання імунної відповіді на туляремійні бактерії в клітинній тест-системі, що надасть можливість оптимізувати схему вакцинопрофілактики туляремії (строки та кратність ревакцинацій). Поставлена задача вирішується тим, що використовують пул лейкоцитів і тромбоцитів ПК щеплених ЖТВ та сокультивують з живими бактеріями вакцинного штаму протягом 1-24 годин, препарати фіксують та фарбують через 1-3, 7 та 24 години, досліджують структурно-функціональні зміни і кооперативні взаємодії різних типів клітин імунної системи та природної резистентності та встановлюють захисний рівень клітинного імунітету за ступенем антигеиспецифічної бласттрансформації та відсутності репродукції вакцинного штаму, а величину алергічного компоненту за ступенем цитодеструктивних змін клітин та характером їх кооперативних взаємодій. При конструюванні моделі і виборі інформативних показників оцінки протитуляремійного імунітету були прийняті до уваги сучасні дані щодо функцій лейкоцитів та тромбоцитів ПК, їх участі в розпізнаванні і презентації антигену, секреції та сприйнятті медіаторів запалення та імунної відповіді, спектру і біологічних ефектів секретуючих ними продуктів. Для виконання запропонованого способу була обрана заражаюча доза туляремійних бактерій 50 мікробних тіл/клітину, яка спричиняла характерні зміни моноцитів-макрофагів ПК нещеплених донорів протягом 24 годин співкультивування. Оскільки в запропонованій тест-системі одночасно присутні моноцити-макрофаги, в яких здійснюється репродукція туляремійних бактерій, Т- і Влімфоцити, гранулоцити, тромбоцити, які беруть участь в імунопатогенезі туляремії та імунітеті, можливо оцінювати не тільки участь окремих типів клітин і їх кооперативні взаємовідносини в динаміці розвитку імунної відповіді, але і захисний рівень специфічного імунітету, величину пошкоджуючого ефекту (алергічний компонент) вакцинного препарату при його повторних введеннях. Заявлений спосіб виконується наступним чином: 1. Виділяють за допомогою 3,3% желатини пул лейкоцитів і тромбоцитів з гепаринізованої крові; 2. Обробляють 0,17 молярним розчином NH4CI, двічі промивають забуференим фізіологічним розчином; 3. Вносять 3-5х105 клітин в 0,05мл фізіологічному розчині на поверхню покривного скельця всередині пеніцилінового флакону; 5 49725 4. Інкубують при 37°С 30 хвилин; 5. Вносять на моношар клітин 0,1мл суспензії туляремійних мікробів в дозі 50 мікробних тіл/клітину та продовжують інкубувати протягом 1 години при 37°С; 6. Вносять по 1,5мл середовища 199 з 10% телячої ембріональної сироватки (ТЕС) в тому числі в контрольні культури (без антигену) та співкультивують клітини і мікроби 1 годину; 7. Видаляють неприкріплені мікроби двократним промиванням в середовищі 199; 8. Додають 1,5мл середовища 199 з 10% телячої ембріональної сироватки (ТЕС) та інкубують при 37°С протягом 1-24 годин; 9. Препарати фіксують через 1-3, 7 та 24 години інкубації розчином Буена або холодним метиловим спиртом та фарбують відповідно гематоксилін-еозином, за Романовським-Гімза чи протитуляремійними флуоресцуючими імуноглобулінами; 10. Препарати досліджують в світловому та люмінісцентному мікроскопах і визначають морфофункціональні зміни клітин периферичної крові людини (ПКЛ) на різних строках розвитку імунної відповіді. Туляремійні мікроби виявляють фарбуванням за Романовським-Гімза, їх специфічність встановлюють після фарбування протитуляремійною люмінісцуючою сироваткою, а характер цитодеструктивних змін визначають на препаратах, фарбованих гематоксилін-еозином (г/е) та за Романовським-Гімза. Встановлюють: 1) ступінь спонтанної та антигеиспецифічної бласттрансформації лімфоцитів, 2) хемотаксичну активність нейтрофілів, еозинофілів, моноцитів-макрофагів, 3) кооперативні взаємодії різних типів клітин і тромбоцитів та їх цитодеструктивні зміни (колоїдальний осмотичний набряк, 6 апоптоз, цитоліз), 4) наявність ознак репродукції туляремійних бактерій - характерні зміни структури моноцитів-макрофагів і нейтрофілів. Об'єктивність оцінки значимості обраних показників грунтується на можливості достовірної ідентифікації на препараті кожного типу клітин та тромбоцитів, виявленні чітко диференційованих морфологічних ознак порушення клітинної структури та кооперації клітин, і встановленні ознак репродукції туляремійних мікробів. Приклади конкретного виконання способу наведені в таблиці 1 та проілюстровані рисунками 15. В запропонованому способі були ідентифіковані найбільш значимі морфологічні ознаки реакції клітин імунної системи і природної резистентності, що характеризують: а) сумарну дію численних біологічно активних речовин, які синтезуються в процесі розвитку імунної відповіді, б) наявність ознак репродукції туляремійних бактерій. Аналіз спонтанної (контрольні препарати) і антигенспецифічної бластної реакції лімфоцитів щеплених ЖТВ людей виявив три чітко морфологічно диференційованих ступенів трансформуючого ефекту туляремійних бактерій. Перший ступінь характеризується наявністю на препараті ізольованих бластних форм, другий - груп із 2-3 зв'язаних між собою лімфобластів, третій - кластерів і/або ланцюжків із 4-5 і більше асоційованих бластних форм (Фіг.1). При вираженій специфічній сенсибілізації, як правило, у ревакцинованих ЖТВ людей спостерігаються структурні пошкодження частини бластних форм: крупносітчата структура хроматину різко збільшеного деформованого ядра, витікання вмісту ядра в направлені клітиниефектора в результаті хроматоліза та порушення цілісності цитоплазматичних і ядерних мембран. Таблиця 1 Приклади конкретного виконання способу Ознаки (критерії) оцінки захисного рівня клітинного імунітету антигенспецифічна бласттрансформація деструкція лімфобластів структурні зміни еозинофілів структурні зміни нейтрофілів ознаки репродукції туляремійних бактерій Наявність захисного рівня Строки після вакцинації Ж1Б Приклад 1 Приклад 2 До 5 років 10 років 3+ 1+ (24 години) (7 годин) 2+ (24 години) так ні Строки після ревакцинації ЖТВ Приклад 3 Приклад 4 до 2 років 8 років 3+ 1+ (24 години) (7 годин) 2+ 1+ (24 години) (24 години) 3+ 1+ (1-3 години) (7 годин) 3+ 1+ (1-3 години) (24 години) 2+ (24 години) так ні Примітки: 1+, 3+ - ступінь вираженності ознаки (критерія). Оцінка інтенсивності бласттрансформуючої активності лімфоцитів ПК щеплених ЖТВ людей за вказаними трьома ступенями виявила високу інформативність, простоту і достовірність такого способу обліку. Показано: 1) у нещеплених спо стерігають лише 1 ступінь бласттрансформації; 2) у вакцинованих ЖТВ виявляють 1 ступінь спонтанної та 2-3 ступені антигенспецифічної бластної реакції лімфоцитів та низький рівень пошкодження лімфобластів; 3) у ревакцинованих різко збільшу 7 ється число та важкість пошкодження лімфобластів уже в перші 7 годин співкультивування з туляремійними бактеріями при наявності 2-3 ступеню бласттрансформації. Грубі зміни лімфобластів у ревакцинованих (цитоскелети, витікання вмісту ядра із клітин) вказують на посилення після ревакцинації алергічного компоненту. Зниження інтенсивності трансформуючого ефекту виявляють при наявності ознак репродукції туляремійних бактерій в клітинній тестсистемі (через 10 років після вакцинації ЖТВ і 8 років після ревакцинації). Більш раннє в порівнянні з прототипом (6 днів) проявлення протягом 24 годин трансформуючого ефекту туляремійних бактерій в розробленій тестсистемі вказує на важливу роль в активації лімфоцитів біологічно активних речовин, які продукують і секретують клітини природної резистентності та тромбоцити. Реакції еозинофілів на специфічний антиген оцінюють по наступних демонстративних формах їх цитоморфологічних змін: 1) формуванню мікровиростів в напрямку клітини-ефектора - джерела хемоатрактантів (нейтрофіл, тромбоцит, лімфобласт); 2) змін рухливості, розміщення і розмірів гранул, їх фарбування; 3) структурним змінам ядер (злиття сегментів, створення одного великого округлого ядра з примембранною агрегацією хроматину і слабким сприйняттям до гематоксиліну, витікання вмісту ядер, пікноз, екзоцитоз); 4) утворенню фрагментів еозинофілів; 5) асоціації з різними типами клітин і тромбоцитами. Ступінь специфічної сенсибілізації (величина алергічного компоненту) встановлюють по вираженності вказаних вище цитоморфологічних змін. Слабкий ступінь характеризується низькою хемотаксичною активністю (розміри мікровиростів не перевищують розміри клітин) і відсутністю значних змін ядерної структури. Помірний ступінь характеризується високою хемотаксичною активністю (розміри мікровиростів перевищують розміри клітин), орієнтованою концентрацією гранул уздовж цитоплазматичної мембрани, виходом частини гранул з клітини і їх асоціації з клітинами-ефекторами, порушення цілісності плазматичної мембрани на ділянці контакту з нейтрофілом та/або тромбоцитами, змінюванням структури ядер (злиття сегментів, примембранна агрегація хроматину). Високий ступінь специфічної сенсибілізації характеризується глибокими цитодеструктивними змінами клітини (швидка часткова або повна дегрануляція і десекреція гранул, збільшення розмірів ядер і втрата ними здатності сприймати фарбування гематоксиліном, витікання вмісту ядра за межі клітини, пікноз ядер та їх екзоцитоз) (Фіг.2). Інтенсивність та строки розвитку описаних змін залежали від кратності щеплень (вакцинація, ревакцинація) і строків минулих після імунізації (табл.1). У вакцинованих ЖТВ людей находять (головним чином) ознаки слабого ступеню специфічної сенсибілізації і лише в ранні строки після щеплень (1-2 роки) виявляється помірний ступінь. Високий ступінь специфічної сенсибілізації виявляється 49725 8 тільки у ревакцинованих ЖТВ уже через 1-1,5 годин після співкультивування клітин і туляремійних бактерій. По мірі збільшення строку після ревакцинації (8 років) ступінь специфічної сенсибілізації знижується і кваліфікується як слабкий або помірний. Диференціація реакції еозинофілів за ступенем специфічної сенсибілізації дозволяє оцінювати величину специфічного алергічного компоненту у щеплених і використовувати еозинофіли в якості клітин-індикаторів специфічної сенсибілізації. Другим важливим критерієм оцінки специфічної сенсибілізації у щеплених є наступні реакції нейтрофілів: активація хемотаксичної активності, колоїдальний осмотичний набряк та апоптоз. У вакцинованих ЖТВ в перші години співкультивування клітин з туляремійними бактеріями підсилюється хемотаксична активність нейтрофілів, а в строки 7-24 години - розвиваються послідовні етапи апоптозу. У ревакцинованих ЖТВ основною найбільш демонстративною ознакою гіперсенсибілізації є колоїдальний осмотичний набряк нейтрофілів (Фіг.3), число яких на препараті перевищує 50%. При цьому повністю припиняється хемотаксична активність клітин. Через 8 років після вакцинації інтенсивність цього процесу знижується до окремих клітин. Слідом за колоїдальним набряком нейтрофіли ревакцинованих зазнають апоптозу (Фіг.4). Захисний рівень клітинного імунітету у щеплених ЖТВ оцінюють за морфологічними змінами моноцитів-макрофагів в присутності живих туляремійних бактерій. Формування кластерів моноцитів-макрофагів або їх апоптоз через 7-24 години характеризує наявність протективного імунітету. Низький захисний рівень клітинного імунітету характеризує відсутність на препараті кластерів моноцитів-макрофагів, наявність характерних структурних змін моноцитів-макрофагів через 24 години співкультивування, цитоскелетів нейтрофілів, та внутрішньоклітинних туляремійних мікробів (Фіг.5), а також низький рівень антигенспецифічної бластрансформадії (табл.1). Таким чином, розроблена модель та методологія досліджень in vitro специфічного клітинного імунітету у людини до внутрішньоклітинних бактерій, зокрема, туляремійних, ідентифіковані ознаки, що характеризують його захисний рівень і специфічну гіперчутливість, (алергічний компонент), особливості поствакцинального імунітету у вакцинованих та ревакцинованих ЖТВ людей. Спосіб високоінформативний, відрізняється простотою обліку і достовірністю оцінки стану клітинного імунітету, здійснюється в короткі строки. Одержані дані підтверджують вдосконалення методології оцінки захисного рівня клітинного імунітету у щеплених ЖТВ людей шляхом моделювання in vitro імунної відповіді на туляремійні бактерії в клітинній тест-системі, що надає можливість оптимізувати схему вакцинопрофілактики туляремії (строки та кратність ревакцинацій). Запропонований спосіб може бути використаний і при необхідності встановлення імунологічної ефективності та безпеки інших вакцинних препаратів і строків їх повторних введень, що має особ 9 ливу актуальність в теперішній час в зв'язку з недостатнім науковим обґрунтуванням схем вакцинопрофілактики багатьох інфекційних хвороб. Джерела інформації: 1. Petersen J.M., Schriefer M.E. Tularemia: emergence/re-emergence // Vet. Res. 2005, 36:455467. 2. Hartley G., Taylor R., Prior J., Newstead S., Hitchen P.G., Morris H.R., Dell A., Titball R.W. Grey variants of the live vaccine strains of Francisella tularensis lack lipopolysaccharide O-antigen, show reduced ability to survive in macrophages and do not induce protective immunity in mice// Vaccine, 2006 24:989-996. 3. Conlan J.W. Vaccines against Francisella tularensis - past, present and future // Expert Rev. Vaccines 2004,3:89-96. 4. McLendon M.K., Apicella M.A., Allen L-A.H. Francisella tularensis: taxonomy, genetics, and immunopathogenesis of a potential agent of biowarfare // Ann. Rev Microbiol. 2006, 60:167-185. 5. Fortier A.H., Narayanan R.B., Drabick J., Williams J.C., Nacy C.A. Vaccination with lipopolysaccharide isolated from the live vaccine strain of Francisella tularensis protects against murine tularemia.//Vaccine Res. 1996, 5:193-202. 6. Sjostedt A., North R.G., and Conlan J.W. The requirement of tumour necrosis factor-alpha and interferon-gamma for the expression of protective immunity to secondary murine tularemia depends on the size of the challenge inoculum.// Мicrobiol. 1996, 142:1369-1374. 7. Conlan J.W., Shen H., Webb A., Perry M.B. Mice vaccinated with the O-antigen of Francisella 49725 10 tularensis LVS lipopolysaccharide conjugate to bovine serum albumin develop varying degrees of protective immunity against systemic or aerosol challenge with virulent type A and type В strains of the pathogen// Vaccine 2002, 20:3465-3471. 8. Ellis J., Oyston P.C.F., Green M., Titball R. Tularemia // Clin. Microbiol. Rev., 2002, 15:631-646. 9. B. De Pascalis, Chou A.Y., Elkins K.L. Derivation of potential correlates of vaccine-induced protection against Francisella tularensis LVS // 6th International Conference on Tularemia 13-16 September 2009 | Berlin, Germany Charire Campus Mitte (CCM).-P.186. 10. Ericsson M., Sandstrmom G., Sjostedt A. and Tarnvik A. Persistence of Cell-Mediated Immunity and Decline of Humoral Immunity to the Intracellular Bacterium Francisella tularensis 25 Years after Natural Infection // Infect. Dis. 1994, 170:110-114. 11. Tranvik A., Berglund L. Tularemia // Eur. Respir. J., 2003, 21:361-373. 12. Sandstrmom G., Tarnvik A. and Wolf-Watz H. Immunospecific T-Lymphocyte Stimulation by Membrane Proteins from Francisella tularensis // Clin. Microbiol. 1987, 25:641-644. 13. Савельева Р.А., Ананова Е.В., Пронин А.В., Фоминых Е.А., Родионова И.В. Определение продолжительности поствакцинального иммунитета против туляремии // Журн. Микробиол., 1995, №6, С.51-52. 14. Tarnvik A. and Lofgren S. Stimulation of Human Lymphocytes by a Vaccine Strain of Francisella tularensis // Infect. Immune 1975, 12.951957. 11 Комп’ютерна верстка А. Рябко 49725 Підписне 12 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for assessment of protective level of cellular immunity
Автори англійськоюStopchanska Alla Hryhorivna
Назва патенту російськоюСпособ оценки защитного уровня противотуляремийного клеточного иммунитета
Автори російськоюСтопчанская Алла Григорьевна
МПК / Мітки
МПК: C12Q 1/06, G01N 33/53, A61B 10/00
Мітки: спосіб, захисного, клітинного, рівня, протитуляремійного, оцінки, імунітету
Код посилання
<a href="https://ua.patents.su/6-49725-sposib-ocinki-zakhisnogo-rivnya-protitulyaremijjnogo-klitinnogo-imunitetu.html" target="_blank" rel="follow" title="База патентів України">Спосіб оцінки захисного рівня протитуляремійного клітинного імунітету</a>
Попередній патент: Спосіб формування клаптя з розтягнутих тканин
Наступний патент: Універсальний канатний міст
Випадковий патент: Автобус пасажирський "а08120"