Композиція солей похідних амідину та інгібітора циклооксигенази, спосіб її одержання, застосування та фармацевтична композиція
Формула / Реферат
1. Композиція солей похідних амідину та інгібітора циклооксигенази, яка складається із сполук A і B,
де
А є інгібітором циклооксигенази, що представляє карбокси групу,
В є сполука загальної формули (Iв)
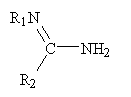 , (Iв)
, (Iв)
де
R1 є Н, нітро або феніловий радикал, феніловий радикал, який при необхідності заміщується одним або кількома замісниками, вибраними серед гало, ціано, нітро, трифторометилових радикалів, нижчих алкіл або алкокси радикалів;
R2 є нижчим алкіл радикалом, нижчим алкілтіо радикалом, алкілтіоалкілом, арилом, який при необхідності заміщується одним або кількома замісниками, вибраними серед гало, ціано, нітро, трифторметилових радикалів, нижчих алкіл або алкокси радикалів, або аміно радикалом, що при необхідності заміщується радикалом, вибраним серед нітро, аміно, нижчих алкіл або феніл радикалів, феніловий радикал сам при необхідності заміщується одним або кількома замісниками, вибраними з гало, ціано, нітро, трифторметилових радикалів, нижчих алкіл або алкокси радикалів,
за умови, якщо А є ацетилсаліцилова кислота, a R1 - атом водню, тоді R2 не є ні ариловим радикалом, ні феніламіновим радикалом, а феніловий радикал при необхідності заміщується.
2. Композиція солей похідних амідину та інгібітора циклооксигенази за п. 1, яка відрізняється тим, що сполука А вибрана з саліцилатів, індометацину, суліндаку, фенаматів і похідних пропіонової кислоти.
3. Композиція солей похідних амідину та інгібітора циклооксигенази за будь-яким з пп. 1 або 2, яка відрізняється тим, що А є саліцилова кислота, метилсаліцилат, ацетилсаліцилова кислота, індометацин, суліндак, мефенамінова кислота, меклофенамінова кислота або ібупрофен, а В відповідає загальній формулі (IB), представленій вище, де R1 є Н, нітро або феніловий радикал, феніловий радикал, який при необхідності заміщується одним або кількома замісниками, вибраними серед хлор, фтор, ціано, нітро, трифторометил, метил, етил, метокси, етокси або ізопропілокси радикалів, а R2 є амін, гідразин, нітроамін, метиламін, етиламін, метил, етил, метилтіо, метилтіометил, феніл при необхідності заміщується одним або кількома замісниками, вибраними з хлор, фтор, ціано, нітро, трифторметил, метил, етил, метокси, етокси або ізопропілокси, тієніл, фурил або піроліл радикалів.
4. Композиція солей похідних амідину та інгібітора циклооксигенази за будь-яким з пп. 1-3, яка відрізняється тим, що представляє собою:
- аміногуанідин саліцилат,
- аміногуанідин ібупрофенат,
- аміногуанідин індометацинат,
- метилгуанідин ацетилсаліцилат,
- метилгуанідин саліцилат,
- метилгуанідин ібупрофенат,
- метилгуанідин мефенамат.
5. Спосіб одержання композиції солей похідних амідину та інгібітора циклооксигенази за п.1, у якому реакцію між сумішшю сполуки формули А та сполуки формули В проводять у воді при температурі, що знаходиться у межах від температури навколишнього середовища до 70°С.
6. Композиція солей похідних амідину та інгібітора циклооксигенази за будь-яким з пп. 1-4, як медикаменти.
7. Композиція солей похідних амідину та інгібітора циклооксигенази за п.6 для приготування медикаментів, призначених для лікування серцево-судинних і церебрально-судинних хвороб, до яких належать, наприклад, мігрені, інсульти, інфаркти, ішемії, септичні шоки, ендотоксичні шоки, геморагічні шоки та болі.
8. Композиція солей похідних амідину та інгібітора циклооксигенази за п. 6 для приготування медикаментів, призначених для лікування різних форм запалення, до яких належать гострі ревматичні гарячки, ревматичні артрити або інші види артритів, остеоартрит, астма.
9. Композиція солей похідних амідину та інгібітора циклооксигенази за п. 6 для приготування медикаментів, призначених для лікування захворювань імунної системи, до яких відносяться вірусні або невірусні інфекції, аутоімунні захворювання і всі патології, що характеризуються надлишковим виробленням у організмі оксиду азоту та/або метаболітів арахідинової кислоти.
10. Фармацевтична композиція, що складається з фармацевтично прийнятного носія і активної основи, яка відрізняється тим, що як активну основу вона містить ефективну кількість щонайменше одного з медикаментів за п. 6.
Текст
УКРАЇНА (19) UA (11) 53624 из) С2 (51)7А61К31/60,31/405, 31/195,31/19,31/155 МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ ДЕРЖАВНИЙ ДЕПАРТАМЕНТ ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ ОПИС ДО ПАТЕНТУ НА ВИНАХІД (54) КОМПОЗИЦІЯ СОЛЕЙ ПОХІДНИХ АМІДИНУ ТА ІНПБІТОРА ЦИКЛООКСИГЕНАЗИ, СПОСІБ її ОДЕРЖАННЯ, ЗАСТОСУВАННЯ ТА ФАРМАЦЕВТИЧНА КОМПОЗИЦІЯ * (21)98010194 (22) 15 07 1996 (24) 17 02 2003 (86) PCT/FR96/01095, 15 07 1996 (31) 9514518 1 (32) 15 07 1995 (33) GB (46) 17 02 2003, Бюл №2, 2003 р (72) Шабрієр Де Лассон'єр, FR, Броке Колетт , FR (73) СОС'ЄТЕ ДЕ КОНСЕЙН ДЕ РЕШЕРШ Е ДАПЛІКАСЬОН С'ЄНТІФІК, FR (56) US, A, 4 324 801,04 1982 GB, А, 2263 111, 1407 1993 JP, А, 61 143320,01 07 1986 JP, А, 56 147761, 16 11 1981 (57) 1 Композиція солей похідних амідину та інпбітора циклооксигенази, яка складається із сполук А 'В, де А є інгібітором циклооксигенази, що представляє карбокси групу, В є сполука загальної формули (їв) ,C-NH, ДЄ (Ів) R1 є Н, нітро або феніловий радикал, феніловий радикал, який при необхідності заміщується одним або кількома замісниками, вибраними серед гало, ціано, нітро, трифторометилових радикалів, нижчих алкіл або алкокси радикалів, R2 є нижчим алкіл радикалом, нижчим алкілтю радикалом, алкілтюалкілом, арилом, який при необхідності заміщується одним або кількома замісниками, вибраними серед гало, ціано, нітро, трифторметилових радикалів, нижчих алкіл або алкокси радикалів, або аміно радикалом, що при необхідності заміщується радикалом, вибраним серед нітро, аміно нижчих алкіл або феніл радикалів, феніловий радикал сам при необхідності заміщується одним або кількома замісниками, вибраними з гало ціано, нітро, трифторметилових радикалів, нижчих алкіл або алкокси радикалів, за умови, якщо А є ацетилсаліцилова кислота, а R1 - атом водню, тоді R2 не є ні ариловим радикалом, ні феніламіновим радикалом, а феніловий 1 радикал при необхідності заміщується 2 Композиція солей похідних амідину та інпбітора циклооксигенази за п 1, яка відрізняється тим, що сполука А вибрана з саліцилатів, індометацину, суліндаку, фенаматів і похідних пропюновоі кислоти 3 Композиція солей похідних амідину та інпбітора циклооксигенази за будь-яким з пп 1 або 2, яка відрізняється тим, що А є саліцилова кислота метилсаліцилат, ацетилсаліцилова кислота, індометацин, суліндак, мефенамінова кислота, меклофенамінова кислота або ібупрофен, а В відповідає загальній формулі (IB), представленій вище, де R1 є Н, нітро або феніловий радикал, феніловий радикал, який при необхідності заміщується одним або кількома замісниками, вибраними серед хлор, фтор, ціано, нітро, трифторометил, метил, етил, метокси, етокси або ізопропілокси радикалів, a R2 є амін, гідразин, нітроамін, метиламін, етиламін, метил, етил, метилтю метилтюметил, феніл при необхідності заміщується одним або кількома замісниками, вибраними з хлор, фтор, ціано, нітро, трифторметил, метил, етил, метокси, етокси або ізопропілокси, тієнш, фурил або піроліл радикалів 4 Композиція солей похідних амідину та інгібггора циклооксигенази за будь-яким з пп 1-3, яка відрізняється тим, що представляє собою - аміногуанідин саліцилат, - аміногуанідин ібупрофенат, - аміногуанідин індометацинат, - метилгуанідин ацетил саліцилат, - метилгуанідин саліцилат, - метилгуанідин ібупрофенат, - метилгуанідин мефенамат 5 Спосіб одержання композиції солей похідних амідину та інгібггора циклооксигенази за п 1, у якому реакцію між сумішшю сполуки формули А та сполуки формули В проводять у воді при температурі, що знаходиться у межах від температури навколишнього середовища до 70°С 6 Композиція солей похідних амідину та інпбітора циклооксигенази за будь-яким з пп 1-4 як медикаменти 7 Композиція солей похідних амідину та інпбітора циклооксигенази за п 6 для приготування медикаментів, призначених для лікування серцевосудинних і церебрально-судинних хвороб, до яких О см (О го in належать, наприклад, мігрені, інсульти, інфаркти, ішеми, септичні шоки, ендотоксичні шоки, геморагічні шоки та болі 8 Композиція солей похідних амідину та інпбітора циклооксигенази за п 6 для приготування медикаментів, призначених для лікування різних форм запалення, до яких належать гострі ревматичні гарячки, ревматичні артрити або ІНШІ ВИДИ артритів, остеоартрит, астма 9 Композиція солей похідних амідину та інпбітора циклооксигенази за п 6 для приготування медика 53624 ментів, призначених для лікування захворювань імунної системи, до яких відносяться вірусні або невірусні інфекції, аутоімунні захворювання і всі патологи, що характеризуються надлишковим виробленням у організмі оксиду азоту та/або метаболітів арахідинової кислоти 10 Фармацевтична композиція, що складається з фармацевтично прийнятного носія і активної основи, яка відрізняється тим, що як активну основу вона містить ефективну КІЛЬКІСТЬ щонайменше одного з медикаментів за п 6 Даний винахід стосується нових сполук, які мають подвійну біологічну активність, а саме, таких, що одночасно інгібують утворення моноксиду азоту (N0) та активність циклооксигеназ, процедури їх приготування, фармацевтичних композицій, що їх містять, та їх конкретного застосування як інгібіторів N0 синтази і циклооксигенази Інгібітори циклооксигенази або медикаментів, аналогічних аспірину, тобто ацетилсаліцилової та саліцилової кислот, похідних метилованого індолу, таких як індометацин (DCI кислоти [1-(4хлоробензоіп)-5-метокси-2-метип-1Н-індоп-3іл]ацетат та суліндак (DCI кислоти [5-фтор-2метил-1-{[4-(метилсульфініл)феніл]-метилен}-іНінден-3-іл]ацетат, похідних N-фенілантранілових кислот (меклофенамат, фенамати), похідних пропюнової кислоти, таких як ібупрофен (DCI різобутилпдратропової кислоти), напроксену, фенопрофену, одержали широке застосування і визнання як ефективні ліки у терапії запалень, але з рядом вторинних небажаних ефектів у випадку передозування [R Flower, S Moncada і Z Vane, Mechanism of action of aspinnlike drugs - in the pharmacological basis of therapeutics Goodman and Gilman, 1985, 29, 674 - 715] Окрім цього, ці сполуки також використовуються при стаціонарному лікуванні та профілактиці мігрені Значення цих медикаментів незаперечне, хоча їх терапевтична дія може бути недостатньою, а тому застосування таких сполук для деяких хворих неприйнятне Враховуючи їх протизапальні та антикоагуляційні властивості щодо тромбоцитів, ці сполуки застосовуються при лікуванні тромбозу зі значним зменшенням набряків, у випадках ішемії мозку і нині запропоновані для лікування та запобігання риникнення інфарктів, струсів і церебросудинних захворювань [W Armstrong Recent trends in research and treatement of stroke, SCRIP, PJB publications, 1991] Біологічна активність інгібіторів NO-синтази була відкрита зовсім недавно, і тому їх потенціальне терапевтичне застосування знаходиться поки що на стадії вивчення Ці субстанції, структури котрих представлені аналогами L-арпніну і описані у датському патенті 3041/90, є інгібіторами вироблення оксиду азоту (N0) Наші теперішні знання про N0 в 1991 р були заново переглянуті Монкада та ін [S Moncada, R М J Palmer, E A Higgs Nitric oxide physiology, pathophysiology pharmacology - Pharmacological reviews 43 2 109 - 142] і зовсім недавно Кервіном з співавторами [Kerwm J , Lancaster J , Feldman P , Nitric oxyde a new paradigm for second messengers, J, Med Chem (1995), vol. 38, 22, 4343 - 4362] По суті, виявляється, що NO служить механізмом трансдукції для панілат циклази, розчинної у тромбоцитах, нервовій системі, та діючої молекули в імунологічних реакціях у багатьох тканевих клітинах, у тому числі в макрофагах та нетрофілах N0 є продуктом ферментації Lарпніну, що відбувається за допомогою ензиму з назвою N0 синтаза Цей ензим існує у двох формах конституційній (ендотеліал та невронал) та індуктованій У деяких патолопях може проявлятись надлишкове вироблення N0, як це вже було показано на прикладі одного шоку, і як було описано у вищезгаданому патенті У цьому контексті інгібітори N0 синтази виступають ефективними медичними препаратами для запобігання судинних ускладнень та смертності, спричиненої хворобою, особливо коли вони комбінуються з такими інгібіторами циклооксигенази як аспірин, індометацин або меклофенамат Сприятлива дія поєднання двох активних принципів у одній і тій же молекулі може бути корисною для пацієнтів, що мають ІНШІ патолог», наприклад - серцево-судинні та церебрально-судинні захворювання, до яких належать, наприклад, атеросклероз, мігрень, артеріальна гіпертонія, септичний шок, серцеві або церебральні інфаркти ішемічного або гемарропчного походження, ішемія та тромбози, - захворювання центральної та периферійної нервової системи таю, наприклад, як невродегенеративні, серед яких особливо можна виділити церебральні інфаркти, старечі деменції, у тому числі хворобу Альзеймера, хорею Хантінгтона, хворобу Паркінсона, хворобу Якоба Крейтзфельда, аміотрофічний бічний склероз, а також біль, церебральні травматизми або травматизми спинного мозку, вживання наркотиків, алкоголю, а також речовин, що спонукають до виникнення шкідливих звичок, неплідність, кон'югація, енцефалопатичні захворювання, - швидкорозповсюджувані та запальні хвороби такі, наприклад, як атеросклероз, легенева гіпертонія, гломерулонефріти, гіпертензія, псоріазм, артроз та ревматоїдний артрит, фібрози, амілоїдози, запалення гастроентестинальноі системи (коліт, хвороба Крона) або легеневої системи та дихальних шляхів (астма, синусіти), - пов'язані з трансплантацією органів, - автоімунні та вірусні захворювання такі, наприклад, як вівчанка, СНІД, паразитарні та вірусні 53624 інфекції, діабет, розсіяний склероз; - рак або - всі паталогічні захворювання, що характеризуються виробленням чи дисфункціонуванням N0 та/або циклооксигеназ. Метою даного винаходу є продукти загальної формули І АБ. (І) у вигляді солі, у якій А - є інгібітором циклооксигенази, що представляє карбокси групу; В - є сполука загальної формули їв :—NH2 (їв) у якій RI є Н, нітро або феніловий радикал, феніловий радикал, який при необхідності заміщується одним або кількома замісниками, вибраними серед гало, ціано, нітро, трифторометилових радикалів, нижчих алкіл або алкокси радікалів; R2 є нижчим алкіл радикалом; нижчим алхілтіо радикалом; алкілтіоалкілом, арілом, який при необхідності заміщується одним або кількома замісниками, вибраними серед гало, ціано, нітро, трифторметилових радикалів, нижчих алкіл або алкокси радикалів, або аміно радикалом, що при необхідності заміщується радикалом, вибраним серед нітро, аміно, нижчих алкіл радикалів або фенілу, феніловий радикал сам при необхідності заміщується одним або кількома замісниками, вибраними з гало, ціано, нітро, трифторметилових радикалів, нижчих алкіл або алкокси радикалів; і коли А є ацетилсаліцилова кислота, a Ri атом водню, тоді R2 не є ні ариловим радикалом, ні феніламіновим радикалом, а феніловий радикал при необхідності заміщується. У визначеннях, що приведені вище, термін гало означає фтор, хлор, бром або іод радикал, переважно фтор або хлор радикал. Вираз нижчий алкіл означає переважно алкіловий радикал, що містить у собі від 1 до 6 атомів лінійного або роз гал уженного вуглецю та особливо алкіловий радикал, що містить у собі від 1 до 4 атомів вуглецю, таких як метиловий, етиловий, пропіловий, ізопропіловий, бутиловий, ізобутиловий, втор-бутиловий, та трет-бутиловий радикали. Нижчі алкокси радикали можуть відповідати алкіловим радикалам, що зазначені вище. Перевага надається метокси, етокси або ізопропілокси радикалам. Вираз арил означає ароматичний радикал, який складається з одного циклу або з конденсованих циклів; кожен цикл при необхідності може містити один або декілька гетероатомів, ідентичних або різних, вибраних з сірки, азоту або кисню. Прикладами радикалу арилу є радикали феніл, нафтил, тієніл, фурил, піроліл, імідазоліл, піразоліл, ізотіазоліл, тіазоліл, ізоксазоліл, оксазоліл, піріділ, піразініл, пірімщіл, бензотієніл, бензофуріл та індоліл. Ще одною метою даного винаходу є продукти вищевказано'і загальної формули 1, які характеризуються тим, що складова А вибирається з саліцилатів, таких як саліцилова кислота та її похідні, індометацин, суліндак, фенамати та похідні пропі онової кислоти. Серед похідних саліцилової1 кислоти можливо відзначити сполуки, отримані шляхом етерифікації1 карбокси групи саліцилової кислоти, такі, наприклад, як метилсаліцилат, сполуки, отримані шляхом заміщення саліцилової кислоти по гідрокси групі, такі, наприклад, як ацетилсаліцилова кислота, або сполуки, отримані шляхом введення замісника (Ів) на ВІЛЬНІ місця фенілу саліцилової кислоти, як, наприклад, дифлунізал. Серед фенаматів можливо ВІДМІТИТИ мефенамінову, меклофенамінову, флуфенамінову та толфенамінову кислоти. Як приклад похідних пропюніової кислоти, можливо відзначити такі сполуки як ібупрофен, напроксен, фенопрофен, фенбуфен, флурбіпрофен, індопрофен, кетопрофен або супрофен. Метою даного винаходу є також сполуки загальної' формули І, як описано вище, які характеризуються тим, що - А є саліцилова кислота, метил саліцилат, ацетилсаліцилова кислота, індометацин, суліндак, мефенамінова кислота, меклофенамінова кислота або ібупрофен; та - В відповідає загальній формулі (1В), представленій вище, у якій Ri є Н, нітро або феніловий радикал, феніловий радикал, який при необхідності заміщується одним або кількома замісниками, вибраними серед хлор, фтор, ціано, нітро, трифторометил, метил, етил, метокси, етокси або ізопропілокси радикалів; та R2 є амін; гідразин; нітроамін; метиламін; етиламін; метил; етил; метилтю; метилтіометил радикал; феніл при необхідності заміщується одним аЬо кількома замісниками, вибраними з хлор, фтор, ціано, нітро, трифторметил, метил, етил, метокси, етокси або ізопропілокси, ТІЄНІЛ, фурил або піроліл радикалів. Ще одною метою даного винаходу є сполуки, які описані далі в прикладах, а саме сполуки, котрі відповідають таким формулам: - аміногуанідин саліцилат; - аміногуанідин ібупрофенат; - аміногуанідин індометацинат; - метилгуанідин ацетилсаліцилат;- метилгуанідин саліцилат; - метилгуанідин ібупрофенат; - метилгуанідин мефенамат. Метою даного винаходу є також спосіб одержання продуктів загальної формули І, зазначеної вище, що характеризується тим, що реакція між сумішшю сполуки з формулою А, визначеною вище, та сполукою формули В, визначеною вище, проводиться у воді при температурі, що знаходиться у межах від температури навколишнього середовища до 70°С. При проведенні реакції сполуку формули А можливо використовувати у чистому вигляді або у вигляді солі, наприклад, солі натрію. Сполуку формули В можливо також використовувати у чистому вигляді або у вигляді, наприклад, її бікарбонату або гїдрохлориду. Продукти формули А відомі або можуть бути виготовлені за загальновідомими методами. Сполуки формули В можуть бути отримані шляхом застосування загальновідомих методів приготування амідинів [Schwan Т. J. et coll., J. Pharm. Sci. (1975), 64, 337 - 338, Roger R et coll., Chem. Rev. 53624 61, 179. (1961); Tetrahedron. 29 (14), 2147 - 51 (1973); Patai S., Chem. Amidines Imidates, vol. 1, 283 - 348 (1975); Patai S., Chem. Amidines Imidates, vol.2, 339-366(1990)]. Сполуки даного винаходу мають цікаві фармакологічні властивості. Вони проявляються у подвійній біологічній активності, а саме - одночасно інгібують процеси L-apriнін/оксид азоту (N0) і процеси циклооксигенази. Сполуки даного винаходу можуть також бути використані у різних терапевтичних застосуваннях. Враховуючи потенційну роль N0 синтази і циклооксигенази у фізіопатології, сполуки даного винаходу можуть відігравати сприятливу роль при лікуванні: - серцево-судинних і церебрально-судинних захворювань, включаючи мігрені, інсульти, інфаркти, ішемії, септичні, ендотоксичні та гемарропчні шоки, болі; - різні форми запалень, до яких, наприклад, належать гострі ревматичні гарячки, ревматичні артрити або інші види артритів, остеоартрит, астма; - захворювання імунної системи, до яких відносяться вірусні та невірусні інфекції, захворювання автоімунні і всі патології, що характеризуються надлишком оксиду азоту в організмі та/або метаболітів арахідінової кислоти. Далі в експериментальній частині буде представлено опис фармакологічних властивостей сполук даного винаходу. Ці властивості надають продуктам формули І придатність до їх застосування у фармакологи. Предметом винаходу є, у рівній мірі, продукти вище визначеної формули І, як медикаменти, а також фармацевтичні композиції, що містять як активну складову щонайменше один з зазначених вище медикаментів. Таким чином, даний винахід стосується також фармацевтичних композицій, до яких входять сполуки даного винаходу, спільно з фармацевтичне прийнятним носієм. Фармацевтична композиція може бути у твердій формі, наприклад, у вигляді порошку, гранул, таблеток, капсул або суппозиторів. Придатними твердими носіями можуть бути, наприклад, фосфат кальцію, стеарат магнію, тальк, цукор, лактоза, декстрин, крохмаль, желатин, целюлоза, метилцелюлоза, натрій карбоксиметилцелюлоза, полівінілшролідин, та віск. Фармацевтичні композиції, що містять сполуку даного винаходу, можуть бути також у вигляді рідини, наприклад, розчинів, емульсій, суспензій, сиропів. Прийнятними рідкими носіями можуть бути, наприклад, вода, органічні розчинники, такі як гліцерин або гліколі, а також їх суміші у різних пропорціях, у воді, з добавленнями олії або фармацевтично прийнятних жирів. Фармацевтичні композиції, згідно з даним винаходом, в залежності від форми випуску можуть вживатися за класичними способами, такими як оральний або шляхом ін'єкцій, внутрішньом'язових, внутрішньочеревних, внутрішньовенних або підшкірних. Предметом винаходу є також застосування продуктів, згідно формули І, для виготовлення медикаментів, призначених для лікування серцево-судинних та церебрально-судинних захворю 8 вань, медикаментів, призначених для лікування різних форм запалень, медикаментів, призначених для лікування захворювань імунної системи. Представлені нижче приклади призначені для ілюстрації вищезазначених способів, і ні у якому разі не повинні розглядатися як будь-які обмеження щодо даного винаходу. ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА: Приклад 1: Аміногуанідин саліцилат В 25мл води розчиняють, підігріваючи до 70"С, 420мг (2,5ммоль) бікарбонату аміногуанідину, потім, помішуючи, додають водний розчин 400мг саліцилату натрію. Підігрівають суміш протягом 20 хвилин і потім ліофілізують (білий порошок; температура топлення Тт = 148°С). Приклад 2: Аміногуанідин Ібупрофенат В 25мл води розчиняють, підігріваючи до 70°С, 420мг (2,5ммоль) бікарбонату аміногуанідину, потім, помішуючи, додають водний розчин 570мг солі ібупрофену натрію. Продовжують підігрівати суміш протягом 20 хвилин і потім ліофілізують (білий порошок; Тт = 134°С). Приклад 3: Аміногуанідин індометацінат Виконуються такі ж самі дії, як описано у прикладі 1, але замість саліцилату натрію використовується індометацин (жовтий порошок; Т т = 196°С). Приклад 4: МетилгуанІдин ацетил саліцилат Розчиняється 450мг (2,5ммоль) ацетилсаліцилової кислоти у 20мл води з2,5мл 1N NaOH. Потім добавляється 237,8мг хлоргідрату метилгуанідіну у Юмл води. Перемішують протягом 15 хвилин. Отримують прозорий розчин. Ліофілізація дає білий порошок (Т т = 153°С). ЯМР - 1 Н (100МГц, D2O): 7,3 - 6,6 (m, 4H, ароматичний); 2,3(s, ЗН, NCH3); 1.8 (s. ЗН. СОСН3). Приклад 5: МетилгуанІдин саліцилат Розчиняють у гарячому стані 345мг (2,5ммоль) саліцилової кислоти у 20мл води з 2,5мл 1N NaOH. Додають розчин хлоргідрату метил гуанідину (2,5ммоль) у Юмл води. Помішують протягом 10 хвилин при 40°С. Ліофілізація дає досить об'ємний білий порошок (Тт = 140°С) ЯМР 1 Н(100МГц, D2O): 7 - 6,8 (m, 4H, ароматичний); 2,4 (s, ЗН, NCH3). Приклад 6: Метилгуанідин ібупрофенат Розчиняють у гарячому стані 2,5ммоль ібупрофену у 20мл води з 2,5мл 1N NaOH. Додають розчин хлоргідрату метилгуанідину (2,5ммоль) у Юмл води. Помішуючи, підігрівають при 60°С протягом 15 хвилин. Ліофілізація дає білий порошок (Тт = 174°С). 'Н-ЯМР (100МГц, D2O): 7,2 (s. 4H, ароматичний.); 3,4 (q, 1Н, СбН6-СН(Ме}-СО); 2,6 (s, ЗН, NCH3); 2,25 (d, 2H, СН2С6Н6); 1,6 (m, 1H, СН(СН3)2); 1,2 (d, ЗН -СН(СН3)-СО2Н); 08 (d, 6H, 2СН3). Приклад 7: Метилгуанідин мефенамат Виконуються ді'і, аналогічні до тих, що описані в прикладі 6, але замість ібупрофену використовується мефенамінова кислота. При охолодженні сполука випадає у осад. Отриманий продукт фільтрується і висушується (Тт = 124°С). 1 Н-ЯМР(100МГц, D 2 O):8,1(m, 1H, Н у о С О 3 Н ) ; 7,2 - 6,8 (m, 6H, 2СбН6); 2,9 (s, ЗН, NCH3); 2,4 та 2,3 (d, 2СНзС6Н6). Використовуючи вище приведений спосіб, мо 53624 жна також одержати продукти, які у рівній мірі входять до складу винаходу та котрим надається пе 10 ревага: Таблиця 1 Сполука В А R1 С D Е F G Н І J К L М N 0 Р Q R S Т и V W X Y Кислота саліцилова Кислота саліцилова Кислота саліцилова Кислота ацетилсаліцилова Кислота ацетилсаліцилова Метил саліцилат Метил саліцилат Індометацин Індометацин Індометацин Індометацин Індометацин Суліндак Суліндак Суліндак Кислота мефенамінова Кислота мефенамінова Кислота мефенамінова Кислота меклофенамінова Кислота меклофенамінова Ібупрофен Ібупрофен Ібупрофен Нітро Н 2-фторфеніл 4-метоксифеніл нітро 3-хлорофеніл н 3-4 діхпорфеніл 4-метилфеніл н нітро нітро 3-ціанофеніл Н Н Н н нітро нітро 3-трифторфеніл нітро нітро Фармакологічне вивчення продуктів винаходу Винайдені сполуки були піддані біологічним випробуванням in vitro для перевірки їх спроможності блокувати індуктовану N0 синтазу та циклооксигеназу. Вони порівнювались з такими еталонними речовинами як аміногуанщин, L-нітроарпнін, Ібупрофен, Індометацин, ацетилсаліцилова кислота 1) Дія in vitro на N0 синтазу, індуктовану мишачими макрофагами J774A1. Випробування полягають у вимірюванні трансформації, що відбувається в L-цитрулині під дією N0 синтази L-арпніну, за методом Бредта і Снідера {Proceedings of the National Academy of Sciences USA, 87, 682-685, 1990). Мишачі макрофаги J774A1 виробляють велику КІЛЬКІСТЬ NO після активації лгпополісахаридами (LPS) та уінтерфероном (IFN^y). Клітини культивуються у середовищі DMEM (DuSbecco's Modified Eagle's Medium), збагаченому 10% телячої зародкової сироватки, при 37°С у атмосфері 5% СОг після активації LPS та IFN-y. Вони засіваються з розрахунку 5000клітин/см2 у склянках по 150см2. Інкубаційний процес проходить у присутності LPS (1мкг/мл) та IFN-y мишачого {50 Одиниць/мл) у DMEM, збагаченому 10% телячої' зародкової сироватки. NO синтазу виділяють за допомогою екстракційного буферного розчину (HEPES 50мМ, рН 7.4, дитютрейтол 0,5мМ, пепстатин А ЧмгУмл, лепептин Імг/мл, інгібітор сойового трипсину 1мг/мл, антипаїн 1мг/мл та PMSP (фенілметилсульфонілфторид) 10мг/мл) Після обробки ультразвуком у екстракційному буфері при 4°С розчини піддають н R2 гідразин метиламін амін етил етокси метил гідразин пропіл гідразин метиламін етил амін 3-хлорофеніл амін метиламін гідразин амін ТІЄНІЛ гідразин амін ізопропілокси метилтюметил метил фурил ультрацентрифугуванню (100 000д при 4°С протягом 1 ГОДИНИ). Дозування провадять у скляних пробірках, у які додають ЮОмкл буферного інкубаційного розчину, що містить ЮОмМ HEPES, рН 7 4, 1мМ дитіотрейтолу, 2,5мМ СаСІг, ЮмкМ тетрапдробюптерину, FAD (флавінаденіндинуклеотид) ЮмкМ, BSA 1 мг/мл, 2мМ NADPH відновленого, 2мМ EDTA (етилендіамінтетраоцтова кислота) і 2,5мМ СаСЬ. Додається 25мкл розчину, що містить ЮОнМ аргініну тритієвого (питома активність. 56,4Кюрі/ммоль, Amersham) і 40мкМ нерадюактивного аргініну. Реакцію ІНІЦІЮЮТЬ ШЛЯХОМ додавання 50мкл гомогенату, кінцевий об'єм складає 200мкл (нестачу у 25мкл складе або вода, або випробуваний продукт) Через 15 хвилин реакцію зупиняють шляхом додавання 2мл буферного зупиняючого розчину (20мМ HEPES, рН 5.5, 2мМ EDTA) Після проходження проб через колонку з 1мл смоли DOWEX, рівень радіоактивності визначається за допомогою рідинного сцинтиляційного спектрометру. Результати, виражені у значеннях СІБО. зведені в таблиці 2 параграфу 2 (перша колонка результатів під назвою "Індуктована NO синтаза, утворення цитруліну") 2) Дія in vitro на вироблення нітритів мишачими макрофагами J774A1: Це випробування використовується для вимірювання інгібуючої' дії продуктів на NO синтазу, індуктовану клітинами в культурах. Клітини культивуються в середовищі DMEM (DulBecco's Modified Eagle's Medium), збагаченому 10% телячої зародкової сироватки, при 37°С у атмосфері 5% СОг- Для проведення дослі 12 11 53624 дів вони розміщуються на пластині у 96 комірках Приклад 2 97 ±35 3,1 ±1,9 (50000 клітин на комірку) й проходять інкубаційний Аміногуанідін інактивний 109 ±44 період у DMEM без фенолового червоного при Ібупрофен інактивний 1,3 ±0,22 10% телячої зародкової сироватки з LPS (1мг/мл) та IFN-y мишачим (50 О/мл) у присутності або від4) Ефект in vitro на індуктовану циклооксигенасутності продуктів, що випробуються. Через 48 зу: годин концентрацію нітритів у культурних середоЦиклооксигеназа існує у двох ізоформах, СОХвищах, продуктів деградації NO, вимірюють коло1 (конституційна) і СОХ-2, індуктована запальними риметричним методом згідно з Green et al., Analytiмітогенами, цитокінами та ендотоксинами. Дані cal Biochemistry 126, 131 - 138 (1982). Результати, сполуки були випробувані на ензиматичну активвиражені у значеннях СІ50. зведені в таблиці 2 паність двох напшочищених ізоформ. раграфу 2 (друга колонка результатів під назвою Принцип випробування полягає у кількісному "Індуктована NO синтаза, утворення нітритів"). визначенні ступеню трансформації арахідонової кислоти (АА) у PGE2 за допомогою СОХ-1 або Таблиця 2 СОХ-2. Спосіб застосовується за Futaki et al. [Prostaglandms, 47, 55 - 59, 1994] COX-1 [Prostaglandme H synthase-1, EC 1.14 9.1] зберігається при -80°С і СІ50 (МКМ) походить від запліднюючої везикули бика СОХ-2 Індуктована NO Індуктована NO (Prostaglandme H synthase-2) також зберігається Продукти синтаза (утвосинтаза (утвопри температурі -80°С і походить від плаценти рення цитруліну) рення нітритів) вівці Аміногуанідін 20 22 Пробірки наповнюють 500мкл буферного розL21 100 чину (100 мМ Tris Неї, рН8, 1мкМ гематіну, 1мМ нітроарпнін фенолу) і сполуками даного винаходу або еталонІбупрофен інактивний інактивний ними речовинами з концентраціями від інМ до Індометацин інактивний інактивний 1мМ. Контрольні зразки отримуються з буферного 11 16 Приклад 2 розчину без інгібіторів Через 2 хвилини інкубаційПриклад 3 26 33 ного періоду з 5 одиницями (СОХ-2)- або 10 одиницями (СОХ-1 )-ензиму від 5мкл арахідонової 3) Дія in vitro на вироблення нітритів та PGE2 кислоти до ЮмкМ додаються на 2 хвилини. Реакмікрогліапьними клітинами щура цію припиняють за допомогою ЗОмкл 1N НСІ ЕкстМікрогліапьні клітини виділюють з культур гліракція провадиться через колонки Seppack C18 альних клітин, взятих з кори головного мозку ново(Waters) Після випаровування до сухого стану народженого щура Wistar, за протоколом Thery et PGE2 вимірюється за раді оім мунолопч ною дозиal. (1991 p.). МІкрогліальні клітини засівають у пламетрією. Результати, виражені у значеннях Clso, 5 стинах з 24 комірками, з розрахунку 5 х 10 клітин зведені до приведеної нижче таблиці 4. на мл і 0,5мл на комірку. МІкрогшапьні клітини проходять інкубаційний період у присутності LPS Таблиця 4 (10мг/мл) та інгібіторів протягом 24 годин при 37°С у присутності 5% СОг- Через 24 години вилучають сполуки, що спливають, для їх аналізу на концентСІ50 (МКМ) рації нітритів та PGE2. PGE2 дозується за допомоПродукти СОХ-1 СОХ-2 гою радіоімунолопчного дозатора, виготовленого Ацетилсаліцилова 77,8 648 підприємством NEN, керуючись інструкцією по кислота користуванню цим приладом, наданою його вироКислота саліци>1000 >1000 бником. Кожен зразок дозується двічі Результати, лова виражені у формі СІ50, розраховані за методом Кислота мефена83,9 388 лінійної регресґі на лінійному відрізку кривої інгібумінова вання (ФігРбС) Нітрити дозуються за методом Ібупрофен >1000 >1000 Green et al. [Analytical Biochemistry 126, 131 - 138, Індометацин 0,54 15,9 1982] Результати, виражені у формі Clso. подані у Аміногуанідін >1000 >1000 таблиці 3 нижче для прикладу 2. L-нітроарпнш >1000 >1000 Приклад 2 525 459 Таблиця З Приклад 3 0,108 29,4 Приклад 4 243 >1000 Виробництво Приклад 5 >1000 >1000 Виробництво Продукт нітритів СІ so Приклад 6 >1000 >1000 PGE C! O(MKM) (мкМ) Приклад 7 411 331 2 5 ТОВ "Міжнародний науковий комітет" вул. Артема, 77, м. Киш, 04050, Україна (044)236-47-24
ДивитисяДодаткова інформація
Назва патенту англійськоюCyclo-oxygenase inhibitor and amidine derivative salts, method of preparation, pharmaceutical composition and its application
Назва патенту російськоюКомпозиция солей производных амидина и ингибитора циклооксигеназы, способ ее получения, применение и фармацевтическая композиция
МПК / Мітки
МПК: A61K 31/60, A61K 31/405, A61K 31/19, A61K 31/155, A61K 31/195
Мітки: композиція, застосування, інгібітора, спосіб, одержання, амідину, циклооксигенази-2, похідних, фармацевтична, солей
Код посилання
<a href="https://ua.patents.su/6-53624-kompoziciya-solejj-pokhidnikh-amidinu-ta-ingibitora-ciklooksigenazi-sposib-oderzhannya-zastosuvannya-ta-farmacevtichna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Композиція солей похідних амідину та інгібітора циклооксигенази, спосіб її одержання, застосування та фармацевтична композиція</a>
Попередній патент: Роторний двигун внутрішнього згоряння
Наступний патент: Привідний відкритошарнірний ланцюг
Випадковий патент: Система збудження синхронної машини










