(сs)-5,11,17,23-тетра-трет.-бутил-25-гідрокси-26-гідроксикарбонілметокси-27,28-дипропоксикалікс[4]арен та (сr)-5,11,17,23- тетра-трет.-бутил-25-гідрокси-28-гідроксикарбонілметокси-26,27-дипропоксикалікс-[4]арен
Номер патенту: 69322
Опубліковано: 25.04.2012
Автори: Бойко Вячеслав Іванович, Войтенко Зоя Всеволодівна, Карпусь Андрій Олегович, Єсипенко Олександр Адольфович, Кальченко Віталій Іванович
Формула / Реферат
(cS)-5,11,17,23-Тетра-трет.-бутил-25-гідрокси-26-гідроксикарбонілметокси-27,28-дипропоксикалікс[4]арен та (cR)-5,11,17,23-тетра-трет.-бутил-25-гідрокси-28-гідроксикарбонілметокси-26,27-дипропоксикалікс[4]арен загальної формули:
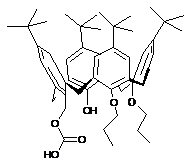
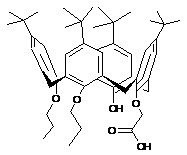 .
.
Текст
Реферат: (cS)-5,11,17,23-Тетра-трет.-бутил-25-гідрокси-26-гідроксикарбонілметокси-27,28дипропоксикалікс[4]арен та (cR)-5,11,17,23-тетра-трет.-бутил-25-гідрокси-28-гідроксикарбонілметокси-26,27-дипропоксикалікс[4]арен загальної формули: OH O O HO O O O O OH O O OH . UA 69322 U (12) UA 69322 U UA 69322 U Корисна модель належить до органічної хімії і стосується синтезу нових сполук енантіомерів внутрішньохіральної n-трет.-бутил-калікс[4]аренкарбонової кислоти загальної формули: O OH O O O OH O O O O OH HO 5 10 15 . Дані сполуки можуть застосовуватися як реагенти для синтезу різноманітних внутрішньохіральних похідних n-трет.-бутилкалікс[4]арену, а також для отримання каталізаторів асиметричного синтезу, хіральних стаціонарних фаз, енантіоселективних сорбентів та сенсорів. Названі сполуки, їх властивості і застосування в науковій літературі та патентних виданнях не описані. Із літератури відомо лише один приклад внутрішньохіральних n-трет.-бутилкалікс[4]аренів із кислотною групою на нижньому вінці [1]. Але п'ятистадійний синтез та низький вихід кінцевого продукту (5-8 %) не дозволяють одержувати ізомерно чисту цільову сполуку в препаративних кількостях. В основу корисної моделі поставлена задача одержати внутрішньохіральні енантіомерночисті похідні n-трет.-бутилкалікс[4]арену з вільною кислотною групою та фенольним гідроксилом на нижньому вінці макроциклічної платформи загальної формули: O OH O O O OH O O O O OH HO 20 25 30 . Наявність двох різних за властивостями функціональних груп робить такі сполуки цінними реагентами для одержання внутрішньохіральних оптичноактивних похідних n-трет.бутилкалікс[4]арену, а відпрацьовані методики дозволяють синтезувати цільові продукти в грамових кількостях. Спосіб отримання заявлених сполук полягає в послідовному регіоселективному алкілуванні n-трет.-бутил-тетрагідроксикалікс[4] арену. На першій стадії при дії пропілброміду в середовищі диметилсульфоксиду (ДМСО) та 40 %-го водного розчину гідроксиду натрію одержують проксимально заміщений дипропоксикалікс[4]арен [2]. На другій стадії алкілування (S)- або (R)N-(-фенілетил)бромацетамідом у диметилформаміді (ДМФА) в присутності гідроксиду барію як основи призводить до двох діастереомерних 1,2-дипропокси-3-N-(фенілетил)амінокарбонілметоксикалікс[4]аренів у співвідношенні 2:1. Кристалізацією з ацетонітрилу виділяють ту діастереомерну форму, яка знаходиться у надлишку. На третій стадії гідролізом індивідуальних ізомерів у бутанолі в присутності гідроксиду барію як основи одержують цільові продукти в оптично чистій формі. BrPr OH OH OH OH Ba(OH)2 BrCH2NHCH(Ph)Me OH OH O O OH O O O OH O HN O O O O HO . 1 UA 69322 U 1 5 10 15 20 25 30 35 40 45 50 55 60 13 Індивідуальність та склад синтезованих продуктів доведено результатами ІЧ, ЯМР Н та С спектроскопії, абсолютна конфігурація енантіомерів встановлена за допомогою рентгеноструктурного аналізу (РСА). Суть корисної моделі ілюструється методами одержання продуктів та фізико-хімічними характеристиками заявлених сполук. Приклад 1. 5,11,17,23-Тетра-трет.-бутил-27,28-дигідрокси-25,26-дипропоксикалікс[4]арен. Розчин 5,11,17,23-тетра-трет.-бутил-25,26,27,28-тетрагідроксикалікс[4]арену (4 г, 5,398 ммоль) в суміші ДМСО (25 мл) та 40 %-го водного розчину гідроксиду натрію (2,5 мл) перемішують 1 год. при 20 °C. Після цього додають пропілбромід (5 мл, 53,978 ммоль), піднімають температуру до 70-75 °C і перемішують 6 год. До реакційної суміші додають 5 %-й розчин соляної кислоти (60 мл), перемішують 3 год. при 20-25 °C, потім витримують 10 год. при 5-10 °C, фільтрують осад, гарно промивають водою та сушать. Після перекристалізації із ацетонітрилу (80 мл) одержують 3,62 г (91 %) білого твердого продукту. Методику взято із роботи [2]. Приклад 2. 5,11,17,23-Тетра-трет.-бутил-27-гідрокси-25,26-дипропокси-28-(S)-N-(-фенілетил)амінокарбонілметоксикалікс[4]арен. Розчин 5,11,17,23-тетра-трет.-бутил-27,28-дигідрокси-25,26-дипропоксикалікс[4]арену (0,500 г, 0,682 ммоль) та безводного Ва(ОН)2 (0,152 г, 0,887 ммоль) в 7 мл сухого ДМФА перемішують 30 хв. при 40 °C. Після охолодження до температури 20-25 °C додають (S)-N-(-фенілетил)бромацетамід (0,2 г, 0,826 ммоль) і перемішують при цій температурі 20-24 год. Після закінчення реакції до суміші додають воду (10 мл), конц. соляну кислоту до кислої реакції середовища, перемішують 5-10 хв. і екстрагують хлороформом (35 мл). Органічний розчин промивають водою (5 мл), сушать Na2SO4 та упарюють. Вихід маслоподібного продукту 0,62 г. Одержану суміш діастереомерів розчиняють в киплячому ацетонітрилі (9 мл) і витримують 20 год. при 5-6 °C. Випавший осад відфільтровують та перекристалізовують повторно із ацетонітрилу (4 мл). Виділяють діастереомерно чистий продукт з виходом 0,25 г (41 %). Тпл -1 1 107 °C (ацетонітрил). ІЧ (KBr), , см : 3350 (OH…OAlk), 3530 (NH), 1680 (C=O). H ЯМР (CDCl3), 3 , м.ч.: 0,58 (т, 3Н, ОСН2СН2СH3, J H-H=7,8 Гц), 0,86 (с, 9Н, t-Bu), 0,91 (с, 9H, t-Bu), 0,98 (т, 3Н, 3 3 ОСН2СН2СH3, J H-H=7,5 Гц), 1,27 (с, 9Н, t-Bu), 1,32 (с, 9Н, t-Bu), 1,55 (д, 3Н, СНСH3, J H-H=7,2 Гц), 2 2 1,73-1,91 (м, 4Н, ОСН2СH2СН3), 3,17 (д, 2Н, Аr-СH2-еq, J H-H=12,4 Гц), 3,22 (д, 1Н, Аr-СН2-eq, J H2 H=12,9 Гц), 3,37 (д, 1Н, Аr-СH2-еq, J H-H=13,.4 Гц), 3,71-3,91 (м, 4Н, ОСH2СН2СН3), 4,08 (д, 1Н, О2 2 2 СH2-СО, J H-H=16,0 Гц), 4,16 (д, 1Н, Аr-СH2-ах, J H-H=13,4 Гц), 4,31 (д, 1Н, Аr-СH2-ах, J H-H=2,9 Гц), 2 2 4,33 (д, 2Н, Аr-СH2-ах, J H-H=12,4 Гц), 4,73 (д, 1Н, О-СH2-СО, J H-H=16,0 Гц), 5,23-5,34 (м, 1H, СH), 4 4 5,75 (с, 1Н, ОН), 6,59 (д, 1Н, Аr-H, J H-H=2,4 Гц), 6,61 (д, 1H, Аr-H, J H-H=2,4 Гц), 6,67 (д, 1Н, Аr-H, 4 4 4 J H-H=2,4 Гц), 6,71 (д, 1Н, Ar-H, J H-H=2.4 Гц), 7,08 (с, 2Н, Аr-H), 7,09 (д, 1Н, Ar-H, J H-H=2,4 Гц), 4 7,11 (д, 1Н, Аr-H, J H-H=2,4 Гц), 7,26-7,31 (м, 1Н, Аr-H), 7,33-7,40 (м, 2Н, Аr-H), 7,49 (д, 2Н, Аr-H), 3 13 8,68 (д, 1Н, NH, J H-H=7,5 Гц). С NMR (CDCl3), , м.ч.: 9,43, 10,38, 22,01, 22,74, 23,08, 30,79, 30,80, 31,12 (2С), 31,16, 31,43, 31,49, 31,83, 33,47, 33,58, 33,72, 33,89, 48,56, 73,76, 75,93, 78,00, 124,96, 124,58, 124,37, 124,30, 125,08, 125,10, 125,12, 125,23, 126,20, 126,67, 128,05, 128,63, 130,08, 130,84, 131,11, 132,02, 132,57, 134,79, 135,23, 142,22, 142,95, 145,08, 145,23, 145,81, 149,45, 149,78, 151,22, 152,86, 168,69. Знайдено, %: С 79,16; Н 8,81; N 3,66. Розраховано C60H79NO5. CH3CN, %: С 79,44; Н 8,60; N 3,29. Приклад 3. 5,11,17,23-Тетра-трет.-бутил-28-гідрокси-25,26-дипропокси-27-(R)-Н-(-фенілетил)амінокарбонілметоксикалікс[4]арен. Розчин 5,11,17,23-тетра-трет.-бутил-27,28-дигідрокси-25,26-дипропоксикалікс[4]арену (0,500 г, 0,682 ммоль) та безводного Ва(ОН)2 (0,152 г, 0,887 ммоль) в 7 мл сухого ДМФА перемішують 30 хв. при 40 °C. Після охолодження до температури 20-25 °C додають (R)-N-(-фенілетил)бромацетамід (0,2 г, 0,826 ммоль) і перемішують при цій температурі 20-24 год. Після закінчення реакції до суміші додають воду (10 мл), конц. соляну кислоту до кислої реакції середовища, перемішують 5-10 хв. і екстрагують хлороформом (35 мл). Органічний розчин промивають водою (5 мл), сушать Na2SO4 та упарюють. Вихід маслоподібного продукту 0,62 г. Одержану суміш діастереомерів розчиняють в киплячому ацетонітрилі (9 мл) і витримують 20 год. при 5-6 °C. Випавший осад відфільтровують та перекристалізовують повторно із ацетонітрилу (4 мл). Виділяють діастереомерно чистий продукт з виходом 0.27 г (42 %). Фізичні властивості та спектральні характеристики повністю співпадають з продуктом, що описаний в прикладі 2. Приклад 4. 2 UA 69322 U 5 10 15 20 25 30 35 40 (cS)-5,11,17,23-Тетра-трет.-бутил-25-гідрокси-26-гідроксикарбонілметокси-27,28дипропоксикалікс[4]арен. До розчину 5,11,17,23-тетра-трет.-бутил-27-гідрокси-25,26-дипропокси-28-(S)-N-(-фенілетил)амінокарбонілметоксикалікс[4]арену (0,30 г, 0,335 ммоль) в н-бутанолі (15 мл) додають безводний гідроксид барію (0,590 г, 3,44 ммоль) і перемішують суміш при 110 °C протягом 25 год. Розчин упарюють в вакуумі, до сухого залишку додають 3 %-й розчин НСl (30 мл) і екстрагують продукт хлороформом (32 мл). Органічний розчин промивають водою (10 мл), насиченим розчином хлориду натрію (10 мл), сушать над Na2SO4 та упарюють. Твердий залишок розчиняють при кипінні в гексані (7 мл), розчин витримують 15 год. при 5 °C, фільтрують і упарюють. Отримують продукт у вигляді твердої речовини з виходом 0,14 г (52 %). -1 1 Тпл 117 °C (MeCN). ІЧ (СН2Сl2), , см : 3690 (СООН), 3600 (АrOН), 1750 (C=О). Н ЯМР (CDCl3), 3 3 , м.ч.: 0,98 (с, 9Н, t-Bu), 0,99 (т, 3Н, ОСН2СН2СH5, J H-H=7,3 Гц), 1,07 (т, 3Н, ОСН2СН2СH3, J HH=7,4 Гц), 1,16 (с, 18Н, t-Bu), 1,18 (с, 9Н, t-Bu), 1,87-2,00 (м, 2Н, ОСН2СH2СН3), 2,01-2,14 (м, 2Н, 2 2 ОСН2СH2СН3), 3,25 (д, 1Н, Аr-СH2-еq, J H-H=13,2 Гц), 3,30 (д, 2Н, Аr-СH.-eq, J H-H=12,5 Гц), 3,38 2 (д, 1H, Аr-СH2-еq, J H-H=13,4 Гц), 3,76-3,93 (м, 3Н, ОСH2СН2СН3), 4,12-4,20 (м, 1Н, ОСH2СН2СН3), 2 2 4,13 (д, 1Н, Аr-СH2-ах, J H-H=13,4 Гц), 4,20 (д, 1H, Аr-СH2-ах, J H-H=13,2 Гц), 4,31 (д, 1Н, Аr-СH22 2 2 ах, J H-H=12,5 Гц), 4,44 (д, 1Н, Аr-СH2-ах, J H-H=12,5 Гц), 4,50 (д, 1Н, О-СH2-СО, J H-H=15,8 Гц), 2 4 4,76 (д, 1Н, О-СH2-СО, J H-H=15,8 Гц), 6,80 (дд, 2Н, Аr-H), 6.90 (д, 1Н, Аr-H, J H-H = 2.4 Гц), 6.964 4 6.98 (м, 3Н, Аr-H), 7.03 (д, 1Н, Ar-H, J H-H = 2.4 Гц), 7.11 (д, 1Н, Аr-H, J H-H=2,4 Гц), 8,27 (с, 1Н, 13 ОН), 11,78-12,10 (шир.с, 1Н, СООH). С NMR (CDCl3), , м.ч.: 10,34, 10,36, 22,98, 23,30, 30,74, 31,26, 31,41, 31,46, 31,54, 31,66, 32,60, 33,13, 33,92, 33,98, 34,14, 34,22, 71,40, 76,94, 78,83, 124,87, 125,33, 125,35, 125,36, 125,38, 125,49, 125,97, 126,40, 128,22, 129,01, 132,67, 132,77, 132,93, 133,20, 134,45, 134,48, 142,46, 145,48, 146,83, 146,96, 148,73, 150,68, 150,94, 151,46, 170,65. Знайдено, %: С 79,03; Н 8,87. Розраховано С52Н70О6, %: С 78,95; Н 8,92. Приклад 5. (сR)-5,11,17,23-Тетра-трет.-бутил-25-гідрокси-28-гідроксикарбонілметокси-26,27дипропоксикалікс[4]арен. До розчину 5,11,17,23-тетра-трет.-бутил-28-гідрокси-25,26-дипропокси-27-(R)-N-(-фенілетил)амінокарбонілметоксикалікс[4]арену (0,30 г, 0,335 ммоль) в н-бутанолі (15 мл) додають безводний гідроксид барію (0,590 г, 3,44 ммоль) і перемішують суміш при 110 °C протягом 25 год. Розчин упарюють в вакуумі, до сухого залишку додають 3 %-й розчин НСl (30 мл) і екстрагують продукт хлороформом (32 мл). Органічний розчин промивають водою (10 мл), насиченим розчином хлориду натрію (10 мл), сушать над Na2SO4 та упарюють. Твердий залишок розчиняють при кипінні в гексані (7 мл), розчин витримують 15 год. при 5 °C, фільтрують і упарюють. Отримують продукт у вигляді твердої речовини з виходом 0,12 г (51 %). Фізичні властивості та спектральні характеристики повністю співпадають з продуктом, що описаний в прикладі 4. Джерела інформації: 1. Luo J., Zheng Qi-Yu, Chen Ch.-F., Huang Zh.-T. Synthesis and Optical Resolution of a Series of Inherently Chiral Calix[4]crowns with Cone and Partial Cone Conformations // Chem.Eur.J. - 2005. №11. - P. 5917-5928. 2. Boyko V.I., Podoprigorina A.A., Yakovenko A.V., Pirozhenko V.V., Kalchenko V.I. Alkylation of narrow rim calix[4]arenes in a DMSO-NaOH medium // J.Inclusion Phenom. - 2004. - Vol.50. - P. 193197. 45 ФОРМУЛА КОРИСНОЇ МОДЕЛІ 50 (cS)-5,11,17,23-Тетра-трет.-бутил-25-гідрокси-26-гідроксикарбонілметокси-27,28дипропоксикалікс[4]арен та (cR)-5,11,17,23-тетра-трет.-бутил-25-гідрокси-28-гідроксикарбонілметокси-26,27-дипропоксикалікс[4]арен загальної формули: 3 UA 69322 U OH O O O O O OH O O O OH HO Комп’ютерна верстка Л.Литвиненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 4 .
ДивитисяДодаткова інформація
Назва патенту англійською(cs)-5,11,17,23-tetra-tert-butyl-25-hydroxy-26-hydroxycarbonylmethoxy-27,28-dipropoxycalix[4]arene and (cr)-5,11,17,23-tetra-tert-butyl-25-hydroxy-28- hydroxycarbonylmethoxy-26,27- dipropoxycalix[4]arene
Автори англійськоюYesypenko Oleksandr Adolfovych, Boiko Viacheslav Ivanovych, Karpus Andrii Olehovych, Kalchenko Vitalii Ivanovych, Voitenko Zoia Vsevolodivna
Назва патенту російською(cs)-5,11,17,23-тетра-трет-бутил-25-гидрокси-26-гидроксикарбонилметокси-27,28-дипропоксикаликс[4]арен и (cr)-5,11,17,23-тетра-трет-бутил-25-гидрокси-28-гидроксикарбонилметокси-26,27-дипропоксикаликс-[4]арен
Автори російськоюЕсипенко Александр Адольфович, Бойко Вячеслав Иванович, Карпусь Андрей Олегович, Кальченко Виталий Иванович, Войтенко Зоя Всеволодовна
МПК / Мітки
МПК: C07C 231/20, C07C 51/06
Мітки: тетра-трет.-бутил-25-гідрокси-28-гідроксикарбонілметокси-26,27-дипропоксикалікс-[4]арен, сr)-5,11,17,23, сs)-5,11,17,23-тетра-трет.-бутил-25-гідрокси-26-гідроксикарбонілметокси-27,28-дипропоксикалікс[4]арен
Код посилання
<a href="https://ua.patents.su/6-69322-ss-5111723-tetra-tret-butil-25-gidroksi-26-gidroksikarbonilmetoksi-2728-dipropoksikaliks4aren-ta-sr-5111723-tetra-tret-butil-25-gidroksi-28-gidroksikarbonilmetoksi-2627-dipropoksik.html" target="_blank" rel="follow" title="База патентів України">(сs)-5,11,17,23-тетра-трет.-бутил-25-гідрокси-26-гідроксикарбонілметокси-27,28-дипропоксикалікс[4]арен та (сr)-5,11,17,23- тетра-трет.-бутил-25-гідрокси-28-гідроксикарбонілметокси-26,27-дипропоксикалікс-[4]арен</a>
Наступний патент: Валкова зубчаста дробарка для шматкових матеріалів
Випадковий патент: Фармацевтично активні сульфонамідні похідні










