Спосіб одержання периндоприлу високої чистоти і проміжних продуктів, корисних у його синтезі
Номер патенту: 77756
Опубліковано: 15.01.2007
Автори: Поркс-Маккей Марта, Сіміг Гайула, Мезей Тібор, Манді Аттіла
Формула / Реферат
1. Спосіб одержання сполуки формули І
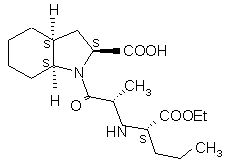 (І)
(І)
та трет-бутиламіннової солі формули I’
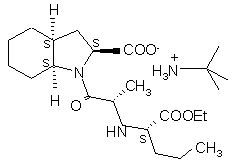 (I’),
(I’),
вільних від забруднень, одержуваних із дициклогексил карбодііміду, зокрема вільних від сполук формул VII' і VIII'
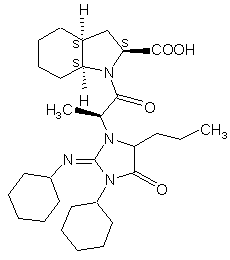 (VII’),
(VII’), 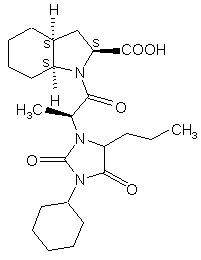 (VIII’),
(VIII’),
в якому сполуку формули II
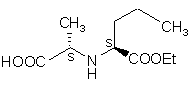 (II)
(II)
піддають реакції з відповідним похідним вугільної кислоти; одержану таким чином сполуку загальної формули III
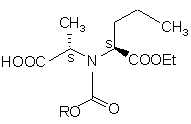 , (III)
, (III)
де R означає нижчий алкіл або арил-нижчий алкіл піддають активації тіонілхлоридом; одержану таким чином активовану сполуку піддають реакції зі сполукою формули IV
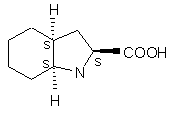 (IV)
(IV)
і, якщо бажано, одержану таким чином сполуку формули І піддають реакції з трет-бутиламіном.
2. Спосіб за п. 1, в якому як похідне вугільної кислоти використовують метилхлорформіат, етилхлорформіат, бензилхлорформіат або ди-трет-бутил дикарбонат.
3. Спосіб за будь-яким із пп. 1-2, в якому проводять ацилування сполуки формули II у присутності основи, переважно карбонату лужного металу, гідрокарбонату лужного металу або третинного аміну.
4. Спосіб за п. 3, в якому використовують карбонат натрію, карбонат калію або триетиламін як основу.
5. Спосіб за будь-яким із пп. 1-4, в якому проводять реакцію в інертному органічному розчиннику.
6. Спосіб за п. 5, в якому використовують галогенопохідне аліфатичного вуглеводню, ароматичного вуглеводню, складного ефіру або кетону як розчинник.
7. Спосіб за п. 6, в якому використовують ацетон як розчинник.
8. Спосіб за п. 1, в якому використовують тіоніл хлорид у молярному співвідношенні 1,1-2, переважно 1,5-1,7, по відношенню до 1 моля сполуки загальної формули III.
9. Спосіб за п. 8, в якому проводять активацію сполуки загальної формули III тіонілхлоридом в інертному органічному розчиннику.
10. Спосіб за п. 9, в якому використовують галогенпохідне аліфатичного вуглеводню, складного ефіру або простого ефіру як інертний органічний розчинник.
11. Спосіб за п. 10, в якому використовують дихлорметан.
12. Спосіб за п. 1, в якому проводять реакцію зі сполукою формули IV в інертному органічному розчиннику.
13. Спосіб за п. 12, в якому використовують галогенопохідне аліфатичного вуглеводню, складного ефіру або простого ефіру як інертний органічний розчинник.
14. Спосіб за п. 13, в якому використовують тетрагідрофуран або дихлорметан.
15. Сполуки загальної формули III
 , (III)
, (III)
де R означає нижчий алкіл або арил-нижчий алкіл.
16. Сполуки за п. 15, де R означає метил, етил, третинний бутил або бензил.
17. Спосіб одержання сполук загальної формули III, де R означає нижчий алкіл або арил-нижчий алкіл, в якому сполуку формули II піддають реакції з відповідним похідним вугільної кислоти.
18. Спосіб за п. 17, в якому використовують як похідне вугільної кислоти метилхлорформіат, етилхлорформіат, бензилхлорформіат або ди-трет-бутил дикарбонат.
19. Спосіб за будь-яким із пп. 17 або 18, в якому проводять ацилування сполуки формули II у присутності основи, переважно карбонату лужного металу, гідрокарбонату лужного металу або третинного аміну.
20. Спосіб за п. 19, в якому використовують карбонат натрію, карбонат калію або триетиламін як основу.
21. Спосіб за будь-яким із пп. 17-20, в якому проводять реакції в інертному органічному розчиннику.
Текст
1. Спосіб одержання сполуки формули І 3 77756 4 жно 1,5-1,7, по відношенню до 1 моля сполуки заде R означає нижчий алкіл або арил-нижчий алкіл. гальної формули III. 16. Сполуки за п.15, де R означає метил, етил, 9. Спосіб за п.8, в якому проводять активацію спотретинний бутил або бензил. луки загальної формули III тіонілхлоридом в інерт17. Спосіб одержання сполук загальної формули ному органічному розчиннику. III, де R означає нижчий алкіл або арил-нижчий 10. Спосіб за п.9, в якому використовують галогеналкіл, в якому сполуку формули II піддають реакції похідне аліфатичного вуглеводню, складного ефіз відповідним похідним вугільної кислоти. ру або простого ефіру як інертний органічний роз18. Спосіб за п.17, в якому використовують як починник. хідне вугільної кислоти метилхлорформіат, етил11. Спосіб за п.10, в якому використовують дихлохлорформіат, бензилхлорформіат або ди-третрметан. бутил дикарбонат. 12. Спосіб за п.1, в якому проводять реакцію зі 19. Спосіб за будь-яким із пп.17 або 18, в якому сполукою формули IV в інертному органічному проводять ацилування сполуки формули II у прирозчиннику. сутності основи, переважно карбонату лужного 13. Спосіб за п.12, в якому використовують галометалу, гідрокарбонату лужного металу або трегенопохідне аліфатичного вуглеводню, складного тинного аміну. ефіру або простого ефіру як інертний органічний 20. Спосіб за п.19, в якому використовують карборозчинник. нат натрію, карбонат калію або триетиламін як 14. Спосіб за п.13, в якому використовують тетраоснову. гідрофуран або дихлорметан. 21. Спосіб за будь-яким із пп.17-20, в якому прово15. Сполуки загальної формули III дять реакції в інертному органічному роз-чиннику. CH3 HOOC s N RO s CH 3 COOEt O , (III) Даний винахід стосується процесу приготування периндоприлу високої чистоти і проміжних продуктів, корисних у синтезі периндоприлу. Конкретніше, даний винахід стосується процесу синтезу периндоприлу високої чистоти, вільного від певних забруднень, проміжних продуктів, корисних у цьому синтезі, і процесу приготування зазначених проміжних продуктів. Периндоприл особливо його третбутиламінна сіль - має корисні фармакологічні властивості. Основною активністю периндоприлу є інгібування перетворення ферменту ангіотензину І (або кінінази II) на октапептид ангіотензин II; таким чином, він є інгібітором АПФ (ангіотензин перетворюючого ферменту). Ви щезгаданий сприятливий вплив периндоприлу робить можливим застосування цього активного інгредієнта у лікуванні серцево-судинних захворювань, зокрема, артеріальної гіпертензії і серцевої недостатності. Периндоприл вперше згадується [в ЕР 0049658]. Проте синтез периндоприлу не проілюстрований прикладами. Синтез периндоприлу в промисловому масштабі описаний [в ЕР 0 308 341]. Структури сполук формул І-ХІІ, I', VII' і VIII' описані у додатку. Відповідно до цього процесу, сполука формули V реагує зі сполукою формули II у присутності дициклогексил карбодііміду і 1-гідроксибензотриазолу, після чого бензиловий ефір формули VI дебензилюють із одержанням периндоприлу формули І, який потім перетворюють на сіль формули Г за допомогою реакції з трет-бутиламіном. Недоліком цього процесу є те, що чистота периндоприлу, одержаного таким чином, не є задовільною, і з цієї причини необхідний ряд стадій очищення, щоб забезпечити продукт, який відповідає жорстким вимогам до якості фармацевтично активних інгредієнтів. Причиною зазначеного недоліку є те, що реакцію зв'язування сполук формул V і II проводять у присутності дициклогексил карбодііміду, який призводить до утворення значної кількості забруднень бензилових ефірів формул VII і VIII, які перетворюють за допомогою дебензилювання на сполуки формул VII' і VIII'. Видалення зазначених забруднень пов'язане із значними труднощами. Відповідно до неопублікованої французької патентної заявки 01,09839, дигідроіндол-2карбонова кислота або її ефір загальної формули IX (де R1 означає водень або нижчий алкіл, що містить 1-6 атомів вуглецю) реагує зі сполукою загальної формули X (де R2 є амінозахисною групою) в органічному розчиннику, за відсутності або у присутності не більше ніж 0,6 молів 1-гідроксибензотриазолу, по відношенню до 1 моля сполуки загальної формули IX, і 1-1,2 молів дициклогексил карбодііміду, по відношенню до 1 моля сполуки формули IX, піддаючи одержану таким чином сполуку загальної формули XI (де R1 і R2 є такими, як зазначено вище) каталітичному гідруванню і перетворюючи одержану таким чином сполуку формули XII (де R1 і R2 є такими, як зазначено вище) на периндоприл у відомий спосіб. Метою даного винаходу є забезпечення процесу приготування периндоприлу високої чистоти, вільного від забруднень, одержуваних із дициклогексил карбодііміду, зокрема, сполук формул VII' і VIII'. Вищезазначена мета задовольняється за допомогою процесу і нових проміжних сполук за да 5 77756 6 ним винаходом. ксил карбодііміду. Відповідно до аспекту даного винаходу, тут Синтез пептидного зв'язку звичайно включає представлена 1-{2(S)-[1(S)реакцію амінокислоти з активованою карбоксиль(етоксикарбоніл)бутиламіно]пропіоніл}ною групою і захищеною аміногрупою з амінокис(3аS,7аS)октагідроіндол-2(S)-карбонова кислота лотою із захищеною карбоксильною групою. Хлоформули І та її трет-бутиламінна сіль формули I', риди N-ацил, або, конкретніше, N-алкоксикарбоніл вільні від забруднень, одержуваних із дициклогекамінокислот (одержувані з кислот формули III) сил карбодііміду. являють собою одну з класичних груп похідних Відповідно до окремого втілення вищезазнаамінокислот з активованою карбоксильною групою ченого аспекту даного винаходу, тут представлена і захищеною аміногрупою. 1-{2(S)-[1(S)Відомі два способи утворення пептидного зв'я(етоксикарбоніл)бутиламіно]пропіоніл}зку, починаючи з хлоридів N-алкоксикарбоніл амі(3аS,7аS)октагідроіндол-2(S)-карбонова кислота нокислот [див. Houben-Weyl: Methoden der Orформули І та її трет-бутиламінна сіль формули I', ganischen Chemie Band ХУЛІ, pp.355-363]: вільні від сполук формул VII' і VIII'. - реакція з ефірами амінокислот в органічному Відповідно до подальшого аспекту даного вирозчиннику у присутності еквівалентної основи, находу, тут представлений процес приготування - реакція з амінокислотами у лужному водному сполуки формули І та її трет-бутиламінної солі розчині (за умов Schotten-Baumann). формули I', вільних від забруднень, одержуваних У сучасній практиці хлориди амінокислот розіз дициклогексил карбодііміду, зокрема, вільних від глядають як над-реакційноздатні сполуки, що присполук формул VII' і VIII', який включає реакцію зводять до небажаних побічних реакцій, тому песполуки формули II з відповідним похідним вугільреважними є альтернативні способи ної кислоти; активацію одержаної таким чином карбоксильної активації, наприклад, використання сполуки загальної формули III (де R означає нижΝ,Ν'-дициклогексил-карбодііміду [див. R.C. чий алкіл або арил-нижчий алкіл) тіоніл хлоридом; Sheppard: Peptide Synthesis in Comprehensive Orреакцію одержаної таким чином активованої споganic Chemistry, Vоl.5, pp.339-352, edited by E. луки зі сполукою формули IV і, якщо бажано, реакHaslam, Pergamon Press, Oxford, 1994]. цію одержаної таким чином сполуки формули І з Даний винахід базується на усвідомленні того, трет-бутиламіном. що нові N-алкокси(аралкокси)карбоніл амінокислоВідповідно до ще подальшого аспекту даного ти загальної формули III можуть бути успішно аквинаходу, тут представлені сполуки загальної фотивовані тіоніл хлоридом, і одержане таким чином рмули III (де R означає нижчий алкіл або арилактивоване похідне карбонової кислоти переважно нижчий алкіл). може бути використане для ацилювання амінокисВідповідно до ще подальшого аспекту даного лоти формули IV в органічному розчиннику з утвовинаходу, тут представлений процес приготування ренням необхідної сполуки формули І за одну реасполук загальної формули III (де R означає нижчий кційну стадію. Це усвідомлення є несподіваним у алкіл або арил-нижчий алкіл), який включає реакдекількох відношеннях: реакцію проводять в оргацію сполуки формули II з відповідним похідним нічному розчиннику за відсутності основи, і не в вугільної кислоти. лужному розчині, як пропонується прототипом; Відповідно до ще подальшого аспекту даного "над-реакційноздатний" характер хлоридів аміновинаходу, тут представлені фармацевтичні компокислот, згаданий вище, не призводить до незручзиції, які містять 1-{2(S)-[1(S)них побічних реакцій, і алкокси(аралкокси)карбоніл (етоксикарбоніл)бутиламіно]-пропіоніл}захисна група видаляється під час процесу утво(3аS,7аS)октагідроіндол-2(S)-карбонову кислоту рення пептиду. Це усвідомлення є поготів несподіформули І та її трет-бутиламінну сіль формули I', ваним, оскільки у всіх розкритих у даний час синвільні від забруднень, одержуваних із дициклогектезах периндоприлу похідне вугільної кислоти сил карбодііміду, як активний інгредієнт у суміші з завжди активувалося дициклогексил карбодііміпридатними інертними фармацевтичними носіями. дом, що спричиняло утворення небажаних забруВідповідно до ще подальшого аспекту даного днень. Використання тіоніл хлориду як активуючої винаходу, тут представлене використання 1-{2(S)речовини є дуже корисним. З одного боку, не [1(S)-(етоксикарбоніл)бутиламіно]пропіоніл}утворюється жодних важко усувних побічних про(3аS,7аS)-октагідроіндол-2(S)-карбонової кислоти дуктів, тоді як з іншого боку газоподібні хлоровоформули І та її трет-бутиламінної солі формули I', день і діоксид сірки, утворювані в реакції, легко вільних від забруднень, одержуваних із дициклогеможуть бути видалені з реакційної суміші. ксил карбодііміду, як фармацевтично активного Визначення, використовувані у патентному інгредієнта, особливо як інгібітора ангіотензин пеописі і формулі винаходу, мають бути інтерпреторетворюючого ферменту. вані як викладено нижче. Відповідно до ще подальшого аспекту даного Термін "нижчий алкіл" включає алкільні групи з винаходу, тут представлений спосіб лікування гіпрямим або розгалуженим ланцюгом, що містять пертензії, який включає призначення пацієнту, 1-6 атомів вуглецю (наприклад, метил, етил, някий потребує такого лікування, фармацевтично пропіл, ізопропіл, н-бутил, вторинний бутил, треактивної кількості 1-{2(S)-[1(S)тинний бутил, н-пентил, н-гексил і т.п.), переважно, (етоксикарбоніл)бутиламіно]пропіоніл}метил, етил або третинний бутил. (3аS,7аS)октагідроіндол-2(S)-карбонової кислоти Термін "аралкіл" включає алкільні групи, такі формули І та її трет-бутиламінної солі формули I', як вище визначені, заміщені однією або двома вільних від забруднень, одержуваних із дициклогеарильними групами (наприклад, бензилом, бета 7 77756 8 феніл-етилом, бета-бета-дифеніл-етилом і т.п.; клад, дихлорметан, дихлоретан або хлороформ), переважно, бензилом). складні ефіри (наприклад, етилацетат) або прості Відповідно до першої стадії синтезу периндопефіри (наприклад, діетиловий ефір, тетрагідрофурилу за даним винаходом, сполуку формули II ран, діоксан). Особливо переважно можна провоацилюють відповідним похідним вугільної кислоти. дити реакцію у дихлорметані як середовищі. РеакПроцес проводять у спосіб, відомий як такий. Як цію проводять при температурі від 0°С до 30°С, похідні вугільної кислоти переважно можуть бути зокрема, при температурі навколишнього середовикористані відповідні алкілхлорформіати або діавища. Можна діяти переважно шляхом приготулкіл-дикарбонати. Метоксикарбонільна, етоксикавання реакційної суміші при низькій температурі 0рбонільна і бензилоксикарбонільна групи можуть 5°С, після цього даючи змогу реакційній суміші бути введені переважно за допомогою метилхлонагрітися до температури навколишнього середорформіату, етилхлорформіату і бензилхлорформівища і проводячи реакцію при цій температурі ату, відповідно. Третинна бутоксикарбонільна групротягом декількох годин. По закінченні активації па може бути введена переважно шляхом тіоніл хлоридом надлишок тіоніл хлориду видалявикористання ди-третинного бутилдикарбонату. ють разом із хлороводневою кислотою і діоксидом Реакцію ацилювання проводять в інертному оргасірки. нічному розчиннику і в присутності основи. Як інеАктивована сполука, одержана зі сполуки зартні органічні розчинники можуть бути використані гальної формули III, реагує зі сполукою формули переважно галогенпохідні аліфатичних вуглеводIV. Сполука формули IV є пергідроіндол-2нів (наприклад, дихлорметан, дихлоретан або карбоновою кислотою. Цю реакцію проводять в хлороформ), складні ефіри (наприклад, етилацеінертному органічному розчиннику. Як реакційне тат) або кетони (наприклад, ацетон). Як розчинник середовище можуть бути використані переважно можна використовува ти переважно ацетон. Реакгалогенпохідні аліфатичних вуглеводнів (наприція може бути проведена у присутності неорганічклад, дихлорметан, дихлоретан або хлороформ), ної або органічної основи. Як неорганічні основи складний ефір (наприклад, етилацетат) або просможуть бути використані переважно карбонати тий ефір (наприклад, діетиловий ефір, тетрагідлужних металів (наприклад, карбонат натрію або рофуран або діоксан). Переважно можна проводикарбонат калію) або гідрокарбонати лужних метати реакцію у тетрагідрофурані або дихлорметані лів (наприклад, гідрокарбонат натрію або гідрокаяк середовищі. Реакцію проводять при нагріванні, рбонат калію). Як органічні основи можуть бути переважно при температурі кипіння реакційної використані переважно триалкіламіни (наприклад, суміші, переважно зі зворотним холодильником. триетиламін) або піридин. Як основу можна викоРеакція проходить в межах декількох годин. Спористовувати переважно карбонат лужного металу луку формули IV використовують у кількості 0,5або триетиламін. 0,9, переважно 0,7-0,8 молів, по відношенню до 1 Реакцію проводять переважно при температумоля сполуки загальної формули III. По закінченні рі від 0°С до 30°С, зокрема, при температурі нареакції ацилювання реакційну суміш концентрують вколишнього середовища. Можна діяти переважно у вакуумі. шляхом приготування реакційної суміші при низьПериндоприл формули І може бути перетвокій температурі, приблизно 0-5°С, потім даючи рений на трет-бутиламінну сіль формули Г за дозмогу реакційній суміші нагрітися до температури помогою реакції з трет-бутиламіном. Утворення навколишнього середовища і проводячи реакцію солі може бути проведене у спосіб, відомий як при цій температурі протягом декількох годин. такий. Реакцію утворення солі проводять в інертРеакційну суміш готують у звичайний спосіб. ному органічному розчиннику, переважно етилаМожна діяти переважно шляхом обробки реакційцетаті. Трет-бутиламін використовують переважно ної суміші після упарювання з кислотою, екстрагуу приблизно еквімолярній кількості. вання суміші органічним розчинником, екстрагу1-{2(S)-[1(S)вання органічної фази водним розчином (етоксикарбоніл)бутиламіно]пропіоніл}гідроксиду лужного металу, підкислення водного (3аS,7аS)октагідроіндол-2(S)-карбонова кислота шару та екстрагування одержаної сполуки загальформули І та її трет-бутиламінна сіль формули I', ної формули III в органічний розчинник. Одержавільні від забруднень, одержуваних із дициклогекний при упарюванні органічної фази сирий продукт сил карбодііміду, можуть бути застосовані в терапії безпосередньо може бути використаний для подау формі фармацевтичних композицій. Приготуванльшої реакції без будь-якого очищення. ня зазначених фармацевтичних композицій, лікарОдержані таким чином сполуки загальної фоських форм і схема добового дозування є подібрмули III є новими і також є предметом даного ними до тих, які описані у прототипі для композиції винаходу. і фармацевтичного застосування периндоприлу. Згідно з наступною стадією синтезу периндопВихідний матеріал формули II [описаний у ЕР рилу за даним винаходом, сполуку загальної фор0 308 340, ЕР 0 308 341 і ЕР 0 309 324]. Кислота мули III активують тіоніл хлоридом. На цій стадії формули IV [описана в ЕР 0 308 339 і ЕР 0 тіоніл хлорид використовують у надлишку, пере308 341]. важно у молярному співвідношенні 1,1-2 - особлиПеревагою даного винаходу є те, що він заво 1,5-1,7 - по відношенню до 1 моля сполуки забезпечує периндоприл високої чистоти, вільний від гальної формули III. Реакцію проводять в забруднень, одержуваних із дициклогексил карбоінертному органічному розчиннику. Як реакційне дііміду. Цей процес є простим і легко може бути середовище можуть бути використані переважно здійснений у промисловому масштабі. Особливою галогенпохідні аліфатичних вуглеводнів (наприперевагою даного винаходу є те, що повністю ви 9 77756 10 ключається використання дициклогексил карбодіісередовища розчинник випарювали і залишок пеміду, і тому не існує навіть теоретичної можливості ремішували з сумішшю води (40мл) і концентроваутворення забруднень, які можуть бути одержані з ної хлороводневої кислоти (0,4мл) протягом 8 годициклогексил карбодііміду. Додаткова перевага: дин при температурі навколишнього середовища. ацилювання може бути проведене з кислотою фоСуміш екстрагували етилацетатом (40мл), і розчин рмули IV. За хист карбоксильної групи не потрібв етилацетаті екстрагували холодним водним розний. чином гідроксиду натрію [приготованим з льоду Додаткові подробиці даного винаходу можуть (20г) і водного розчину гідроксиду натрію (1н., бути знайдені у наступних прикладах, без обме40мл)]. До водного шару додавали концентровану ження обсягу патентного захисту зазначеними хлороводневу кислоту (3мл) і суміш екстрагували прикладами. етилацетатом (40мл). Після сушіння та упарюванПриклади ня одержували N-[2-(етоксикарбоніл)бутил]-NПриготування N-[2-(етоксикарбоніл)бутил]-Nметоксикарбонілаланін (3,84г, 70%) у вигляді масалкоксикарбонілаланіну ла жовтого кольору, яке може бути використане у Приклад 1 наступній реакції без додаткового очищення. N-[2-(етоксикарбоніл)бутил]-NІЧ (плівка): ~3400 (ОН ст), 1713 (С=О ст), 1294 етоксикарбонілаланін (ОН у площині b), 1205 (С-O ст ефір) см -1. 1 До суспензії N-[2H-ЯМР (CDCI3, ТМС, 400МГц): δ -10,2 (1Н, бс, (етоксикарбоніл)бутил]аланіну (21,7г, 100ммоль) в COOH), 5,00 і 4,60 (1Н, с, СН-СН2-СН2-СН3), 4,28 ацетоні (250мл) додавали розчин триетиламіну (2Н, кв, J=7,2Гц, О-СН 2-СН3), 3,96 і 3,85 (1Н, м, (27,7мл, 20,2г, 200ммоль) в ацетоні (50мл), супроСН-СН3), 3,75 (3Н, с, ОСН3), [2,10-1,98 (1Н, м) і воджуючи додаванням етилхлорформіату (24,8мл, 1,74-1,62 (1Н, м) СН-СН2-СН2-СН3], 1,56-1,42 (2Н, 28,2г, 260ммоль) при 0-5°С. Після перемішування м, СН-СН2-СН2-СН3), 1,50 (3Н, д, J=6,9Гц, СНпротягом 2 годин при температурі навколишнього СН3), 1,33 (ЗН, т, J=7,2Гц, О-СН 2-СН3), 0,99 (3Н, т, середовища розчинник випарювали, і залишок J=7,3Гц, СН-СН 2-СН2-СН3). перемішували з сумішшю води (200мл) і концентПриклад 3 рованої хлороводневої кислоти (2мл) протягом 8 N-[2-(етоксикарбоніл)бутил]-N-третгодин при температурі навколишнього середовибутилоксикарбонілаланін ща. С уміш екстрагували етилацетатом (200мл), і До суспензії N-[2розчин в етилацетаті екстрагували холодним вод(етоксикарбоніл)бутил]аланіну (1,1г, 5ммоль) і каним розчином гідроксиду натрію [приготованим з рбонату калію (0,76г, 5,5ммоль) в ацетоні (15мл) льоду (100г) і водного розчину гідроксиду натрію додавали ди-трет-бутил дикарбонат (1,20г, (1н., 200мл)]. До водного шару додавали концент5,5ммоль) і воду (1,25мл) при 0-5°С. Після переровану хлороводневу кислоту (15мл) і суміш екстмішування протягом 2 годин при температурі нарагували етилацетатом (200мл). Після сушіння та вколишнього середовища суміш о холоджували і упарювання одержували N-[2твердий осад відфільтровували. Додавали етила(етоксикарбоніл)бутил]-N-етоксикарбонілаланін цетат (15мл), лід (5г) і водний розчин NaOH (1н., (23,8г, 82%) у вигляді масла жовтого кольору, яке 10мл). Після перемішування протягом 5 хвилин може бути використане у наступній реакції без шари розділяли. До водного шару додавали кондодаткового очищення. центровану хлороводневу кислоту (1,5мл) і суміш ІЧ (плівка): 3500-2400 (ОН ст), 1709 (С=О ст), екстрагували етилацетатом (15мл). Після сушіння ~1200 (С-O ст), 898 (ОН поза площиною b), см -1. та упарювання одержували N-[21 Н-ЯМР (CDCI3, ТМС, 400МГц): δ 10,14 (1Н, бс, (етоксикарбоніл)бутил]-N-третСООН), 4,99 і 4,58 (1Н, дд, J=4,5, 10,0Гц, N-CHбутилоксикарбонілаланін (0,61г, 38%) у вигляді CH2-CH2-CH3), 4,29 (2Н, кв, J=7,1Гц, N-C(O)-O-CH 2масла жовтого кольору, яке може бути використаCH3), 4,24-4,13 (2H, м, СН-С(О)-О-СН2-СН3), 3,84 не у наступній реакції без додаткового очищення. (1Н, кв, J=6,9Гц, СН3-СН), [2,08-1,97 (1Н, м) і 1,74ІЧ (KВr): ~3400 (ОН ст), 1705 (C=O ст кислота), 1,62 (1Н, м) N-CH-CH2-CH2-CH3], 1,56-1,42 (2Н, м, 1299 (ОН у площині b), ~1690 (C=О ст амід), 1771 N-CH-CH2-CH2-СН3), 1,51 (3Н, д, J=6,9Гц, СН3-СН), (C=О ст ефір), 1159 (С=O ст ефір) см -1. 1 1,33 (3Н, т, J-7,2Гц, СН-С(О)-О-СН2-СН3), 1,27 (3Н, H-ЯМР (CDCI3, ТМС, 400МГц): δ ~9,2 (1Н, бс, т, J=7,1Гц, N-C(O)-O-CH 2-CH3), 0,99 (3Н, т, COOH), 5,00 (1Н, дд, J=4,4, 10,2Гц, СН-СН 2-СН2J=7,3Гц, N-CH-CH2-CH2-СН3). СН3), 4,29 (2Н, кв, J=7,1Гц, О-СН 2-СН3), 3,69 (1Н, 13 С-ЯМР (CDCI3, ТМС, 400МГц): δ 176,4 і кв, J=6,8Гц, СН-СН3), [2,10-1,98 (1Н, м) і 1,70-1,56 175,8, 172,5, 155,8, 63,0, 62,7, 58,9, 53,8, 31,4, 19,8, (1Н, м), СН-СН2-СН2-СН3], 1,56-1,42 (2Н, м, СН16,6, 14,0, 13,9, 13,5. (сигнали головного ротамеСН2-СН2-СН3), 1,49 (3Н, д, J=6,8Гц, СН-СН3), 1,46 ра). (9Н, с, С(СН3)3), 1,34 (3Н, т, J=7,1Гц, О-СН 2-СН3), Приклад 2 0,99 (3Н, т, J=7,3Гц, CH-CH 2-CH2CH3). N-[2-(етоксикарбоніл)бутил]-NПриклад 4 метоксикарбоніланін N-[2-(етоксикарбоніл)бутил]-NДо суспензії Ν-[2бензилоксикарбонілаланін (етоксикарбоніл)бутил]аланіну (4,35г, 20ммоль) в До суспензії N-[2ацетоні (50мл) додавали розчин триетиламіну (етоксикарбоніл)бутил]аланіну (2,2г, 10ммоль) і (5,5мл, 4,05г, 40ммоль) в ацетоні (10мл), супровокарбонату калію (2,2г, 16ммоль) у суміші ацетону джуючи додаванням метилхлорформіату (4,0мл, (30мл) і води (2,5мл) додавали бензилхлорформі4,91г, 52ммоль) при 0-5°С. Після перемішування ат (2,0мл, 2,4г, 14ммоль) при 0-5°С. Після переміпротягом 2 годин при температурі навколишнього шування протягом 2 годин при температурі навко 11 77756 12 лишнього середовища тверду речовину відфільтприкладу 5, використовуючи N-[2ровували, розчинник випарювали, залишок пере(етоксикарбоніл)бутил]-N-метоксикарбонілаланін мішували з холодним водним розчином гідроксиду (3,4г, 12,5ммоль) і пергідроіндол-2-карбонову киснатрію [приготованим з льоду (20г) і водного розлоту (1,7г, 10ммоль). Одержаний кристалічний чину гідроксиду натрію (1н., 40мл)] і екстрагували продукт фільтрували з одержанням периндоприлу етилацетатом (40мл). Водний шар підкислювали ебурміну (2,4г, 54%). водним розчином хлороводневої кислоти 1:1 Приклад 7 (20мл) і суміш екстрагували етилацетатом (40мл). Лцилювання пергідроіндол-2-карбонової кисПісля сушіння та упарювання одержували N-[2лоти з використанням N-[2-(етоксикарбоніл)бутил](етоксикарбоніл)бутил]-NНN-трет-бутоксикарбонілаланіну бензилоксикарбонілаланін (1,66г, 47%) у вигляді Периндоприл ебурмін готували аналогічно до масла жовтого кольору, яке може бути використаприкладу 5, використовуючи N-[2не у наступній реакції без додаткового очищення. (етоксикарбоніл)бутил]-N-третІЧ (плівка): ~3400 (ОН ст), 1710 (C=О ст), 699 бутоксикарбонілаланін (0,69г, 2,2ммоль) і пергідро(СН аром.) см -1. індол-2-карбонову кислоту (0,29г, 1,7ммоль). Оде1 Н-ЯМР (CDCI3, ТМС, 400МГц): δ ~9,0 (1Н, бс, ржаний кристалічний продукт фільтрували з одерСООН), 5,00 (5Н, м, Ph), 5,2-5,1 (2Н, м, Ph-CH 2), жанням периндоприлу ебурміну (0,37г, 49%). 4,96 і 4,57 (1Н, дд, J=9,6, 4,8, N-CH-CH2-CH2-CH3), Приклад 8 4,26 і 4,12 (2Н, кв, J=7,1Гц, О-СН 2-СН3), 4,02 і 3,89 Ацилювання пергідроіндол-2-карбонової кис(1Н, кв, J=6,9Гц, СН-СН 3), [2,10-1,93 (1Н, м) і 1,72лоти з використанням N-[2-(етоксикарбоніл)бутил]1,62 (1Н, м), СН-СН2-СН2-СН3], 1,54 і 1,48 (3Н, д, N-бензилоксикарбонілаланіну J=7,0Гц, СН-СН3), 1,56-1,42 (2H, м, СН-СН2-СН2Периндоприл ебурмін готували аналогічно до СН3), 1,31 і 1,22 (3Н, т, J=7,2Гц, О-СН2-СН3), 0,98 і прикладу 5, використовуючи N-[20,93 (3Н, т, J=7,3Гц, СН-СН 2-СН2-СН3). (етоксикарбоніл)бутил]-NПриготування периндоприлу ебурміну бензилоксикарбонілаланін (1,41г, 4ммоль) і пергіПриклад 5 дроіндол-2-карбонову кислоту (0,51г, 3ммоль). Ацилювання пергідроіндол-2-карбонової кисОдержаний кристалічний продукт фільтрували з лоти з використанням N-[2-(етоксикарбоніл)бутил]одержанням периндоприлу ебурміну (0,60г, 45%). N-етоксикарбонілаланіну Приклад 9 До розчину N-[2-(етоксикарбоніл)бутил]-NАцилювання пергідроіндол-2-карбонової кисетоксикарбонілаланіну (10,1г, 35ммоль) у дихлорлоти з використанням N-[2-(етоксикарбоніл)бутил]метані (35мл) по краплях додавали тіоніл хлорид N-етоксикарбонілаланіну (4,2мл, 6,9г, 58ммоль) при 0-5°С. Розчин переміДо розчину N-[2-(етоксикарбоніл)бутил]-Nшували при температурі навколишнього середоетоксикарбонілаланіну (1,45г, 5ммоль) у дихлорвища протягом 2-3 годин. Розчинник випарювали з метані (7,5мл) по краплях додавали тіоніл хлорид одержанням масла червонуватого кольору. Зали(0,6мл, 0,98г, 8,5ммоль) при 0-5°С. Розчин перешок розчиняли у тетрагідрофурані (37,5мл) і його мішували при температурі навколишнього середододавали до суспензії пергідроіндол-2-карбонової вища протягом 2-3 годин. Надлишок тіоніл хлорикислоти (4,7г, 28ммоль) у тетрагідрофурані ду та утворювані діоксид сірки і хлороводень (37,5мл). Суспензію нагрівали зі зворотним холовидаляли при незначному вакуумі. До одержаного дильником при перемішуванні протягом 4-4,5 готаким чином дихлорметанового розчину додавали дин до утворення розчину коричнюватого кольору. пергідроіндол-2-карбонову кислоту (0,71г, Після випарювання розчинника залишок розчиня4,2ммоль) і дихлорметан (5,0мл). Суспензію нагріли в етилацетаті (120мл), до розчину, що перемівали зі зворотним холодильником при перемішушується, повільно додавали трет-бутиламін ванні протягом 2 годин до утворення розчину ко(2,8мл, 1,95г, 27ммоль) в етилацетаті (60мл), що ричнюватого кольору. Після випарювання призводило до відділення кристалічної маси. Сурозчинника залишок розчиняли в етилацетаті міш нагрівали до утворення розчину, потім оброб(20мл), після чого до розчину, що перемішується, ляли вугіллям. Кристалічний продукт, одержаний повільно додавали трет-бутиламін (0,42мл, 0,29г, після охолодження, фільтрували з одержанням 4,05ммоль) в етилацетаті (5,0мл), що призводило периндоприлу ебурміну (6,8г, 55%). до відділення кристалічної маси. Суміш нагрівали Приклад 6 до утворення розчину, потім обробляли вугіллям. Ацилювання пергідроіндол-2-карбонової кисКристалічний продукт, одержаний після охололоти з використанням N-[2-(етоксикарбоніл)бутил]дження, фільтрували з одержанням периндоприлу N-метоксикарбонілаланіну ебурміну (0,64г, 35%). Периндоприл ебурмін готували аналогічно до Комп’ютерна в ерстка Т. Чепелев а Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for preparation of highly purified perindopril and intermediates useful for its synthesis
Автори англійськоюMezei Tibor, Mandi Attila
Назва патенту російськоюСпособ получения периндоприла высокой чистоты и промежуточных продуктов его синтеза
Автори російськоюМезей Тибор, Манди Аттила
МПК / Мітки
МПК: C07D 209/42, A61K 31/404, A61P 9/12, A61P 43/00
Мітки: високої, проміжних, спосіб, одержання, чистоти, периндоприлу, продуктів, синтезі, корисних
Код посилання
<a href="https://ua.patents.su/6-77756-sposib-oderzhannya-perindoprilu-visoko-chistoti-i-promizhnikh-produktiv-korisnikh-u-jjogo-sintezi.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання периндоприлу високої чистоти і проміжних продуктів, корисних у його синтезі</a>
Попередній патент: Пристрій кріплення статора у пласкому двигуні ліфта
Наступний патент: Інгібітори катепсин цистеїн протеази, фармацевтична композиція на їх основі та спосіб її одержання
Випадковий патент: Пристрій для безперервного визначення енергетичного обміну організму










