Спосіб стабілізації рекомбінантного штаму бактерій escherichia coli за ознакою “продукція аргініндезімінази mycoplasma hominis”
Номер патенту: 87054
Опубліковано: 27.01.2014
Автори: Фаюра Любов Романівна, Сибірний Андрій Андрійович, Пиняга Юрій Володимирович, Борецький Юрій Романович
Формула / Реферат
Спосіб стабілізації рекомбінантного штаму бактерій Escherichia coli за ознакою "продукція аргініндезімінази Mycoplasma hominis", який відрізняється тим, що для селекції трансформантів, їх зберігання та вирощування стартової культури продуцента АДI використовується LB середовище з додатком 0,2 % аргініну і 0,5 % глюкози.
Текст
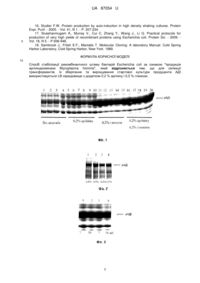
Реферат: Спосіб стабілізації рекомбінантного штаму бактерій Escherichia coli за ознакою "продукція аргініндезімінази Mycoplasma hominis", причому для селекції трансформантів, їх зберігання та вирощування стартової культури продуцента АДI використовується LB середовище з додатком 0,2 % аргініну і 0,5 % глюкози. UA 87054 U (12) UA 87054 U UA 87054 U 5 10 15 20 25 30 35 40 45 50 55 Корисна модель належить до галузі медичної біотехнології і є способом стабілізації рекомбінантного штаму продуцента ферменту аргініндезімінази (рАДІ), яка використовується для лікування певних типів онкозахворювань. Відомо, що замінна амінокислота L-аргінін присутня в кров'яному руслі ссавців. Нормальні клітини цих організмів можуть синтезувати Lаргінін із цитруліну в реакціях, каталізованих аргінінсукцинатсинтазою і аргінінсукцинатліазою. Тоді як у клітинах деяких видів пухлин людини і тварин аргінінсукцинатсинтаза не експресується [1, 2] і наявність L-аргініну в крові є необхідною умовою їх росту. Відомо, що голодування пухлинних клітин меланоми, гепатокарциноми, деяких видів саркоми та ін. за аргініном веде до індукції їх загибелі внаслідок апоптозу [1, 3, 4]. Ферменти, здатні деградувати аргінін, можуть викликати значне зниження його рівня у крові людини та інгібувати ріст злоякісних клітин [4] Аргініндезіміназа (АДІ, ЕС3.5.3.6), яка каталізує реакцію гідролізу L-аргініну до L-цитруліну та аміаку [5], виявлена у клітинах деяких мікроорганізмів [2, 6, 7]. Гідролізуючи аргінін за допомогою АДІ [5], неферментуючі бактерії Mycoplasma hominis використовують його як негліколітичне джерело енергії [8]. У деяких роботах показано інгібування росту пухлинних клітин як наслідок дефіциту аргініну, утвореного при додаванні АДІ [1, 2, 3, 9, 10]. Також показано, що АДІ є супресуючим фактором реплікації віруса імунодефіциту людини ВІЛ [11]. Gong і співавтори повідомляють, що АДІ є приблизно в 100 раз більш ефективною при інгібуванні проліферації клітин лімфатичної лейкемії, порівняно з використовуваною в клінічній онкології L-аспарагіназою [12]. У провідних онкологічних клініках світу проводяться клінічні випробовування ензимотерапії онкозахворювань за допомогою АДІ. Проте широкому практичному використанню АДІ в онкологічній практиці заважає дуже висока ціна препаратів ферменту, отриманого розробленими та запатентованими [13] методами. Запропоновано значно дешевший спосіб індукції синтезу та активації рАДІ [14]. Необхідно наголосити, що продуценти АДІ є нестабільними і швидко втрачають здатність до надпродукції АДІ як при зберіганні, так і у процесі вирощування [15]. Тому суттєвим недоліком описаних раніше способів отримання АДІ є необхідність кожен раз розпочинати процес виробництва із трансформації клітин кишкової палички плазмідою із геном АДІ та селекції високопродуктивних клонів трансформантів Е. соlі. В основу корисної моделі поставлено задачу стабілізувати штами продуценти АДІ і тим самим оптимізувати запатентовані [14] способи одержання АДІ. Поставлена задача вирішується тим, що у способі стабілізації рекомбінантних (містить ген АДІ М. hominis з покращеною трансляцією) штамів бактерій Е. соlі, згідно з корисною моделлю, оптимізуються умови селекції і зберігання трансформантів, а також вирощування стартової культури продуцента АДІ, що приводить до суттєвого зниження собівартості виробництва ферменту. Запропоновані нами модифікації LB середовища для зберігання та вирощування стартової культури штамів продуцентів АДІ бактерій Е. соlі дозволяють зберігати їх здатність до надпродукції цільового білка незмінною впродовж 50 днів. Тоді як у запатентованому способі культивування бактерій та індукції синтезу АДІ за допомогою лактози (автоіндукція) використовується тільки свіжа культура трансформантів. Найбільш близькими до запропонованого є описані у літературі умови кріозберігання при 70 °C штамів продуцентів різних рекомбінантних білків [16, 17]. Проте при зберіганні при -70 °C рекомбінантного штаму бактерій Е. соlі продуцента АДІ із М. hominis його здатність до надекспресії фермента за допомогою індукії лактозою не зберігається [14]. У запропонованому способі використовуються наступні методи: трансформація бактерій методом електропорації, виділення плазмід із бактерій, рестрикційний аналіз, електрофорез в агарозному гелі, електрофорез білків в поліакриламідному гелі в денатуруючих умовах [18]. Спосіб стабілізації рекомбінантного штаму бактерій Е. соlі продуцента АДІ із М. hominis ілюструється наступними графічними матеріалами: На фіг. 1 показано електрофоретичний аналіз продукції рАДІ М. hominis у трансформантів Е. соlі при їх селекції, зберігання (7 діб) та культивуванні стартової культури на середовищі LB з різними додатками: LB (1-5); LB+0,2 % аргініну (6-10); LB+0,2 % глюкози (11-15); LB+0,2 % аргініну і 0,2 % глюкози (16-20). На фіг. 2 показано залежність продукції рАДІ М. hominis у трансформантів Е. соlі від концентрації глюкози (0,2 % (1,3) або 0,5 % (2,4) у середовищі LB, яке використовувалось для культивування стартової культури. На фіг. 3 зображено рівень продукції рАДІ М. hominis у трансформантів Е. соlі у залежності від часу зберігання (1,3-7 діб; 2,4-50 діб) продуцента при 4 °C на середовищі LB з додатком 0,5 % глюкози. 60 1 UA 87054 U 5 10 15 20 25 30 35 40 45 50 55 Етап 1 Плазміду, що містить оптимізований ген АДІ М. hominis, під контролем промотора гена РНКполімерази бактеріофага Т7 вводять (трансформують) у клітини Е. соlі BL-21 методом, описаним раніше [14, 18]. Селекцію трансформанти проводять при 37 °C на LB середовищі з 100 мкг/мл ампіциліну (NaCl 1 %, пептон 1,5 %, дріжджовий екстракт 0,5 %, агар мікробіологічний 2 %), що містить: 1-0,2 % аргініну; 2-0,2 % глюкози; 3-0,2 % аргініну і 0,2 % глюкози. На середовищі аналогічного складу зберігають та вирощують стартову культуру, продуцента рАДІ Для аутоіндукційної гетерологічної експресії АДІ використовується мінеральне середовище та методика, запропоновані раніше [14]. Як індуктор експресії використовується лактоза. Електрофоретичний аналіз залежності продукції рАДІ М. hominis бактеріями Е. соlі від складу селекційного середовища, середовищ їх зберігання (7 діб) при 4 °C)) та культивування стартової культури представлено на фіг. 1. Максимальний рівень експресії цільового білка спостерігається у клітин трансформантів, культивованих на LB середовищі з 0,2 % аргініну і 0,2 % глюкози. Збільшення концентрації глюкози у LB середовищі до 0,5 % (фіг. 2) приводить до зростання продукції рАДІ під час автоіндукційного культивування. Продуцент ферменту не втрачає здатності до надекспресії рАДІ при зберіганні 50 діб при 4 °C на середовищі LB з додатками 0,2 % аргініну та 0,5 % глюкози (фіг. 3). Джерела інформації: 1. Philip R., Campbell F., Wheatley D.N. Arginine deprivation, growth inhibition and tumour cell death. Part 2. Enzymatic degradation of arginine in normal and malignant cell cultures. Br.J.Cancer. 2003. - Vol. 88, N 4. - P. 213-283. 2. Takaku H., Matsumoto M., Misawa S., Miyazaki K. Anti-tumor activity of arginine deiminase from Mycoplasma arginini and its growth-inhibitory mechanism. Jpn. J. Cancer Res. - 1995. - Vol. 86, N 9. - P. 840-846. 3. Sugimura K., Ohno Т., Kusuyama Т., Azuma L. High sensitivity of human melanoma cell lines to the growth inhibitory activity of mycoplasmal arginine deiminase in vitro. Melanoma Res. - 1992. Vol. 2, N 3. - P. 191-196. 4. Takaku H., Takase ML, Abe S., Hayashi H., Miyazaki K. In vivo anti-tumor activity of arginine deiminase purified from Mycoplasma arginine. Int. J.Cancer. - 1992. - Vol. 51, N 2. - P. - 244-249. 5. Barile M.F., Schimke R.T., Riggs D.B. Presence of the arginine dehydrolase pathway in Mycoplasma. J.Bacteriology. - 1966. - Vol. 91, N 1. - P. 189-192. 6. Shibatani Т., Kamimoto T., Chibata I. Crystalization and properties of L-arginine deiminase of Pseudomonas putida. J.Biol. Chem. - 1975. - Vol. 250, N 12. - P. 4580-4583. 7. Kim J.E., Hur H.J., Lee K.W., Lee H.J. Antiinflammatory effects of recombinants arginine deiminase originating from Lactococcus lactis ssp. lactis ATCC 7962. J. Microbiol. Biotechnol. - 2007. - Vol. 17, N 9. - P. 1491-1497. 8. Schimke P.Т., Berlin С.М., Shweeney E.W., Carroll W.R. The generation of energy by the arginine dehidrolase pathway in Mycoplasma hominis. J. Biol. Chem. - 1966. - Vol. 241, N 10. - P. 2228-2236. 9. Park I.S., Kang S.W., Shin Y.J., Chac K.Y., Park M.O., Kim M.Y., Wheatley D.N., Min B.H. Arginine deiminase a potential ingibitor of angiogenesis and tumour growth. Br. J. Cancer. - 2003. Vol. 89, N 5. - P. 907-914. 10. Matsumoto M., Hayashi H. High-level expression of Mycoplasma arginine deiminase in Escherichia coli and its efficient renaturation as an anti-tumor enzyme. Biotechnol. - 1994. - Vol. 36, N 2. - P. 145-155. 11. Kubo M., Nishitsuji H., Kurihara K., Hayashi T., Masuda Т., Kannagi M. Suppression of human immunodeficiency virus type 1 replication by arginine deiminase of Mycoplasma arginine. J. Gen. Virol. - 2006. - Vol. 87, N 6. - P. 1589-1593 12. Gong H., Zolzer F., von Recklinghhausen G., Havers W., Schweigerer L. Arginine deiminase inhibits proliferation of human leukemia cells more potently than asparaginase by inducing cell cycle arrest and apoptosis. Leukemia. - 2000. - Vol. 14, N 5. - P. 826-829. 13. Патент США, Pub. No.: US 2005/0129706 AI, заявка від 15.01.2004, МПК А61К 39/02, C12N 9/10 // Modified arginine deiminase // Опубліковано 16.06.2005. 14. Патент України на винахід, N 97610, заявка від 19.05.2011, МПК А61K 38/50, C12N 1/21, C12N 9/14 / Поліпшений спосіб одержання аргініндезімінази Mycoplasma hominis із рекомбінантних штамів бактерій Escherichia coli // Зареєстровано 27.02.2012. 15. Misawa S., Aoshima M., Takaku H., Matsumoto M., Hayashi H. High-level expression of Mycoplasma arginine deiminase in Escherichia coli and its efficient renaturation as an anti-tumor enzyme. Biotechnol. - 1994. - Vol. 36, N 2. - P. 145-155. 2 UA 87054 U 5 16. Studier F.W. Protein production by auto-induction in high density shaking cultures. Protein Expr. Purif. - 2005. - Vol. 41, N 1. - P. 207-234. 17. Sivashanmugam A., Murray V., Cui C, Zhang Y., Wang J., Li Q. Practical protocols for production of very high yields of recombinant proteins using Escherichia coli. Protein Sci. - 2009. Vol. 18, N 5. - P.936-948. 18. Sambrook J., Fritsh E.F., Maniatis T. Molecular Cloning: A laboratory Manual. Cold Spring Harbor Laboratory, Cold Spring Harbor, New York. 1989. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 10 Спосіб стабілізації рекомбінантного штаму бактерій Escherichia coli за ознакою "продукція аргініндезімінази Mycoplasma hominis", який відрізняється тим, що для селекції трансформантів, їх зберігання та вирощування стартової культури продуцента АДI використовується LB середовище з додатком 0,2 % аргініну і 0,5 % глюкози. 3 UA 87054 U Комп’ютерна верстка І. Мироненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 4
ДивитисяДодаткова інформація
Автори англійськоюSybirnyi Andrii Andriiovych, Faiura Liubov Romanivna, Boretskyi Yurii Romanovych
Автори російськоюСибирный Андрей Андреевич, Фаюра Любовь Романовна, Борецкий Юрий Романович
МПК / Мітки
МПК: C12N 1/21, A61K 38/50, C12N 9/14
Мітки: аргініндезимінази, продукція, ознакою, mycoplasma, escherichia, рекомбінантного, спосіб, стабілізації, hominis, бактерій, штаму
Код посилання
<a href="https://ua.patents.su/6-87054-sposib-stabilizaci-rekombinantnogo-shtamu-bakterijj-escherichia-coli-za-oznakoyu-produkciya-arginindeziminazi-mycoplasma-hominis.html" target="_blank" rel="follow" title="База патентів України">Спосіб стабілізації рекомбінантного штаму бактерій escherichia coli за ознакою “продукція аргініндезімінази mycoplasma hominis”</a>
Попередній патент: Спосіб лікування дерматофітозів великої рогатої худоби
Наступний патент: Спосіб концентрування нітратної кислоти з одержанням кальцієвої селітри
Випадковий патент: Фітоаеротенк для очистки стічної комунальної води