Спосіб експрес-виявлення антибіотиків групи ландоміцинів
Номер патенту: 88383
Опубліковано: 12.10.2009
Автори: Лужецький Андрій Миколайович, Федоренко Віктор Олександрович, Бехтольд Андреас, Осташ Ірина Степанівна, Осташ Богдан Омелянович
Формула / Реферат
Спосіб експрес-виявлення три-, пента- і гексаглікозильованих ландоміцинів, який базується на індукції експресії гена канаміцин-стійкості nео у стрептоміцетів, який відрізняється тим, що як регуляторний елемент використовують ген lаnК, клонований у складі плазміди рМО11с у актиноміцетів Streptomyces albus.
Текст
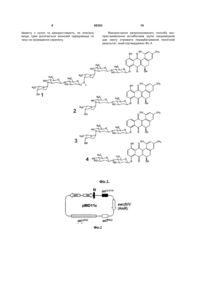
Спосіб експрес-виявлення три-, пента- і гексаглікозильованих ландоміцинів, який базується на індукції експресії гена канаміцин-стійкості nео у стрептоміцетів, який відрізняється тим, що як регуляторний елемент використовують ген lаnК, клонований у складі плазміди рМО11с у актиноміцетів Streptomyces albus. Винахід стосується генетики бактерій та біотехнології і може бути використаний для виявлення продуцентів полікетидних сполук ландоміцинової родини і їхніх похідних, що містять у своїй структурі лінійний глікозидний ланцюг з трьох і більше вуглеводневих залишків. Ландоміцини - велика група природних метаболітів полікетидної природи, що виявляють цитотоксичні та протипухлинні властивості. [Depenbrock H., Bomschlegl S., Peter R., Rohr J., Schmid P., Schweighart Т., Block Т., Rastetter J., Hanauske A.R. Assessment of antitumor activity of landomycin A (NSC 6399187-A) // Arm.Hematol.-1996.-Vol.73.P.A80/316; Korynevska A., Heffeter P., Matselyukh В., Elbling L., Micksche M., Stoika R., Berger W. Mechanisms underlying the anticancer activities of the angucycline landomycin E //Biochem Pharmacol.2007.-vol.74.-N12.-P. 1713-1726]. Протипухлинна активність ландоміцинів у значній мірі залежить від їхньої глікозидної частини [Zhu L., Luzhetskyy A., Luzhetska М., Mattingly С, Adams V., Bechthold A., Rohr J. Generation of new landomycins with al tered saccharide patterns through over-expression of the glycosyltransferase gene lanGT3 in the biosynthetic gene cluster of landomycin A in Streptomyces cyanogenus S-136 // Chembiochem. -2007.-vol.8.-Nl.P.83-88]. Також, зміни у полікетидній частині ландоміцинів призводять до кількісних та якісних змін спектру їхніх біологічних активностей [Ostash В., Rix U., Rix L.L., Liu Т., Lombo F., Luzhetskyy A., Gromyko O., Wang C, Brana A.F., Mendez C, Salas J.A., Fedorenko V., Rohr J. Generation of new landomycins by combinatorial biosynthetic manipulation of the lndGT4 gene of the landomycin E cluster in S. globisporus II Chem. Biol.-2004.-vol.ll.-N.4.-P.547555]. Виявлення продуцентів нових ландоміцинів з довгими глікозидними ланцюгами - 3 вуглеводневі залишки і більше – та змінами у структурі аглікону дозволило б отримати нові сполуки з покращеними біологічними чи фармакологічними властивостями. Виявлення нових мікроорганізмів, що продукуватимуть вже відомі ландоміцини, також становить практичний інтерес, оскільки вони можуть бути більш зручними ніж наявні штами. (19) UA (11) 88383 (13) C2 (21) a200800261 (22) 08.01.2008 (24) 12.10.2009 (46) 12.10.2009, Бюл.№ 19, 2009 р. (72) ОСТАШ БОГДАН ОМЕЛЯНОВИЧ, ОСТАШ ІРИНА СТЕПАНІВНА, ФЕДОРЕНКО ВІКТОР ОЛЕКСАНДРОВИЧ, ЛУЖЕЦЬКИЙ АНДРІЙ МИКОЛАЙОВИЧ, БЕХТОЛЬД АНДРЕАС, DE (73) ЛЬВІВСЬКИЙ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ ІМЕНІ ІВАНА ФРАНКА (56) EP A1 1925670, 15.02.2007. WO A1 2007016860, 15.02.2007. UA A 65866, 15.04.2004. Лужецький А.М. Система клонування генів у штамах актиноміцетів – продуцентах канаміцину streptomyces kanamyceticus та ландоміцину E streptomyces globisporus 1912. Автореф… канд.біол.наук. 03.00.15 – генетика. Київ - 2003 Осташ Б.О. Генетичний контроль окремих етапів біосинтезу ландоміцину Е в streptomyces 3 Відомий спосіб, що включає ферментацію продуцентів ландоміцинів, їхнє очищення з клітин і хімічний аналіз кінцевого продукту [Henkel Т., Rohr J., Schwenen L. Landomycins, new angucycline antibiotics from Streptomyces sp. I. Structural studies on landomycins A-D // J. Antibiot. -1990.-vol.43.-N5.P.492-503]. Однак цей спосіб передбачає використання складних мікробіологічних та хімічних процедур, є тривалим, трудомістким і залежить від здатності мікроорганізму накопичувати ландоміцини в рідкому середовищі. Відомий спосіб експрес-виявлення продукції стрептограмінів [Aubel D., Morris R., Lennon В., Rimann M., Kaufmann H., Folcher M., Bailey J.E., Thompson С J., Fussenegger M. Design of a novel mammalian screening system for the detection of bioavailable, non-cytotoxic streptogramin antibiotics // J. Antibiot.-2001.-vol.54.-Nl.-P.44-55], макролідів [Mohrle V., Stadler M., Eberz G. Biosensor-guided screening for macrolides // Anal. Bioanal. Chem.2007.-vol.388.-N5-6.-P.l 117-1125], інгібіторів синтезу клітинної стінки [De Pascale G., Grigoriadou C, Losi D., Ciciliato I., Sosio M., Donadio S. Validation for high-throughput screening of a VanRS-based reporter gene assay for bacterial cell wall inhibitors //J. Appl. Microbiol.-2007.-vol.l03.-Nl.-P.133-140; Sun D., Cohen S., Mani N., Murphy C, Rothstein D.M. A pathway-specific cell based screening system to detect cell wall inhibitors // J Antibiot.-2002.-vol.55.P.279-287] у колекціях культур мікроорганізмів з використанням спеціально сконструйованих бактерійних штамів чи клітин інших організмів - репортерних систем. Цей спосіб полягає у тому, що неочищені екстракти мікроорганізмів, чи концентрати культуральної рідини, або ж агарові блоки, вирізані з газону мікроорганізму, наносять на газон культури ре портерного штаму, який попередньо засіяли на агаризоване селективне середовище, або ж досліджувану суміш змішують з репортерним штамом. Про наявність сполуки певного хімічного класу чи типу дії у цій суміші або блоці судять за ростом або люмінесценцією, або ж за зміною забарвлення репортерного штаму у районі дифузії сполук. Однак, жодна з описаних репортерних систем не дає змоги виявляти сполуки ландоміцинової родини. Найбільш близьким за технічною сутністю прототипом - є спосіб виявлення тіострептонподібних тіопептидних антибіотиків за допомогою репортерного штаму Streptomyces lividans, що містить у своїй хромосомі ген tipA та рекомбінантну плазміну, в якій безпромоторний ген канаміцинстійкості пео злитий з промотором гену tip A [Yun B.S., Hidaka Т., Furihata К., Seto H. Microbial metabolites with tip A promoter inducing activity. II. Geninthiocin, a novel thiopeptide produced by Streptomyces sp. DD84 // J. Antibiot. -1994.- vol.47.-N9.-P.969975]. Промотор гену tipA клонували у вектор pIJ486 [Kieser Т., Bibb M.J., Buttner M.J., Chater K.F., Hopwood D.A. Practical Streptomyces genetics // John Innes Foundation, Norwich, United Kingdom. 2000.-613 pages] так, що транскрипція гену пео підпадає під його контроль. Сконструйовану плаз 88383 4 міду вводили у S. lividans шляхом трансформації протопластів. Відбір трансформантів проводили на регенераційному середовищі R2YE за стійкістю до тіострептону, яка визначається маркерним геном вектора. Рекомбінантний штам S. lividans вирощували на середовищі R2YE з тіострептоном 5 днів для отримання спорової суспензії. Одночасно розливали чашки з середовищем Беннета, що містить 50мкг/мл канаміцину, на яке засівали спорову суспензію рекомбінантного штаму S. lividans. Екстракти з клітин різних мікроорганізмів наносили на паперові диски, підсушували, та ставили на щойно засіяний газон репортерного штаму. Суміш сполук дифундувала з дисків у клітини репортерного штаму. Якщо у суміші були тіострептонподібні тіопептиди, то вони зв'язувались з білком Tip А, і той, у свою чергу, набував здатності зв'язуватися з промотором tipA та запускати транскрипцію гена nео. Ті екстракти, що містили тіопептидні антибіотики тіострептонового ряду, індукували ріст рекомбінантного штаму S. lividans навколо відповідних дисків на середовищі Беннета з канаміцином. Проте, цей спосіб не може бути використаний для виявлення сполук ландоміцинової родини, оскільки білок ТірА є високоспецифічним по відношенню до тіопептидів і не активуватиме транскрипцію гена пео у відповідь на появу ландоміцинів у клітинному середовищі. Крім того, S. lividans у значній мірі є стійким до ландоміцинів, і це ускладнює його використання для створення репортерної системи. В основу винаходу покладено завдання удосконалити спосіб експрес-виявлення антибіотиків групи ландоміцинів шляхом конструювання ефективної ландоміцин-специфічної репортерної системи, що дасть змогу швидко виявляти продуцентів нових ландоміцинів з цінними біологічними властивостями, чи нових продуцентів вже відомих ландоміцинів, які володіють покращеними біотехнологічними властивостями. Поставлене завдання вирішується так, що у способі експрес-виявлення антибіотиків групи ландоміцинів, який базується на індукції експресії гена канаміцин-стійкості nео у стрептоміцетному штамі, як регуляторний елемент використовують ген lanК, клонований у складі плазміди рМО11с у штамі S. albus. Авторами вперше запропоновано використати плазміду, у якій експресія гена nео підпадає під транскрипційний контроль з боку РlanK-J та LanK, штам Streptomyces albus та агарові блоки культур мікроорганізмів для експрес-виявлення антибіотиків групи ландоміцинів. Спосіб базується на використанні векторної молекули ДНК рМO9, ділянки ДНК між генами ІаnК та lanJ - РlanK-J - та регуляторного гена ІаnК. Ген ІаnК кодує TetR-подібний репресорний білок, який, за відсутності у клітинах Streptomyces cyanogenus поліглікозильованих ландоміцинів, зв'язується з РlanK-J і У такий спосіб пригнічує експресію оперона lanJ-Z5 у межах кластера генів біосинтезу ландоміцину A [Westrich L., Domann S., Faust В., Bedford D., Hopwood D.A., Bechthold A. Cloning and characterization of a gene cluster from Streptomyces cyanogenus S136 proba 5 bly involved in landomycin biosynthesis // FEMS Microbiol. Lett.-1999.-vol.l70.-N2.-P.381-387]. Коли у клітинах S. cyanogenus кількість молекул три-, пента- і гексаглікозильованих ландоміцинів перевищує певну порогову концентрацію, то вони, зв'язуючись із білком LanK, позбавляють його здатності взаємодіяти з РlanK-J. Це запускає експресію оперона lanJ-Z5. Ген lanК може бути використаний для конструювання репортерного штаму на основі S. albus, де відсутність чи наявність ландоміцинів у його клітинах може бути спряжена з ростом чи відсутністю росту S. albus, відповідно, на селективних середовищах. Цей штам характеризується високою чутливістю до багатьох антибіотиків, які інгібують внутрішньоклітинні процеси - аміноглікозиди, тетрацикліни, антрацикліни, та синтез клітинної стінки - глікопептиди, моеноміцини, деякі цефалоспорини та бета-лактами. Це свідчить про високу проникність клітинної стінки S. albus, що повинно сприяти дифузії індукторів -ландоміцинів у його клітини. Порівняно з іншими актиноміцетами, S. albus також характеризується швидким та дисперсним ростом, що скорочує час від початку скринінгу до появи чітких зон росту репортерного штаму в зоні дифузії індуктора. Запропонований спосіб пошуку ландоміцинів за участю S. albus (pMO11c) є простішим та ефективнішим порівняно з відомими способами, що базуються на ферментації мікроорганізмів та екстракції метаболітів з подальшим структурним аналізом. Запропонований спосіб дає змогу швидко виявляти потрібні штами у великих колекціях мікроорганізмів та зосередити більш детальні хімічні дослідження тільки на тих організмах, які напевне накопичують очікувані сполуки. Цінністю запропонованої репортерної системи є те, що вона дає змогу виявляти ландоміцини, які містять глікозидні ланцюги різної довжини та певні модифікації у структурі аглікону. Водночас, неглікозильовані ландоміцини, що володіють незначною біоактивністю, та інші споріднені до ангуциклінів полікетидні антибіотики не індукують описану репортерну систему і тому будуть відсіяні на перших етапах скринінгу. Фіг.1 Структурні формули окремих представників родини ландоміцинів, де 1- ландоміцин А 2- ландоміцин Е 3- ландоміцин О 4- ландоміцин В Фіг.2 Схема рекомбінантної плазміди рМО11с. Фіг.3 Схема функціонування репортерної системи, що базується на плазміді рМО11с та штамі S. albus. Фіг.4 Індукція росту S. albus (рМО11с) агаровими блоками, що були вирізані з газонів штамів актиноміцетів-продуцентів ангуциклічних антибіотиків, де 1 - Streptomyces globisporus Е7 - продуцент прежадоміцину 2 - S. globisporus GT4.1 - продуцент ландоміцину F 3 - S. globisporus 1912 - продуцент ландоміцину Е 4 - S. globisporus GT4.1(pSElanGT4.3) - продуцент ландоміцину G 88383 6 5 - S. antibioticus Tu6040 - продуцент симоциклінону А 6 - S. globisporus F133 - мутант з порушеним біосинтезом ландоміцину Е 7 - S. globisporus LD3 - продуцент ландоміцину D 8 - S. cyanogenus S136 - продуцент ландоміцину А Спосіб можна проілюструвати прикладами: Конструюють плазміду рМО9. З плазміди pIJ486 [Kieser Т., Bibb M.J., Buttner M.J., Chater K.F., Hopwood D.A. Practical Streptomyces genetics // John Innes Foundation, Norwich, United Kingdom. 2000.-613 pages] за допомогою праймерів terforNhel (5'-AAAGCTAGCGTCCGGATCGCGGCCAAC-3') та neorevMfel (5'AAACAATCGGCGTCGCTTGGTCGGTCATT-3') ампліфікують фрагмент ДНК розміром 1.5тисяч п.н., що містить полілінкер, безпромоторний ген канаміцин-стійкості nео та термінатор фага fd, який далі позначено як фрагмент MCS-neo-fd. Цей амплікон обробляють ендонуклеазами рестрикції Nhel та MfeI. Вектор рКС1139 [Kieser Т., Bibb M.J., Buttner M.J., Chater K.F., Hopwood D.A. Practical Streptomyces genetics // John Innes Foundation, Norwich, United Kingdom. -2000.-613 pages] обробляють ендонуклеазами рестрикції Xbal та ЕсоRI, та лігують з вищеописаним ампліконом. Лігазною сумішшю трансформують Е. coli DH5a та відбирають клони, що несуть рекомбінантні плазміди на середовищі LA з 25мкг/мл апраміцину, 65мкг/мл 5бром-4-хлор-3-індоліл-b-D-галактозиду та 30мкг/мл ізопропілтіогалактозиду. Плазмідну ДНК із трансформантів аналізують рестрикційним картуванням ферментами Xhol та ЕсоRI [Гловер Д. Молекулярное клонирование ДНК. Методы. М., Мир-1989-т.1374с]. Як результат отримують плазміду рМО9, що містить вставку ДНК розміром 1.5тисяч п.н. з фрагментом MCS-neo-fd. Конструюють плазміду рМОПс. Ген ІаnК разом з РlanK-J ампліфікують з геному S. cyanogenus за допомогою праймерів KupEcoRIn (5'AAAGAATTCGGTCTGCTCCCTTGATCAG-3') та KrpXbaln (5'AAATCTAGATCACAGGTCCTCCTCGGC-3'). Отриманий амплікон обробляють ендонуклеазами рестрикції Xbal та ЕсоRI та лігують з плазмідою рМО9, яку попередньо лінеаризують ендонуклеазами рестрикції Xbal та ЕсоШ. Лігазною сумішшю трансформують Е. coli DH5a та відбирають клони, що несуть рекомбінантні плазміди на середовищі LA з 25мкг/мл апраміцину, з яких плазмідну ДНК аналізують рестрикційним картуванням ферментами Xbal та ЕсоRI [Гловер Д. Молекулярное клонирование ДНК. Методы. М., Мир-1989-т.1-374с]. Як результат отримують плазміду рМО11с (Фіг.1), що містить вставку ДНК розміром 0.76тисяч п.н. з геном ІаnК та РlanK-J. Плазмідою рМО11с трансформують штам Е. coli ЕТ12567 (pUZ8002), який за рахунок tra-генів плазміди pUZ8002 забезпечує кон'югативне перенесення корезидентних плазмід [Flett F., Mersinias V., Smith C.P. High efficiency intergeneric conjugal transfer of plasmid DNA from Escherichia coli to methyl-DNA-restricting Streptomycetes II FEMS 7 Microbiol. Lett.-1997.-vol.155.- Р.223-229]. Одну колонію нічної культури Escherichia coli засівають у 5мл середовища LB з 50мкг/мл канаміцину. Культуру вирощують до оптичної густини OD6oo=0,1, переносять у мікропробірки з об'ємом 1.5мл та осаджують центрифугуванням при 10тис. об./хв.. протягом 1хв. Зливають супернантант та клітини ресуспендують у 50мкл середовища LB. Отриману суспензію клітин охолоджують у льоді 5хв., додають 1мл 0.1М розчину СаСl2 та інкубують у льоді 1год. Клітини осаджують центрифугуванням при 10тис. об./хв. протягом 1хв., зливають надосадову рідину та ресуспендують у 100мкл 0.1М розчину СаСІ2- Інкубують 1год. у льоді та додають розчин плазмідної ДНК. Інкубують 1год. у льоді, після чого клітини піддають тепловому шоку протягом 1хв. при 40°С, охолоджують та додають 1мл середовища LB. Інкубують 2год. при 37°С для індукції експресії генів стійкості та висівають на чашки з середовищем LA з 25мкг/мл апраміцину та 50мкг/мл канаміцину. Чашки інкубують при 37°С 16год. після чого трансформанти пересівають на свіже середовище LA з 25мкг/мл апраміцину та 50мкг/мл канаміцину. Плазміду рМО11с в S. albus переносили шляхом міжродової кон'югації з відповідним штамом Е. coli ЕТ12567 (pUZ8002). Суспензію спор штаму S. albus висівають на середовище ОМ та вирощують 5 діб при 28°С для отримання спорової суспензії для кон'югаційних схрещувань. Штам Е. coli ЕТ12567 (pUZ8002) з плазмідою рМО11с висівають на чашку з середовищем LA з 25мкг/мл апраміцину та 50мкг/мл канаміцину та вирощують 18год. при 37°С. Готують суспензію клітин у 4мл середовища LB. Одночасно готують суспензію спор штаму S. albus у 4мл стерильної води. Спори піддають тепловому шоку протягом 10хв. при 50°С. Суспензію клітин та спор стрептоміцетів осаджують центрифугуванням 2хв. при 10000об/хв., зливають надосадову рідину, розчиняють у 100мкл середовища LB, змішують між собою та висівають на чашки з середовищем ОМ. Чашки інкубують 8-12год. при 28°С та заливають 1мл водного розчину 25мкг апраміцину та 50мкг налідиксової кислоти. Отриманий штам S. albus (рМО11с) перевіряють на наявність плазміди. Вирощують у 50мл рідкого середовища YEME та виділяють сумарну ДНК, зразками якої трансформують штам Е. coli DH5a [Kieser Т., Bibb M.J., Buttner M.J., Chater K.F., Hopwood D.A. Practical Streptomyces genetics // John Innes Foundation, Norwich, United Kingdom. 2000.-613 pages]. Плазмідну ДНК з трансформантів аналізують рестрикційним картуванням. Перевіряють здатність репортерної системи S. albus (pMO11c) виявляти ландоміцини у колекції очищених зразків ангуциклінів та інших антибіотиків. Штам S. albus (рМО11с) висівають на середовище LA з 25мкг/мл апраміцину. Вирощують 5 діб при 30°С. Готують суспензію спор з 5-денної культури S. albus (pMO11с) у 1мл води, яку висівають на середовище ММС з складом: L-аспарагін - 0.5г, К2НРО4 - 0.5г, MgSO4 ´ 7H2O - 0.2г, FeSO4 ´ 7H2O 0.01г, казамінові кислоти - 3г, агар - 15г, дистильо 88383 8 вана вода - до 1000мл. Після автоклавування у середовище додають 10г/л глюкози та 50мкг/мл канаміцину. Одночасно, на паперові диски Whatman діаметром 5мм наносять розчини антибіотиків у метанолі: ландоміцин А - 20мкг, ландоміцин Е - 20мкг, ландоміцин D - 50мкг, ландоміцинон - 10мкг, урдаміцин А (30мкг), ландоміцин G 20мкг, симоциклінон - 20мкг, еритроміцин - 10мкг, ногаламіцин - 10мкг, доксорубіцин - 5мкг, моеноміцин - 5мкг, еверніноміцин - 5мкг. Формули окремих представників родини ландоміцинів - див. Фіг.1. Диски підсушують при 4°С у темряві протягом 1 години, а потім накладають на щойно засіяний газон репортерного штаму. Чашки з дисками інкубують при 28-30°С протягом 4 діб. Навколо дисків з ландоміцином А, ландоміцином Е та ландоміцином G помітні чіткі зони росту S. albus (рМО11с). Це свідчить, що вищезгадані молекули по відношенню до LanK є лігандами, що умовно відображені чорним квадратом позначеним літерою L на Фіг.3Б, і вони були успішно виявлені репортерною системою. Інші антибіотики, що вивчались, не здатні зв'язуватися з LanK та індукувати експресію гена nео, а відтак і ріст репортерного штаму, як відображено на Фіг.3А. За допомогою репортерної системи S. albus (pMO11c) виявляють ландоміцини у агарових блоках культур актиноміцетів. На середовище ОМ [Gromyko О, Rebets Y, Ostash В, Luzhetskyy A, Fukuhara М, Bechthold A, Nakamura Т, Fedorenko V.Generation of Streptomyces globisporns SMY622 strain with increased landomycin E production and it's initial characterization // J. Antibiot-2004.- vol.57.-N6.383-389] висівають суспензії спор таких штамів: Streptomyces globisporus F133 - мутант з порушеним біосинтезом ландоміцину Е; S. cyanogenus S136 - продуцент ландоміцинів А, С, В; S. globisporus 1912 - продуцент ландоміцину Е; S. globisporus LD3 - продуцент ландоміцину D; S. antibioticus Tu6040 - продуцент симоциклінону; S. globisporus Е7 - продуцент прежадоміцину; S. globisporus GT4.1 (pSElanGT4) - продуцент ландоміцину G; S. globisporus GT4.1 - продуцент ландоміцину F. Штами вирощують 8 діб при 30°С. Суспензію спор репортерного штаму S. albus (pMO411c) висівають на чашки ММС з 50мкг/мл канаміцину, і на щойно засіяний газон ставлять агарові блоки діаметром 5мм, які вирізали з газонів культур актиноміцетів. Інкубують чашки з блоками 4 доби. Штами S. cyanogenus S136, S. globisporus 1912 та S. globisporus GT4.1 (pSElanGT4) індукують ріст S. albus (pMO11c), інші штами - ні, як показано на Фіг.4. Як результат репортерна система дає змогу виявити ті агарові блоки, і, відповідно, продуценти, в яких накопичуються сполуки ландоміцинового ряду, і відкинути, ті, в яких містяться інші сполуки, або ландоміцини, що містять два чи менше вуглеводневі залишки у своїй глікозидній частині. В іншому варіанті виконання цього експерименту можна засівати штами, що досліджуються, не на чашки, а у лунки 96-гніздового імунологічного планшета з об'ємом лунки 200мкл, в які попередньо залили по 150мкл середовища ОМ. Після вирощуваняштамів у планшеті, агарові блоки ви 9 ймають з лунок та використовують, як описано вище. Цим досягається економія середовища та часу на проведення скринінгу. 88383 10 Використання запропонованого способу експрес-виявлення антибіотиків групи ландоміцинів дає змогу отримати передбачуваний технічний результат, який підтверджено Фіг.4. 11 Комп’ютерна верстка А. Крижанівський 88383 Підписне 12 Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for expresss determination of antibiotics of landomycine group
Автори англійськоюOstash Bohdan Omelianovych, Ostash Iryna Stepanivna, Fedorenko Viktor Oleksandrovych, Luzhetskyi Andrii Mykolaiovych, Bekhtold Andreas
Назва патенту російськоюСпособ экспресс-определения антибиотиков группы ландомицинов
Автори російськоюОсташ Богдан Емельянович, Осташ Ирина Степановна, Федоренко Виктор Александрович, Лужецкий Андрей Николаевич, Бехтольд Андреас
МПК / Мітки
МПК: C12Q 1/04
Мітки: ландоміцинів, експрес-виявлення, групи, антибіотиків, спосіб
Код посилання
<a href="https://ua.patents.su/6-88383-sposib-ekspres-viyavlennya-antibiotikiv-grupi-landomiciniv.html" target="_blank" rel="follow" title="База патентів України">Спосіб експрес-виявлення антибіотиків групи ландоміцинів</a>
Попередній патент: Контактний апарат
Наступний патент: Реактор цмура для безперервного ацилювання у парогазовій фазі
Випадковий патент: Фрикційний варіатор