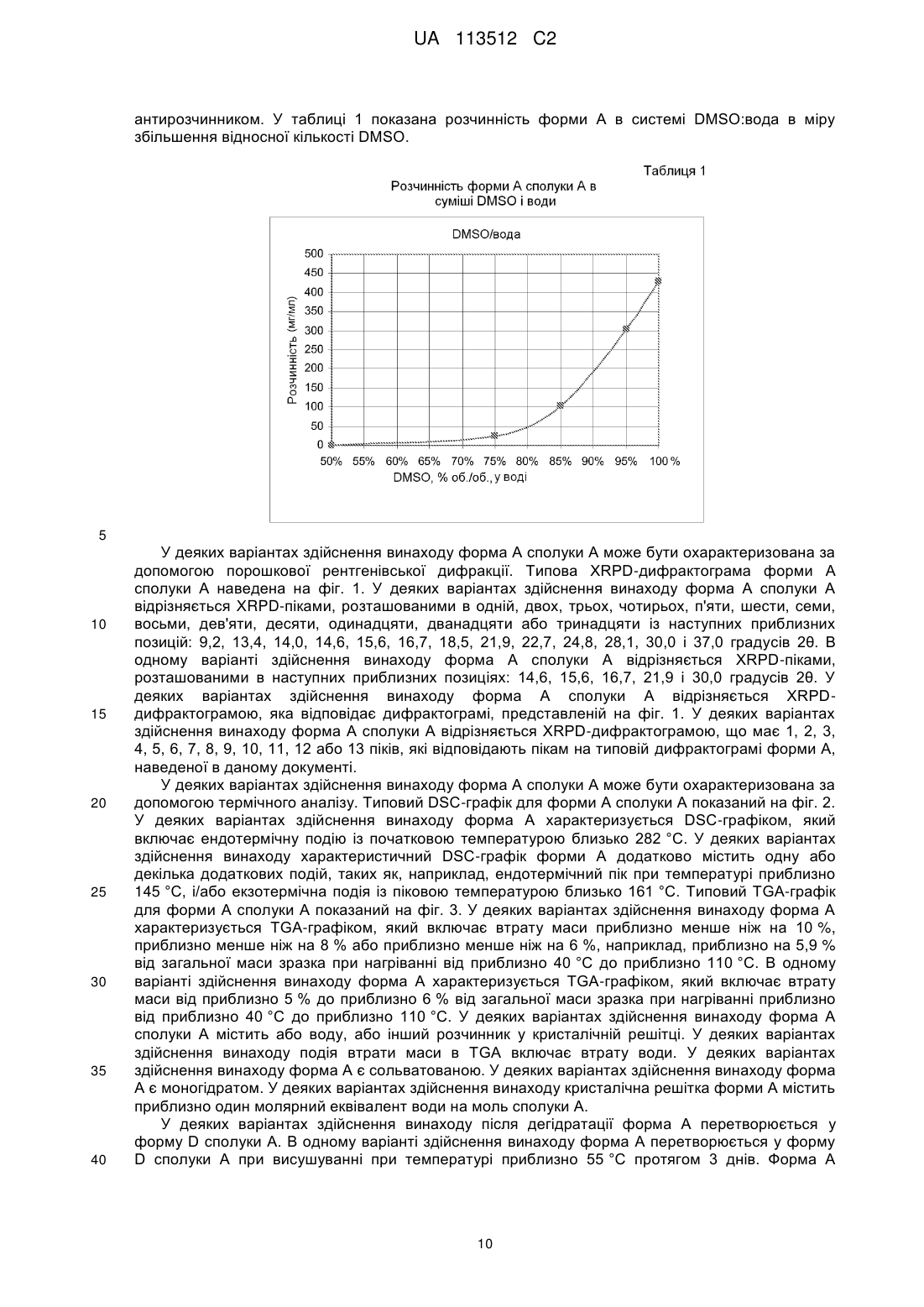
Тверда форма 3-(5-аміно-2-метил-4-оксо-4н-хіназолін-3-іл)піперидин-2,6-діону і її фармацевтична композиція та застосування
Номер патенту: 113512
Опубліковано: 10.02.2017
Автори: Мюллер Джордж В., Лі Інь, Леонґ Уілльям В., Коен Бенджамін М., Ман Хон-Вах, Сюй Джин
Формула / Реферат
1. Тверда форма 3-(5-аміно-2-метил-4-оксо-4Н-хіназолін-3-іл)піперидин-2,6-діону:
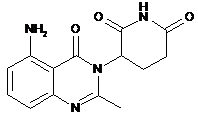
або його гідрохлоридної солі,
яка має порошкову рентгенограму, що включає:
піки при приблизно 8,6, 13,1, 20,5 і 26,3 градуса 2θ;
піки при приблизно 14,6, 15,6, 16,7, 21,9 і 30,0 градуса 2θ;
піки при приблизно 10,6, 14,7, 19,1 і 25,9 градуса 2θ;
піки при приблизно 10,8, 15,1, 25,1 і 26,6 градуса 2θ;
піки при приблизно 16,7, 21,7, 21,9 і 25,8 градуса 2θ;
піки при приблизно 7,3, 14,6, 22,0, 30,0 і 37,0 градуса 2θ; або
піки при приблизно 14,5, 15,7, 22,7 і 29,9 градуса 2θ.
2. Тверда форма за п. 1, яка має порошкову рентгенограму, представлену на фіг. 18.
3. Тверда форма за п. 1, яка є твердою формою гідрохлориду 3-(5-аміно-2-метил-4-оксо-4Н-хіназолін-3-іл)піперидин-2,6-діону і має порошкову рентгенограму, яка включає піки при приблизно 8,6, 13,1, 20,5 і 26,3 градуса 2θ.
4. Тверда форма за п. 3, яка має порошкову рентгенограму, що включає піки при приблизно 8,6, 11,3, 13,1, 15,3, 17,3, 20,5, 22,7, 23,6, 26,3 і 31,4 градуса 2θ.
5. Тверда форма за будь-яким одним із пп. 2-4, яка має графік диференціальної скануючої калориметрії, який включає ендотермічну подію із початковою температурою приблизно 276 °C.
6. Тверда форма за будь-яким одним із пп. 2-5, яка має графік термогравіметричного аналізу, який включає втрату маси менше ніж приблизно 0,5 % при нагріванні від приблизно 25 °C до приблизно 150 °C.
7. Тверда форма за будь-яким одним із пп. 2-6, яка є безводною.
8. Тверда форма за будь-яким одним із пп. 2-7, маса якої збільшується менше ніж приблизно на 0,5 % при збільшенні відносної вологості від приблизно 0 % до приблизно 95 %.
9. Тверда форма за будь-яким одним із пп. 2-8, яка негігроскопічна.
10. Тверда форма за будь-яким одним із пп. 2-9, яка стабільна при впливі приблизно 40 °C і приблизно 75 %-й відносній вологості протягом чотирьох тижнів.
11. Тверда форма за будь-яким одним із пп. 2-10, у якій молярне співвідношення 3-(5-аміно-2-метил-4-оксо-4Н-хіназолін-3-іл)піперидин-2,6-діону і гідрохлориду складає від приблизно 0,1 до приблизно 10.
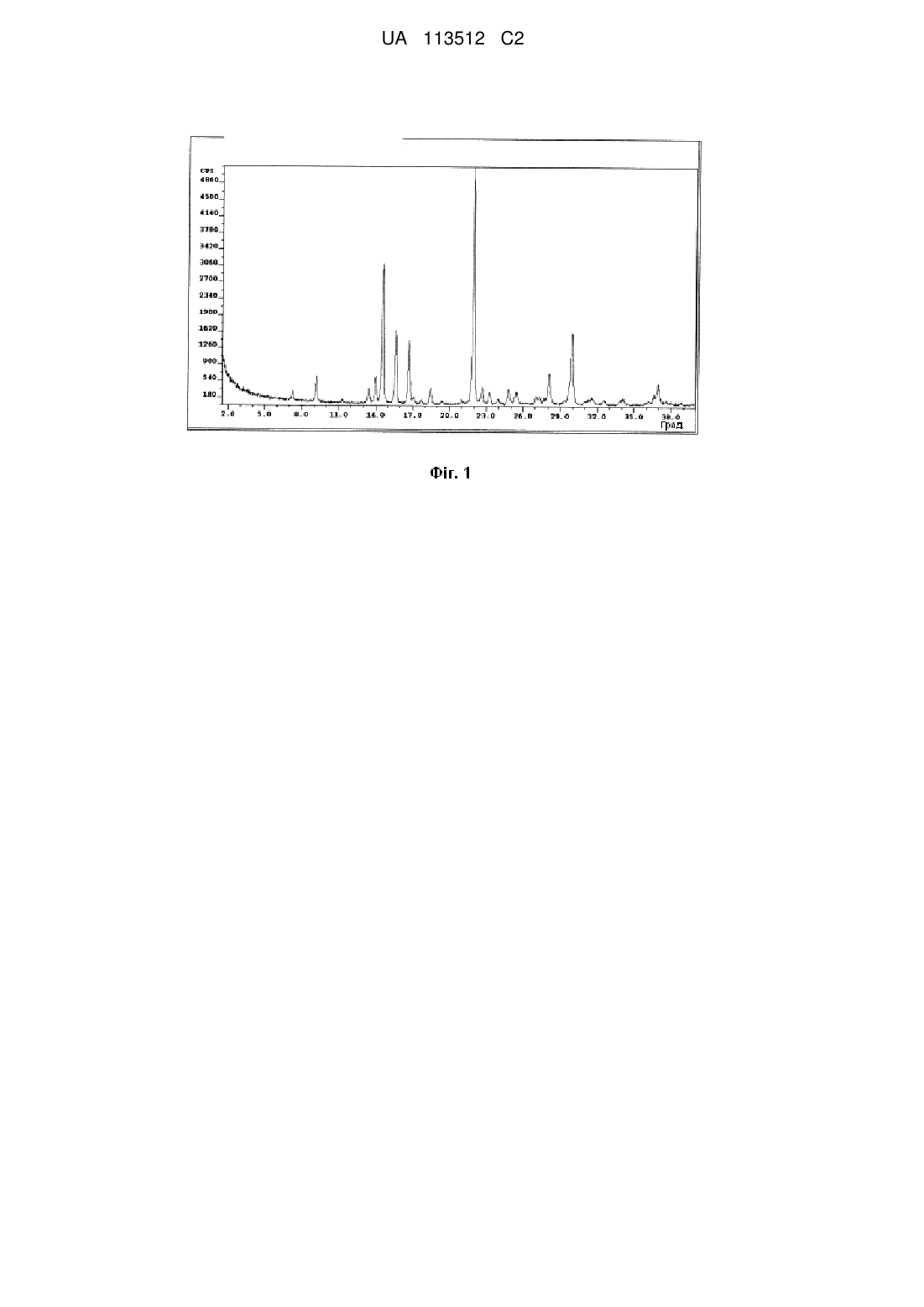
12. Тверда форма за п. 1, яка має порошкову рентгенограму, як показано на фіг. 1.
13. Тверда форма за п. 1, яка має порошкову рентгенограму, що включає піки при приблизно 14,6, 15,6, 16,7, 21,9 і 30,0 градуса 2θ.
14. Тверда форма за п. 13, яка має порошкову рентгенограму, що включає піки при приблизно 9,2, 13,4, 14,0, 14,6, 15,6, 16,7, 18,5, 21,9, 22,7, 24,8, 28,1, 30,0 і 37,0 градуса 2θ.
15. Тверда форма за будь-яким одним із пп. 12-14, яка має графік диференціальної скануючої калориметрії, що включає ендотермічну подію із початковою температурою приблизно 282 °C.
16. Тверда форма за будь-яким одним із пп. 12-15, яка має графік термогравіметричного аналізу, що включає втрату маси менше ніж приблизно 6 % при нагріванні від приблизно 25 °C до приблизно 150 °C.
17. Тверда форма за будь-яким одним із пп. 12-16, маса якої збільшується менше ніж приблизно на 6 % або приблизно на 6 % при збільшенні відносної вологості від приблизно 0 % до приблизно 95 %.
18. Тверда форма за будь-яким одним із пп. 12-17, яка є гідратованою.
19. Тверда форма за п. 18, причому кристалічна решітка твердої форми містить приблизно 1 молярний еквівалент води на моль 3-(5-аміно-2-метил-4-оксо-4Н-хіназолін-3-іл)піперидин-2,6-діону.
20. Тверда форма за п. 1, яка має порошкову рентгенограму, як показано на фіг. 4.
21. Тверда форма за п. 1, яка має порошкову рентгенограму, що включає піки при приблизно 10,6, 14,7, 19,1 і 25,9 градуса 2θ.
22. Тверда форма за п. 21, яка має порошкову рентгенограму, що включає піки при приблизно 10,6, 11,4, 12,6, 13,7, 14,7, 19,1, 20,3, 20,9, 21,2, 22,9, 24,9, 25,3, 25,9, 26,9, 29,5 і 33,8 градуса 2θ.
23. Тверда форма за будь-яким одним із пп. 20-22, яка має графік диференціальної скануючої калориметрії, що включає ендотермічну подію із початковою температурою приблизно 279 °C.
24. Тверда форма за будь-яким одним із пп. 20-23, яка має графік термогравіметричного аналізу, що включає втрату маси менше ніж приблизно 0,1 % при нагріванні від приблизно 25 C до приблизно 150 °C.
25. Тверда форма за будь-яким одним із пп. 20-24, маса якої збільшується менше ніж приблизно на 0,2 % при збільшенні відносної вологості від приблизно 0 % до приблизно 95 %.
26. Тверда форма за будь-яким одним із пп. 20-25, яка є несольватованою.
27. Тверда форма за будь-яким одним із пп. 20-26, яка є негігроскопічною.
28. Тверда форма за п. 1, яка має порошкову рентгенограму, як показано на фіг. 7.
29. Тверда форма за п. 1, яка має порошкову рентгенограму, що включає піки при приблизно 10,8, 15,1, 25,1 і 26,6 градуса 2θ.
30. Тверда форма за п. 29, яка має порошкову рентгенограму, що включає піки при приблизно 10,8, 11,9, 15,1, 18,8, 19,2, 19,3, 22,0, 24,9, 25,1, 26,6 і 29,2 градуса 2θ.
31. Тверда форма за будь-яким одним із пп. 28-30, яка має графік диференціальної скануючої калориметрії, що включає ендотермічну подію із початковою температурою приблизно 281 °C.
32. Тверда форма за будь-яким одним із пп. 28-31, яка має графік термогравіметричного аналізу, що включає втрату маси менше ніж приблизно 0,1 % при нагріванні від приблизно 25 °C до приблизно 150 °C.
33. Тверда форма за будь-яким одним із пп. 28-32, маса якої збільшується менше ніж приблизно на 0,2 % при збільшенні відносної вологості від приблизно 0 % до приблизно 95 %.
34. Тверда форма за будь-яким одним із пп. 28-33, яка є несольватованою.
35. Тверда форма за будь-яким одним із пп. 28-34, яка є негігроскопічною.
36. Тверда форма за п. 1, яка має порошкову рентгенограму, як показано на фіг. 10.
37. Тверда форма за п. 1, яка має порошкову рентгенограму, що включає піки при приблизно 16,7, 21,7, 21,9 і 25,8 градуса 2θ.
38. Тверда форма за п. 37, яка має порошкову рентгенограму, що включає піки при приблизно 10,6, 14,0, 14,6, 15,7, 16,3, 16,7, 18,8, 21,7, 21,9, 24,8, 25,1, 25,8, 28,1 і 28,6 градуса 2θ.
39. Тверда форма за будь-яким одним із пп. 36-38, яка має графік диференціальної скануючої калориметрії, що включає ендотермічну подію із початковою температурою приблизно 283 °C.
40. Тверда форма за будь-яким одним із пп. 36-39, яка має графік термогравіметричного аналізу, що включає втрату маси менше ніж приблизно 4 % при нагріванні від приблизно 25 °C до приблизно 150 °C.
41. Тверда форма за будь-яким одним із пп. 36-40, маса якої збільшується менше ніж приблизно на 6 % або приблизно на 6 % при збільшенні відносної вологості від приблизно 0 % до приблизно 95 %.
42. Тверда форма за п. 1, яка має порошкову рентгенограму, як показано на фіг. 13.
43. Тверда форма за п. 1, яка має порошкову рентгенограму, що включає піки при приблизно 7,3, 14,6, 22,0, 30,0 і 37,0 градуса 2θ.
44. Тверда форма за п. 43, яка має порошкову рентгенограму, що включає піки при приблизно 7,3, 9,3, 12,2, 14,0, 14,6, 15,7, 16,8, 21,0, 22,0, 22,7, 29,4, 30,0 і 37,0 градуса 2θ.
45. Тверда форма за будь-яким одним із пп. 42-44, яка має графік диференціальної скануючої калориметрії, що включає ендотермічну подію із початковою температурою приблизно 279 °C.
46. Тверда форма за будь-яким одним із пп. 42-45, яка має графік термогравіметричного аналізу, що включає втрату маси менше ніж приблизно 6 % при нагріванні від приблизно 25 °C до приблизно 150 °C.
47. Тверда форма за будь-яким одним із пп. 42-46, маса якої збільшується менше ніж приблизно на 0,5 % при збільшенні відносної вологості від приблизно 0 % до приблизно 95 %.
48. Тверда форма за будь-яким одним із пп. 42-47, яка є гідратованою.
49. Тверда форма за будь-яким одним із пп. 42-48, яка є негігроскопічною.
50. Тверда форма за п. 1, яка має порошкову рентгенограму, як показано на фіг. 16.
51. Тверда форма за п. 1, яка має порошкову рентгенограму, що включає піки при приблизно 14,5, 15,7, 22,7 і 29,9 градуса 2θ.
52. Тверда форма за п. 51, яка має порошкову рентгенограму, що включає піки при приблизно 7,2, 9,1, 14,5, 15,7, 16,8, 18,3, 21,9, 22,7, 29,9 і 36,9 градуса 2θ.
53. Тверда форма за будь-яким одним із пп. 50-52, яка має графік диференціальної скануючої калориметрії, що включає ендотермічну подію із початковою температурою приблизно 267 °C.
54. Тверда форма за будь-яким одним із пп. 50-53, яка є гідратованою.
55. Суміш, яка містить дві або кілька твердих форм, вибраних із твердих форм за пп. 1-54.
56. Фармацевтична композиція, яка містить тверду форму за будь-яким одним із пп. 1-54 або суміш за п. 55 і фармацевтично прийнятний носій, розріджувач або допоміжну речовину.
57. Фармацевтична композиція за п. 56, причому композиція складена для перорального, парентерального або внутрішньовенного введення.
58. Фармацевтична композиція за п. 56 або 57, причому композиція складена у вигляді стандартної лікарської форми.
59. Фармацевтична композиція за п. 58, причому пероральною лікарською формою є таблетка або капсула.
60. Спосіб лікування, контролю або попередження раку, який включає введення пацієнту твердої форми за будь-яким одним з пп. 1-54, суміші за п. 55 або фармацевтичної композиції за будь-яким з пп. 56-59.
61. Спосіб за п. 60, який додатково включає введення другого активного засобу.
Текст
Реферат: Винахід стосується твердої форми 3-(5-аміно-2-метил-4-оксо-4Н-хіназолін-3-іл)піперидин-2,6діону або його гідрохлоридної солі, композиції, яка містить тверду форму, способу її застосування. UA 113512 C2 (12) UA 113512 C2 UA 113512 C2 5 10 15 20 25 30 35 40 45 50 55 60 Дана заявка вимагає пріоритет попередньої патентної заявки США № 61/451806, поданої 11 березня 2011 року, повний зміст якої включено в даний опис шляхом посилання. 1. ГАЛУЗЬ ТЕХНІКИ Даний винахід стосується твердих форм 3-(5-аміно-2-метил-4-оксо-4Н-хіназолін-3іл)піперидин-2,6-діону, їх фармацевтичних композицій і способів їх застосування для лікування захворювань або розладів. 2. ПЕРЕДУМОВИ СТВОРЕННЯ ВИНАХОДУ 2.1 ПАТОБІОЛОГІЯ РАКУ І ІНШИХ ЗАХВОРЮВАНЬ Рак характеризується насамперед збільшенням числа аномальних клітин, які походять із даної здорової тканини, проникненням цих аномальних клітин у оточуючі тканини або поширенням через лімфатичну або кровоносну системи злоякісних клітин у регіонарних лімфатичних вузлах і у віддалених ділянках організму (метастазування). Клінічні дані і молекулярно-біологічні дослідження показують, що рак являє собою багатостадійний процес, який починається із незначних пренеопластичних змін, які за певних умов можуть прогресувати в неоплазію. Неопластичне ураження може еволюціонувати клонально і розвиватися із збільшенням здатності до інвазії, росту, метастазування і гетерогенності, особливо в умовах, коли пухлинні клітини уникають імунного нагляду хазяїна. Roitt, I., Brostoff, J. and Kale, D., Immunology, 17.1-17.12 (3rd ed., Mosby, St. Louis, Mo., 1993). Існує величезна кількість різних видів раку, які докладно описані в медичній літературі. Приклади включають рак легень, товстої кишки, прямої кишки, простати, молочних залоз, головного мозку і кишечнику. Захворюваність раком продовжує рости в міру росту загального віку населення, виникнення нових видів раку, а також сприйнятливих груп населення (наприклад, хворих на СНІД або підданих надлишковому впливу сонячного світла). Однак можливості лікування раку обмежені. Наприклад, у випадку різних видів раку крові (наприклад, множинної мієломи), доступна невелика кількість варіантів лікування, особливо коли традиційна хіміотерапія не дає результатів і немає можливості проведення трансплантації кісткового мозку. Тому існує величезна потреба в нових способах і композиціях, які можна використовувати для лікування ракових пацієнтів. Багато видів раку пов'язані із утворенням нових кровоносних судин, процесом, відомим як ангіогенез. Виявлено деякі із механізмів, які беруть участь в індукованому пухлиною ангіогенезі. Найбільш прямий із цих механізмів являє собою секрецію пухлинними клітинами цитокінів із ангіогенними властивостями. Приклади таких цитокінів включають кислотний і основний фактор росту фібробластів (a, b-FGF), ангіогенін, фактор росту ендотелію судин (VEGF) і TNF-α. В альтернативному варіанті пухлинні клітини можуть вивільняти ангіогенні пептиди шляхом експресії протеаз і наступного розщеплення позаклітинного матриксу, у якому містяться деякі цитокіни (наприклад, b-FGF). Ангіогенез також можна індукувати непрямим чином шляхом залучення запальних клітин (зокрема, макрофагів) і наступного вивільнення ними ангіогенних цитокінів (наприклад, TNF-α, b-FGF). Множина інших захворювань і розладів також пов'язані із небажаним ангіогенезом або характеризуються ним. Наприклад, посилений або нерегульований ангіогенез бере участь у ряді захворювань і патологічних станів, включаючи, але не обмежені ними, очні неоваскулярні захворювання, хоріоїдальні неоваскулярні захворювання, неоваскулярні захворювання сітківки, рубеоз (неоваскуляризацію райдужки), вірусні захворювання, генетичні захворювання, запальні захворювання, алергічні захворювання і аутоімунні захворювання. Приклади таких захворювань і станів включають, але не обмежені ними, діабетичну ретинопатію, ретинопатію недоношених, відторгнення трансплантата рогівки, неоваскулярну глаукому, ретролентальну фіброплазію, артрит і проліферативну вітреоретинопатію. Відповідно, сполуки, які можуть регулювати ангіогенез або інгібувати продукцію деяких цитокінів, включаючи TNF-α, можуть бути корисні в лікуванні і запобіганні різних захворювань і станів. 2.2 СПОСОБИ ЛІКУВАННЯ РАКУ Сучасна протиракова терапія для видалення пухлинних клітин із організму пацієнта може включати хірургічне втручання, хіміотерапію, гормональну терапію і/або променеву терапію (див., наприклад, Stockdale, 1998, Medicine, vol. 3, Rubenstein and Federman, eds., Chapter 12, Section IV). Останнім часом протиракова терапія може також включати біологічну терапію або імунотерапію. Усі ці підходи мають значні недоліки для пацієнтів. Хірургічне втручання, наприклад, може бути протипоказаним за станом здоров'я пацієнта або може бути неприйнятним для пацієнта. Крім того, операція не може цілком видалити неопластичну тканину. Променева терапія ефективна тільки тоді, коли неопластична тканина виявляє більш високу чутливість до опромінення, ніж здорова тканина. Променева терапія також може часто 1 UA 113512 C2 5 10 15 20 25 30 35 40 45 50 55 60 викликати важкі побічні ефекти. Гормональна терапія рідко застосовується у вигляді монотерапії. Хоча гормональна терапія може бути ефективною, її часто застосовують, щоб попередити або відстрочити рецидив раку після того, як більшість ракових клітин були видалені за допомогою інших методів лікування. Кількість варіантів біологічної терапії і імунотерапії обмежена, і вони можуть викликати побічні ефекти, такі як висип або набряк, грипозні симптоми, включаючи лихоманку, озноб і втому, проблеми із травним трактом або алергічні реакції. Що стосується хіміотерапії, то існує множина хіміотерапевтичних засобів для лікування раку. Більшість протиракових хіміотерапевтичних препаратів діють шляхом інгібування синтезу ДНК, безпосередньо або побічно шляхом інгібування біосинтезу попередників дезоксирибонуклеотидтрифосфатів, щоб запобігти реплікації ДНК і супровідний поділ клітин. Gilman et al., Goodman and Gilman's: The Pharmacological Basis of Therapeutics, Tenth Ed. (McGraw Hill, New York). Незважаючи на наявність різних хіміотерапевтичних агентів, хіміотерапія має багато недоліків. Stockdale, Medicine, vol. 3, Rubenstein and Federman, eds., ch. 12, sect. 10, 1998. Майже всі хіміотерапевтичні препарати є токсичними, і хіміотерапія викликає значні і часто небезпечні побічні ефекти, включаючи сильну нудоту, пригнічення функції кісткового мозку і імуносупресію. Крім того, навіть при введенні комбінацій хіміотерапевтичних агентів, багато пухлинних клітин стійкі або розвивають стійкість до хіміотерапевтичних агентів. Фактично, ці клітини, стійкі до конкретних хіміотерапевтичних агентів, які використовуються у протоколі лікування, часто виявляються стійкими до інших лікарських засобів, навіть, якщо ці агенти діють за іншим механізмом, ніж лікарські засоби, які використовуються в конкретному методі лікування. Це явище називається плейотропною лікарською або мультилікарською резистентністю. Через лікарську резистентність багато видів раку стійкі або стають несприйнятливими до стандартних протоколів хіміотерапевтичних методів лікування. Інші захворювання або стани, асоційовані із або відмінним небажаним ангіогенезом, також важко піддаються лікуванню. Однак деякі сполуки, такі як протамін, гепарини і стероїди, були запропоновані як придатні для лікування деяких конкретних захворювань. Taylor et al., Nature 297:307 (1982); Folkman et al., Science 221:719 (1983); і патенти США № 5001116 і 4994443. Проте, існує значна потреба в безпечних і ефективних методах лікування, попередження і контролю раку і інші захворювання і станів, у тому числі хвороб, які не сприйнятливі до стандартних методів лікування, таких як хірургічне втручання, променева терапія, хіміотерапія і гормональна терапія, із одночасним зниженням або повним виключенням токсичності і/або побічних ефектів, пов'язаних із звичайними методами лікування. 2.3 ТВЕРДІ ФОРМИ Одержання і вибір твердої форми фармацевтичної сполуки є складним процесом, зважаючи на те, що зміна твердої форми може вплинути на різні фізичні і хімічні властивості, які можуть забезпечити переваги і недоліки в одержанні, введенні в рецептуру, стабільності і біодоступності серед інших важливих фармацевтичних характеристик. Потенційні фармацевтичні тверді форми включають кристалічні тверді речовини і аморфні тверді речовини. Аморфні тверді речовини відрізняються відсутністю протяжної структурної упорядкованості, тоді як кристалічні тверді речовини відрізняються структурною періодичністю. Переважаючий клас фармацевтичних твердих форм залежить від конкретного застосування: аморфні тверді речовини іноді вибирають, виходячи, наприклад, із кращого профілю розчинності, у той час як кристалічні тверді речовини можуть бути переважаючими через такі властивості, як, наприклад, фізична або хімічна стабільність (див., наприклад, S. R. Vippagunta et al., Adv. Drug. Deliv. Rev., (2001) 48:3-26; L. Yu, Adv. Drug. Deliv. Rev., (2001) 48:27-42). Кристалічні або аморфні, потенційні тверді форми фармацевтичної сполуки включають однокомпонентні і багатокомпонентні тверді речовини. Однокомпонентні тверді речовини складаються по суті із фармацевтичної сполуки за відсутності інших сполук. Розмаїтість серед однокомпонентних кристалічних речовин потенційно може виникнути, наприклад, внаслідок явища поліморфізму, коли для конкретної фармацевтичної сполуки існує кілька варіантів тривимірної структури (див., наприклад, S. R. Byrn et al., Solid State Chemistry of Drugs, (1999) SSCI, West Lafayette). Важливість вивчення поліморфних форм підкреслив випадок із ритонавіром, інгібітором ВІЛ-протеази, який виготовляли у вигляді м'яких желатинових капсул. Приблизно через два роки після випуску продукту в продаж, непередбачене випадання в осад нової, менш розчинної поліморфної форми у фармацевтичній сполуці вимагало виведення продукту із ринку до розробки більш однорідної сполуки (див. S. R. Chemburkar et al., Org. Process Res. Dev., (2000) 4:413-417). Додаткова розмаїтість серед потенційних твердих форм фармацевтичної сполуки може виникнути, наприклад, через можливість використання багатокомпонентних твердих речовин. 2 UA 113512 C2 5 10 15 20 25 30 35 40 45 50 55 60 Кристалічні тверді речовини, які містять два або декілька видів іонів, можна назвати солями (див., наприклад, Handbook of Pharmaceutical Salts: Properties, Selection and Use, P. H. Stahl and C. G. Wermuth, Eds., (2002), Wiley, Weinheim). Додаткові типи багатокомпонентних твердих речовин, які потенційно можуть забезпечити додаткове поліпшення властивостей фармацевтичної сполуки або її солі, включають, наприклад у числі інших, гідрати, сольвати, співкристали і клатрати (див., наприклад, S. R. Byrn et al., Solid State Chemistry of Drugs, (1999) SSCI, West Lafayette). Більш того, багатокомпонентні кристалічні форми можуть потенційно бути чуттєвими до поліморфізму, коли дана багатокомпонентна композиція може існувати більше ніж в одній тривимірній кристалічній структурі. Одержання твердих форм має велике значення при розробці безпечної, ефективної, стабільної і фармацевтичної сполуки, яка користується попитом. У даному документі наведені варіанти здійснення винаходу, які вирішують проблему потреби у твердих формах 3-(5-аміно-2-метил-4-оксо-4Н-хіназолін-3-іл)піперидин-2,6-діону ("сполуки А"). Сполуку A було описано в патенті США № 7635700, повний зміст якого включено в даний документ шляхом посилання. 3. КОРОТКИЙ ВИКЛАД СУТІ ВИНАХОДУ Даний винахід стосується способів лікування захворювань і розладів із використанням твердої форми 3-(5-аміно-2-метил-4-оксо-4Н-хіназолін-3-іл)піперидин-2,6-діону або його стереоізомера, або їх фармацевтично прийнятної солі, сольвату, гідрату, співкристала, клатрату або поліморфу. Даний винахід стосується твердих форм 3-(5-аміно-2-метил-4-оксо-4Н-хіназолін-3іл)піперидин-2,6-діону або його стереоізомера, або їх фармацевтично прийнятної солі, сольвату, гідрату, співкристала, клатрату або поліморфу. В одному із варіантів здійснення винаходу тверда форма є кристалічною формою А. В іншому варіанті здійснення винаходу тверда форма є кристалічною формою В. У ще одному варіанті здійснення винаходу тверда форма є кристалічною формою С. У ще одному варіанті здійснення винаходу тверда форма є формою D. У ще в одному варіанті здійснення винаходу твердою формою є кристалічна форма Е. У ще одному варіанті здійснення винаходу твердою формою є кристалічна форма F. У ще одному варіанті здійснення винаходу твердою формою є тверда форма гідрохлориду 3-(5аміно-2-метил-4-оксо-4Н-хіназолін-3-іл)піперидин-2,6-діону. У ще одному варіанті здійснення винаходу твердою формою є кристалічна форма A1. Крім того, винахід стосується фармацевтичних композицій, стандартних лікарських форм, режимів дозування і наборів, які включають тверду форму 3-(5-аміно-2-метил-4-оксо-4Нхіназолін-3-іл)піперидин-2,6-діону або його стереоізомера, або їх фармацевтично прийнятної солі, сольвату, гідрату, співкристала, клатрату або поліморфу і фармацевтично прийнятний носій. Додатково, винахід стосується способів лікування і контролю різних захворювань або розладів, які включають уведення пацієнту терапевтично ефективної кількості твердої форми 3(5-аміно-2-метил-4-оксо-4Н-хіназолін-3-іл)піперидин-2,6-діону або його стереоізомера, або їх фармацевтично прийнятної солі, сольвату, гідрату, співкристала, клатрату або поліморфу. Також, винахід стосується способів попередження різних захворювань і розладів, які включають введення пацієнту профілактично ефективної кількості твердої форми 3-(5-аміно-2метил-4-оксо-4Н-хіназолін-3-іл)піперидин-2,6-діону або його стереоізомера, або їх фармацевтично прийнятної солі, сольвату, гідрату, співкристала, клатрату або поліморфу. У деяких варіантах здійснення винаходу твердими формами є однокомпонентні кристалічні форми 3-(5-аміно-2-метил-4-оксо-4Н-хіназолін-3-іл)піперидин-2,6-діону. У деяких варіантах здійснення винаходу твердими формами є багатокомпонентні кристалічні форми 3-(5-аміно-2метил-4-оксо-4Н-хіназолін-3-іл)піперидин-2,6-діону, у тому числі, але без обмеження, солі, співкристали і/або сольвати (включаючи гідрати), які містять 3-(5-аміно-2-метил-4-оксо-4Нхіназолін-3-іл)піперидин-2,6-діон. У деяких варіантах здійснення винаходу твердими формами є однокомпонентні аморфні форми 3-(5-аміно-2-метил-4-оксо-4Н-хіназолін-3-іл)піперидин-2,6діону. У деяких варіантах здійснення винаходу твердими формами є багатокомпонентні аморфні форми 3-(5-аміно-2-метил-4-оксо-4Н-хіназолін-3-іл)піперидин-2,6-діону. Без обмеження якою-небудь конкретною теорією, деякі тверді форми за даним винаходом мають конкретні переважаючі фізичні і/або хімічні властивості, що робить їх придатними, наприклад, для виробництва, одержання, введення в рецептуру і/або зберігання, одночасно маючи особливо переважаючі біологічні властивості, такі як, наприклад, біодоступність і/або біологічна активність. У деяких варіантах здійснення винаходу тверді форми, наведені в даному документі, включають тверді форми, які містять 3-(5-аміно-2-метил-4-оксо-4Н-хіназолін-3-іл)піперидин-2,6 3 UA 113512 C2 5 10 15 20 25 30 35 40 45 50 55 діон, включаючи, але без обмеження, однокомпонентні і багатокомпонентні тверді форми, які містять 3-(5-аміно-2-метил-4-оксо-4Н-хіназолін-3-іл)піперидин-2,6-діон. У деяких варіантах здійснення винаходу тверді форми, наведені в даному документі, включають солі, поліморфи, сольвати (включаючи гідрати) і співкристали, які містять 3-(5-аміно-2-метил-4-оксо-4Н-хіназолін3-іл)піперидин-2,6-діон. Деякі варіанти здійснення даного винаходу стосуються способів виготовлення, виділення і/або опису твердих форм за даним винаходом. Тверді форми, наведені в даному документі, придатні як активні фармацевтичні інгредієнти для одержання фармацевтичних сполук для застосування в пацієнтів. Таким чином, варіанти здійснення даного винаходу охоплюють застосування цих твердих форм як кінцевого лікарського продукту. Деякі варіанти здійснення винаходу стосуються твердих форм, придатних для виготовлення кінцевих лікарських форм із поліпшеними властивостями, наприклад, серед інших - плинністю порошку, пресованістю, таблетованістю, стабільністю і сумісністю із допоміжними речовинами, які необхідні для виготовлення, одержання, введення в рецептуру і/або зберігання кінцевих лікарських засобів. Деякі варіанти здійснення даного винаходу стосуються фармацевтичних композицій, які містять однокомпонентну кристалічну форму, багатокомпонентну кристалічну форму, однокомпонентну аморфну форму і/або багатокомпонентну аморфну форму, які містять 3-(5-аміно-2-метил-4-оксо-4Н-хіназолін-3іл)піперидин-2,6-діон і фармацевтично прийнятний розріджувач, допоміжну речовину або носій. Тверді форми і кінцеві лікарські засоби, наведені в даному документі, придатні, наприклад, для лікування, попередження або лікування захворювань і розладів, зазначених у даному документі. 3.1. КОРОТКИЙ ОПИС ФІГУР На фіг. 1 представлена порошкова рентгенограма ("XRPD") форми А 3-(5-аміно-2-метил-4оксо-4Н-хіназолін-3-іл)піперидин-2,6-діону. На фіг. 2 представлений графік, отриманий диференціальною скануючою калориметрією ("DSC") форми А 3-(5-аміно-2-метил-4-оксо-4Н-хіназолін-3-іл)піперидин-2,6-діону. На фіг. 3 представлений графік, отриманий термогравіметричним аналізом ("TGA") форми А 3-(5-аміно-2-метил-4-оксо-4Н-хіназолін-3-іл)піперидин-2,6-діону. На фіг. 4 представлена порошкова рентгенограма форми В 3-(5-аміно-2-метил-4-оксо-4Нхіназолін-3-іл)піперидин-2,6-діону. На фіг. 5 представлений графік, отриманий DSC форми В 3-(5-аміно-2-метил-4-оксо-4Нхіназолін-3-іл)піперидин-2,6-діону. На фіг. 6 представлений графік, отриманий TGA форми В 3-(5-аміно-2-метил-4-оксо-4Нхіназолін-3-іл)піперидин-2,6-діону. На фіг. 7 представлена порошкова рентгенограма форми С 3-(5-аміно-2-метил-4-оксо-4Нхіназолін-3-іл)піперидин-2,6-діону. На фіг. 8 представлений графік, отриманий DSC форми С 3-(5-аміно-2-метил-4-оксо-4Нхіназолін-3-іл)піперидин-2,6-діону. На фіг. 9 представлений графік, отриманий TGA форми С 3-(5-аміно-2-метил-4-оксо-4Нхіназолін-3-іл)піперидин-2,6-діону. На фіг. 10 представлена порошкова рентгенограма форми D 3-(5-аміно-2-метил-4-оксо-4Нхіназолін-3-іл)піперидин-2,6-діону. На фіг. 11 представлений графік, отриманий DSC форми D 3-(5-аміно-2-метил-4-оксо-4Нхіназолін-3-іл)піперидин-2,6-діону. На фіг. 12 представлений графік, отриманий TGA форми D 3-(5-аміно-2-метил-4-оксо-4Нхіназолін-3-іл)піперидин-2,6-діону. На фіг. 13 представлена порошкова рентгенограма форми Е 3-(5-аміно-2-метил-4-оксо-4Нхіназолін-3-іл)піперидин-2,6-діону. На фіг. 14 представлений графік, отриманий DSC форми Е 3-(5-аміно-2-метил-4-оксо-4Нхіназолін-3-іл)піперидин-2,6-діону. На фіг. 15 представлений графік, отриманий TGA форми Е 3-(5-аміно-2-метил-4-оксо-4Нхіназолін-3-іл)піперидин-2,6-діону. На фіг. 16 представлена порошкова рентгенограма форми F 3-(5-аміно-2-метил-4-оксо-4Нхіназолін-3-іл)піперидин-2,6-діону. На фіг. 17 представлений графік, отриманий DSC форми F 3-(5-аміно-2-метил-4-оксо-4Нхіназолін-3-іл)піперидин-2,6-діону. На фіг. 18 представлена порошкова рентгенограма форми А1 гідрохлориду 3-(5-аміно-2метил-4-оксо-4Н-хіназолін-3-іл)піперидин-2,6-діону. На фіг. 19 представлений графік, отриманий DSC форми А1 гідрохлориду 3-(5-аміно-2метил-4-оксо-4Н-хіназолін-3-іл)піперидин-2,6-діону. 4 UA 113512 C2 5 10 15 На фіг. 20 представлений графік, отриманий TGA форми А1 гідрохлориду 3-(5-аміно-2метил-4-оксо-4Н-хіназолін-3-іл)піперидин-2,6-діону. На фіг. 21 представлений графік динамічної сорбції парів ("DVS") форми A1 гідрохлориду 3(5-аміно-2-метил-4-оксо-4Н-хіназолін-3-іл)піперидин-2,6-діону. Фіг. 22 являє собою отримане під мікроскопом зображення кристалів форми A1 гідрохлориду 3-(5-аміно-2-метил-4-оксо-4Н-хіназолін-3-іл)піперидин-2,6-діону. На фіг. 23 зображені взаємоперетворення між різними твердими формами 3-(5-аміно-2метил-4-оксо-4Н-хіназолін-3-іл)піперидин-2,6-діону. 3.2. ВИЗНАЧЕННЯ У контексті даного документа термін "сполука А" стосується 3-(5-аміно-2-метил-4-оксо-4Н1 хіназолін-3-іл)піперидин-2,6-діону. H-ЯМР-спектр сполуки А по суті є наступним: δ (DMSO-d6): 2,10-2,17 (мультиплет, 1H), 2,53 (синглет, 3H), 2,59-2,69 (мультиплет, 2H), 2,76-2,89 (мультиплет, 1H), 5,14 (подвійний дублет, J=6,11 Гц, 1H), 6,56 (дублет, J=8 Гц, 1H), 6,59 (дублет, 13 J=8 Гц, 1H), 7,02 (синглет, 2H), 7,36 (триплет, J=8 Гц, 1H), 10,98 (синглет, 1H). C-ЯМР-спектр сполуки А по суті є наступним: δ (DMSO-d6): 20,98, 23,14, 30,52, 55,92, 104,15, 110,48, 111,37, 134,92, 148,17, 150,55, 153,62, 162,59, 169,65, 172,57. Не обмежуючи якою-небудь теорією, думають, що сполука А є 3-(5-аміно-2-метил-4-оксо-4Нхіназолін-3-іл)піперидин-2,6-діоном, що має наступну структуру: . 20 25 30 35 40 45 50 55 У контексті даного документа термін "пацієнт" стосується ссавця, зокрема людини. У контексті даного документа термін "фармацевтично прийнятна сіль" стосується солі, отриманої із фармацевтично прийнятних нетоксичних кислоти або основи, включаючи неорганічні кислоти і основи і органічні кислоти і основи. У контексті даного документа термін "побічні ефекти" включає, але без обмеження, шлунково-кишкову, ниркову і печінкову токсичність, лейкопенію, збільшення часу кровотечі внаслідок, наприклад, тромбоцитопенії, і збільшення терміну вагітності, нудоту, блювання, сонливість, астенію, запаморочення, тератогенність, симптоми екстрапірамідних розладів, акатизію, кардіотоксичність, включаючи серцево-судинні порушення, запалення, чоловічу сексуальну дисфункцію і підвищення рівня печінкових ферментів. Термін "шлунково-кишкова токсичність" включає, але без обмеження, шлункові і кишкові виразки і ерозії. Термін "ниркова токсичність" включає, але без обмеження, такі стани, як папілярний некроз і хронічний інтерстиціальний нефрит. У контексті даного документа і якщо не зазначено інше, фрази "знизити або виключити побічні ефекти" і "що знижує або виключає побічні ефекти" означає зниження тяжкості одного або декількох побічних ефектів, зазначених у даному документі. Слід зазначити, що, якщо існує розбіжність між зображеною структурою і назвою, даною цій структурі, зображена структура повинна відповідати більшій вазі. Крім того, якщо стереохімія структури або ділянки структури не зазначена, наприклад, напівжирним шрифтом або пунктирними лініями, то структуру або ділянку структури варто інтерпретувати як такі, що охоплюють усі стереоізомери. У контексті даного документа і якщо не зазначено інше, терміни "тверда форма" і споріднені терміни стосуються фізичної форми, яка переважно не знаходиться в рідкому або газоподібному стані. У контексті даного документа і, якщо не зазначено інше, термін "тверда форма" і споріднені терміни, коли вони використовуються в даному документі відносно сполуки А, стосуються фізичної форми, що містить сполуку А, яка переважно не знаходиться в рідкому або газоподібному стані. Тверді форми можуть бути кристалічними, аморфними або їх сумішами. У конкретних варіантах здійснення винаходу тверді форми можуть бути рідкими кристалами. "Однокомпонентна" тверда форма, яка містить сполуку А, по суті складається зі сполуки А. "Багатокомпонентна" тверда форма, яка містить сполуку А, містить у твердій формі значну кількість однієї або декількох додаткових сполук, таких як іони і/або молекули. У деяких варіантах здійснення винаходу "багатокомпонентна" тверда форма, яка містить сполуку А, являє собою гідрохлорид сполуки А. Наприклад, у конкретних варіантах здійснення винаходу кристалічна багатокомпонентна тверда форма, яка містить сполуку А, додатково містить одну 5 UA 113512 C2 5 10 15 20 25 30 35 40 45 50 55 60 або декілька сполук, нековалентно зв'язаних у регулярних положеннях у кристалічній решітці. Багатокомпонентні тверді форми, які містять сполуку А, включають співкристали, сольвати (наприклад, гідрати) і клатрати сполуки А. У конкретних варіантах здійснення винаходу термін "тверда форма, яка містить сполуку А" і споріднені терміни включають однокомпонентні і багатокомпонентні тверді форми, які містять сполуку А. У конкретних варіантах здійснення винаходу термін "тверді форми, які містять сполуку А" і споріднені терміни включають кристалічні форми, які містять сполуку А, аморфні форми, які містять сполуку А, і їх суміші. У контексті даного документа і якщо не зазначено інше, термін "кристалічний" і споріднені терміни, які використовують в даному документі, при їх використанні для опису сполуки, речовини, модифікації, матеріалу, компонента або продукту, якщо не зазначено інше, означають, що сполука, речовина, модифікація, матеріал, компонент або продукт є по суті кристалічними, як визначено за допомогою рентгенівської дифракції. Див., наприклад, st Remington: The Science and Practice of Pharmacy, 21 edition, Lippincott, Williams and Wilkins, rd Baltimore, MD (2005); The United States Pharmacopeia, 23 ed., 1843-1844 (1995). У контексті даного документа і якщо не зазначено інше, термін "форми кристалів", "кристалічні форми" і споріднені терміни в даному документі стосуються твердих форм, які є кристалічними. Кристалічні форми включають однокомпонентні кристалічні форми і багатокомпонентні кристалічні форми, і вони включають, але без обмеження, солі (наприклад, гідрохлориди), поліморфи, сольвати, гідрати і/або інші молекулярні комплекси. У деяких варіантах здійснення винаходу кристалічна форма речовини може бути по суті вільна від аморфних форм і/або інших кристалічних форм. У деяких варіантах здійснення винаходу кристалічна форма речовини може містити менше ніж приблизно 1 %, 2 %, 3 %, 4 %, 5 %, 6 %, 7 %, 8 %, 9 %, 10 %, 15 %, 20 %, 25 %, 30 %, 35 %, 40 %, 45 % або 50 % однієї або декількох аморфних форм і/або інших кристалічних форм за вагою. У деяких варіантах здійснення винаходу кристалічна форма речовини може бути фізично і/або хімічно чистою. У деяких варіантах здійснення винаходу кристалічна форма речовини може бути приблизно на 99 %, 98 %, 97 %, 96 %, 95 %, 94 %, 93 %, 92 %, 91 % або 90 % фізично і/або хімічно чистою. У контексті даного документа і якщо не зазначено інше, терміни "поліморфи", "поліморфні форми" і споріднені терміни в даному документі стосуються двох або декількох кристалічних форм, які складаються по суті із однієї і тієї ж молекули, молекул і/або іонів. Як різні кристалічні форми, різні поліморфні форми можуть мати різні фізичні властивості, такі як, наприклад, температура плавлення, теплота плавлення, розчинність, властивості при розчиненні і/або коливальний спектр, у результаті організації або конформації молекули і/або іонів у кристалічній решітці. Розходження у фізичних властивостях можуть уплинути на фармацевтичні параметри, такі як стабільність при зберіганні, пресованість і щільність (важливо при введенні в рецептуру і виробництві продукту), а також швидкість розчинення (важливий фактор для біодоступності). Розходження в стабільності можуть бути результатом змін у хімічній реакційній здатності (наприклад, неоднакового окиснення, так що лікарська форма знебарвлюється швидше, коли складається із однієї поліморфної форми, ніж коли складається із іншої поліморфної форми) або механічних змін (наприклад, таблетки кришаться при зберіганні, тому що кінетично переважаюча поліморфна форма перетворюється в термодинамічно більш стабільну поліморфну форму), або їх обох (наприклад, таблетки із однієї поліморфної форми більше піддані руйнуванню при високій вологості). У крайньому випадку, у результаті розходжень у розчинності/розчиненні деякі твердофазні переходи можуть привести до відсутності активності або, навпаки, до токсичності. Крім того, фізичні властивості можуть бути важливі для одержання (наприклад, одна поліморфна форма може із більшою імовірністю утворювати сольвати, або її може бути важко фільтрувати і відмивати від домішок, а також форма частинок і розподіл за розмірами можуть розрізнятися між поліморфними формами). У контексті даного документа і якщо не зазначено інше, терміни "сольват" і "сольватований" стосуються кристалічної форми речовини, яка містить розчинник. Терміни "гідрат" і "гідратований" стосуються сольвату, у якому розчинник містить воду. Термін "поліморфи сольватів" стосується існування більше однієї кристалічної форми для конкретної композиції сольватів. Аналогічним чином, термін "поліморфи гідратів" стосується існування більше однієї кристалічної форми для конкретної композиції гідратів. Термін "десольватований сольват" у контексті даного документа стосується кристалічної форми речовини, яка може бути отримана видаленням розчинника із сольвату. У контексті даного документа і якщо не зазначено інше, терміни "аморфний", "аморфна форма" і пов'язані із ними терміни, які використовуються в даному документі, означають, що речовина, компонент або продукт, про який іде мова, по суті не є кристалічним, як визначено рентгенівською дифракцією. Зокрема, термін "аморфна форма" описує неупорядковані тверді 6 UA 113512 C2 5 10 15 20 25 30 35 40 45 50 55 60 форми, тобто тверді форми, у яких відсутня протяжна кристалічна упорядкованість. У деяких варіантах здійснення винаходу аморфна форма речовини може бути по суті вільна від інших аморфних форм і/або кристалічних форм. В інших варіантах здійснення винаходу аморфна форма речовини може містити приблизно менше 1 %, 2 %, 3 %, 4 %, 5 %, 10 %, 15 %, 20 %, 25 %, 30 %, 35 %, 40 %, 45 % або 50 % однієї або декількох інших аморфних форм і/або кристалічних форм за вагою. У деяких варіантах здійснення винаходу аморфна форма речовини може бути фізично і/або хімічно чистою. У деяких варіантах здійснення винаходу аморфна форма речовини може бути приблизно на 99 %, 98 %, 97 %, 96 %, 95 %, 94 %, 93 %, 92 %, 91 % або 90 % фізично і/або хімічно чистою. Методики характеристики кристалічних форм і аморфних форм включають, але без обмеження, термогравіметричний аналіз (TGA), диференціальну скануючу калориметрію (DSC), порошкову рентгенівську дифрактометрію (XRPD), рентгенівську дифрактометрію монокристалів, коливальну спектроскопію, наприклад, інфрачервону (IR) спектроскопію і Раманівську спектроскопію, ядерну магнітно-резонансну спектроскопію (ЯМР) твердого тіла і у розчині, оптичну мікроскопію, високотемпературну оптичну мікроскопію, скануючу електронну мікроскопію (SEM), електронну кристалографію і кількісний аналіз, аналіз розміру частинок (PSA), аналіз площі поверхні, дослідження розчинності, дослідження розчинення, елементний аналіз і аналіз Карла Фішера. Характеристичні параметри елементарної комірки можуть бути визначені із використанням одного або декількох методів, таких як, але без обмеження, рентгенівська дифракція і нейтронна дифракція, включаючи дифракцію на монокристалах і порошкову дифракцію. Методи, придатні для аналізу даних порошкової дифракції, включають уточнення профілю, таке як уточнення методом Рітвельда, який можна використовувати, наприклад, для аналізу дифракційних піків, асоційованих із однією фазою в зразку, який містить більше однієї твердої фази. Інші способи, придатні для аналізу даних порошкової дифракції, включають індексацію елементарних комірок, що дозволяє фахівцю в даній галузі визначити параметри елементарної комірки із зразка, який містить кристалічний порошок. У контексті даного документа і якщо не зазначено інше, терміни "примірно" і "приблизно" при використанні в зв'язку із числовим або значенням діапазоном значень, які наведені для опису конкретної твердої форми, наприклад, конкретної температури або діапазону температур, таких як, наприклад, що описують DSC або TGA термічну подію, включаючи, наприклад, плавлення, дегідратацію, десольватацію або склування; зміни маси, такої як, наприклад, зміна маси в залежності від температури або вологості; вмісту розчинника або води, наприклад, масовим або процентним; або положення піків, таких як, наприклад, в аналізі методами ІЧ-спектроскопії або Раманівської спектроскопії, або XRPD; указують, що значення або діапазон значень можуть відхилятися в такій мірі, що фахівцем у даній галузі вважається розумною, при цьому усе ще описуючи конкретну тверду форму. Наприклад, терміни "приміром" і "приблизно" при використанні в даному контексті і якщо не зазначено інше, указують, що числове значення або діапазон значень може варіювати в межах 25 %, 20 %, 15 %, 10 %, 9 %, 8 %, 7 %, 6 %, 5 %, 4 %, 3 %, 2 %, 1,5 %, 1 %, 0,5 % або 0,25 % від зазначеного значення або діапазону значень. У контексті даного документа і якщо не зазначено інше, зразок, який містить конкретну кристалічну форму або аморфну форму, яка є "по суті чистою", наприклад, по суті вільною від інших твердих форм і/або інших хімічних сполук, містить, у окремих варіантах здійснення винаходу, приблизно менше 25 %, 20 %, 15 %, 10 %, 9 %, 8 %, 7 %, 6 %, 5 %, 4 %, 3 %, 2 %, 1 %, 0,75 %, 0,5 %, 0,25 % або 0,1 % (за вагою) однієї або декількох інших твердих форм і/або інших хімічних сполук. У контексті даного документа і якщо не зазначено інше, або зразок композиція які "по суті вільні" від однієї або декількох інших твердих форм і/або інших хімічних сполук, означає, що композиція містить, у приватних варіантах здійснення винаходу, приблизно менше 25 %, 20 %, 15 %, 10 %, 9 %, 8 %, 7 %, 6 %, 5 %, 4 %, 3 %, 2 %, 1 %, 0,75 %, 0,5 %, 0,25 % або 0,1 % за вагою однієї або декількох інших твердих форм і/або інших хімічних сполук. У контексті даного документа і якщо не зазначено інше, терміни "лікувати", "лікуючий" і "лікування" стосуються усунення або ослаблення захворювання або розладу, або одного або декількох симптомів, асоційованих із захворюванням або розладом. У деяких варіантах здійснення винаходу терміни стосуються мінімізації поширення або погіршення захворювання або розладу в результаті введення одного або декількох профілактичних або терапевтичних засобів пацієнту із таким захворюванням або розладом. У деяких варіантах здійснення винаходу терміни стосуються введення сполуки, наведеної в даному документі, спільно або без іншого додаткового активного засобу після появи симптомів конкретного захворювання. У контексті даного документа і якщо не зазначено інше, терміни "попередити", "попереджуючий" і "попередження" стосуються запобігання появи, рецидиву або поширення 7 UA 113512 C2 5 10 15 20 25 30 35 40 45 50 55 60 захворювання або розладу одного або декількох їх симптомів. У деяких варіантах здійснення винаходу терміни стосуються лікування сполукою або введення сполуки, наведеної в даному документі, спільно або без іншої додаткової активної сполуки до появи симптомів, особливо пацієнтам, які мають ризик захворювань або розладів, зазначених у даному документі. Терміни охоплюють придушення або зменшення симптому конкретного захворювання. Зокрема, у деяких варіантах здійснення винаходу пацієнти із захворюванням у сімейному анамнезі є кандидатами для застосування профілактичних схем. Крім того, пацієнти, які мають в анамнезі рецидив симптомів, також є потенційними кандидатами для профілактики. У цьому значенні термін "попередження" може використовуватися взаємозамінно із терміном "профілактика". У контексті даного документа і якщо не зазначено інше, терміни "контролювати", "контролюючий" і "контроль" стосуються попередження або уповільнення розвитку, поширення або погіршення захворювання або розладу або одного або декількох його симптомів. Часто корисні ефекти, які пацієнт одержує від профілактичного і/або терапевтичного засобу, не приводять до лікування захворювання або розладу. У зв'язку із ним термін "контролюючий" охоплює лікування пацієнта, який мав конкретне захворювання, для того, щоб спробувати попередити або мінімізувати рецидив захворювання. У контексті даного документа і якщо не зазначено інше, "терапевтично ефективна кількість" сполуки являє собою кількість, достатню для забезпечення терапевтичної користі при лікуванні або контролі захворювання або розладу, або для уповільнення або мінімізації одного або декількох симптомів, асоційованих із захворюванням або розладом. Терапевтично ефективна кількість сполуки означає кількість терапевтичного засобу, окремо або в сполученні із іншими терапевтичними засобами, що забезпечує терапевтичну користь при лікуванні або контролі захворювання або розладу. Термін "терапевтично ефективна кількість" може охоплювати кількість, що поліпшує загальну терапію, або знижує усуває симптоми або причини захворювання або розладу, або підсилює терапевтичну ефективність іншого терапевтичного засобу. У контексті даного документа і якщо не зазначено інше, "профілактично ефективна кількість" сполуки являє собою кількість, достатню для попередження захворювання або розладу або попередження його рецидиву. Профілактично ефективна кількість сполуки означає кількість терапевтичного засобу, окремо або в сполученні із іншими засобами, що забезпечує профілактичну користь відносно попередження захворювання. Термін "профілактично ефективна кількість" може охоплювати кількість, яка поліпшує загальну профілактику або підсилює профілактичну ефективність іншого профілактичного засобу. Передбачається, що термін "композиція" у контексті даного документа охоплює продукт, який містить зазначені інгредієнти (і в зазначених кількостях, якщо зазначено), а також продукт, який прямо або опосередковано є результатом сполучення зазначених інгредієнтів у зазначених кількостях. Під "фармацевтично прийнятним" мають на увазі, що розріджувач, допоміжні речовини або носій повинні бути сумісними із іншими інгредієнтами препарату і не повинні бути небезпечними для його реципієнта. 4. ДОКЛАДНИЙ ОПИС ВИНАХОДУ Даний винахід стосується твердих форм сполуки А, яка являє собою 3-(5-аміно-2-метил-4оксо-4Н-хіназолін-3-іл)піперидин-2,6-діон і її стереоізомери, і їх фармацевтично прийнятні солі, сольвати, гідрати, співкристали, клатрати і поліморфи, а також способів застосування і композицій, які містять тверду форму сполуки А або його стереоізомера, або їх фармацевтично прийнятної солі, сольвату, гідрату, співкристала, клатрату або поліморфу. Наприклад, даний винахід охоплює in vitro і in vivo застосування твердої форми сполуки А і включення твердої форми сполуки А у фармацевтичні композиції і стандартні лікарські форми, придатні для лікування і попередження різних захворювань і розладів. 4.1. ТВЕРДІ ФОРМИ СПОЛУКИ А В одному варіанті здійснення винахід стосується твердих форм сполуки А або його стереоізомера, або їх фармацевтично прийнятної солі, сольвату, гідрату, співкристала, клатрату або поліморфу. Сполуку А легко одержують із використанням способів, описаних у патенті США № 7635700, повний зміст якого включено в даний документ шляхом посилання. Тверді форми, які містять сполуку А, включають однокомпонентні і багатокомпонентні форми, у тому числі кристалічні форми і аморфні форми, включаючи, але без обмеження ними, солі, поліморфи, сольвати, гідрати, співкристали і клатрати. Конкретні варіанти здійснення даного винаходу стосуються однокомпонентних аморфних твердих форм сполуки А. Конкретні варіанти здійснення даного винаходу стосуються однокомпонентних кристалічних твердих форм сполуки А. Конкретні варіанти здійснення даного винаходу стосуються багатокомпонентних 8 UA 113512 C2 5 10 15 20 25 30 35 40 45 50 55 60 аморфних форм, які містять сполуку А. Конкретні варіанти здійснення даного винаходу стосуються багатокомпонентних кристалічних твердих форм, які містять сполуку А. Багатокомпонентні тверді форми, представлені в даному документі, включають тверді форми, які можуть бути описані термінами "сіль", "співкристал", "гідрат", "сольват", "клатрат" і/або "поліморф", і включають тверді форми, які можуть бути описані одним або декількома із цих термінів. Тверді форми, які містять сполуку А, можуть бути отримані способами, описаними в даному документі, включаючи способи, описані нижче в прикладах, або за методиками, відомими у даній галузі, включаючи нагрівання, охолодження, сушіння при заморожуванні, ліофілізацію, різке охолодження розплаву, швидке випаровування розчинника, повільне випаровування розчинника, перекристалізацію із розчинника, додавання антирозчинника, перекристалізацію із суспензії, кристалізацію із розплаву, десольватацію, перекристалізацію в обмеженому просторі, наприклад, у нанопорах або капілярах, перекристалізацію на поверхні носія, наприклад, на полімерах, перекристалізацію в присутності добавок, таких як, наприклад, протимолекули в співкристалі, десольватацію, дегідратацію, швидке охолодження, повільне охолодження, контакт із розчинником і/або водою, сушіння, включаючи, наприклад, вакуумне сушіння, дифузію парів, сублімацію, подрібнювання (у тому числі, наприклад, кріоподрібнювання, подрібнювання в мінімальній кількості або розчинника подрібнювання за допомогою рідини), осадження, яке викликається мікрохвильовим випромінюванням, осадження, яке викликається ультразвуковим випромінюванням, осадження, яке викликається лазерним випромінюванням, і осадження із надкритичних рідин. Розмір частинок отриманих твердих форм, який може варіювати, наприклад, від нанометрового до міліметрового діапазону, можна контролювати, наприклад, за допомогою зміни умов кристалізації, таких як, наприклад, швидкість кристалізації і/або система розчинників для кристалізації, або за допомогою методик зменшення розмірів частинок, наприклад, за допомогою подрібнювання, перемелювання, мікронізації або обробки ультразвуком. Без зв'язку із якою-небудь конкретною теорією, деякі тверді форми відрізняються фізичними властивостями, наприклад, стабільністю, розчинністю і швидкістю розчинення, які придатні для фармацевтичних і терапевтичних лікарських форм. Крім того, хоч і без зв'язку із якою-небудь конкретною теорією, деякі тверді форми відрізняються фізичними властивостями (наприклад, щільністю, пресованістю, твердістю, морфологією, розпаданням, липкістю, розчинністю, поглинанням води, електричними властивостями, температурними властивостями, реакційною здатністю у твердому стані, фізичною стабільністю і хімічною стабільністю), що впливають на конкретні процеси (наприклад, вихід продукту, фільтрацію, промивання, сушіння, подрібнювання, змішування, таблетування, плинність, розчинення, введення в рецептуру і ліофілізацію), які роблять деякі тверді форми придатними для виготовлення твердої лікарської форми. Такі властивості можуть бути визначені із використанням конкретних методів аналітичної хімії, включаючи методи аналізу твердої речовини (наприклад, рентгенівську дифракцію, мікроскопію, спектроскопію і термічний аналіз), описані в даному документі і відомі в даній галузі. Деякі варіанти здійснення винаходу стосуються композицій, які містять одну або кілька твердих форм. Деякі варіанти здійснення винаходу стосуються композицій однієї або декількох твердих форм у комбінації із іншими діючими інгредієнтами. Деякі варіанти здійснення стосуються способів застосування цих композицій для лікування, запобігання або контролю захворювань і розладів, включаючи, але без обмеження, захворювання і порушення, наведені в даному документі. Тверді форми за даним винаходом можуть також містити неприродні співвідношення ізотопів одного або декількох атомів у сполуці А. Наприклад, сполука може бути радіоактивно 3 125 міченим радіоактивними ізотопами, такими як, наприклад, тритій ( H), йод-125 ( I), сірка-35 35 14 ( S) або вуглець-14 ( С). Радіоактивно мічені сполуки придатні як терапевтичні засоби, наприклад, протиракові терапевтичні засоби, аналітичні реагенти, наприклад, реагенти для методів аналізу зв'язування, і діагностичні засоби, наприклад, контрастні речовини. Передбачається, що всі ізотопні варіанти сполуки А, незалежно від того, радіоактивні вони чи ні, входять в обсяг варіантів здійснення винаходу, наведених у даному документі. 4.1.1. ФОРМА A СПОЛУКИ A Деякі варіанти здійснення даного винаходу стосуються кристалічної форми А сполуки А. Форма А може бути отримана кристалізацією із суміші DMSO:вода при кімнатній температурі шляхом розчинення сполуки А в суміші DMSO:вода в співвідношенні 95:5 (за об'ємом) і кристалізації шляхом додавання води до об'ємного співвідношення DMSO:вода 50:50. Велике дослідження розчинників привело до вибору системи DMSO:вода, причому вода є 9 UA 113512 C2 антирозчинником. У таблиці 1 показана розчинність форми А в системі DMSO:вода в міру збільшення відносної кількості DMSO. 5 10 15 20 25 30 35 40 У деяких варіантах здійснення винаходу форма А сполуки А може бути охарактеризована за допомогою порошкової рентгенівської дифракції. Типова XRPD-дифрактограма форми А сполуки А наведена на фіг. 1. У деяких варіантах здійснення винаходу форма А сполуки А відрізняється XRPD-піками, розташованими в одній, двох, трьох, чотирьох, п'яти, шести, семи, восьми, дев'яти, десяти, одинадцяти, дванадцяти або тринадцяти із наступних приблизних позицій: 9,2, 13,4, 14,0, 14,6, 15,6, 16,7, 18,5, 21,9, 22,7, 24,8, 28,1, 30,0 і 37,0 градусів 2θ. В одному варіанті здійснення винаходу форма А сполуки А відрізняється XRPD-піками, розташованими в наступних приблизних позиціях: 14,6, 15,6, 16,7, 21,9 і 30,0 градусів 2θ. У деяких варіантах здійснення винаходу форма А сполуки А відрізняється XRPDдифрактограмою, яка відповідає дифрактограмі, представленій на фіг. 1. У деяких варіантах здійснення винаходу форма А сполуки А відрізняється XRPD-дифрактограмою, що має 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 або 13 піків, які відповідають пікам на типовій дифрактограмі форми А, наведеної в даному документі. У деяких варіантах здійснення винаходу форма А сполуки А може бути охарактеризована за допомогою термічного аналізу. Типовий DSC-графік для форми А сполуки А показаний на фіг. 2. У деяких варіантах здійснення винаходу форма А характеризується DSC-графіком, який включає ендотермічну подію із початковою температурою близько 282 °C. У деяких варіантах здійснення винаходу характеристичний DSC-графік форми А додатково містить одну або декілька додаткових подій, таких як, наприклад, ендотермічний пік при температурі приблизно 145 °C, і/або екзотермічна подія із піковою температурою близько 161 °C. Типовий TGA-графік для форми А сполуки А показаний на фіг. 3. У деяких варіантах здійснення винаходу форма А характеризується TGA-графіком, який включає втрату маси приблизно менше ніж на 10 %, приблизно менше ніж на 8 % або приблизно менше ніж на 6 %, наприклад, приблизно на 5,9 % від загальної маси зразка при нагріванні від приблизно 40 °C до приблизно 110 °C. В одному варіанті здійснення винаходу форма А характеризується TGA-графіком, який включає втрату маси від приблизно 5 % до приблизно 6 % від загальної маси зразка при нагріванні приблизно від приблизно 40 °C до приблизно 110 °C. У деяких варіантах здійснення винаходу форма А сполуки А містить або воду, або інший розчинник у кристалічній решітці. У деяких варіантах здійснення винаходу подія втрати маси в TGA включає втрату води. У деяких варіантах здійснення винаходу форма А є сольватованою. У деяких варіантах здійснення винаходу форма А є моногідратом. У деяких варіантах здійснення винаходу кристалічна решітка форми А містить приблизно один молярний еквівалент води на моль сполуки А. У деяких варіантах здійснення винаходу після дегідратації форма А перетворюється у форму D сполуки А. В одному варіанті здійснення винаходу форма А перетворюється у форму D сполуки А при висушуванні при температурі приблизно 55 °C протягом 3 днів. Форма А 10 UA 113512 C2 5 10 15 20 25 30 35 40 45 50 55 60 сполуки А може бути отримана із форми D шляхом суспендування форми D у воді при 22 °C або 50 °C протягом ночі. В одному варіанті здійснення винаходу форма А сполуки А фізично і хімічно стабільна при 40 °C протягом 5 днів у вакуумі. В іншому варіанті здійснення винаходу форма А сполуки А фізично і хімічно стабільна при 40 °C протягом 4 днів в атмосфері азоту. У деяких варіантах здійснення винаходу форма А сполуки А може бути охарактеризована за допомогою аналізу сорбції вологи. У деяких варіантах здійснення, коли відносна вологість ("RH") збільшується від приблизно 0 % до приблизно 95 % RH, маса форми А змінюється в діапазоні від приблизно 1 % до приблизно 10 %, від приблизно 2 % до приблизно 5 % або від приблизно 3 % до приблизно 4 % від вихідної маси зразка. У деяких варіантах здійснення винаходу маса, отримана при адсорбції, втрачається при зниженні RH назад до приблизно 0 % RH. Деякі варіанти здійснення винаходу стосуються форми А сполуки А, яка є по суті чистою. Деякі варіанти здійснення винаходу стосуються форми А сполуки А, яка по суті є вільною від інших твердих форм, що містять сполуку А, включаючи, наприклад, форми B, C, D, E і F і/або аморфну тверду форму, яка містить сполуку А за даним винаходом, а також форму A1 і аморфну тверду форму, які включають гідрохлорид сполуки А за даним винаходом. Деякі варіанти здійснення винаходу стосуються форми А в вигляді суміші твердих форм, які містять сполуку А, у тому числі, наприклад, суміші, що містить одну або декілька із наступних форм: форми B, C, D, E, F і аморфну тверду форму, які містять сполуку А за даним винаходом, а також форму A1 і аморфну тверду форму, що містять гідрохлорид сполуки А за даним винаходом. 4.1.2. ФОРМА В СПОЛУКИ А Деякі варіанти здійснення винаходу стосуються кристалічної форми В сполуки А. У деяких варіантах здійснення винаходу форма B сполуки А може бути отримана із різних розчинників, включаючи, але без обмеження, систему розчинників, яка містить ацетон, ацетонітрил, метанол і їх суміші. У деяких варіантах здійснення винаходу форма B може бути отримана із використанням способу перекристалізації із суспензії. У деяких варіантах здійснення винаходу форму В одержують із використанням способу перекристалізації із суспензії в ацетоні, ацетонітрилі, метанолі або їх сумішах, при температурі близько 50 °C. У деяких варіантах здійснення винаходу форма В сполуки А може бути охарактеризована за допомогою порошкової рентгенівської дифракції. Типова XRPD-дифрактограма форми В сполуки А наведена на фіг. 4. У деяких варіантах здійснення винаходу форма В сполуки А відрізняється XRPD-піками, розташованими в одній, двох, трьох, чотирьох, п'яти, шести, семи, восьми, дев'яти, десяти, одинадцяти, дванадцяти, тринадцяти, чотирнадцяти, п'ятнадцяти або шістнадцяти із наступних приблизних позицій: 10,6, 11,4, 12,6, 13,7, 14,7, 19,1, 20,3, 20,9, 21,2, 22,9, 24,9, 25,3, 25,9, 26,9, 29,5 і 33,8 градусів 2θ. В одному варіанті здійснення винаходу форма В сполуки А відрізняється XRPD-піками, розташованими в наступних приблизних позиціях: 10,6, 14,7, 19,1 і 25,9 градусів 2θ. У деяких варіантах здійснення винаходу форма В сполуки А відрізняється XRPD-дифрактограмою, яка відповідає дифрактограмі, представленій на фіг. 4. У деяких варіантах здійснення винаходу форма В сполуки А відрізняється XRPDдифрактограмою, яка має 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 або 16 піків, які відповідають пікам на типовій дифрактограмі форми В, наведеної в даному документі. У деяких варіантах здійснення винаходу форма В сполуки А може бути охарактеризована за допомогою термічного аналізу. Типовий DSC-графік для форми В сполуки А показаний на фіг. 5. У деяких варіантах здійснення винаходу форма В характеризується DSC-графіком, який включає ендотермічну подію із початковою температурою близько 279 °C. Типовий TGA-графік для форми В сполуки А показаний на фіг. 6. У деяких варіантах здійснення винаходу форма В характеризується TGA-графіком, який включає втрату маси приблизно менше ніж на 1 %, приблизно менше ніж на 0,5 %, приблизно менше ніж на 0,1 % або приблизно менше ніж на 0,05 % від загальної маси зразка при нагріванні від приблизно 25 °C до приблизно 200 °C. У деяких варіантах здійснення винаходу форма В сполуки А не містить істотної кількості води або іншого розчинника в кристалічній решітці. У деяких варіантах здійснення винаходу форма В є безводною. У деяких варіантах здійснення форма В є несольватованою. У деяких варіантах здійснення винаходу форма В сполуки А може бути охарактеризована за допомогою аналізу сорбції вологи. У деяких варіантах здійснення, коли RH збільшується від приблизно 0 % до приблизно 95 % RH, маса форми В змінюється менше ніж приблизно на 1 %, менше ніж приблизно на 0,5 % або менше ніж приблизно на 0,2 %, наприклад, приблизно на 0,1 %, від вихідної маси зразка. У деяких варіантах здійснення винаходу маса, набрана при адсорбції, втрачається при зниженні RH назад до приблизно 0 % RH. У деяких варіантах здійснення винаходу форма В по суті негігроскопічна. У деяких варіантах здійснення винаходу 11 UA 113512 C2 5 10 15 20 25 30 35 40 45 50 55 60 XRPD-дифрактограма речовини форми В по суті не змінюється після аналізу адсорбції/десорбції. У деяких варіантах здійснення винаходу форма B стійка до вологості. Деякі варіанти здійснення винаходу стосуються форми В сполуки А, яка є по суті чистою. Деякі варіанти здійснення винаходу стосуються форми В сполуки А, яка по суті є вільною від інших твердих форм, що містять сполуку А, включаючи, наприклад, форми А, C, D, E, F і/або аморфну тверду форму, які містять сполуку А за даним винаходом, а також форму A1 і аморфну тверду форму, які містять гідрохлорид сполуки А за даним винаходом. Деякі варіанти здійснення винаходу стосуються форми В у вигляді суміші твердих форм, які містять сполуку А, у тому числі, наприклад, суміші, що містить одну або декілька із наступних форм: форми А, C, D, E, F і аморфну тверду форму, які містять сполуку А за даним винаходом, а також форму A1 і аморфну тверду форму, які містять гідрохлорид сполуки А за даним винаходом. 4.1.3. ФОРМА C СПОЛУКИ A Деякі варіанти здійснення винаходу стосуються кристалічної форми С сполуки А. У деяких варіантах здійснення винаходу форма C сполуки А може бути отримана із різних розчинників, включаючи, але без обмеження, системи розчинників, які містять етилацетат, етанол, 2пропанол, метилетилкетон, н-бутанол, тетрагідрофуран і суміші, які містять два або декілька із них. У деяких варіантах здійснення винаходу форма із може бути отримана із використанням перекристалізації із суспензії. У деяких варіантах здійснення винаходу форму C може бути одержана із використанням перекристалізації із суспензії із етилацетату, етанолу, 2-пропанолу, метилетилкетону, н-бутанолу, тетрагідрофурану або суміші, яка містить два або декілька із них, при температурі приблизно 50 °C. У деяких варіантах здійснення винаходу форма С сполуки А може бути охарактеризована за допомогою порошкової рентгенівської дифракції. Типова XRPD-дифрактограма форми С сполуки А наведена на фіг. 7. У деяких варіантах здійснення винаходу форма С сполуки А відрізняється XRPD-піками, розташованими в одній, двох, трьох, чотирьох, п'яти, шести, семи, восьми, дев'яти, десяти або одинадцяти із наступних приблизних позицій: 10,8, 11,9, 15,1, 18,8, 19,2, 19,3, 22,0, 24,9, 25,1, 26,6 і 29,2 градусів 2θ. В одному варіанті здійснення винаходу форма С сполуки А відрізняється XRPD-піками, розташованими в наступних приблизних позиціях: 10,8, 15,1, 25,1 і 26,6 градусів 2θ. У деяких варіантах здійснення винаходу форма С сполуки А відрізняється XRPD-дифрактограмою, яка відповідає дифрактограмі, представленій на фіг. 7. У деяких варіантах здійснення винаходу форма С сполуки А відрізняється XRPDдифрактограмою, яка має 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 або 11 піків, що відповідають пікам на типовій дифрактограмі форми С, наведеної в даному документі. У деяких варіантах здійснення винаходу форма С сполуки А може бути охарактеризована за допомогою термічного аналізу. Типовий DSC-графік для форми С сполуки А показаний на фіг. 8. У деяких варіантах здійснення винаходу форма із характеризується DSC-графіком, який включає ендотермічну подію із початковою температурою близько 281 °C. Типовий TGA-графік для форми С сполуки А показаний на фіг. 9. У деяких варіантах здійснення винаходу форма С характеризується TGA-графіком, який включає втрату маси приблизно менше ніж на 1 %, приблизно менше ніж на 0,5 % або приблизно менше ніж на 0,1 %, наприклад, приблизно на 0,07 % від загальної маси зразка при нагріванні від приблизно 25 °C до приблизно 150 °C. У деяких варіантах здійснення винаходу форма С сполуки А не містить суттєвої кількості або води іншого розчинника в кристалічній решітці. У деяких варіантах здійснення винаходу форма С є безводною. У деяких варіантах здійснення форма С є несольватованою. У деяких варіантах здійснення винаходу форма С сполуки А може бути охарактеризована за допомогою аналізу сорбції вологи. У деяких варіантах здійснення, коли RH збільшується від приблизно 0 % до приблизно 95 % RH, маса форми С змінюється менше ніж приблизно на 1 %, менше ніж приблизно на 0,5 % або менше ніж приблизно на 0,2 %, наприклад, приблизно на 0,17 %, від вихідної маси зразка. У деяких варіантах здійснення винаходу маса, набрана при адсорбції, втрачається при зниженні RH назад до приблизно 0 % RH. У деяких варіантах здійснення винаходу форма С по суті негігроскопічна. У деяких варіантах здійснення винаходу XRPD-дифрактограма речовини форми С по суті не змінюється після аналізу адсорбції/десорбції. У деяких варіантах здійснення винаходу форма С стійка до вологості. Деякі варіанти здійснення винаходу стосуються форми С сполуки А, яка є по суті чистою. Деякі варіанти здійснення винаходу стосуються форми С сполуки А, яка по суті є вільною від інших твердих форм, які містять сполуку А, включаючи, наприклад, форми А, В, D, E, F і/або аморфну тверду форму, які містять сполуку А за даним винаходом, а також форму A1 і аморфну тверду форму, які містять гідрохлорид сполуки А за даним винаходом. Деякі варіанти здійснення винаходу стосуються форми С у вигляді суміші твердих форм, які містять сполуку А, у тому числі, наприклад, суміші, які містить одну або декілька із наступних форм: форми А, В, D, 12 UA 113512 C2 5 10 15 20 25 30 35 40 45 50 55 60 E, F і аморфну тверду форму, які містять сполуку А за даним винаходом, а також форму A1 і аморфну тверду форми, які містять гідрохлорид сполуки А за даним винаходом. 4.1.4. ФОРМА D СПОЛУКИ A Деякі варіанти здійснення винаходу стосуються форми D сполуки А. У визначених варіантах здійснення винаходу форма D сполуки А може бути отримана шляхом сушіння форми А сполуки А в печі. У деяких варіантах здійснення винаходу форму D одержують шляхом сушіння форми А в печі при температурі близько 70 °C. У деяких варіантах здійснення винаходу форма D сполуки А може бути охарактеризована за допомогою порошкової рентгенівської дифракції. Типова XRPD-дифрактограма форми D сполуки А наведена на фіг. 10. У деяких варіантах здійснення винаходу форма D сполуки А відрізняється XRPD-піками, розташованими в одній, двох, трьох, чотирьох, п'яти, шести, семи, восьми, дев'яти, десяти, одинадцяти, дванадцяти, тринадцяти або чотирнадцяти із наступних приблизних позицій: 10,6, 14,0, 14,6, 15,7, 16,3, 16,7, 18,8, 21,7, 21,9, 24,8, 25,1, 25,8, 28,1 і 28,6 градусів 2θ. В одному варіанті здійснення винаходу форма D сполуки А відрізняється XRPDпіками, розташованими в наступних приблизних позиціях: 16,7, 21,7, 21,9 і 25,8 градусів 2θ. У деяких варіантах здійснення винаходу форма D сполуки А відрізняється XRPDдифрактограмою, яка має 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 або 14 піків, що відповідають пікам на типової дифрактограмі форми D, наведеної в даному документі. У деяких варіантах здійснення винаходу форма D сполуки А може бути охарактеризована за допомогою термічного аналізу. Типовий DSC-графік для форми D сполуки А показаний на фіг. 11. У деяких варіантах здійснення винаходу форма D характеризується DSC-графіком, який включає ендотермічну подію із початковою температурою близько 283 °C. У деяких варіантах здійснення винаходу характеристичний DSC-графік форми D додатково містить одну додаткову подію, таку як, наприклад, ендотермічна подія із піковою температурою приблизно 114 °C. Типовий TGA-графік для форми D сполуки А показаний на фіг. 12. У деяких варіантах здійснення винаходу форма D характеризується TGA-графіком, який включає втрату маси приблизно менше ніж на 10 %, приблизно менше ніж на 8 %, приблизно менше ніж на 6 %, приблизно менше ніж на 4 %, наприклад, приблизно на 3 % від загальної маси зразка при нагріванні від приблизно 25 °C до приблизно 150 °C. У деяких варіантах здійснення винаходу подія втрати маси в TGA включає втрату води. У деяких варіантах здійснення винаходу форма D сполуки А є сольватованою. У деяких варіантах здійснення винаходу форма D є гідратованою. У деяких варіантах здійснення винаходу форма D сполуки А може бути охарактеризована за допомогою аналізу сорбції вологи. У деяких варіантах здійснення, коли RH збільшується від приблизно 0 % до приблизно 95 % RH, маса форми D змінюється менше ніж приблизно на 5 %, наприклад, приблизно на 4 %, від вихідної маси зразка. У деяких варіантах здійснення винаходу маса, набрана при адсорбції, втрачається при зниженні RH назад до приблизно 0 % RH. Деякі варіанти здійснення винаходу стосуються форми D сполуки А, яка є по суті чистою. Деякі варіанти здійснення винаходу стосуються форми D сполуки А, яка по суті є вільною від інших твердих форм, які містять сполуку А, включаючи, наприклад, форми А, В, С, D, E, F і/або аморфну тверду форму, яка містять сполуку А за даним винаходом, а також форму A1 і аморфну тверду форму, які містять гідрохлорид сполуки А за даним винаходом. Деякі варіанти здійснення винаходу стосуються форми D у вигляді суміші твердих форм, які містять сполуку А, у тому числі, наприклад, суміші, яка містить одну або декілька із наступних форм: форми А, В, С, E, F і аморфну тверду форму, які містять сполуку А за даним винаходом, а також форму A1 і аморфну тверду форму, які містять гідрохлорид сполуки А за даним винаходом. 4.1.5. ФОРМА E СПОЛУКИ A Деякі варіанти здійснення винаходу стосуються кристалічної форми E сполуки А. У деяких варіантах здійснення винаходу форма Е сполуки А може бути отримана із різних розчинників, включаючи, але без обмеження ними, системи розчинників, які включають ацетонітрил або ізопропанол, і їх суміші. У деяких варіантах здійснення винаходу форма Е може бути отримана із використанням способу перекристалізації із суспензії. У деяких варіантах здійснення винаходу форма Е може бути отримана із використанням способу перекристалізації із суспензії при кімнатній температурі. Форма Е також може бути отримана способом перекристалізації із антирозчинника шляхом розчинення сполуки А в DMF або NMP і швидкого додавання води як антирозчинника. У деяких варіантах здійснення винаходу форма Е сполуки А може бути охарактеризована за допомогою порошкової рентгенівської дифракції. Типова XRPD-дифрактограма форми Е сполуки А наведена на фіг. 13. У деяких варіантах здійснення винаходу форма Е сполуки А відрізняється XRPD-піками, розташованими в одній, двох, трьох, чотирьох, п'яти, шести, семи, 13 UA 113512 C2 5 10 15 20 25 30 35 40 45 50 55 60 восьми, дев'яти, десяти, одинадцяти, дванадцяти або тринадцяти із наступних приблизних позицій: 7,3, 9,3, 12,2, 14,0, 14,6, 15,7, 16,8, 21,0, 22,0, 22,7, 29,4, 30,0 і 37,0 градусів 2θ. В одному варіанті здійснення винаходу форма Е сполуки А відрізняється XRPD-піками, розташованими в наступних приблизних позиціях: 7,3, 14,6, 22,0, 30,0 і 37,0 градусів 2θ. У деяких варіантах здійснення винаходу форма Е сполуки А відрізняється XRPDдифрактограмою, яка відповідає дифрактограмі, представленій на фіг. 13. У деяких варіантах здійснення винаходу форма Е сполуки А відрізняється XRPD-дифрактограмою, яка має 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 або 13 піків, що відповідають пікам на типовій дифрактограмі форми Е, наведеної в даному документі. У деяких варіантах здійснення винаходу форма Е сполуки А може бути охарактеризована за допомогою термічного аналізу. Типовий DSC-графік для форми Е сполуки А показаний на фіг. 14. У деяких варіантах здійснення винаходу форма Е характеризується DSC-графіком, який включає ендотермічну подію із початковою температурою близько 279 °C. У деяких варіантах здійснення винаходу характеристичний DSC-графік форми Е додатково містить одну додаткову подію, таку як, наприклад, ендотермічна подія із піковою температурою приблизно 146 °C. Типовий TGA-графік для форми Е сполуки А показаний на фіг. 15. У деяких варіантах здійснення винаходу форма Е характеризується TGA-графіком, який включає втрату маси приблизно менше ніж на 10 %, приблизно менше ніж на 8 %, приблизно менше ніж на 6 %, наприклад, приблизно на 5,97 % від загальної маси зразка при нагріванні від приблизно 25 °C до приблизно 150 °C. У деяких варіантах здійснення винаходу подія втрати маси в TGA включає втрату води. У деяких варіантах здійснення винаходу форма Е сполуки А є сольватованою. У деяких варіантах здійснення винаходу форма Е є гідратованою. У деяких варіантах здійснення винаходу форма Е сполуки А може бути охарактеризована за допомогою аналізу сорбції вологи. У деяких варіантах здійснення, коли RH збільшується від приблизно 0 % до приблизно 95 % RH, маса форми Е змінюється менше ніж приблизно на 2 %, менше ніж приблизно на 1 % або менше ніж приблизно на 0,5 %, наприклад, приблизно на 0,4 %, від вихідної маси зразка. У деяких варіантах здійснення винаходу маса, набрана при адсорбції, втрачається при зниженні RH назад до приблизно 0 % RH. У деяких варіантах здійснення винаходу форма Е по суті негігроскопічною. У деяких варіантах здійснення винаходу XRPD-дифрактограма речовини форми Е по суті не змінюється після аналізу адсорбції/десорбції. У деяких варіантах здійснення винаходу форма Е стійка до вологості. Деякі варіанти здійснення винаходу стосуються форми Е сполуки А, яка є по суті чистою. Деякі варіанти здійснення винаходу стосуються форми Е сполуки А, яка по суті є вільною від інших твердих форм, які містять сполуку А, включаючи, наприклад, форми А, В, С, D, F і/або аморфну тверду форму, які містять сполуку А за даним винаходом, а також форму A1 і аморфну тверду форму, які містять гідрохлорид сполуки А за даним винаходом. Деякі варіанти здійснення винаходу стосуються форми Е у вигляді суміші твердих форм, які містять сполуку А, у тому числі, наприклад, суміші, що містить одну або декілька із наступних форм: форми А, В, С, D, F і аморфну тверду форму, які містять сполуку А за даним винаходом, а також форму A1 і аморфну тверду форму, які містять гідрохлорид сполуки А за даним винаходом. 4.1.6. ФОРМА F СПОЛУКИ A Деякі варіанти здійснення винаходу стосуються кристалічної форми F сполуки А. У деяких варіантах здійснення винаходу форма F сполуки А може бути отримана із різних розчинників, включаючи, але без обмеження ними, системи розчинників, які містять воду. У деяких варіантах здійснення винаходу форма F може бути отримана із використанням способу перекристалізації із суспензії. У деяких варіантах здійснення винаходу форма F сполуки А може бути охарактеризована за допомогою порошкової рентгенівської дифракції. Типова XRPD-дифрактограма форми F сполуки А наведена на фіг. 16. У деяких варіантах здійснення винаходу форма F сполуки А відрізняється XRPD-піками, розташованими в одній, двох, трьох, чотирьох, п'яти, шести, семи, восьми, дев'яти або десяти із наступних приблизних позицій: 7,2, 9,1, 14,5, 15,7, 16,8, 18,3, 21,9, 22,7, 29,9 і 36,9 градусів 2θ. В одному варіанті здійснення винаходу форма F сполуки А відрізняється XRPD-піками, розташованими в наступних приблизних позиціях: 14,5, 15,7, 22,7 і 29,9 градусів 2θ. У деяких варіантах здійснення винаходу форма F сполуки А відрізняється XRPD-дифрактограмою, яка відповідає дифрактограмі, представленій на фіг. 16. У деяких варіантах здійснення винаходу форма F сполуки А відрізняється XRPD-дифрактограмою, яка має 1, 2, 3, 4, 5, 6, 7, 8, 9 або 10 піків, що відповідають пікам на типовій дифрактограмі форми F, наведеної в даному документі. У деяких варіантах здійснення винаходу форма F сполуки А може бути охарактеризована за допомогою термічного аналізу. Типовий DSC-графік для форми Е сполуки А показаний на фіг. 14 UA 113512 C2 5 10 15 20 25 30 35 40 45 50 55 60 17. У деяких варіантах здійснення винаходу форма F характеризується DSC-графіком, який включає ендотермічну подію із початковою температурою близько 267 °C. У деяких варіантах здійснення винаходу характеристичний DSC-графік форми F додатково містить одну додаткову подію, таку як, наприклад, екзотермічна подія із піковою температурою приблизно 170 °C. У деяких варіантах здійснення винаходу форма F сполуки А є сольватованою. У деяких варіантах здійснення винаходу форма F є гідратованою. Деякі варіанти здійснення винаходу стосуються форми F сполуки А, яка є по суті чистою. Деякі варіанти здійснення винаходу стосуються форми F сполуки А, яка по суті є вільною від інших твердих форм, які містять сполуку А, включаючи, наприклад, форми А, В, С, D, Е і/або аморфну тверду форму, які містять сполуку А за даним винаходом, а також форму A1 і аморфну тверду форму, які містять гідрохлорид сполуки А за даним винаходом. Деякі варіанти здійснення винаходу стосуються форми F у вигляді суміші твердих форм, які містять сполуку А, у тому числі, наприклад, суміші, яка містить одну або декілька із наступних форм: форми А, В, С, D, Е і аморфну тверду форму, які містять сполуку А за даним винаходом, а також форму A1 і аморфну тверду форму, які містять гідрохлорид сполуки А за даним винаходом. 4.1.7. ФОРМА A1 ГІДРОХЛОРИДУ СПОЛУКИ A Деякі варіанти здійснення винаходу стосуються кристалічної форми A1 гідрохлориду сполуки А. У деяких варіантах здійснення винаходу форма A1 може бути отримана із різних розчинників, включаючи, але без обмеження ними, системи розчинників, які містять ацетон, ацетонітрил, н-бутанол, етанол, етилацетат, гептан, метанол, метиленхлорид, метилетилкетон, метил-трет-бутиловий ефір, 2-пропанол, толуол, тетрагідрофуран, воду і їх суміші. У деяких варіантах здійснення винаходу форма A1 може бути отримана із використанням способу кристалізації швидким або повільним охолодженням. У деяких варіантах здійснення винаходу форма A1 може бути отримана із використанням способу кристалізації додаванням антирозчинника. Форма A1 гідрохлориду сполуки А є стабільною кристалічною формою. Наприклад, знайдено, що форма A1 хімічно стабільна протягом 6 тижнів при зберіганні при кімнатній температурі, впливі повітря і світла. Також знайдено, що форма A1 хімічно стабільна при зберіганні при 40 °C у вакуумі. Також знайдено, що форма A1 хімічно стабільна при зберіганні при 40 °C в атмосфері азоту. Також знайдено, що форма A1 хімічно стабільна при зберіганні при 40 °C і відносній вологості (RH) 75 %. Також знайдено, що форма A1 хімічно стабільна при зберіганні при 60 °C у закритому контейнері. На підставі цих даних було визначено, що форма A1 сполуки А досить стабільна для великомасштабного виробництва (приклад 5.4.3.2). У деяких варіантах здійснення винаходу форма А1 може бути охарактеризована за допомогою порошкової рентгенівської дифракції. Типова XRPD-дифрактограма форми А1 наведена на фіг. 18. У деяких варіантах здійснення винаходу форма А1 відрізняється XRPDпіками, розташованими в одній, двох, трьох, чотирьох, п'яти, шести, семи, восьми, дев'яти або десяти із наступних приблизних позицій: 8,6, 11,3, 13,1, 15,3, 17,3, 20,5, 22,7, 23,6, 26,3 і 31,4 градусів 2θ. В одному варіанті здійснення винаходу форма А1 відрізняється XRPD-піками, розташованими в наступних приблизних позиціях: 8,6, 13,1, 20,5 і 26,3 градусів 2θ. У деяких варіантах здійснення винаходу форма А1 відрізняється XRPD-дифрактограмою, яка відповідає дифрактограмі, представленій на фіг. 18. У деяких варіантах здійснення винаходу форма А1 відрізняється XRPD-дифрактограмою, яка має 1, 2, 3, 4, 5, 6, 7, 8, 9 або 10 піків, що відповідають пікам на типовій дифрактограмі форми А1, наведеної в даному документі. У деяких варіантах здійснення винаходу форма A1 гідрохлориду сполуки А може бути охарактеризована термічним аналізом. Типовий DSC-графік для форми A1 показаний на фіг. 19. У деяких варіантах здійснення винаходу форма A1 характеризується DSC-графіком, який включає ендотермічну подію із початковою температурою приблизно 276 °C. У деяких варіантах здійснення винаходу форма A1 має температуру розкладання приблизно 276 °C. Типовий TGAграфік для форми A1 сполуки А показаний на фіг. 20. У деяких варіантах здійснення винаходу форма A1 характеризується TGA-графіком, який включає втрату маси менше ніж приблизно на 1 %, менше ніж приблизно на 0,5 %, менше ніж приблизно на 0,2 %, менше ніж приблизно на 0,1 %, менше ніж приблизно на 0,05 %, менше ніж приблизно на 0,01 %, наприклад, приблизно на 0,0008 %, від загальної маси зразка при нагріванні приблизно від 25 °C до приблизно 150 °C. У деяких варіантах здійснення винаходу форма A1 сполуки А не містить суттєвої кількості або води іншого розчинника в кристалічній решітці. У деяких варіантах здійснення винаходу форма A1 є несольватованою. У деяких варіантах здійснення винаходу форма A1 є безводною. У деяких варіантах здійснення винаходу форма А1 може бути охарактеризована за допомогою аналізу сорбції вологи. Типова ізотерма сорбції вологи показана на фіг. 21. У деяких варіантах здійснення, коли відносна вологість ("RH") збільшується від приблизно 0 % до 15 UA 113512 C2 5 10 15 20 25 30 35 40 45 50 55 приблизно 95 % RH, маса форми А1 змінюється менше ніж приблизно на 1 %, менше ніж приблизно на 0,5 %, менше ніж приблизно на 0,2 % (наприклад, приблизно на 0,15 %) від вихідної маси зразка. У деяких варіантах здійснення винаходу маса, набрана при адсорбції, втрачається при зниженні RH назад до приблизно 0 % RH. Відповідно, у деяких варіантах здійснення винаходу форма А1 по суті негігроскопічна. У деяких варіантах здійснення винаходу XRPD-дифрактограма речовини форми А1 по суті не змінюється після аналізу адсорбції/десорбції. У деяких варіантах здійснення винаходу форма А1 стійка до вологості. У деяких варіантах здійснення винаходу форма A1 гідрохлориду сполуки А може бути охарактеризована її профілем стабільності. У деяких варіантах здійснення винаходу речовина форми A1 є стабільною, наприклад, її XRPD-дифрактограма залишається по суті незмінною при впливі підвищеної температури, при впливі підвищеної вологості, при впливі одного або декількох розчинників, і/або при стисненні. Наприклад, у деяких варіантах здійснення винаходу форма A1 стабільна при приблизно 40 °C і відносній вологості 75 % протягом приблизно чотирьох тижнів. Наприклад, у деяких варіантах здійснення винаходу форма A1 стабільна при кімнатній температурі і приблизно 95 %-й відносній вологості протягом приблизно чотирьох днів. У деяких варіантах здійснення винаходу форма A1 стабільна після впливу одного або декількох розчинників, включаючи, наприклад, ацетон, ацетонітрил, н-бутанол, етанол, етилацетат, гептан, метанол, метиленхлорид, метилетилкетон, метил трет-бутиловий ефір, 2-пропанол, толуол і/або тетрагідрофуран, при температурі близько 50 °C протягом щонайменше близько 24 годин. У деяких варіантах здійснення винаходу форма A1 стабільна при тиску близько 2000 psi (13,79 МПа) протягом приблизно однієї хвилини. У деяких варіантах здійснення винаходу форма А1 може бути охарактеризована аналізом частинок. У деяких варіантах здійснення винаходу зразок форми А1 містить частинки, які мають голчасту морфологію. Деякі варіанти здійснення винаходу стосуються форми A1 сполуки А, яка є по суті чистою. Деякі варіанти здійснення винаходу стосуються форми A1 гідрохлориду сполуки А, яка є по суті вільною від інших твердих форм, які містять сполуку А, включаючи, наприклад, аморфну тверду форму, яка містить гідрохлорид сполуки А за даним винаходом, і форми A, B, C, D, E, F і/або аморфну тверду форму, які містять сполуку А за даним винаходом. Деякі варіанти здійснення винаходу стосуються форми A1 як суміші твердих форм, які містять сполуку А, включаючи, наприклад, суміш, яка містить одну або декілька із наступних форм: форми A, B, C, D, E, F і аморфну тверду форму А1, які містять сполуку А за даним винаходом, і аморфну тверду форму, що містить гідрохлорид сполуки А за даним винаходом. Деякі варіанти здійснення винаходу стосуються форми А1 гідрохлориду сполуки А, причому молярне співвідношення сполуки А і гідрохлориду у формі А варіює від приблизно 0,1 до приблизно 10, від приблизно 0,2 до приблизно 5, від приблизно 0,5 до приблизно 2, від приблизно 0,6 до приблизно 1,5, від приблизно 0,7 до приблизно 1,3, від приблизно 0,8 до приблизно 1,2, від приблизно 0,9 до приблизно 1,1 або від приблизно 0,95 до приблизно 1,05. У деяких варіантах здійснення винаходу молярне співвідношення сполуки і гідрохлориду у формі А1 складає приблизно 0,5, приблизно 0,6, приблизно 0,7, приблизно 0,8, приблизно 0,9, приблизно 0,95, приблизно 1, приблизно 1,05, приблизно 1,1, приблизно 1,2, приблизно 1,3, приблизно 1,4 або приблизно 1,5. 4.2. СПОСОБИ ЛІКУВАННЯ Винахід охоплює способи лікування, попередження і/або контролю різних захворювань або розладів із використанням твердої форми сполуки А або його стереоізомера, або їх фармацевтично прийнятної солі, сольвату, гідрату, співкристала, клатрату або поліморфу, які включають введення терапевтично або профілактично ефективної кількості однієї або декількох твердих форм, які містять сполуку А, таких як, наприклад, форма А, B, C, D, E або аморфна форма сполуки А, або форма А1 або аморфна форма гідрохлориду сполуки А за даним винаходом. Не обмежуючи якою-небудь теорією, сполука А може контролювати ангіогенез або може інгібувати синтез деяких цитокінів, включаючи, але без обмеження ними, TNF-α, IL-1β, IL-12, IL18, GM-CSF і/або IL-6. Без обмеження якою-небудь конкретною теорією, сполука А може стимулювати синтез деяких інших цитокінів, у тому числі IL-10; а також може діяти як допоміжний сигнал для активації Т-клітин, що приводить до підвищеного синтезу цитокінів, таких як, але без обмеження ними, IL-12 і/або IFN-γ. Крім того, сполука А може підсилювати ефекти NK-клітин і опосередковану антитілами клітинну цитотоксичність (ADCC). Крім того, сполука А може бути імуномодулюючою і/або цитотоксичною і, отже, може бути придатною як хіміотерапевтичний засіб. Отже, без обмеження якої-небудь конкретної теорії, деякі або всі такі 16 UA 113512 C2 5 10 15 20 25 30 35 40 45 50 55 60 характеристики, які має сполука А можуть зробити її корисною для лікування, контролю і/або попередження різних захворювань або розладів. Приклади захворювань або розладів включають, але без обмеження ними, рак, захворювання, асоційовані із ангіогенезом, болю, у тому числі, але без обмеження ним, комплексний регіональний больовий синдром (CRPS), дегенерацію жовтої плями (MD) і супутні синдроми, шкірні захворювання, легеневі захворювання, пов'язані із азбестом захворювання, паразитарні захворювання, імунодефіцитні розлади, розлади ЦНС, ураження ЦНС, атеросклероз і супутні розлади, порушення сну і супутні розлади, гемоглобінопатію і супутні розлади (наприклад, анемію), TNF-α-зв'язані розлади і інші різні захворювання і розлади. Приклади раку і предракових станів включають, але без обмеження ним, рак і предракові стани, описані в патентах США № 6281230 і 5635517, Muller et al., у різних патентних публікаціях на ім'я Zeldis, включаючи публікації № 2004/0220144А1, опубліковану 4 листопада 2004 р. (Treatment of Myelodysplastic Syndrom), 2004/00298332А1, опубліковану 12 лютого 2004 р. (Treatment of Various Types of Cancer); і 2004/0087546, опубліковану 6 травня 2004р. (Treatment of Myeloproliferative Diseases). Приклади також включають рак і предракові стани, описані в WO 2004/103274, опублікованій 2 грудня 2004 р. Повний зміст зазначених посилань включено в даний документ шляхом посилання. Конкретні приклади раку включають, але без обмеження ним, ракові захворювання шкіри, наприклад, меланому; лімфатичних вузлів; молочних залоз; шийки матки; матки; шлунковокишкового тракту; легень; яєчників; простати; товстої кишки; прямої кишки; ротової порожнини; головного мозку; голови і шиї; горла; сім'яників; нирок; підшлункової залози; кісти; селезінки; печінки; сечового міхура; гортані; носових проходів і ракові захворювання, пов'язані із СНІДом. Сполуки також можуть бути придатні для лікування ракових захворювань крові і кісткового мозку, таких як множинна мієлома, і гостра і хронічна лейкемії, наприклад лімфобластна, мієлогенна, лімфоцитарна і мієлоцитарна лейкемії. Сполуки за винаходом можуть використовуватися для лікування, попередження або контролю або первинних, або метастатичних пухлин. Інші конкретні види ракових захворювань включають, але без обмеження ними, злоякісні новоутворення на пізній стадії, амілоїдоз, нейробластому, менінгіому, гемангіоперицитому, множинні метастази мозку, мультиформну гліобластому, гліобластому, гліому стовбура мозку, погано прогнозовану злоякісну пухлину мозку, злоякісну гліому, рецидивуючу злоякісну гліому, анапластичну астроцитому, анапластичну олігодендрогліому, нейроендокринну пухлину, ректальну аденокарциному, колоректальний рак на стадіях Dukes C і D, неоперовану колоректальну карциному, метастатичну гепатоцелюлярну карциному, саркому Капоші, каріотипну гостру нейробластну лейкемію, хронічну лімфоцитарну лейкемію (CLL), ходжкінську лімфому, неходжкінську лімфому, Т-клітинну лімфому шкіри, В-клітинну лімфому шкіри, дифузійну велико-В-клітинну лімфому, високодиференційовану фолікулярну лімфому, метастатичну меланому (локалізовану меланому, включаючи, але без обмеження ним, очну меланому), злоякісну мезотеліому, синдром плеврального випоту при злоякісній мезотеліомі, перитонеальну карциному, папілярну серозну карциному, гінекологічну саркому, саркому м'яких тканин, склеродерму, васкуліт шкіри, гістіоцитоз клітин Лангерганса, лейоміосаркому, прогресивну осифікуючу фібродисплазію, стійкий до гормонів рак простати, видалену саркому м'якої тканини високого ризику, неоперабельну печінковоклітинну карциному, макроглобулінемію Вальденстрема, в'ялоплинну мієлому, мієлому, яка повільно росте, рак фалопієвих труб, андрогеннезалежний рак простати, андрогензалежний неметастазуючий рак простати IV стадії, стійкий до гормонів рак простати, несприйнятливий до хіміотерапії рак простати, папілярну карциному щитовидної залози, фолікулярну карциному щитовидної залози, медулярну карциному щитовидної залози і лейоміому. У конкретному варіанті здійснення винаходу рак є метастатичним. У іншому варіанті здійснення винаходу рак є несприйнятливим або стійким до хіміотерапії або променевої терапії. В одному із варіантів здійснення винаходу запропоновані способи лікування, попередження або контролю різних форм лейкемії, таких як хронічна лімфоцитарна лейкемія, хронічна мієлоцитарна лейкемія, гостра лімфобластна лейкемія, гостра мієлогенна лейкемія і гостра мієлобластна лейкемія, включаючи лейкемії, які є рецидивуючими, несприйнятливими або стійкими, які описані в публікації США 2006/0030594, опублікованій 9 лютого 2006 р., повний зміст якої включено в даний документ шляхом посилання. Термін "лейкемія" стосується злоякісних новоутворень кровотворних тканин. Термін "лейкемія" включає, але без обмеження ними, хронічну лімфоцитарну лейкемію, хронічну мієлоцитарну лейкемію, гостру лімфобластну лейкемію, гостру мієлогенну лейкемію і гостру мієлобластну лейкемію. Лейкемія може бути рецидивуючою, несприйнятливою або стійкою до 17 UA 113512 C2 5 10 15 20 25 30 35 40 45 50 55 60 звичайної терапії. Визначення "рецидивуюча" стосується ситуації, коли у пацієнтів із лейкемією, які знаходяться в ремісії після терапії, спостерігається повторна поява лейкемічних клітин у кістковому мозку і зниження кількості нормальних клітин крові. Термін "несприйнятливий або стійкий" стосується ситуації, коли пацієнти, навіть після інтенсивного лікування, мають залишкові лейкемічні клітини в кістковому мозку. В інших варіантах здійснення винаходу запропоновані способи лікування, попередження або контролю різних типів лімфом, включаючи неходжкінську лімфому (NHL). Термін "лімфома" стосується гетерогенної групи новоутворень, які виникають у ретикулоендотеліальній і лімфатичній системах. "NHL" стосується злоякісної моноклональної проліферації лімфоїдних клітин у тканинах імунної системи, включаючи лімфовузли, кістковий мозок, селезінку, печінку і шлунково-кишковий тракт. Приклади NHL включають, але без обмеження ними, лімфому із клітин мантійної зони (MCL), лімфоцитарну лімфому проміжного ступеня диференціювання, проміжну лімфоцитарну лімфому (ILL), дифузійну низькодиференційовану лімфоцитарну лімфому (PDL), центроцитарну лімфому, дифузійну дрібноклітинну лімфому із розщепленими ядрами (DSCCL), фолікулярну лімфому і будь-який тип лімфом клітин мантійної зони, який можна побачити під мікроскопом (нодулярну, дифузійну, бластну і мантійну зони). Приклади захворювань і розладів, асоційованих із або відмінним небажаним ангіогенезом, включають, але без обмеження ними, запальні захворювання, аутоімунні захворювання, вірусні захворювання, генетичні захворювання, алергічні захворювання, бактеріальні захворювання, очні неоваскулярні захворювання, хоріоїдальні неоваскулярні захворювання, неоваскулярні захворювання чутливої оболонки ока і рубеоз (неоваскуляризацію кута передньої камери). Конкретні приклади захворювань і розладів, асоційованих із або відмінним небажаним ангіогенезом, включають, але без обмеження ними, артрит, ендометріоз, хворобу Крона, серцеву недостатність, важку серцеву недостатність, ниркову недостатність, ендотоксемію, синдром токсичного шоку, остеоартрит, ретровірусну реплікацію, зашлакованість, менінгіт, індукований діоксидом кремнію фіброз, індукований азбестом фіброз, ветеринарні порушення, зв'язану із злоякісною пухлиною гіперкальціємію, інсульт, циркуляторний шок, періодонтит, гінгівіт, макроцитарну анемію, несприйнятливу анемію і синдром 5q-делеції. Приклади болів включають, але без обмеження ними, болі, описані в патентній публікації США 2005/0203142, опублікованій 15 вересня 2005 р., яка включена в даний документ шляхом посилання. Конкретні типи болів включають, але без обмеження ними, ноцицептивний біль, нейропатичний біль, змішаний біль із ноцицептивного болю і нейропатичного болю, вісцеральний біль, мігрень, головний біль і післяопераційний біль. Приклади ноцицептивного болю включають, але без обмеження ними, біль, який супроводжує хімічні або термічні опіки, порізи шкіри, забиті місця шкіри, остеоартрит, ревматоїдний артрит, тендоніт і міофасціальний біль. Приклади нейропатичного болю включають, але без обмеження ними, CRPS I типу, CRPS II типу, рефлекторну симпатичну дистрофію (RSD), рефлекторну нейроваскулярну дистрофію, рефлекторну дистрофію, утримуваний симпатичною частиною нервової системи больовий синдром, каузалгію, кісткову атрофію Зудека, алгонейродистрофію, плечовий синдром, посттравматичну дистрофію, тригемінальну невралгію, постгерпетичну невралгію, біль, який супроводжує рак, помилкове відчуття ампутованої кінцівки, фіброміалгію, синдром хронічної утоми, біль від травми спинного мозку, центральний післяшоковий біль, радикулопатію, діабетичну невропатію, післяшоковий біль, люетичну невропатію і інші причиняючі біль невропатичні стани, наприклад стани, викликані лікарськими засобами, такими як вінкристин і велкейд. У контексті даного документа терміни "комплексний регіональний больовий синдром", "CRPS" і "CRPS і пов'язані синдроми" означають хронічні болючі розлади, які відрізняються однією або декількома наступними ознаками: біль, або спонтанний або спровокований, у тому числі, алодинія (зухвалий біль реакція на стимул, який звичайно не є хворобливим) і гіпералгезія (перебільшена реакція на стимул, який звичайно є тільки помірно хворобливим); біль, який є непропорційним для провокуючого події (наприклад, роки сильного болю після розтягнення з'вязок гомілковостопного суглоба); регіональний біль, який не обмежений поширенням в одному периферичному нерві; і розлад вегетативної нервової системи (наприклад, набряк, альтерація кров'яного потоку і гіпергідроз), асоційований із трофічними змінами шкіри (ненормальність росту волосся і нігтів і шкірне укривання виразками). Приклади MD і супутніх синдромів включають, але без обмеження ними, приклади, описані в патентній публікації США 2004/0091455, опублікованій 13 травня 2004 р., яка включена в даний документ шляхом посилання. Конкретні приклади включають, але без обмеження ними, атрофічну (суху) MD, ексудативну (вологу) MD, вікову макулопатію (ARM), хоріоїдальну 18 UA 113512 C2 5 10 15 20 25 30 35 40 45 50 55 неоваскулізацію (CNVM), відшарування пігментного епітелію сітківки (PED) і атрофію пігментного епітелію сітківки (RPE). Приклади шкірних захворювань включають, але без обмеження ними, приклади, описані в публікації США 2005/0214328А1, опублікованій 29 вересня 2005 р., яка включена в даний документ шляхом посилання. Конкретні приклади включають, але без обмеження ними, кератоз і супутні симптоми, шкірні захворювання і розлади, що характеризуються надмірним ростом епідермісу, вугри і зморшки. У контексті даного документа термін "кератоз" стосується будь-якого пошкодження епідермісу, відзначеному присутністю осередкового надмірного росту ороговілого шару, включаючи, але без обмеження ним, актинічний кератоз, себорейний кератоз, кератоакантому, фолікулярний кератоз (хвороба Дарьє), ретроградний фолікулярний кератоз, долоннопідошовний кератоз (PPR, кератоз долонь і підошов), кератоз волосяний і штукатурний кератоз. Термін "актинічний кератоз" також стосується старечого кератозу, сенільного кератозу, старечої кератоми, юнацької кератоми, старечої бородавки, кератодермії або кератоми. Термін "себорейний кератоз" також стосується себорейної бородавки, старечої бородавки або базальноклітинної папіломи. Кератоз характеризується одним або декількома наступними симптомами: неприємний зовнішній вигляд, еритематозні папули, бляшки, спікули або нарости на відкритих поверхнях (наприклад, на обличчі, руках, вухах, шиї, ногах і грудній клітці), патологічне розростання кератину, називане шкірними рогами, гіперкератоз, телангіектазія, еластоз, пігментований лентігіноз, акантоз, паракератоз, дискератоз, папіломатоз, гіперпігментація базальних клітин, клітинна атипія, мітотичні фігури, аномальна міжклітинна адгезія, щільні запальні інфільтрати і невелика перевага сквамозноклітинних карцином. Приклади шкірних захворювань або розладів, які характеризуються надмірним ростом епідермісу, включають, але без обмеження ними, будь-які стани, захворювання або розлади, відзначені присутністю епідермісу, який надмірно розрісся, включаючи, але без обмеження ними, інфекції, пов'язані із папіломавірусом, миш'яковистий кератоз, симптом Лезера-Трелата, бородавкову дискератому (WD), волосся пучкоподібне (trichostasis spinulosa, TS), фігурну варіабельну еритрокератодермію (EKV), вроджений іхтіоз (арлекіновий іхтіоз), вроджену вузлуватість пальців кисті, шкірну меланоакантому, порокератоз, псоріаз, сквамозноклітинну карциному, зливальний і ретикулярний папіломатоз (CRP), акрохордон, шкірний ріг, хвороба Каудена (синдром множинної гамартоми), дерматичний папульозний висип (dermatosis papulosa nigra, DPN), синдром епідермального невусу (ENS), простий іхтіоз, контагіозний молюск, вузликовий свербець і акантокератодермію (AN). Приклади легеневих захворювань включають, але без обмеження ними, приклади, описані в публікації патентної заявки США 2005/0239842А1, опублікованій 27 жовтня 2005 р., яка включена в даний документ шляхом посилання. Конкретні приклади включають легеневу гіпертензію і супутні розлади. Приклади легеневої гіпертензії і супутніх розладів включають, але не обмежені ними, первинну легеневу гіпертензію (РРН); вторинну легеневу гіпертензію (SPH); сімейну РРН; спорадичну РРН; прекапілярну легеневу гіпертензію; легеневу артеріальну гіпертензію (РАН); легеневу системну гіпертензію; ідіопатичну легеневу гіпертензію; тромботичну легеневу артеріопатію (ТРА); плексогенну легеневу артеріопатію; легеневу гіпертензію функціональних класів I-IV і легеневу гіпертензію, пов'язану з, супутню або вторинну відносно дисфункції лівого шлуночка, мітрального пороку серця, констриктивного перикардиту, стенозу устя аорти, кардіоміопатії, медіастинального фіброзу, аномального легеневого венозного відтоку, легеневої венооклюзійної хвороби, судинного колагенозу, уродженого пороку серця, інфікування ВІЛ, лікарських засобів і токсинів, таких як фенфлураміни, вродженого пороку серця, легеневої венозної гіпертензії, хронічного обструктивного легеневого захворювання, інтерстиціального захворювання легень, порушеного у сні дихання, альвеолярної гіповентиляції, хронічного впливу високого положення над рівнем моря, хвороби легень немовляти, альвеолярно-капілярної дисплазії, серпоподібноклітинної хвороби, інших порушеннь згортання крові, хронічної тромбоемболії, хвороби сполучних тканин, вовчака, включаючи системний і шкірний вовчак, шистосомозу, саркоїдозу або легеневого капілярного гемангіоматозу. Приклади захворювань, пов'язаних із азбестом, включають, але без обмеження ними, приклади, описані в публікації патентної заявки США 2005/0100529, опублікованій 12 травня 2005 р., яка включена в даний документ шляхом посилання. Типові приклади включають, але без обмеження ними, мезотеліому, азбестоз, злоякісний плевральний випіт, доброякісний ексудативний випіт, плевральні бляшки, кальциноз плеври, дифузійне плевральне нашарування, округлий ателектаз, фіброзні маси і рак легень. 19 UA 113512 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклади паразитарних захворювань включають, але без обмеження ними, приклади, описані в публікації патентної заявки США 2006/0154880, опублікованій 13 липня 2006 р., яка включена в даний документ шляхом посилання. Паразитарні захворювання включають захворювання і розлади, викликані внутрішньоклітинними паразитами людини, такими як, але без обмеження ними, P. falcifarium, P. ovale, P. vivax, P. malariae, L. donovari, L. infantum, L. aethiopica, L. major, L. tropica, L. mexicana, L. braziliensis, T. Gondii, B. microti, B. divergens, B. coli, C. parvum, C. cayetanensis, E. histolytica, I. belli, S. mansonii, S. haematobium, Trypanosoma ssp., Toxoplasma ssp. і O. volvulus. Також охоплені інші захворювання і порушення, викликані внутрішньоклітинними паразитами інших біологічних видів, крім людини, такими як, але без обмеження ними, Babesia bovis, Babesia canis, Babesia Gibsoni, Besnoitia darlingi, Cytauxzoon felis, Eimeria ssp., Hammondia ssp. і Theileria ssp. Конкретні приклади включають, але без обмеження ними, малярію, бабезіоз, сонну хворобу, лейшманіоз, токсоплазмоз, менінгоенцефаліт, кератит, амебіоз, гіардіоз, криптоспоридоз, ізоспоридіоз, циклоспоріоз, мікроспоридіоз, аскаридоз, трихіуріаз, анкілостомоз, стронгілоїдоз, токсокароз, трихінельоз, лімфатичний філяріатоз, онхоцеркоз, філяріатоз, шистосомоз і дерматит, викликаний шистосомами тварин. Приклади порушень імунодефіциту включають, але без обмеження ними, приклади, описані в патентній заявці США 11/289723, зареєстрованій 30 листопада 2005 р. Конкретні приклади включають, але без обмеження ними, недостатність аденозиндезамінази, недостатність антитіл із нормальним або підвищеним рівнем імуноглобулінів, атаксію-телеангіектазію, синдром "голих" лімфоцитів, загальну варіабельну імунну недостатність, недостатність імуноглобулінів із синдромом підвищених IgМ, делеції важких ланцюжків Ig, недостатність IgА, імунодефіцит із тимомою, ретикулярну дисгенезію, синдром Незелофа, селективний дефіцит підкласу IgG, немовлячу гіпогаммаглобулінемію, синдром Віскотта-Олдриджа, зчеплену із Х-хромосомою агаммаглобулінемію, зчеплену із Х-хромосомою тяжку комбіновану агаммаглобулінемію. Приклади розладів ЦНС включають, але без обмеження ними, приклади, описані в патентній публікації США 2005/0143344, опублікованій 30 червня 2005 р., яка включена в даний документ шляхом посилання. Конкретні приклади включають, але не обмежені ними, бічний аміотрофічний склероз, хворобу Альцгеймера, хворобу Паркінсона, хворобу Хантінгтона, розсіяний склероз і інші нейроімунологічні розлади, такі як синдром Туретта, делірій або порушення свідомості, які відбуваються протягом короткого періоду часу, і амнестичний розлад, або розрізнене порушення пам'яті, яке відбувається під час відсутності інших порушень центральної нервової системи. Приклади уражень ЦНС і супутніх синдромів включають, але без обмеження ними, приклади, описані в патентній публікації США 2006/0122228, опублікованій 8 червня 2006 р., що включена в даний документ шляхом посилання. Конкретні приклади включають, але без обмеження ними, ураження/ушкодження ЦНС і супутні синдроми, що включають, але без обмеження ними, первинну травму головного мозку, вторинну травму головного мозку, травматичне ушкодження мозку, фокальне ушкодження мозку, дифузійне аксональне ушкодження, травму голови, постконтузійний синдром, струс і розрив головного мозку, субдуральну гематому, епідермальну гематому, посттравматичну епілепсію, хронічний вегетативний стан, повну травму спинного мозку, неповну травму спинного мозку, гостру травму спинного мозку, підгостру травму спинного мозку, хронічну травму спинного мозку, центральний спінальний синдром, синдром Броун-Секара, синдром переднього хорда, синдром мозкового конуса, синдром ураження кінського хвоста, нейрогенний шок, спінальний шок, змінені рівні свідомості, головний біль, нудоту, блювання, утрату пам'яті, запаморочення, диплопію, розмитий зір, емоційну нестійкість, порушення сну, дратівливість, нездатність до концентрації, нервозність, поведінкові порушення, порушення пізнавальної здатності і припадки. Інші захворювання і порушення включають, але не обмежені ними, вірусні, генетичні, алергічні і аутоімунні захворювання. Конкретні приклади включають, але не обмежені ними, ВІЛ, гепатит, респіраторний дистрес-синдрому дорослих, резорбцію кістки, хронічні легеневі запальні захворювання, дерматити, кістозний фіброз, септичний шок, сепсис, ендотоксичний шок, гемодинамічний шок, септичний синдром, постішемічне реперфузійне ушкодження, менінгіт, псоріаз, фіброзне захворювання, кахексію, реакцію трансплантат-проти-хазяїна, відторгнення трансплантата, аутоімунне захворювання, ревматоїдний спондиліт, хворобу Крона, виразковий коліт, запальне захворювання кишечнику, розсіяний склероз, системний червоний вовчак, ENL (лепрозну вузлову еритему) при проказі, радіаційне ураження, рак, астму або альвеолярну гіпоксію. Приклади атеросклерозу і супутніх станів включають, але без обмеження ними, приклади, описані в патентній публікації США 2002/0054899, опублікованій 9 травня 2002 р., яка включена 20 UA 113512 C2 5 10 15 20 25 30 35 40 45 50 55 60 в даний документ шляхом посилання. Конкретні приклади включають, але без обмеження ними, усі форми станів, що включають атеросклероз, у тому числі рестеноз після судинного втручання, такого як ангіопластика, ендопротезування, атеректомія і трансплантація. У даному документі передбачені усі форми судинного втручання, включаючи втручання при серцевосудинних і ниркових захворюваннях, такі як, але без обмеження ними, ангіопластика ниркових артерій, підшкірне коронарне втручання (PCI), підшкірна транслумінальна коронарна ангіопластика (PTCA), транслумінальна коронарна ангіопластика сонної артерії (РТА), коронарне шунтування, ангіопластика із імплантацією стента, периферична підшкірна транслумінальна інтервенція здухвинної, стегнової або підколінної артерії і хірургічне втручання із використанням імпрегнованих штучних трансплантатів. Приклади порушень сну і супутніх синдромів включають, але не обмежені ними, приклади, описані в патентній публікації США 2005/0222209А1, опублікованій 6 жовтня 2005 р., яка включена в даний документ шляхом посилання. Конкретні приклади включають, але не обмежені ними, храп, апное у сні, безсоння, нарколепсію, синдром утомлених ніг, жахи під час сну, лунатизм, синдром нічного апетиту, а також порушений сон, який супроводжується хронічним неврологічним або запальним станами. Хронічні неврологічні або запальні стани включають, але не обмежені ними, синдром комплексного регіонального болю, хронічний поперековий біль, скелетно-м'язовий біль, артрит, радикулопатію, біль, який супроводжує ракове захворювання, фіброміалгію, синдром хронічної утоми, вісцеральний біль, біль у сечовому міхурі, хронічний панкреатит, невропатії (діабетичну, постгерпетичну, травматичну або запальну) і нейродегенеративні розлади, такі як хвороба Паркінсона, хвороба Альцгеймера, бічний аміотрофічний склероз, розсіяний склероз, хвороба Хантінгтона, брадикінезія; м'язова ригідність; паркінсонів тремор; паркінсонова хода; затримка руху; депресія; порушена довгострокова пам'ять, синдром Рубінштейна-Тейби (RTS); деменція; постуральна нестабільність; гіпокінетичні розлади; синуклеїнові розлади; множинна системна атрофія; стріатонігральна дегенерація; оливопонтоцеребелярна атрофія; синдром Шая-Дрейджера; захворювання моторних нервів із ознаками паркінсонізму; деменція із тільцями Леві; патологічні розлади Тау; прогресуючий супрануклеарний параліч; кортико-базальна дегенерація; лобноскронева деменція; амілоїдні патологічні розлади; середні порушення пізнавальної здатності; хвороба Альцгеймера із паркінсонізмом; хвороба Вільсона; хвороба Галлервордена-Шпатца; хвороба Чедіака-Хігасі; спиноцеребелярна атаксія 3 (SCA-3); дистонія-паркінсонізм, зчеплені із Х-хромосомою; пріонна інфекція; гіперкінетичні порушення; хорея; балізм (розмашистий гіперкінез кінцівок (ballismus); дистонічний тремор; бічний аміотрофічний склероз (ALS); травма ЦНС і міоклонус. Приклади гемоглобінопатії і супутніх розладів включають, але не обмежені ними, приклади, описані в публікації США 2005/0143420А1, опублікованій 30 червня 2005 р., яка включена в опис як посилання. Конкретні приклади включають, але не обмежені ними, гемоглобінопатію, серпоподібноклітинну анемію і будь-які інші розлади, пов'язані із диференціюванням CD34+ клітин. Приклади TNF-α-зв'язаних розладів включають, але не обмежені ними, приклади, описані в WO 98/03502 і WO 98/54170, повний зміст яких включено в даний документ шляхом посилання. Конкретні приклади включають, але не обмежені ними, ендотоксемію або синдром токсичного шоку; кахексію; респіраторний дистрес-синдром у дорослих; резорбцію кісток, таку як артрит; гіперкальціємію; реакцію трансплантат-проти-хазяїна; мозкову форму малярії; запалення; ріст пухлини; хронічні легеневі запальні захворювання; реперфузне ушкодження; інфаркт міокарда; удар; циркуляторний шок; ревматоїдний артрит; хвороба Крона; ВІЛ-інфекцію і СНІД; інші розлади, такі як ревматоїдний артрит, ревматоїдний спондиліт, остеоартрит, псоріатичний артрит і інші артритні стани, септичний шок, сепсис, ендотоксичний шок, реакцію трансплантатпроти-хазяїна, зашлакованість, хворобу Крона, виразковий коліт, розсіяний склероз, системний червоний вовчак, ENL (лепрозну вузлову еритему) при проказі, ВІЛ, СНІД і опортуністичні інфекції при ВІЛ; розлади, такі як септичний шок, сепсис, ендотоксичний шок, гемодинамічний шок і септичний синдром, постішемічне реперфузне ураження, малярія, мікобактеріальна інфекція, менінгіт, псоріаз, застійна серцева недостатність, фіброзні захворювання, кахексія, відторгнення трансплантата, онкогенні або канцерогенні стани, астма, аутоімунне захворювання, променеві ураження і альвеолярні ушкодження, викликані гіпероксією; вірусні інфекції, такі як інфекції, викликані вірусом герпесу; вірусні кон'юнктивіти; або атопічний дерматит. В інших варіантах здійснення винаходу охоплено також застосування сполуки А в імунології, зокрема, як вакцинних ад'ювантів, особливо, протиракових вакцинних ад'ювантів, які розкриті в попередній заявці США № 60/712823, зареєстрованій 1 вересня 2005 р., повний зміст якої 21 UA 113512 C2 5 10 15 20 25 30 35 40 45 50 55 60 включено в даний документ шляхом посилання. Такі варіанти здійснення винаходу також стосуються застосування сполуки А у комбінації із вакцинами для лікування або попередження ракових або інфекційних захворювань і інших різних варіантів застосування імуномодулюючих сполук, таких як зниження або десенсибілізація алергійних реакцій. Дози сполуки А варіюють у залежності від таких факторів, як конкретні показання для лікування, попередження або контролю; вік і стан пацієнта; а також кількість використовуваного другого активного засобу, якщо він використовується. Загалом, сполука А може використовуватися в кількості від приблизно 0,1 мг до приблизно 500 мг у день, і її кількість може коректуватися стандартним чином (наприклад, однакову кількість вводять щодня протягом часу лікування, попередження або контролю), циклами (наприклад, один тиждень прийому, один тиждень без прийому) або в кількості, яка підвищується або знижується по ходу курсу лікування, попередження або контролю. В інших варіантах здійснення винаходу доза може складати від приблизно 1 мг до приблизно 300 мг, від приблизно 0,1 мг до приблизно 150 мг, від приблизно 1 мг до приблизно 200 мг, від приблизно 10 мг до приблизно 100 мг, від приблизно 0,1 мг до приблизно 50 мг, від приблизно 1 мг до приблизно 50 мг, від приблизно 10 мг до приблизно 50 мг, від приблизно 20 мг до приблизно 30 мг або від приблизно 1 мг до приблизно 20 мг. Тверда форма сполуки А за даним винаходом може бути змішана із іншими фармакологічно активними сполуками ("другими діючими засобами") у способах і композиціях за винаходом. Деякі комбінації можуть діяти синергетично при лікуванні визначених типів захворювань або розладів, а також патологічних станів і симптомів, асоційованих із такими захворюваннями або розладами. Тверда форма сполуки А за даним винаходом також може діяти, пом'якшуючи побічні ефекти, асоційовані із деякими другими діючими засобами, і навпаки. У способах і композиціях за винаходом можуть використовуватися один або декілька других активних інгредієнтів або засобів. Інші активні засоби можуть являти собою великі молекули (наприклад, білки) або невеликі молекули (наприклад, синтетичні неорганічні, металорганічні або органічні молекули). Приклади активних засобів, які являють собою великі молекули, включають, але не обмежені ними, гемопоетичні ростові фактори, цитокіни і моноклональні і поліклональні антитіла. Конкретними прикладами активних засобів є моноклональні анти-CD40-антитіла (такі як, наприклад, SGN-40); інгібітори гістондеацетилази (такі як, наприклад, SAHA і LAQ 824); інгібітори білка теплового шоку 90 (такі як, наприклад, 17-AAG); інгібітори кінази рецептора інсуліноподібного фактора росту-1; інгібітори кінази судинного ендотеліального фактора росту (такі як, наприклад, PTK787); інгібітори рецептора інсулінового фактора росту; інгібітори ацилтрансферази лізофосфатидилової кислоти; інгібітори кінази IkВ; інгібітори p38MAPK; інгібітори EGFR (такі як, наприклад, гефітиніб і ерлотиніб HCL); антитіла до HER-2 (такі як, наприклад, трастузумаб (Herceptin®) і пертузумаб (Omnitarg™)); антитіла до VEGFR (такі як, наприклад, бевацизумаб (Avastin™)); інгібітори VEGFR (такі як, наприклад, інгібітори кіназ, специфічні до flk-1, SU5416 і ptk787/zk222584); інгібітори PI3K (такі як, наприклад, вортманін); інгібітори C-Met (такі як, наприклад, PHA-665752); моноклональні антитіла (такі як, наприклад, ритуксимаб (Rituxan®), тозитумомаб (Bexxar®), едреколомаб (Panorex®) і G250); і анти-TNF-α антитіла. Приклади низькомолекулярних активних засобів включають, але не обмежені ними, протиракові засоби і антибіотики (наприклад, кларитроміцин). Конкретні інші активні сполуки, які можна об'єднати із твердою формою сполуки А за винаходом, залежать від конкретного показання для лікування, попередження або контролю. Наприклад, для лікування, попередження або контролю ракових захворювань другі активні засоби включають, але не обмежені ними, семаксаніб; циклоспорин; етанерсепт; доксициклін; бортезоміб; ацивіцин; акларубіцин; акодазол гідрохлорид; акронін; адозелецин; альдеслейкін; альтретамін; амбоміцин; аметантрону ацетат; амсакрин; анастрозол; антраміцин; аспарагіназу; асперлін; азацитидин; азетепу; азотоміцин; батимастат; бензодепу; бікалутамід; бісантрену гідрохлорид; біснафіду димезилат; бізелезин; блеоміцину сульфат; бреквінар натрій; бропіримін; бусульфан; кактиноміцин; калустерон; карацемід; карбетимер; карбоплатин; кармустин; карубіцину гідрохлорид; карзелезин; цедефінгол; целекоксиб; хлорамбуцил; циролеміцин; цисплатин; кладрибін; криснатолу мезилат; циклофосфамід; цитарабін; дакарбазин; дактиноміцин; даунорубіцину гідрохлорид; децитабін; дексормаплатин; дезагуанін; дезагуаніну мезилат; діазиквон; доцетаксел; доксорубіцин; доксорубіцину гідрохлорид; дролоксифен; дролоксифену цитрат; дромостанолону пропіонат; дуазоміцин; едатрексат; ефлорнітину гідрохлорид; елсамітруцин; енлоплатин; енпромат; епіпропідин; епірубіцину гідрохлорид; ербулозол; езорубіцину гідрохлорид; естрамустин; естрамустин натрій фосфат; етанідазол; етопозид; етопозиду фосфат; етоприн; фадрозолу гідрохлорид; фазарабін; 22 UA 113512 C2 5 10 15 20 25 30 35 40 45 50 55 60 фенретинід; флоксуридин; флударабіну фосфат; фторурацил; фторцитабін; фосхідон; фострієцин натрій; гемцитабін; гемцитабіну гідрохлорид; гідроксисечовину; ідарубіцину гідрохлорид; іфосфамід; ілмофозин; іпроплатин; іринотекан; іринотекану гідрохлорид; ланреотиду ацетат; летрозол; леупроліду ацетат; ліарозолу гідрохлорид; лометрексол натрій; ломустин; лозоксантрону гідрохлорид; мазопрокол; майтанзин; мехлоретаміну гідрохлорид; мегестролу ацетат; меленгестролу ацетат; мелфалан; меногарил; меркаптопурин; метотрексат; метотрексат натрій; метоприн; метуредепу; мітиндомід; мітокарцин; мітокромін; мітогілін; мітомалцин; мітоміцин; мітоспер; мітотан; мітоксантрону гідрохлорид; мікофенолову кислоту; нокодазол; ногаламіцин; ормаплатин; оксисуран; паклітаксел; пегаспаргазу; пеліоміцин; пентамустин; пепломіцину сульфат; перфосфамід; піпоброман; піпосульфан; піроксантрону гідрохлорид; плікаміцин; пломестан; порфімер натрій; порфіроміцин; преднімустин; прокарбазину гідрохлорид; пуроміцин; пуроміцину гідрохлорид; піразофурин; рибоприн; сафінгол; сафінголу гідрохлорид; семустин; симтразен; спарфосат натрій; спарсоміцин; спірогерманію гідрохлорид; спіромустин; спіроплатин; стрептонігрин; стрептозоцин; сулофенур; талізоміцин; текогалан натрій; таксотер; тегафур; телоксантрону гідрохлорид; темопорфін; теніпозид; тероксирон; тестолактон; тіаміприн; тіогуанін; тіотепу; тіазофурин; тірапазамін; тореміфену цитрат; трестолону ацетат; трицирибіну фосфат; триметрексат; триметрексату глюкуронат; трипторелін; тубулозолу гідрохлорид; урамустин; уредепу; вапреотид; вертепорфін; вінбластину сульфат; вінкристину сульфат; віндезин; віндезину сульфат; вінепідину сульфат; вінгліцинату сульфат; вінлейрозину сульфат; вінорелбіну тартрат; вінрозидину сульфат; вінзолідину сульфат; ворозол; зеніплатин; зіностатин і зорубіцину гідрохлорид. Інші другі засоби включають, але не обмежені ними, 29-епі-1,25-дигідроксивітамін D3; 5етинілурацил; абіратерон; акларубіцин; ацилфульвен; адеципенол; адозелецин; альдезлейкін; антагоністи ALL-TK; альтретамін; амбамустин; амідокс; аміфостин; амінолевулінову кислоту; амрубіцин; амсакрин; анагрелід; анастрозол; андрографолід; інгібітори ангіогенезу; антагоніст D; антагоніст G; антарелікс; антидорсальний морфогенетичний білок-1; антиандроген для лікування карциноми передміхурової залози; антиестроген; антинеопластон; антисмислові олігонуклеотиди; афідиколіну гліцинат; модулятори апоптотичних генів; регулятори апоптозу; апуринову кислоту; ara-CDP-DL-PTBA; аргініндеаміназу; асулакрин; атаместан; атримустин; аксинастатин 1; аксинастатин 2; аксинастатин 3; азасетрон; азатоксин; азатирозин; похідні бакатину III; баланол; батимастат; антагоністи BCR/ABL; бензохлорини; бензоїлстауроспорин; бета-лактамні похідні; бета-алетин; бетакламіцин В; бетулінову кислоту; інгібітор bFGF; бікалутамід; бісантрен; бісазиридинілспермін; біснафід; бістратен А; бізелезин; брефлат; бропіримін; будотитан; бутіоніну сульфоксимін; кальципотріол; калфостин С; похідні камптотецину; капецитабін; карбоксамідамінотриазол; карбоксіамінотриазол; CaRest M3; CARN 700; інгібітор, отриманий із хряща; карзелезин; інгібітори казеїнкінази (ICOS); кастаноспермін; цекропін В; цетрорелікс; хлорини; хлорхіноксаліну сульфонамід; цикапрост; циспорфірин; кладрибін; аналоги кломіфену; клотримазол; колісміцин А; колісміцин В; комбретастатин А4; аналоги комбретастатину; конагенін; крамбесцидин 816; криснатол; криптофіцин 8; похідні криптофіцину А; курацин А; циклопентантрахінони; циклоплатам; ципеміцин; цитарабіну ocfosfate; цитолітичний фактор; цитостатин; дакліксимаб; децитабін; дегідродидемнін В; деслорелін; дексаметазон; дексифосфамід; дексразоксан; дексверапаміл; діазиквон; дидемнін В; дидокс; діетилнорспермін; дигідро-5-азацитидин; 9-дигідротаксол; діоксаміцин; дифенілспіромустин; доцетаксел; докозанол; долазетрон; доксифлуридин; доксорубіцин; дролоксифен; дронабінол; дуокарміцин SA; ебселен; екомустин; еделфозин; едреколомаб; ефлорнітин; елемене; емітефур; епірубіцин; епристерид; аналоги естрамустину; агоністи естрогену; антагоністи естрогену; етанідазол; етопозиду фосфат; ексеместан; фадрозол; фазарабін; фенретинід; філграстим; фінастерид; флавопіридол; флезеластин; флуастерон; флударабін; флуородаунорубіцину гідрохлорид; форфенімекс; форместан; фостриецин; фотемустин; гадолінію тексафурин; галію нітрат; галоцитабін; ганірелікс; інгібітори гелатинази; гемцитабін; інгібітори глутатіону; гепсульфам; герегулін; гексаметилену бісацетамід; гіперицин; ібандронову кислоту; ідарубіцин; ідоксифен; ідрамантон; ілмофозин; іломастат; іматиніб (Gleevec®), іміквімод; імуностимулюючі пептиди; інгібітори рецептора інсуліноподібного фактора росту 1; агоністи інтерферону; інтерферони; інтерлейкіни; йобенгуан; йододоксорубіцин; 4іпомеанол; іропласт; ірсогладин; ізобенгазол; ізогомогалікондрин В; ітасетрон; джасплакінолід; кахалалід F; ламеларин-N-триацетат; ланреотид; леїнаміцин; ленограстим, лентинану сульфат; лептолстатин; летрозол; фактор, інгібуючий активність лейкозних клітин; інтерферон-альфа лейкоцитів; лейпролін+естроген+прогестерон; лейпрорелін; левамізол; ліарозол; аналоги лінійного поліаміну; ліпофільний дисахаридний пептид; ліпофільні сполуки платини; лісоклінамід 7; лобаплатин; ломбрицин; лометрексол; лонідамін; лозоксантрон; локсорибін; 23 UA 113512 C2 5 10 15 20 25 30 35 40 45 50 55 луртотекан; тексафірин лютецію; лізофулін; літичні пептиди; майтанзин; маностатин А; маримастат; мазопрокол; маспін; інгібітори матрилізину; інгібітори матричних металопротеїназ; меногарил; мербарон; метерелін; метіоніназу; метоклопрамід; інгібітор MIF; міфепристон; мілтефозин; міримостим; мітогуазон; мітолактол; аналоги мітоміцину; мітонафід; мітотоксиновий фактор росту фібробластів сапорину; мітоксантрон; мофаротен; молграмостим; ербітукс; людський хоріонічний гонадотропін; монофосфорил-ліпід А+стінка мікобактеріальних клітин sk; мопідамол; гірчичний протиканцерогенний агент; мікапероксид В; екстракт стінок мікобактеріальних клітин; міриапорон; N-ацетилдиналін; N-заміщені бензаміди; нафарелін; нагрестип; налоксон+пентазоцин; напавін; нафтерпін; нартограстим; недаплатин; неморубіцин; неридронову кислоту; нілутамід; нізаміцин; модулятори оксиду азоту; антіоксидант нітроксиду; нітрулін; облімерсен (Genasense®); О6-бензилгуанін; октреотид; окіценон; олігонуклеотиди; онапристон; ондансетрон; орацин; пероральний цитокіновий індуктор; ормаплатин; осатерон; оксаліплатин; оксауноміцин; паклітаксел; аналоги паклітакселу; похідні паклітакселу; палауамін; пальмітоїлризоксин; памідронову кислоту; панакситріол; паноміфен; парабактин; пазеліптин; пегаспаргаз; пелдесин; пентосан-натрій полісульфат; пентостатин; пентрозол; перфлуброн; перфосфамід; периліловий спирт; феназиноміцин; фенілацетат; інгібітори фосфатази; піцибаніл; пілокарпін-гідрохлорид; пірарубіцин; піритрексим; плацетин А; плацетин В; інгібітор активатора плазміногена; платиновий комплекс; сполуки платини; комплекс платина-триамін; порфімер натрій; порфіроміцин; преднізон; пропіл-бісакридон; простагландин J2; інгібіторипротеасоми; імуномодулятор на основі білка А; інгібітор протеїнкінази С; мікроалгал; інгібітори протеїнтирозинфосфатази; інгібітори пуриннуклеозидфосфорилази; пурпурини; піразолакридин; піридоксилований гемоглобінполіоксіетиленовий кон'югат; антагоністи raf; ралтитрексед; рамосетрон; інгібітори raf фарнезилпротеїнтрансферази; інгібітори ras; інгібітор ras-GAP; 186 ретеліптин деметильований; етидронат ренію ( Re); ризоксин; рибозими; RII ретинамід; рохітукін; ромуртид; роквінімекс; рубігінон В1; рубоксил; сафінгол; саїнтопін; SarCNU; саркофітол А; сарграмостин; міметики Sdi 1; семустин; інгібітор 1, отриманий із старіючих клітин; смислові олігонуклеотиди; інгібітори сигнальної трансдукції; сизофіран; собузоксан; борокаптат натрію; фенілацетат натрію; солверол; соматомедин-зв'язувальний білок; сонермін; спарфозову кислоту; спікаміцин D; спіромустин; спленопентин; спонгістатин 1; скваламін; стипіамід; інгібітори стромелізину; сульфінозин; антагоністи гіперактивного вазоактивного інтестинального пептиду; сурадисту; сурамін; сваїнсонін; талімустин; тамоксифену метіодид; тауромустин; тазаротен; текогалан натрій; тегафур; телурапірилій; інгібітори теломерази; темопорфін; теніпозид; тетрахлородекаоксид; тетразомін; талібластин; тіокоралін; тромбопоетин; тромбопоетиновий міметик; тималфазин; агоніст рецептора тимопоетину; тимотринан; тиреостимулюючий гормон; олово етилетіопурпурин; тирапазамін; титаноцену дихлорид; топсентин; тореміфен; інгібітори трансляції; третиноїн; триацетилуридин; трицирибін; триметрексат; трипторелін; тропісетрон; туростерид; інгібітори тирозинкіназ; тирфостини; інгібітори UBC; убенімекс; отриманий із сечостатевої пазухи фактор, інгібуючий ріст; антагоністи рецептора урокінази; вапреотид; варіолін В; веларезол; верамін; вердини; вертепорфін; вінорелбін; вінксалтин; вітаксин; ворозол; занотерон; зеніплатин; зиласкорб і зиностатин стималамер. Конкретні другі активні засоби включають, але не обмежені ними, 2-метоксіестрадіол, теломестатин, індуктори апоптозу в клітинах множинної мієломи (такі як, наприклад, TRAIL), статини, семаксаніб, циклоспорин, етанерсепт, доксициклін, бортезоміб, облімерсен (Genasense®), ремікад, доцетаксел, целекоксиб, мелфалан, дексаметазон (Decadron®), стероїди, гемцитабін, цисплатин, темозоломід, етопозид, циклофосфамід, темодар, карбоплатин, прокарбазин, гліадел, тамоксифен, топотекан, метотрексат, Arisa®, таксол, таксотер, фторурацил, лейковорин, іринотекан, кселоду, СРТ-11, інтерферон-альфа, пегильований інтерферон-альфа (наприклад, PEG INTRON-A), капецитабін, цисплатин, тіотепу, флударабін, карбоплатин, ліпосомальний даунорубіцин, цитарабін, доксетаксол, паклітаксел, вінбластин, IL-2, GM-CSF, дакарбазин, вінорелбін, золедронову кислоту, палмітронат, біаксин, бусульфан, преднізон, бісфосфонат, триоксид миш'яку, вінкристин, доксорубіцин (Doxil®), паклітаксел, ганцикловір, адріаміцин, естрамустин натрій фосфат (Emcyt®), суліндак і етопозид. В іншому варіанті здійснення винаходу приклади конкретних других засобів згідно із показаннями для лікування, попередження або контролю можна знайти в наведених нижче посиланнях, повний зміст яких включено в даний документ шляхом посилання: патентах США № 6281230 і 5635517; патентних публікаціях США № 2004/0220144, 2004/0190609, 2004/0087546, 2005/0203142, 2004/0091455, 2005/0100529, 2005/0214328, 2005/0239842, 2006/0154880, 2006/0122228 і 2005/0143344; і в попередній патентній заявці США № 60/631870. 24 UA 113512 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклади других активних засобів, які можуть використовуватися для лікування, попередження і/або контролю болю, включають, але не обмежені ними, звичайні терапевтичні засоби, використовувані для лікування або попередження болю, такі як антидепресанти, антиконвульсанти, антигіпертензивні засоби, анксіолітичні засоби, блокатори кальцієвих каналів, м'язові релаксанти, ненаркотичні анальгетики, опіоїдні анальгетики, протизапальні засоби, інгібітори СОХ-2, імуномодулюючі агенти, агоністи або антагоністи альфаадренергічного рецептора, імунодепресивні засоби, кортикостероїди, гіпербаричний кисень, кетамін, інші анестезуючі засоби, антагоністи NMDA і інші терапевтичні засоби, наведені, наприклад, у публікації Physician's Desk Reference 2003. Конкретні приклади включають, але не обмежені ними, ацетат саліцилової кислоти (Aspirin®), целекоксиб (Celebrex®), Enbrel®, кетамін, габапентин (Neurontin®), фенітоїн (Dilantin®), карбамазепін (Tegretol®), окскарбазепін (Trileptal®), валпроєву кислоту (Depakene®), морфіну сульфат, гідроморфон, преднізон, гризеофульвін, пентоніум, алендронат, дифенгідрамід, гуанетидин, кеторолак (Acular®), тирокальцитонін, диметилсульфоксид (DMSO), клонідин (Catapress®), бретиліум, кетансерин, резерпін, дроперидол, атропін, фентоламін, бупівакаїн, лідокаїн, ацетамінофен, нортриптилін (Pamelor®), амітриптилін (Elavil®), іміпрамін (Tofranil®), доксепін (Sinequan®), кломіпрамін (Anafranil®), флуоксетин (Prozac®), сертралін (Zoloft®), напроксен, нефазодон (Serzone®), венлафаксин (Effexor®), тразодон (Desyrel®), бупропіон (Wellbutrin®), мексилетин, ніфедипін, пропранолол, трамадол, ламотригін, віокс, зиконотид, кетамін, декстрометорфан, бензодіазепіни, баклофен, тизанідин і феноксибензамін. Приклади других активних засобів, які можуть використовуватися для лікування, попередження і/або контролю дегенерації жовтої плями і супутніх синдромів, включають, але не обмежені ними, стероїд, світловий сенсибілізатор, інтегрин, антіоксидант, інтерферон, похідне ксантину, гормон росту, нейротрофічний фактор, регулятор неоваскуляризації, анти-VEGF антитіло, простагландин, антибіотик, фітоестроген, протизапальна сполука або антиангіогенна сполука, або їх комбінацію. Конкретні приклади включають, але не обмежені ними, вертепорфін, пурлітин, ангіостатичний стероїд, rhuFab, інтерферон-2α, пентоксифілін, олово етіопурпурин, мотексафін, люцентис, лютецій, 9-фтор-11,21-дигідрокси-16, 17,1метилетилідинбіс(окси)прегна-1,4-дієн-3,20-діон, латанопрост (див. патент США № 6225348), тетрациклін і його похідні, рифаміцин і його похідні, макроліди, метронідазол (патенти США № 6218369 і 6015803), геністеїн, геністин, 6'-О-Mal геністин, 6'-О-Ас геністин, даїдзеїн, даїдзин, 6'О-Mal даїдзин, 6'-О-Ас даїдзин, гліцитеїн, гліцитин, 6'-О-Mal гліцитин, біоханін А, формононетин (патент США № 6001368), триамцинолону ацетомід, дексаметазон (патент США № 5770589), талідомід, глутатіон (патент США № 5632984), основний фактор росту фібробластів (bFGF), трансформуючий фактор росту b (TGF-b), нейротропний фактор мозку (BDNF), фактор активатора плазміногена 2 типу (PAI-2), EYE101 (Eyetech Pharmaceuticals), LY333531 (Eli Lilly), Miravant і імплант RETISERT (Bausch & Lomb). Повний зміст усіх посилань, цитованих в у даному документі, включено в нього шляхом посилання. Приклади других активних засобів, які можуть використовуватися для лікування, попередження і/або контролю шкірних захворювань, включають, але не обмежені ними, кератолітики, ретиноїди, α-гідроксикислоти, антибіотики, колаген, ботулінічний токсин, інтерферон, стероїди і імуномодулюючі засоби. Конкретні приклади включають, але не обмежені ними, 5-фторурацил, мазопрокол, трихлороцтову кислоту, саліцилову кислоту, молочну кислоту, лактат амонію, сечовину, третиноїн, ізотретиноїн, антибіотики, колаген, ботулінічний токсин, інтерферон, кортикостероїд, транс-ретиноєву кислоту і колагени, такі як людський плацентарний колаген, тваринний плацентарний колаген, Dermalogen, AlloDerm, Fascia, Cymetra, Autologen, Zyderm, Zyplast, Resoplast і Isolagen. Приклади других активних засобів, які можуть використовуватися для лікування, попередження і/або контролю легеневої гіпертензії і супутніх розладів, включають, але не обмежені ними, антикоагулянти, діуретики, серцеві глікозиди, блокатори кальцієвих каналів, вазодилататори, аналоги простацикліну, антагоністи ендотеліну, інгібітори фосфодіестерази (наприклад, інгібітори PDE V), інгібітори ендопептидази, ліпідознижувальні засоби, інгібітори тромбоксану і інші терапевтичні засоби, що знижують тиск у легеневій артерії. Конкретні приклади включають, але не обмежені ними, варфарин (Coumadin®), діуретик, серцевий глікозид, дигоксин-кисень, дилтіазем, ніфедипін, вазодилатор, такий як простациклін (наприклад, простагландин I2 (PGI2), епопростенол (ЕРО, Floran®), трепростиніл (Remodulin®), оксид азоту (NO), бозентан (Tracleer®), амлодипін, епопростенол (Floran®), трепростиніл (Remodulin®), простациклін, тадалафіл (Cialis®), симвастатин (Zocor®), омапатрилат (Vanlev®), ірбесартан (Avapro®), правастатин (Pravachol®), дигоксин, L-аргінін, ілопрост, бетапрост і силденафіл (Viagra®). 25 UA 113512 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклади других активних засобів, які можуть використовуватися для лікування, попередження і/або контролю розладів, зв'язаних із азбестом, включають, але не обмежені ними, антрациклін, платин, алкілуючий агент, облімерсен (Genasense®), цисплатин, циклофосфамід, темодар, карбоплатин, прокарбазин, гліадел, тамоксифен, топотекан, метотрексат, таксотер, іринотекан, капецитабін, цисплатин, тіотепу, флударабін, карбоплатин, ліпосомальний даунорубіцин, цитарабін, доксетаксол, пацилітаксел, вінбластин, IL-2, GM-CSF, дакарбазин, вінорелбін, золедронову кислоту, пальмітронат, біаксин, бусульфан, преднізон, бісфосфонат, триоксид миш'яку, вінкристин, доксорубіцин (Doxil®), паклітаксел, ганцикловір, адріаміцин, блеоміцин, гіалуронідазу, мітоміцин С, мепакрин, тіотепу, тетрациклін і гемцитабін. Приклади других активних засобів, які можуть використовуватися для лікування, попередження і/або контролю паразитарних захворювань, включають, але не обмежені ними, хлорохін, хінін, хінідин, піриметамін, сульфадіазин, доксициклін, кліндаміцин, мефлоквін, галофантрин, примаквін, гідроксіхлороквін, прогуаніл, атоваквон, азитроміцин, сурамін, пентамідин, меларсопрол, ніфуртимокс, бензнідазол, амфотерицин В, пентавалентні сполуки стибію (наприклад, стибоглюкуронат натрію), інтерферон-гамма, ітраконазол, комбінацію вбитих промастигот і BCG, лейковорин, кортикостероїди, сульфонамід, спіраміцин, IgG (серологія), триметоприм і сульфаметоксазол. Приклади других активних засобів, які можуть використовуватися для лікування, попередження і/або контролю імунодефицитних станів, включають, але не обмежені ними, антибіотики (терапевтичні або профілактичні), такі як, але не обмежені ними, ампіцилін, тетрациклін, пеніцилін, цефалоспорини, стрептоміцин, канаміцин і еритроміцин; противірусні засоби, такі як, але не обмежені ними, амантадин, римантадин, ацикловір і рибавірин; імуноглобулін; плазму; лікарські засоби, які підсилюють імунітет, такі як, але не обмежені ними, левамізол і ізопринозин; біологічні препарати, такі як, але не обмежені ними, гаммаглобулін, фактор перенесення, інтерлейкіни і інтерферони; гормони, такі як, але без обмеження ними, тимічні гормони; і інші імунологічні засоби, такі як, але без обмеження ними, стимулятори Вклітин (наприклад, BAFF/BlyS), цитокіни (наприклад, IL-2, IL-4 і IL-5), фактори росту (наприклад, TGF-α), антитіла (наприклад, анти-CD40 і IgМ), олігонуклеотиди, що містять неметиловані CpGмотиви, і вакцини (наприклад, вакцини проти вірусних і пухлинних пептидів). Приклади других активних засобів, які можуть використовуватися для лікування, попередження і/або контролю розладів ЦНС, включають, але без обмеження ними, опіоїди, агоністи або антагоністи допаміну, такі як, але без обмеження ними, леводопу, L-DOPA, кокаїн, α-метилтирозин, резерпін, тетрабеназин, бензотропін, паргілін, фенодолпаму мезилат, каберголін, праміпексолу дигідрохлорид, ропінорол, амантадину гідрохлорид, селегіліну гідрохлорид, карбідопу, перголіду мезилат, Sinemet CR і Symmetrel; інгібітори МАО, такі як, але без обмеження ними, іпроніазид, клоргілін, фенелзин і ізокарбоксазид; інгібітори COMT, такі як, але без обмеження ними, толкапон і ентакапон; інгібітори холінестерази, такі як, але без обмеження ними, фізостигміну саліцилат, фізостигміну сульфат, фізостигміну бромід, неостигміну бромід, меостигміну метилсульфат, амбенонію хлорид, едрофонію хлорид, такрин, пралідоксиму хлорид, обідоксиму хлорид, тримедоксиму бромід, діацетилмонооксим, ендрофоній, піридостигмін і демекарій; протизапальні засоби, такі як, але без обмеження ними, напроксен натрій, дихлофенак натрій, диклофенак калій, целекоксиб, суліндак, оксапрозин, дифлунізал, етодолак, мелоксикам, ібупрофен, кетопрофен, набуметон, рефекоксиб, метотрексат, лефлуномід, сульфасалазин, солі золота, Rho(D) імуноглобулін, мікофенолят мофетил, циклоспорин, азатіоприн, такролімус, базиліксимаб, даклізумаб, саліцилова кислота, ацетилсаліцилова кислота, метилсаліцилат, дифлунізал, салсалат, олсалазин, сульфасалазин, ацетамінофен, індометацин, суліндак, мефенамінова кислота, меклофенамат натрій, толметин, кеторолак, диклофенак, флурбінпрофен, оксапрозин, піроксикам, мелоксикам, ампіроксикам, дроксикам, півоксикам, теноксикам, фенілбутазон, оксифенбутазон, антипірин, амінопірин, апазон, зилейтон, ауротіоглюкоза, тіомалат золота-натрію, ауранофін, метотрексат, колхіцин, алопуринол, пробенецид, сульфінпіразон і бензбромарон або бетаметазон і інші глюкокортикоїди; і протиблювотні засоби, такі як, але без обмеження ними, метоклопромід, домперидон, прохлорперазин, прометазин, хлорпромазин, триметобензамід, ондансетрон, гранісетрон, гідроксизин, ацетиллейцину моноетаноламін, алізаприд, азасетрон, бензхінамід, біетанаутин, бромоприд, буклізин, клебоприд, циклізин, дименгідринат, дифенідол, доласетрон, меклізин, металатал, метопімазин, набілон, оксиперидил, піпамазин, скополамін, сулпірид, тетрагідроканабінол, триетилперазин, тіопроперазин, тропізетрон і їх суміші. Приклади других активних засобів, які можуть використовуватися для лікування, попередження і/або контролю розладів ЦНС і супутніх синдромів, включають, але не обмежені ними, імуномодулюючі засоби, імунодепресивні засоби, антигіпертензивні засоби, 26 UA 113512 C2 5 10 15 20 25 30 35 40 45 50 55 60 антиконвульсанти, фібринолітичні засоби, антитромботичні засоби, антипсихотичні засоби, антидепресанти, бензодіазепіни, буспірон, амантадин і інші відомі або звичайні засоби, які використовуються для лікування пацієнтів із травмою/ураженням ЦНС і супутніми синдромами. Конкретні приклади включають, але не обмежені ними, стероїди (наприклад, глюкокортикоїди, такі як, але без обмеження ними, метилпреднізолон, дексаметазон і бетаметазон); протизапальні агенти, включаючи, але без обмеження ними, напроксен натрій, диклофенак натрій, диклофенак калій, целекоксиб, суліндак, оксапрозин, дифлунізал, етодолак, мелоксикам, ібупрофен, кетопрофен, набуметон, рефекоксиб, метотрексат, лефлуномід, сульфасалазин, солі золота, Rho(D) імуноглобулін, мікофенолят мофетил, циклоспорин, азатіоприн, такролімус, базиліксимаб, даклізумаб, саліцилову кислоту, ацетилсаліцилову кислоту, метилсаліцилат, дифлунізал, салсалат, олсалазин, сульфасалазин, ацетамінофен, індометацин, суліндак, мефенамінову кислоту, меклофенамат натрію, толметин, кеторолак, диклофенак, флурбінпрофен, оксапрозин, піроксикам, мелоксикам, ампіроксикам, дроксикам, півоксикам, теноксикам, фенілбутазон, оксифенбутазон, антипірин, амінопірин, апазон, зилейтон, ауротіоглюкоза, тіомалат золота-натрію, ауранофін, метотрексат, колхіцин, алопуринол, пробенецид, сульфінпіразон і бензбромарон; аналоги цАМФ, включаючи, але без обмеження ним, db-цАМФ; засіб, який містить препарат на основі метилфенідату, що включає lтреометилфенідат, d-треометилфенідат, dl-треометилфенідат, l-еритрометилфенідат, dеритрометилфенідат, dl-еритрометилфенідат, а також їх суміш; і діуретичний засіб, такий як, але без обмеження ним, маніт, фуросемід, гліцерин і сечовину. Приклади других активних засобів, які можуть використовуватися для лікування, попередження і/або контролю порушень сну і супутніх синдромів, включають, але без обмеження ними, трициклічний антидепресант, селективний інгібітор зворотного захоплення серотоніну, протиепілептичний засіб (габапентин, прегабалін, карбамазепін, окскарбазепін, левітирацетам, топірамат), антиаритмічний засіб, блокатор натрієвих каналів, селективний інгібітор медіатора запальної відповіді, опіоїдний агент, друга імуномодулююча сполука, комбінований засіб, а також інші відомі або стандартні засоби, які використовуються в терапії сну. Конкретні приклади включають, але не обмежені ними, нейронтин, оксиконтин, морфін, топірамат, амітриптилін, нортриптилін, карбамазепін, леводопу, L-DOPA, кокаїн, αметилтирозин, резерпін, тетрабеназин, бензотропін, паргілін, фенодолпаму мезилат, каберголін, праміпексолу дигідрохлорид, ропінорол, амантадину гідрохлорид, селегіліну гідрохлорид, карбідопу, перголід-мезилат, Sinemet CR, Symmetrel, іпроніазид, клоргілін, фенелзин, ізокарбоксазид, толкапон, ентакапон, фізостигміну саліцилат, фізостигміну сульфат, фізостигміну бромід, меостигміну бромід, неостигміну метилсульфат, амбенонію хлорид, едрофонію хлорид, такрин, пралідоксиму хлорид, обідоксиму хлорид, тримедоксиму бромід, діацетилмонооксим, ендрофоній, піридостигмін, демекарій, напроксен натрій, дихлофенак натрій, диклофенак калій, целекоксиб, суліндак, оксапрозин, дифлунізал, етодолак, мелоксикам, ібупрофен, кетопрофен, набуметон, рефекоксиб, метотрексат, лефлуномід, сульфасалазин, солі золота, Rho(D) імуноглобулін, мікофенолят мофетил, циклоспорин, азатіоприн, такролімус, базиліксимаб, даклізумаб, саліцилову кислоту, ацетилсаліцилову кислоту, метилсаліцилат, дифлунізал, салсалат, олсалазин, сульфасалазин, ацетамінофен, індометацин, суліндак, мефенамінову кислоту, меклофенамат натрій, толметин, кеторолак, диклофенак, флурбінпрофен, оксапрозин, піроксикам, мелоксикам, ампіроксикам, дроксикам, півоксикам, теноксикам, фенілбутазон, оксифенбутазон, антипірин, амінопірин, апазон, зилейтон, ауротіоглюкозу, тіомалат золото натрій, ауранофін, метотрексат, колхіцин, алопуринол, пробенецид, сульфінпіразон, бензбромарон, бетаметазон і інші глюкокортикоїди, метоклопромід, домперидон, прохлорперазин, прометазин, хлорпромазин, триметобензамід, ондансетрон, гранісетрон, гідроксизин, ацетиллейцину моноетаноламін, алізаприд, азасетрон, бензхінамід, біетанаутин, бромоприд, буклізин, клебоприд, циклізин, дименгідринат, дифенідол, доласетрон, меклізин, металатал, метопімазин, набілон, оксиперидил, піпамазин, скополамін, сульпірид, тетрагідроканабінол, тіетилперазин, тіопроперазин, тропісетрон і їх суміші. Приклади других активних засобів, які можна застосовувати для лікування, попередження і/або контролю гемоглобінопатії і пов'язаних із нею розладів, включають, але не обмежені ними, інтерлейкіни, такі як IL-2 (включаючи рекомбінантний IL-II ("rIL2") і канарипокс IL-2), IL-10, IL-12 і IL-18; інтерферони, такі як інтерферон альфа-2a, інтерферон альфа-2b, інтерферон альфа-n1, інтерферон альфа-n3, інтерферон бета-Ia і інтерферон гамма-Ib; і G-CSF; гідроксисечовину; бутирати або бутиратні похідні; оксид азоту; гідроксисечовину; HEMOXIN™ (NIPRISAN™; див. патент США № 5800819); антагоністи каналів Гардоса, такі як клотримазол і триарилметанові похідні; дефероксамін; білок C; і переливання крові або замінника крові, такого як Hemospan™ або Hemospan™ PS (Sangart). 27 UA 113512 C2 5 10 15 20 25 30 35 40 45 50 55 60 Введення твердої форми сполуки А за винаходом і других активних засобів пацієнту можна здійснювати одночасно або послідовно із використанням одного і різних шляхів введення. Прийнятність конкретного шляху введення, використовуваного для конкретного активного засобу, буде залежати від самого активного засобу (наприклад, або може він вводитися перорально, не деградуючи до надходження в кровотік) і від захворювання, проти якого проводиться лікування. Одним із шляхів введення твердої форми сполуки А за винаходом є пероральний шлях. Шляхи введення інших активних засобів або інгредієнтів відомі фахівцям у th даній галузі техніки (див., наприклад, Physicians' Desk Reference (60 ed., 2006)). В одному варіанті здійснення другий активний засіб вводять внутрішньовенно або підшкірно і один або два рази в день у кількості від приблизно 1 до приблизно 1000 мг, від приблизно 5 до приблизно 500 мг, від приблизно 10 до приблизно 350 мг або від приблизно 50 до приблизно 200 мг. Конкретна кількість другого активного засобу буде залежати від конкретного використовуваного засобу, типу захворювання, відносно якого проводиться лікування або здійснюється контроль, тяжкості і стадії захворювання і кількостей(і) сполук за винаходом, а також від будь-яких необов'язкових додаткових активних засобів, що одночасно вводять пацієнту. Як вже обговорювалося в даному документі, винахід також охоплює спосіб зниження, лікування і/або попередження побічних або небажаних ефектів, пов'язаних із загальноприйнятою терапією, що включає, але без обмеження цим, хірургічне втручання, хіміотерапію, променеву терапію, гормональну терапію, біологічну терапію і імунотерапію. Сполуки за винаходом і інші активні інгредієнти можна вводити пацієнту до, під час або після виникнення побічного ефекту, асоційованого із загальноприйнятою терапією. У деяких варіантах здійснення винаходу профілактичні або терапевтичні засоби за винаходом вводять пацієнту циклічним чином. Циклічна терапія включає введення активного засобу протягом деякого періоду часу, за яким випливає відпочинок (тобто скасування введення) протягом деякого періоду часу, і повторення такого послідовного введення. Циклічна терапія може знизити розвиток стійкості до одного або декількох видів терапії, виключити або зменшити побічні ефекти від одного із видів терапії, і/або підвищити ефективність лікування. Отже, в одному варіанті здійснення винаходу тверду форму сполуки А за винаходом вводять щодня в разовій або дробних дозах протягом циклу, який складає від чотирьох до шести тижнів із періодом відпочинку, який складає приблизно один або два тижні. Циклічна терапія додатково дає можливість збільшення частоти, кількості і тривалості циклів лікування. Таким чином, інший варіант здійснення винаходу охоплює введення сполуки за винаходом протягом більшої кількості циклів, ніж звичайно, коли вони вводиться окремо. У ще одному варіанті здійснення сполуку за винаходом вводять протягом більшої кількості циклів, ніж кількість циклів, яка, як правило, викликала б дозолімітуючу токсичність у пацієнта, якому другий активний інгредієнт також не вводиться. В одному варіанті здійснення винаходу тверду форму сполуки А за винаходом вводять щодня і безупинно протягом трьох або чотирьох тижнів у дозі, яка складає від приблизно 0,1 мг до приблизно 500 мг у день, із наступним відпочинком протягом одного або двох тижнів. В інших варіантах здійснення винаходу доза може складати від приблизно 1 мг до приблизно 300 мг, від приблизно 0,1 мг до приблизно 150 мг, від приблизно 1 мг до приблизно 200 мг, від приблизно 10 мг до приблизно 100 мг, від приблизно 0,1 мг до приблизно 50 мг, від приблизно 1 мг до приблизно 50 мг, від приблизно 10 мг до приблизно 50 мг, від приблизно 20 мг до приблизно 30 мг або від приблизно 1 мг до приблизно 20 мг із наступним відпочинком. В одному варіанті здійснення винаходу тверду форму сполуки А за винаходом і другий активний засіб вводять перорально, причому сполуки за винаходом вводять за 30-60 хвилин до введення другого активного інгредієнта протягом циклу, який складає від чотирьох до шести тижнів. В іншому варіанті здійснення винаходу комбінацію сполуки за винаходом і другий активний інгредієнт вводять внутрішньовенним вливанням протягом приблизно 90 хвилин кожного циклу. Як правило, кількість циклів, під час яких проводять комбіноване лікування хворого, буде складати від приблизно одного до приблизно 24 циклів, від приблизно двох до приблизно 16 циклів або від приблизно чотирьох до приблизно трьох циклів. 4.3. ФАРМАЦЕВТИЧНІ КОМПОЗИЦІЇ Даний винахід стосується фармацевтичних композицій і стандартних лікарських форм, які містять одну або кілька твердих форм, що містять сполуку А. Також винахід стосується способів одержання фармацевтичних композицій і стандартних лікарських форм, які містять одну або кілька твердих форм, що містять сполуку А. Наприклад, у деяких варіантах здійснення винаходу окремі лікарські форми, які містять тверду форму за винаходом або отримані із використанням 28
ДивитисяДодаткова інформація
Назва патенту англійськоюSolid forms of 3-(5-amino-2methyl-4-oxo-4h-quinazolin-3-yl)-piperidine-2,6-dione, and their pharmaceutical compositions and uses
Автори англійськоюMuller, George W., Man, Hon-Wah, Cohen, Benjamin M., Li, Ying, Xu, Jean, Leong, William W.
Автори російськоюМюллер Джордж В., Ман Хон-Вах, Коен Бенджамин М., Ли Ин, Сюй Джин, Леонг Уилльям В.
МПК / Мітки
МПК: C07D 401/04, A61K 31/517
Мітки: композиція, тверда, фармацевтична, 3-(5-аміно-2-метил-4-оксо-4н-хіназолін-3-іл)піперидин-2,6-діону, застосування, форма
Код посилання
<a href="https://ua.patents.su/60-113512-tverda-forma-3-5-amino-2-metil-4-okso-4n-khinazolin-3-ilpiperidin-26-dionu-i-farmacevtichna-kompoziciya-ta-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Тверда форма 3-(5-аміно-2-метил-4-оксо-4н-хіназолін-3-іл)піперидин-2,6-діону і її фармацевтична композиція та застосування</a>
Попередній патент: Спосіб і пристрій для біологічного очищення стічних вод коксохімічного виробництва
Наступний патент: N-(3-карбамоїлфеніл)-1н-піразол-5-карбоксамідні похідні і їх застосування для боротьби з тваринами-шкідниками
Випадковий патент: Спосіб побудови семантичного простору міжособистісної оцінки або самооцінки