Похідні іміносульфонілсечовини, що мають гербіцидні властивості, гербіцидна композиція на їх основі та спосіб боротьби з бур’янами
Номер патенту: 29389
Опубліковано: 15.11.2000
Автори: АКІЯМА Сігеакі, НАВАМАКІ Цутому, СУЗУКІ Хідеакі, Ватанабе Сігеомі, НІКІ Тосіо, ІСІКАВА Кіміхіро, СУЗУКІ Коісі, МАКІНО Кензі, НАГАОКА Такесі
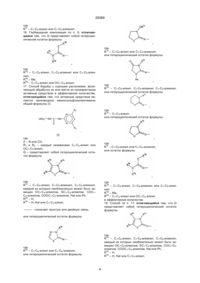
Текст
1. Производные иминосульфонилмочевины общей формулы (I) 29389 где R3e – С1-С4-алкил. 7. Производные по п. 1, отличающиеся тем, что Q представляет собой гетероциклический остаток формулы где R3g – С1-С6-алкил, С1-С6-алкенил или С1-С6-алкинил, R4g – Ме, R5g – С1-С4-алкил или ОС1-С4-алкил, обладающие гербицидными свойствами. 2. Производные по п. 1, отличающиеся тем, что Q представляет собой гетероциклический остаток формулы где R3f – С1-С6-алкил или С1-С6-алкенил. 8. Производные по п. 1, отличающиеся тем, что Q представляет собой гетероциклический остаток формулы где R3a – С1-С6-алкил, С1-С6-алкенил, С1-С6-алкинил, каждый из которых необязательно может быть замещен ОС1-С4-алкилом, SС1-С4- алкилом, СОС1С4-алкилом, СООС1-С4-алкилом, Hal или Ph, R4a – Н, R5a – Н, Hal или С1-С4-алкил. 3. Производные по п. 1, отличающиеся тем, что Q представляет собой гетероциклический остаток формулы где R3g – С1-С6-алкил, С1-С6-алкенил или С1-С6-алкинил, R4g – Me, R5g – C1-C4-алкил или ОС1-С4-алкил. 9. Гербицидная композиция, содержащая активный компонент и сельскохозяйственно-приемлемые добавки, отличающаяся тем, что активным компонентом является производное иминосульфонилмочевины общей формулы (I) где R3b – С1-С6-алкил или С1-С6-алкенил. 4. Производные по п. 1, отличающиеся тем, что Q представляет собой гетероциклический остаток формулы (I) где Z – N или СН, R1 и R2 – каждый независимо С1-С4-алкил или ОС1-С4-алкил, Q – представляет собой гетероциклический остаток формулы где R3d – С1-С6-алкил, С1-С6-алкенил или С1-С6-алкинил. 5. Производные по п. 1, отличающиеся тем, что Q представляет собой гетероциклический остаток формулы где R3a – C1-C6-алкил, С1-С6-алкенил, С1-С6-алкинил, каждый из которых необязательно может быть замещен ОС1-С4-алкилом, SС1-С4-алкилом, СОС1С4-алкилом, СООС1-С4-алкилом, Hal или Ph, R4a – H, 3c где R – С1-С6-алкил, С1-С6-алкенил. 6. Производные по п. 1, отличающиеся тем, что Q представляет собой гетероциклический остаток формулы 2 29389 R5a – H, Hal или С1-С4-алкил, -------- – означает простую или двойную связь, или гетероциклический остаток формулы где R3a – C1-C6-алкил, С1-С6-алкенил, С1-С6-алкинил, каждый из которых необязательно может быть замещен ОС1-С4-алкилом, SС1-С4-алкилом, СОС1С4-алкилом, СООС1-С4-алкилом, Hal или Ph, R4a – H, R5a – H, Hal или С1-С4-алкил. 11. Гербицидная композиция по п. 9, отличающаяся тем, что Q представляет собой гетероциклический остаток формулы где R3b – С1-С6-алкил или С1-С6-алкенил, или гетероциклический остаток формулы где R3c – С1-С6-алкил или С1-С6-алкенил, или гетероциклический остаток формулы где R3b – С1-С6-алкил или С1-С6-алкенил. 12. Гербицидная композиция по п. 9, отличающаяся тем, что Q представляет собой гетероциклический остаток формулы где R3d – С1-С6-алкил, С1-С6-алкенил С1-С6-алкинил, или гетероциклический остаток формулы где R3d – С1-С6-алкил, С1-С6-алкенил или С1-С6-алкинил. 13. Гербицидная композиция по п. 9, отличающаяся тем, что Q представляет собой гетероциклический остаток формулы где R3e – С1-С4-алкил, или гетероциклический остаток формулы где R3c – С1-С6-алкил или С1-С6-алкенил. 14. Гербицидная композиция по п. 9, отличающаяся тем, что Q представляет собой гетероциклический остаток формулы где R3f – С1-С6-алкил или С1-С6-алкенил, или остаток формулы где R3e – С1-С4-алкил. 15. Гербицидная композиция по п. 9, отличающаяся тем, что Q представляет собой гетероциклический остаток формулы где R3g – С1-С6-алкил, С1-С6-алкенил или С1-С6-алкинил, R4g – Ме, R5g – С1-С4-алкил или ОС1-С4-алкил, в эффективном количестве. 10. Гербицидная композиция по п. 9, отличающаяся тем, что Q представляет собой гетероциклический остаток формулы 3 29389 где R3f – С1-С6-алкил или С1-С6-алкенил. 16. Гербицидная композиция по п. 9, отличающаяся тем, что Q представляет собой гетероциклический остаток формулы где R3c – С1-С6-алкил или С1-С6-алкенил, или гетероциклический остаток формулы где R3g – С1-С6-алкил, С1-С6-алкенил или С1-С6-алкинил, R4g – Me, R5g – C1-C4-алкил или ОС1-С4-алкил. 17. Способ борьбы с сорными растениями, включающий обработку их или места их произрастания активным средством в эффективном количестве, отличающийся тем, что активным средством является производное иминосульфонилмочевины общей формулы (I) где R3d – С1-С6-алкил, С1-С6-алкенил С1-С6-алкинил, или гетероциклический остаток формулы где R3e – С1-С4-алкил, или гетероциклический остаток формулы , (I) где Z – N или СН, R1 и R2 – каждый независимо С1-С4-алкил или ОС1-С4-алкил, Q – представляет собой гетероциклический остаток формулы где R3f – С1-С6-алкил или С1-С6-алкенил, или остаток формулы где R3a – C1-C6-алкил, С1-С6-алкенил, С1-С6-алкинил, каждый из которых необязательно может быть замещен ОС1-С4-алкилом, SС1-С4-алкилом, СОС1С4-алкилом, СООС1-С4-алкилом, Hal или Ph, R4a– H, R5a – H, Hal или С1-С4-алкил, где R3g – С1-С6-алкил, С1-С6-алкенил или С1-С6-алкинил, R4g – Ме, R5g – С1-С4-алкил или ОС1-С4-алкил, в эффективном количестве. 18. Способ по п. 17, отличающийся тем, что Q представляет собой гетероциклический остаток формулы -------- –означает простую или двойную связь, или гетероциклический остаток формулы где R3a – C1-C6-алкил, С1-С6-алкенил, С1-С6-алкинил, каждый из которых необязательно может быть замещен ОС1-С4-алкилом, SС1-С4-алкилом, СОС1-С4алкилом, СООС1-С4-алкилом, Hal или Ph, R4a – H, R5a – H, Hal или С1-С4-алкил. где R3b – С1-С6-алкил или С1-С6-алкенил, или гетероциклический остаток формулы 4 29389 19. Способ по п. 17, отличающийся тем, что Q представляет собой гетероциклический остаток формулы где R3e – С1-С4-алкил. 23. Способ по п. 17, отличающийся тем, что Q представляет собой гетероциклический остаток формулы , где R3b – С1-С6-алкил или С1-С6-алкенил. 20. Способ по п. 17, отличающийся тем, что Q представляет собой гетероциклический остаток формулы где R3f – С1-С6-алкил или С1-С6-алкенил. 24. Способ по п. 17, отличающийся тем, что Q представляет собой гетероциклический остаток формулы где R3d – С1-С6-алкил, С1-С6-алкенил С1-С6-алкинил. 21. Способ по п. 17, отличающийся тем, что Q представляет собой гетероциклический остаток формулы где R3g – С1-С6-алкил, С1-С6-алкенил или С1-С6-алкинил, R4g – Ме, R5g – С1-С4-алкил или ОС1-С4-алкил. где R3c – С1-С6-алкил или С1-С6-алкенил. 22. Способ по п. 17, отличающийся тем, что Q представляет собой гетероциклический остаток формулы _______________________ рязнения окружающей среды и снизить затраты на транспортировку и применение. Некоторые из веществ, обладающие такими свойствами, используются в настоящее время в качестве гербицидов избирательного действия. Однако все еще существует потребность в новых, более совершенных веществах, обладающих такими свойствами. К числу аналогов, демонстрирующих сходность химической структуры с соединениями, предложенными в соответствии с настоящим изобретением, можно отнести вещества на основе сульфонилмочевины, связанной с атомом азота, которые раскрыты в не подвергнутых экспертизе патентных публикациях Японии № 15962/1983, 103371/1983, 126859/1983, 48973/1985, 214785/1985, 134377/1986, 151577/1989, 45473/1990, 91060/1990, 7284/1991 и 68562/1991, а также в патентах США № 4559081, 4592776, 4602939, 4622065, 4666508, 4696695 и 4741762. Однако вещества на основе сульфонилмочевины, связанной с атомом азота иминоструктуры, как это имеет место в настоящем изобретении, совершенно не известны и, следовательно, являются новыми. Область техники. Настоящее изобретение относится к новым производным иминосульфонилмочевины, обладающим гербицидными свойствами, гербицидной композиции на их основе и способу борьбы с сорными растениями. Уровень техники. Неотъемлемой частью повышения урожайности таких важных сельскохозяйственных культур, как рис, пшеница, кукуруза, соя, хлопок и сахарная свекла, является использование гербицидов с целью защиты этих культур от сорняков. С недавнего времени, особенно в последние годы, возникла настоятельная потребность в создании гербицида избирательного действия, способного уничтожать сорные растения без привнесения фитотоксичности в сельскохозяйственные культуры при нанесении его на листву как сельскохозяйственных культур, так и сорных растений в тех случаях, когда и те, и другие сосуществуют на одном поле. Кроме того, в течение многих лет ведутся исследования и разработки в области создания таких веществ, которые обладали бы высоким гербицидным действием при использовании в малых дозах и, тем самым, позволили бы избежать заг Раскрытие изобретения. 5 29389 Авторами настоящего изобретения были проведены многолетние обширные исследования по созданию гербицидов избирательного действия для культур важного сельскохозяйственного назначения, а также по изучению гербицидных свойств многих соединений с целью поиска веществ, обладающих высокой гербицидной активностью и избирательной способностью. В результате, было установлено, что чрезвычайно высокую гербицидную активность в отношении многих сорных растений при почвенной, листовой или смешанной обработке проявляет, при этом сохраняя высокий уровень безопасности в отношении таких важных сельскохозяйственных культур, как пшеница, кукуруза, хлопок, соя, сахарная свекла, рис и т. д., иминосульфонилмочевины общей формулы (I) или их соли, пригодные для сельскохозяйственного применения: где R3d – С1-С6-алкил, С1-С6-алкенил С1-С6-алкинил, или гетероциклический остаток формулы где где где R3f – С1-С6-алкил или С1-С6-алкенил, или остаток формулы Z – N или СН, R1 и R2 – каждый независимо С1-С4-алкил или ОС1-С4-алкил, Q – представляет собой гетероциклический остаток формулы где где R3g – С1-С6-алкил, С1-С6-алкенил или С1-С6алкинил, R4g – Ме, R5g – С1-С4-алкил или ОС1-С4-алкил. Cоединение, предложенное в соответствии с настоящим изобретением, может быть использовано в качестве гербицида на суходолах при любом способе обработки, например, при почвенной обработке, при обработке листвы или при смешанной обработке. Дозировка соединения, предложенного в соответствии с настоящим изобретением, варьируется в зависимости от места применения, способа применения, времена года, вида сорных растений, против которых используется гербицид, вида сельскохозяйственных культур и т.д. Однако, как правило, доза активного компонента составляет от 0,0001 до 10 кг, преимущественно от 0,005 до 5 кг на гектар. Кроме того, соединение, предложенное в соответствии с настоящим изобретением, может использоваться в сочетании и с другими гербицидами, различными инсектицидами, фунгицидами, регуляторами роста растений, агентами-синергистами и обезвреживателями как в процессе приготовления состава, так и в процессе непосредственного применения, в зависимости от потребности. 3a R – C1-C6-алкил, С1-С6-алкенил, С1-С6-алкинил, каждый из которых необязательно может быть замещен ОС1-С4-алкилом, SС1-С4-алкилом, СОС1-С4-алкилом, СООС1-С4-алкилом, Hal или Ph, R4a – H, R5a – H, Hal или С1-С4-алкил, ------- –означает простую или двойную связь, или гетероциклический остаток формулы где R3e – С1-С4-алкил, или гетероциклический остаток формулы R3b – С1-С6-алкил или С1-С6-алкенил, или гетероциклический остаток формулы где R3c – С1-С6-алкил или С1-С6-алкенил, или гетероциклический остаток формулы 6 29389 Более конкретно, при использовании в сочетании с каким-либо другим гербицидом, можно ожидать сокращения стоимости вследствие уменьшения дозы, или расширения спектра гербицидного действия, или же получения более высокого гербицидного эффекта вследствие синергического эффекта от комбинации гербицидов. В этом случае могут быть использованы несколько известных гербицидов одновременно. К числу гербицидов, которые могут быть использованы в комбинации с соединением, предложенным в соответствии с настоящим изобретением, относятся, например, соединения, описанные в Farm Chemical Handbook (1990). В тех случаях, когда соединение, предложенное в соответствии с настоящим изобретением, надлежит использовать в качестве гербицида, оно, как правило, подвергается смешению с подходящим носителем, например, с твердым носителем – глиной, тальком, бентонитом, диатомовой землей или тонкоизмельченным кремнеземовым порошком, или жидким носителем – водой, спиртом (например, изопропанолом, бутанолом, бензиловым спиртом или фуриловым спиртом), ароматическим углеводородом (например, толуолом или ксиленом), простым эфиром (например, анизолом), кетоном (например, циклогексаноном или изофороном), сложным эфиром (например, бутилацетатом), амидом кислоты (например, Nметилпирролидоном) или галогенизированным углеводородом (например, хлорбензолом). При необходимости, для получения оптимального состава в виде жидкости, концентрата эмульсии, смачивающегося порошка, сыпучего или текучего вещества, дуста или гранулированного материала могут быть добавлены поверхностно-активные вещества, эмульгаторы, наполнители, диспергирующие агенты, антифризы, инфильтраторы, адгезивы, антикоагулянты или стабилизаторы. К числу сорных растений, которые сосуществуют с сельскохозяйственными культурами и которые являются объектами борьбы с помощью соединения, предложенного в соответствии с настоящим изобретением, относятся, например, пасленовые, как, например, Solanum nigrum и Datura stramonium, мальвовые, как, например, Abutilon theophrasti и Side spinosa, вьюнковые, как, например, вид Ipomoea, в частности Ipomoea purpurea, и вид Calystegia, щирицевые, как, например, Amaranthus lividus и Amaranthus viridis, сложноцветные, как, например, Xanthiuni strumariui, Ambrosia artemisiaefolia, Helianthus annuu, Galinsoga ciliat, Cirsium arvense, Senecio vulgaris и Erxgeron annus, крестоцветные, как, например, Rorippa indica, Sinapis arvensis и Capsella Bursapastris, гречишные, как, например, Polygonum Blumei и Polygonum convolvulus, портулаковые, как, например, Portulaca oleracea, лебедовые, как, например, Chenopodium album, Chenopodium ficifolium и Kochia scoparis, гвоздичные, как, например, Stellaria media, норичниковые, как, например, Veronica persica, коммелиновые, как, например, Commelina communis, губоцветные, как, например, Lamium amplexicaule и Lamium purpurium, молочайные, как например, Euphorbia supina и Euphorbia maculata, маренные, как, например, Galium aparine, Galium spurium и Rubia akane, фиалковые, как, например, Viola arvensis, бобовые, как, например, Sesbania exaltata и Cassia obtusifolia, злаковые, как, например, Sorgham bicolor, Panicum dichotomiflorum, Sorghum halepense, Echinochloa crus-galli, Digitaria adscendens, Avena fatua, Eleusine indica, Setaria viridis и Alopecurus aequalis, и осоковые, как, например, Cyperus rotundus и Cyperus esculentus. Кроме того, соединение, предложенное в соответствии с настоящим изобретением, может быть использовано в качестве гербицида на рисовниках при любом способе обработки, например, при обработке орошаемых почв или при обработке листвы. К числу сорных растений, произрастающих на рисовниках, относятся, например, частуховые, как, например, Alisma canaliculatum, Sagittaria trifolia и Sagittaria pygmaea, осоковые, как, например, Cyperus difformis, Cyperus serotinus, Scirpus juncoides и Eleocharis kuroquwai, коричниковые, как, например, Lindemia pyxidaria, потендерные, как, например, Monochoria vaginalis, рдестовые, как, например, Potageton distinctus, дербенниковые, как, например, Rotala indica, и злаковые, как, например, Echinochloa crus-galli. Соединение, предложенное в соответствии с настоящим изобретением, может быть использовано для борьбы с различными сорными растениями не только на сельскохозяйственных землях и садоводческих участках, например, на суходолах, рисовниках или садах, но также и на землях несельскохозяйственного назначения, например, на игровых площадках, не используемых свободных площадях или же на полосах отчуждения по бокам железнодорожных путей. Соединение, предложенное в соответствии с настоящим изобретением, может быть без труда получено путем выбора какой-либо одной из приведенных ниже реакционных схем 1–5 7 29389 Реакционная схема 1 В приведенных выше формулах Q, G и L – как определено выше, а Z – атом галогена. Более конкретно, для получения соединения, предложенного в соответствии с настоящим изобретением, (I : X = 0), амин (2) вводится сначала в реакцию с хлорсульфонилизоцианатом в растворителе, например, в тетрагидрофуране, диме тилоксиэтане, ацетонитриле, пропионитриле, тиметилформамиде, дихлорметане, дихлорэтане, бензоле или толуоле, а затем в реакцию с имином (3) или (4) в присутствии основания, например, триэтиламина, пиридина, гидрида натрия, метоксида натрия, этоксида натрия, гидроксида натрия, гидроксида калия или карбоната калия. Реакционная схема 2 В приведенных выше формулах Q, G, L и Z – как определено выше, а Y – алкильная группа С1-С6 или фенильная группа. Более конкретно, реакция имина (3) или (4) с фенил-N-хлорсульфонилкарбаматом (5 : У = =фенильная группа) или алкил-N- хлорсульфонилкарбаматом (5 : У = низшая алкильная группа) проводится с использованием производного карбамата (5) в количестве от 0,5 до 3,0 моль на моль имина (3) или (4), преимущественно в пределах от 0,9 до 1,2 моль. Температура реакции может быть выбрана произвольно в пределах от –50оС до 100оС, однако предпочтительной является от –20оС до 30оС. Данная реакция может проводиться с использованием различных оснований. Количество используемого основания находится в пределах от 0,5 до 4,0 моль на моль имина (3) или (4). Подходящим для этой цели основанием может быть, например, органическое основание, такое как триэтиламин или пиридин, гидрид металла, например, гидрид натрия, неорганическое основание, например, гидроксид натрия, гидроксид калия или карбонат калия, или алкоксид металла, например, метоксид натрия или этоксид натрия. Подходящим растворителем для этой реакции является растворитель, инертный к данной реакции, например, ароматический углеводород, такой как бензол, толуол или ксилен, галогенизированный углеводород, например, дихлорметан, хлороформ или тетрахлорид углерода, простой эфир, например, этиловый эфир, изопропиловый эфир, диоксан или тетрагидрофуран, нитрил, например, ацетонитрил или пропионитрил, углеводород, например, петролейный эфир или n-гексан, 8 29389 кетон, например, ацетон или метилэтилкетон, сложный эфир, например, этилацетат, или амид, например, диметилформамид, диметилацетамид или гексаметилфосфотриамид. Затем фенил-N-замещенный иминосульфонилкарбамат (6 : X = О, У – фенильная группа) или алкил-N-замещенный иминосульфонилкарбамат (6 : Х = О, У = низшая алкильная группа) и соединение (2) подвергаются нагреву в растворителе, например, в бензоле, толуоле или диоксане, с целью получения соединения (1 : X = O), предложенного в соответствии с настоящим изобретением. Эти растворители могут быть использованы в отдельности или в комбинации в виде смеси. Особенно предпочтительным является использование простого эфира или амида. Реакционная схема 3 производным карбамата (8) в растворителе, например, в ацетоне, ацетонитриле или диоксане, в присутствии неорганического основания, например, карбоната калия, или органического основания, например, триэтиламина или 1,8-диазабицикло(5,4,0)-7- ундецина (ДБУ). В приведенных выше формулах Q, G, L и Y – как определено выше. Более конкретно, для получения соединения (I : X = O), предложенного в соответствии с настоящим изобретением, замещенное производное иминосульфонамида (7) вводится в реакцию с Реакционная схема 4 В приведенных выше формулах Q, G, L, Х и Y – как определено выше. диоксане или тетрагидрофуране, в присутствии основания, например, карбоната калия, триэтилалмина или пиридина, с целью получения соединения (6), которое затем совместно с соединением (2) подвергается нагреву в растворителе, например, в толуоле, бензоле или диоксане, с целью получения соединения (I), предложенного в соответствии с настоящим изобретением. Более конкретно, замещенное производное иминосульфонамида (7) вводится в реакцию с (тио)эфиром карбоновой кислоты или (тио)эфиром хлормуравьиной кислоты в растворителе, например, в ацетоне, метилэтилкетоне, ацетонитриле, 9 29389 Реакционная схема 5 В приведенных выше формулах Q и G – как определено выше. Более конкретно, замещенное производное иминосульфонамида (7) вводится в реакцию с производным изотиоцианата (9) в растворителе, например, в ацетоне, ацетонитриле, диоксане или тетрагидрофуране, в присутствии неорганического основания, например, карбоната калия, или органического основания, например, триэтиламина или ДБУ, с целью получения соединения (I : Х = =S, L = H), предложенного в соответствии с настоящим изобретением. Промежуточные соедине ния, подлежащие использованию в настоящем изобретении, т.е. замещенное производное иминосульфонамида (7), фенил-N-замещенный иминосульфонил(тио)карбамат (6 : У = фенильная группа) и алкил-N-замещенный иминосульфонил(тио)карбамат (6 : У = алкильная группа С1-6), также являются новыми веществами. Замещенное производное иминосульфонамида (7) может быть синтезировано из имина (3) или (4) путем применения способов в соответствии с приведенными ниже реакционными схемами 6 и 7. Реакционная схема 6 основание, например, триэтиламин или пиридин, неорганическое основание, например, гидроксид натрия, гидроксид калия или карбонат калия, или алкоксид металла, например, метоксид натрия или этоксид натрия. Подходящим растворителем для этой реакции является растворитель, инертный к данной реакции, например, ароматический углеводород, такой как бензол, толуол или ксилен, галогенизированный углеводород, например, дихлорметан, хлороформ или тетрахлорид углерода, простой эфир, например, этиловый эфир, изопропиловый эфир, диоксан или тетрагидрофуран, нитрил, например, ацетонитрил или пропионитрил, углеводород, например, петролейный эфир или n-гексан, кетон, например, ацетон или метилэтилкетон, сложный эфир, например, этилацетат, или амид, например, диметилформамид, диметилацетамид или гексаметилфосфотриамид. В приведенных выше формулах Q и Z – как определено выше. В реакционной схема 6 реакция трет-бутанола с хлорсульфонилизоцианатом может проводиться известным способом, например, упомянутым в неподвергнутой экспертизе патентной публикации Японии № 101323/1975. Реакция имина (3) или (4) с трет-бутилсульфамоилхлоридом проводится с использованием трет-бутилсульфамоилхлоридом в количестве от 0,5 до 3,0 моль на моль имина (3) или (4). Предпочтительное количество составляет от 0,9 до 1,2 моль. Температура реакции может быть выбрана произвольно в пределах от –50оС до 100оС. Однако предпочтительная температура находится в пределах от –20оC до 30оС. Данная реакция может проводиться с использованием различных оснований. Количество основания берется из расчета 0,5–4,0 моль на моль имина (3) или (4). Предпочтительно это количество составляет от 0,8 до 2,5 моль. Подходящим основанием может быть, например, гидрид металла, такой как гидрид натрия, органическое Эти растворители могут использоваться как в отдельности, так и в сочетании один с другим. Особенно предпочтительным является использование простого эфира или амида. 10 29389 Реакционная схема 7 В приведенных выше формулах Q – как определено выше. В реакционной схеме 7 удаление трет-бутильной группы осуществляется путем использования трифторуксусной кислоты. Количество трифторуксусной кислоты может быть выбрано произвольно в диапазоне от эквимолярного до избыточного. Трифторуксусная кислота может без особых проблем использоваться в качестве растворителя. Температура реакции может быть выбрана произвольно в диапазоне от –50оС до 80оС. Предпочтительная температура находится в пределах от –20оС до 30оС. В тех случаях, когда в этой реакции используется растворитель, то таким растворителем может быть любой инертный к данной реакции растворитель, например, ароматический углеводород, такой какбензол, толуол или ксилен, галогенизированный углеводород, например, дихлорметан, хлороформ или тетрахлорид углерода, простой эфир, например, этиловый эфир, изопропиловый эфир, диоксан или тетрагидрофуран, нитрил, например, ацетонитрил или пропионитрил, углеводород, например, петролейный эфир или n-гексан, кетон, например, ацетон или метилэтилкетон, сложный эфир, например, этилацетат, или амид, например, диметилформамид, диметилацетамид или гексаметилфосфотриамид. Эти растворители могут быть использованы как по отдельности, так и в комбинации один с другим в виде смеси. В реакционной схеме 2 фенил-N-хлорсульфонилкарбамат (5 : У = фенильная группа) и алкил-N-хлорсульфонилкарбамат (5 : У = низшая алкильная группа) могут быть синтезированы одним из известных способов, например, способом, описанным в Chemische Berichte, vol. 96, p. 56 (1963). Имины (3) и (4), которые подлежат использованию в упомянутой выше реакции в качестве исходных материалов, могут быть синтезированы способами, описанными, например, в патенте США № 4237302, Journal of Chemical Society, p. 307 (1956), Chemical and Pharmaceutical Bulletin, vol. 26, p. 3658 (1978), Journal of Organic Chemistry, vol. 30, p. 4298 (1965), патенте ГДР № 291757, Journal of American Chemical Society, vol. 93, p. 5552 (1971), патенте США № 4054652, патенте Великобритании № 752003, Chemische Berichte, vol. 92, p. 1928 (1959), Journal of Medicinal Chemistry, vol. 6, p. 266 (1963), Chemical Abstracts, vol. 64, 14171e (1966) и патенте Бельгии № 654416. Приведенные ниже в виде примеров реакционные схемы 8, 9 и 10 представляют схемы синтеза 2-имино-3-этокситиазолидингидробромида, 2-имино-3-n-пропокситиазолидингидробромида и 2-имино-3-метокси-4,5-диметилтиазолидингидрохлорида. Реакционная схема 8 11 29389 Реакционная схема 9 Реакционная схема 10 Лучший вариант осуществления изобрете Ниже следует подробное описание синтеза соединений, предложенных в соответствии с нас ния. 12 29389 лено фильтрацией. В условиях пониженного давления хлороформ был отогнан, после чего в результате дистилляции, также в условиях пониженного давления, были получены 6,9 г 2-имино-3-nбутилтиазолидина. Температура кипения: 85–89оС/0,26 Т. Контрольный пример а-3. Получение 2-имино-1,3-диметилимидазол-4ин-гидрохлорида тоящим изобретением, ведущееся со ссылками на контрольные и рабочие примеры. Однако настоящее изобретение ни в коей мере не ограничивается этими конкретными примерами. Контрольный пример а-1. Получение 2-имино-3-метилтиазол-4-ин-гидроиодида 50 г (0,5 моль) 2-аминотиазола были растворены в 125 мл диметилформамида, после чего при комнатной температуре в полученный раствор были добавлены 90 г (0,63 моль) метилиодида. Смесь была подвергнута перемешиванию в течение 48 чаc при комнатной температуре. Затем к реакционной смеси были добавлены 1000 мл этилацетата. Образовавшиеся кристаллы были отфильтрованы, промыты этилацетатом, а затем высушены, в результате чего было получено 105 г 2-имино-3-метилтиазол-4-ин-гидроиодида. Температура плавления: 181–183оС. 2-имино-3-метилтиазол-4-ин-гидроиодид был подвергнут нейтрализации карбонатом калия, в результате чего был получен 2-имино-3-метилтиазол4-ин. Температура кипения: 55–60оС/1 мм рт.ст. Контрольный пример а-2. Получение 2-имино-3-n-бутилтиазолидина В 100 мл N,N-диметилформамида были растворены 16,9 г (150 ммоль) креатинина. Затем в полученный раствор были добавлены 27,6 г (194 ммоль) метилиодида, после чего смесь была подвергнута нагреву до 50оС и перемешиванию при этой температуре в течение 2 час и в течение ночи – при комнатной. К реакционной смеси были добавлены 500 мл этилацетата, после чего путем фильтрации были выделены образовавшиеся кристаллы. Полученные кристаллы были промыты этилацетатом и высушены, в результате чего было получено 26,2 г 2-имино-1,3-диметилимидазолидин-4-он-гидроиодида в виде белых кристаллов. Затем к 150 мл раствора метанола, содержащего 5,17 г (78,4 ммоль) 85%-ного гидроксида калия, были добавлены 20 г (78,4 ммоль) 2-имино1,3-диметилимидазолидин-4-он-гидроиодида, после чего смесь была подвергнута перемешиванию при комнатной температуре в течение 20 мин. Растворитель был отогнан при пониженном давлении. Затем к остатку были добавлены 200 мл хлороформа, после чего фильтрованием было выделено нерастворимое вещество. Полученный фильтрат был высушен над безводным сульфатом магния, а растворитель был отогнан в условиях пониженного давления, в результате чего было получено 9,0 г 2-имино-1,3- диметилимидазолидин-4-она. 800 мг (21,0 ммоль) алюмогидрида лития были размешаны в 20 мл сухого тетрагидрофурана, куда затем было добавлено 200 мл раствора сухого тетрагидрофурана, содержащего 1,5 г (11,8 ммоль) 2-имино-1,3-диметилимидазолидин-4-она, что было сделано при комнатной температуре. Сразу же после этого при этой же температуре смесь была подвергнута перемешиванию. Затем к реакционной смеси с большой осторожностью было добавлено 10 мл этилацетата и 5 мл воды, а нерастворимое вещество было отфильтровано. При помощи концентрированной хлорводородной кислоты фильтрат был скорректирован до рН 3, после чего в условиях пониженного давления был отогнан растворитель. Полученные кристаллы были промыты растворяющей смесью, состоящей из этилового эфира и этилового спирта, в результате чего было получено 1,2 г 2-имино-1,3-диметилимидазол-4-ин-гидрохлорида. Температура плавления: 168–171оС. Структура, а также физические свойства или характеристики соединений, полученных способа 8,2 г (80 ммоль) 2-амино-2-тиазолидина были растворены в 25 мл диметилформамида, после чего при комнатной температуре в полученный раствор были добавлены 18,4 г (100 ммоль) n-бутилиодида. Реакционная смесь была подвергнута нагреву с последующим перемешиванием в течение 10 час при 60оС, после чего оставлена для охлаждения до комнатной температуры. Затем реакционная смесь была добавлена к 300 мл этилацетата, после чего подвергнута перемешиванию в течение 10 мин при комнатной температуре. Образовавшееся маслянистое вещество было выделено путем декантации из раствора этилацетата, причем эта операция была произведена дважды. Затем этилацетат, содержащийся в указанном маслянистом веществе, был подвергнут отгонке при пониженном давлении, в результате чего был получен 2-имино-3-n-бутилтиазолидингидроиодид, служащий в качестве полуфабриката. После этого 2-имино-3-n-бутилтиазолидингидроиодид совместно с 5,28 г (80 ммоль) 85%-ного гидроксида калия был подвергнут перемешиванию в 300 мл метанола в течение 1 час при комнатной температуре. Затем метанол был отогнан в условиях пониженного давления. После этого к остатку было добавлено 200 мл хлороформа, а осажденное нерастворимое вещество было уда 13 29389 ми, описанными в контрольных примерах а-1 – а3, представлены в таблицах 13а-1, 13а-2 и 13а-3. Контрольный пример b-1. Получение 2-имино-3-n-пропилтиадиазол-4ин-гидроиодида ния под льдом при температуре, не превышающей 10оС, по каплям было добавлено 26,7 г (182 ммоль) этил-N-n-пропоксикарбамата. После повышения температуры до комнатной смесь была подвергнута перемешиванию при этой температуре в течение 20 мин, а затем повторному охлаждению под льдом. Затем в смесь за один раз было добавлено 121,4 г (646 ммоль) 1,2-дибромэтана. Температура была постепенно повышена, после чего смесь была подвергнута дефлегмации в условиях нагрева в течение 2 часов. Затем смесь была оставлена для охлаждения до комнатной температуры, после чего в условиях пониженного давления частично был отогнан растворитель. Остаток был слит в 100 мл ледяной воды и подвергнут тройному экстрагированию 100 мл хлороформа. Слой хлороформа был промыт насыщенным водным раствором хлорида натрия и затем просушен над безводным сульфатом натрия. Затем в условиях пониженного давления был отогнан растворитель, после чего в результате дистилляции в условиях пониженного давления было получено 42,0 г этил-N-(2-бромэтил)- N-n-пропоксикарбамата. Температура кипения: 97оС/0,4 мм рт.ст. Смесь, содержащая 41,7 г (164 ммоль) этил-N(2-бромэтил)-N-n-пропоксикарбамата, 16,2 г (213 ммоль) тиомочевины и 200 мл этилового спирта, была подвергнута дефлегмации в условиях нагрева в течение 5 час. Затем смесь была оставлена для охлаждения, после чего в условиях пониженного давления был отогнан растворитель. К остатку было добавлено 300 мл хлороформа, а полученная смесь была подвергнута перемешиванию при комнатной температуре в течение 10 мин. После удаления нерастворимого вещества фильтрованием хлороформ был отогнан в условиях пониженного давления. С целью достижения кристаллизации к остатку были добавлены этиловый эфир и небольшое количество воды. Затем в результате фильтрования было получено 50 г гидробромида S-[2-(N-этоксикарбонил-N-n-пропокси)аминоэтил]изотиомочевины. Температура плавления: 74–76оС. К 30 мл 30%-ного раствора бромистого водорода и уксусной кислоты были добавлены 5,0 г (15,2 ммоль) гидробромида S-[2-(N-этоксикарбонил-N-n-пропокси)аминоэтил]изотиомочевины и 0,27 г (15,0 ммоль) воды, а полученная смесь была подвергнута нагреву и перемешиванию при 55оС в течение 4 час. Смесь была оставлена для охлаждения, после чего в условиях пониженного давления была отогнана уксусная кислота. С целью достижения кристаллизации к остатку были добавлены этиловый эфир и небольшое количество этилового спирта. Затем в результате фильтрования было получено 3,8 г гидробромида S-[2-(N-nпропокси)аминоэтил]изотиомочевины. Температура плавления: 112–113оС. К 60 мл этилового спирта было добавлено 3,8 г (14,7 ммоль) гидробромида S-[2-(N-n-пропокси)аминоэтил]изотиомочевины, после чего полученная смесь была подвергнута дефлегмации в условиях нагрева в течение 3 час. Смесь была оставлена для охлаждения, после чего в условиях пониженного давления был отогнан этиловый спирт. С целью достижения кристаллизации к остатку были добавлены этиловый эфир и неболь В 40 мл диметилформамида были растворены 8,1 г (80 ммоль) 2-аминотиадиазола, куда затем были добавлены при комнатной температуре 17,0 г (100 ммоль) n-пропилиодида. Смесь была подвергнута нагреву до 60оС, выдерживанию при этой температуре в течение 30 мин, после чего была оставлена остывать с последующим перемешиванием при комнатной температуре в течение 24 час. Затем к реакционной смеси было добавлено 500 мл этилацетата. Образовавшиеся кристаллы были выделены фильтрованием, промыты этилацетатом и затем высушены, в результате чего было получено 13,1 г требуемого 2-имино-3-n– пропилтиадиазол-4-ин-гидрохлорида. Температура плавления: 121–124оС. Структура и значения, характеризующие физические свойства соединений, полученных способом, описанным в приведенном выше контрольном примере b-1, представлены в таблице 13b. Контрольный пример с-1. Получение 2-имино-3-n-пропокситиазолидингидробромида В 100 мл воды были растворены 22 г (197 ммоль) n-пропоксиамингидрохлорида, после чего к полученному раствору было добавлено 200 мл этилендихлорида. Затем в условиях охлаждения несколькими порциями были добавлены 27,2 г (197 ммоль) карбоната калия, после чего к полученной смеси было добавлено по каплям 21,3 г (196 ммоль) этилового хлорформиата, что осуществлялось при температуре, не превышающей 10оС. После повышения температуры до комнатной смесь была подвергнута перемешиванию при этой температуре в течение 4 час. Сначала был отделен слой этилендихлорида, после чего водный слой был подвергнут двойному экстрагированию 100 мл хлороформа. После этого слой этилендихлорида и слой хлороформа были смешаны и промыты насыщенным водным раствором хлорида натрия, а затем полученный продукт был высушен над безводным сульфатом натрия. Затем в условиях пониженного давления был отогнан растворитель. В результате дистилляции в условиях пониженного давления было получено 27 г этил-N-n-пропоксикарбамата. Температура кипения: 88оС/2,5 мм рт.ст. В 200 мл сухого тетрагидрофурана было размешано 8,73 г 60%–ного гидрида натрия, после чего к полученной суспензии в условиях охлажде 14 29389 Температура плавления: 237–238оС. Контрольный пример d-2. Получение 1-метил-3-n-пропил-2-иминоимидазолидин-4-он-гидроиодида шое количество этилового спирта. После этого в результате фильтрования было получено 3,2 г 2имино-3-n-пропокситиазолидингидробромида, представляющего собой кристаллическое вещество. Температура плавления: 117–119оС. Контрольный пример с-2. Получение 2-имино-3-метокси-4-метилтиазол4-ин-гидрохлорида В 12 мл воды было растворено 5,67 г (70 ммоль) тиоцианата натрия, после чего раствор был подвергнут нагреву до 80оС. Затем в течение одного часа к раствору по каплям было добавлено 5,55 г (60 ммоль) хлорацетона, после чего смесь была подвергнута перемешиванию в течение 3 час при указанной температуре. Затем смесь была подвергнута охлаждению до комнатной температуры, после чего к ней было добавлено 60 мл этилового эфира. Затем был отделен и удален водяной слой. Слой этилового эфира был дважды промыт 10 мл воды, а затем в условиях пониженного давления был отогнан растворитель, в результате чего было получено 6,0 г тиоцианоацетона. В 10 мл этилового спирта были растворены 2,30 г (20 ммоль) тиоцианоацетона и 1,67 г (20 ммоль) метоксиамингидрохлорида, после чего раствор был подвергнут дефлегмации в условиях нагрева в течение 5 час. Затем с целью получения остатка было добавлено 50 мл этилацетата. В результате фильтрования было получено 3,34 г кристаллического 2-имино-3-метокси-4-метилтиазол-4-ин-гидрохлорида. Температура плавления: 145–155оС (разлагается). Структура и физические свойства соединений, полученных способами, описанными в контрольных примерах с-1 и с-2, представлены в таблицах 13с-1, 13с-2 и 13с-3. Контрольный пример d-1. Получение 3-метил-2-иминотиазолидин-4-онгидрохлорида 9,04 г (80 ммоль) креатинина были размешаны в 50 мл диметилформамида, после чего к полученной суспензии было добавлено 17,0 г (100 ммоль) n-пропилиодида. Затем смесь была подвергнута нагреву и перемешиванию при 70–80оС до состояния полного растворения креатинина. Смесь была оставлена для охлаждения, после чего к ней были добавлены 500 мл этилацетата. В результате фильтрования были получены 10,6 г кристаллов 1-метил-3-n-пропил-2-иминоимидазолидин-4-он-гидроиодида. Температура плавления: 159–161оС. С целью получения 1-метил-3-n-пропил-2иминоимидазолидин-4-она 1-метил-3-n-пропил-2иминоимидазолидин-4-он-гидроиодид был подвергнут нейтрализации в соответствии со следующим образом. К 25 мл метилового спирта, содержащего 0,66 г (10 ммоль) 85%-ного гидроксида калия, было добавлено 2,83 г (10 ммоль) 1-метил-3-n-пропил-2-иминоимидазолидин-4-он-гидроиодида, после чего смесь была подвергнута перемешиванию при комнатной температуре в течение одного часа. В условиях пониженного давления метиловый спирт был отогнан, а к остатку был добавлен хлороформ. Осажденные кристаллы были выделены фильтрацией. В условиях пониженного давления хлороформ был отогнан, в результате чего было получено 1,16 г 1-метил-3-n-пропил-2-иминоимидазолидин-4-она в виде маслянистого вещества. Структура и значения, характеризующие физические свойства соединений, полученных способами, описанными в контрольных примерах d-1 и d-2, представлены в таблице 13d. Контрольный пример е-1. Получение 3,6-дигидро-3-n-пропил-2Н-1,3тиазин-2-имина В 150 мл диметилформамида было размешано 11,6 г (0,1 моль) псевдотиогидантоина, после чего в полученную суспензию было добавлено 17 г (0,12 моль) метилиодида. Затем смесь была подвергнута перемешиванию при 60оС в течение одного часа. После этого реакционная смесь была оставлена для охлаждения, а затем она была добавлена к 1000 мл этилацетата. В результате фильтрования было получено 15 г 3-метил-2-иминотиазолидин-4-он-гидрохлорида в виде кристаллов светло-желтого цвета. В 4 мл диметилформамида было растворено 1,3 г (11,4 ммоль) 2-амино-6Н-1,3-тиазина, после чего к раствору было добавлено 2,4 г (14,1 ммоль) n-пропилиодида. Смесь была подвергнута нагреву до 50оС, выдерживанию при этой температуре в течение одного часа и перемешиванию при комнатной температуре в течение ночи. К реакционной смеси было добавлено 100 мл этилацетата, после чего смесь была перемешана и оставлена для отстаивания. Затем методом декантации слой этилацетата был отделен и удален. После этого остаточное маслянистое вещество было растворено в 50 мл метилового спирта, после чего 15 29389 к этому раствору было добавлено 30 мл раствора метилового спирта, содержащего 0,75 г (11,4 ммоль) 85%-ного гидроксида калия, что было сделано при комнатной температуре. Затем при этой же температуре смесь была подвергнута перемешиванию в течение одного часа, после чего в условиях пониженного давления метиловый спирт был отогнан. К остатку было добавлено 60 мл хлороформа, а нерастворимая фракция была удалена фильтрованием. Затем в условиях пониженного давления фильтрат был подвергнут концентрированию. Остаточное маслянистое вещество было подвергнуто очистке методом колоночной хроматографии на глиноземе (элюент: хлороформ), в результате чего было получено 0,4 г маслянистого вещества, представляющего собой 3,6-дигидро-3n-пропил-2Н-1,3-тиазин-2-имин. Контрольный пример 2-е. Получение 3,4,5,6-тетрагидро-3-метил-2Н1,3-тиазин-2-имина совместно с 8,4 г (128 ммоль) 85%-ного гидроксида калия в 400 мл метилового спирта при комнатной температуре в течение одного часа. Метиловый спирт был отогнан в условиях пониженного давления, после чего было добавлено 500 мл хлороформа. Осажденные нерастворимые вещества были удалены фильтрованием. Затем в условиях пониженного давления был отогнан хлороформ, в результате чего было получено 10,5 г 2-амино-2оксазолина. Затем 10,5 г 2-амино-2-оксазолина были растворены в 40 мл диметилформамиде, после чего к этому раствору при комнатной температуре было добавлено 22 г (155 ммоль) метилиодида. Затем смесь была подвергнута перемешиванию при комнатной температуре в течение 48 час. После этого к реакционной смеси было добавлено 1000 мл этилацетата. Образовавшиеся кристаллы были выделены фильтрованием, промыты этилацетатом и высушены, в результате чего было получено 23 г 2-имино-3-метилоксазолидингидроиодида. Температура плавления: 165–169оС. Структура и характеристики соединений, полученных способом, описанным в контрольном примере f-1, представлены в таблице 13f. Контрольный пример g-1. Получение гидроиодида N,N-диметил-S-метилизотиомочевины В 20 мл изопропилового спирта было растворено 3,13 г (27 ммоль) 2-амино-4,5-дигидро-6Н1,3-тиазина, после чего к раствору было добавлено 4,26 г (30 ммоль) метилиодида. Смесь была подвергнута дефлегмации в условиях нагрева в течение одного часа, а затем оставлена для охлаждения. В условиях пониженного давления растворитель быть отогнан. Затем остаточное маслянистое вещество было растворено в 200 мл метилового спирта, после чего к этому раствору при комнатной температуре было добавлено 70 мл раствора метилового спирта, содержащего 1,68 г (25,5 ммоль) 85%-ного гидроксида калия. При этой же температуре смесь была подвергнута перемешиванию в течение 5 мин, а затем в условиях пониженного давления был отогнан метиловый спирт. К остатку было добавлено 300 мл хлороформа, после чего последовало просушивание над безводным сульфатом натрия. Неорганические фракции были удалены фильтрованием, а хлоpофоpм был отогнан в условиях пониженного давления, в результате чего было получено 3 г маслянистого вещества светло-красного цвета, представляющего собой 3,4,5,6- тетрагидро-3-метил-2Н-1,3-триазин-2-имин. Структура и характеристики соединений, полученных способами, описанными в контрольных примерах е-1 и е-2, представлены в таблицах 13е-1 и 13е-2. Контрольный пример f-1. Получение 2-имино-3-метилоксазолидингидроиодида 35 г (0,5 моль) N,N-диметилцианамида были растворены в смешанном растворе 70 мл пиридина и 70 мл триэтиламина, после чего раствор был подвергнут нагреву до 60оС. В течение 30 мин в раствор вводился газообразный сероводород. Затем реакционная смесь была оставлена для охлаждения до комнатной температуры, после чего в нее было добавлено 300 мл этилового эфира. Осажденные кристаллы были отделены фильтрованием, а затем промыты, в результате чего было получено 48 г светло-коричневого кристаллического вещества, представляющего собой N,N-диметилтиомочевину. Температура плавления: 163–164оС. 10,4 г (0,1 моль) N,N-диметилтиомочевины были размешаны в 80 мл этилового спирта, после чего в полученную суспензию было добавлено 17 г (0,12 моль) метилиодида. Смесь была подвергнута дефлегмации в условиях нагрева в течение 30 мин. Затем реакционная смесь была оставлена для охлаждения до комнатной температуры, после чего в условиях пониженного давления был отогнан растворитель. Полученные кристаллы были промыты этиловым эфиром, отделены фильтрованием и высушены, в результате чего было получено 20 г желтого кристаллического вещества, представляющего собой гидроиодид N,N-диметилS-метилизотиомочевины. Температура плавления: 84–85оС. Контрольный пример g-2. Получение гидроиодида N-этил-N-метил-Sметилизотиомочевины 15 г (122 ммоль) 2-амино-2-оксазолингидрохлорида были подвергнуты перемешиванию 16 29389 центрированной хлористоводородной кислоты. Затем температура реакции была повышена до 80оС, и при этой температуре смесь была подвергнута дальнейшему перемешиванию в течение 5 час. Затем смесь была охлаждена до 0оС, после чего для нейтрализации реакционной смеси (рН=6–7) к ней постепенно был добавлен карбонат аммония. После добавления 10 мл воды смесь была подвергнута троекратному экстрагированию 50 мл этилацетата. Затем слой этилацетата был промыт водой и высушен над безводным сульфатом магния. После этого в условиях пониженного давления растворитель был отогнан, в результате чего было получено 2,0 г светло-желтого кристаллического вещества, представляющего собой N-метокси-N-метилтиомочевину. Температура плавления: 30–32оС. В 5 мл N,N-диметилформамида было растворено 1,76 г (14,7 ммоль) N-метокси-N-метилтиомочевины. Затем при комнатной температуре к полученному раствору было добавлено 2,09 г (14,7 ммоль) метилиодида, после чего при этой же температуре смесь была подвергнута перемешиванию в течение 15 часов. После этого к смеси было добавлено 500 мл этилацетата, а осажденные кристаллы были отделены фильтрованием и промыты этилацетатом, в результате чего было получено 2,7 г светло-желтого кристаллического вещества, представляющего собой гидроиодид Nметокси-N-метил-S- метилизотиомочевины. Температура плавления: 122–124оС. Структура и значения, характеризующие физические свойства, а также характеристики соединений, полученных способами, описанными в контрольных примерах g-1 – g-3, представлены в таблице 13g. Пример а-1. Получение 1-(3-метил-4-тиазолин-2-сульфонилимино)-3-(4,6- диметоксипиримидин-2-ил)мочевины 7,08 г (120 ммоль) N-этил-N-метиламина были растворены в 80 мл безводного ацетона, после чего полученный раствор был подвергнут охлаждению до 0оС. Затем к нему по каплям было добавлено 13,1 г (100 ммоль) этоксикарбонилизотиоцианата. Затем температура реакции была поднята до комнатной, и смесь была подвергнута при этой температуре перемешиванию в течение 2 час. В условиях пониженного давления растворитель был отогнан. К полученному остатку было добавлено 80 мл концентрированной хлористоводородной кислоты. Температура реакции была повышена до 80оС, и при этой температуре смесь была подвергнута перемешиванию в течение 5 час. Затем она была охлаждена до 0оС, после чего для нейтрализации реакционной смеси (рН=6–7) в нее постепенно добавляли карбонат аммония. После добавления небольшого количества воды смесь была подвергнута тройному экстрагированию 100 мл этилацетата. Слой этилацетата был промыт водой и просушен над безводным сульфатом натрия. Затем в условиях пониженного давления растворитель был отогнан, а полученные кристаллы промыты растворяющей смесью этанола и n-гексана, в результате чего было получено 5,8 г белого кристаллического вещества, представляющего собой N-этил-N- метилтиомочевину. Температура плавления: 124–125оС. В 10 мл N,N-диметилформамида было растворено 5,8 г (49 ммоль) N- этил-N-метилтиомочевины. Затем при комнатной температуре к полученному раствору было добавлено 8,8 г (62 ммоль) метилиодида, после чего смесь была подвергнута перемешиванию при комнатной температуре в течение 15 час. Затем к смеси было добавлено 500 мл этилацетата, осажденные кристаллы были отделены фильтрованием и промыты этилацетатом, в результате чего было получено 3,1 г кристаллического вещества светло-желтого цвета, представляющего собой гидроиодид N-этил-N-метил-S-метилизотиомочевины. Температура плавления: 94–97оС. Контрольный пример g-3. Получение гидроиодида N-метокси-N-метилS-метилизотиомочевины В 20 мл сухого тетрагидрофурана было растворено 1,55 г (10 ммоль) 2-амино-4,6-диметоксипиримидина, после чего при температуре в пределах от –10оС до –5оС к полученному раствору по каплям было добавлено 1,42 г (10 ммоль) хлорсульфонилизоцианата. После повышения температуры реакции до 0оС смесь была подвергнута перемешиванию в течение 5 мин. Затем реакционная смесь вновь была подвергнута охлаждению до –30оС, после чего к ней по каплям было добавлено 1,14 г (10 ммоль) 2-имино-3-метилтиазол-4ина и 1,11 г (11 ммоль) триэтиламина, растворенного в 10 мл сухого тетрагидрофурана. Температура реакции была повышена до комнатной, и смесь была подвергнута дальнейшему перемешиванию при этой температуре в течение одного часа. Затем в условиях пониженного давления был отогнан растворитель. После этого для получения остатка была добавлена вода. Осажденные кристаллы были отделены с помощью ацетонитрила, в В 20 мл дихлорметана было растворено 1,83 г (30 ммоль) N-метокси-N-метиламина, после чего полученный раствор был охлажден до 0оС. Затем к раствору по каплям было добавлено 3,93 г (30 ммоль) этоксикарбонилизотиоцианата. Температура реакции была повышена до комнатной, и при этой температуре смесь была подвергнута перемешиванию в течение 15 часов. Растворитель был отогнан в условиях пониженного давления, а к полученному остатку было добавлено 20 мл кон 17 29389 результате чего было получено 1,5 г требуемой 1(3-метил-4-тиазолин-2-сульфонилимино)-3-(4,6- диметоксипиримидин-2-ил)мочевины. Температура плавления: 214–215оС. Пример а-2. Получение 1-(3-n-пропил-4-тиазолин-2-сульфонилимино)-3-(4,6-диметоксипиримидин-2-ил)мочевины пература реакции была повышена до комнатной, и при этой температуре смесь была подвергнута перемешиванию в течение одного часа. Затем в условиях пониженного давления был отогнан растворитель. К остатку была добавлена вода, и смесь была подвергнута троекратному экстрагированию хлороформом. Слой хлороформа был последовательно промыт водой и насыщенным водным раствором хлорида натрия и просушен над безводным сульфатом натрия. После этого в условиях пониженного давления был отогнан растворитель. Полученные кристаллы были промыты этиловым эфиром, в результате чего было получено 2,8 г требуемой 1-(3-n-бутилтиазолидин-2-сульфонилимино)-3-(4,6-диметоксипиримидин-2-ил)мочевины. Температура плавления: 139–140оС. Пример а-4. Получение 1-(1,3-диметил-4-имидазолин-2сульфонилимино)-3-(4,6- диметоксипиримидин-2ил)мочевины В 30 мл сухого тетрагидрофурана было растворено 1,55 г (10 ммоль) 2-амино-4,6-диметоксипиримидина, после чего к полученному раствору при температуре, не превышающей –20оС, по каплям было добавлено 1,42 г (10 ммоль) хлорсульфонилизоцианата. Температура реакции была повышена до 0оС, после чего смесь вновь была подвергнута охлаждению до температуры, не превышающей –20оС. Затем к смеси были добавлены 2,70 г (10 ммоль) 2-имино-3-n- пропилтиазол-4-ингидроиодида и 2,22 г (22 ммоль) триэтиламина, растворенного в 30 мл сухого тетрагидрофурана. Температура реакции была затем повышена до комнатной, при которой смесь была подвергнута дальнейшему перемешиванию в течение одного часа. Затем в условиях пониженного давления был отогнан растворитель. После этого к остатку была добавлена вода, и смесь была подвергнута троекратному экстрагированию хлороформом. Слой хлороформа был последовательно промыт водой и насыщенным водным раствором хлорида натрия и просушен над безводным сульфатом натрия. После этого в условиях пониженного давления был отогнан растворитель. Полученные кристаллы были промыты этиловым эфиром, в результате чего было получено 3 г требуемой 1-(3-nпропил-4-тиазолин-2-сульфонилимино)-3-(4,6-диметоксипиримидин-2-ил)мочевины. Температура плавления: 166–167оС. Пример а-3. Получение 1-(3-n-бутилтиазолидин-2-сульфонилимино)-3-(4,6-диметоксипиримидин-2-ил)мочевины В 30 мл сухого тетрагидрофурана было растворено 540 мг (3,46 ммоль) 2-амино-4,6-диметоксипиримидина, после чего к полученному раствору при температуре в пределах от –20оС до –15оС по каплям было добавлено 490 мг (3,46 ммоль) хлорсульфонилизоцианата. После того, как температура реакции повысилась до 0оС, смесь вновь была подвергнута охлаждению до –20оС. Затем к ней была добавлена смесь, содержащая 600 мг (4,07 ммоль) 2-имино-1,3-диметилимидазол-4-ин-гидрохлорида, 820 мг (8,13 ммоль) триэтиламина и 30 мл сухого тетрагидрофурана. Температура реакции была повышена до комнатной, и при этой температуре смесь была подвергнута дальнейшему перемешиванию в течение 3 часов. Затем в условиях пониженного давления был отогнан растворитель. После этого к полученному остатку было добавлено 60 мл воды, и путем фильтрования были отделены кристаллы. Полученные кристаллы были промыты растворяющей смесью этилового эфира, ацетонитрила и ацетона, в результате чего было получено 200 мг требуемой 1-(1,3-диметил4-имидазолин-2-сульфонилимино)-3-(4,6- диметоксипиримидин-2-ил)мочевины. Температура плавления: 201–203оС. Структура и значения, характеризующие физические свойства соединений, полученных способами, описанными в примерах а-1 – а-4, представлены в таблицах 14а-1, 14а-2 и 14а-3. Пример b-1. Получение 1-(3-n-пропил-4-тиадиазолин-2сульфонилимино)-3-(4,6-диметоксипиримидин-2ил)мочевины В 40 мл сухого тетрагидрофурана было растворено 1,55 г (10 ммоль) 2-амино-4,6-диметоксипиримидина, после чего к полученному раствору при –40оС по каплям было добавлено 1,42 г (10 ммоль) хлорсульфонилизоцианата. После повышения температуры реакции до 0оС реакционная смесь вновь была подвергнута охлаждению до –60оС. Затем к ней было добавлено 1,90 г (12 ммоль) 2-амино-3-n-бутилтиазолидина, смешанного с 40 мл сухого тетрагидрофурана, содержащего 1,33 г (13 ммоль) триэтиламина. После этого тем В 40 мл сухого тетрагидрофурана было растворено 1,55 г (10 ммоль) 2-амино-4,6-диметокси 18 29389 сульфонилимино)-3-(4,6-диметоксипиримидин-2ил)мочевины. Температура плавления: 175–176оС. Пример с-2. Получение 1-(3-n-пропокситиазолидин-2-сульфонилимино)-3-(4,6-диметоксипиримидин-2-ил)мочевины пиримидина, после чего к полученному раствору при –40оС по каплям было добавлено 1,42 г (10 ммоль) хлорсульфонилизоцианата. После повышения температуры реакции до 0оС смесь вновь была подвергнута охлаждению до –40оС. Затем к ней было добавлено 2,58 г (9,5 ммоль) 2-имино-3n- пропилтиадиазол-4-ин-гидроиодида, размешанного в 40 мл сухого тетрагидрофурана, содержащего 2,22 г (22 ммоль) триэтиламина. Температура реакции была повышена до комнатной, и при этой температуре смесь была подвергнута перемешиванию в течение одного часа. Затем в условиях пониженного давления был отогнан растворитель, а к полученному остатку была добавлена вода. Смесь была затем подвергнута троекратному экстрагированию хлороформом. Слой хлороформа был последовательно промыт водой и насыщенным водным раствором хлорида натрия и просушен над безводным сульфатом натрия. Затем в условиях пониженного давления растворитель был отогнан. Полученные кристаллы были промыты ацетонитрилом, в результате чего было получено 2,25 г требуемой 1-(3-n-пропил-4-тиадиазолин-2-сульфонилимино)-3-(4,6- диметоксипиримидин-2-ил)мочевины. Температура плавления: 189–190оС. Структура и значения, характеризующие физические свойства соединений, полученных способом, описанным в примере b-1, представлены в таблице 14b. Пример с-1. Получение 1-(3-этокситиазолидин-2-сульфонилимино)-3-(4,6- диметоксипиримидин-2-ил)мочевины В 30 мл сухого тетрагидрофурана было растворено 0,62 г (4,0 ммоль) 2-амино-4,6-диметоксипиримидина, после чего при температуре –50оС к полученному раствору по каплям было добавлено 0,57 г (4,0 ммоль) хлорсульфонилизоцианата. Температура реакции была повышена до комнатной, после чего реакционная смесь была подвергнута повторному охлаждению до –50оС. Затем к ней были добавлены 1,2 г (5,0 ммоль) 2-имино-3n-пропокситиазолидингидробромида, смешанного с 20 мл сухого тетрагидрофурана, содержащего 1,01 г (10,0 ммоль) триэтиламина. Температура реакции была затем постепенно повышена до комнатной,и и смесь была подвергнута перемешиванию при этой температуре в течение 10 минут. Затем в условиях пониженного давления был отогнан растворитель, а к остатку была добавлена вода. Смесь была подвергнута троекратному экстрагированию 50 мл хлороформа. Слой хлороформа был промыт насыщенным водным раствором хлорида натрия, после чего высушен над безводным сульфатом натрия. Затем в условиях пониженного давления был отогнан растворитель. К полученному остатку с целью достижения состояния кристаллизации были добавлены этиловый эфир и небольшое количество ацетонитрила. Кристаллы были отделены фильтрованием, в результате чего было получено 0,65 г требуемой 1-(3-nпропокситиазолидин-2-сульфонилимино)-3-(4,6-диметоксипиримидин-2-ил)мочевины. Температура плавления: 173–175оС. Пример с-3. Получение 1-(3-n-пропокситиазолидин-2-сульфонилимино)-3-(4,6-диметокситриазин-2-ил)мочевины В 20 мл сухого тетрагидрофурана было растворено 1,55 г (10 ммоль) 2-амино-4,6-диметоксипиримидина, после чего при температуре в пределах от –10оС до –5оС по каплям к полученному раствору было добавлено 1,42 г (10 ммоль) хлорсульфонилизоцианата. Температура реакции была повышена до 0оС, после чего смесь была подвергнута перемешиванию в течение 5 мин. Затем реакционная смесь была охлаждена до –30оС, и к ней постепенно было добавлено 2,72 г (12 ммоль) 2-имино-3-этокситиазолидингидробромида и 2,43 г (24 ммоль) триэтиламина, смешанного с 10 мл сухого тетрагидрофурана. Температура реакции была повышена до комнатной, и при этой температуре смесь была подвергнута дополнительному перемешиванию в течение 20 мин. Затем в условиях пониженного давления был отогнан растворитель, а к полученному остатку была добавлена вода. Осажденные кристаллы были подвергнуты троекратному экстpагиpованию 100 мл хлороформа, экстракт был промыт 100 мл воды и просушен над безводным сульфатом натрия. Затем в условиях пониженного давления растворитель был отогнан, а полученные кристаллы промыты этиловым эфиром и ацетонитрилом, в результате чего было получено 2,1 г требуемой 1-(3-этокситиазолидин-2 В 40 мл сухого тетрагидрофурана было растворено 3,76 г (40,0 ммоль) фенола, после чего к полученному раствору при температуре –50оС по каплям было добавлено 5,66 г (40,0 ммоль) хлорсульфонилизоцианата. Затем температура реакции была повышена до комнатной, после чего смесь вновь была подвергнута охлаждению до –50оС. После этого к ней были добавлены 10,6 г (44 ммоль) 2-имино-3-n-пропокситиазолидингидробромида, смешанного с 20 мл безводного ацетонитрила, содержащего 8,08 г (80 ммоль) триэти 19 29389 ламина. Затем температура реакции была постепенно повышена до комнатной, и при этой температуре смесь была подвергнута перемешиванию в течение 10 мин. В условиях пониженного давления растворитель был отогнан, а к полученному остатку была добавлена вода. Смесь была подвергнута троекратному экстрагированию 70 мл хлороформа. Затем слой хлороформа был промыт насыщенным водным раствором хлорида натрия и просушен над безводным сульфатом натрия. После этого в условиях пониженного давления был отогнан растворитель. К полученному остатку с целью достижения состояния кристаллизации были добавлены этиловый эфир и небольшое количество ацетонитрила. Полученные кристаллы были отделены фильтрованием, в результате чего было получено 14 г фенил-N- (3-n-пропокситиазолидин-2-сульфонилимино)карбамата. Затем в 30 мл безводного диоксана было растворено 0,72 г (2,0 ммоль) полученного карбамата, после чего к раствору было добавлено 0,23 г (1,5 ммоль) 2амино-4,6-диметокситриазина. После этого смесь была подвергнута дефлегмации в условиях нагрева в течение 4 час. Затем в условиях пониженного давления был отогнан растворитель, а к остатку с целью достижения состояния кристаллизации были добавлены этиловый эфир и небольшое количество ацетонитрила. После этого кристаллы были отделены фильтрованием, в результате чего было получено 0,3 г требуемой 1-(3-n-пропокситиазолидин-2-сульфонилимино)-3-(4,6-диметокситриазин-2-ил)мочевины. Температура плавления: 166–167оС. Пример с-4. Получение 1-[3-(3-хлораллилокси)тиазолидин-2-сульфонилимино]-3-(4-метил-6-метокситризин-2-ил)мочевины но 1,2 г требуемой 1-[3-(хлораллилокси)тиазолидин-2-сульфонилимино]-3-(4-метил-6-метокситриазин-2-ил)мочевины. Температура плавления: 145–147оС. Пример с-5. Получение 1-(3-метокси-4-метил-4-тиазолин2-сульфонилимино)-3-(4,6-диметоксипиримидин-2ил)мочевины В 10 мл сухого тетрагидрофурана было растворено 0,78 г (5 ммоль) 2-амино-4,6-диметоксипиримидина, после чего к полученному раствору при температуре в пределах от –20оС до -15оС по каплям было добавлено 0,71 г (5 ммоль) хлорсульфонилизоцианата. Затем температура реакции была повышена до 0оС, и смесь была подвергнута перемешиванию в течение 5 мин. После этого реакционная смесь снова была охлаждена до температуры –20оС, и к ней были добавлены 0,90 г (5 ммоль)2-имино-3-метокси-4-метилтиазол-4-ин-гидрохлорида и 1,11 г (11 ммоль) триэтиламина, смешанного с 10 мл сухого тетрагидрофурана. Затем температура реакции была повышена до комнатной, и смесь при этой температуре была подвергнута перемешиванию в течение 20 мин. Растворитель был отогнан в условиях пониженного давления, а к полученному остатку была добавлена вода. Осажденные кристаллы были подвергнуты троекратному экстрагированию 50 мл хлороформа. Затем экстрагирующий раствор был подвергнут одноразовой промывке 50 мл воды и просушен над безводным сульфатом натрия. После этого в условиях пониженного давления был отогнан растворитель. Полученные кристаллы были промыты этиловым эфиром и ацетонитрилом, в результате чего было получено 1,02 г требуемой 1-(3-метокси-4-метил-4-тиазолидин-2-сульфонилимино)-3-(4,6-диметоксипиримидин-2-ил)мочевины. Температура плавления: 183–185оС. Структура и значения, характеризующие физические свойства соединений, полученных способами, описанными в примерах с-1 – с-5, представлены в таблицах 14с-1, 14с-2 и 14с-3. Пример d-1. Получение 1-(2-метилтиазолидин-4-он-2сульфонилимино)-3-(4,6- диметоксипиримидин-2ил)мочевины В 20 мл сухого тетрагидрофурана было размешано 0,84 г (6 ммоль) 2-амино-4-метил-6-метокситриазина, после чего к полученной суспензии при комнатной температуре было по каплям добавлено 0,85 г (6 ммоль) хлорсульфонилизоцианата. В результате умеренного подогрева реакционная смесь превратилась в раствор светложелтого цвета. Затем к нему постепенно были добавлены 1,64 г (6 ммоль) 2-имино-3-(3-хлораллилокси)тиазолидингидробромида и 1,43 г (14 ммоль) триэтиламина, смешанного с 15 мл сухого тетрагидрофурана, после чего смесь была подвергнута перемешиванию при комнатной температуре в течение 30 мин. Растворитель был отогнан в условиях пониженного давления, а к полученному остатку была добавлена вода. Полученное маслянистое вещество было подвергнуто троекратному экстрагированию 80 мл хлороформа. Затем экстрагирующий раствор был подвергнут одноразовой промывке 100 мл воды и просушен над безводным раствором сульфата натрия. Полученные кристаллы были промыты этиловым эфиром и ацетонитрилом, в результате чего было получе В 30 мл сухого тетрагидрофурана было растворено 1,55 г (10 ммоль) 2-амино-4,6-диметоксипиримидина, после чего к полученному раствору при температуре в пределах от –20оС до –15оС по каплям было добавлено 1,42 г (10 ммоль) хлорсульфонилизоцианата. Затем температура реакции была повышена до 0оС, и реакционная смесь была подвергнута перемешиванию при этой температуре в течение 10 минут. Затем реакционная 20 29389 смесь вновь была подвергнута охлаждению до –30оС, после чего к ней была добавлена смесь, содержащая 2,84 г (11 ммоль) 3-метил-2-иминотиазолидин-4-он-гидроиодида, 2,22 г (22 ммоль) триэтиламина и 30 мл сухого тетрагидрофурана. Температура реакции была повышена до комнатной, и смесь при этой температуре была подвергнута перемешиванию в течение 20 мин. Затем в условиях пониженного давления был отогнан растворитель, а к полученному остатку было добавлено 100 мл воды. Осажденные кристаллы были подвергнуты троекратному экстрагированию 100 мл хлороформа. Затем слой хлороформа был промыт водой и просушен над безводным сульфатом натрия. Затем в условиях пониженного давления был отогнан растворитель. Полученные кристаллы были промыты растворяющей смесью этилового эфира и ацетонитрила и отделены фильтрованием, в результате чего было получено 1,5 г бесцветного кристаллического вещества, представляющего собой требуемую 1-(3-метилтиазолидин-4-он-2-сульфонилимино)-3-(4,6- диметоксипиримидин-2-ил)мочевину. Температура плавления: 200–201оС. Пример d-2. Получение 1-(1-метил-3-n-пропилимидазолидин-4-он-2-сульфонилимино)-3-(4,6-диметоксипиримидин-2-ил)мочевины Получение 1-(3,6-дигидро-3-n-пропил-2Н1,3-тиазин-2-сульфонилимино)-3-(4,6-диметоксипиримидин-2-ил)мочевины В 40 мл сухого тетрагидрофурана было растворено 0,32 г (2,06 ммоль) 2-амино-4,6-диметоксипиримидина, после чего полученный раствор был охлажден до –40оС. При этой температуре к раствору по каплям было добавлено 0,29 г хлорсульфонилизоцианата. Затем температура реакции была повышена до 0оС. После этого смесь была подвергнута повторному охлаждению до –40оС, и к ней по каплям была добавлена смесь, содержащая 0,4 г (2,56 ммоль) 3,6-дигидро-3-nпропил-2Н-1,3-тиазин-2-имина, 0,26 г (2,57 ммоль) триэтиламина и 40 мл сухого тетрагидрофурана. Смесь была подвергнута постепенному нагреву при одновременном перемешивании до комнатной температуры, после чего в условиях пониженного давления был отогнан растворитель. К остатку было добавлено 100 мл воды, после чего смесь была подвергнута двойному экстрагированию 50 мл хлороформа. Слой хлороформа был промыт водой и просушен над безводным сульфатом натрия. Затем в условиях пониженного давления хлороформ был отогнан. Полученные кристаллы были сначала промыты ацетонитрилом, а затем этиловым эфиром, в результате чего было получено 0,3 г требуемой 1-(3,6-дигидро-3-n-пропил-2Н-1,3тиазин-2-сульфонилимино)-3- (4,6-диметоксипиримидин-2-ил)мочевины. Температура плавления: 161–163оС. Пример е-2. Получение 1-(3,4,5,6-тетрагидро-3-метил-2Н1,3-тиазин-2-сульфонилимино)-3-(4,6-диметоксипиримидин-2-ил)мочевины В 20 мл сухого тетрагидрофурана было растворено 1,16 г (7,5 ммоль) 2-амино-4,6-диметоксипиримидина, после чего к полученному раствору было добавлено 1,07 г (7,5 ммоль) хлорсульфонилизоцианата, что осуществлялось при температуре – 40оС. Затем температура реакции была повышена до 0оС, после чего реакционная смесь была снова охлаждена до –40оС. Затем к ней была добавлена смесь, содержащая 1,16 г (7,5 ммоль) 1-метил-3-nпропил-2-иминоимидазолидин-4-она, 0,83 г (8,2 ммоль) триэтиламина и 20 мл сухого тетрагидрофурана. Температура реакции была повышена до комнатной, и при этой температуре смесь была подвергнута перемешиванию в течение 2 час. Затем в условиях пониженного давления растворитель был отогнан, а к полученному остатку было добавлено 100 мл воды. После этого смесь была подвергнута троекратному экстрагированию 100 мл хлороформа. Слой хлороформа был промыт водой, а затем просушен над безводным сульфатом натрия. В условиях пониженного давления растворитель был отогнан, а полученные кристаллы были промыты растворяющей смесью этилового эфира и ацетонитрила и отделены фильтрованием, в результате чего было получено 0,16 г требуемой 1-(1-метил-3-n- пропилимидазолидин-4-он2-сульфонилимино)-3-(4,6-диметоксипиримидин-2ил)мочевины. Температура плавления: 96–98оС. Структура и значения, характеризующие физические свойства соединений, полученных способами, описанными в примерах d-1 – d-2, представлены в таблице 14d. Пример е-1. В 30 мл сухого тетрагидрофурана было растворено 1,55 г (10 ммоль) 2-амино-4,6-диметоксипиримидина, после чего к полученному раствору при температуре в пределах от –15оС до –5оС по каплям было добавлено 1,42 г (10 ммоль) хлорсульфонилизоцианата. Реакционный раствор был нагрет до 0оС и подвергнут перемешиванию при этой температуре в течение 15 мин. Затем реакционный раствор был снова охлажден до –30оС, после чего к нему по каплям был добавлен смешанный раствор, содержащий 1,56 г (12 ммоль) 3,4,5,6-тетрагидро-3-метил-2Н-1,3-тиазин-2-имина, 1,21 г (12 ммоль) триэтиламина и 10 мл сухого тетрагидрофурана. Реакционный раствор был подвергнут постепенному нагреву до комнатной температуры при одновременном перемешивании, после чего в условиях пониженного давления растворитель был отогнан. К остатку было добавлено 80 мл воды, а полученные кристаллы были 21 29389 подвергнуты троекратному экстрагированию 60 мл хлороформа. Затем слой хлороформа был промыт водой и просушен над безводным сульфатом натрия. После этого хлороформ был отогнан в условиях пониженного давления. Полученные кристаллы были промыты растворяющей смесью этилового эфира и ацетонитрила, в результате чего было получено 1,2 г требуемой 1-(3,4,5,6-тетрагидро-3-метил-2Н-1,3-тиазин2-сульфонилимино)-3-(4,6-димеоксипиримидин-2ил)мочевины. Температура плавления: 188–190оС. Структура и значения, характеризующие физические свойства соединений, полученных способами, описанными в примерах е–1 и е–2, представлены в таблицах 14е-1 и 14е-2. Пример f-1. Получение 1-(3-метилоксазолидин-2-сульфонилимино)-3-(4,6-диметоксипиримидин-2-ил)мочевины пиримидина, после чего к полученному раствору было добавлено 1,42 г (10 ммоль) хлорсульфонилизоцианата, что было осуществлено по каплям и при температуре в пределах от –20оС до –15оС. Температура реакции была повышена до 0оС, после чего смесь снова была охлаждена до –20оС. Затем к ней была добавлена смесь, содержащая 2,5 г (10,2 ммоль) гидроиодида N,N-диметил-S-метилизотиомочевины, 2,22 г (22 ммоль) триэтиламина и 30 мл сухого тетрагидрофурана. Затем температура реакции была повышена до комнатной, и при этой температуре смесь была подвергнута перемешиванию в течение 10 минут. В условиях пониженного давления растворитель был отогнан, а к полученному остатку было добавлено 80 мл воды. После троекратного экстрагирования смеси 30 мл хлороформа слой хлороформа был промыт водой и просушен над безводным сульфатом натрия. Затем в условиях пониженного давления был отогнан растворитель. Полученные кристаллы были промыты растворяющей смесью этилового эфира и ацетонитрила, в результате чего было получено 2 г требуемой 1-[N-((метилтио-N,Nдиметиламино)-метилен)аминосульфонил]-3-(4,6диметоксипиримидин-2-ил)мочевины. Температура плавления: 167–168оС. Пример g-2. Получение 1-[N-((метилтио-N-этил-N-метиламино)метилен)аминосульфонил]-3-(4,6-диметоксипиримидин-2-ил)мочевины В 30 мл сухого тетрагидрофурана было растворено 1,55 г (10 ммоль) 2-амино-4,6-диметоксипиримидина, после чего к полученному раствору при –20оС по каплям было добавлено 1,42 г (10 ммоль) хлорсульфонилизоцианата. Температура реакции была повышена до –5оС, и при этой температуре смесь была подвергнута перемешиванию в течение 5 мин. Затем реакционная смесь была снова охлаждена до –20оС, и к ней была добавлена смесь, содержащая 2,28 г (10 ммоль) 2имино-3-метилоксазолидингидроиодида, 2,22 г (22 ммоль) триэтиламина и 30 мл сухого тетрагидрофурана. После этого температура реакции была повышена до комнатной, и при этой температуре смесь была подвергнута перемешиванию в течение одного часа. Затем в условиях пониженного давления растворитель был отогнан, а к полученному остатку было добавлено 100 мл воды. Осажденные кристаллы были отделены фильтрованием, промыты сначала водой, а затем растворяющей смесью этилового эфира и ацетонитрила и просушены, в результате чего было получено 0,8 г требуемой 1-(3-метилоксазолидин-2-сульфонилимино)-3-(4,6- диметоксипиримидин-2-ил)мочевины. Температура плавления: 174–175оС. Структура и значения, характеризующие физические свойства соединений, полученных способом, описанным в примере f-1, представлены в таблице 14f. Пример g-1. Получение 1-[N-((метилтио-N,N-диметиламино)-метилен)аминосульфонил]-3-(4,6-диметоксипиримидин-2-ил)мочевины В 40 мл сухого тетрагидрофурана было растворено 1,55 г (10 ммоль) 2-амино-4,6-диметоксипиримидина, после чего при температуре в пределах от –20оС до –15оС по каплям к полученному раствору было добавлено 1,42 г (10 ммоль) хлорсульфонилизоцианата. Температура реакции была повышена до 0оС, после чего смесь снова была охлаждена до –20оС. Затем к ней была добавлена смесь, содержащая 2,60 г (10 ммоль) гидроиодида N-этил-N-метил-S-метилизомочевины, 2,22 г (22 ммоль) триэтиламина и 30 мл тетрагидрофурана. После этого температура реакции была повышена до комнатной, и при этой температуре смесь была подвергнута перемешиванию в течение одного часа. Затем в условиях пониженного давления растворитель был отогнан, а к полученному остатку было добавлено 80 мл воды. Смесь затем была подвергнута троекратному экстрагированию 50 мл хлороформа. Слой хлороформа был промыт водой, а затем просушен над безводным сульфатом натрия. Затем в условиях пониженного давления растворитель был отогнан. Полученные кристаллы были промыты ацетонитрилом, в результате чего было получено 1,32 г требуемой 1-[N-((метилтио-N-этил-N-метиламино)метилен)-аминосульфонил]-3-(4,6-диметоксипиримидин-2-ил)мочевины. Температура плавления: 143–144оС. Пример g-3. Получение 1-[N-((метилтио-N-метокси-N-метиламино)метиленаминосульфонил]-3-(4,6-диметоксипиримидин-2-ил)мочевины В 40 мл сухого тетрагидрофурана было растворено 1,55 г (10 ммоль) 2-амино-4,6-диметокси 22 29389 вещество 5–12 частей Другие 5–30 частей В качестве других составных частей могут быть упомянуты, например, антифриз и загуститель. Гранулированный смачивающийся порошок (дуст). Соединение, предложенное в соответствии с настоящим изобретением 20–90 частей Твердый носитель 10–60 частей Поверхностно-активное вещество 1–20 частей Гранулированный материл Соединение, предложенное в соответствии с настоящим изобретением 0,1–10 частей Твердый носитель 90–99,9 частей Поверхностно-активное вещество 1–5 частей Пример состава а-1: Смачивающийся порошок. Соединение № 1-а, предложенное в соответствии с настоящим изобретением 20 частей "Зиклайт-А" (фирменное наименование глины типа каолина, выпускаемой фирмой "Зиклайт индастриз, ко., лтд.") 76 частей "Сорпол-5039" (фирменное наименование смеси неионогенного поверхностно-активного вещества и анионогенного поверхностно-активного вещества, выпускаемой фирмой "Тохо кемикл индастри ко., лтд.") 2 части "Карплекс" (фирменное наименование антикоагулянта, состоящего из белой сажи, выпускаемого фирмой "Сионоги фармасьютикл ко., лтд.") 2 части Указанные выше компоненты подвергаются измельчению до состояния однородного порошка и смешению с целью получения смачивающегося порошка. Пример состава а-2: Смачивающийся порошок. Соединение № 2-а, предложенное в соответствии с настоящим изобретением 40 частей "Зиклайт-А" (фирменное наименование глины типа каолина, выпускаемой фирмой "Зиклайт индастриз, ко., лтд.") 54 части "Сорпол-5039" (фирменное наименование смеси неионогенного поверхностно-активного вещества и анионогенного поверхностно-активного вещества, выпускаемого фирмой "Тохо кемикл индастри ко., лтд.") 2 части "Карплекс" (фирменное наименование антикоагулянта, состоящего из белой сажи, выпускаемого фирмой "Сионоги фармасьютикл ко., лтд.") 4 части В 20 мл сухого тетрагидрофурана было растворено 0,78 г 2-амино-4,6-диметоксипиримидина (5 ммоль), после чего к полученному раствору по каплям и при температуре в пределах от –20оС до –15оС было добавлено 0,71 г (5 ммоль) хлорсульфонилизоцианата. Температура реакции была повышена до 0оС, после чего смесь снова была охлаждена до –20оС. Затем к ней была добавлена смесь, содержащая 1,31 г (5 ммоль) гидроиодида N-метокси-N-метил-S-метилизомочевины, 1,11 г (11 ммоль) триэтиламина и 15 мл сухого тетрагидрофурана. Затем температура реакции была повышена до комнатной, и при этой температуре смесь была подвергнута перемешиванию в течение одного часа. После этого в условиях пониженного давления растворитель был отогнан, а к полученному остатку было добавлено 40 мл воды. Затем смесь была подвергнута троекратному экстрагированию 25 мл хлороформа. После этого слой хлороформа был промыт водой, а затем просушен над безводным сульфатом натрия. Затем в условиях пониженного давления был отогнан растворитель. Полученные кристаллы были промыты ацетонитрилом, в результате чего было получено 1,51 г требуемой 1-[N-((метилтио-N-метокси-N-метиламино)метилен)аминосульфонил]-3-(4,6-диметоксипиримидин-2-ил)мочевины. Температура плавления: 165–167оС. Структура и значения, характеризующие физические свойства соединений, полученных способами, описанными в примерах g-1 – g-3. представлены в таблице 14g. Ниже приведены конкретные примеры составов гербицидов, содержащих соединения, предложенные в соответствии с настоящим изобретением. Однако следует понимать, что настоящее изобретение ни в коей мере не ограничено этими конкретными примерами. В приведенных ниже примерах термин "части" означает "массовые части". Смачивающийся порошок: Соединение, предложенное в соответствии с настоящим изобретением 5–80 частей Твердый носитель 10–85 частей Поверхностно-активное вещество 1–10 частей Другие 1–5 частей В качестве других составных частей может быть упомянут, например, антикоагулянт. Концентрат эмульсии: Соединение, предложенное в соответствии с настоящим изобретением 1–30 частей Жидкий носитель 30–95 частей Поверхностно-активное вещество 5–15 частей Жидкий раствор Соединение, предложенное в соответствии с настоящим изобретением 5–70 частей Жидкий носитель 15–65 частей Поверхностно-активное 23 29389 Указанные выше компоненты подвергаются измельчению до состояния однородного порошка и смешению с целью получения смачивающегося порошка. Пример состава а-3: Концентрат эмульсии. Соединение № 3-а, предложенное в соответствии с настоящим изобретением 5 частей Ксилен 75 частей N,N-диметилформамид 15 частей "Сорпол-2680" (фирменное наименование смеси неионогенного поверхностно-активного вещества и анионогенного поверхностно-активного вещества, выпускаемой фирмой "Тохо кемикл индастри ко., лтд.") 5 частей Указанные выше компоненты подвергаются гомогенному смешиванию с целью получения концентрата эмульсии. Пример состава а-4: Жидкий раствор. Соединение № 7-а, предложенное в соответствии с настоящим изобретением 25 частей "Агризоль s-710" (фирменное наименование неионогенного поверхностно-активного вещества, выпускаемого фирмой "Као корп.") 10 частей "Ранокс-1000С" (фирменное наименование анионогенного поверхностно-активного вещества, выпускаемого фирмой "Тохо кемикл индастри ко., лтд.") 0,5 части 1%-ная вода "Родопол" (фирменное наименование загустителя, выпускаемого фирмой "Рон-Пуленк" 20 частей Вода 44,5 частей Указанные выше компоненты были подвергнуты гомогенному смешиванию с целью получения жидкого раствора. Пример состава а-5: Жидкий раствор. Соединение № 8-а, предложенное в соответствии с настоящим изобретением 40 частей "Агризоль s-710" (фирменное наименование неионогенного поверхностно-активного вещества, выпускаемого фирмой "Као корп.") 10 частей "Ранокс-1000С" (фирменное наименование анионогенного поверхностно-активного вещества, выпускаемого фирмой "Тохо кемикл индастри ко., лтд.") 0,5 части 1%-ная вода "Родопол" (фирменное наименование загустителя, выпускаемого фирмой "Рон-Пуленк" 20 частей Вода 29,5 частей Указанные выше компоненты были подвергнуты гомогенному смешиванию с целью получения жидкого раствора. Пример состава а-6: Гранулированный смачивающийся порошок (дуст). Соединение № 10-а, предложенное в соответствии с настоящим изобретением 75 частей "Изобан №1" (фирменное наименование анионогенного поверхностно-активного вещества, выпускаемого фирмой "Курарей айзоприн кемикл ко., лтд.") 10 частей "Ванирекс-N" (фирменное наименование анионогенного поверхностно-активного вещества, выпускаемого фирмой "Саньо кокусаку палп ко., лтд.") 5 частей "Карплекс № 80" (фирменное наименование белой сажи, выпускаемой фирмой "Сионоги фармасьютикл ко., лтд.") 10 частей Указанные выше компоненты подвергаются гомогенному смешиванию и измельчению с целью получения дуста. Пример состава а-7: Гранулированный материал. Соединение № 69-а, предложенное в соответствии с настоящим изобретением 1 часть Бентонит 55 частей Тальк 44 части Указанные выше компоненты были подвергнуты гомогенному смешиванию и измельчению, а после добавления небольшого количества воды смесь была подвергнута перемешиванию и гранулированию в гранулирующем экструдере с последующей просушкой, в результате чего был получен гранулированный материал. Пример состава b-1: Смачивающийся порошок. Соединение № 1-b, предложенное в соответствии с настоящим изобретением 20 частей "Зиклайт-А" (фирменное наименование глины типа каолина, выпускаемой фирмой "Зиклайт индастриз, ко., лтд.") 76 части "Сорпол-5039" (фирменное наименование смеси неионогенного поверхностно-активного вещества и анионогенного поверхностно-активного вещества, выпускаемого фирмой "Тохо кемикл индастри ко., лтд.") 2 части "Карплекс" (фирменное наименование антикоагулянта, состоящего из белой сажи, выпускаемого фирмой "Сионоги фармасьютикл ко., лтд.") 2 части Указанные выше компоненты подвергаются измельчению до состояния однородного порошка и смешению с целью получения смачивающегося порошка. Пример состава b-2: Смачивающийся порошок. Соединение № 2-b, предложенное в соответствии с настоящим изобретением 40 частей "Зиклайт-А" (фирменное наименование глины типа каолина, 24 29389 выпускаемой фирмой "Зиклайт индастриз, ко., лтд.") 54 части "Сорпол-5039" (фирменное наименование смеси неионогенного поверхностно-активного вещества и анионогенного поверхностно-активного вещества, выпускаемого фирмой "Тохо кемикл индастри ко., лтд.") 2 части "Карплекс" (фирменное наименование антикоагулянта, состоящего из белой сажи, выпускаемого фирмой "Сионоги фармасьютикл ко., лтд.") 4 части Указанные выше компоненты подвергаются измельчению до состояния однородного порошка и смешению с целью получения смачивающегося порошка. Пример состава b-3: Концентрат эмульсии. Соединение № 3-b, предложенное в соответствии с настоящим изобретением 5 частей Ксилен 75 частей N,N-диметилформамид 15 частей "Сорпол-2680" (фирменное наименование смеси неионогенного поверхностно-активного вещества и анионогенного поверхностно-активного вещества, выпускаемой фирмой "Тохо кемикл индастри ко., лтд.") 5 частей Указанные выше компоненты подвергаются гомогенному смешиванию с целью получения концентрата эмульсии. Пример состава b-4: Жидкий раствор. Соединение № 1-b, предложенное в соответствии с настоящим изобретением 25 частей "Агризоль s-710" (фирменное наименование неионогенного поверхностно-активного вещества, выпускаемого фирмой "Као корп.") 10 частей "Ранокс-1000С" (фирменное наименование анионогенного поверхностно-активного вещества, выпускаемого фирмой "Тохо кемикл индастри ко., лтд.") 0,5 части 1%-ная вода "Родопол" (фирменное наименование загустителя, выпускаемого фирмой "Рон-Пуленк" 20 частей Вода 44,5 частей Указанные выше компоненты были подвергнуты гомогенному смешиванию с целью получения жидкого раствора. Пример состава b-5: Жидкий раствор. Соединение № 4-b, предложенное в соответствии с настоящим изобретением 40 частей "Агризоль s-710" (фирменное наименование неионогенного поверхностноактивного вещества, выпускаемого фирмой "Као корп.") 10 частей "Ранокс-1000С" (фирменное наименование анионогенно го поверхностно-активного вещества, выпускаемого фирмой "Тохо кемикл индастри ко., лтд.") 0,5 части 1%-ная вода "Родопол" (фирменное наименование загустителя, выпускаемого фирмой "Рон-Пуленк") 20 частей Вода 29,5 частей Указанные выше компоненты были подвергнуты гомогенному смешиванию с целью получения жидкого раствора. Пример состава b-6: Гранулированный смачивающийся порошок (дуст). Соединение № 5-b, предложенное в соответствии с настоящим изобретением 75 частей "Изобан № 1" (фирменное наименование анионогенного поверхностно-активного вещества, выпускаемого фирмой "Курарей айзоприн кемикл ко., лтд.") 10 частей "Ванирекс-N" (фирменное наименование анионогенного поверхностно-активного вещества, выпускаемого фирмой "Саньо кокусаку палп ко., лтд.") 5 частей "Карплекс № 80" (фирменное наименование белой сажи, выпускаемой фирмой "Сионоги фармасьютикл ко., лтд.") 10 частей Указанные выше компоненты подвергаются гомогенному смешиванию и измельчению с целью получения дуста. Пример состава b-7: Гранулированный материал. Соединение № 6-b, предложенное в соответствии с настоящим изобретением 1 часть Бентонит 55 частей Тальк 44 части Указанные выше компоненты были подвергнуты гомогенному смешиванию и измельчению, а после добавления небольшого количества воды смесь была подвергнута перемешиванию и гранулированию в гранулирующем экструдере с последующей просушкой, в результате чего был получен гранулированный материал. Пример состава c-1: Смачивающийся порошок. Соединение № 1-c, предложенное в соответствии с настоящим изобретением 20 частей "Зиклайт-А" (фирменное наименование глины типа каолина, выпускаемой фирмой "Зиклайт индастриз, ко., лтд.") 76 частей "Сорпол-5039" (фирменное наименование смеси неионогенного поверхностно-активного вещества и анионогенного поверхностно-активного вещества, выпускаемого 25 29389 фирмой "Тохо кемикл индастри ко., лтд.") 2 части "Карплекс" (фирменное наименование антикоагулянта, состоящего из белой сажи, выпускаемого фирмой "Сионоги фармасьютикл ко., лтд.") 2 части Указанные выше компоненты подвергаются измельчению до состояния однородного порошка и смешению с целью получения смачивающегося порошка. Пример состава c-2: Смачивающийся порошок. Соединение № 2-c, предложенное в соответствии с настоящим изобретением 40 частей "Зиклайт-А" (фирменное наименование глины типа каолина, выпускаемой фирмой "Зиклайт индастриз, ко., лтд.") 54 части "Сорпол-5039" (фирменное наименование смеси неионогенного поверхностно-активного вещества и анионогенного поверхностно-активного вещества, выпускаемого фирмой "Тохо кемикл индастри ко., лтд.") 2 части "Карплекс" (фирменное наименование антикоагулянта, состоящего из белой сажи, выпускаемого фирмой "Сионоги фармасьютикл ко., лтд.") 4 части Указанные выше компоненты подвергаются измельчению до состояния однородного порошка и смешению с целью получения смачивающегося порошка. Пример состава c-3: Концентрат эмульсии. Соединение № 12-c, предложенное в соответствии с настоящим изобретением 5 частей Ксилен 75 частей N,N-диметилформамид 15 частей "Сорпол-2680" (фирменное наименование смеси неионогенного поверхностно-активного вещества и анионогенного поверхностно-активного вещества, выпускаемой фирмой "Тохо кемикл индастри ко., лтд.") 5 частей Указанные выше компоненты подвергаются гомогенному смешиванию с целью получения концентрата эмульсии. Пример состава c-4: Жидкий раствор. Соединение № 24-с, предложенное в соответствии с настоящим изобретением 25 частей "Агризоль s-710" (фирменное наименование неионогенного поверхностно-активного вещества, выпускаемого фирмой "Као корп.") 10 частей "Ранокс-1000С" (фирменное наименование анионогенного поверхностно-активного вещества, выпускаемого фир мой "Тохо кемикл индастри ко., лтд.") 0,5 части 1%-ная вода "Родопол" (фирменное наименование загустителя, выпускаемого фирмой "Рон-Пуленк") 20 частей Вода 44,5 частей Указанные выше компоненты были подвергнуты гомогенному смешиванию с целью получения жидкого раствора. Пример состава c-5: Жидкий раствор. Соединение № 37-c, предложенное в соответствии с настоящим изобретением 40 частей "Агризоль s-710" (фирменное наименование неионогенного поверхностно-активного вещества, выпускаемого фирмой "Као корп.") 10 частей "Ранокс-1000С" (фирменное наименование анионогенного поверхностноактивного вещества, выпускаемого фирмой "Тохо кемикл индастри ко., лтд.") 0,5 части 1%-ная вода "Родопол" (фирменное наименование загустителя, выпускаемого фирмой "Рон-Пуленк") 20 частей Вода 29,5 частей Указанные выше компоненты были подвергнуты гомогенному смешиванию с целью получения жидкого раствора. Пример состава c-6: Гранулированный смачивающийся порошок (дуст). Соединение № 45-c, предложенное в соответствии с настоящим изобретением 75 частей "Изобан №1" (фирменное наименование анионогенного поверхностно-активного вещества, выпускаемого фирмой "Курарей айзоприн кемикл ко., лтд.") 10 частей "Ванирекс-N" (фирменное наименование анионогенного поверхностно-активного вещества, выпускаемого фирмой "Саньо кокусаку палп ко., лтд.") 5 частей "Карплекс № 80" (фирменное наименование белой сажи, выпускаемой фирмой "Сионоги фармасьютикл ко., лтд.") 10 частей Указанные выше компоненты подвергаются гомогенному смешиванию и измельчению с целью получения дуста. Пример состава c-7: Гранулированный материал. Соединение № 48-c, предложенное в соответствии с настоящим изобретением Бентонит Тальк 26 1 часть 55 частей 44 части 29389 Указанные выше компоненты были подвергнуты гомогенному смешиванию и измельчению, а после добавления небольшого количества воды смесь была подвергнута перемешиванию и гранулированию в гранулирующем экструдере с последующей просушкой, в результате чего был получен гранулированный материал. Пример состава d-1: Смачивающийся порошок. Соединение № 1-d, предложенное в соответствии с настоящим изобретением 20 частей "Зиклайт-А" (фирменное наименование глины типа каолина, выпускаемой фирмой "Зиклайт индастриз, ко., лтд.") 76 частей "Сорпол-5039" (фирменное наименование смеси неионогенного поверхностно-активного вещества и анионогенного поверхностно-активного вещества, выпускаемого фирмой "Тохо кемикл индастри ко., лтд.") 2 части "Карплекс" (фирменное наименование антикоагулянта, состоящего из белой сажи, выпускаемого фирмой "Сионоги фармасьютикл ко., лтд.") 2 части Указанные выше компоненты подвергаются измельчению до состояния однородного порошка и смешению с целью получения смачивающегося порошка. Пример состава d-2: Смачивающийся порошок. Соединение № 2-d, предложенное в соответствии с настоящим изобретением 40 частей "Зиклайт-А" (фирменное наименование глины типа каолина, выпускаемой фирмой "Зиклайт индастриз, ко., лтд.") 54 части "Сорпол-5039" (фирменное наименование смеси неионогенного поверхностно-активного вещества и анионогенного поверхностно-активного вещества, выпускаемого фирмой "Тохо кемикл индастри ко., лтд.") 2 части "Карплекс" (фирменное наименование антикоагулянта, состоящего из белой сажи, выпускаемого фирмой "Сионоги фармасьютикл ко., лтд.") 4 части Указанные выше компоненты подвергаются измельчению до состояния однородного порошка и смешению с целью получения смачивающегося порошка. Пример состава d-3: Концентрат эмульсии. Соединение № 3-d, предложенное в соответствии с настоящим изобретением 5 частей Ксилен 75 частей N,N-диметилформамид 15 частей "Сорпол-2680" (фирменное наименование смеси неионогенного поверхностно-активного вещества и анионогенного поверхностно-активного вещества, выпускаемой фирмой "Тохо кемикл индастри ко., лтд.") 5 частей Указанные выше компоненты подвергаются гомогенному смешиванию с целью получения концентрата эмульсии. Пример состава d-4: Жидкий раствор. Соединение № 4-d, предложенное в соответствии с настоящим изобретением 25 частей "Агризоль s-710" (фирменное наименование неионогенного поверхностно-активного вещества, выпускаемого фирмой "Као корп.") 10 частей "Ранокс-1000С" (фирменное наименование анионогенного поверхностно-активного вещества, выпускаемого фирмой "Тохо кемикл индастри ко., лтд.") 0,5 части 1%-ная вода "Родопол" (фирменное наименование загустителя, выпускаемого фирмой "РонПуленк") 20 частей Вода 44,5 частей Указанные выше компоненты были подвергнуты гомогенному смешиванию с целью получения жидкого раствора. Пример состава d-5: Жидкий раствор. Соединение № 5-d, предложенное в соответствии с настоящим изобретением 40 частей "Агризоль s-710" (фирменное наименование неионогенного поверхностно-активного вещества, выпускаемого фирмой "Као корп.") 10 частей "Ранокс-1000С" (фирменное наименование анионогенного поверхностно-активного вещества, выпускаемого фирмой "Тохо кемикл индастри ко., лтд.") 0,5 части 1%-ная вода "Родопол" (фирменное наименование загустителя, выпускаемого фирмой "Рон-Пуленк") 20 частей Вода 29,5 частей Указанные выше компоненты были подвергнуты гомогенному смешиванию с целью получения жидкого раствора. Пример состава d-6: Гранулированный смачивающийся порошок (дуст). Соединение № 6-d, предложенное в соответствии с настоящим изобретением 75 частей "Изобан № 1" (фирменное наименование анионогенного поверхностно-активного вещества, выпускаемого фирмой "Курарей айзоприн кемикл ко., лтд.") 10 частей "Ванирекс-N" (фирменное наименование анионогенного поверхностно-активного 27 29389 вещества, выпускаемого фирмой "Саньо Кокусаку палп ко., лтд.") 5 частей "Карплекс № 80" (фирменное наименование белой сажи, выпускаемой фирмой "Сионоги фармасьютикл ко., лтд.") 10 частей Указанные выше компоненты подвергаются гомогенному смешиванию и измельчению с целью получения дуста. Пример состава d-7: Гранулированный материал. Соединение № 9-d, предложенное в соответствии с настоящим изобретением 1 часть Бентонит 55 частей Тальк 44 части Указанные выше компоненты были подвергнуты гомогенному смешиванию и измельчению, а после добавления небольшого количества воды смесь была подвергнута перемешиванию и гранулированию в гранулирующем экструдере с последующей просушкой, в результате чего был получен гранулированный материал. Пример состава e-1: Смачивающийся порошок. Соединение № 1-e, предложенное в соответствии с настоящим изобретением 20 частей "Зиклайт-А" (фирменное наименование глины типа каолина, выпускаемой фирмой "Зиклайт индастриз, ко., лтд.") 76 частей "Сорпол-5039" (фирменное наименование смеси неионогенного поверхностно-активного вещества и анионогенного поверхностно-активного вещества, выпускаемого фирмой "Тохо кемикл индастри ко., лтд.") 2 части "Карплекс" (фирменное наименование антикоагулянта, состоящего из белой сажи, выпускаемого фирмой "Сионоги фармасьютикл ко., лтд.") 2 части Указанные выше компоненты подвергаются измельчению до состояния однородного порошка и смешению с целью получения смачивающегося порошка. Пример состава e-2: Смачивающийся порошок. Соединение № 2-e, предложенное в соответствии с настоящим изобретением 40 частей "Зиклайт-А" (фирменное наименование глины типа каолина, выпускаемой фирмой "Зиклайт индастриз, ко., лтд.") 54 части "Сорпол-5039" (фирменное наименование смеси неионогенного поверхностно-активного вещества и анионогенного поверхностно-активного вещества, выпускаемого фирмой "Тохо кемикл индас три ко., лтд.") 2 части "Карплекс" (фирменное наименование антикоагулянта, состоящего из белой сажи, выпускаемого фирмой "Сионоги фармасьютикл ко., лтд.") 4 части Указанные выше компоненты подвергаются измельчению до состояния однородного порошка и смешению с целью получения смачивающегося порошка. Пример состава e-3: Концентрат эмульсии. Соединение № 3-e, предложенное в соответствии с настоящим изобретением 5 частей Ксилен 75 частей N,N-диметилформамид 15 частей "Сорпол-2680" (фирменное наименование смеси неионогенного поверхностно-активного вещества и анионогенного поверхностно-активного вещества, выпускаемой фирмой "Тохо кемикл индастри ко., лтд.") 5 частей Указанные компоненты подвергаются смешиванию до состояния образования гомогенной массы с целью получения концентрата эмульсии. Пример состава e-4: Жидкий раствор. Соединение № 4-e, предложенное в соответствии с настоящим изобретением 25 частей "Агризоль S-710" (фирменное наименование неионогенного поверхностно-активного вещества, выпускаемого фирмой "Као корп.") 10 частей "Ранокс-1000С" (фирменное наименование анионогенного поверхностно-активного вещества, выпускаемого фирмой "Тохо кемикл индастри ко., лтд.") 0,5 части 1%-ная вода "Родопол" (фирменное наименование загустителя, выпускаемого фирмой "Рон-Пуленк") 20 частей Вода 44,5 частей Указанные выше компоненты были подвергнуты гомогенному смешиванию с целью получения жидкого раствора. Пример состава e-5: Жидкий раствор. Соединение № 5-e, предложенное в соответствии с настоящим изобретением 40 частей "Агризоль S-710" (фирменное наименование неионогенного поверхностно-активного вещества, выпускаемого фирмой "Као корп.") 10 частей "Ранокс-1000С" (фирменное наименование анионогенного поверхностно-активного вещества, выпускаемого фирмой "Тохо кемикл индастри ко., лтд.") 0,5 части 1%-ная вода "Родопол" (фирменное наименование загустителя, выпускаемого фирмой "Рон-Пуленк") 20 частей Вода 29,5 частей 28 29389 Указанные выше компоненты были подвергнуты гомогенному смешиванию с целью получения жидкого раствора. Пример состава e-6: Гранулированный смачивающийся порошок (дуст). Соединение № 1-e, предложенное в соответствии с настоящим изобретением 75 частей "Изобан № 1" (фирменное наименование анионогенного поверхностно-активного вещества, выпускаемого фирмой "Курарей айзоприн кемикл ко., лтд.") 10 частей "Ванирекс-N" (фирменное наименование анионогенного поверхностно-активного вещества, выпускаемого фирмой "Саньо кокусаку палп ко., лтд.") 5 частей "Карплекс № 80" (фирменное наименование белой сажи, выпускаемой фирмой "Сионоги фармасьютикл ко., лтд.") 10 частей Указанные выше компоненты подвергаются равномерному смешиванию и измельчению с целью получения дуста. Пример состава е-7: Гранулированный материал. Соединение № 5-е, предложенное в соответствии с настоящим изобретением 1 часть Бентонит 55 частей Тальк 44 части и смешению с целью получения смачивающегося порошка. Пример состава f-2: Смачивающийся порошок. Соединение № 2-f, предложенное в соответствии с настоящим изобретением 40 частей "Зиклайт-А" (фирменное наименование глины типа каолина, выпускаемой фирмой "Зиклайт индастриз, ко., лтд.") 54 части "Сорпол-5039" (фирменное наименование смеси неионогенного поверхностно-активного вещества и анионогенного поверхностно-активного вещества, выпускаемого фирмой "Тохо кемикл индастри ко., лтд.") 2 части "Карплекс" (фирменное наименование антикоагулянта, состоящего из белой сажи, выпускаемого фирмой "Сионоги фармасьютикл ко., лтд.") 4 части Указанные выше компоненты подвергаются измельчению до состояния однородного порошка и смешению с целью получения смачивающегося порошка. Пример состава f-3: Концентрат эмульсии. Соединение № 1-f, предложенное в соответствии с настоящим изобретением 5 частей Ксилен 75 частей N,N-диметилформамид 15 частей "Сорпол-2680" (фирменное наименование смеси неионогенного поверхностно-активного вещества и анионогенного поверхностно-активного вещества, выпускаемой фирмой "Тохо кемикл индастри ко., лтд.") 5 частей Указанные выше компоненты подвергаются гомогенному смешиванию с целью получения концентрата эмульсии. Пример состава f-4: Жидкий раствор. Соединение № 2-f, предложенное в соответствии с настоящим изобретением 25 частей "Агризоль s-710" (фирменное наименование неионогенного поверхностноактивного вещества, выпускаемого фирмой "Као корп.") 10 частей "Ранокс-1000С" (фирменное наименование анионогенного поверхностно-активного вещества, выпускаемого фирмой "Тохо кемикл индастри ко., лтд.") 0,5 части 1%-ная вода "Родопол" (фирменное наименование загустителя, выпускаемого фирмой "Рон-Пуленк") 20 частей Вода 44,5 частей Указанные выше компоненты были подвергнуты гомогенному смешиванию с целью получения жидкого раствора. Указанные выше компоненты были подвергнуты гомогенному смешиванию и измельчению, а после добавления небольшого количества воды смесь была подвергнута перемешиванию и гранулированию в гранулирующем экструдере с последующей просушкой, в результате чего был получен гранулированный материал. Пример состава f-1: Смачивающийся порошок. Соединение № 1-f, предложенное в соответствии с настоящим изобретением 20 частей "Зиклайт-А" (фирменное наименование глины типа каолина, выпускаемой фирмой "Зиклайт индастриз, ко., лтд.") 76 частей "Сорпол-5039" (фирменное наименование смеси неионогенного поверхностно-активного вещества и анионогенного поверхностно-активного вещества, выпускаемого фирмой "Тохо кемикл индастри ко., лтд.") 2 части "Карплекс" (фирменное наименование антикоагулянта, состоящего из белой сажи, выпускаемого фирмой "Сионоги фармасьютикл ко., лтд.") 2 части Указанные выше компоненты подвергаются измельчению до состояния однородного порошка 29 29389 Пример состава f-5: Жидкий раствор. Соединение № 2-f, предложенное в соответствии с настоящим изобретением 40 частей "Агризоль s-710" (фирменное наименование неионогенного поверхностно-активного вещества, выпускаемого фирмой "Као корп.") 10 частей "Ранокс-1000С" (фирменное наименование анионогенного поверхностно-активного вещества, выпускаемого фирмой "Тохо кемикл индастри ко., лтд.") 0,5 части 1%-ная вода "Родопол" (фирменное наименование загустителя, выпускаемого фирмой "Рон-Пуленк") 20 частей Вода 29,5 частей Указанные выше компоненты были подвергнуты гомогенному смешиванию с целью получения жидкого раствора. Пример состава f-6: Гранулированный смачивающийся порошок (дуст). Соединение № 2-f, предложенное в соответствии с настоящим изобретением 75 частей "Изобан № 1" (фирменное наименование анионогенного поверхностно-активного вещества, выпускаемого фирмой "Курарей айзоприн кемикл ко., лтд.") 10 частей "Ванирекс-N" (фирменное наименование анионогенного поверхностно-активного вещества, выпускаемого фирмой "Саньо кокусаку палп ко., лтд.") 5 частей "Карплекс № 80" (фирменное наименование белой сажи, выпускаемой фирмой "Сионоги фармасьютикл ко., лтд.") 10 частей Указанные выше компоненты подвергаются гомогенному смешиванию и измельчению с целью получения дуста. Пример состава f-7: Гранулированный материал. Соединение № 2-f, предложенное в соответствии с настоящим изобретением 1 часть Бентонит 55 частей Тальк 44 части Указанные выше компоненты были подвергнуты гомогенному смешиванию и измельчению, а после добавления небольшого количества воды смесь была подвергнута перемешиванию и гранулированию в гранулирующем экструдере с последующей просушкой, в результате чего был получен гранулированный материал. Пример состава g-1: Смачивающийся порошок. Соединение № 1-g, предложенное в соответствии с настоящим изобретением 20 частей "Зиклайт-А" (фирменное наименование глины типа каолина, выпускаемой фирмой "Зиклайт индастриз, ко., лтд.") 76 частей "Сорпол-5039" (фирменное наименование смеси неионогенного поверхностно-активного вещества и анионогенного поверхностно-активного вещества, выпускаемого фирмой "Тохо кемикл индастри ко., лтд.") 2 части "Карплекс" (фирменное наименование антикоагулянта, состоящего из белой сажи, выпускаемого фирмой "Сионоги фармасьютикл ко., лтд.") 2 части Указанные выше компоненты подвергаются измельчению до состояния однородного порошка и смешению с целью получения смачивающегося порошка. Пример состава g-2: Смачивающийся порошок. Соединение № 2-g, предложенное в соответствии с настоящим изобретением 40 частей "Зиклайт-А" (фирменное наименование глины типа каолина, выпускаемой фирмой "Зиклайт индастриз, ко., лтд.") 54 части "Сорпол-5039" (фирменное наименование смеси неионогенного поверхностно-активного вещества и анионогенного поверхностно-активного вещества, выпускаемого фирмой "Тохо кемикл индастри ко., лтд.") 2 части "Карплекс" (фирменное наименование антикоагулянта, состоящего из белой сажи, выпускаемого фирмой "Сионоги фармасьютикл ко., лтд.") 4 части Указанные выше компоненты подвергаются измельчению до состояния однородного порошка и смешению с целью получения смачивающегося порошка. Пример состава g-3: Концентрат эмульсии. Соединение № 3-g, предложенное в соответствии с настоящим изобретением 5 частей Ксилен 75 частей N,N-диметилформамид 15 частей "Сорпол-2680" (фирменное наименование смеси неионогенного поверхностно-активного вещества и анионогенного поверхностно-активного вещества, выпускаемой фирмой "Тохо кемикл индастри ко., лтд.") 5 частей Указанные выше компоненты подвергаются гомогенному смешиванию с целью получения концентрата эмульсии. Пример состава g-4: Жидкий раствор. Соединение № 4-g, предложенное в соответствии с настоящим изобретением 25 частей 30
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of iminosulfonylurea having herbicide properties, a herbicide composition on their basis and a method for controlling weeds
Автори англійськоюMAKINO Kenzi, AKIYAMA Sigeaki, SUZUKI Hideaki, NAGAOKA Takeshi, NIKI Toshio, SUZUKI Koishi, NAVAMAKI Tsutomu, Watanabe Shigeomi, ISHIKAWA Kimihiro
Назва патенту російськоюПроизводные иминосульфонилмочевины, обладающие гербицидными свойствами, гербицидная композиция на их основе и способ борьбы с бурьянами
Автори російськоюМАКИНО Кензи, АКИЯМА Сигеаки, СУЗУКИ Хидеаки, НАГАОКА Такеси, НИКИ Тосио, СУЗУКИ Коиси, НАВАМАКИ Цутому, ВАТАНАБЕ Сигеоми, ИСИКАВА Кимихиро
МПК / Мітки
МПК: C07D 251/14, A01N 43/58, C07C 311/53, A01N 47/32, A01N 43/66, C07D 239/42
Мітки: боротьби, гербіцидні, основі, властивості, бур'янами, іміносульфонілсечовини, мають, гербіцидна, спосіб, композиція, похідні
Код посилання
<a href="https://ua.patents.su/61-29389-pokhidni-iminosulfonilsechovini-shho-mayut-gerbicidni-vlastivosti-gerbicidna-kompoziciya-na-kh-osnovi-ta-sposib-borotbi-z-buryanami.html" target="_blank" rel="follow" title="База патентів України">Похідні іміносульфонілсечовини, що мають гербіцидні властивості, гербіцидна композиція на їх основі та спосіб боротьби з бур’янами</a>
Попередній патент: Пристрій для передачі натурального інформаційного живлення біологічному об’єкту “біотрон цзян-2″
Наступний патент: Автоматичний пристрій для приготування гарячих напоїв шляхом заварювання
Випадковий патент: Термопластична формувальна композиція для отримання фільтрувального матеріалу на основі ультратонких синтетичних волокон