Нові пептиди, що зв’язуються з рецептором еритропоетину
Номер патенту: 88146
Опубліковано: 25.09.2009
Автори: Палані Балу, Тумелті Давід, Хольмез Кристофер П., Лалонде Гай, Іін Кан, Земеде Гемет Х., Шац Петер
Формула / Реферат
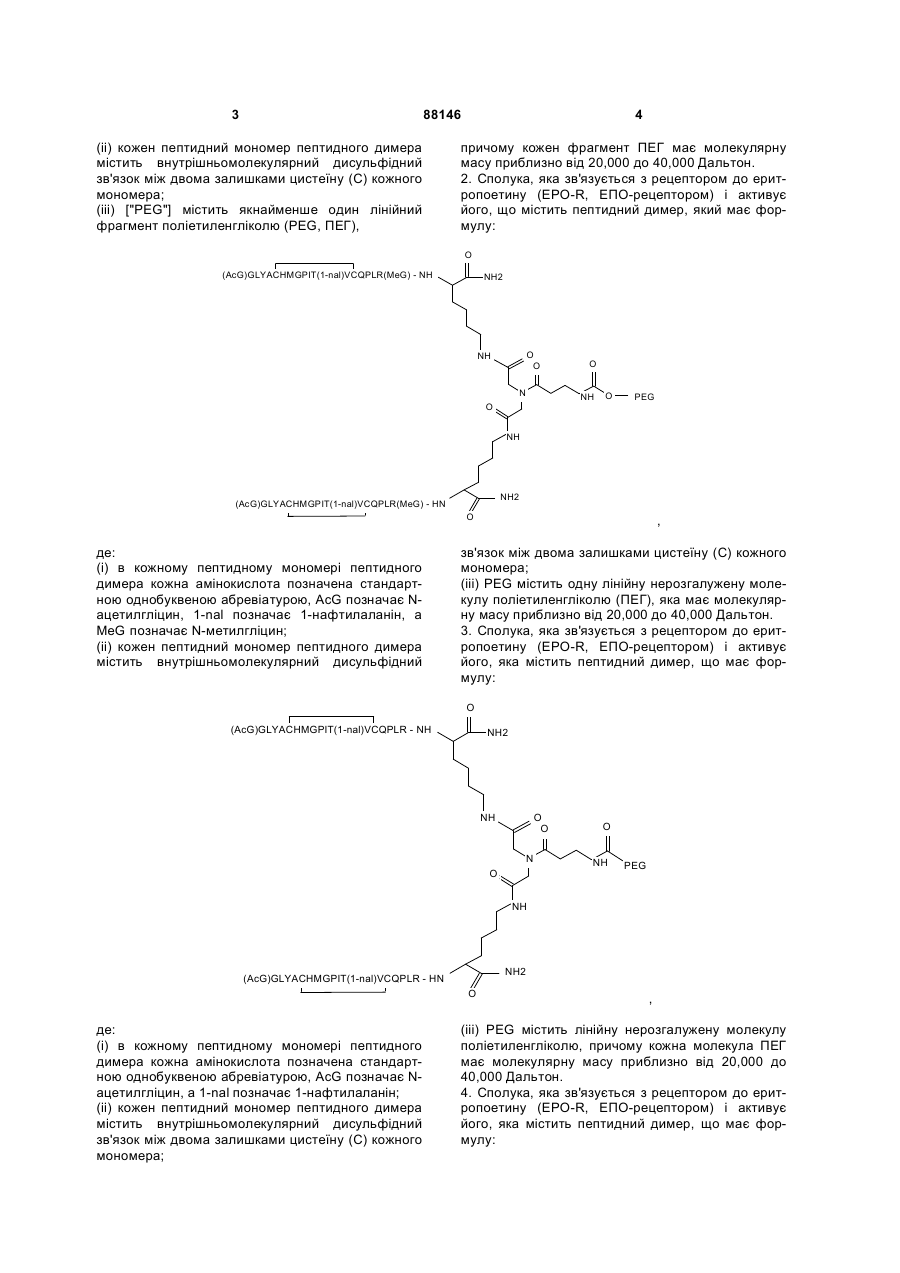
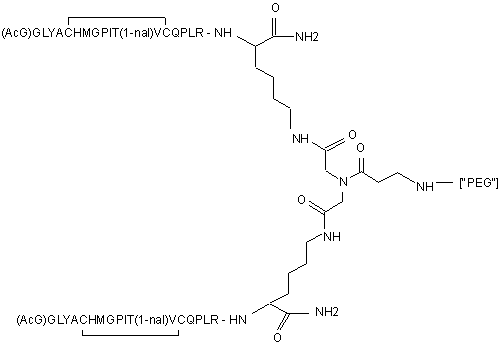
1. Сполука, яка зв'язується з рецептором до еритропоетину (EPO-R, ЕПО-рецептором) та активує його, і яка містить пептидний димер, що має формулу:
 ,
,
де:
(і) в кожному пептидному мономері пептидного димера кожна амінокислота позначена стандартною однобуквеною абревіатурою, AcG позначає N-ацетилгліцин, а 1-nal позначає 1-нафтилаланін;
(іі) кожен пептидний мономер пептидного димера містить внутрішньомолекулярний дисульфідний зв'язок між двома залишками цистеїну (С) кожного мономера;
(ііі) ["PEG"] містить якнайменше один лінійний фрагмент поліетиленгліколю (PEG, ПЕГ),
причому кожен фрагмент ПЕГ має молекулярну масу приблизно від 20,000 до 40,000 Дальтон.
2. Сполука, яка зв'язується з рецептором до еритропоетину (EPO-R, ЕПО-рецептором) і активує його, що містить пептидний димер, який має формулу:
 ,
,
де:
(і) в кожному пептидному мономері пептидного димера кожна амінокислота позначена стандартною однобуквеною абревіатурою, AcG позначає N-ацетилгліцин, 1-nal позначає 1-нафтилаланін, a MeG позначає N-метилгліцин;
(іі) кожен пептидний мономер пептидного димера містить внутрішньомолекулярний дисульфідний зв'язок між двома залишками цистеїну (С) кожного мономера;
(ііі) PEG містить одну лінійну нерозгалужену молекулу поліетиленгліколю (ПЕГ), яка має молекулярну масу приблизно від 20,000 до 40,000 Дальтон.
3. Сполука, яка зв'язується з рецептором до еритропоетину (EPO-R, ΕΠΟ-рецептором) і активує його, яка містить пептидний димер, що має формулу:
 ,
,
де:
(і) в кожному пептидному мономері пептидного димера кожна амінокислота позначена стандартною однобуквеною абревіатурою, AcG позначає N-ацетилгліцин, а 1-nal позначає 1-нафтилаланін;
(іі) кожен пептидний мономер пептидного димера містить внутрішньомолекулярний дисульфідний зв'язок між двома залишками цистеїну (С) кожного мономера;
(ііі) PEG містить лінійну нерозгалужену молекулу поліетиленгліколю, причому кожна молекула ПЕГ має молекулярну масу приблизно від 20,000 до 40,000 Дальтон.
4. Сполука, яка зв'язується з рецептором до еритропоетину (EPO-R, ЕПО-рецептором) і активує його, яка містить пептидний димер, що має формулу:
 ,
,
де:
(і) в кожному пептидному мономері пептидного димера кожна амінокислота позначена стандартною однобуквеною абревіатурою, AcG позначає N-ацетилгліцин, 1-nal позначає 1-нафтилаланін, a MeG позначає N-метилгліцин;
(іі) кожен пептидний мономер пептидного димера містить внутрішньомолекулярний дисульфідний зв'язок між двома залишками цистеїну (С) кожного мономера;
(ііі) PEG містить лінійну нерозгалужену молекулу поліетиленгліколю (ПЕГ), яка має молекулярну масу приблизно від 20,000 до 40,000 Дальтон.
5. Сполука, яка зв'язується з рецептором до еритропоетину (EPO-R, ΕΠΟ-рецептором) і активує його, яка містить пептидний димер, що має формулу:
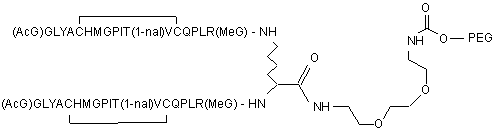 ,
,
де:
(і) в кожному пептидному мономері пептидного димера кожна амінокислота позначена стандартною однобуквеною абревіатурою, AcG позначає N-ацетилгліцин, 1-nal позначає 1-нафтилаланін, a MeG позначає N-метилгліцин;
(іі) кожен пептидний мономер пептидного димера містить внутрішньомолекулярний дисульфідний зв'язок між двома залишками цистеїну (С) кожного мономера;
(ііі) PEG містить лінійну нерозгалужену молекулу поліетиленгліколю, яка має молекулярну масу приблизно від 20,000 до 40,000 Дальтон.
6. Сполука згідно з будь-яким з пп. 1-5, в якій PEG має молекулярну масу, що дорівнює приблизно 30,000 Дальтон.
7. Сполука, яка зв'язується з рецептором до еритропоетину (EPO-R, ΕΠΟ-рецептором) і активує його, яка містить пептидний димер, що має формулу:
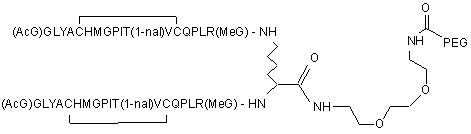 ,
,
де:
(і) в кожному пептидному мономері пептидного димера кожна амінокислота позначена стандартною однобуквеною абревіатурою, AcG позначає N-ацетилгліцин, 1-nal позначає 1-нафтилаланін, a MeG позначає N-метилгліцин;
(іі) кожен пептидний мономер пептидного димера містить внутрішньомолекулярний дисульфідний зв'язок між двома залишками цистеїну (С) кожного мономера;
(ііі) PEG містить лінійну нерозгалужену молекулу поліетиленгліколю, яка має молекулярну масу приблизно від 20,000 до 40,000 Дальтон.
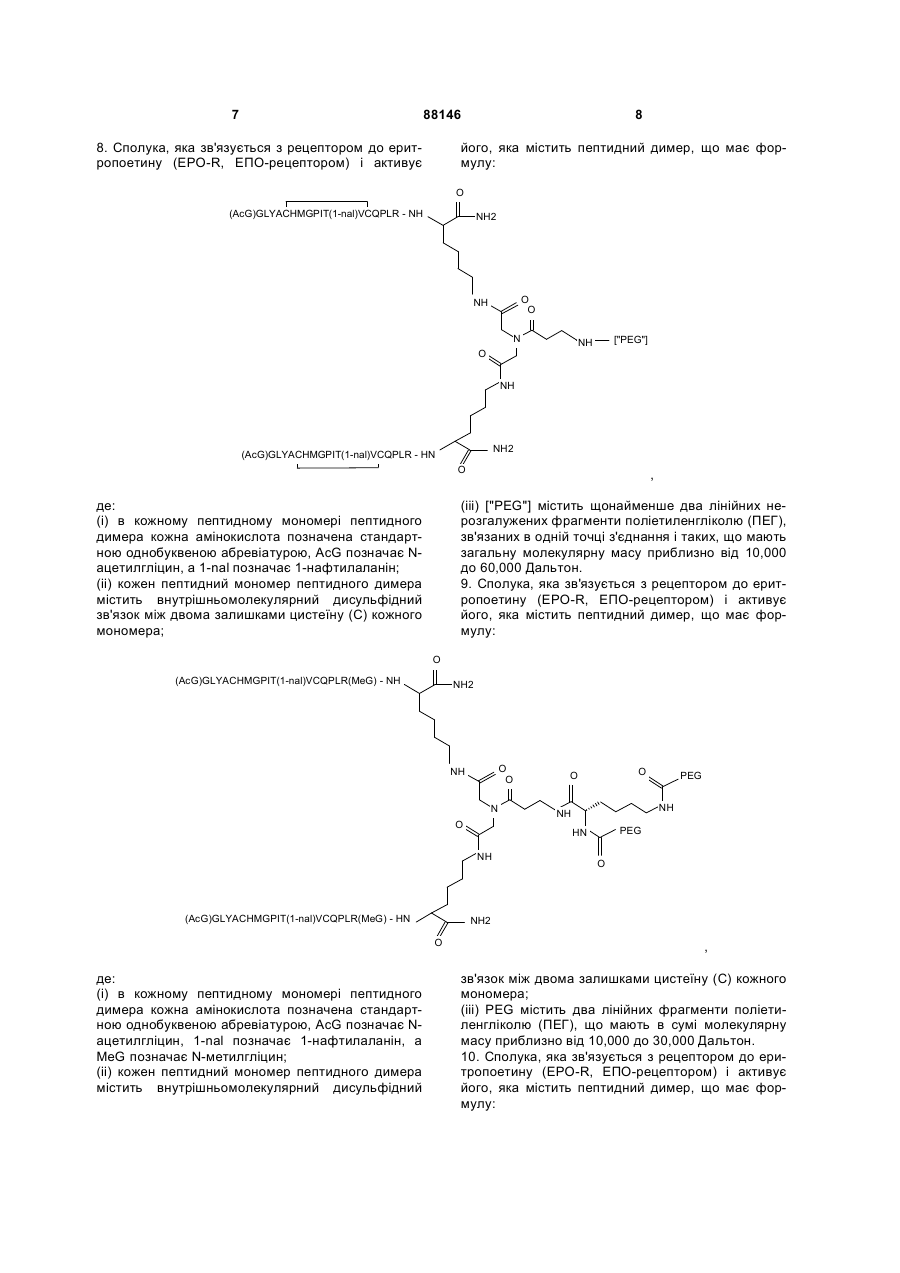
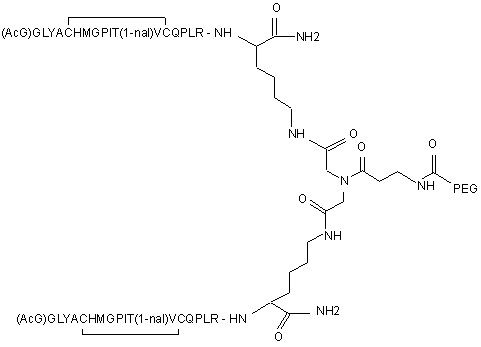
8. Сполука, яка зв'язується з рецептором до еритропоетину (EPO-R, ЕПО-рецептором) і активує його, яка містить пептидний димер, що має формулу:
 ,
,
де:
(і) в кожному пептидному мономері пептидного димера кожна амінокислота позначена стандартною однобуквеною абревіатурою, AcG позначає N-ацетилгліцин, а 1-nal позначає 1-нафтилаланін;
(іі) кожен пептидний мономер пептидного димера містить внутрішньомолекулярний дисульфідний зв'язок між двома залишками цистеїну (С) кожного мономера;
(ііі) ["PEG"] містить щонайменше два лінійних нерозгалужених фрагменти поліетиленгліколю (ПЕГ), зв'язаних в одній точці з'єднання і таких, що мають загальну молекулярну масу приблизно від 10,000 до 60,000 Дальтон.
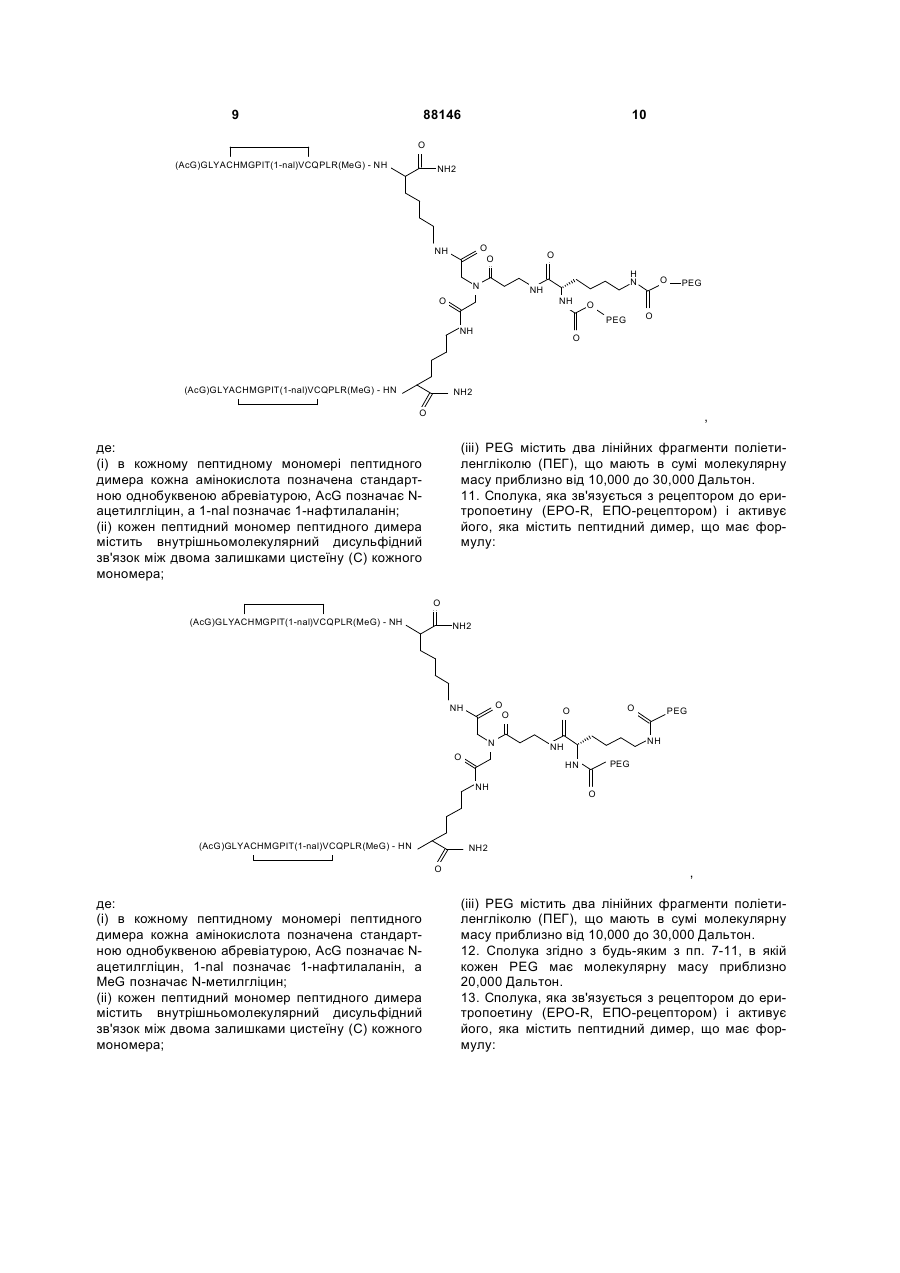
9. Сполука, яка зв'язується з рецептором до еритропоетину (EPO-R, ЕПО-рецептором) і активує його, яка містить пептидний димер, що має формулу:
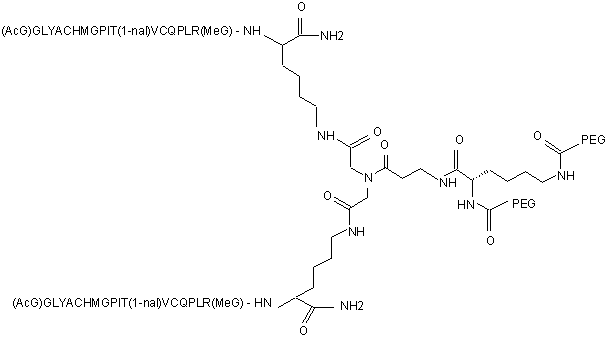 ,
,
де:
(і) в кожному пептидному мономері пептидного димера кожна амінокислота позначена стандартною однобуквеною абревіатурою, AcG позначає N-ацетилгліцин, 1-nal позначає 1-нафтилаланін, a MeG позначає N-метилгліцин;
(іі) кожен пептидний мономер пептидного димера містить внутрішньомолекулярний дисульфідний зв'язок між двома залишками цистеїну (С) кожного мономера;
(ііі) PEG містить два лінійних фрагменти поліетиленгліколю (ПЕГ), що мають в сумі молекулярну масу приблизно від 10,000 до 30,000 Дальтон.
10. Сполука, яка зв'язується з рецептором до еритропоетину (EPO-R, ЕПО-рецептором) і активує його, яка містить пептидний димер, що має формулу:
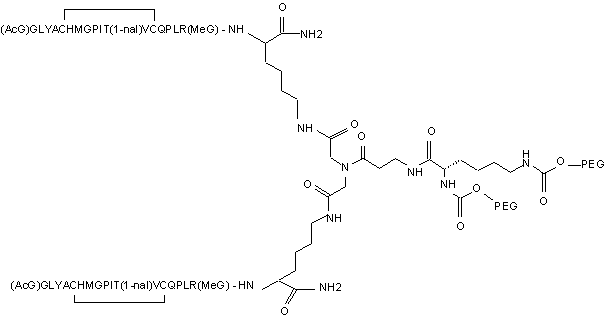 ,
,
де:
(і) в кожному пептидному мономері пептидного димера кожна амінокислота позначена стандартною однобуквеною абревіатурою, AcG позначає N-ацетилгліцин, а 1-nal позначає 1-нафтилаланін;
(іі) кожен пептидний мономер пептидного димера містить внутрішньомолекулярний дисульфідний зв'язок між двома залишками цистеїну (С) кожного мономера;
(ііі) PEG містить два лінійних фрагменти поліетиленгліколю (ПЕГ), що мають в сумі молекулярну масу приблизно від 10,000 до 30,000 Дальтон.
11. Сполука, яка зв'язується з рецептором до еритропоетину (EPO-R, ЕПО-рецептором) і активує його, яка містить пептидний димер, що має формулу:
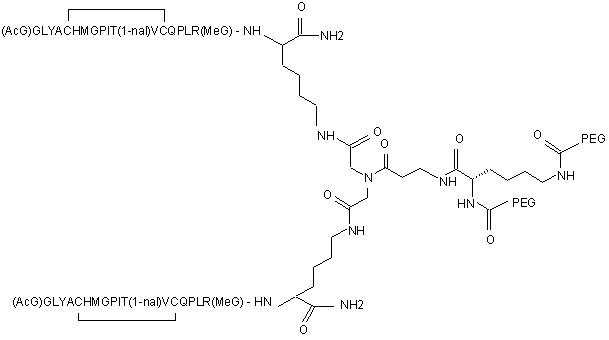 ,
,
де:
(і) в кожному пептидному мономері пептидного димера кожна амінокислота позначена стандартною однобуквеною абревіатурою, AcG позначає N-ацетилгліцин, 1-nal позначає 1-нафтилаланін, a MeG позначає N-метилгліцин;
(іі) кожен пептидний мономер пептидного димера містить внутрішньомолекулярний дисульфідний зв'язок між двома залишками цистеїну (С) кожного мономера;
(ііі) PEG містить два лінійних фрагменти поліетиленгліколю (ПЕГ), що мають в сумі молекулярну масу приблизно від 10,000 до 30,000 Дальтон.
12. Сполука згідно з будь-яким з пп. 7-11, в якій кожен PEG має молекулярну масу приблизно 20,000 Дальтон.
13. Сполука, яка зв'язується з рецептором до еритропоетину (EPO-R, ЕПО-рецептором) і активує його, яка містить пептидний димер, що має формулу:
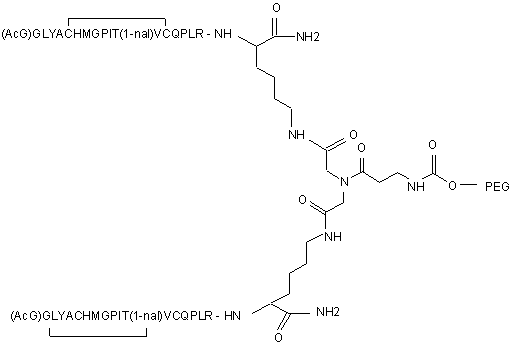 ,
,
де:
(і) в кожному пептидному мономері пептидного димера кожна амінокислота позначена стандартною однобуквеною абревіатурою, AcG позначає N-ацетилгліцин, а 1-nal позначає 1-нафтилаланін;
(іі) кожен пептидний мономер пептидного димера містить внутрішньомолекулярний дисульфідний зв'язок між двома залишками цистеїну (С) кожного мономера;
(ііі) PEG містить лінійний нерозгалужений фрагмент поліетиленгліколю (ПЕГ), що має молекулярну масу приблизно від 20,000 до 40,000 Дальтон.
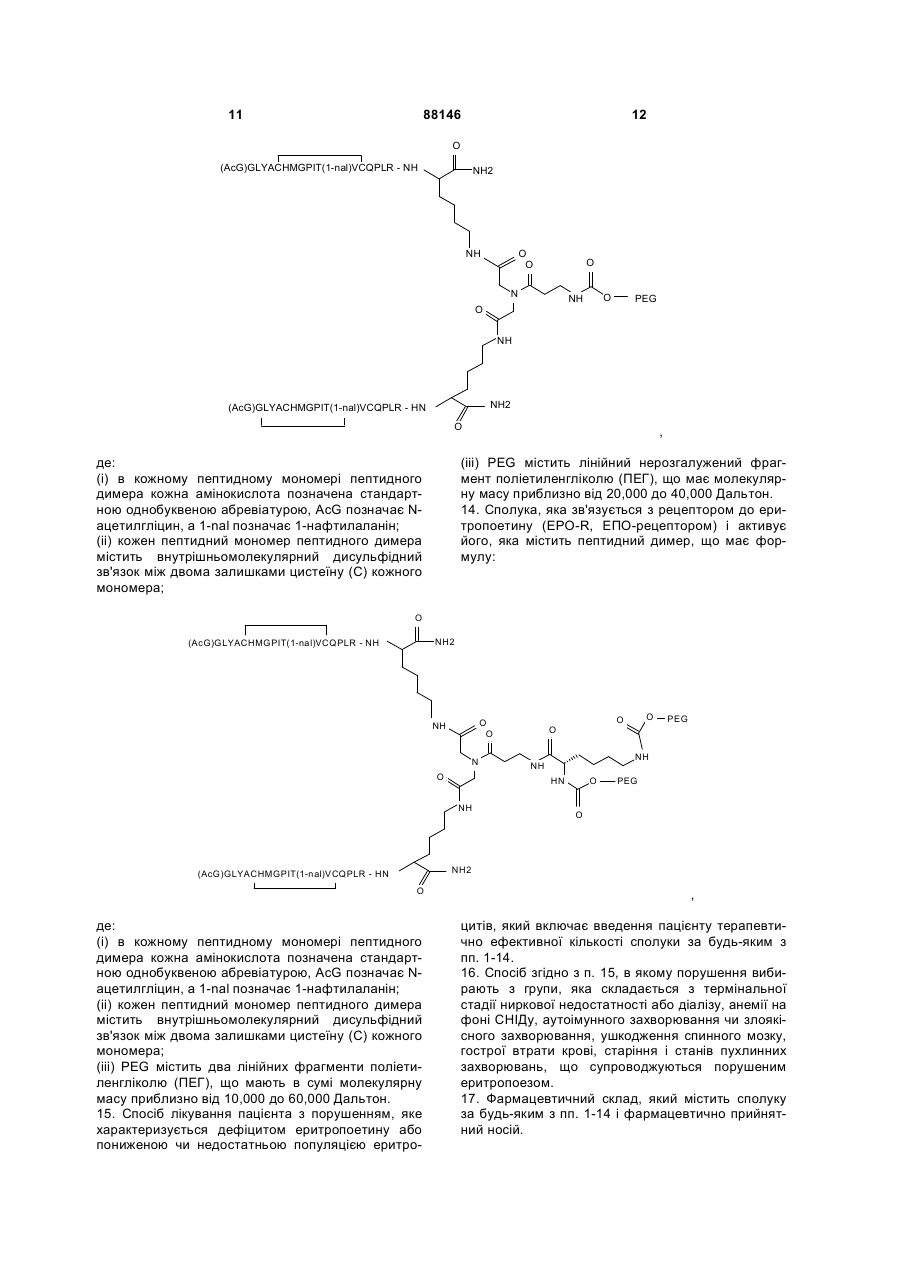
14. Сполука, яка зв'язується з рецептором до еритропоетину (EPO-R, ЕПО-рецептором) і активує його, яка містить пептидний димер, що має формулу:
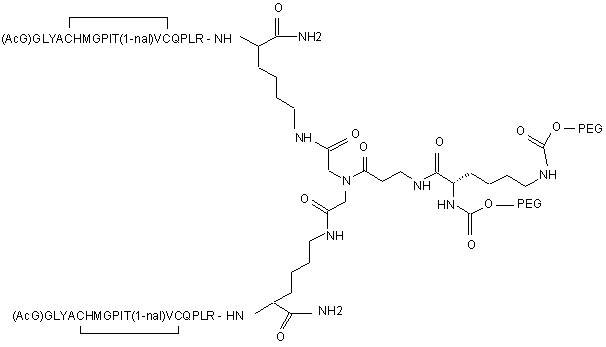 ,
,
де:
(і) в кожному пептидному мономері пептидного димера кожна амінокислота позначена стандартною однобуквеною абревіатурою, AcG позначає N-ацетилгліцин, а 1-nal позначає 1-нафтилаланін;
(іі) кожен пептидний мономер пептидного димера містить внутрішньомолекулярний дисульфідний зв'язок між двома залишками цистеїну (С) кожного мономера;
(ііі) PEG містить два лінійних фрагменти поліетиленгліколю (ПЕГ), що мають в сумі молекулярну масу приблизно від 10,000 до 60,000 Дальтон.
15. Спосіб лікування пацієнта з порушенням, яке характеризується дефіцитом еритропоетину або пониженою чи недостатньою популяцією еритроцитів, який включає введення пацієнту терапевтично ефективної кількості сполуки за будь-яким з пп. 1-14.
16. Спосіб згідно з п. 15, в якому порушення вибирають з групи, яка складається з термінальної стадії ниркової недостатності або діалізу, анемії на фоні СНІДу, аутоімунного захворювання чи злоякісного захворювання, ушкодження спинного мозку, гострої втрати крові, старіння і станів пухлинних захворювань, що супроводжуються порушеним еритропоезом.
17. Фармацевтичний склад, який містить сполуку за будь-яким з пп. 1-14 і фармацевтично прийнятний носій.
Текст
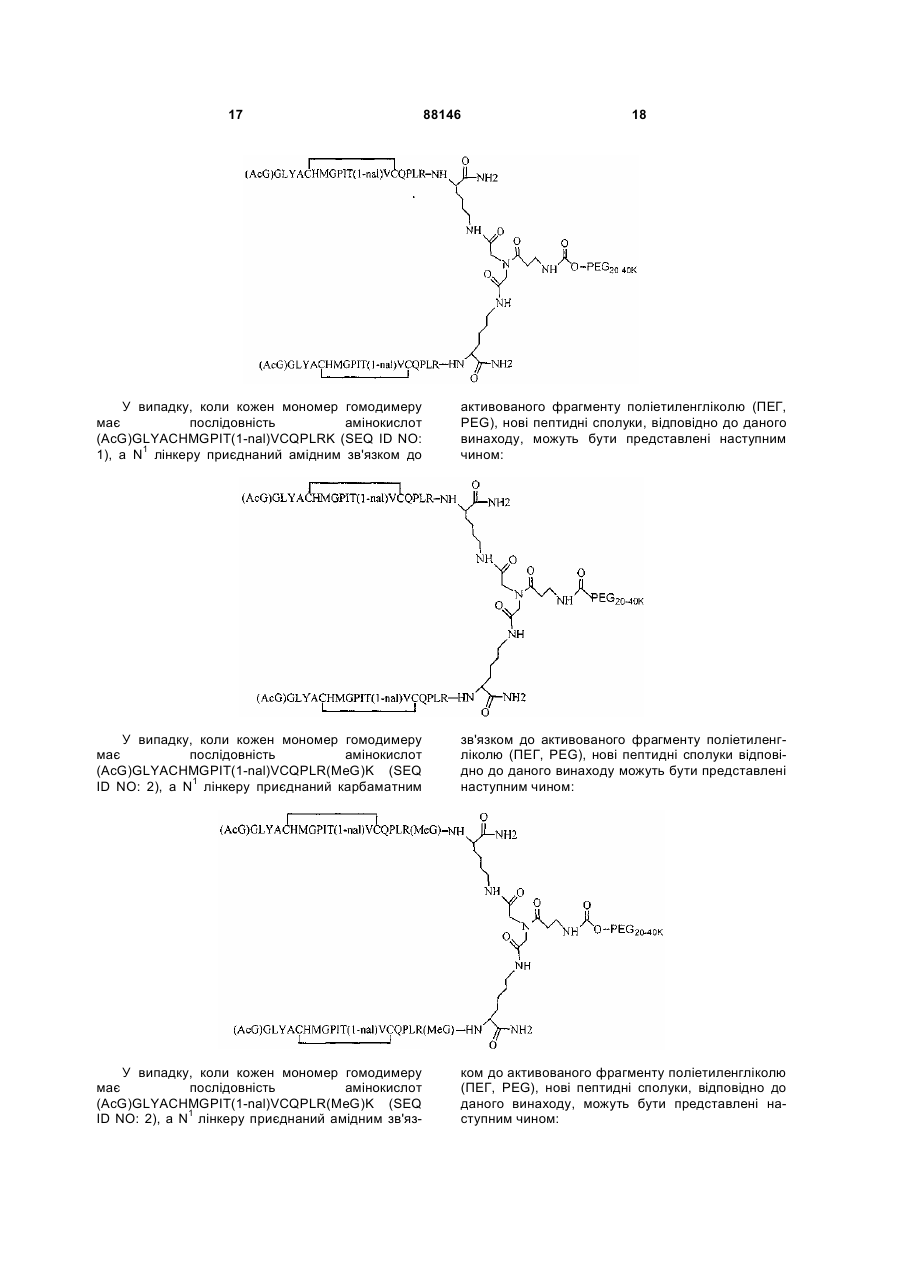
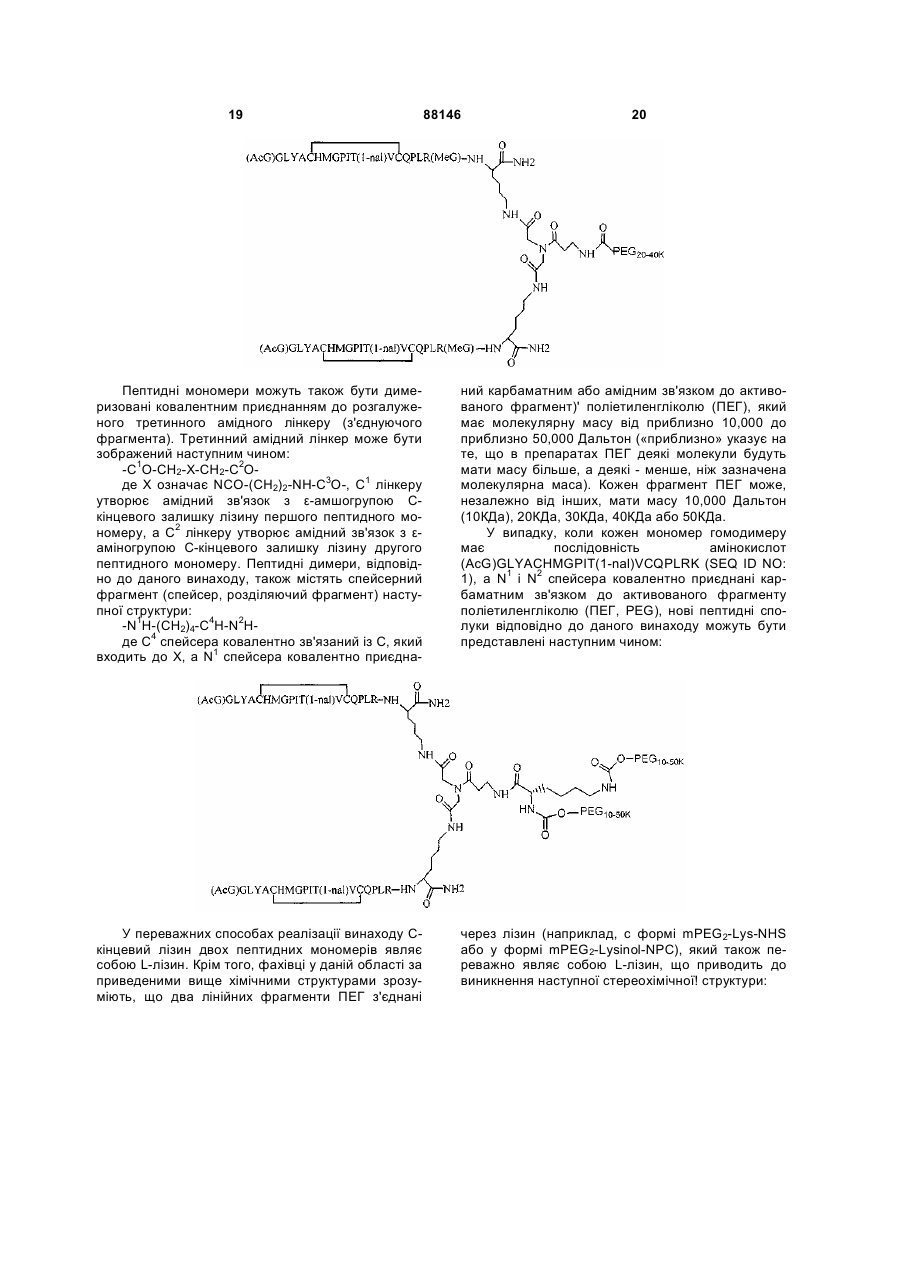
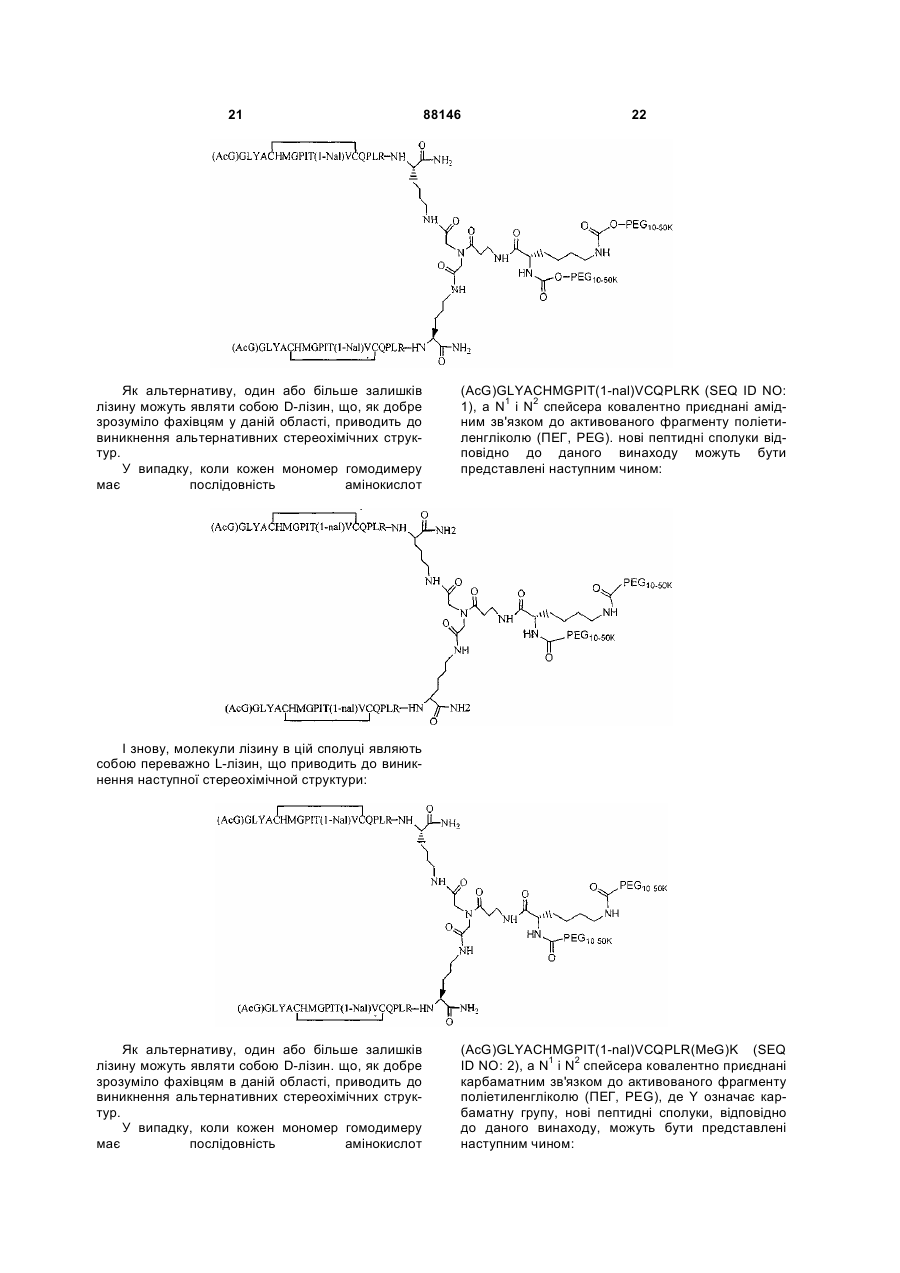
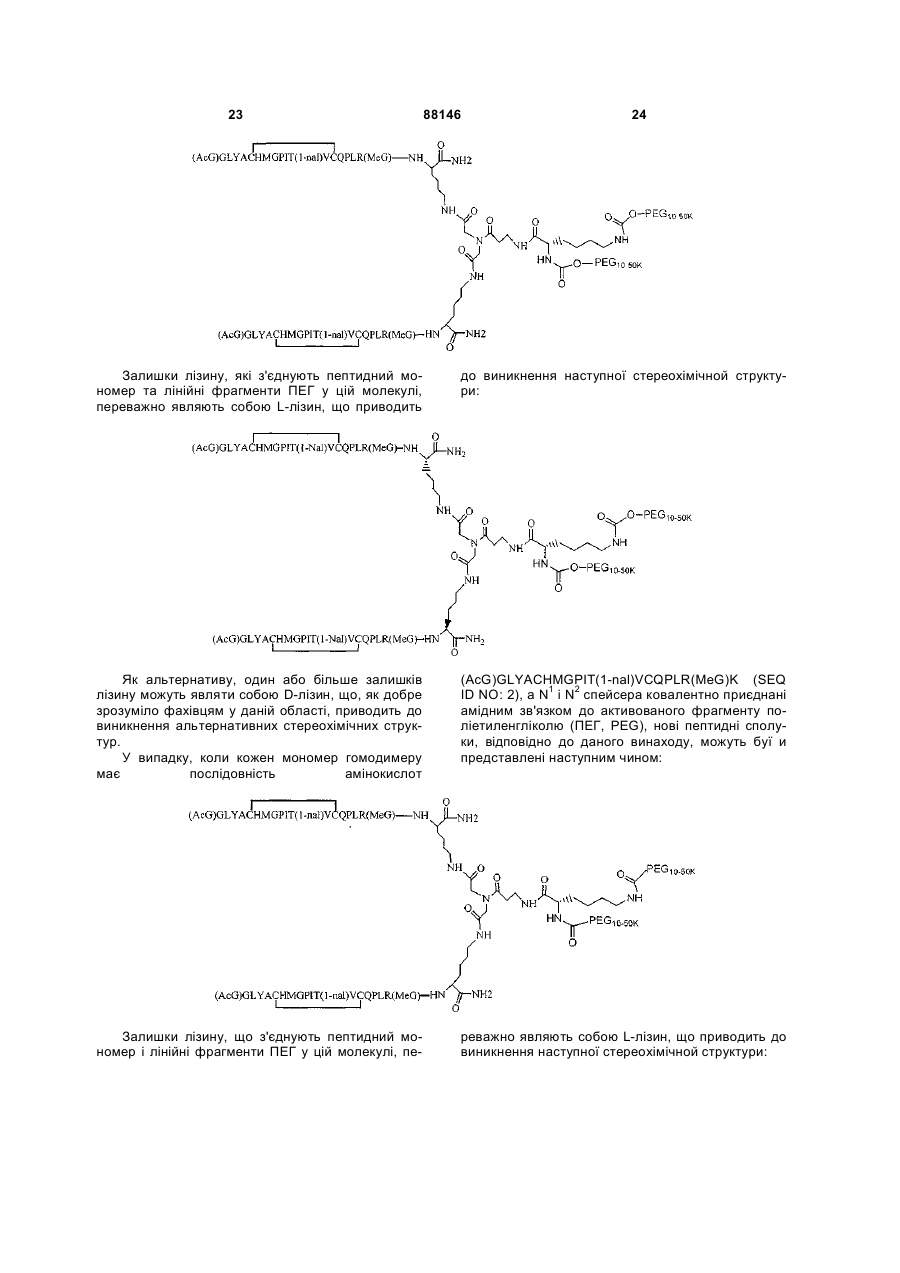
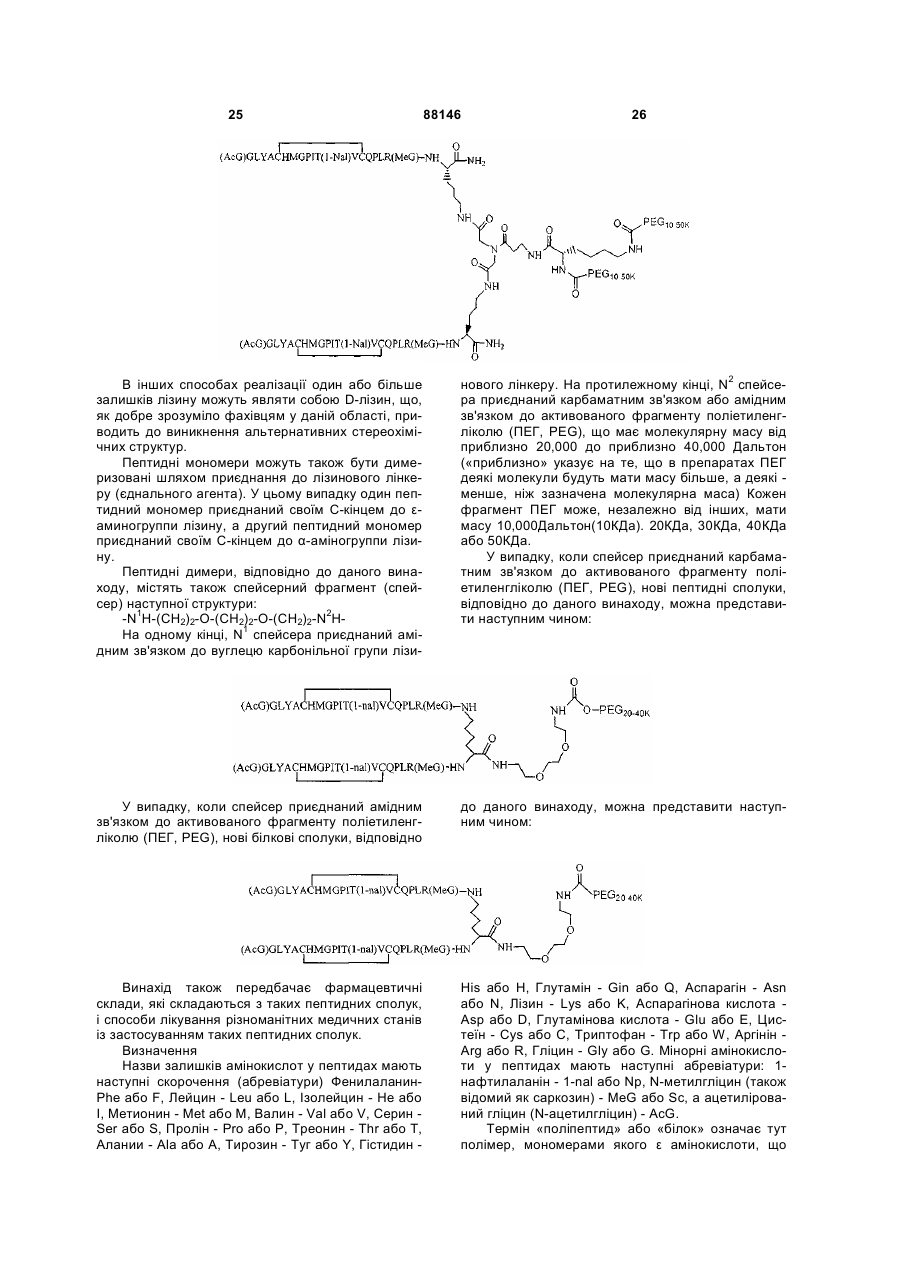
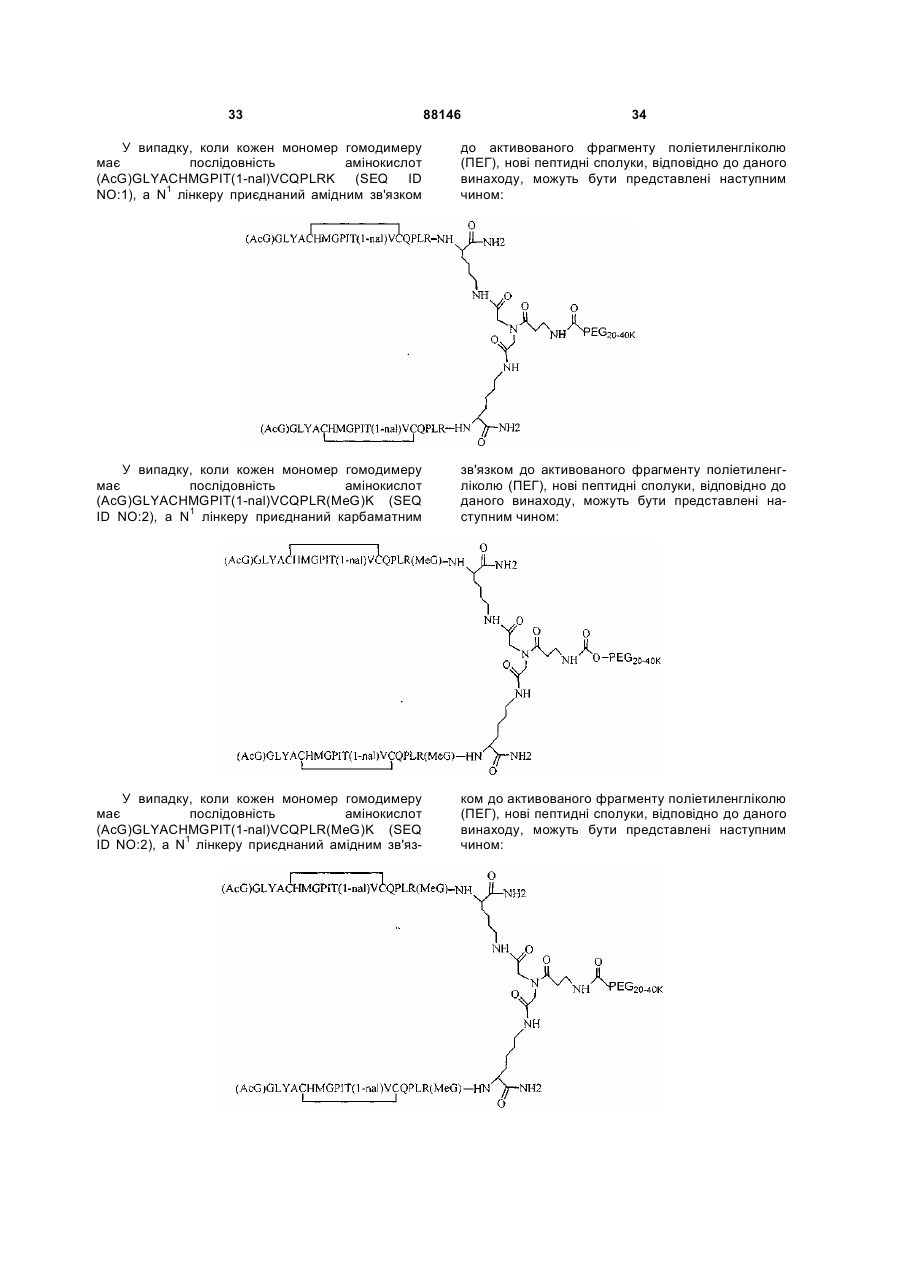
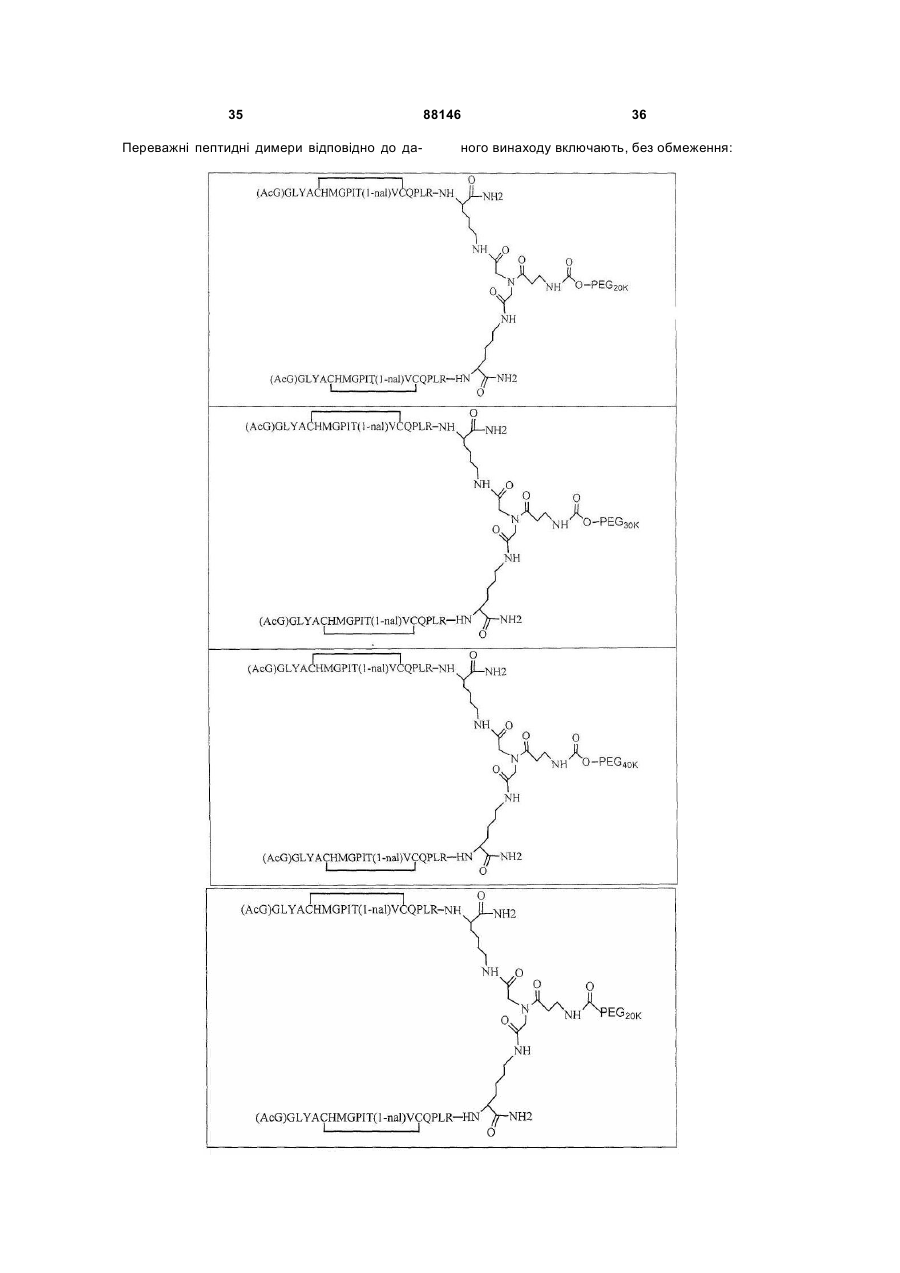
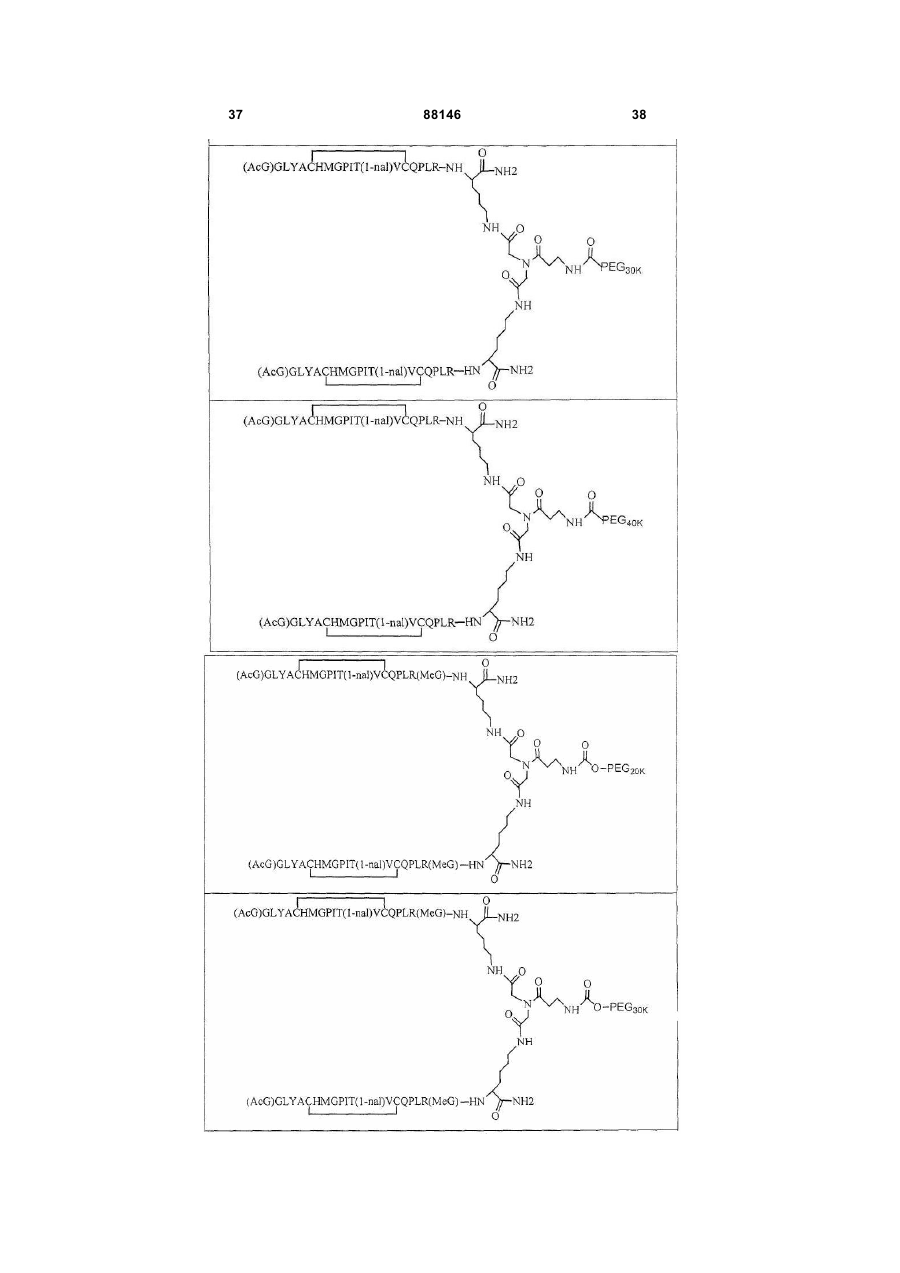
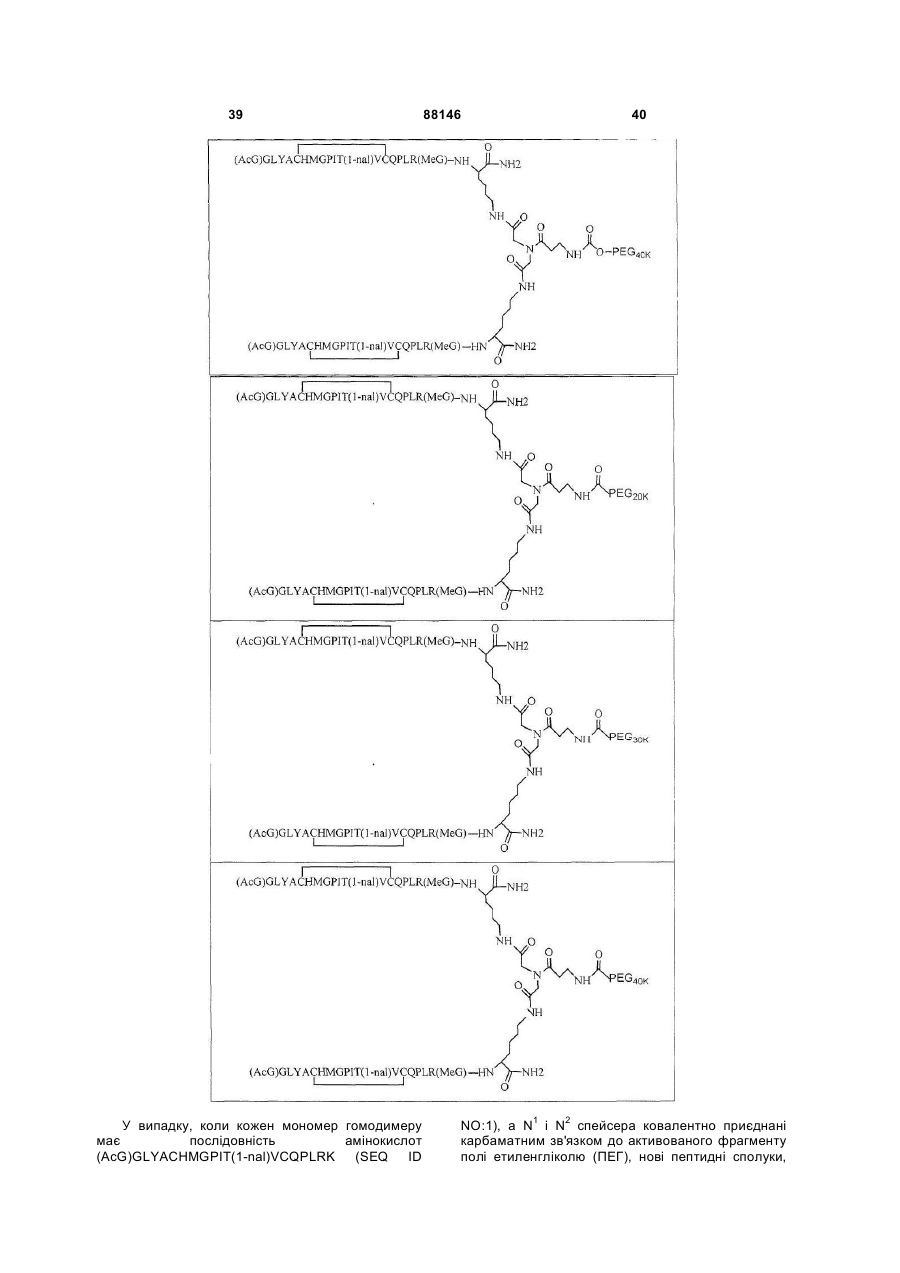
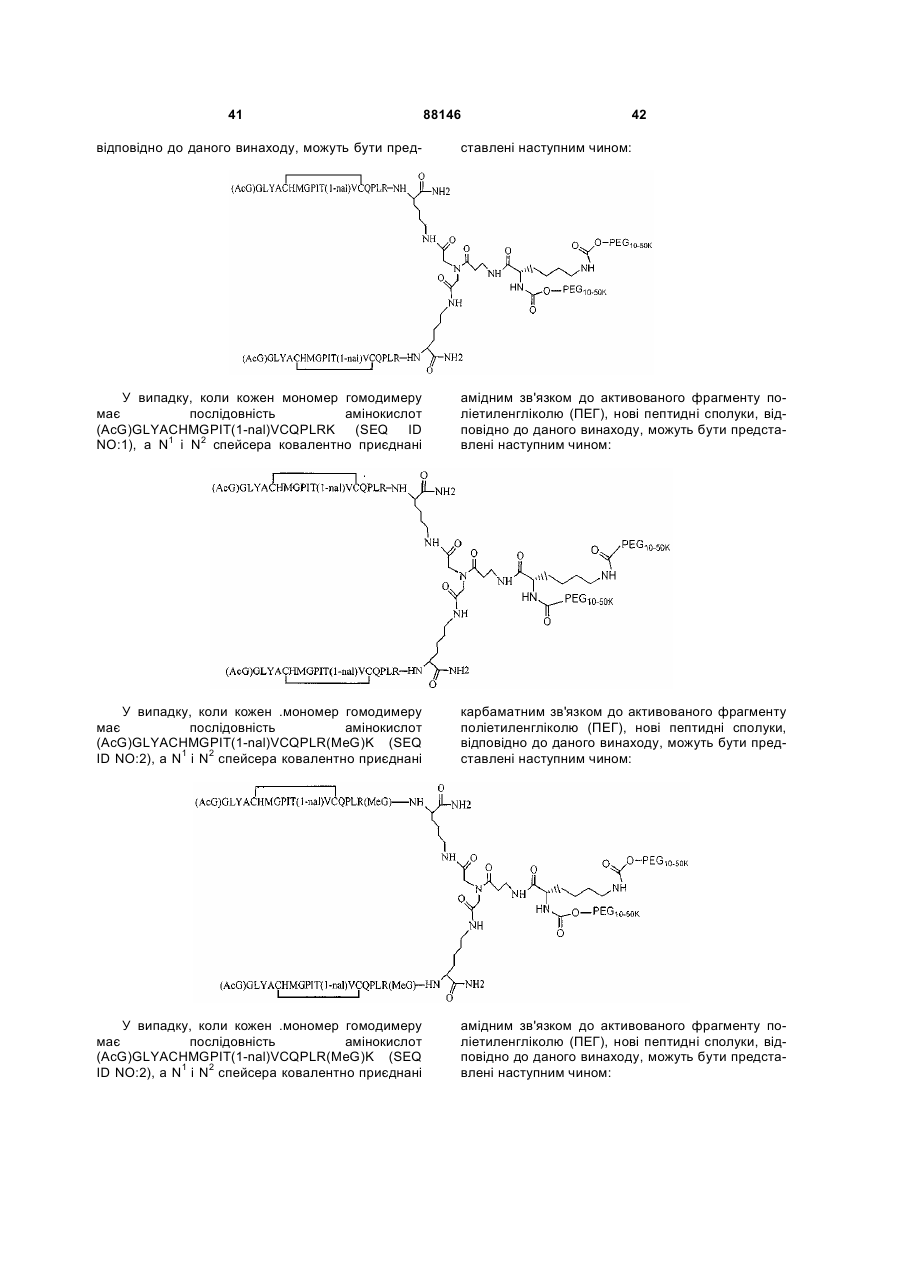
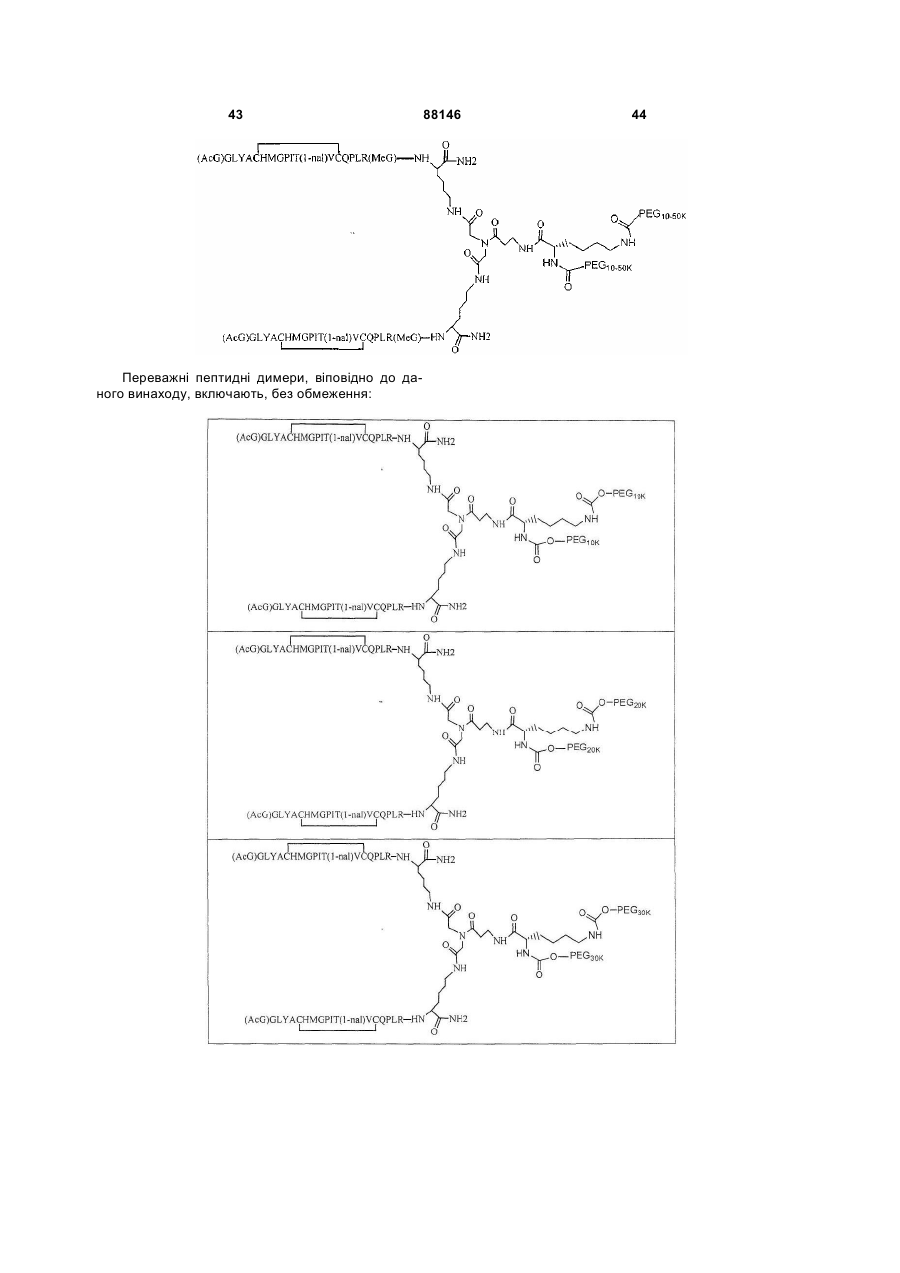
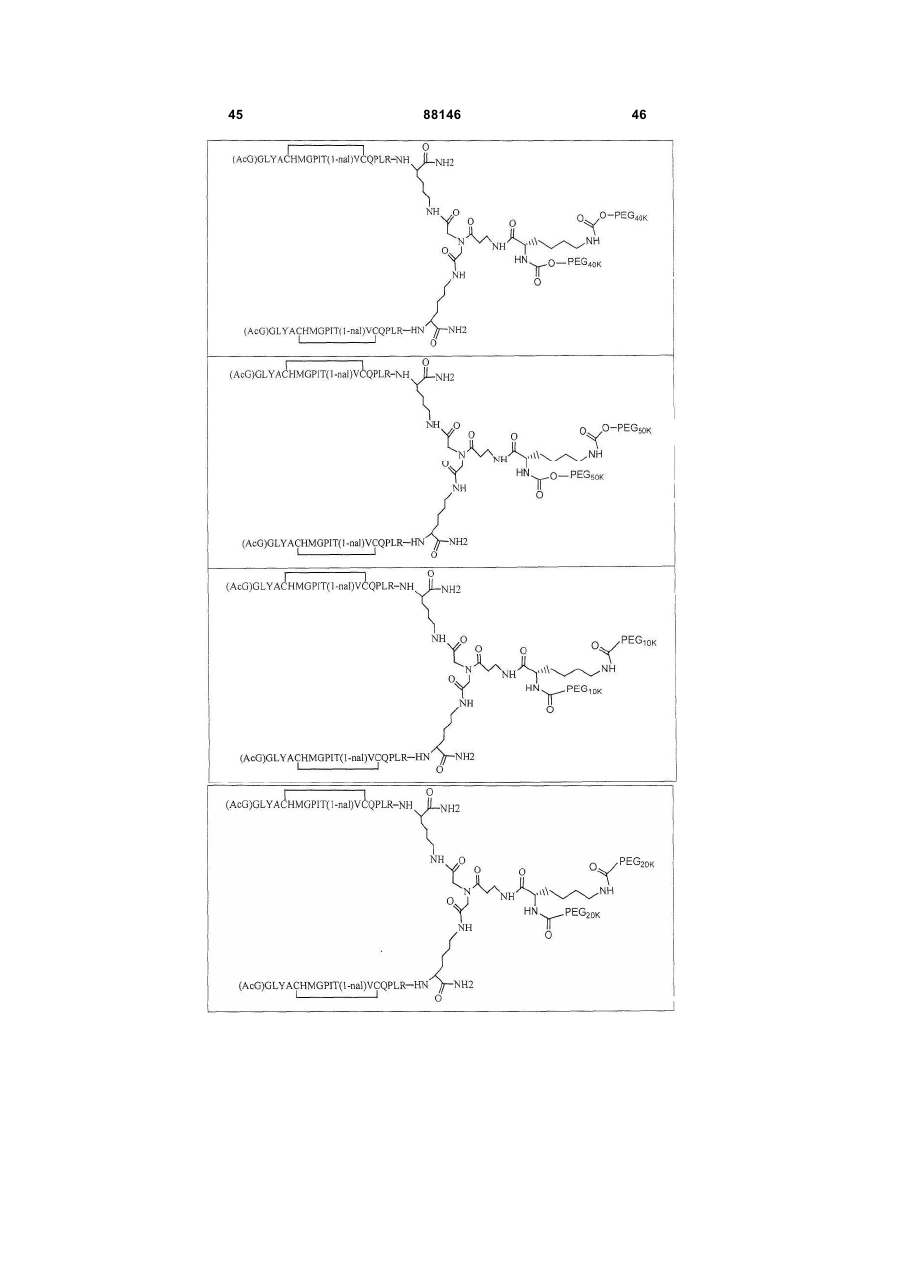
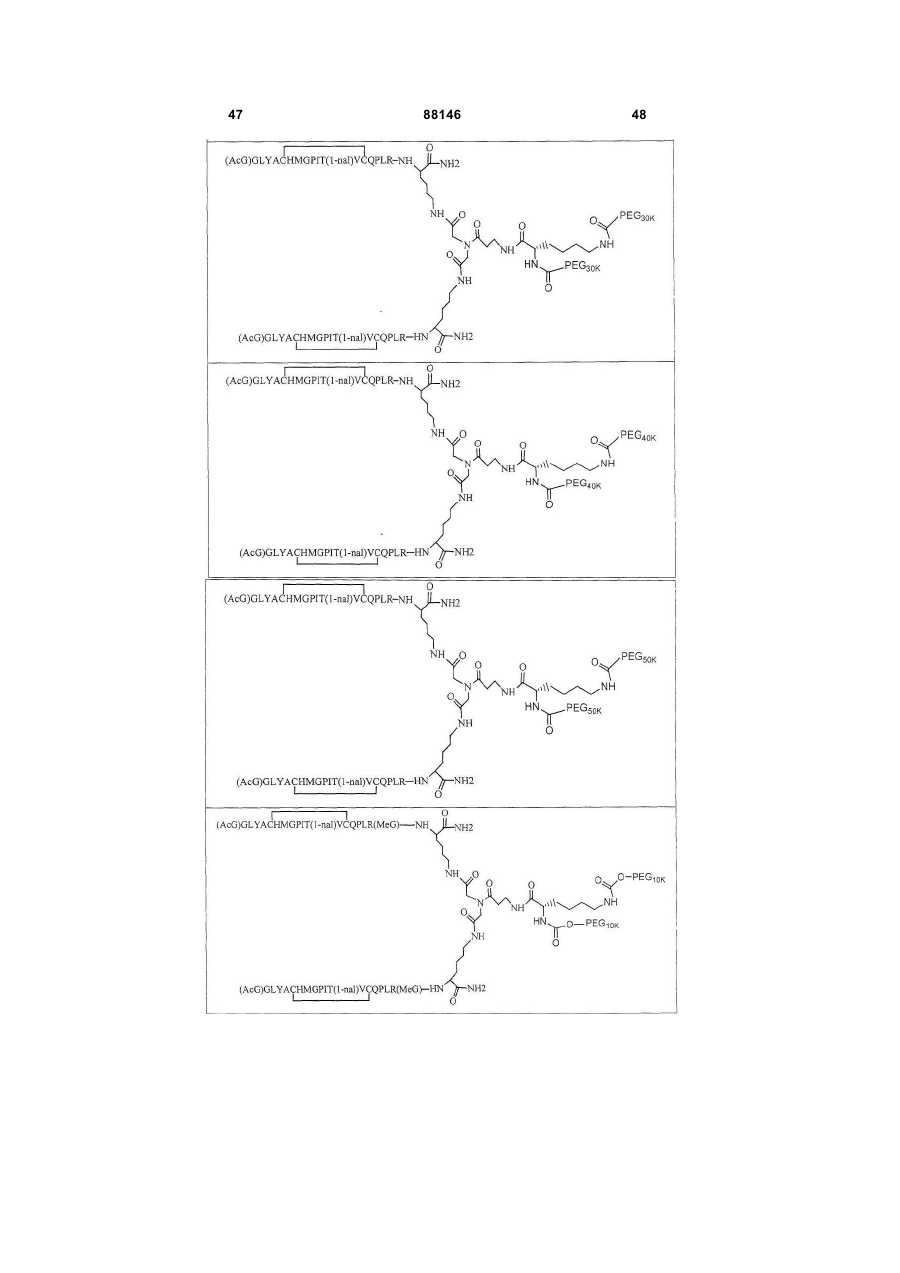
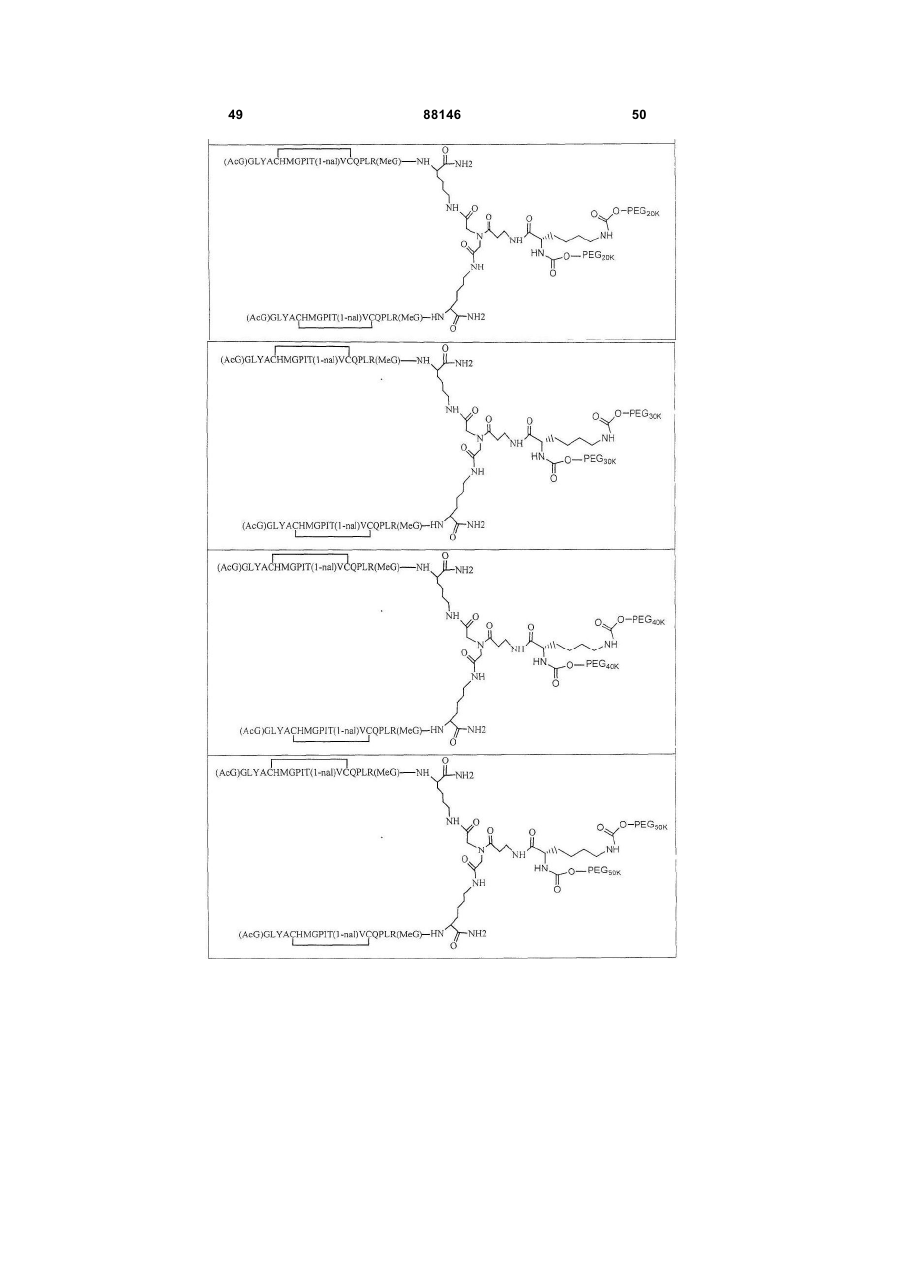
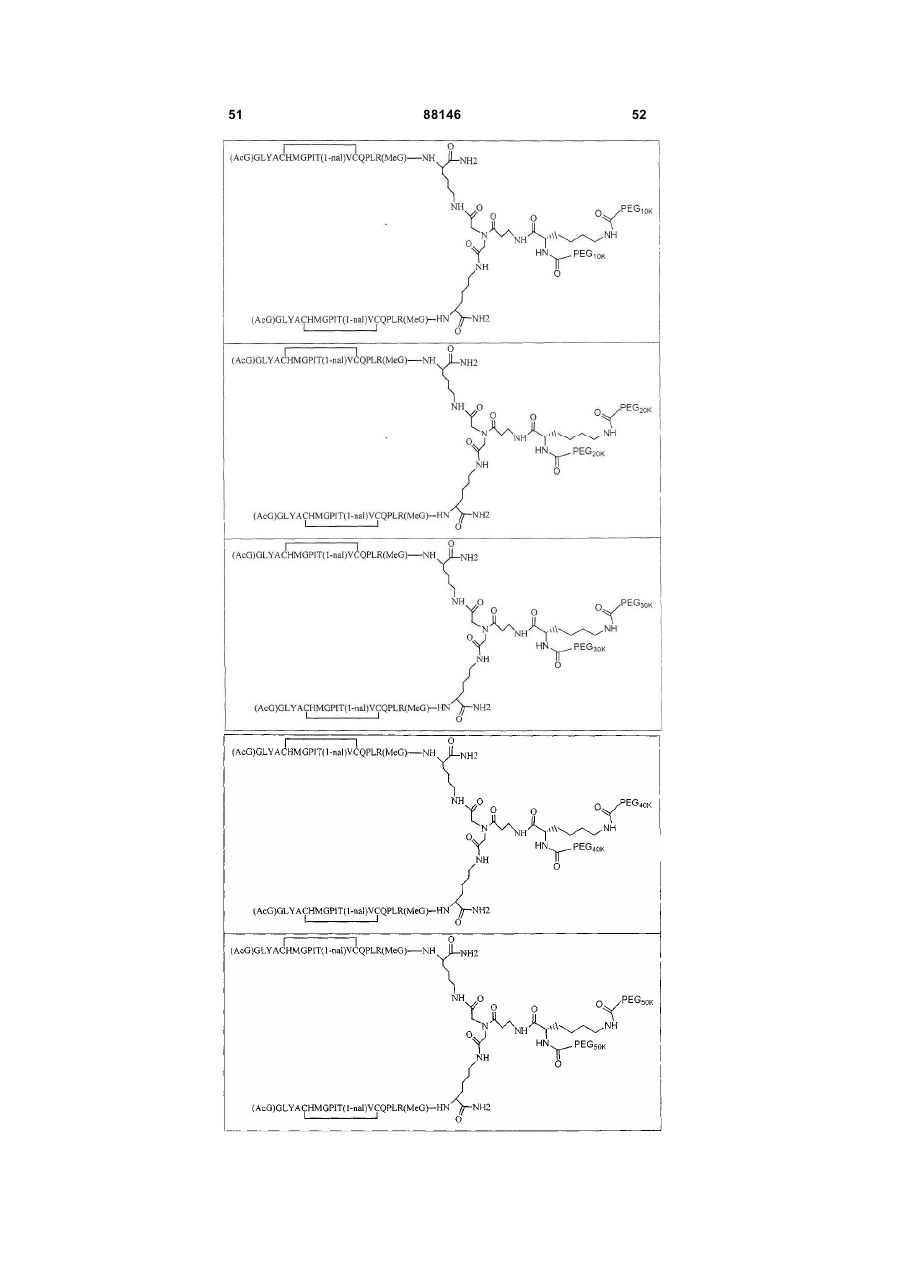
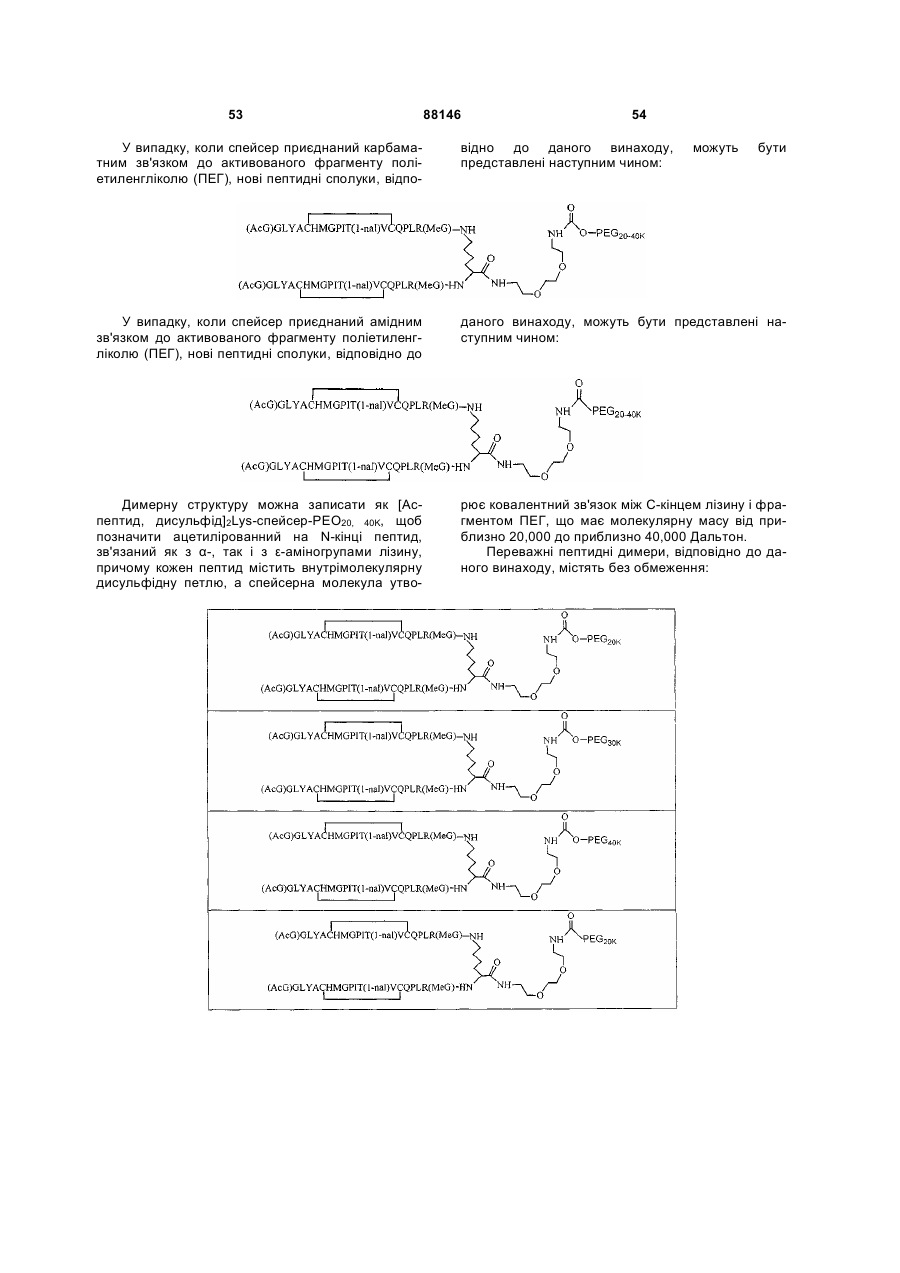
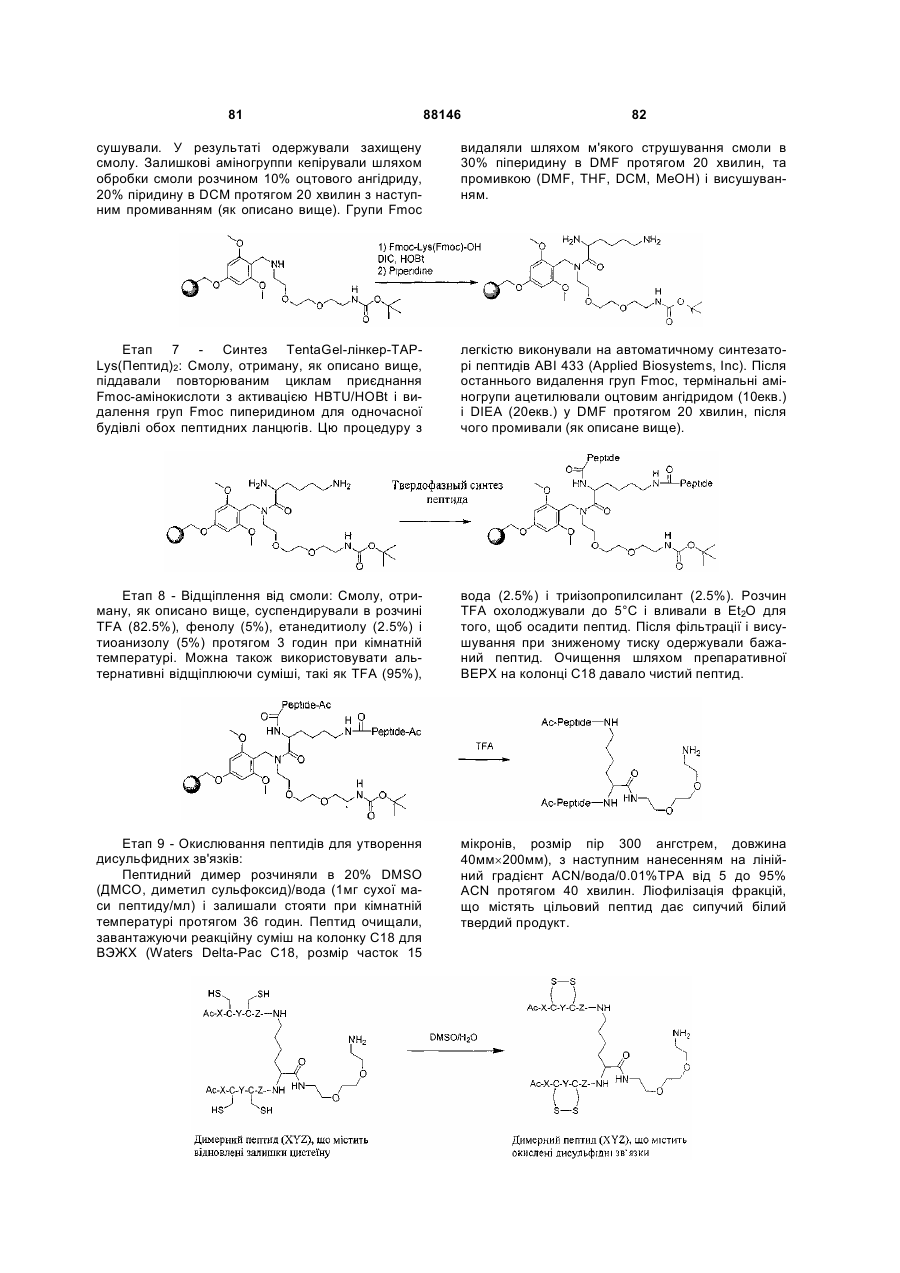
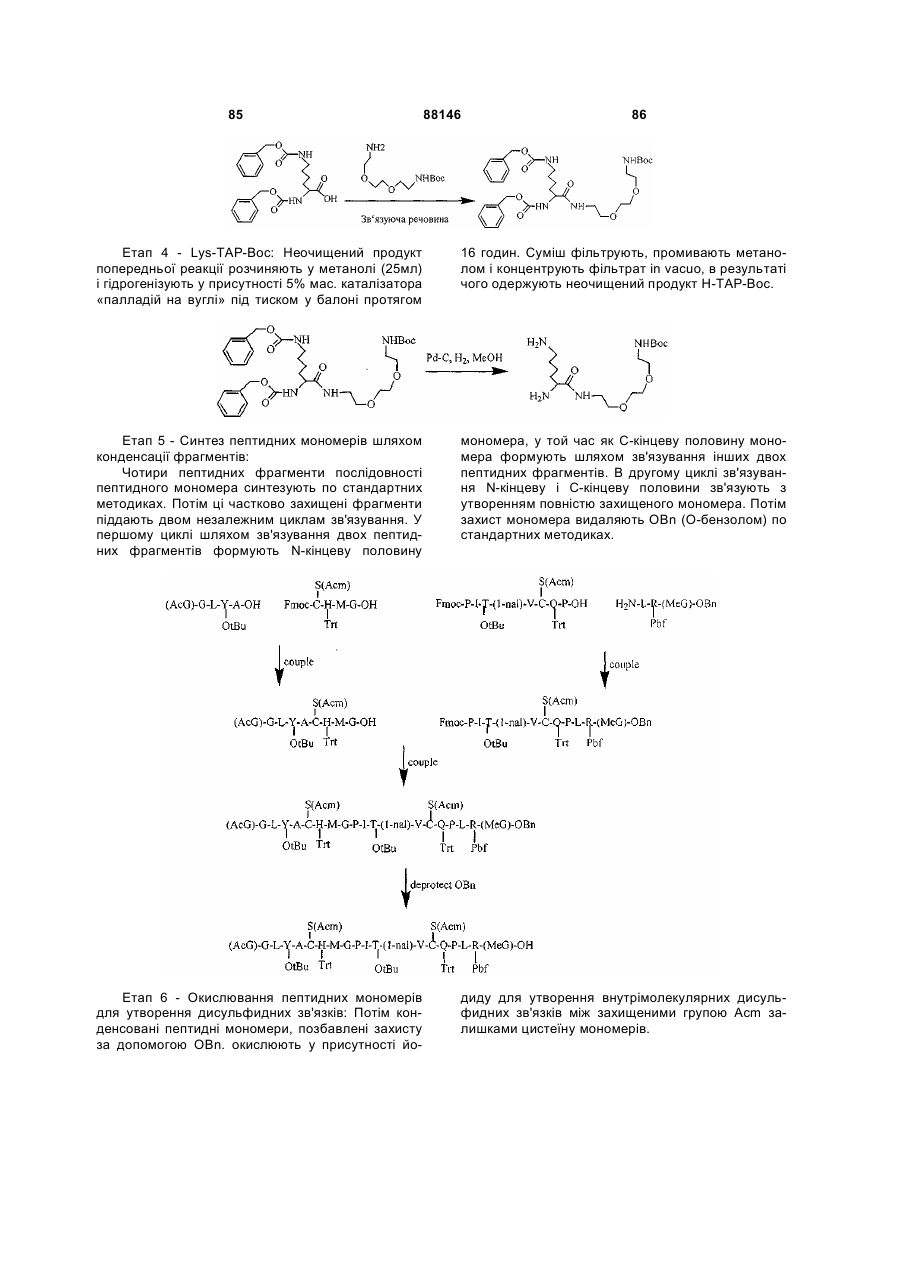
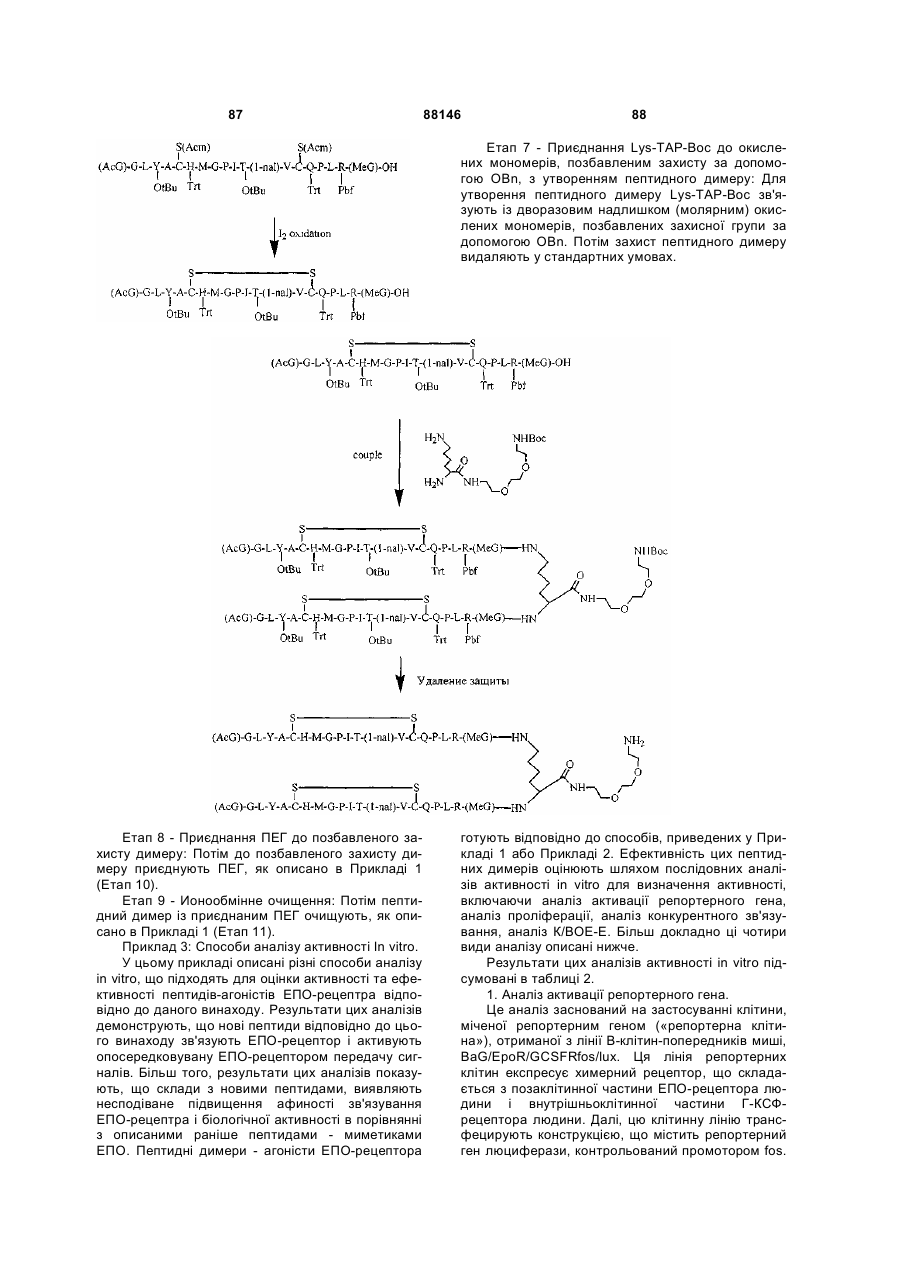
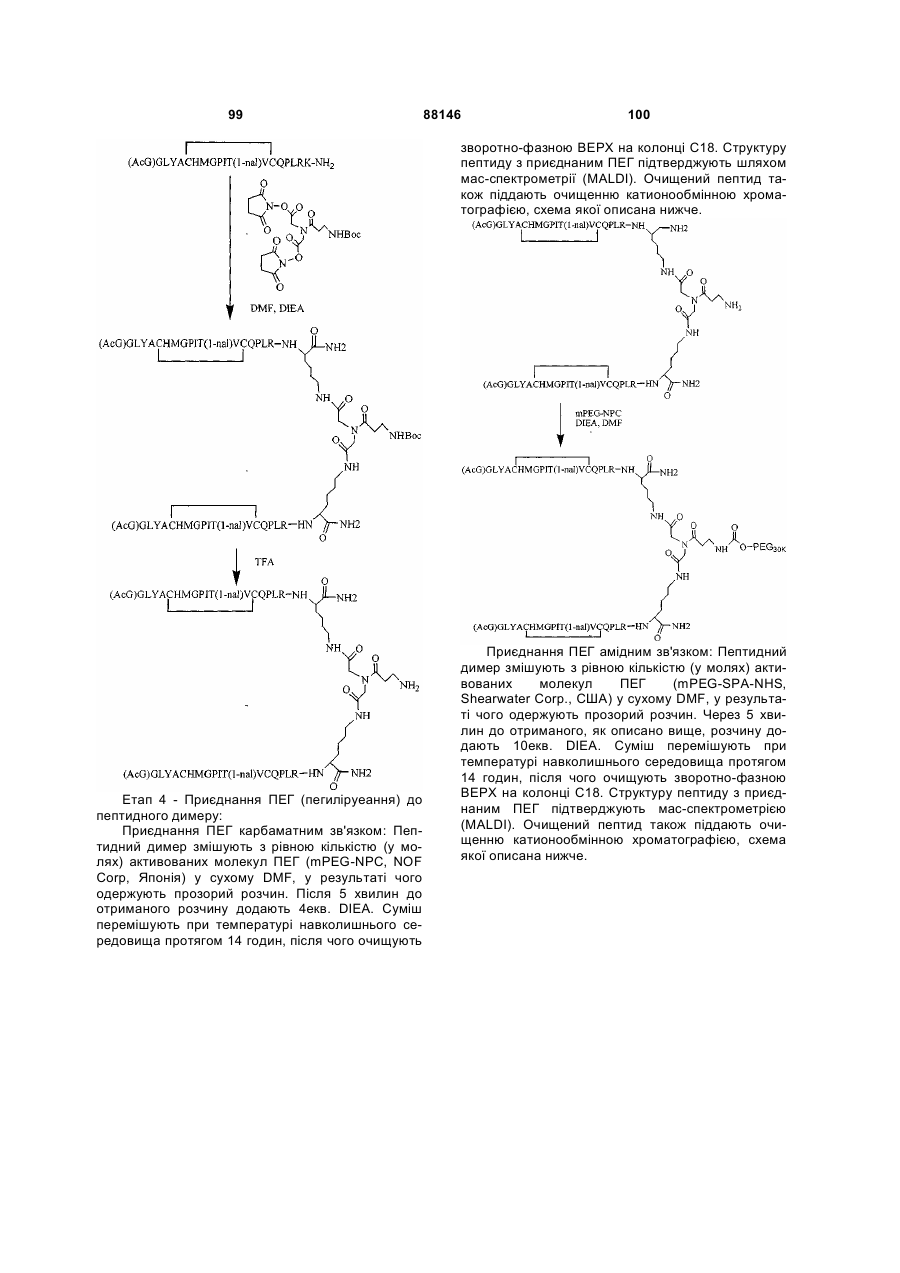
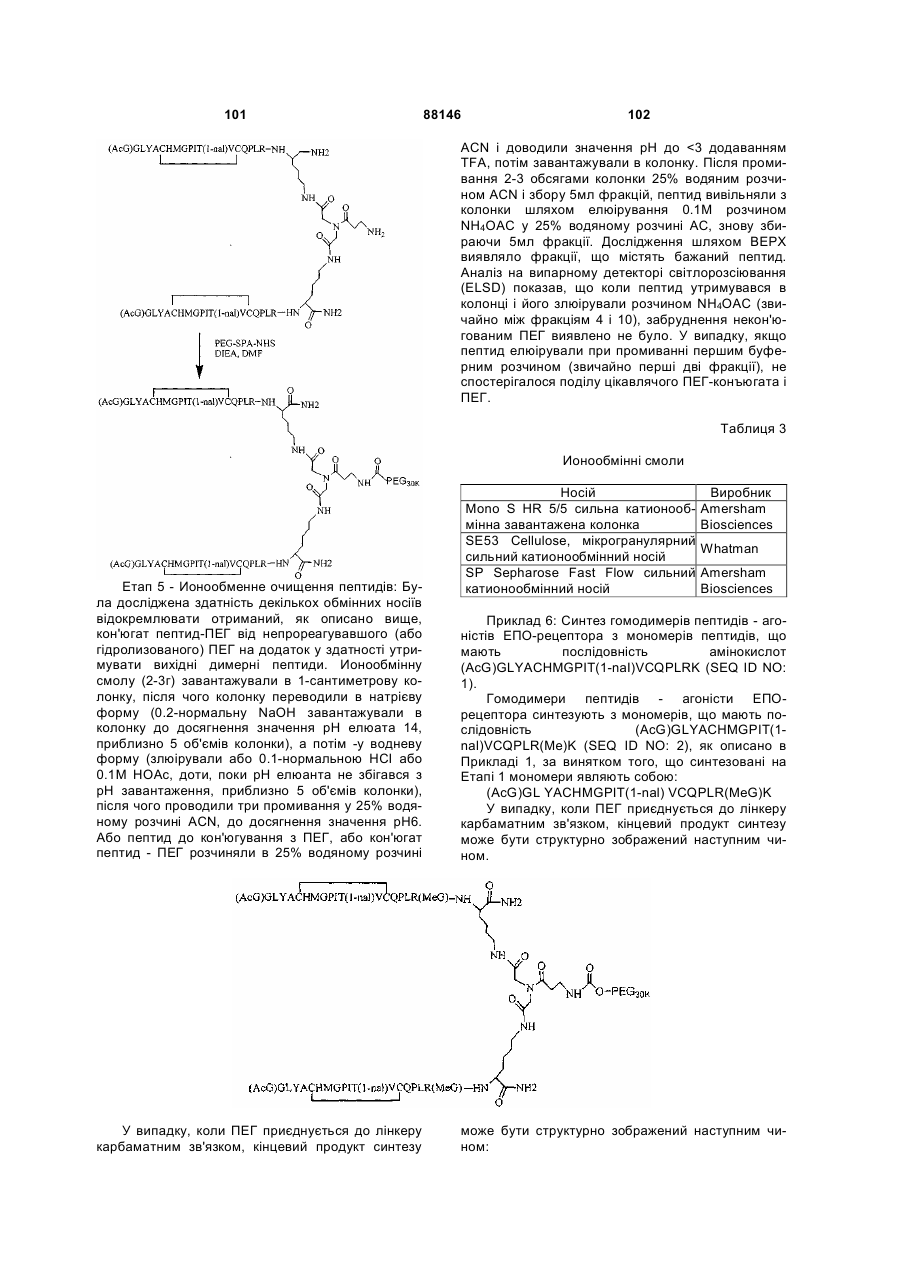
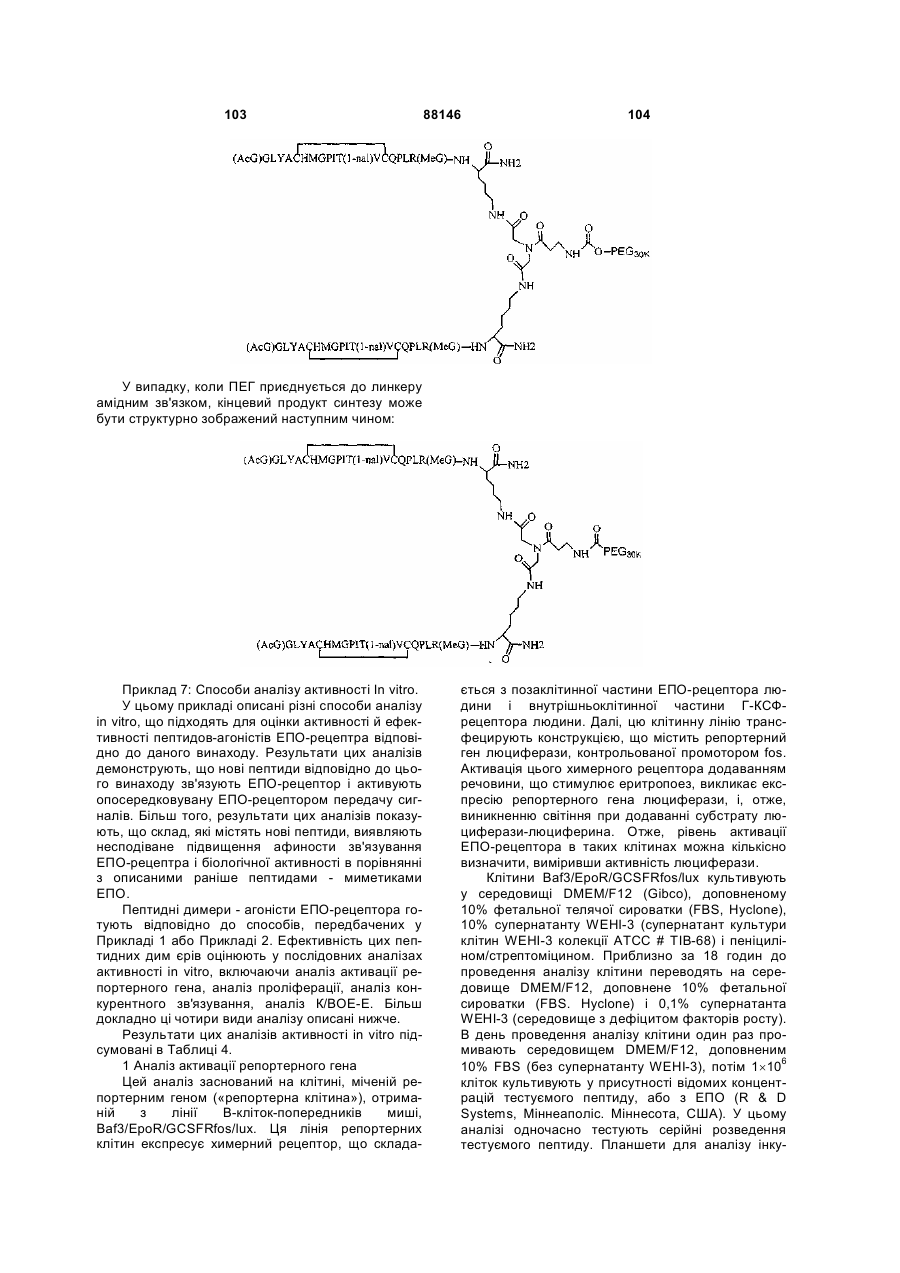
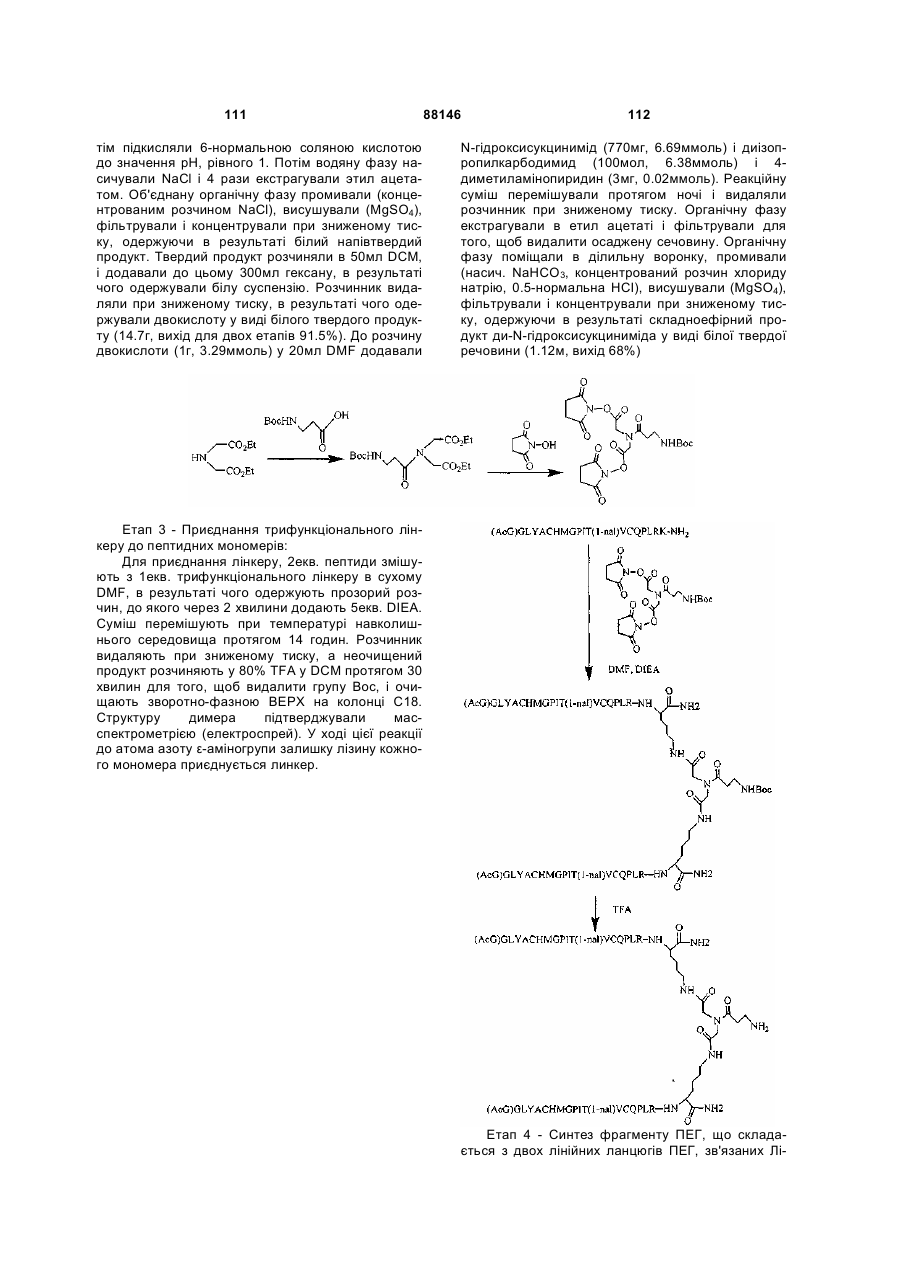
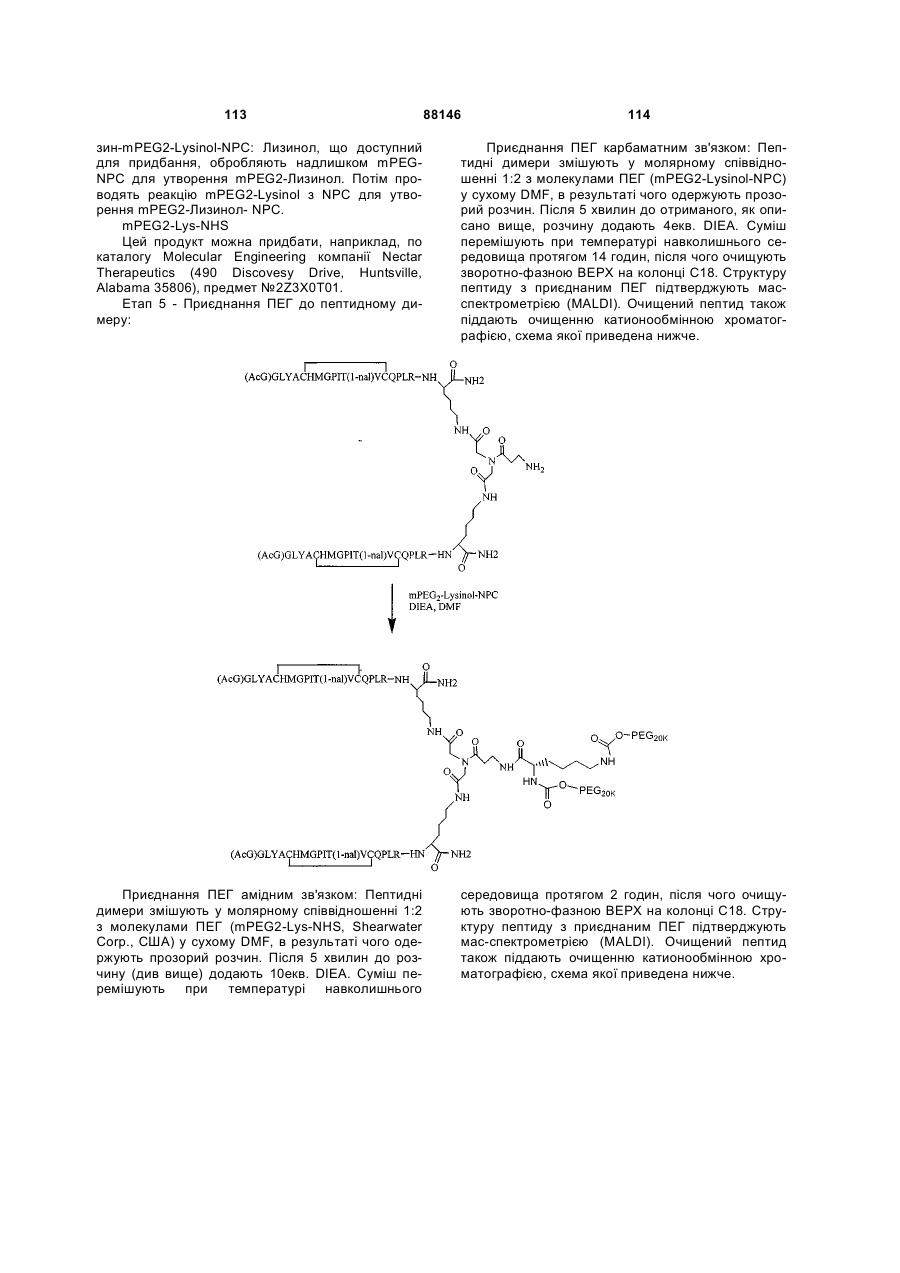
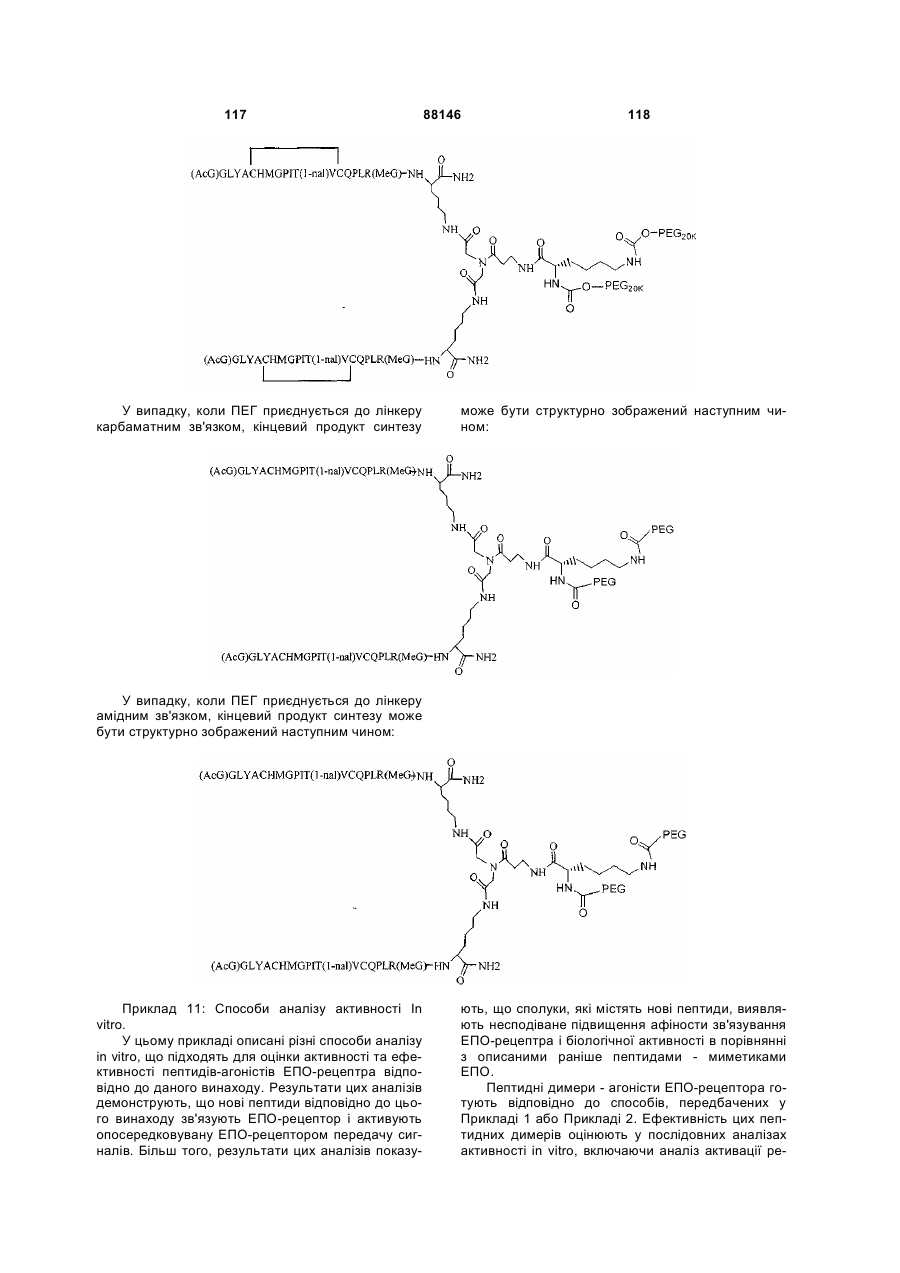
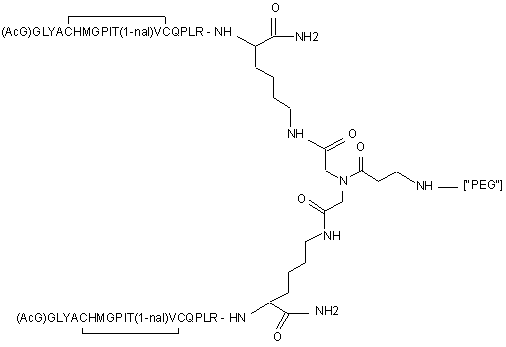
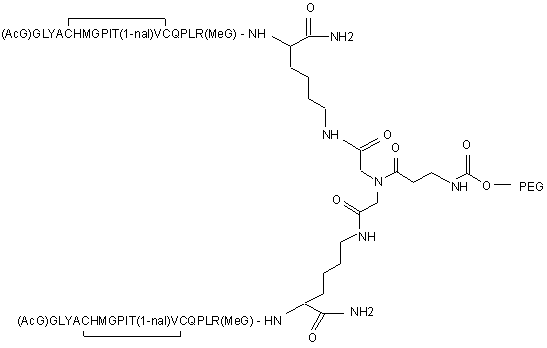
1. Сполука, яка зв'язується з рецептором до еритропоетину (EPO-R, ЕПО-рецептором) та активує його, і яка містить пептидний димер, що має формулу: C2 (21) a200511859 (22) 12.05.2004 (24) 25.09.2009 (86) PCT/US2004/014889, 12.05.2004 (31) 60/469,993 (32) 12.05.2003 (33) US (31) 60/470,244 (32) 12.05.2003 (33) US (46) 25.09.2009, Бюл.№ 18, 2009 р. (72) ХОЛЬМЕЗ КРИСТОФЕР П., US, ІІН КАН, US, ЛАЛОНДЕ ГАЙ, US, ШАЦ ПЕТЕР, US, ТУМЕЛТІ ДАВІД, US, ПАЛАНІ БАЛУ, US, ЗЕМЕДЕ ГЕМЕТ Х., US (73) АФІМАКС, ІНК., US (56) WRIGHTON N C ET AL: "INCREASED POTENCY OF AN ERYTHROPOIETIN PEPTIDE MIMETIC THROUGH COVALENT DIMERIZATION" NATURE BIOTECHNOLOGY, NATURE PUBLISHING, US, vol. 15, November 1997 (199711), pages 1261-1265. JOHNSON D L ET AL: "AMINO-TERMINAL DIMERIZATION OF AN ERYTHROPOIETIN 2 (13) 1 88146 O (AcG)GLYACHMGPIT(1-nal)VCQPLR - NH O O N O NH ["PEG"] UA NH (11) NH2 (19) NH NH2 (AcG)GLYACHMGPIT(1-nal)VCQPLR - HN O де: (і) в кожному пептидному мономері пептидного димера кожна амінокислота позначена стандарт , ною однобуквеною абревіатурою, AcG позначає Nацетилгліцин, а 1-nal позначає 1-нафтилаланін; 3 88146 (іі) кожен пептидний мономер пептидного димера містить внутрішньомолекулярний дисульфідний зв'язок між двома залишками цистеїну (С) кожного мономера; (ііі) ["PEG"] містить якнайменше один лінійний фрагмент поліетиленгліколю (PEG, ПЕГ), 4 причому кожен фрагмент ПЕГ має молекулярну масу приблизно від 20,000 до 40,000 Дальтон. 2. Сполука, яка зв'язується з рецептором до еритропоетину (EPO-R, ЕПО-рецептором) і активує його, що містить пептидний димер, який має формулу: O (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG) - NH NH2 O O NH N O NH O O PEG NH NH2 (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG) - HN O де: (і) в кожному пептидному мономері пептидного димера кожна амінокислота позначена стандартною однобуквеною абревіатурою, AcG позначає Nацетилгліцин, 1-nal позначає 1-нафтилаланін, a MeG позначає N-метилгліцин; (іі) кожен пептидний мономер пептидного димера містить внутрішньомолекулярний дисульфідний , зв'язок між двома залишками цистеїну (С) кожного мономера; (ііі) PEG містить одну лінійну нерозгалужену молекулу поліетиленгліколю (ПЕГ), яка має молекулярну масу приблизно від 20,000 до 40,000 Дальтон. 3. Сполука, яка зв'язується з рецептором до еритропоетину (EPO-R, ΕΠΟ-рецептором) і активує його, яка містить пептидний димер, що має формулу: O (AcG)GLYACHMGPIT(1-nal)VCQPLR - NH NH2 NH O O N O O NH PEG NH NH2 (AcG)GLYACHMGPIT(1-nal)VCQPLR - HN O де: (і) в кожному пептидному мономері пептидного димера кожна амінокислота позначена стандартною однобуквеною абревіатурою, AcG позначає Nацетилгліцин, а 1-nal позначає 1-нафтилаланін; (іі) кожен пептидний мономер пептидного димера містить внутрішньомолекулярний дисульфідний зв'язок між двома залишками цистеїну (С) кожного мономера; , (ііі) PEG містить лінійну нерозгалужену молекулу поліетиленгліколю, причому кожна молекула ПЕГ має молекулярну масу приблизно від 20,000 до 40,000 Дальтон. 4. Сполука, яка зв'язується з рецептором до еритропоетину (EPO-R, ЕПО-рецептором) і активує його, яка містить пептидний димер, що має формулу: 5 88146 6 O (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG) - NH NH2 NH O O O N NH O PEG NH NH2 (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG) - HN O де: (і) в кожному пептидному мономері пептидного димера кожна амінокислота позначена стандартною однобуквеною абревіатурою, AcG позначає Nацетилгліцин, 1-nal позначає 1-нафтилаланін, a MeG позначає N-метилгліцин; (іі) кожен пептидний мономер пептидного димера містить внутрішньомолекулярний дисульфідний , зв'язок між двома залишками цистеїну (С) кожного мономера; (ііі) PEG містить лінійну нерозгалужену молекулу поліетиленгліколю (ПЕГ), яка має молекулярну масу приблизно від 20,000 до 40,000 Дальтон. 5. Сполука, яка зв'язується з рецептором до еритропоетину (EPO-R, ΕΠΟ-рецептором) і активує його, яка містить пептидний димер, що має формулу: O (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG) - NH NH O PEG O O (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG) - HN NH O де: (і) в кожному пептидному мономері пептидного димера кожна амінокислота позначена стандартною однобуквеною абревіатурою, AcG позначає Nацетилгліцин, 1-nal позначає 1-нафтилаланін, a MeG позначає N-метилгліцин; (іі) кожен пептидний мономер пептидного димера містить внутрішньомолекулярний дисульфідний зв'язок між двома залишками цистеїну (С) кожного мономера; , (ііі) PEG містить лінійну нерозгалужену молекулу поліетиленгліколю, яка має молекулярну масу приблизно від 20,000 до 40,000 Дальтон. 6. Сполука згідно з будь-яким з пп. 1-5, в якій PEG має молекулярну масу, що дорівнює приблизно 30,000 Дальтон. 7. Сполука, яка зв'язується з рецептором до еритропоетину (EPO-R, ΕΠΟ-рецептором) і активує його, яка містить пептидний димер, що має формулу: O (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG) - NH NH PEG O O (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG) - HN NH O де: (і) в кожному пептидному мономері пептидного димера кожна амінокислота позначена стандартною однобуквеною абревіатурою, AcG позначає Nацетилгліцин, 1-nal позначає 1-нафтилаланін, a MeG позначає N-метилгліцин; , (іі) кожен пептидний мономер пептидного димера містить внутрішньомолекулярний дисульфідний зв'язок між двома залишками цистеїну (С) кожного мономера; (ііі) PEG містить лінійну нерозгалужену молекулу поліетиленгліколю, яка має молекулярну масу приблизно від 20,000 до 40,000 Дальтон. 7 88146 8. Сполука, яка зв'язується з рецептором до еритропоетину (EPO-R, ЕПО-рецептором) і активує 8 його, яка містить пептидний димер, що має формулу: O (AcG)GLYACHMGPIT(1-nal)VCQPLR - NH NH2 O O NH N ["PEG"] NH O NH NH2 (AcG)GLYACHMGPIT(1-nal)VCQPLR - HN O де: (і) в кожному пептидному мономері пептидного димера кожна амінокислота позначена стандартною однобуквеною абревіатурою, AcG позначає Nацетилгліцин, а 1-nal позначає 1-нафтилаланін; (іі) кожен пептидний мономер пептидного димера містить внутрішньомолекулярний дисульфідний зв'язок між двома залишками цистеїну (С) кожного мономера; , (ііі) ["PEG"] містить щонайменше два лінійних нерозгалужених фрагменти поліетиленгліколю (ПЕГ), зв'язаних в одній точці з'єднання і таких, що мають загальну молекулярну масу приблизно від 10,000 до 60,000 Дальтон. 9. Сполука, яка зв'язується з рецептором до еритропоетину (EPO-R, ЕПО-рецептором) і активує його, яка містить пептидний димер, що має формулу: O (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG) - NH NH2 O O NH N O PEG O NH2 O де: (і) в кожному пептидному мономері пептидного димера кожна амінокислота позначена стандартною однобуквеною абревіатурою, AcG позначає Nацетилгліцин, 1-nal позначає 1-нафтилаланін, a MeG позначає N-метилгліцин; (іі) кожен пептидний мономер пептидного димера містить внутрішньомолекулярний дисульфідний PEG NH NH HN NH (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG) - HN O O , зв'язок між двома залишками цистеїну (С) кожного мономера; (ііі) PEG містить два лінійних фрагменти поліетиленгліколю (ПЕГ), що мають в сумі молекулярну масу приблизно від 10,000 до 30,000 Дальтон. 10. Сполука, яка зв'язується з рецептором до еритропоетину (EPO-R, ЕПО-рецептором) і активує його, яка містить пептидний димер, що має формулу: 9 88146 10 O (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG) - NH NH2 O O NH O N NH O H N NH (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG) - HN PEG O O PEG NH O O NH2 O , де: (і) в кожному пептидному мономері пептидного димера кожна амінокислота позначена стандартною однобуквеною абревіатурою, AcG позначає Nацетилгліцин, а 1-nal позначає 1-нафтилаланін; (іі) кожен пептидний мономер пептидного димера містить внутрішньомолекулярний дисульфідний зв'язок між двома залишками цистеїну (С) кожного мономера; (ііі) PEG містить два лінійних фрагменти поліетиленгліколю (ПЕГ), що мають в сумі молекулярну масу приблизно від 10,000 до 30,000 Дальтон. 11. Сполука, яка зв'язується з рецептором до еритропоетину (EPO-R, ЕПО-рецептором) і активує його, яка містить пептидний димер, що має формулу: O (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG) - NH NH2 O O NH N O PEG O NH2 O де: (і) в кожному пептидному мономері пептидного димера кожна амінокислота позначена стандартною однобуквеною абревіатурою, AcG позначає Nацетилгліцин, 1-nal позначає 1-нафтилаланін, a MeG позначає N-метилгліцин; (іі) кожен пептидний мономер пептидного димера містить внутрішньомолекулярний дисульфідний зв'язок між двома залишками цистеїну (С) кожного мономера; PEG NH NH HN NH (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG) - HN O O , (ііі) PEG містить два лінійних фрагменти поліетиленгліколю (ПЕГ), що мають в сумі молекулярну масу приблизно від 10,000 до 30,000 Дальтон. 12. Сполука згідно з будь-яким з пп. 7-11, в якій кожен PEG має молекулярну масу приблизно 20,000 Дальтон. 13. Сполука, яка зв'язується з рецептором до еритропоетину (EPO-R, ЕПО-рецептором) і активує його, яка містить пептидний димер, що має формулу: 11 88146 12 O (AcG)GLYACHMGPIT(1-nal)VCQPLR - NH NH2 NH O O O N O NH O PEG NH NH2 (AcG)GLYACHMGPIT(1-nal)VCQPLR - HN O де: (і) в кожному пептидному мономері пептидного димера кожна амінокислота позначена стандартною однобуквеною абревіатурою, AcG позначає Nацетилгліцин, а 1-nal позначає 1-нафтилаланін; (іі) кожен пептидний мономер пептидного димера містить внутрішньомолекулярний дисульфідний зв'язок між двома залишками цистеїну (С) кожного мономера; , (ііі) PEG містить лінійний нерозгалужений фрагмент поліетиленгліколю (ПЕГ), що має молекулярну масу приблизно від 20,000 до 40,000 Дальтон. 14. Сполука, яка зв'язується з рецептором до еритропоетину (EPO-R, ЕПО-рецептором) і активує його, яка містить пептидний димер, що має формулу: O NH2 (AcG)GLYACHMGPIT(1-nal)VCQPLR - NH O O NH N O PEG NH NH O HN NH O O O PEG O NH2 (AcG)GLYACHMGPIT(1-nal)VCQPLR - HN O де: (і) в кожному пептидному мономері пептидного димера кожна амінокислота позначена стандартною однобуквеною абревіатурою, AcG позначає Nацетилгліцин, а 1-nal позначає 1-нафтилаланін; (іі) кожен пептидний мономер пептидного димера містить внутрішньомолекулярний дисульфідний зв'язок між двома залишками цистеїну (С) кожного мономера; (ііі) PEG містить два лінійних фрагменти поліетиленгліколю (ПЕГ), що мають в сумі молекулярну масу приблизно від 10,000 до 60,000 Дальтон. 15. Спосіб лікування пацієнта з порушенням, яке характеризується дефіцитом еритропоетину або пониженою чи недостатньою популяцією еритро , цитів, який включає введення пацієнту терапевтично ефективної кількості сполуки за будь-яким з пп. 1-14. 16. Спосіб згідно з п. 15, в якому порушення вибирають з групи, яка складається з термінальної стадії ниркової недостатності або діалізу, анемії на фоні СНІДу, аутоімунного захворювання чи злоякісного захворювання, ушкодження спинного мозку, гострої втрати крові, старіння і станів пухлинних захворювань, що супроводжуються порушеним еритропоезом. 17. Фармацевтичний склад, який містить сполуку за будь-яким з пп. 1-14 і фармацевтично прийнятний носій. 13 Даний винахід відноситься до пептидних сполук, які є агоністами рецептору до еритропоетину (EPO-R, ΕΠΟ-рецептора). Даний винахід також відноситься до терапевтичних способів, у яких такі пептидні сполуки застосовують для лікування порушень, асоційованих з недостатньою або дефіцитною продукцією еритроцитів. Також передбачені фармацевтичні склади, які містять пептидні сполуки відповідно до даного винаходу. Еритропоетин (ΕΠΟ) являє собою гормон глікопротеінової природи, який складається з 165 амінокислот, з молекулярною масою приблизно 34 кілодальтон (кДа) і переважними сайтами глікозилірування в 24, 38, 83 і 126 положеннях амінокислот. ΕΠΟ спочатку синтезується у вигляді білкапопередника із сигнальним пептидом з 23 амінокислот. Еритропоетин існує в трьох формах: α-, β- і асиало-. Форми α- і β- трохи різні у своїй вуглеводній частині, але мають однакову ефективність, біологічну активність і молекулярну масу. Асиалоформа являє собою α- або β-форму без кінцевого вуглеводу (сиалової кислоти). Послідовності ДНК, що кодують еритропоетин були описані раніше (Патент США U.S. Pat. No 4,703,008, виданий Lin). ΕΠΟ стимулює мітотичне ділення і диференціацію кліток-попередників еритроцитів, що забезпечує продукцію еритроцитів. Продукція ΕΠΟ відбувається у нирках в умовах гіпоксії. У ході індуцируємої еритропоетином диференціації кліток-попередників еритроцитів відбувається індукція синтезу глобіну, стимуляція синтезу геммісткого комплексу і збільшення числа рецепторів до феритину. Ці зміни дозволяють клітині поглинати більше заліза і синтезувати функціонально активний гемоглобін, який зв'язує кисень у зрілих еритроцитах. Отже, еритроцити і їхній гемоглобін відіграють ключову роль у постачанні організму киснем. Ці зміни ініційовані взаємодією еритропоетину з відповідним рецептором на поверхні клітинпопередників еритроцитів [Див., наприклад., Graber, Krantz (1978) Ann. Rev. Med. 29.51-66]. Якщо організм знаходиться в здоровому стані, коли існуюче число еритроцитів забезпечує достатню оксигенацію тканин, еритропоетин є присутнім у плазмі в дуже низьких концентраціях. Ці нормальні низькі концентрації достатні для стимуляції заміщення еритроцитів, що природним образом гинуть в результаті старіння. Кількість ΕΠΟ в циркулюючій крові зростає в умовах гіпоксії, коли транспорт кисню еритроцитами в циркулюючій крові знижений. Гіпоксія може бути викликана, наприклад, значною втратою крові внаслідок кровотечі, руйнуванням еритроцитів при передозуванні радіації, зменшенням кількості кисню при вдиханні внаслідок перебування на великій висоті або тривалою непритомністю, або різними формами анемії. У відповідь на гіпоксичний стрес підвищення рівня ΕΠΟ збільшує продукцію еритроцитів шляхом стимуляції проліферації еритроїдних попередників. Коли кількість еритроцитів перевищує кількість, необхідну для задоволення 88146 14 нормальної потреби тканин у кисні, відбувається зниження рівня ΕΠΟ в циркулюючій крові. Оскільки ΕΠΟ необхідний для утворення еритроцитів, існують потенційно корисні застосування цього гормону як у діагностиці, так і в лікуванні хвороб крові, які характеризуються низькою, або дефіцитною (недостатньою) продукцією еритроцитів Недавні дослідження забезпечили основу для планування ефективного терапевтичного застосування ΕΠΟ в лікуванні різноманітних хворобливих станів, порушень і етапів з гематологічними розладами, включаючи: бета-таласемію [Див. Vedovato, et al. (1984) Acta. Haematol. 71: 211-213], кистозний фіброз (муковисцедоз) [Див. Vichinsky, et al. (1984) J. Pediatric 105:15-21], порушення менструального циклу і вагітності [Див. Cotes, el al. (193) Brit. J. Ostet. Gyneacol. 90:304-311], анемію недоношених дітей [Див. Haga, et al. (1983) Acta Pediatr. Scand. 72; 827-831], ушкодження спиного мозку [Див. Claus-Walker, et al. (1984) Arch. Phys. Med. Rehabil. 65:370-374], космічний політ [Див. Dunn, et al. (1984) Eur. J. Appl. Physiol. 52:178-182], гостру втрату крові [Див., Miller, et al. (1982) Brit. J. Haematol. 52:545-590], старіння [Див. Udupa, et al. (1984) J. Lab. Clin. Med. 103:574-580 і 581-588, a також Lipschitz, et al. (1983) Blood 63: 502-509], різні пухлинні захворювання, які супроводжуються порушеним еритропоезом [Див. Dainiak, el al. (1983) Cancer 5:1101-1106, а також Schwartz, et al. (1983) Otolaryngol. 109: 269-272], а також ниркову недостатність [Див. Eschbach. et al. (1987) N. Eng. J. Med. 316: 73-78]. Був описаний очищений однорідний ΕΠΟ [Патент США U.S. Pal. No.4,677,195. Hewick]. Послідовність ДНК, яка кодує ΕΠΟ була очищена, клонована і експресована, в результаті чого були отримані рекомбінантні поліпептиди, які мають біохімічні й імунологічні властивості природного ΕΠΟ. Також була отримана молекула рекомбінантного ΕΠΟ з олігосахаридами, ідентичними олігосахаридам природного ΕΠΟ [См. Sasaki, etal. (1987) J. Biol. Chem. 262:12059-12076]. Виявилося, що біологічна дія ΕΠΟ частково опосередкована взаємодією з мембранопов'язаним клітинним рецептором. Первісні дослідження на незрілих еритроідних клітинах, виділених із селезінки миші, дозволили припустити, що білки, які зв'язують ΕΠΟ, на поверхні клітини містять два поліпептиди, які мають молекулярні маси, рівні приблизно 85,000 Дальтон і 100,000 Дальтон, відповідно [Sawyer, et al. (1987) Proc. Natl. Acad. Sci. USA 84:3690-3694]. Розрахункове число сайтів зв'язування ΕΠΟ склало в середньому від 800 до 1000 на поверхні однієї клітки. З цих сайтів зв'язування приблизно 300 зв'язувало ΕΠΟ із Kd, рівною приблизно 90пМ (пікомоль), у той час як інші зв'язували ΕΠΟ зі зниженої афіністю, рівною приблизно 570пМ [Sawyer, et al. (1987) J. Biol. Chem. 262:5554-5562]. Незалежне дослідження дозволило припустити, що ΕΠΟ-чутливі еритробласти отримані із селезінки мишей, яким ін'єкцією вводили ослаблений штам (FVA) вірусу лейкозу Оренда, 15 володіють високо- і низькоаффінними сайтами зв'язування ΕΠΟ загальним числом приблизно 400, причому значення Kd складають 10пМ і 800пМ для високо- і низькоафінних сайтів відповідно [Landschulz, el al. (1989) Blood 73: 1476-1486]. Наступна робота показала, що один ген кодує дві форми рецептора до ΕΠΟ (ΕΠΟ-рецептора). Цей ген було клоновано [Див, наприклад, Jones, et al. (1990) Blood 76, 31-35, Noguchi, et al. (1991) Blood 78:2548-2556; Maouche, et al. (1991) Blood 78: 2557-2563]. Наприклад, послідовності ДНК і кодовані пептидні послідовності для білків ЕПОрецептора миші і людини описані в публікації РСТ номер WO 90/08822 (D'Andrea, et al.). Сучасні моделі припускають, що зв'язування ΕΠΟ з ΕΠΟрецептором призведе до димеризації й активації двох молекул ΕΠΟ-рецептора, що приводить до ряду послідовних етапів передачі сигналу [Див., наприклад, Watowich, et al. (1992) Proc. Natl. Acad. Sci. USA 89: 2140-2144]. Доступність клонованих генів ΕΠΟ-рецептора полегшує пошук агоністів і антагоністів цього важливого рецептора. Доступність рекомбінантного білка рецептора дозволяє вивчати лігандрецепторні взаємодії у великій кількості систем випадкової і напівдовшьної генерації різноманітних білків. Ці системи включають систему «пептиди на плазмідах» [описана в Патенті США U.S. Pat. No.6,270,170], систему «пептиди на фагі» [описана в Патенті США U.S. Pat. No.5,432,018 і Cwirla, et al. (1990) Proc. Natl. Acad. Sci. USA 87: 6378-6382], систему «бібліотека кодованих синтетичних пептидів» [описана в заявці на Патент США U.S. patent application Ser. No.946,239, поданій 16 вересня 1992] і систему «синтез іммобілізованих полімерів у дуже великих масштабах» [описана в Патенті США U.S. Pat. No.5,143,854, публікації РСТ Pub. No.90/15070; Fodor. et al. (1991) Science 251:767-773; Dower, Fodor (1991) Ann. Rep. Med. Chem. 26:271-180; і Патенті США U.S. Pat. No.5,424,186]. Були ідентифіковані пептиди, які щонайменше, у деякій мірі взаємодіють з ЕПО-рецептором. Ці білки описані, наприклад, в Патентах США U.S. Pat. Nos.5,773,569 і 5,830,851, а також 5,986,047 (Wrighton, et al); публікації РСТ Pub. No.WO 96/40749 (Wrighton, et al.); Патенті США U.S. Pat. No.5,767,078 і публікації РСТ Pub. No.96/40772 (Johnson і Zivin); публікації РСТ Pub. No.WO 01/38342 (Balu); і WO 01/91780 (Smith-Swintosky, et al.). Зокрема, була ідентифікована група пептидів, яка містить пептидний мотив, члени якої зв'язуються з ΕΠΟ-рецепторами і стимулюють ЕПОзалежиу проліферацію клітин. Однак, ідентифіковані дотепер пептиди, які містять даний мотив, стимулюють ΕΠΟ-залежну проліферацію клітин in vitro зі значеннями ЕС50, рівними від приблизно 20 наномоль(нМ) до приблизно 250нМ. Тобто, для того, щоб стимулювати 50% максимальної проліферації, що стимулюється ΕΠΟ, потрібні концентрації пептиду від 20нм до 250нм. 88146 16 З урахуванням величезного потенціалу агоністів ΕΠΟ-рецепторів, як для досліджень важливих біологічних функцій, опосередковуваних цим рецептором, так і для лікування захворювань, залишається потреба в ідентифікації пептидів-агоністів ЕПО-рецепторів з підвищеною ефективністю й активністю. Даний винахід передбачає такі сполуки. Цитування і/або обговорення джерел, що цитуються у цьому розділі і у всій специфікації, приведено просто для роз'яснення опису даного винаходу, і не є визнанням того, що яке-небудь з посилань являє собою прототип дійсного винаходу. Даний винахід передбачає нові пептидш сполуки, що є агоністами ЕПО-рецепторів з істотно підвищеними ефективністю й активністю. Ці пептидні сполуки являють собою гомодимери з пептидних мономерів, які мають послідовність амінокислот (AcG)GLYACHMGPIT(1-nal)VCQPLRK (SEQ ID NO: 1), або гомодимери з пептидних мономерів, які мають послідовність амінокислот (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG)K (SEQ ID NO: 2), або гомодимери з білкових мономерів, які мають послідовність амінокислот (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG) (SEQ ID NO: 3). де кожна амінокислота визначена стандартною однобуквеною абревіатурою. «(AcG)» означає N-ацетилгліцин, «(1-nаІ)» означає 1нафтилаланін, a «(MeG)» означає N-метилгліцин, відомий також як саркозин. Кожен пептидний мономер пептидного димеру містить внутрімолекулярний дисульфідний зв'язок між залишками цистеїну цього мономеру. Пептидні мономери можуть бути димеризовані шляхом ковалентного приєднання до лінкеру на основі розгалуженого третинного аміду (з'єднуючому фрагменіу) Третинний амідний лінкер може бути зображений наступним чином -С1О-СН2-ХСН2-С2О-, де X позначає NCO-(CH2)2-N1H-, C1 лінкера утворює амідний зв'язок з ε-аміногрупою Скінцевого залишку лізину першого пептидного мономеру, С2 лінкеру утворює амідний зв'язок з εаміногрупою С-кінцевого залишку лізину другого пептидного мономеру, a N1, що входить у X, приєднаний карбаматним зв'язком або амідним зв'язком до активованого фрагменту поліетиленгліколю (ПЕГ, PEG), який має молекулярну мас) від приблизно 20,000 до приблизно 40,000 Дальтон («приблизно» указує на те. що в препаратах ПЕГ деякі молекули будуть мати масу більше, а деякі менше, ніж зазначені молекулярні маси). У випадку, коли кожен мономер гомодимеру має послідовність амінокислот (AcG)GLYACHMGPIT(1-nal)VCQPLRK (SEQ ID NO: 1), a N1 лінкеру приєднаний карбаматним зв'язком до активованого фрагменту поліетиленгліколю (ПЕГ, PEG), нові пептидні сполуки відповідно до даного винаходу можуть бути представлені наступним чином: 17 88146 18 У випадку, коли кожен мономер гомодимеру має послідовність амінокислот (AcG)GLYACHMGPIT(1-nal)VCQPLRK (SEQ ID NO: 1), a N1 лінкеру приєднаний амідним зв'язком до активованого фрагменту поліетиленгліколю (ПЕГ, PEG), нові пептидні сполуки, відповідно до даного винаходу, можуть бути представлені наступним чином: У випадку, коли кожен мономер гомодимеру має послідовність амінокислот (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG)K (SEQ ID NO: 2), a N1 лінкеру приєднаний карбаматним зв'язком до активованого фрагменту поліетиленгліколю (ПЕГ, PEG), нові пептидні сполуки відповідно до даного винаходу можуть бути представлені наступним чином: У випадку, коли кожен мономер гомодимеру має послідовність амінокислот (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG)K (SEQ ID NO: 2), a N1 лінкеру приєднаний амідним зв'яз ком до активованого фрагменту поліетиленгліколю (ПЕГ, PEG), нові пептидні сполуки, відповідно до даного винаходу, можуть бути представлені наступним чином: 19 88146 20 Пептидні мономери можуть також бути димеризовані ковалентним приєднанням до розгалуженого третинного амідного лінкеру (з'єднуючого фрагмента). Третинний амідний лінкер може бути зображений наступним чином: -С1О-СН2-Х-СН2-С2Оде X означає NCO-(CH2)2-NH-C3O-, С1 лінкеру утворює амідний зв'язок з ε-амшогрупою Скінцевого залишку лізину першого пептидного мономеру, а С2 лінкеру утворює амідний зв'язок з εаміногрупою С-кінцевого залишку лізину другого пептидного мономеру. Пептидні димери, відповідно до даного винаходу, також містять спейсерний фрагмент (спейсер, розділяючий фрагмент) наступної структури: -N1H-(CH2)4-C4H-N2Hде С4 спейсера ковалентно зв'язаний із С, який входить до X, a N1 спейсера ковалентно приєдна ний карбаматним або амідним зв'язком до активованого фрагмент)' поліетиленгліколю (ПЕГ), який має молекулярну масу від приблизно 10,000 до приблизно 50,000 Дальтон («приблизно» указує на те, що в препаратах ПЕГ деякі молекули будуть мати масу більше, а деякі - менше, ніж зазначена молекулярна маса). Кожен фрагмент ПЕГ може, незалежно від інших, мати масу 10,000 Дальтон (10КДа), 20КДа, 30КДа, 40КДа або 50КДа. У випадку, коли кожен мономер гомодимеру має послідовність амінокислот (AcG)GLYACHMGPIT(1-nal)VCQPLRK (SEQ ID NO: 1), а Ν1 і Ν2 спейсера ковалентно приєднані карбаматним зв'язком до активованого фрагменту поліетиленгліколю (ПЕГ, PEG), нові пептидні сполуки відповідно до даного винаходу можуть бути представлені наступним чином: У переважних способах реалізації винаходу Скінцевий лізин двох пептидних мономерів являє собою L-лізин. Крім того, фахівці у даній області за приведеними вище хімічними структурами зрозуміють, що два лінійних фрагменти ПЕГ з'єднані через лізин (наприклад, с формі mPEG2-Lys-NHS або у формі mPEG2-Lysinol-NPC), який також переважно являє собою L-лізин, що приводить до виникнення наступної стереохімічної! структури: 21 Як альтернативу, один або більше залишків лізину можуть являти собою D-лізин, що, як добре зрозуміло фахівцям у даній області, приводить до виникнення альтернативних стереохімічних структур. У випадку, коли кожен мономер гомодимеру має послідовність амінокислот 88146 22 (AcG)GLYACHMGPIT(1-nal)VCQPLRK (SEQ ID NO: 1), а Ν1 і Ν2 спейсера ковалентно приєднані амідним зв'язком до активованого фрагменту поліетиленгліколю (ПЕГ, PEG). нові пептидні сполуки відповідно до даного винаходу можуть бути представлені наступним чином: І знову, молекули лізину в цій сполуці являють собою переважно L-лізин, що приводить до виникнення наступної стереохімічной структури: Як альтернативу, один або більше залишків лізину можуть являти собою D-лізин. що, як добре зрозуміло фахівцям в даній області, приводить до виникнення альтернативних стереохімічних структур. У випадку, коли кожен мономер гомодимеру має послідовність амінокислот (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG)K (SEQ ID NO: 2), а Ν1 і Ν2 спейсера ковалентно приєднані карбаматним зв'язком до активованого фрагменту поліетиленгліколю (ПЕГ, PEG), де Υ означає карбаматну групу, нові пептидні сполуки, відповідно до даного винаходу, можуть бути представлені наступним чином: 23 88146 24 Залишки лізину, які з'єднують пептидний мономер та лінійні фрагменти ПЕГ у цій молекулі, переважно являють собою L-лізин, що приводить до виникнення наступної стереохімічной структури: Як альтернативу, один або більше залишків лізину можуть являти собою D-лізин, що, як добре зрозуміло фахівцям у даній області, приводить до виникнення альтернативних стереохімічних структур. У випадку, коли кожен мономер гомодимеру має послідовність амінокислот (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG)K (SEQ ID NO: 2), а Ν1 і Ν2 спейсера ковалентно приєднані амідним зв'язком до активованого фрагменту поліетиленгліколю (ПЕГ, PEG), нові пептидні сполуки, відповідно до даного винаходу, можуть буї и представлені наступним чином: Залишки лізину, що з'єднують пептидний мономер і лінійні фрагменти ПЕГ у цій молекулі, пе реважно являють собою L-лізин, що приводить до виникнення наступної стереохімічной структури: 25 88146 26 В інших способах реалізації один або більше залишків лізину можуть являти собою D-лізин, що, як добре зрозуміло фахівцям у даній області, приводить до виникнення альтернативних стереохімічних структур. Пептидні мономери можуть також бути димеризовані шляхом приєднання до лізинового лінкеру (єднального агента). У цьому випадку один пептидний мономер приєднаний своїм С-кінцем до εаминогруппи лізину, а другий пептидний мономер приєднаний своїм С-кінцем до α-аміногруппи лізину. Пептидні димери, відповідно до даного винаходу, містять також спейсерний фрагмент (спейсер) наступної структури: -N1H-(CH2)2-O-(CH2)2-O-(CH2)2-N2HНа одному кінці, N1 спейсера приєднаний амідним зв'язком до вуглецю карбонільної групи лізи нового лінкеру. На протилежному кінці, N2 спейсера приєднаний карбаматним зв'язком або амідним зв'язком до активованого фрагменту поліетиленгліколю (ПЕГ, PEG), що має молекулярну масу від приблизно 20,000 до приблизно 40,000 Дальтон («приблизно» указує на те, що в препаратах ПЕГ деякі молекули будуть мати масу більше, а деякі менше, ніж зазначена молекулярна маса) Кожен фрагмент ПЕГ може, незалежно від інших, мати масу 10,000Дальтон(10КДа). 20КДа, 30КДа, 40КДа або 50КДа. У випадку, коли спейсер приєднаний карбаматним зв'язком до активованого фрагменту поліетиленгліколю (ПЕГ, PEG), нові пептидні сполуки, відповідно до даного винаходу, можна представити наступним чином: У випадку, коли спейсер приєднаний амідним зв'язком до активованого фрагменту поліетиленгліколю (ПЕГ, PEG), нові білкові сполуки, відповідно до даного винаходу, можна представити наступним чином: Винахід також передбачає фармацевтичні склади, які складаються з таких пептидних сполук, і способи лікування різноманітних медичних станів із застосуванням таких пептидних сполук. Визначення Назви залишків амінокислот у пептидах мають наступні скорочення (абревіатури) ФенилаланинPhe або F, Лейцин - Leu або L, Ізолейцин - Не або І, Метионин - Met або М, Валин - Val або V, Серин Ser або S, Пролін - Pro або Р, Треонин - Thr або Τ, Алании - Ala або А, Тирозин - Туг або Υ, Гістидин His або Н, Глутамін - Gin або Q, Аспарагін - Asn або Ν, Лізин - Lys або K, Аспарагінова кислота Asp або D, Глутамінова кислота - Glu або Ε, Цистеїн - Cys або С, Триптофан - Тrр або W, Аргінін Arg або R, Гліцин - Gly або G. Мінорні амінокислоти у пептидах мають наступні абревіатури: 1нафтилаланін - 1-nal або Np, N-метилгліцин (також відомий як саркозин) - MeG або Sc, а ацетилірований гліцин (N-ацетилгліцин) - AcG. Термін «поліпептид» або «білок» означає тут полімер, мономерами якого ε амінокислоти, що 27 88146 28 являють собою альфа-амінокислоти, з'єднані між собою амідними зв'язками. Отже, довжина поліпептидів дорівнює щонайменше двом залишкам амінокислот, а звичайно поліпептиди довші. Звичайно термін «пептид» означає поліпептид, довжина якого складає всього кілька залишків амінокислот. Довжина нових пептидів - агоністів ΕΠΟрецептора, відповідно до даного винаходу, складає переважно не більше, ніж приблизно 50 залишків амінокислот. Переважно, їх довжина складає від приблизно 17 до приблизно 40 залишків амінокислот. Поліпептид, на відміну від пептиду, може містити будь-яке число залишків амінокислот. Отже, термін поліпептид включає пептиди, а також більш довгі послідовності амінокислот. Фраза «фармацевтично прийнятний» означає тут молекули або склади, що «вважають у цілому безпечними», наприклад, ті, котрі є фізіологічно прийнятними і зазвичай не викликають при введенні людині алергійних або аналогічних небажаних реакцій, таких як розлад шлунка, запаморочення і т.п. Термін «фармацевтично прийнятний» переважно вживається тут у значенні: схвалений органом федерального або державного регулювання, або перерахований у Фармакопеї США або іншій загальновизнаній фармакопеї, як придатний для застосування у тварин, а точніше - у людей. Термін «носій» позначає дилюент, ад'ювант, наповнювач або розріджувач, з яким вводять сполуку. Такі фармацевтичні носії можуть являти собою стерильні рідини, такі як вода й олії, включи олії нафти, олії рослинного, тваринного або синтетичного походження, такі як арахісова олія, соєва олія, мінеральна олія, кунжутна олія і т.п. У якості носіїв, особливо для ін'єкційних розчинів, використовують переважно воду або водяні буферні розчини, а також водяні розчини декстрози і гліцерину. Придатні фармацевтичні носії описані в «Remington's Pharmaceutical Sciences» (автор E.W Martin) Термін «агоніст» позначає тут біологічно активний ліганд, який зв'язується з комплементарним йому біологічно активним рецептором і активує останній, що або викликає біологічну відповідь рецептора, або підсилює вже існуючу біологічну активність рецептора. Нові пептиди, які є агоністами ЕПО-рецептора Даний винахід передбачає нові пептидні сполуки, що є агоністами ΕΠΟ-рецептора і мають істотно підвищену ефективність і активність. Ці пептидні сполуки являють собою гомодимери з пептидних мономерів, що мають послідовність амінокислот (AcG)GLYACHMGPIT(1-nal)VCQPLRK (SEQ ID NO: 1), або з пептидних мономерів, що мають послідовність амінокислот (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG)K (SEQ ID NO: 2), де кожна амінокислота визначена стандартною однобуквеною абревіатурою, «(AcG)» означає N-ацетилгліцин, «(1-nаl)» означає 1нафтилаланін, a «(MeG)» означає N-метилгліцин, також відомий як саркозин. Кожен пептидний мономер пептидного димеру містить внутрімолекулярний дисульфідний зв'язок між залишками цистеїну даного мономеру. Такі мономери можуть бути схематично представлені наступним чином: Ці мономерні пептиди димеризують, одержуючи в результаті димери з підвищеною активністю агоністів ΕΠΟ-рецепторів. Лінкерньш фрагмент (Lk) являє собою лінкер на основі розгалуженого третинного аміду, який з'єднує С-кінці двох пептидних мономерів шляхом одночасного приєднання до Скінцевого залишку лізину кожного мономеру Третинний амідний лінкер можна представити таким чином: -С1О-СН2-Х-СН2-С2Оде X являє собою NCO-(CH2)2-N1H-, C1 лінкеру утворює амідний зв'язок з ε-аміногрупою Скінцевого залишку лізину першого білкового мономеру, С2 лінкера утворює амідний зв'язок з εаміногрупою С-кінцевого залишку лізину другого білкового мономера, a N1, який входить в X, прикріплений карбаматним зв'язком або амідним зв'язком до активованого фрагменту поліетиленгліколю (ПЕГ, PEG), який має молекулярну масу від приблизно 20,000 до приблизно 40,000 Дальтон («приблизно» указує на те, що в препаратах ПЕГ деякі молекули будуть мати масу більше, а деякі менше, ніж зазначені молекулярні маси). Третинний амідний лінкер можна також представити у виді: -С1О-СН2-X-СН2-С2О-де X позначає NCO-(CH2)2-NH-C3O-, С1 лінкера утворює амідний зв'язок з ε-амшогрупою С-кінцевого залишку лізину першого пептидного мономера, а С2 лінкера утворює амідний зв'язок з ε-аміногрупою С-кінцевого залишку лізину другого пептидного мономеру Пептидні димери, відповідно до даного винаходу, також містять спейсерний фрагмент (спейсер, розділяючий фрагмент) наступної структури: -N1H-(CH2)4-C4H-N2Hде С4 спейсера ковалентно зв'язаний із С3, що входить у Χ, Ν1 спейсера ковалентно приєднаний карбаматним або амідним зв'язком до активованого фрагменту ПЕГ, a N2 спейсера ковалентно приєднаний карбаматним або амідним зв'язком до активованого фрагменту ПЕГ, де ПЕГ має молекулярну масу від приблизно 10,000 до приблизно 60,000 Дальтон («приблизно» указує на -те, що в препаратах ПЕГ деякі молекули будуть мати масу більше, а деякі - менше, ніж зазначена молекулярна маса). Нові пептиди, відповідно до даного винаходу, можуть також містити фрагмент ПЕГ, який ковалентно приєднаний за допомогою карбаматного або амідного зв'язку з третинним амідним лінкером до пептидного димеру. ПЕГ являє собою водорозчинний фармацевтично прийнятний полімер. ПЕГ для 29 застосування в даному винаході може являти собою лінійний, нерозгалужений ПЕГ, який має молекулярну масу від приблизно 20кілодальтон (20ДО) до приблизно 60ДО Дальтон («приблизно» указує на те. що в препаратах ПЕГ деякі молекули будуть мати масу більше, а деякі - менше, ніж зазначена молекулярна маса). Переважно, ПЕГ має молекулярну масу від приблизно 30К до приблизно 40К. Фахівець у даній області зможе підібрати бажаний розмір полімеру, ґрунтуючись на таких параметрах, як бажане дозування, час циркуляції, стійкість до протеолізу, вплив, якщо він є, на біологічну активність, простота в застосуванні, ступінь антигенності або її відсутність, а також інші відомі впливи ПЕГ на терапевтичний пептид. Пептиди, пептидні димери та інші молекули на основі пептидів, відповідно до даного винаходу, можуть бути приєднані до водорозчинних полімерів (наприклад, ПЕГ) за допомогою різноманітних хімічних способів, які дозволяють зв'язати водорозчинний(ні) полімер(и) з рецептор-єднальною частиною молекули (наприклад, пептид +спейсер). У звичайному способі реалізації для ковалентного приєднання водорозчинного полімеру(ів) до рецептор-єднальної частини задіяне єдине місце (сайт) приєднання Однак в альтернативних способах реалізації винаходу можна застосовувати зв'язування в множинних сайтах приєднання, включаючи подальші варіанти, у яких різні види водорозчинних полімерів приєднують до рецепторєднального частині в різних сайтах приєднання, які можуть включати сайти ковалентного приєднання (приєднань) до спейсеру і/або одній або обом пептидним ланцюгам. У деяких способах реалізації димер або більш великий полімер буде містити різні види пептидних ланцюгів (тобто буде являти собою гетеродимер або інший гетеромультимер). Як приклад, але не обмеження, димер може містити один пептидний ланцюг, який має сайт приєднання ПЕГ, а у другому пептидному ланцюзі сайт приєднання ПЕГ може бути або відсутнім, або для приєднання може бути використаний зв'язок не такого, як у першому ланцюзі, хімічного складу. У деяких варіантах спейсер може містити або не містити сайт приєднання ПЕГ. а у випадку приєднання ПЕГ до зазначеного спейсеру, для приєднання може бути використаний зв'язок не такого, як у першому і/або другому ланцюзі, хімічного складу. В альтернативному способі реалізації ПЕГ приєднано до спейсерной частини рецепторєднальної частини, а інший водорозчинний полімер (наприклад, вуглеводень) кон'югірований з боковим радикалом однієї з амінокислот пептидної частини молекули. Для приєднання ПЕГ (пегилірування) до рецептор-єднальної частини (пептиди+спейсер) може бути використано безліч різних видів поліетиленгліколю (ПЕГ) Можна використовувати практично будь-який придатний хімічно активний реагент ПЕГ. Застосування у переважних способах реалізації хімічно активного реагенту ПЕГ приведе до утворення карбаматного або амідного зв'язку після кон'югірування з рецептор-єднальною частиною. Придатні хімічно активні реагенти ПЕГ включають, без обмеження, комерційно доступні реагенти, які 88146 30 можна придбати по каталогу Drug Delivery Systems (2003) корпорації NOF Corporation (Yebisu Garden Place Tower, 20-3 Ebisu 4-chome, Shibuya-ku, Tokyo 150-6019) і каталогу Molecular Enginering 2003 компанії Nectar Therapeutics (490 Discovery Drive, Huntsville, Alabama 35806). Як приклад, але не обмеження, тут приводяться наступні реагенти ПЕГ, яким часто надається перевага у різних способах реалізації: m-PEG2-NHS, mPEG2-ALD, multiArm PEG, mPEG(MAL)2, mPEG(MAL), m-PEG2NH2, mPEG-SPA, mPEG-SBA, mPEG-тиоефіри, mPEG-подвійні складні ефіри, mPEG-BTC, mPEGButyrALD, mPEG-ACET, гетерофункціональні ПЕГ (NH2-PEG-COOH, Boc-PEG-NHS, Fmoc-PEG-NHS, NHS-PEG-VS, NHS-PEG-MAL), акрилати ПЕГ (ACRL-PEG-NHS), ПЕГ-фосфодиліпіди (наприклад, mPEG-DSPE). багатопроменеві (розгалужені) ПЕГ серії SUNBRITE, включаючи серію GL ПЕГ на основі гліцеринових, активованих хімічним способом, обраним фахівцем, любої з активованих ПЕГ серії SUNBRITE (включаючи, без обмеження, карбоксил-ПЕГи, p-NP-ПЕГ, Тресил-PEGs, альдегід ПЕГи, ацеталь-ПЕГи, аміно-ПЕГи, тіол-ПЕГи, імід-малеінові ПЕГи, гідроксил-ПЕГ-амін, аміноПЕГ-соон, гідроксил-ПЕГ-альдегід, ПЕГ карбоксильно-ангідридного типу, функціоналізовані фосфоліпід-ПЕГ і інші аналогічні і/або придатні хімічно активні ПЕГ, які обирають фахівці в даній області для конкретного застосування і використання. Нові пептиди відповідно до даного винаходу можуть також містити два фрагменти ПЕГ, ковалентно приєднаних карбаматним або амідним зв'язком до спейсерного фрагменту, який ковалентно приєднаний до третинного амідного лінкеру пептидного димеру. Кожен з двох фрагментів ПЕГ, що використаний у такому способі реалізації даного винаходу, може бути лінійним, або вони можуть бути зв'язані разом в одній (загальній) точці приєднання. Кожен фрагмент ПЕГ має молекулярну масу переважно від приблизно 10 кілодальтон (10К) до приблизно 60К («приблизно» указує на те, що в препаратах ПЕГ деякі молекули будуть мати масу більше, а деякі - менше, ніж зазначені молекулярні маси). Більш переважні лінійні фрагменти ПЕГ. Переважно, кожен з двох фрагментів ПЕГ має молекулярну масу від приблизно 20К до приблизно 40К, а переважніше - в інтервалі від приблизно 20К до приблизно 40К. Краще, щоб кожен з двох фрагментів ПЕГ мав молекулярну масу приблизно 20К. Фахівець в даній області зможе підібрати бажаний розмір полімеру ґрунтуючись на таких параметрах, як бажане дозування, час циркуляції, стійкість до протеолізу, вплив, якщо він є, на біологічну активність, простота застосування, ступінь антигенності або її відсутність, а також інші відомі впливи ПЕГ на терапевтичний пептид. Даний винахід також включає пептиди - агоністи, які являють собою гомодимери з пептидних мономерів, що мають послідовність амінокислот (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG) (SEQ ID NO: 3), де кожна амінокислота визначена стандартною одноб^квеною абревіатурою, «(AcG)» означає N-ацетилгліцин, «(1-nal)» означає 1нафтилаланін, a «(MeG)» означає N-метилглщин, відомий також як саркозин Кожен пептидний мо 31 88146 номер пептидного димеру містить внутрімолекулярний дисульфідний зв'язок між залишками цистеїну даного мономеру. Такі мономери можуть бути схематично представлені наступним чином: або . Ці мономерні пептиди димеризують, одержуючи в результаті димери з підвищеною активністю агоністів ΕΠΟ-рецепторів. Лінкерний фрагмент (Lk) В Формулі 1 і Формулі 2 N2 являє собою атом азоту ε-аміногрупи лізину, a N1 представляє атом азоту α-аміногрупи лізину. Пептидні димери, відповідно до даного винаходу, також містять спейсерний фрагмент (спейсер, розділяючий фрагмент) наступної структури: -N1H-(CH2)2-O-(CH2)2-O-(CH2)2-N2HНа одному кінці, N1 спейсера приєднаний амідним зв'язком до вуглецю карбонільної групи лізинового лінкеру. На протилежному кінці, N2 спейсера приєднаний карбаматним зв'язком або амідним зв'язком до активованого фрагменту поліетиленгліколю (ПЕГ, PEG), який має молекулярну масу від приблизно 10,000 до приблизно 60,000 Дальтон («приблизно» указує на те, що в препаратах ПЕГ деякі молекули будуть мати масу більше, а деякі менше, ніж зазначена молекулярна маса) Переважно, ПЕГ має молекулярну масу приблизно від 20,000 до 40,000 Дальтон. Таким чином, нові пептиди відповідно до даного винаходу також містять фрагмент ПЕГ, ковалентно приєднаний до пептидного димеру. ПЕГ являє собою водорозчинний полімер і є фармацевтично прийнятним. ПЕГ для застосуван 32 являє собою залишок лізину, який з'єднує С-кінці двох пептидних мономерів шляхом одночасного приєднання до С-кінцевої амінокислоти кожного мономеру. Один пептидний мономер приєднаний своїм С-кінцем до ε-аміногрупи лізину, а другий пептидний мономер своїм С-кінцем приєднаний до α-аміногрупи лізину. Наприклад, структура даного димеру може бути зображена, як показано в Формулі 1: Узагальнене зображення показане в Формулі 2. ня в даному винаході може являти собою лінійний, нерозгалужений ПЕГ, який має молекулярну масу приблизно від 20КДа (20К) до приблизно 60К Дальтон («приблизно» указує на те, що в препаратах ПЕГ деякі молекули будуть мати масу більше, а деякі - менше, ніж зазначена молекулярна маса). Переважно, ПЕГ має молекулярну масу від приблизно 30К до приблизно 40К. Фахівець у даній області зможе підібрати бажаний розмір полімеру, ґрунтуючись на таких параметрах, як бажане дозування;·час циркуляції, стійкість до протеолізу, вплив, якщо він є, на біологічну активність, простота в застосуванні, ступінь антигенності або її відсутність, а також інші відомі впливи ПЕГ на терапевтичний пептид. У випадку, коли кожен мономер гомодимеру має послідовність амінокислот (AcG)GLYACHMGPIT(1-nal)VCQPLRK (SEQ ID NO:1), a N1 лінкеру приєднаний карбаматним зв'язком до активованого фрагменту поліетиленгліколю (ПЕГ), нові пептидні сполуки, відповідно до даного винаходу, можуть бути представлені наступним чином: 33 88146 34 У випадку, коли кожен мономер гомодимеру має послідовність амінокислот (AcG)GLYACHMGPIT(1-nal)VCQPLRK (SEQ ID NO:1), a N1 лінкеру приєднаний амідним зв'язком до активованого фрагменту поліетиленгліколю (ПЕГ), нові пептидні сполуки, відповідно до даного винаходу, можуть бути представлені наступним чином: У випадку, коли кожен мономер гомодимеру має послідовність амінокислот (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG)K (SEQ ID NO:2), a N1 лінкеру приєднаний карбаматним зв'язком до активованого фрагменту поліетиленгліколю (ПЕГ), нові пептидні сполуки, відповідно до даного винаходу, можуть бути представлені наступним чином: У випадку, коли кожен мономер гомодимеру має послідовність амінокислот (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG)K (SEQ ID NO:2), a N1 лінкеру приєднаний амідним зв'яз ком до активованого фрагменту поліетиленгліколю (ПЕГ), нові пептидні сполуки, відповідно до даного винаходу, можуть бути представлені наступним чином: 35 Переважні пептидні димери відповідно до да 88146 36 ного винаходу включають, без обмеження: 37 88146 38 39 У випадку, коли кожен мономер гомодимеру має послідовність амінокислот (AcG)GLYACHMGPIT(1-nal)VCQPLRK (SEQ ID 88146 40 NO:1), а Ν1 і Ν2 спейсера ковалентно приєднані карбаматним зв'язком до активованого фрагменту полі етиленгліколю (ПЕГ), нові пептидні сполуки, 41 88146 42 відповідно до даного винаходу, можуть бути пред ставлені наступним чином: У випадку, коли кожен мономер гомодимеру має послідовність амінокислот (AcG)GLYACHMGPIT(1-nal)VCQPLRK (SEQ ID NO:1), а Ν1 і Ν2 спейсера ковалентно приєднані амідним зв'язком до активованого фрагменту поліетиленгліколю (ПЕГ), нові пептидні сполуки, відповідно до даного винаходу, можуть бути представлені наступним чином: У випадку, коли кожен .мономер гомодимеру має послідовність амінокислот (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG)K (SEQ ID NO:2), а Ν1 і Ν2 спейсера ковалентно приєднані карбаматним зв'язком до активованого фрагменту поліетиленгліколю (ПЕГ), нові пептидні сполуки, відповідно до даного винаходу, можуть бути представлені наступним чином: У випадку, коли кожен .мономер гомодимеру має послідовність амінокислот (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG)K (SEQ ID NO:2), а Ν1 і Ν2 спейсера ковалентно приєднані амідним зв'язком до активованого фрагменту поліетиленгліколю (ПЕГ), нові пептидні сполуки, відповідно до даного винаходу, можуть бути представлені наступним чином: 43 Переважні пептидні димери, віповідно до даного винаходу, включають, без обмеження: 88146 44 45 88146 46 47 88146 48 49 88146 50 51 88146 52 53 88146 54 У випадку, коли спейсер приєднаний карбаматним зв'язком до активованого фрагменту поліетиленгліколю (ПЕГ), нові пептидні сполуки, відпо відно до даного винаходу, представлені наступним чином: можуть бути У випадку, коли спейсер приєднаний амідним зв'язком до активованого фрагменту поліетиленгліколю (ПЕГ), нові пептидні сполуки, відповідно до даного винаходу, можуть бути представлені наступним чином: Димерну структуру можна записати як [Аспептид, дисульфід]2Lуs-спейсер-РЕО20, 40K, щоб позначити ацетилірованний на N-кінці пептид, зв'язаний як з α-, так і з ε-аміногрупами лізину, причому кожен пептид містить внутрімолекулярну дисульфідну петлю, а спейсерна молекула утво рює ковалентний зв'язок між С-кінцем лізину і фрагментом ПЕГ, що має молекулярну масу від приблизно 20,000 до приблизно 40,000 Дальтон. Переважні пептидні димери, відповідно до даного винаходу, містять без обмеження: 55 Стереоізомери (наприклад, D-аміноксилоти) двадцяти звичайних амінокислот амінокислоти, що не зустрічаються в природі, такі як а,а-дизаміщені амінокислоти, N-алкіламінокислоти та інші мінорні амінокислоти також можуть бути придатними компонентами сполук відповідно до даного винаходу. Приклади мінорних амінокислот включають, без обмеження, β-аланін, 3-приридилаланін, 4гідроксипролін. О-фосфосерин. N-метилгліцин, Nацетилсерин, N-формілметіонін, 5-гідроксилізин, нора-лейцин та інші аналогічні амінокислоти та імінокислоти. Можливі також інші модифікації, включаючи модифікацію N-кінця, модифікацію Скінця, заміну однієї або більше зустрічающихся у природі генетично кодуємих амінокислот, мінорними амінокислотами, модифікацію бокових радикалів одного або більше залишків амінокислот, фосфорилірування пептиду і т. п. Послідовності пептидів відповідно до даного винаходу можуть бутиприсутніми окремо або у вигляді кон'югатів з додатковими відрізками пептидного ланцюга на N-кінці або С-кінці (Nкінцевими або С-кінцевими «продовженнями»). Такі «продовження» можуть являти собою природно кодуємі послідовності пептидів, можливо з послідовностями, які не зустрічаються в природі, або практично без них «Продовження» можуть включати, за рішенням фахівця в даній області, будь-які додавання, делеції, точечні мутації або інші модифікації послідовності, або їхні комбінації. Як приклад, але не обмеження, послідовності, що зустрічаються в природі, можуть являти собою повнорозмірні або укорочені послідовності, а також можуть включати заміни амінокислот, які створюють сайт приєднання вуглеводу, ПЕГ, іншого полімеру і т.п. шляхом з'єднання з боковим радикалом. В одному з варіантів заміна амінокислоти приводить до гуманізації послідовності, що робить її сумісною з імунною системою людини. Передбачені всі типи білків злиття, включаючи такі, у яких послідовності імуноглобуліну примикають до послідовностей відповідно даному винаходу, які активують ΕΠΟ-рецептори, або розташовані поблизу від них, з послідовністю неімуноглобулінового спейсера або без неї. Один вид реалізації являє собою ланцюг імуноглобуліну, який містить замість варіабельної області важкого і/або легкого ланцюга послідовність, яка активує ЕПО-рецептор. Готування пептидних сполук відповідно до даного винаходу 88146 56 Синтез пептидів Пептиди відповідно до даного винаходу можуть бути приготовлені класичними способами, відомими в даній області. Ці стандартні способи включають синтез повністю у твердій фазі (твердофазний синтез), способи синтезу частково у твердій фазі, конденсації фрагментів, класичний синтез у розчині і технологію рекомбінантних ДНК [Див., наприклад, Merrifield J. Am. Chem. Soc. 1963 85: 2149]. В одному зі способів реалізації пептидні мономери пептидного димеру синтезують окремо, після чого піддають димеризації. В іншому способі реалізації пептидні мономери пептидного димеру з'єднують їх С-кінцями через розгалужений третинний амідний лінкерний фрагмент LK, який мас дві функціональні групи, що можуть служити сайтами ініціації для синтезу пептидів, і третю функціональну групу (наприклад, карбоксильну групу або аміногрупу), яка забезпечує зв'язування з іншим молекулярним фрагментом (який може, наприклад, бути присутнім на поверхні твердого носія (підложки)). У цьому випадку, два пептидних мономери можуть бути синтезовані безпосередньо на двох хімічно активних азотних групах лінкерного фрагменту LK (варіанта методики твердофазного синтезу). Такий синтез може бути послідовним або одночасним (паралельним). В іншому способі реалізації два пептидні мономери можуть бути синтезовані безпосередньо на двох хімічно активних азотних групах лінкерного фрагменту LK, (як варіант методики твердофазного синтезу). Такий синтез може бути послідовним або одночасним. У цьому способі реалізації застосовують лізиновий лінкерний фрагмент (LK), який має дві аміногруппи, що можуть служити сайтами ініціації для синтезу пептидів, і третю функціональну групу (наприклад, карбоксильну групу лізину, або аміногруппу аміду лізину, залишку лізину, у якому карбоксильна група була трансформована в амідний фрагмент -CONH2), яка забезпечує зв'язування з іншим молекулярним фрагментом (який може, наприклад, бути присутнім на поверхні твердого носія (підложки)). У випадку, коли має бути проведений послідовний синтез пептидних ланцюгів димеру на лінкері, дві функціональні аміногруппи захищають двома різними, що видаляються ортогонально, захисними групами для аміногруп (амін-захищаючу групу). Захищений лінкер зв'язують («зшивають») із твер 57 дим носієм через третю функціональну групу лінкеру. Видаляють першу амін-захищаючу групу і на першому позбавленому захисту аміно-залишку синтезують перший пептид димеру. Потім видаляють другу амін-захищаючу групу і на другому позбавленому захисту аміно-залишку синтезують другий пептид димеру. Наприклад, перший амінозалишок лінкеру може бути захищений групою Аllос (алілоксикарбоніл), а другий - групою Fmoc (9-флуоренілметилкарбоксил). У цьому випадку групу Fmoc (але не групу Аllос), можна видалити обробкою слабкою основою [наприклад, 20% піперидином у диметил формаміді (ДМФ, DMF)] і синтезувати перший пептидний ланцюг. Після цього можна видалити групу Аllос придатним реагентом (наприклад, Рd(РРh3)/4-метил морфолін і хлороформ) і синтезувати другий пептидний ланцюг. Необхідно відзначити, що в тих випадках, коли мають бути використані тіол-захищаючі групи для цистеїну з метою контроля утворення дисульфідних зв'язків (як обговорюється нижче), необхідно застосовувати цю методику, навіть якщо послідовності амінокислот пептидних ланцюгів димеру ідентичні. У випадках, коли має бути проведений одночасний (паралельний) синтез пептидних ланцюгів димеру на лінкері, дві функціональні аміногрупи захищають однією і тою ж, що видаляється, амінзахищаючою групою. Захищений лінкер зв'язують із твердим носієм через третю функціональну групу лінкеру. У цьому випадку захист з двох захищених функціональних груп видаляють одночасно, і на позбавлених захисту аміногрупах синтезують одночасно два пептидні ланцюги. Необхідно відзначити, що послідовності пептидних ланцюгів при застосуванні цієї методики будуть ідентичними, а всі тіол-захищаючі групи для залишків цистеїну однакові. Переважним способом синтезу пептидів є твердофазний синтез. Процедури синтезу пептидів у твердій фазі добре відомі в даній області [Див., наприклад , Stewart Solid Phase Peptide Syntheses (вид-во Freeman and Co.: San Francisco) 1969; каталог 2002/2003 General Catalog компанії Novabiochem Corp, San Diego, USA (Сан-Дієго, США), Goodman Synthesis of Peptides and Peptidomimetics (вид-во Houben-Weyl, Stuttgart (Штедгарт)) 2002]. У твердофазному синтезі, синтез звичайно починають із С-кінця пептиду, використовуючи α-аміно-захищену смолу. Придатний вихідний матеріал можна приготувати, наприклад, шляхом приєднання необхідної α-амінокислоти до хлорометилірованої смоли, карбоксиметилової смолі, полістиренової смоли, бензгідриламінової смоли і т.п. Одну з таких хлориметилірованих смол продає компанія Bio Rad Laboratories (Ричмонд, Каліфорнія) під торговою маркою ΒΙΟBEADS SX-1 Препарат гідроксиметилової смоли був описаний Bodonszky, el al. (1966) Chem. Ind. London 38:1597]. Бензгідриламінова смола (ВНА) була описана [Pietta, Marshall (1970) Chem. Commun. 650], а гідрохлоридна форма доступна комерційно (Beckman Inxtruments. Inc, Пало Альто, Каліфорнія, США). Наприклад, α-аміно-захищена амінокислота може бути зв'язана з хлорометилі 88146 58 рованою смолою за допомогою бікарбонат цезію (каталізатор), відповідно до способу, описаному в Gisin (1973) Helv. Chim. Acta 56: 1467. Після первісного зв'язування α-амінозахищаючу групу видаляють, наприклад, використовуючи розчини трифтороцтової кислоти (ТФА, TFA) або соляної кислоти (НСl) в органічних розчинниках при кімнатній температурі. Після цього ос-аміно-захищені амінокислоти успішно зв'язуються з пептидним, що росте ланцюгом, зв'язаним з носієм α-аміно-захищаючі групи являють собою ті групи, що застосовують в області поетапного синтезу пептидів, включаючи: захисні групи алкільного типу (наприклад, форміл, трифторацетил, ацетил), ароматичні захисні групи уретанового типу [наприклад, бензилоксикарбоіл (Cbz) і заміщений Cbz], аліфатичні уретанові захисні групи [наприклад, t-бутилоксикарбоніл (Вос), ізопропілоксикарбоніл, циклогексилоксикарбоніл], і захисні групи алкільного тип}/ (наприклад, бензил, трифенілметил), флуоренілметил оксикарбоніл (Fmoc), алілоксикарбоніл (АIIос) і 1-(4,4-диметил-2,6диоксоциклогекс-1-іліден)етил(Ddе). Групи, які захищають бокові радикали (звичайно ефіри, складні ефіри, тритил, РМС і т.п.) залишаються неушкодженими в ході зв'язування і не відщеплюються в ході видалення захисту Nкінцевих груп або у ході зв'язування. Видалення груп, які захищають бокові радикали, повинно ставати можливим після завершення синтезу кінцевого пептиду і за таких умов реакції, які не приведуть до зміни цільового пептиду. Групи, що захищають боковий радикал тирозину, включають тетрагідропіраніл, терт-бутил, тритил, бензил, Cbz, Z-Br-Cbz і 2,5-дихлоробензил. Групи, які захищають боковий радикал аспарагіну, включають бензил, 2,6дихлоробензил, метил, етил і циклогексил. Групи, які захищають боковий радикал треоніну і серину, включають ацетил, бензоіл, тритил, тетрагідропіраніл, бензил, 2,6-дихлоробензил, і Cbz. Групи, які захищають боковий радикал аргініну, включають нітро-, Tosyl(Tos), Cbz, адамантилоксикарбоніл, мезитоілсульфоніл (Mts), 2,2,4,6; 7пентаметилдигідробензофуран-5-сульфноніл (Pbf), 4-метокси-2,3,6-триметилбензансульфоніл(Мtr) або Воc. Групи, які захищають боковий радикал лізину, включають Cbz, 2хлоробензилоксикарбонш(2-Сl-Сbz), 2бромобензилоксикарбоніл (2-Br-Cbz), Toc або Воc. Після видалення α-аміно-захищаючих груп амінокислоти, які залишаються захищеними, поетапно зв'язують у бажаному порядку. Звичайно проводять реакцію кожної захищеної амінокислоти в приблизно 3-х кратном надлишку, використовуючи придатний активатор карбоксильної групи, такий як 2-(1Н-бензотриазол-1-ил)-1,1,3,3тетраметилуронія гексафлуорофосфат (HBTU) або дициклогексилкарбодимід (DDC), розчинений, наприклад у метиленхлориді (СН2Сl2), N-метил піролідоні, диметил формаміді (DMF) або їх сумішах. Після завершення синтезу бажаної послідовності амінокислот, бажані пептиди від'єднують від носія (смоли) шляхом обробки реагентом, таким як трифтороцтова кислота (TFA) або фтористий во 59 день (HF), який не тільки відщеплює пептид від смоли, але й відщеплює усі групи, що залишилися, які захищають бокові радикали. У випадкy використання хлорметилированої смоли в результаті обробки фтористим воднем одержують пептидні кислоти в розчині. У випадку використання бензгідриламінової смоли в результаті обробки фтористим воднем одержують безпосередньо амід пептиду. Як альтернативу, у випадку застосування хлорметилірованої смоли, пептид із захищеними боковими радикалами може бути від'єднано шляхом обробки смоли, до якої приєднаний пептид, аміаком, що дає бажаний амід із захищеними боковими радикалами, або алкіламіном, що дає алкіламід або діалкіламід із захищеними боковими радикалами. Захист бокових радикалів потім видаляють стандартним образом шляхом обробки фтористим воднем та одержанням вільних амідів, алкіламідів, або діалкіламідів. При готуванні складних ефірів відповідно до даного винаходу застосовують смоли, які використовуються для готування кислот пептидів, а пептиди з захищеними боковими радикалами з'єднують з використанням основи і відповідного спирту (наприклад, метанолу). Потім групи, що захищають бокові радикали, видаляють звичайним способом шляхом обробки фтористим воднем, в результаті чого одержують бажаний ефір. Для синтезу пептидів можна також застосовувати процедури, в яких зроблені заміни 20, амінокислот, що зустрічаються в природі та генетично кодуються, на інші амінокислоти в одній, двох або більше позиціях із складу позицій згідно даного винаходу. Синтетичні амінокислоти, які можуть бути введені шляхом заміни в пептиди згідно даного винаходу включають, без обмеження, Nметил, L-гідроксипропіл, L-3, 4дигідроксифенілаланін, d-амінокислоти, такі як L-dгідроксилізил, D-d-метилаланініл, L-α-метилаланіл, β-амінокислоти і ізоквиноліл. Синтетичні амінокислоти, які не зустрічаються в природі можуть також бути введені в пептиди відповідно до дійсного винаходу. Модифікація пептидів Також можна модифікувати аміно- і/або карбоксильні кінці пептидних сполук згідно даного винаходу для того, щоб одержати інші сполуки згідно даного винаходу. Наприклад, N-кінець може бути ацетилірований оцтовою кислотою або її галогенпохідними, такими як α-хлороцтова кислота, αбромоцтова кислота або α-йодоцтова кислота). Можна замінити бокові радикали, які зустрічаються в природі, 20 генетично кодуємих амінокислот (або стереоізомеричних D-амінокислот) іншими боковими радикалами, наприклад, такими групами як алкільні групи, нижчі алкіли, 4-, 5-, 6- до 7-члених алкілів, нижчий алкіл-амід-, алкокси-, гідрокси-, карбокси-групи та їх похідні з нижчими ефірами, а також 4-, 5-, 6- до 7-члених гетероциклічні групи. Зокрема, можна застосовувати аналоги проліну, у яких розмір кільця залишку проліну змінили з 4-членного на 5-, 6-, або 7-членне. Циклічні групи можуть бути насиченими або ненасиченими, а ненасичені - ароматичними або неароматичними. Гетероциклічні групи переважно 88146 60 містять наступні гетероатоми (один або більше): азот, кисень і/або сірку Приклади таких груп включають фуразаніл-, фураніл-, імідазолідил-, імідазоліл-, імідазоліл-, ізотіазоліл-, ізоксазоліл-, морфолініл- (наприклад, морфоліно-), оксазоліл-, піперазиніл- (наприклад, 1-піперазил-), піперидил(наприклад, 1-піперидил-, піперидино-), піраніл-, піразиніл-, піразолідил-, піразоніл-, піразоліл-, піридазиніл-, піридил-, піримідиніл-, піролідиніл(наприклад, 1-піролідиніл-), піролініл-, піроліл-, тіадіазоліл-. тіазоліл-, тіеніл-, тіоморфолініл- (наприклад, тіоморфоліно-) і триазоліл- групи. Ці гетероциклічні групи можуть бути заміщеними або незаміщеними. У випадку заміщеної групи, замісник може являти собою алкіл, алкокси-групу, галоген, кисень, або заміщений чи незаміщений феніл. Можна легко модифікувати пептиди шляхом фосфорилірування, а також іншими способами [наприклад, як описано в Hruby et al.(1990) Biochem. J. 268: 249-262]. Пептидні сполуки згідно даного винаходу також служать структурною моделлю непептидних сполук з подібною біологічною активністю. Фахівці в даній області усвідомлюють, що доступні безліч методик, які дозволяють конструювати сполуки з біологічною активністю ідентичною або аналогічною активності пептидної сполуки-зразка, але з більш придатною, ніж у взятого за зразок пептиду, активністю у відношенні розчинності, стабільності і схильності до гідролізу і протеолізу [Див. Morgan, Gamor (1989) Ann. Rep. Med. Chem. 24: 243-252]. Ці методики включають заміну пептидного остова остовом, який складено з фосфонатів, амідатів, карбаматів, сульфонамідів. вторинних амідів і Nметиламінокислот. Утворення дисульфідних зв'язків Сполуки згідно даного винаходу містять дві внутрімолекулярні дисульфідні зв'язки. Такі дисульфідні зв'язки можуть бути утворені шляхом окислювання залишків цистеїну в кожному пептидному мономері. В одному зі способів реалізації утворення зв'язків між залишками цистеїну контролюють, вибираючи тип і концентрацію окисляючої речовини таким чином, щоб ефективно оптимізувати утворення бажаного ізомеру. Наприклад, окислювання пептидного димеру з переважним (у порівнянні з утворенням міжмолекулярних дисульфідних зв'язків) утворенням двох внутрімолекулярних дисульфидних зв'язків (по одному в кожному пептидному ланцюзі) досягають, коли речовина, яка окислює представляє ДМСО (DMSO) або йодин(І2). В інших способах реалізації утворення зв'язків між залишками цистеїн) контролюють шляхом вибіркового застосування тиол-захисних груп в ході синтезу пептидів. Наприклад, якщо бажано одержати димер із двома міжмолекулярними дисульфидними зв'язками, перший мономер синтезують із двома залишками цистеїну в послідовності каркаса, захищеними першою тиол-захисною групою. [Наприклад, тритильной (Trt), алілоксикарбонильной(Аllос), 1-(4,4-диметил-2,6-дициклооксигекс-1іліден) етильной (Dde) і т.п.], потім синтезують другий мономерний пептид із двома залишками цистеїну в коровій послідовності захищеними дру
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel peptides that bind to the erythropoietin receptor
Автори англійськоюHolmes Christopher P., Yin Qun, Lalonde Guy, Schatz Peter, Tumelty David, Palani Balu, Zemede Gemete H.
Назва патенту російськоюНовые пептиды, которые связываются с рецептором эритропоэтина
Автори російськоюХольмез Кристофер П., Иин Кан, Лалонде Гай, Шац Петер, Тумелти Давид, Палани Балу, Земеде Гемет Х.
МПК / Мітки
МПК: C07K 14/505
Мітки: еритропоетину, пептиди, рецептором, зв'язуються, нові
Код посилання
<a href="https://ua.patents.su/63-88146-novi-peptidi-shho-zvyazuyutsya-z-receptorom-eritropoetinu.html" target="_blank" rel="follow" title="База патентів України">Нові пептиди, що зв’язуються з рецептором еритропоетину</a>
Попередній патент: Пристрій для визначення кількості зрідженого газу в ємності
Наступний патент: Спосіб окиснення для одержання карбонової кислоти і алкену
Випадковий патент: Дозатор рідких продуктів