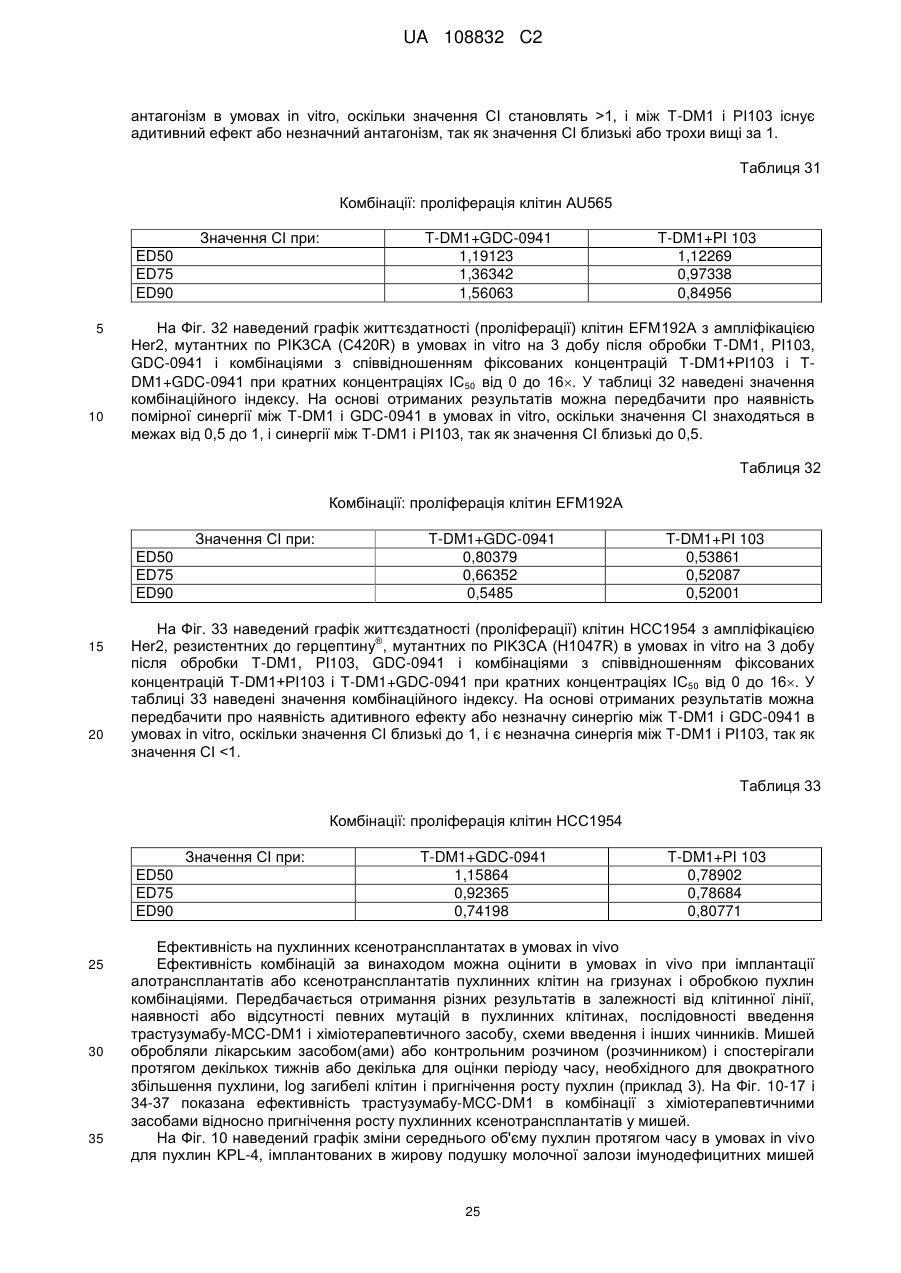
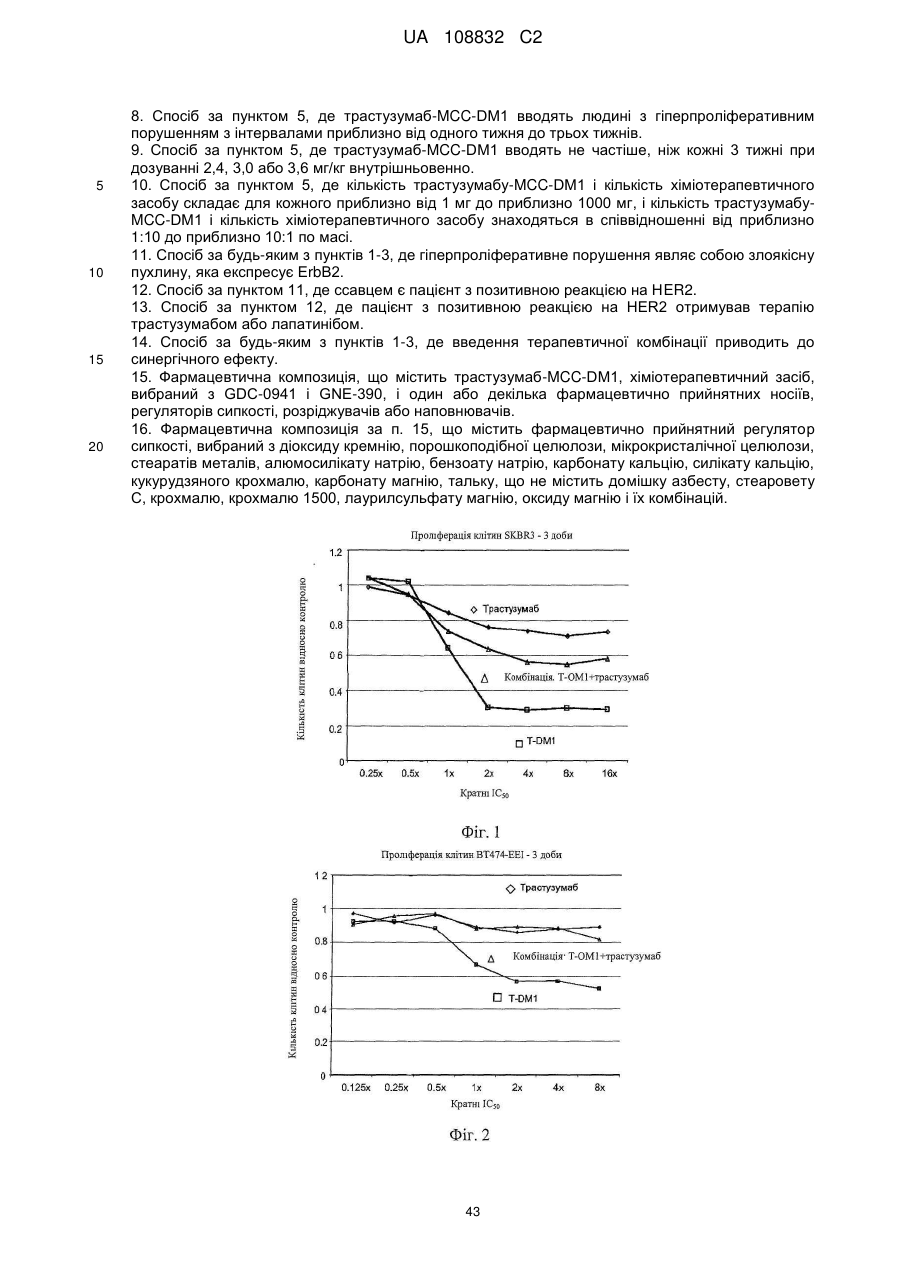
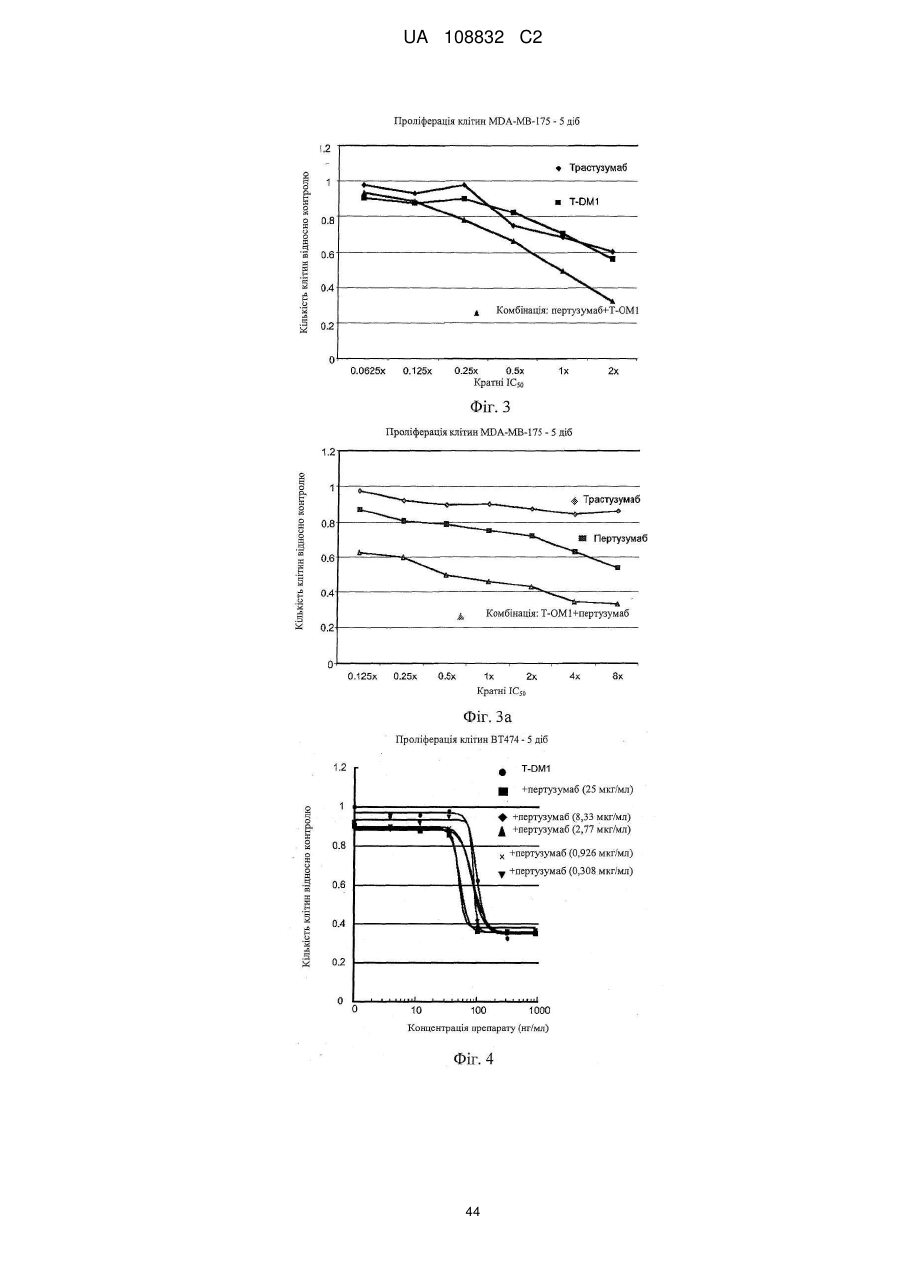
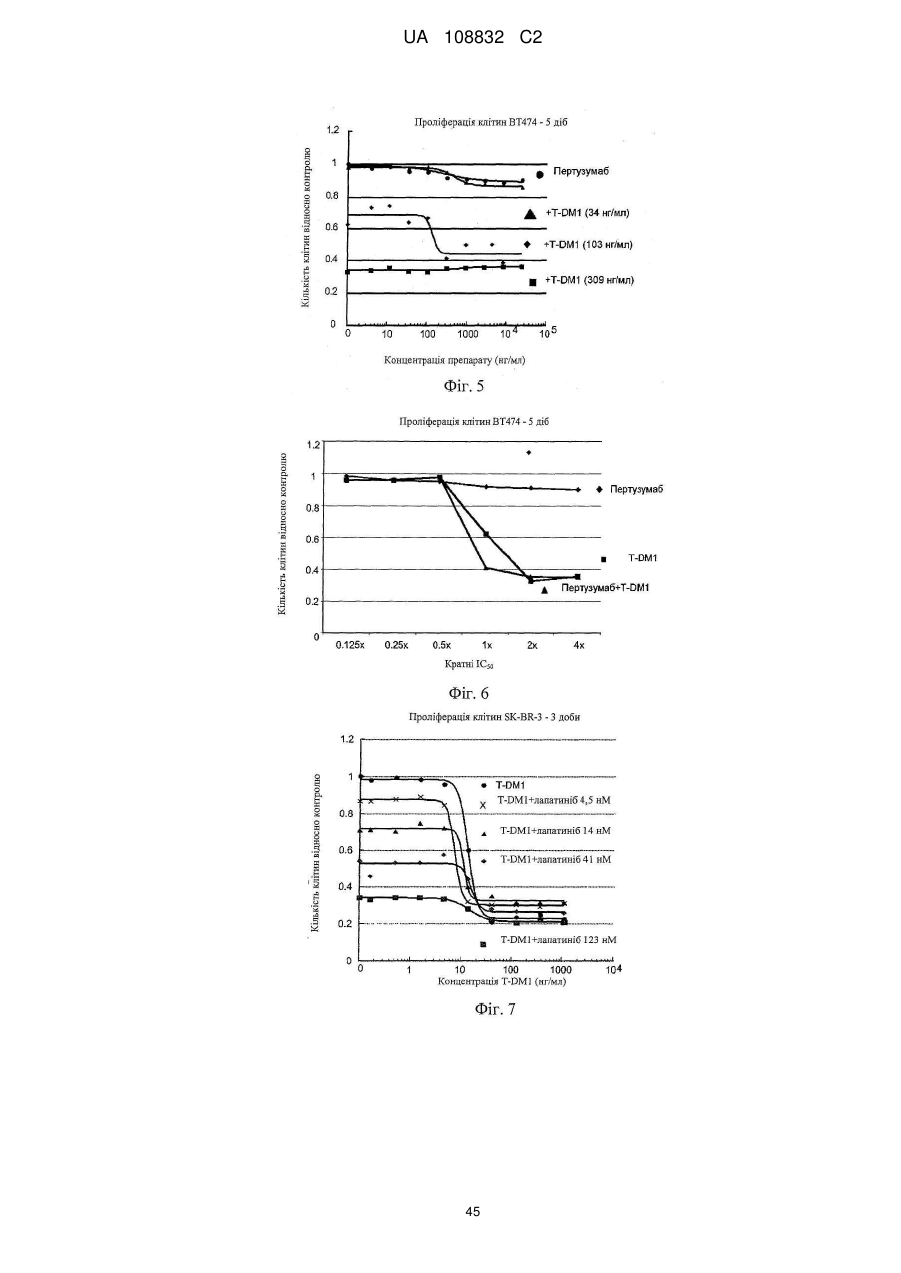
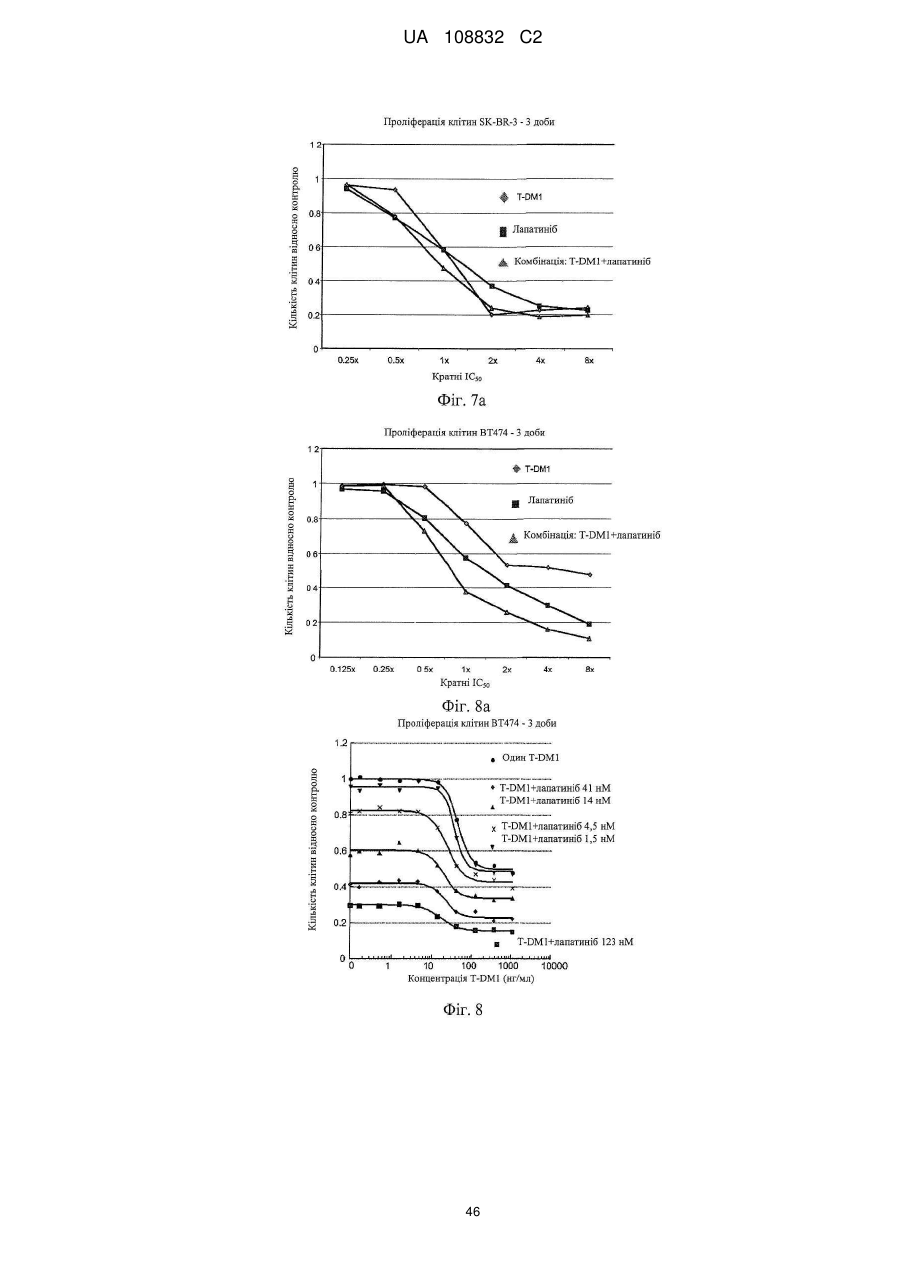
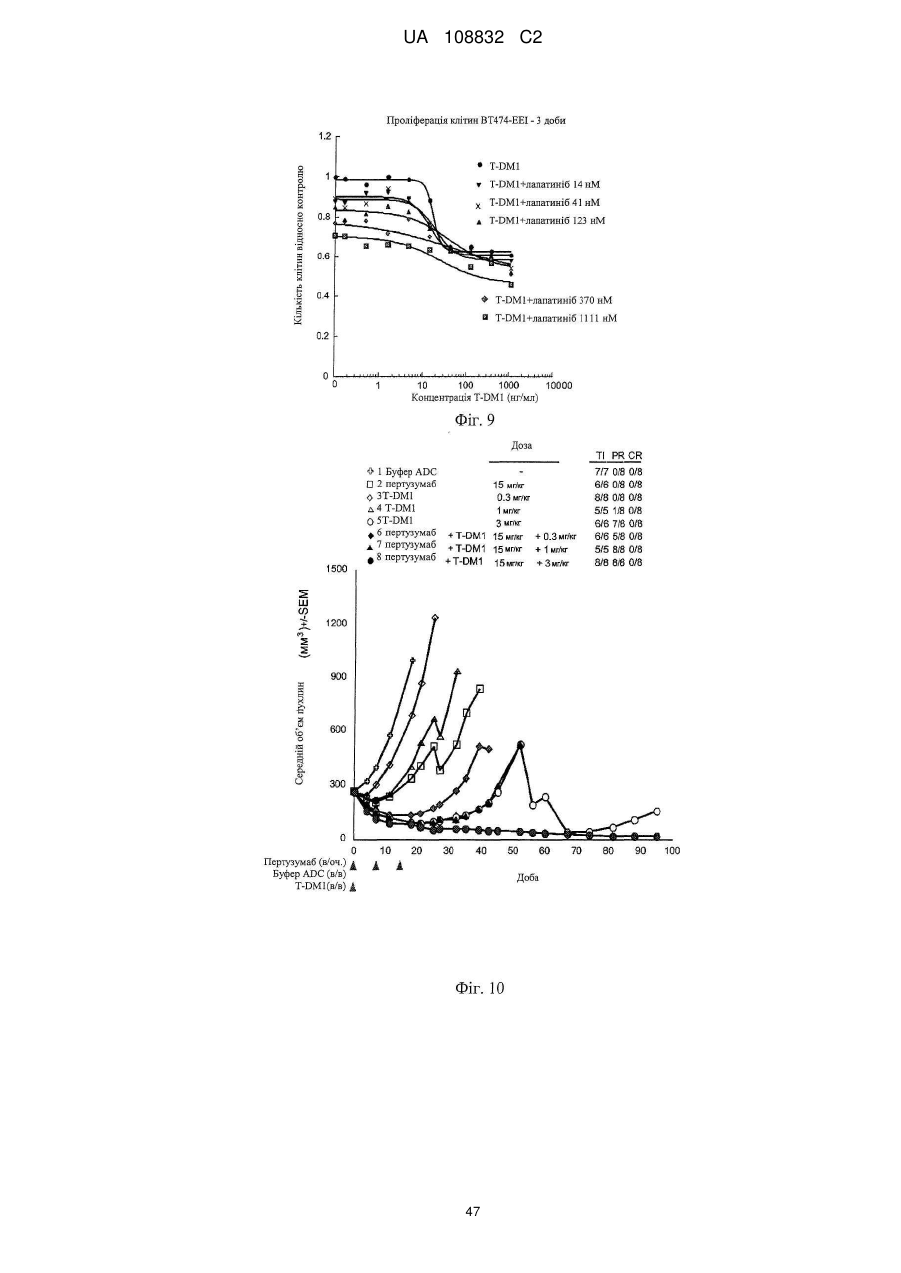
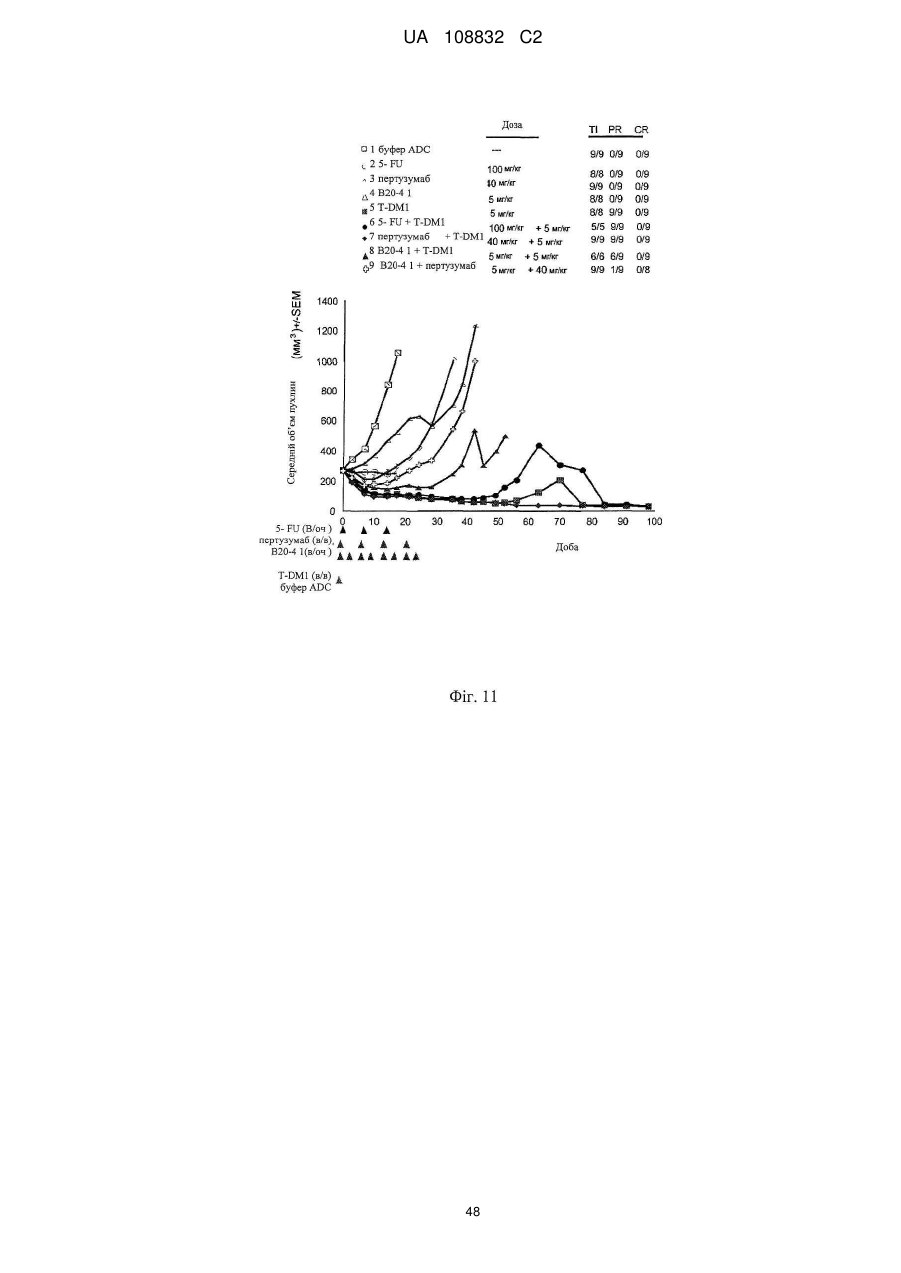
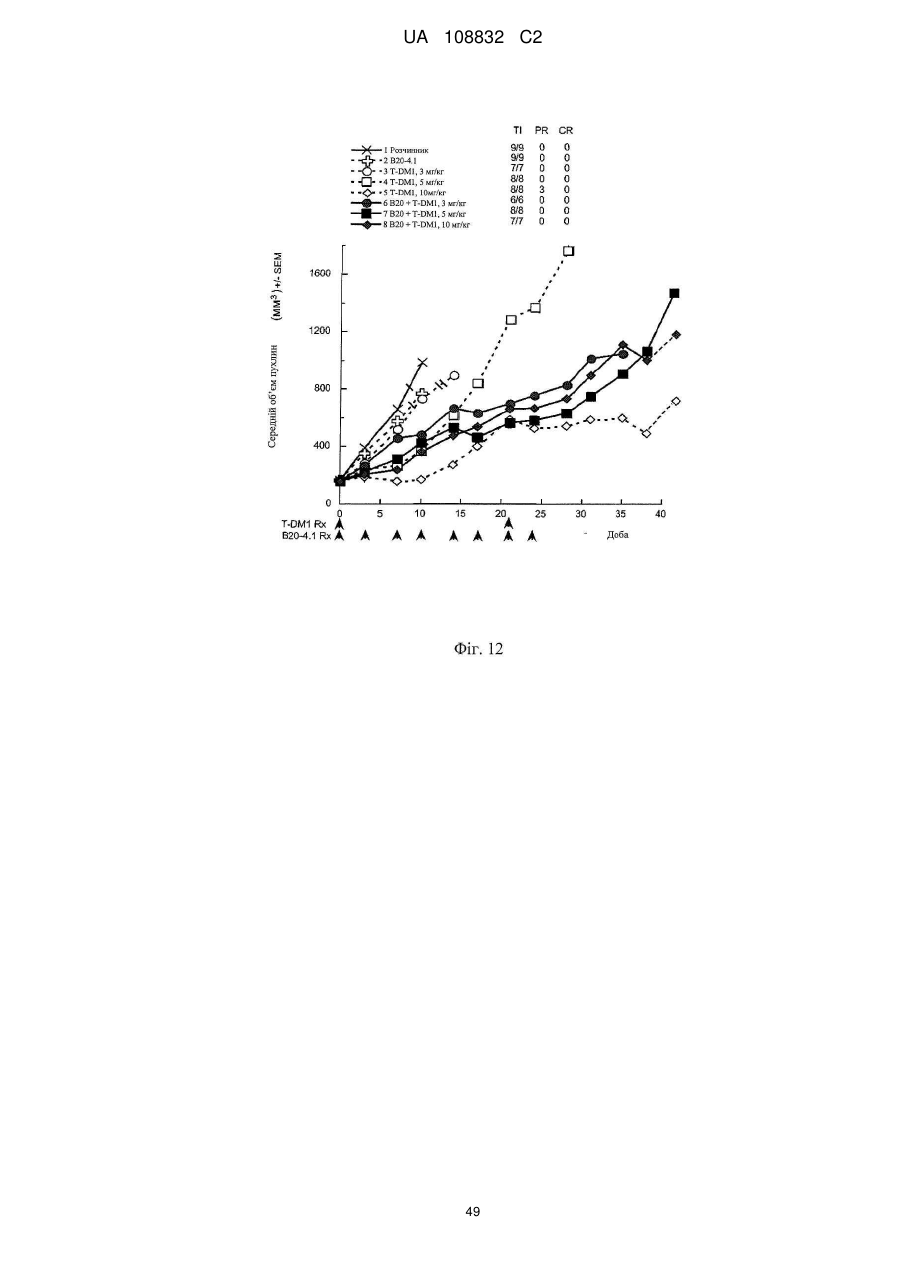
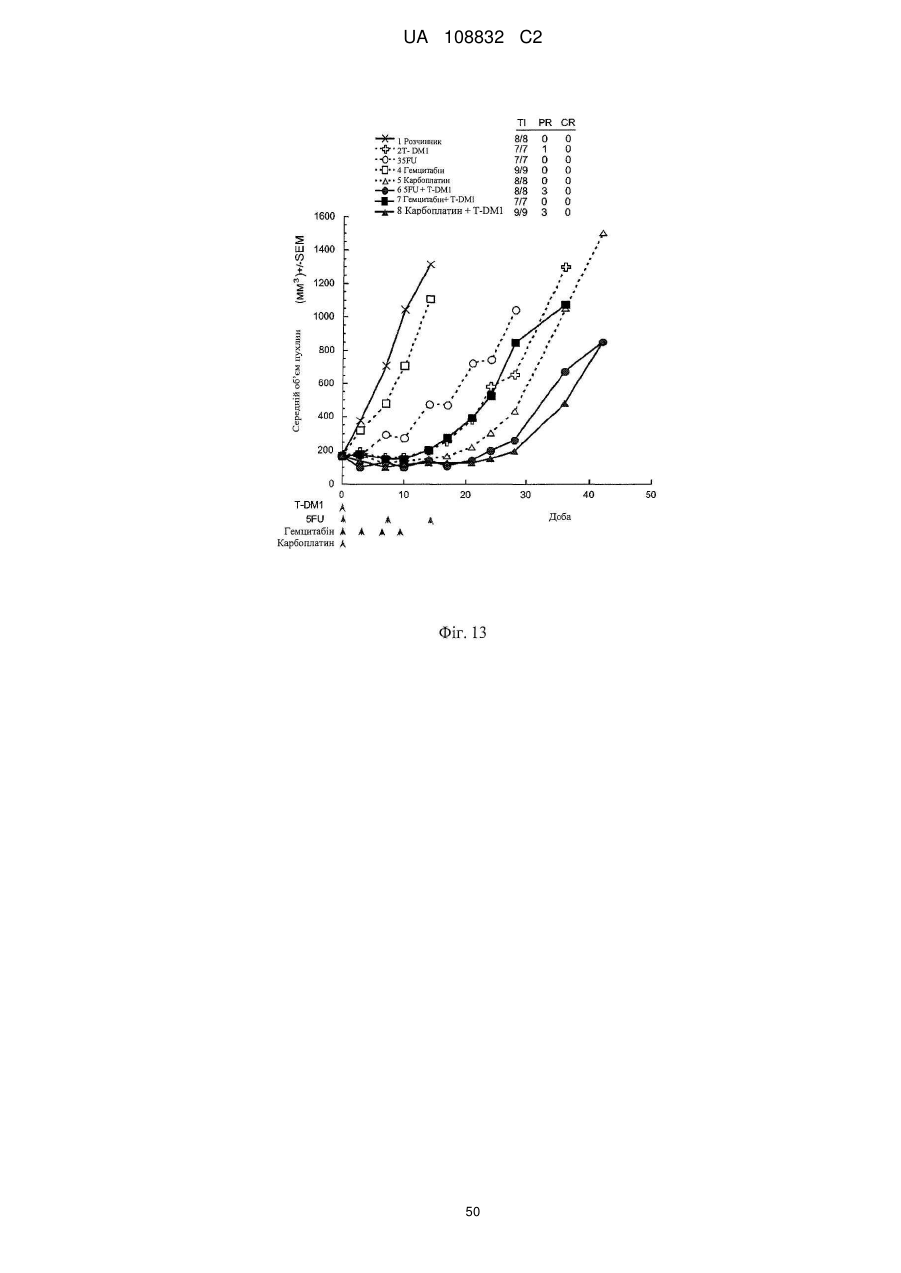
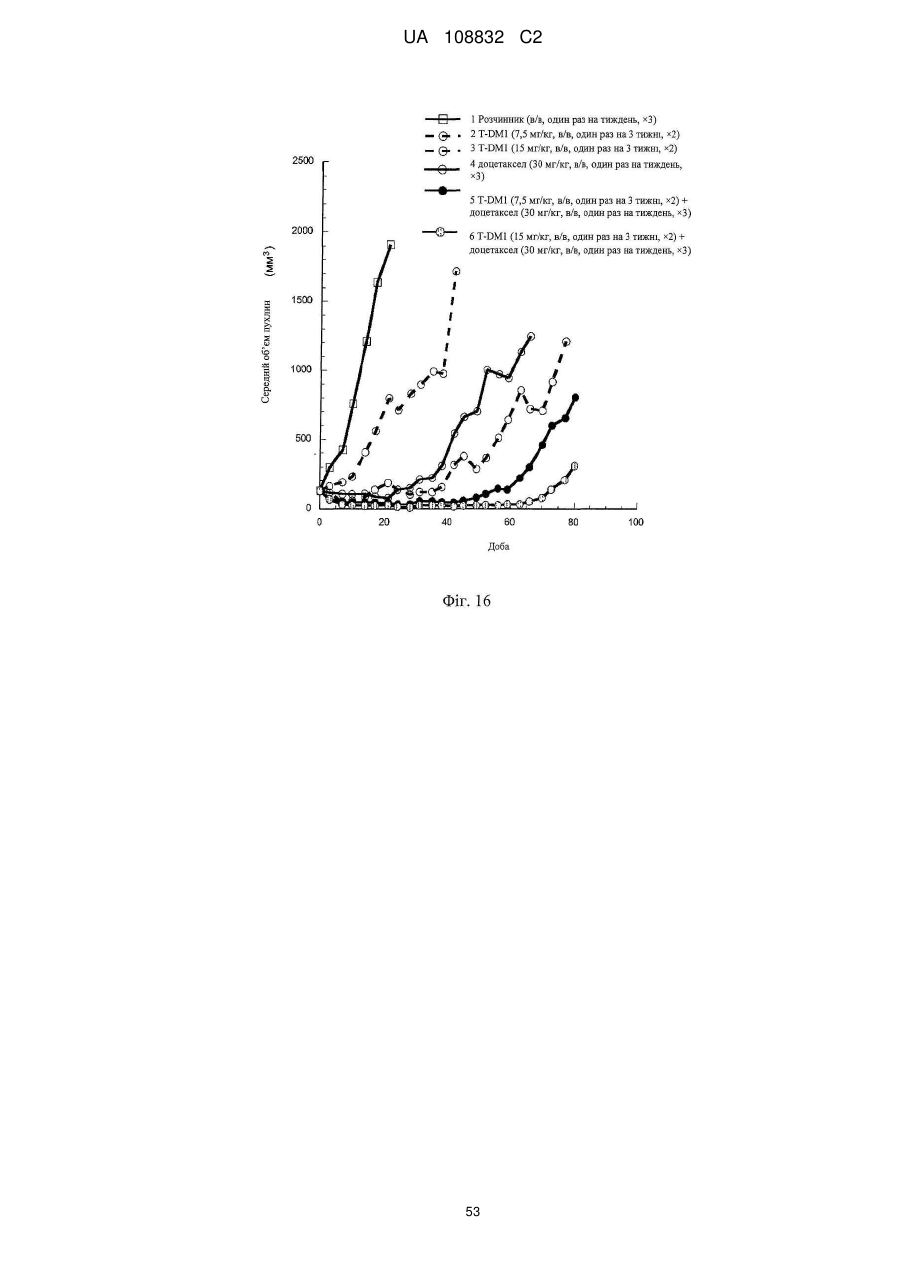
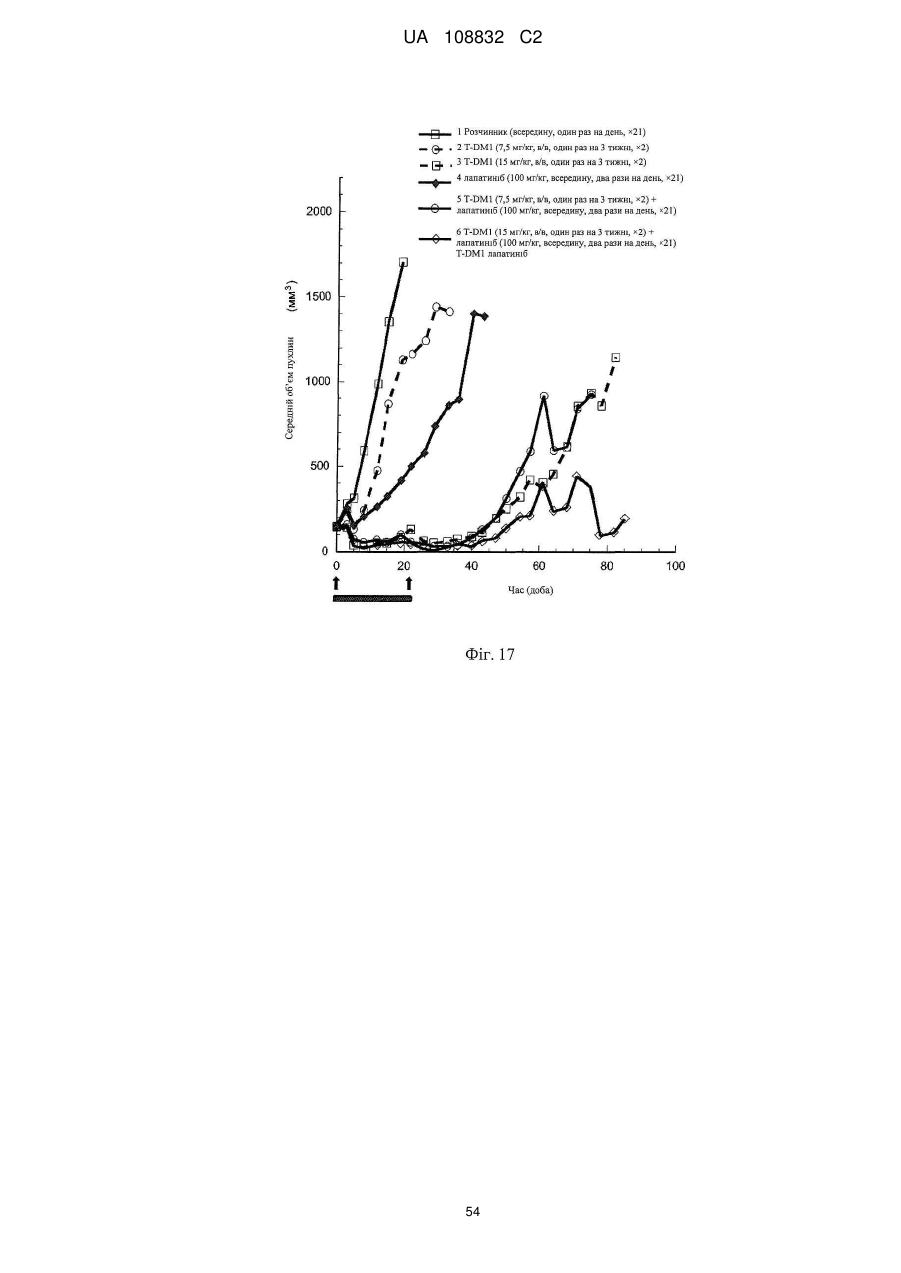
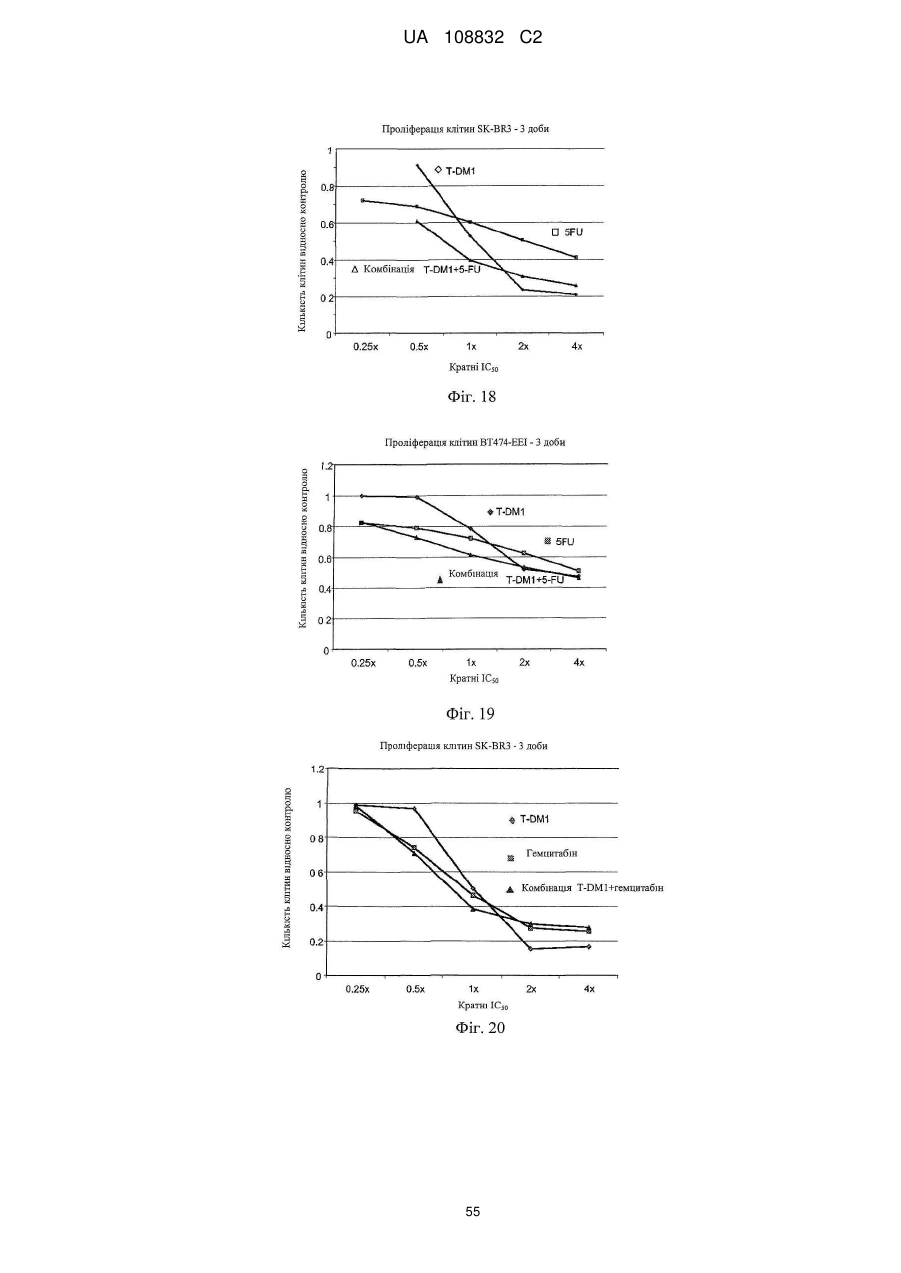
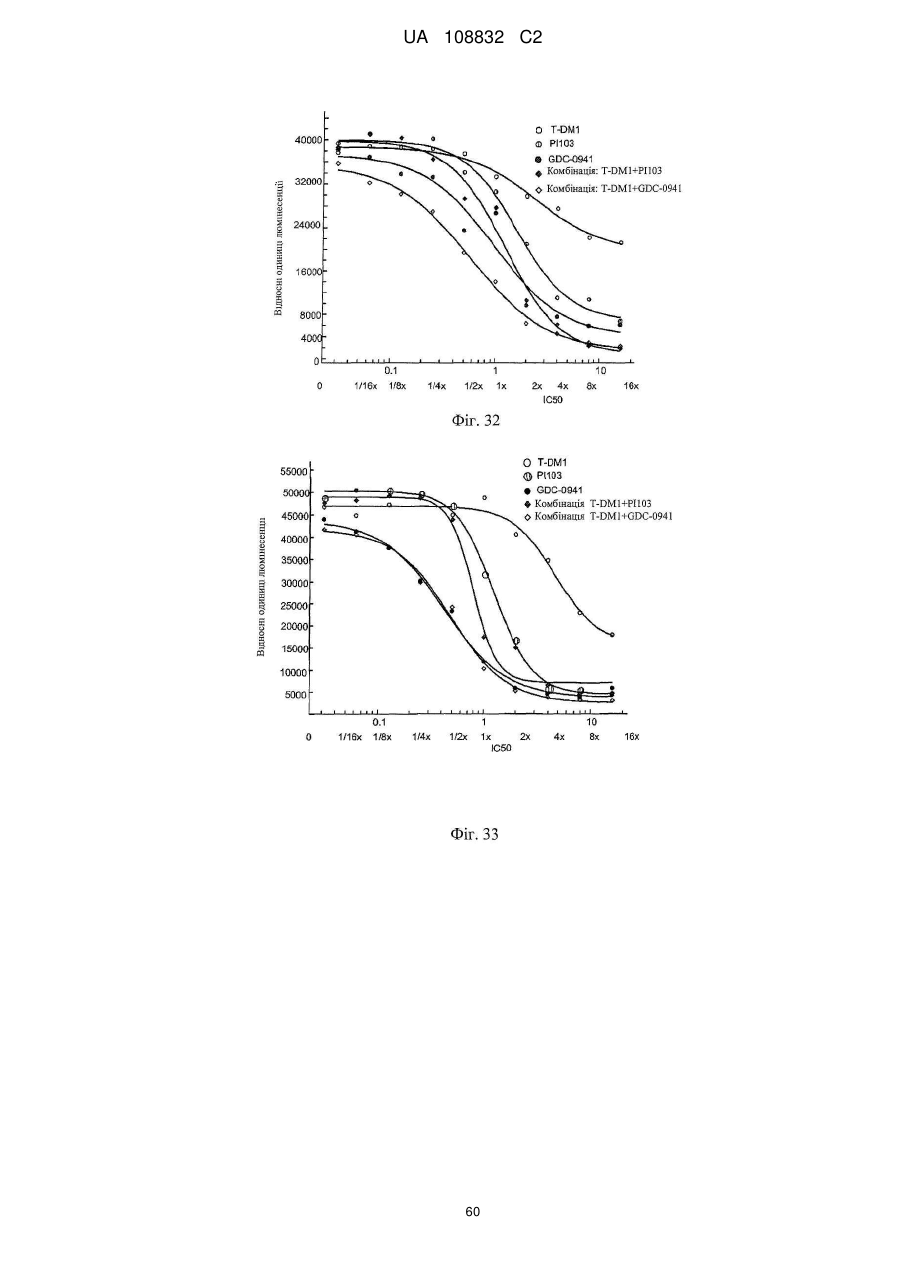
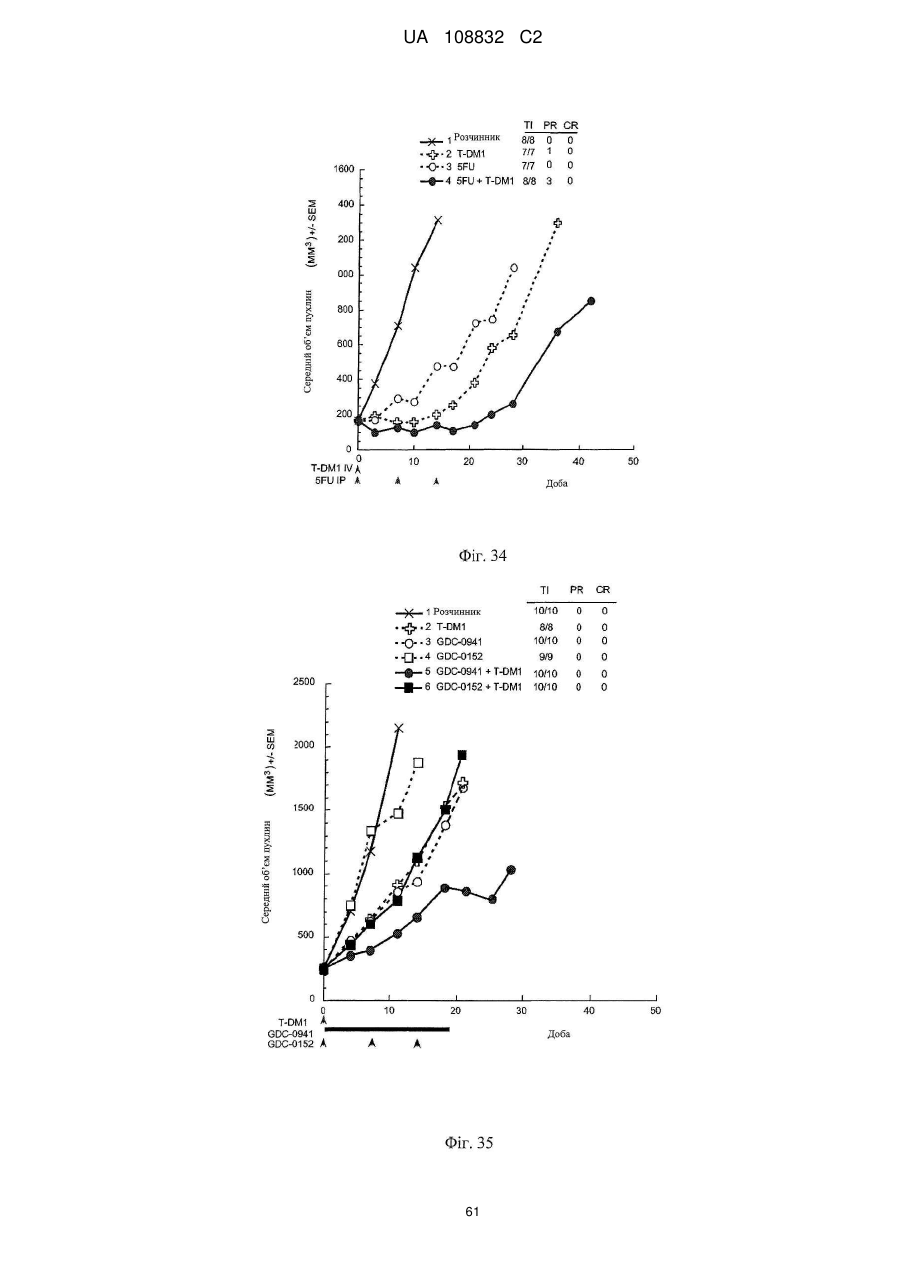
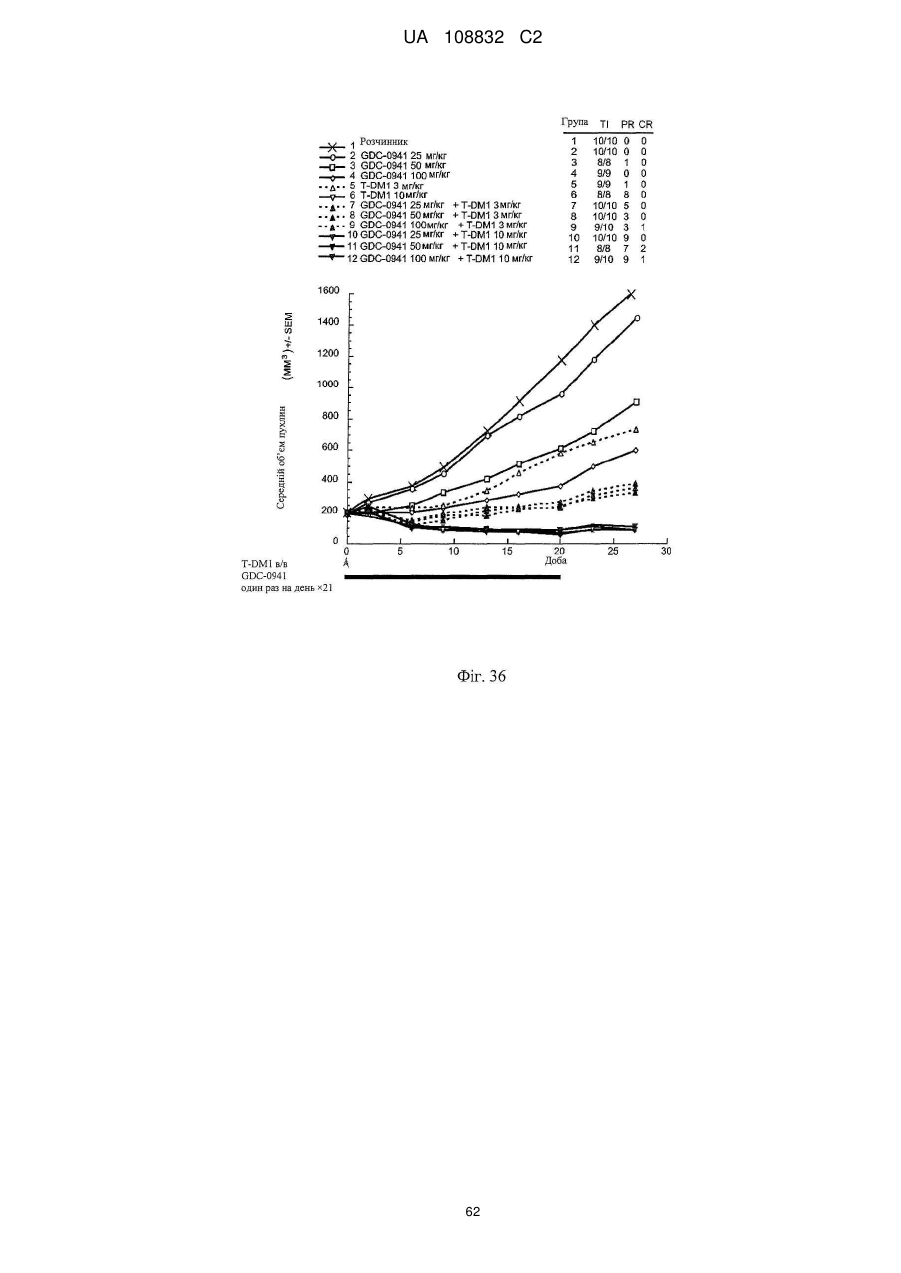
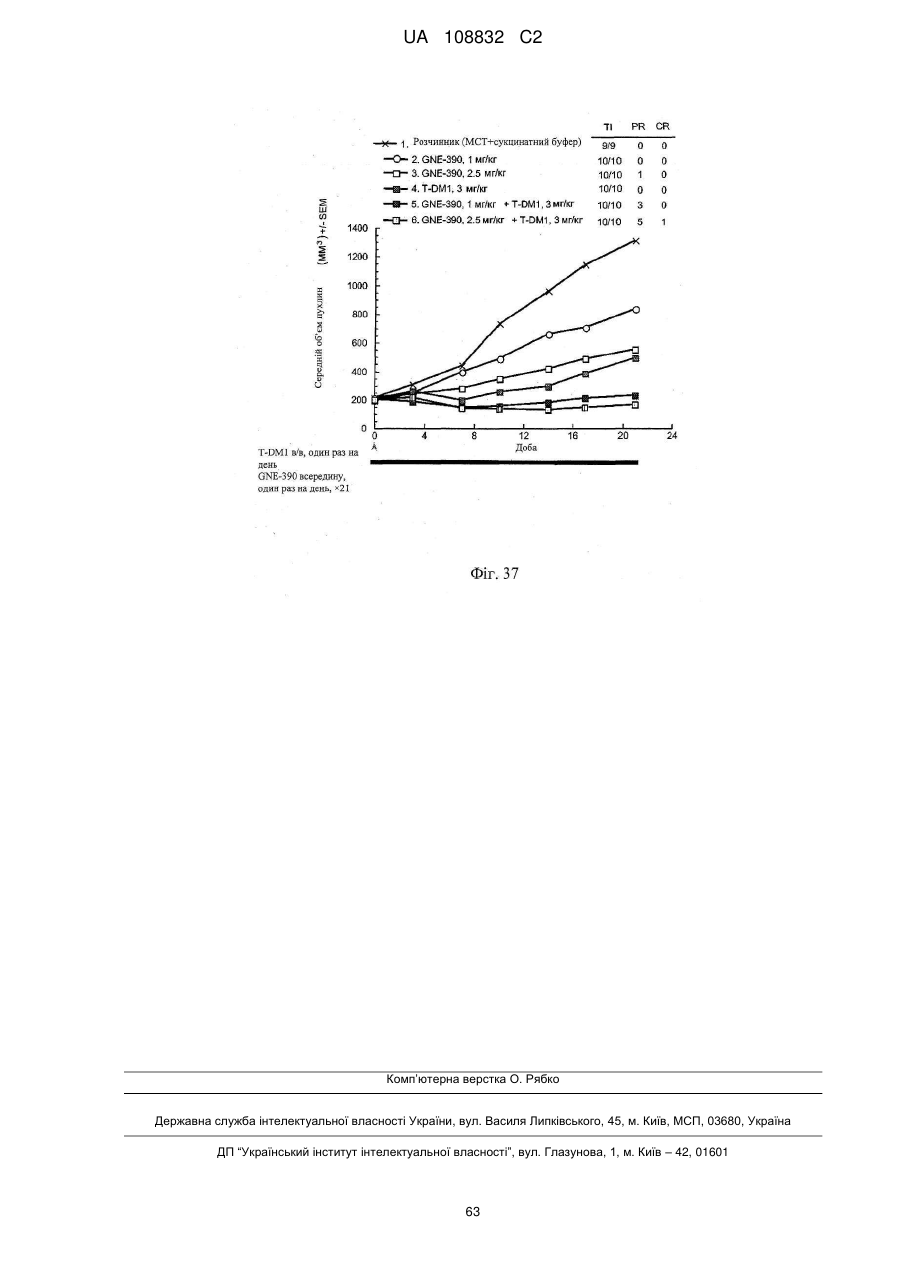
Комбінації кон’югата анти-нer2-антитіло-лікарський засіб і хіміотерапевтичних засобів і способи застосування
Номер патенту: 108832
Опубліковано: 25.06.2015
Автори: Філліпс Гейл Льюіс, Сліковскі Марк Кс., Беррі Лінн
Формула / Реферат
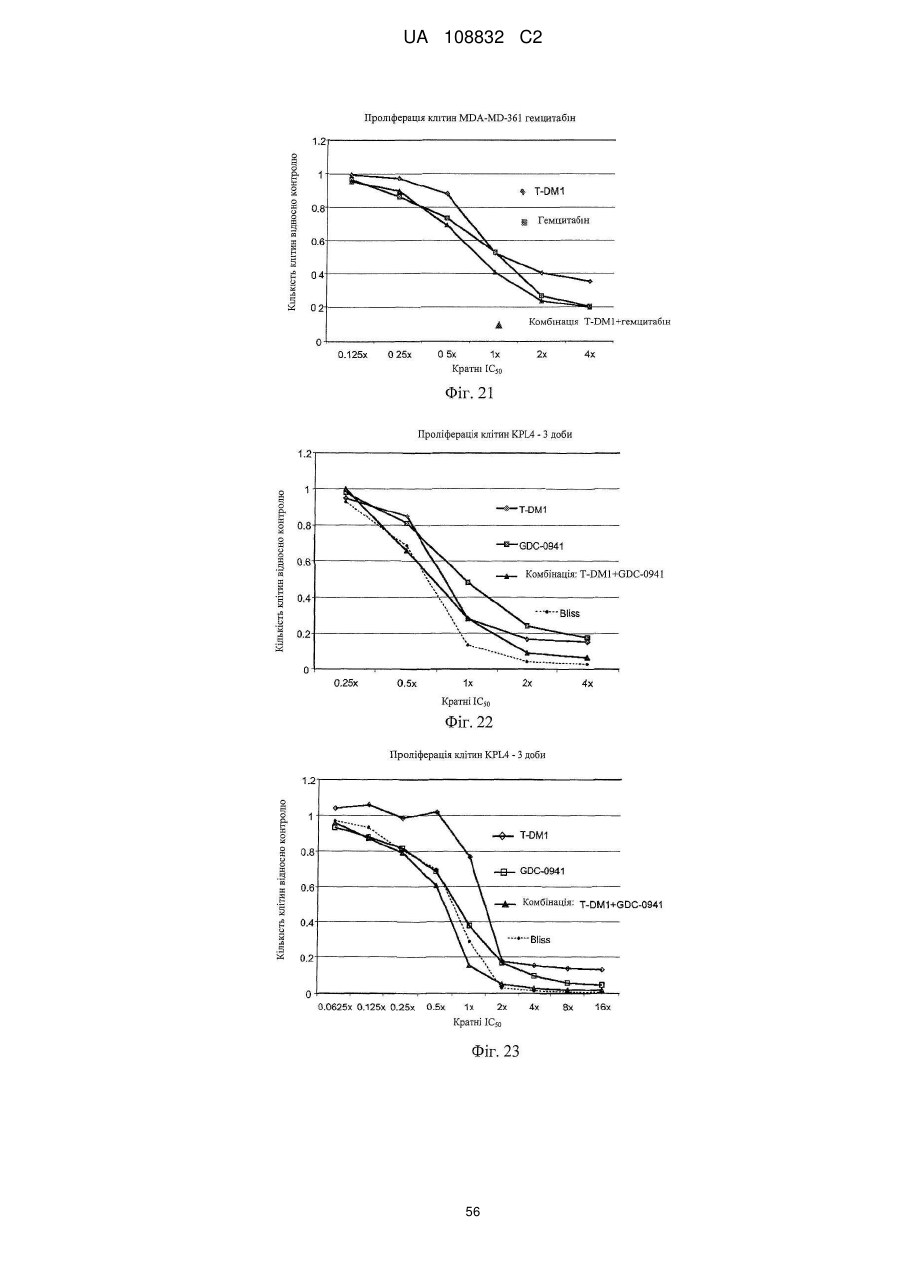
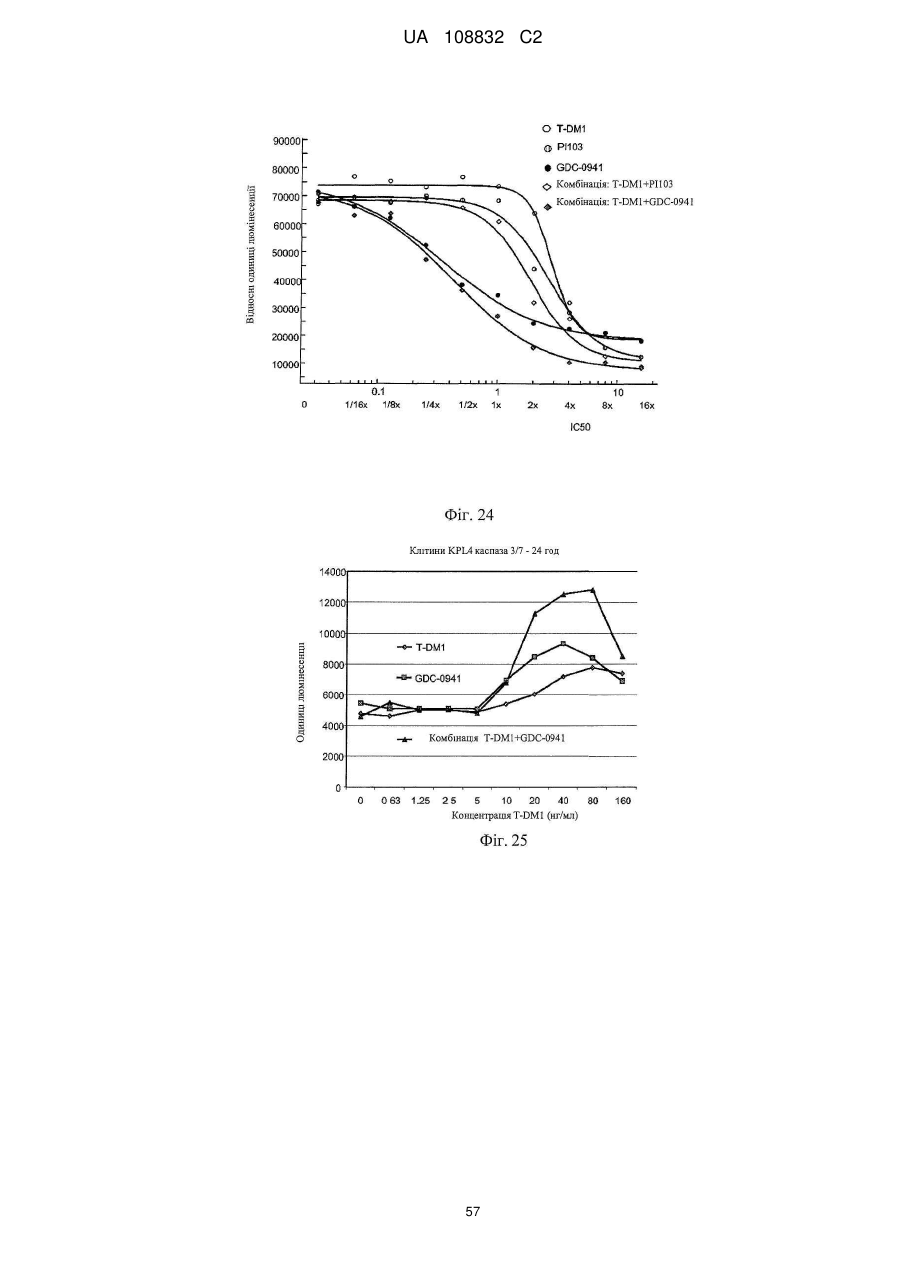
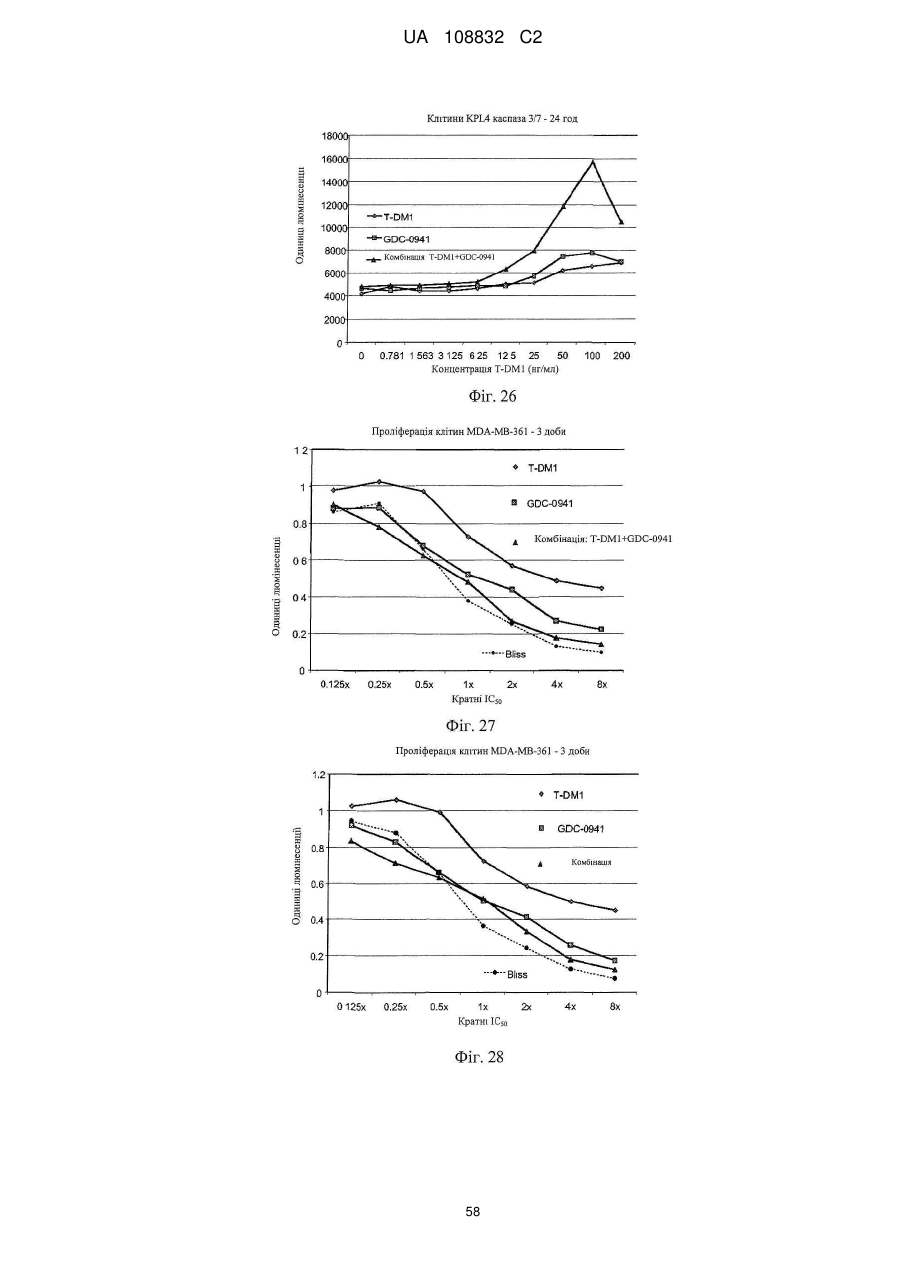
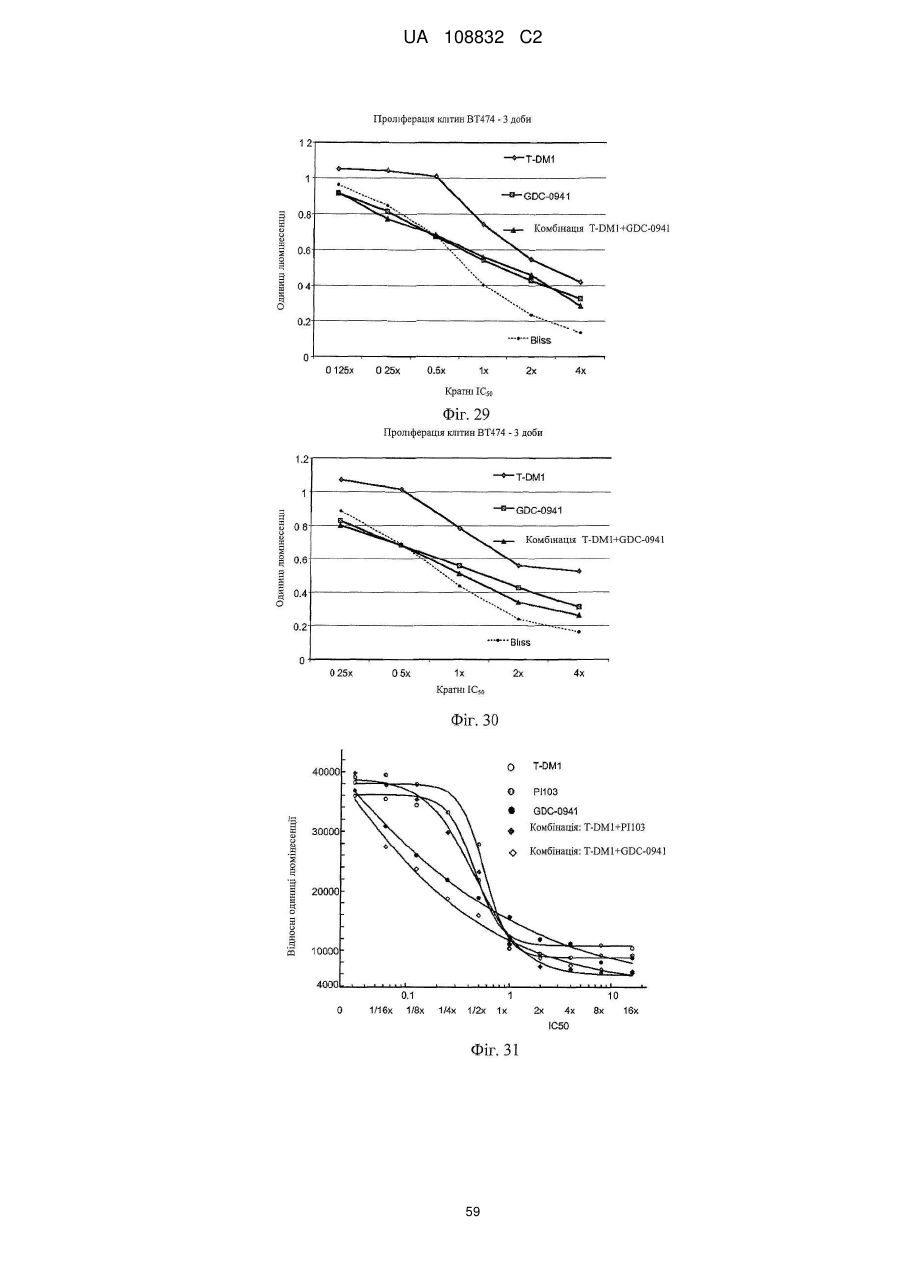
1. Спосіб лікування гіперпроліферативного порушення, який включає введення терапевтичної комбінації у вигляді комбінованої композиції або почергово ссавцю, де терапевтична комбінація містить трастузумаб-MCC-DM1 і хіміотерапевтичний засіб, вибраний з GDC-0941 і GNE-390.
2. Спосіб за п. 1, в якому хіміотерапевтичним засобом є GDC-0941.
3. Спосіб за п. 1, в якому хіміотерапевтичним засобом є GNE-390.
4. Спосіб за будь-яким з пунктів 1-3, де трастузумаб-MCC-DM1 і хіміотерапевтичний засіб вводять у вигляді комбінованої композиції.
5. Спосіб за будь-яким з пунктів 1-3, де трастузумаб-MCC-DM1 і хіміотерапевтичний засіб вводять почергово.
6. Спосіб за пунктом 5, де ссавцю вводять хіміотерапевтичний засіб і потім згодом вводять трастузумаб-MCC-DM1.
7. Спосіб за пунктом 5, де терапевтичну комбінацію вводять людині з гіперпроліферативним порушенням з інтервалами приблизно три тижні.
8. Спосіб за пунктом 5, де трастузумаб-MCC-DM1 вводять людині з гіперпроліферативним порушенням з інтервалами приблизно від одного тижня до трьох тижнів.
9. Спосіб за пунктом 5, де трастузумаб-MCC-DM1 вводять не частіше, ніж кожні 3 тижні при дозуванні 2,4, 3,0 або 3,6 мг/кг внутрішньовенно.
10. Спосіб за пунктом 5, де кількість трастузумабу-MCC-DM1 і кількість хіміотерапевтичного засобу складає для кожного приблизно від 1 мг до приблизно 1000 мг, і кількість трастузумабу-MCC-DM1 і кількість хіміотерапевтичного засобу знаходяться в співвідношенні від приблизно 1:10 до приблизно 10:1 по масі.
11. Спосіб за будь-яким з пунктів 1-3, де гіперпроліферативне порушення являє собою злоякісну пухлину, яка експресує ЕrbВ2.
12. Спосіб за пунктом 11, де ссавцем є пацієнт з позитивною реакцією на НER2.
13. Спосіб за пунктом 12, де пацієнт з позитивною реакцією на HER2 отримував терапію трастузумабом або лапатинібом.
14. Спосіб за будь-яким з пунктів 1-3, де введення терапевтичної комбінації приводить до синергічного ефекту.
15. Фармацевтична композиція, що містить трастузумаб-MCC-DM1, хіміотерапевтичний засіб, вибраний з GDC-0941 і GNE-390, і один або декілька фармацевтично прийнятних носіїв, регуляторів сипкості, розріджувачів або наповнювачів.
16. Фармацевтична композиція за п. 15, що містить фармацевтично прийнятний регулятор сипкості, вибраний з діоксиду кремнію, порошкоподібної целюлози, мікрокристалічної целюлози, стеаратів металів, алюмосилікату натрію, бензоату натрію, карбонату кальцію, силікату кальцію, кукурудзяного крохмалю, карбонату магнію, тальку, що не містить домішку азбесту, стеаровету С, крохмалю, крохмалю 1500, лаурилсульфату магнію, оксиду магнію і їх комбінацій.
Текст
Реферат: Винахід стосується способу лікування гіперпроліферативного порушення, що включає введення терапевтичної комбінації у вигляді комбінованої композиції або почергово ссавцю, де терапевтична комбінація містить трастузумаб-MCC-DM1 і хіміотерапевтичний засіб, вибраний з GDC-0941 і GNE-390. UA 108832 C2 (12) UA 108832 C2 UA 108832 C2 5 10 15 20 25 30 35 40 45 50 55 Релевантні заявки За даною непопередньою заявкою, поданою згідно з 37 CFR § 1.53(b) вимагається пріоритет згідно з 35 USC § 119(е) за попередньою заявкою на патент США № 61/037410, поданою 18 березня 2008 р., яка повністю включена в даний документ за допомогою посилання. Галузь техніки, до якої належить винахід Винахід головним чином стосується фармацевтичних комбінацій сполук, що мають активність відносно гіперпроліферативних порушень, таких як злоякісна пухлина. Також винахід стосується способів застосування комбінацій сполук для діагностики або лікування клітин ссавців в умовах in vitro, in situ і in vivo, або асоційованих патологічних станів. Рівень техніки HER2 (ErbB2) рецептор тирозинкінази є членом сімейства рецепторів епідермальних факторів росту (EGFR) трансмембранних рецепторів. Надекспресію HER2 відмічають приблизно в 20 % злоякісних пухлин молочної залози людини, і вона асоціюється з агресивним ростом і несприятливим прогнозом для пацієнток з даними пухлинами (Slamon et al., 1987, Science, 235:177-182). ® Трастузумаб (номер по CAS 180288-69-1, ГЕРЦЕПТИН , huMAb4D5-8, rhuMAb HER2, Genentech) являє собою варіант рекомбінантного, отриманого з ДНК, гуманізованого, IgG1 каппа, моноклонального антитіла мишачого антитіла до HER2, яке вибірково зв'язується з високою афінністю в клітинному тесті (Kd=5 нМ) з позаклітинним доменом білка рецептора 2 людського епідермального фактора росту, HER2 (ErbB2) (патент США № 5677171; патент США № 5821337; патент США № 6054297; патент США № 6165464; патент США № 6339142; патент США № 6407213; патент США № 6639055; патент США № 6719971; патент США № 6800738; патент США № 7074404; Coussens et al., 1985, Science, 230:1132-1139; Slamon et al., 1989, Science, 244:707-712; Slamon et al., 2001, New Engl. J. Med., 344:783-792). Трастузумаб містить людські касні області з областями, що визначають комплементарність мишачого антитіла (4D5), яке зв'язується з HER2. Трастузумаб зв'язується з антигеном HER2 і таким чином інгібує ріст пухлинних клітин. У тестах в умовах in vitro і на тваринах було показано, що трастузумаб інгібує проліферацію людських пухлинних клітин із надекспресією HER2 (Hudziak et al., 1989, Mol. Cell Biol., 9:1165-1172; Lewis et al., 1993, Cancer Immunol. Immunother: 37:255-63; Baselga et al., 1998, Cancer Res., 58:2825-2831). Трастузумаб є медіатором антитілозалежної клітинної цитотоксичності, ADCC (Lewis et al., 1993, Cancer Immunol. Immunother., 37(4):255-263; Hotaling et al., 1996, [abstract]. Proc. Annual Meeting Am. Assoc. Cancer Res., 37:471; Pegram M.D. et al., 1997, [abstract]. Proc. Annual Meeting Am. Assoc. Cancer Res., 38:602; Sliwkowski M. et al., 1999, Seminars in Oncology, 26(4), Suppl. 12:60-70; Yarden Y. and Sliwkowski M., 2001, Nature Reviews: Molecular Cell Biology, Macmillan Magazines, Ltd., Vol. 2:127-137). ® Герцептин був дозволений до застосування в 1998 для лікування пацієнток з метастатичними злоякісними пухлинами молочної залози з надекспресією ErbB2 (Baselga et al., 1996, J. Clin. Oncol., 14:737-744), які до цього отримували інтенсивну протипухлинну терапію, і з того часу його застосували на більш ніж 300000 пацієнтках (Slamon D.J. et al., N. Engl. J. Med., 2001, 344:783-92; Vogel C.L. et al., J. Clin. Oncol., 2002, 20:719-26; Marty M. et al., J. Clin. Oncol., 2005, 23:4265-74; Romond E.H. et al., ТN. Engl. J. Med., 2005, 353:1673-84; Piccart-Gebhart M.J. et al., N. Engl. J. Med., 2005, 353:1659-72; Slamon D. et al., [abstract]. Breast Cancer Res. Treat., ® 2006, 100 (Suppl. 1):52). У 2006 р. FDA дозволила герцептин (трастузумаб, Genentech Inc.) до застосування як складового компоненту в схемі лікування, що містить доксорубіцин, циклофосфамід і паклітаксел, для ад'ювантного лікування пацієнток з HER2-позитивною, ® метастатичною злоякісною пухлиною молочної залози. Незважаючи на те, що герцептин , розроблений для пацієнток з HER2-позитивними пухлинами, забезпечував більш високий терапевтичний ефект в порівнянні з однією хіміотерапією, в кінцевому результаті у всіх пацієнток з HER2-позитивною метастатичною злоякісною пухлиною молочної залози (MBC) мало місце прогресування захворювання на доступних лікарських засобах. Залишалися можливості для поліпшення ефективності в лікуванні пацієнток з МВС. Незважаючи на різні механізми дії трастузумабу, у ряду пацієнток, що зазнали лікування трастузумабом, не було відповіді на лікування або відповідь припинилася після позитивного періоду лікування. Деякі ® HER2+ (HER2-позитивні) пухлини не відповідали на лікування герцептином і у більшості пацієнток, у яких спостерігали відповідь пухлин, в кінцевому результаті мало місце прогресування захворювання. У клініці є істотна потреба в розробці додаткових, направлених на HER2 протипухлинних засобів для лікування пацієнтів з пухлинами, які надмірно експресують HER2, або з іншими захворюваннями, асоційованими з експресією HER2, які не ® відповідають або слабо відповідають на лікування герцептином . 1 UA 108832 C2 5 10 15 20 25 30 35 40 45 50 55 60 Альтернативним підходом для антитіло-направленої терапії є застосування антитіл для доставки цитотоксичних лікарських засобів специфічно в антиген-експресуючі пухлинні клітини. Майтансиноїди, похідні антимітотичного засобу майтансину, зв'язуються з мікротрубочками аналогічно лікарським засобам на основі алкалоїдів барвінку (Issell B.F. et al., 1978, Cancer Treat. Rev., 5:199-207; Cabanillas F. et al., 1979, Cancer Treat. Rep., 63:507-509). Кон'югати антитіло-лікарський засіб (ADC), що складаються з майтансиноїду DM1, зв'язаного з трастузумабом, проявляють високу протипухлинну активність на HER2-експресуючих чутливих до трастузумабу і резистентних до трастузумабу лініях пухлинних клітин і на моделях ксенотрансплантатів злоякісної пухлини молочної залози людини. Ефективність кон'югату майтансиноїдів, зв'язаних з мишачим антитілом проти HER2, ТА.1 через лінкер МСС, в 200 разів вище в порівнянні з відповідним кон'югатом з дисульфідним лінкером (Chari et al., 1992, Cancer Res., 127-133). Кон'югати антитіло-лікарський засіб (ADC), що складаються з майтансиноїду, DM1, зв'язаного з трастузумабом, проявляють високу протипухлинну активність на чутливих до трастузумабу і резистентних до трастузумабу лініях пухлинних клітин і на моделях ксенотрансплантатів злоякісної пухлини молочної залози людини. У цей час кон'югат трастузумаб-MCC-DM1 (T-DM1) проходить фазу II клінічних випробувань у пацієнтів, які стійкі до лікування препаратами, направленими на HER2 (Beeram et al., 2007, "А phase I study of trastuzumab-MCC-DM1 (T-DM1), а first-in-class HER2 antibody-drug conjugate (ADC) in patients rd (pts) with HER2+metastatic breast cancer (BC) ", American Society of Clinical Oncology 43 :June 02 (Abs 1042; Krop et al., European Cancer Conference ECCO, Poster 2118, September 23-27, 2007, Barcelona; патент США № 7097840; заявка на патент США № 2005/0276812; заявка на патент США № 2005/0166993). Комбінована терапія, в якій використовують два або декілька лікарських засобів по певній схемі або в певній формі введення, як правило, має одну або декілька цілей: (i) зниження частоти виникнення набутої резистентності об'єднанням лікарських засобів з мінімальною перехресною резистентністю, (ii) зниження дозування лікарських засобів, які не є токсичними, і має аналогічний терапевтичний профіль для досягнення ефективності з проявом менших побічних ефектів, тобто збільшенням терапевтичного індексу, (iii) сенсибілізація клітин до впливу одного лікарського засобу через дію іншого лікарського засобу, за допомогою зміни стадії клітинного циклу або здатності до росту і (iv) досягнення підвищеної ефективності при використанні адитивної дії або декілька ніж адитивної дії, ефектів в біологічній активності двох лікарських засобів (Pegram M. et al., 1999, Oncogene, 18:2241-2251; Konecny G. et al., 2001, Breast Cancer Res. and Treatment, 67:223-233; Pegram M. et al., 2004, J. Nat. Cancer Inst., 96(10):739-749; Fitzgarald et al., 2006, Nature Chem. Biol., 2(9):458-466; Borisy et al., 2003, Proc. Natl. Acad. Sci., 100(13):7977-7982). Адитивність Леве (Chou T.C. and Talalay Р., 1977, J. Biol. Chem., 252:6438-6442; Chou T.C. and Talalay Р., 1984, Adv. Enzyme Regul., 22:27-55; Berenbaum M.C., 1989, Pharmacol. Rev., 41:93-141) і незалежність/синергія Блісса (Bliss C.I., 1956, Bacteriol. Rev., 20:243-258; Greco et al., 1995, Pharmacol. Rev., 47:331-385) є методами, що застосовуються для розрахунку передбачуваного взаємовідношення доза-ефект при комбінованій терапії в порівнянні з монотерапією, засновані на таких параметрах, як IC50, дозі лікарського засобу, необхідній для інгібування 50 % мішені і що дорівнює Ki в найбільш простому випадку. Повідомлялося про застосування антитіл-інгібіторів димеризації HER2 і інгібіторів EGFR для комбінованої терапії раку (заявка на патент США № 2007/0020261). Трастузумаб-MCC-DM1 (TDM1) і пертузумаб окремо виявили ефективність на пацієнтках з MBC, і було показано, що комбінація пертузумабу і трастузумабу є активною у пацієнток з HER-позитивними MBC (Baselga J. et al., "А Phase II trial of trastuzumab and pertuzumab in patients with HER2-positive metastatic breast cancer that had progressed during trastuzumab therapy: full response data", European Society of Medical Oncology, Stockholm, Sweden, September 12-16, 2008). Суть винаходу Винахід головним чином стосується кон'югату анти-HER2-антитіло-лікарський засіб, трастузумабу-МСС-DM1, який вводять в комбінації з одним або декількома хіміотерапевтичними засобами, для пригнічення росту пухлинних клітин. Деякі комбінації трастузумабу-МСС-DM1 і хіміотерапевтичного засобу проявляють синергічну дію в пригніченні росту пухлинних клітин в умовах in vitro і in vivo. Комбінації і способи за винаходом можуть бути придатними при лікуванні гіперпроліферативних порушень, таких як злоякісна пухлина. Комбінації можуть інгібувати ріст пухлин у ссавців і можуть бути придатними для лікування людей із злоякісними пухлинами. В одному аспекті винахід стосується способу лікування гіперпроліферативного порушення, що включає введення терапевтичної комбінації у вигляді комбінованої композиції або почергово ссавцеві, в якому терапевтична комбінація містить терапевтично ефективну кількість 2 UA 108832 C2 5 10 15 20 25 30 35 40 45 50 55 трастузумабу-МСС-DM1 і терапевтично ефективну кількість хіміотерапевтичного засобу, вибраного з антитіла-інгібітора димеризації HER2, антитіла до VEGF, 5-FU, карбоплатину, лапатинібу, ABT-869, доцетакселу, GDC-0941 і GNE-390. Терапевтично ефективну кількість трастузумабу-МСС-DM1 і терапевтично ефективну кількість хіміотерапевтичного засобу можна вводити у вигляді комбінованої композиції або почергово. Також винахід стосується способів застосування композицій для діагностики або лікування клітин ссавців, організмів в умовах in vitro, in situ і in vivo, або асоційованих патологічних станів. Також винахід стосується способів, в яких введення терапевтичної комбінації приводить до синергічного ефекту. Ще один аспект винаходу стосується фармацевтичних композицій, що містять трастузумабМСС-DM1, хіміотерапевтичний засіб, вибраний з антитіла-інгібітора димеризації HER2, антитіла до VEGF, 5-FU, карбоплатину, лапатинібу, ABT-869, доцетакселу, GDC-0941 і GNE-390; і один або декілька фармацевтично прийнятних носіїв, регуляторів сипкості, розріджувачів або наповнювачів. Ще один аспект винаходу стосується способів лікування гіперпроліферативного захворювання або порушення, що включають введення ссавцеві, який потребує такого лікування, терапевтично ефективних кількостей трастузумабу-МСС-DM1 і хіміотерапевтичного засобу. Трастузумаб-МСС-DM1 і хіміотерапевтичний засіб можна формулювати спільно для введення в комбінації у вигляді фармацевтичної композиції або їх можна вводити почергово (що чергуються, послідовні введення) у вигляді терапевтичної комбінації. В одному варіанті здійснення T-DM1 вводять інфузією, і хіміотерапевтичний засіб вводять перорально. Ще один аспект винаходу стосується способів прогнозу ефективних лікарських комбінацій відносно ефективності в умовах in vivo, де комбінації містять трастузумаб-МСС-DM1 і протипухлинний хіміотерапевтичний засіб, що широко застосовується. Дані по ефективності, отримані в дослідах за оцінкою проліферації клітин в умовах in vitro і на пухлинних ксенотрансплантатах в умовах in vivo, піддають якісному і кількісному аналізу. Методи кількісного аналізу можуть бути засновані на принципі медіанного ефекту Chou&Talalay і ізоболограмах, за допомогою яких визначають значення комбінаційного індексу (CI) для встановлення синергізму, антагонізму або адитивного ефекту, або вони можуть бути засновані на незалежності відхилення Блісса. Ще один аспект винаходу стосується способу застосування терапевтичної комбінації за винаходом для лікування у ссавця захворювання або стану, такого як злоякісна пухлина, що включає захворювання, яке модулюється HER2 або KDR9 (рецептором 1 VEGF). Ще один аспект винаходу стосується застосування терапевтичної комбінації за винаходом у виробництві лікарського засобу для лікування у ссавця захворювання або стану, такого як злоякісна пухлина, що включає захворювання, яке модулюється HER2 або KDR9 (рецептором 1 VEGF). Ще один аспект винаходу стосується виробів або наборів, що містять трастузумаб-МССDM1, хіміотерапевтичний засіб, контейнер і необов'язково вкладиш в упаковці або етикетку, з описом лікування. Ще один аспект винаходу стосується способу визначення сполук для застосування в комбінації для лікування злоякісної пухлини, що включає: (а) введення терапевтичної комбінації трастузумабу-МСС-DM1 і хіміотерапевтичного засобу, вибраного з антитіла-інгібітора димеризації HER2, антитіла до VEGF, 5-FU, карбоплатину, лапатинібу, ABT-869, доцетакселу, GDC-0941 і GNE-390 в пухлинну клітинну лінію в умовах in vitro і (b) визначення синергічного або не синергічного ефекту. Додаткові переваги і нові ознаки даного винаходу будуть частково наведені в подальшому описі, і частково стануть зрозумілими фахівцям в даній галузі при ознайомленні з подальшою заявкою або вивчені при практичному застосуванні винаходу. Переваги винаходу можуть бути реалізовані і досягнуті за допомогою інструментального виконання, комбінацій, композицій і способів, заявлених в прикладеній формулі винаходу. Короткий опис Фігур На Фіг. 1 наведений графік залежності життєздатності клітин SK-BR-3 в умовах in vitro на 3 добу від кратних концентрацій IC50 трастузумабу, трастузумабу-МСС-DM1 (T-DM1) і комбінації трастузумабу і T-DM1. На Фіг. 2 наведений графік залежності життєздатності клітин BT-474 EEI в умовах in vitro на 3 добу від кратних концентрацій IC50 трастузумабу, трастузумабу-МСС-DM1 (T-DM1) і комбінації трастузумабу і T-DM1. 3 UA 108832 C2 5 10 15 20 25 30 35 40 45 50 55 60 На Фіг. 3 наведений графік залежності життєздатності клітин MDA-MB-175 в умовах in vitro на 5 добу від кратних концентрацій IC50 пертузумабу, трастузумабу-МСС-DM1 (T-DM1) і комбінації пертузумабу і T-DM1. На Фіг. 3а наведений графік залежності життєздатності клітин MDA-MB-175 в умовах in vitro на 5 добу від кратних концентрацій IC50 пертузумабу, трастузумабу-МСС-DM1 (T-DM1) і комбінації пертузумабу і T-DM1. На Фіг. 4 наведений графік залежності життєздатності клітин BT-474 в умовах in vitro на 5 добу від різних фіксованих концентрацій пертузумабу в комбінації з концентрацією реакції у відповідь трастузумабу-МСС-DM1 (T-DM1) і різних концентрацій одного T-DM1. На Фіг. 5 наведений графік залежності життєздатності клітин BT-474 в умовах in vitro на 5 добу від різних фіксованих концентрацій трастузумабу-МСС-DM1 (T-DM1) в комбінації з концентрацією пертузумабу реакції у відповідь і різних концентрацій одного пертузумабу. На Фіг. 6 наведений графік залежності життєздатності клітин ВТ-474 в умовах in vitro на 5 добу від кратних концентрацій IC50 пертузумабу, трастузумабу-МСС-DM1 (T-DM1) і комбінації пертузумабу і T-DM1. На Фіг. 7 наведений графік залежності життєздатності клітин SK-BR-3 в умовах in vitro на 3 добу від різних концентрацій T-DM1 в комбінації з фіксованими концентраціями лапатинібу (4,5 нМ; 14 нМ; 41 нМ; 123 нМ) і різних концентрацій одного T-DM1 (0-1000 нг/мл). На Фіг. 7а наведений графік залежності життєздатності клітин SK-BR-3 в умовах in vitro на 3 добу від кратних концентрацій IC50 T-DM1, лапатинібу і комбінацій з співвідношенням фіксованих концентрацій T-DM1 і лапатинібу. На Фіг. 8а наведений графік залежності життєздатності клітин BT-474 в умовах in vitro на 3 добу від кратних концентрацій IC50 T-DM1, лапатинібу і комбінацій з співвідношенням фіксованих концентрацій T-DM1 і лапатинібу. На Фіг. 8 наведений графік залежності життєздатності клітин BT-474 в умовах in vitro на 3 добу від різних концентрацій T-DM1 в комбінації з фіксованими концентраціями лапатинібу (1,5 нМ; 4,5 нМ; 14 нМ; 41 нМ; 123 нМ) і різних концентрацій одного T-DM1 (0-1000 нг/мл). На Фіг. 9 наведений графік залежності життєздатності клітин BT-474-EEI в умовах in vitro на 3 добу від різних концентрацій T-DM1 в комбінації з фіксованими концентраціями лапатинібу (14 нМ; 41 нМ; 123 нМ; 370 нМ; 1111 нМ) і різних концентрацій одного T-DM1 (0-1000 нг/мл). На Фіг. 10 наведений графік зміни середнього об'єму пухлин протягом часу в умовах in vivo для пухлин KPL-4, імплантованих в жирову подушку молочної залози імунодефіцитних мишей SCID (3 мільйони клітин в матригелі на мишу) після введення: (1) буфера ADC; (2) пертузумабу в дозі 15 мг/кг; (3) T-DM1 в дозі 0,3 мг/кг; (4) T-DM1 в дозі 1 мг/кг; (5) T-DM1 в дозі 3 мг/кг, (6) пертузумабу в дозі 15 мг/кг + T-DM1 в дозі 0,3 мг/кг; (7) пертузумабу в дозі 15 мг/кг + T-DM1 в дозі 1 мг/кг; (8) пертузумабу в дозі 15 мг/кг + T-DM1 в дозі 3 мг/кг. Буфер ADC і T-DM1 вводили один раз на 0 добу. Претузумаб вводили на 0; 7 і 14 добу. На Фіг. 11 наведений графік зміни середнього об'єму пухлин протягом часу в умовах in vivo для пухлин KPL-4, імплантованих в жирову подушку молочної залози імунодефіцитних мишей SCID (3 мільйони клітин в матригелі на мишу) після введення: (1) буфера ADC; (2) 5-FU в дозі 100 мг/кг; (3) пертузумабу в дозі 40 мг/кг, перша доза пертузумабу (групи 5, 7 і 9) була 2 навантажувальною дозою; (4) B20-4.1 в дозі 5 мг/кг; (5) T-DM1 в дозі 5 мг/кг; (6) 5-FU в дозі 100 мг/кг + T-DM1 в дозі 5 мг/кг; (7) пертузумабу в дозі 40 мг/кг + T-DM1 в дозі 5 мг/кг; (8) B20-4.1 в дозі 5 мг/кг + T-DM1 в дозі 5 мг/кг; (9) B20-4.1 в дозі 5 мг/кг + пертузумаб в дозі 40 мг/кг. Буфер ADC і T-DM1 вводили внутрішньовенно один раз на 0 добу. Претузумаб вводили на 0; 7 і 14 добу (один раз на тиждень 4). 5FU вводили на 0; 7 14 і 21 доби (один раз на тиждень 3). В204.1 вводили на 0; 3; 7; 10; 14; 17; 21 і 24 доби (2/тиждень 8 загалом). На Фіг. 12 наведений графік зміни середнього об'єму пухлин протягом часу в умовах in vivo для трансгенних пухлин молочної залози MMTV-Her2 Fo5, імплантованих в жирову подушку молочної залози мишей CRL nu/nu, після введення: (1) розчинника (буфера ADC); (2) B20-4.1 в дозі 5 мг/кг; (3) T-DM1 в дозі 3 мг/кг; (4) T-DM1 в дозі 5 мг/кг; (5) T-DM1 в дозі 10 мг/кг; (6) B20-4.1 в дозі 5 мг/кг + T-DM1 в дозі 3 мг/кг; (7) B20-4.1 в дозі 5 мг/кг + T-DM1 в дозі 5 мг/кг; (8) B20-4.1 в дозі 5 мг/кг + T-DM1 в дозі 10 мг/кг. Буфер ADC і T-DM1 вводили на 0 і 21 добу. B20-4.1 вводили на 0; 3; 7; 10; 14; 17; 21 і 24 доби (2/тиждень 4, 8 загалом). На Фіг. 13 наведений графік зміни середнього об'єму пухлин протягом часу в умовах in vivo для трансгенних пухлин молочної залози MMTV-Her2 Fo5, імплантованих в жирову подушку молочної залози мишей CRL nu/nu, після введення: (1) розчинника (буфера ADC); (2) T-DM1 в дозі 10 мг/кг; (3) 5-FU в дозі 100 мг/кг; (4) гемцитабіну в дозі 120 мг/кг; (5) карбоплатину в дозі 100 мг/кг; (6) 5-FU в дозі 100 мг/кг + T-DM1 в дозі 10 мг/кг; (7) гемцитабіну в дозі 120 мг/кг + TDM1 в дозі 10 мг/кг; (8) карбоплатину в дозі 100 мг/кг + T-DM1 в дозі 10 мг/кг. Буфер ADC, T-DM1 4 UA 108832 C2 5 10 15 20 25 30 35 40 45 50 55 і карбоплатин вводили однократно на 0 добу. 5-FU вводили однократно на 0; 7 і 14 доби (один раз на тиждень 3). Гемцитабін вводили на 0; 3; 6 і 9 доби (кожні 3 дні 4). На Фіг. 14 наведений графік зміни середнього об'єму пухлин протягом часу в умовах in vivo для трансгенних пухлин молочної залози MMTV-Her2 Fo5, імплантованих в жирову подушку молочної залози безтимусних мишей Harlan, після введення: (1) розчинника (буфера PBS) в/в, один раз на тиждень 4; (2) лапатинібу в дозі 101 мг/кг, перорально, два рази на день 21; (3) пертузумабу в дозі 40 мг/кг, в/в, один раз на тиждень 4; (4) B20-4.1 в дозі 5 мг/кг, в/оч., 2/в тиждень 4; (5) T-DM1 в дозі 15 мг/кг, в/в, один раз на 3 тижні до кінця; (6) лапатинібу в дозі 101 мг/кг перорально, два рази на день 21+T-DM1 в дозі 15 мг/кг, в/в, один раз на 3 тижні до кінця; (7) пертузумабу в дозі 40 мг/кг в/в, один раз на тиждень 4+T-DM1 в дозі 15 мг/кг, в/в, один раз в 3 тижні до кінця; (8) B20-4.1 в дозі 5 мг/кг, в/б, 2/в тиждень 4+T-DM1 в дозі 15 мг/кг, в/в, один раз в 3 тижні до кінця. На Фіг. 15 наведений графік зміни середнього об'єму пухлин протягом часу в умовах in vivo для трансгенних пухлин молочної залози MMTV-Her2 Fo5, імплантованих в жирову подушку молочної залози безтимусних мишей Harlan, після введення: (1) розчинник (буфера PBS) перорально, два рази на день 21; (2) T-DM1 в дозі 7,5 мг/кг, в/в, один раз на день 1; (3) T-DM1 в дозі 15 мг/кг, в/в, один раз на день 1; (4) ABT-869 в дозі 5 мг/кг, перорально, два рази на день 21; (5) ABT-86 в дозі 15 мг/кг, перорально, два рази на день 21; (6) T-DM1 в дозі 7,5 мг/кг в/в, один раз на день 1+ABT-869 в дозі 5 мг/кг, перорально, два рази на день 21; (7) T-DM1 в дозі 7,5 мг/кг в/в, один раз на день 1+ABT-869 в дозі 15 мг/кг, перорально, два рази на день 21; (8) T-DM1 в дозі 15 мг/кг, в/в, один раз на день 1+ABT-869 в дозі 5 мг/кг, перорально, два рази на день 21; (9) T-DM1 в дозі 15 мг/кг, в/в, один раз в день 1+ABT-869 в дозі 15 мг/кг, перорально, два рази на день 21. На Фіг. 16 наведений графік зміни середнього об'єму пухлин протягом часу в умовах in vivo для трансгенних пухлин молочної залози MMTV-Her2 Fo5, імплантованих в жирову подушку молочної залози безтимусних мишей Harlan, після введення: (1) розчинника в/в, один раз на тиждень 3; (2) T-DM1 в дозі 7,5 мг/кг в/в, один раз в 3 тижні 2; (3) T-DM1 в дозі 15 мг/кг в/в, один раз в 3 тижні 2; (4) доцетакселу в дозі 30 мг/кг в/в, один раз на тиждень 3; (5) T-DM1 в дозі 7,5 мг/кг в/в, один раз в 3 тижні 2 + доцетакселу в дозі 30 мг/кг в/в, один раз на тиждень 3; (6) T-DM1 в дозі 15 мг/кг в/в, один раз в 3 тижні 2 + доцетакселу в дозі 30 мг/кг в/в, один раз на тиждень 3. На Фіг. 17 наведений графік зміни середнього об'єму пухлин в умовах in vivo для трансгенних пухлин MMTV-Her2 Fo5, імплантованих в жирову подушку молочної залози безтимусних мишей Harlan, після введення: (1) розчинник перорально, один раз на день 21; (2) T-DM1 в дозі 7,5 мг/кг в/в, один раз в 3 тижні 2; (3) T-DM1 в дозі 15 мг/кг в/в, один раз в 3 тижні 2; (4) лапатинібу в дозі 100 мг/кг перорально, два рази на день 21; (5) T-DM1 в дозі 7,5 мг/кг в/в, один раз в 3 тижні 2 + лапатинібу в дозі 100 мг/кг перорально, два рази на день 21; (6) TDM1 в дозі 15 мг/кг в/в, один раз в 3 тижні 2 + лапатинібу в дозі 100 мг/кг перорально, два рази на день 21. На Фіг. 18 наведений графік залежності життєздатності клітин SK-BR-3 в умовах in vitro на 3 добу від кратних концентрацій IC50 5-FU, трастузумабу-MCC-DM1 (T-DM1) і комбінацій з співвідношенням фіксованих концентрацій 5-FU і T-DM1. На Фіг. 19 наведений графік залежності життєздатності клітин BT-474 в умовах in vitro на 3 добу від кратних концентрацій IC50 5-FU, трастузумабу-MCC-DM1 (T-DM1) і комбінацій з співвідношенням фіксованих концентрацій 5-FU і T-DM1. На Фіг. 20 наведений графік залежності життєздатності клітин SK-BR-3 в умовах in vitro на 3 добу від кратних концентрацій IC50 гемцитабіну, трастузумабу-MCC-DM1 (T-DM1) і комбінацій з співвідношенням фіксованих концентрацій гемцитабіну і T-DM1. На Фіг. 21 наведений графік залежності життєздатності клітин MDA-MD-361 в умовах in vitro на 3 добу від кратних концентрацій IC50 гемцитабіну, трастузумабу-MCC-DM1 (T-DM1) і комбінацій з співвідношенням фіксованих концентрацій гемцитабіну і T-DM1. На Фіг. 22 наведений графік життєздатності (проліферації) клітин KPL4 в умовах in vitro на 3 добу після обробки T-DM1, GDC-0941 і комбінаціями з співвідношенням фіксованих концентрацій 1:10 T-DM1 і GDC-0941 (від 62,5 нМ до 1 мкМ) при кратних концентраціях IC 50 від 0,25 до 4. Будували графік прогнозу аддитивної дії Блісса у вигляді пунктирної лінії. На Фіг. 23 наведений графік життєздатності (проліферації) клітин KPL4 в умовах in vitro на 3 добу після обробки T-DM1, GDC-0941 і комбінаціями з співвідношенням фіксованих концентрацій 1:25 (від 1,25 до 80 нг/мл) і GDC-0941 (від 31,25 нМ до 2 мкМ) при кратних 5 UA 108832 C2 5 10 15 20 25 30 35 40 45 50 55 концентраціях IC50 від 0,0625 до 16. Будували графік прогнозу адитивної дії Блісса у вигляді пунктирної лінії. На Фіг. 24 наведений графік життєздатності (проліферації) клітин KPL4 з ампліфікацією Her2, резистентних до герцептину®, мутантних по PIK3CA (H1047R) в умовах in vitro на 3 добу після обробки T-DM1, PI103, GDC-0941 і комбінаціями з співвідношенням фіксованих концентрацій T-DM1+PI103 і T-DM1+GDC-0941 при кратних концентраціях IC50 від 0 до 16. На Фіг. 25 наведений графік життєздатності (проліферації) клітин KPL4 каспаза 3/7 в умовах in vitro через 24 год. після обробки T-DM1, GDC-0941 і комбінаціями з співвідношенням фіксованих концентрацій T-DM1 і GDC-0941 при концентраціях T-DM1 до 160 нг/мл. На Фіг. 26 наведений графік життєздатності (проліферації) клітин KPL4 в умовах in vitro через 3 діб після обробки T-DM1, GDC-0941 і комбінаціями з співвідношенням фіксованих концентрацій T-DM1 і GDC-0941 при концентраціях T-DM1 від 0 до 200 нг/мл. На Фіг. 27 наведений графік життєздатності (проліферації) клітин MDA-0MB-361 в умовах in vitro на 3 добу після обробки T-DM1, GDC-0941 і комбінаціями з співвідношенням фіксованих концентрацій 1:20 T-DM1 (від 3,125 до 50 нг/мл) і GDC-0941 (від 62,5 нМ до 1 мкМ) при кратних концентраціях IC50 від 0,125 до 8. Будували графік прогнозу адитивної дії Блісса у вигляді пунктирної лінії. На Фіг. 28 наведений графік життєздатності (проліферації) клітин MDA-0MB-361 в умовах in vitro на 3 добу після обробки T-DM1, GDC-0941 і комбінаціями з співвідношенням фіксованих концентрацій 1:20 T-DM1 (від 3,125 до 100 нг/мл) і GDC-0941 (від 62,5 нМ до 2 мкМ) при кратних концентраціях IC50 від 0,125 до 8. Будували графік прогнозу адитивної дії Блісса у вигляді пунктирної лінії. На Фіг. 29 наведений графік життєздатності (проліферації) клітин BT-474 в умовах in vitro на 3 добу після обробки T-DM1, GDC-0941 і комбінаціями з співвідношенням фіксованих концентрацій 1:10 T-DM1 (від 3,125 до 100 нг/мл) і GDC-0941 (від 31,25 нМ до 1 мкМ) при кратних концентраціях IC50 від 0,125 до 4. Будували графік прогнозу адитивної дії Блісса у вигляді пунктирної лінії. На Фіг. 30 наведений графік життєздатності (проліферації) клітин BT-474 в умовах in vitro на 3 добу після обробки T-DM1, GDC-0941 і комбінаціями з співвідношенням фіксованих концентрацій 1:10 T-DM1 (від 6,25 до 100 нг/мл) і GDC-0941 (від 62,5 нМ до 1 мкМ) при кратних концентраціях IC50 від 0,25 до 4. Будували графік прогнозу адитивної дії Блісса у вигляді пунктирної лінії. На Фіг. 31 наведений графік життєздатності (проліферації) клітин AU565 з ампліфікацією Her2, мутантних без PIK3 в умовах in vitro на 3 добу після обробки T-DM1, PI103, GDC-0941 і комбінаціями з співвідношенням фіксованих концентрацій T-DM1+PI103 і T-DM1+GDC-0941 при кратних концентраціях IC50 від 0 до 16. На Фіг. 32 наведений графік життєздатності (проліферації) клітин EFM192А з ампліфікацією Her2, мутантних по PIK3СА (C420R) в умовах in vitro на 3 добу після обробки T-DM1, PI103, GDC-0941 і комбінаціями з співвідношенням фіксованих концентрацій T-DM1+PI103 і TDM1+GDC-0941 при кратних концентраціях IC50 від 0 до 16. На Фіг. 33 наведений графік життєздатності (проліферації) клітин HCC1954 з ампліфікацією Her2, резистентних до герцептину®, мутантних по PIK3CA (H1047R) в умовах in vitro після обробки T-DM1, PI103, GDC-0941 і комбінаціями з співвідношенням фіксованих концентрацій TDM1+PI103 і T-DM1+GDC-0941 при кратних концентраціях IC50 від 0 до 16. На Фіг. 34 наведений графік зміни середнього об'єму пухлин протягом часу в умовах in vivo для трансгенних пухлин MMTV-Her2 Fo5, імплантованих в жирову подушку молочної залози мишей CRL nu/nu, після введення: (1) розчинник перорально, один раз на день 21; (2) T-DM1 в дозі 10 мг/кг в/в, один раз на 3 тижні; (3) 5-FU в дозі 100 мг/кг перорально, один раз на тиждень 2; (4) T-DM1 в дозі 5 мг/кг в/в, один раз в 3 тижні + 5-FU в дозі 100 мг/кг перорально, один раз на тиждень 2. На Фіг. 35 наведений графік зміни середнього об'єму пухлин протягом часу в умовах in vivo для трансгенних пухлин MMTV-Her2 Fo5, імплантованих в жирову подушку молочної залози мишей CRL nu/nu, після введення: (1) розчинник перорально, один раз на день 21; (2) T-DM1 в дозі 5 мг/кг в/в, один раз на день 1; (3) GDC-0941 в дозі 100 мг/кг перорально, один раз на день 21; (4) GDC-0152 дозі 50 мг/кг перорально, один раз на тиждень 3; (5) T-DM1 в дозі 5 мг/кг в/в, один раз на день 1+GDC-0941 в дозі 100 мг/кг перорально, один раз на день 21; (6) T-DM1 в дозі 5 мг/кг в/в, один раз на день 1+GDC-0152 в дозі 50 мг/кг перорально, один раз на тиждень 3. 6 UA 108832 C2 5 10 15 20 25 30 35 40 45 50 55 На Фіг. 36 наведений графік зміни середнього об'єму пухлин протягом часу в умовах in vivo для пухлин MDA-MB-361.1, імплантованих в жирову подушку молочної залози мишей CRL nu/nu, після введення: (1) розчинник перорально, один раз на день 21; (2) GDC-0941 в дозі 25 мг/кг, перорально, один раз на день 21; (3) GDC-0941 в дозі 50 мг/кг, перорально, один раз на день 21; (4) GDC-0941 в дозі 100 мг/кг, перорально, один раз на день 21; (5) T-DM1 в дозі 3 мг/кг в/в, один раз на день 1; (6) T-DM1 в дозі 10 мг/кг в/в, один раз на день 1; (7) GDC-0941 в дозі 25 мг/кг перорально, один раз на день 21+T-DM1 в дозі 3 мг/кг в/в, один раз на день 1; (8) GDC-0941 в дозі 50 мг/кг перорально, один раз на день 21+T-DM1 в дозі 3 мг/кг в/в, один раз на день 1; (9) GDC-0941 в дозі 100 мг/кг перорально, один раз на день 21+T-DM1 в дозі 3 мг/кг в/в, один раз на день 1; (10) GDC-0941 в дозі 25 мг/кг перорально, один раз на день 21+TDM1 в дозі 10 мг/кг в/в, один раз на день 1; (11) GDC-0941 в дозі 50 мг/кг перорально, один раз на день 21+T-DM1 в дозі 10 мг/кг в/в, один раз на день 1; (12) GDC-0941 в дозі 100 мг/кг перорально, один раз на день 21+T-DM1 в дозі 10 мг/кг в/в, один раз на день 1. На Фіг. 37 наведений графік зміни середнього об'єму пухлин протягом часу в умовах in vivo для пухлин MDA-MB-361.1, імплантованих в жирову подушку молочної залози мишей CRL nu/nu, після введення: (1) розчинники [MCT (0,5 % метилцелюлоза/0,2 % твін 80) + сукцинатний буфер (100 мМ сукцинату натрію, 100 мг/мл трегалози, 0,1 % твіну 80, рН 5,0)] перорально+в/в, один раз на день 21 і один раз на день; (2) GNE-390 в дозі 1,0 мг/кг, перорально, один раз на день 21; (3) GNE-390 в дозі 2,5 мг/кг, перорально, один раз на день 21; (4) T-DM1 в дозі 3 мг/кг в/в, один раз на день; (5) GNE-390 в дозі 1,0 мг/кг перорально, один раз на день 21+T-DM1 в дозі 3 мг/кг в/в, один раз на день; (6) GNE-390 в дозі 2,5 мг/кг перорально, один раз на день 21+T-DM1 в дозі 3 мг/кг в/в, один раз на день. Докладний опис переважних варіантів здійснення Далі будуть детально описані деякі варіанти здійснення винаходу, приклади яких наведені з прикладеними структурами і формулами. Незважаючи на те, що винахід буде описаний в поєднанні з перерахованими варіантами здійснення, очевидно, зрозуміло, що вони не призначені для обмеження винаходу даними варіантами здійснення. Навпаки, винахід призначений для включення всіх альтернатив, модифікацій і еквівалентних варіантів, які можуть бути включені в об'єм даного винаходу, визначеного формулою винаходу. Фахівцям в даній галузі, очевидно, зрозуміло, що існує багато способів і речовин, аналогічних або еквівалентних описаним в даному документі, які можна використати в практиці даного винаходу. Даний винахід ніяким чином не обмежується описаними способами і речовинами. У випадку, коли один або декілька включених джерел літератури, патентів і аналогічних матеріалів відрізняється або суперечить даній заявці, включаючи, не обмежуючись цим, визначення термінів, використання термінів, опис методик або тому подібне, то дана заявка контролює це. Визначення Вирази "містить", "що містить", "включає", "що включає" і "включає" при використанні в даній заявці і формулі винаходу, призначаються для визначення наявності вказаних ознак, цілих чисел, компонентів або стадій, але вони не перешкоджають наявності або додаванню однієї або декількох ознак, цілих чисел, компонентів або стадій або їх груп. Терміни "лікувати" і "лікування" стосуються лікувальних і профілактичних або превентивних заходів, метою яких є попередження або сповільнення (ослаблення) небажаної фізіологічної зміни або порушення, такої як ріст, розвиток або поширення гіперпроліферативного стану, такого як злоякісна пухлина. Для цілей даного винаходу позитивні або бажані клінічні результати включають, не обмежуючись цим, ослаблення симптомів, зниження ступеня вираженості захворювання, забезпечення стабільного (тобто, відсутність погіршення) стану захворювання, зниження або сповільнення прогресування захворювання, ослаблення або пом'якшення хворобливого стану і ремісія (часткова або повна), незалежно від того, чи вони детектуються або не детектуються. Також термін "лікування" може означати пролонговану здатність до виживання в порівнянні з передбачуваною здатністю до виживання в порівнянні з ситуацією при відсутності лікування. Суб'єкти, що потребують лікування, включають пацієнтів з станом або порушенням, що вже є, а також суб'єктів схильних до розвитку стану або порушення, і суб'єктів, у яких стан або порушення потрібно попередити. Вираз "терапевтично ефективна кількість" означає кількість сполуки за даним винаходом, за допомогою якої можна (i) лікувати конкретне захворювання, стан або порушення, (ii) ослабляти, полегшувати або елімінувати один або декілька симптомів конкретного захворювання, стану або порушення і (iii) попереджати або сповільнювати початок розвитку одного або декількох симптомів конкретного захворювання, стану або порушення, описаного в даному документі. У разі злоякісної пухлини терапевтично ефективна кількість лікарського засобу може привести до 7 UA 108832 C2 5 10 15 20 25 30 35 40 45 50 55 60 зменшення кількості пухлинних клітин, зменшення розміру пухлини, пригнічення (тобто сповільненню до певної міри і переважно зупинки) інфільтрації пухлинних клітин до периферичних органів, пригніченню (тобто сповільненню до певної міри і переважно зупинки) метастазування пухлини, пригніченню до певної міри росту пухлини і/або ослабленню до певної міри одного або декількох симптомів, асоційованих зі злоякісною пухлиною. Лікарський засіб може до певної міри попередити ріст пухлини і/або привести до загибелі пухлинних клітин, що є, він може бути цитостатичним і/або цитотоксичним. Відносно терапії злоякісної пухлини, то ефективність можна оцінити, наприклад, за часом прогресування захворювання (ТТР) і/або по швидкості прояву реакції у відповідь (RR). Термін "гіперпроліферативне порушення" стосується пухлин, раку і новоутворень, включаючи передзлоякісні і незлоякісні стадії, а також він включає псоріаз, ендометріоз, поліпи і фіброаденому. Терміни "рак" і "злоякісна пухлина" стосуються або описують фізіологічний стан у ссавців, який характеризується некотрольованим ростом клітин. "Пухлина" містить одну або декілька пухлинних клітин. Приклади злоякісної пухлини включають, не обмежуючись цим, карциному, лімфому, бластому, саркому і лейкоз або злоякісні пухлини лімфоїдної тканини. Більш конкретні приклади таких злоякісних пухлин включають плоскоклітинний рак (наприклад, епітеліальний плоскоклітинний рак), рак легень, в тому числі, дрібноклітинну карциному легень, недрібноклітинну карциному легень ("NSCLC"), аденокарциному легень і плоскоклітинну карциному легень, рак очеревини, гепатоцелюлярну карциному, рак шлунка, в тому числі, злоякісні пухлини органів травного тракту, рак підшлункової залози, гліобластому, рак шийки матки, рак яєчників, печінки, сечового міхура, гепатому, рак молочної залози, ободової кишки, прямої кишки, колоректальний рак, рак ендометрію або матки, рак слинних залоз, нирок або органів видільної системи, вульви, щитовидної залози, карциному печінки, рак анального отвору, рак статевого члена, а також злоякісні пухлини голови і шиї. Термін "хіміотерапевтичний засіб" являє собою хімічну сполуку, придатну для лікування раку, незалежно від механізму дії. Групи хіміотерапевтичних засобів включають, не обмежуючись цим: алкілуючі агенти, антиметаболіти, рослинні алкалоїди, що являють собою отрути мітотичного веретена, цитотоксичні/протипухлинні антибіотики, інгібітори топоізомерази, антитіла, фотосенсибілізатори і інгібітори кінази. Хіміотерапевтичні засоби включають сполуки, що застосовуються в "цілеспрямованій терапії" і звичайній хіміотерапії. Приклади ® хіміотерапевтичних засобів включають: ерлотиніб (тарцева , Genentech/OSI Pharm.), ® доцетаксел (таксотер , Sanofi-Aventis), 5-FU (фторурацил, 5-фторурацил, номер по CAS 51-218), гемцитабін (гемзар®, Lilly), PD-0325901 (номер по CAS 391210-10-9, Pfizer), цисплатин (цисдіамін дихлорплатини (II), номер по CAS 15663-27-1), карбоплатин (номер по CAS 41575-94-4), ® паклітаксел (таксол , Bristol-Myers Squibb Oncology, Princeton, N.J.), трастузумаб (герцептин®, Genentech), темозоломід (4-метил-5-оксо-2,3,4,6,8-пентабіцикло[4.3.0]нона-2,7,9-триєн-9карбоксамід, номер по CAS 85622-93-1, темодар®, темодал®, Shering Plough), тамоксифен ((Z)® ® 2-[4-(1,2-дифенілбут-1-еніл)фенокси]-N, N-диметилетанамін, нольвадекс , істубал , валодекс®) і доксорубіцин (адріаміцин®), акти-1/2, HPPD і рапаміцин. ® Інші приклади хіміотерапевтичних засобів включають: оксалиплатин (елоксатин , Sanofi), бортезоміб (велкаде®, Millennium Pharm.), сутент (сунітиніб®, SU11248, Pfizer), летрозол ® (фемара®, Novartis), іматиніб мезилат (глівек , Novartis), XL-518 (інгібітор МЕК, Exelixis, міжнародна заявка WO 2007/044515), ARRY-886 (інгібітор МЕК, AZD6244, Array BioPharma, Astra Zeneca), SF-1126 (інгібітор PI3K, Semafore Pharmaceuticals), BEZ-235 (інгібітор PI3K, Novartis), ® XL-147 (інгібітор PI3K, Exelixis), PTK787/ZK 222584 (Novartis), фулвестрант (фазлодекс , ® AstraZeneca), лейковорин (фолінова кислота), рапаміцин (сиролімус, рапамун , Wyeth), ® ТМ лапатиніб (тикерб , GSK572016, Glaxo Smith Kline), лонафарніб (сарасар , SCH 66336, Shering ® Plough), сорафеніб (нексавар , BAY43-9006, Bayer Labs), гефітиніб (іресса®, AstraZeneca), ТМ ТМ іринотекан (камтосар®, CPT-11, Pfizer), типіфарніб (зарнестра , Johnson&Johnson), абраксан (не містить кремофору), наночастинки на основі альбуміну з паклітакселом (American Pharmaceutical Partners, Schaumberg, Il), вандетаніб (rINN, ZD6474, зактима®, AstraZeneca), ® хлорамбуцил, AG1478, AG1571 (SU 5271; Sugen), темсиролімус (торисел , Wyeth), пазопаніб ® ® (GlaxoSmithKline), канфосфамід (телсіта®, Telik), тіотеру і циклофосфамід (цитоксан , неосар ); алкісульфонати, такі як бусульфан, імпросульфан і піпосульфан; азиридини, такі як бензодопа, карбоквон, метуредопа і уредопа; етиленіміни і метиламеламіни, включаючи альтретамін; триетиленамін, триетиленфосфорамід, триетилентіофосфорамід і триметиломеламін; ацетогеніни (зокрема, булатацин і булатацинон); камптотецин (включаючи синтетичний аналог топотекан); бріостатин; калістатин; СС-1065 (включаючи його синтетичні аналоги адозелезин, карзелезин і бізелезин); криптофіцини (зокрема, криптофіцин 1 і криптофіцин 8); доластатин; 8 UA 108832 C2 5 10 15 20 25 30 35 40 45 50 55 дуокарміцин (включаючи синтетичні аналоги KW-2189 і CB1-TM1); елеутеробін; панкратистатин; саркодиктиїн; спонгістатин; азотистий іприт, такий як хлорамбуцил, хлорнафазин, хлорфосфамід, естрамустин, іфосфамід, мехлоретамін, мехлортаміну оксид гідрохлорид, мелфалан, новембіхін, фенестрин, преднімустин, трофосфамід, урациловий іприт; нітрозосечовини, такі як кармустин, хлорзотоцин, фотемустин, ломустин, німустин і ранімнустин; антибіотики, такі як енедіїнові антибіотики (наприклад, каліхеаміцин, каліхеаміцин гамма 1I, каліхеаміцин омегаI1 (Angew Chem. Intl. Ed. Engl., 1994, 33:183-186); динеміцин, динеміцин А; біфосфонати, такі як клодронат; еспераміцин; а також неокарзиностатин хромофор і близькі хромопротеїнові енедіїнові антибіотики хромофори), аклациномізини, актиноміцин, аутраміцин, азасерин, блеоміцини, кактиноміцин, карабіцин, карміноміцин, карзинофілін, хромоміцини, дактиноміцин, даунорубіцин, деторубіцин, 6-діазо-5-оксо-Lнорлейцин, морфоліно-доксорубіцин, ціаноморфоліно-доксорубіцин, 2-піроліно-доксорубіцин і дезоксидоксорубіцин), епірубіцин, езорубіцин, ідарубіцин, марцеломіцин, мітоміцини, такі як мітоміцин С, мікофенолову кислоту, ногаламіцин, олівоміцини, пепломіцин, порфіроміцин, пуроміцин, квеламіцин, родорубіцин, стрептонігрин, стрептозоцин, туберцидин, убенімес, зиностатин, зорубіцин; антиметаболіти, такі як метотрексат і 5-фторурацил (5-FU); аналоги фолієвої кислоти, такі як деноптерин, метотрексат, птероптерин, триметрексат; аналоги пуринів, такі як флударабін, 6-меркаптопурин, тіаміприн, тіогуанін; аналоги піримідинів, такі як анцитабін, азацитидин, 6-азауридин, кармофур, цитарабін, дидезоксіуридин, доксифлуридин, еноцитабін, флоксуридин; андрогени, такі як калустерон, дромостанолон пропіонат, епітіостанол, мепітіостан, тестолактон; інгібітори наднирників, такі як аміноглутетимід, мітотан, трилостан; поповнювачі фолієвої кислоти, такі як фролинова кислота; ацеглатон; альдофосфамід глікозид; амінолевулінову кислоту; енілурацил; амсакрин; бестрабуцил; бісантрен; едатраксат; дефофамін; демеколцин; діазиквон; елфорнітрин; еліптиній ацетат; епотилон; етоглюцид; нітрат галію; гідроксисечовину; лентинан; лонідаїнін; майтансиноїди, такі як майтансин і ансамітоцини; мітогуазон; мітоксантрон; мопіданмол; нітаерин; пентостатин; фенамет; парарубіцин; лозоксантрон; подофілову кислоту; 2-етилгідразид; прокарбазин; полісахаридний комплекс ® PSK (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофіран; спірогерманій; тенуазонову кислоту; триазиквон; 2,2',2"-трихлоретиламін; трихотецени (Т-2 токсин, веракурин А, роридин А і ангуїдин); уретан; віндезин; дакарбазин; маномустин; мітобронітол; мітолактол; піпоброман; гацитозин; арабінозид (Ара-С); циклофосфамід; тіотепа; 6-тіогуанін; меркаптопурин; метотрексат; аналоги платини, такі як цисплатин і карбоплатин; вінбластин; ® етопозид (VP-16); іфосфамід; мітоксантрон; вінкристин; вінорельбін (навелбін ); новантрон; ® теніпозид; етатрексат; дауноміцин; аміноптерин; капецитабін (кселода , Roche); ібандронат; СРТ-11; інгібітор топоізомерази RFS 2000; дифторметилорнітин (DMFO); ретиноїди, такі як ретиноєва кислота, і фармацевтично прийнятні солі, кислоти і похідні будь-якого з перерахованих вище продуктів. Також в поняття "хіміотерапевтичний засіб" входять: (i) антигормональні засоби, що регулюють або інгібують дію гормонів на пухлини, такі як антиестрогени і селективні модулятори ® рецепторів естрогенів (SERM), включаючи, наприклад, тамоксифен (нольвадекс ; тамоксифену цитрат), ралоксифен, дролоксифен, 4-гідрокситамоксифен, триоксифен, кеоксифен, LY117018, ® онапристон і фарестон (тореміфін цитрат); (ii) інгібітори ароматази, що інгібують фермент ароматазу, яка регулює продукцію естрогенів в наднирниках, наприклад, такі як 4(5)-імідазоли, ® аміноглютетимід, мегаза® (мегестрол ацетат), аромазин (ексеместан, Pfizer), форместан, фадрозол, ривізор® (ворозол), фемара® (летрозол, Novartis) і аримідекс® (анастрозол, AstraZeneca); (iii) антиандрогени, такі як флутамід, нілутамід, бікалутамід, лейпролід і гозерелін, а також троксацитабін (аналог нуклеозиду цитозину 1,3-діоксолан); (iv) інгібітори протеїнкінази, такі як інгібітори MEK (міжнародна заявка WO 2007/044515); (v) інгібітори ліпідкінази; (vi) антисмислові олігонуклеотиди, зокрема, які інгібують експресію генів в сигнальних шляхах, що беруть участь в аномальній проліферації клітин, наприклад, PKC-альфа, Raf і H-Ras, така як ® облімерсен (генасенс , Genta Inc.); (vii) рибозими, такі як інгібітори експресії VEGF (наприклад, ® ангіозим ) і інгібітори експресії HER2; (viii) вакцини, такі як вакцини на основі генної терапії, ® ® ® ® наприклад, аловектин , лейвектин і ваксид ; пролейкін rIL-2; інгібітори топоізомерази 1, такі як ® ® луртотекан ; абарелікс® rmRH; (ix) антиангіогенні засоби, такі як бевацизумаб (авастин , Genentech), і фармацевтично прийнятні солі, кислоти і похідні будь-якого з перерахованих вище продуктів. Також в поняття "хіміотерапевтичний засіб" входять терапевтичні антитіла, такі як ® ® алемтузумаб (Campath), бевацизумаб (авастин , Genentech); цетуксимаб (ербітукс , Imclone); ® ® панітумумаб (вектибікс , Amgen), ритуксимаб (ритуксан , Genentech/Biogen Idec), пертузумаб 9 UA 108832 C2 ® 5 10 15 20 25 30 35 40 45 50 55 60 (омнітаргТМ, 2С4, Genentech), трастузумаб (герцептин , Genentech), тозитумомаб (Bexxar, ® Corixia) і кон'югат антитіло-лікарський засіб, гемтузумаб озогаміцин (мілотарг , Wyeth). Гуманізовані моноклональні антитіла з лікувальною активністю у вигляді хіміотерапевтичних засобів в комбінації з трастузумабом-MCC-DM1 включають: алемтузумаб, аплізумаб, азелізумаб, атлізумаб, бапіньюзумаб, бевацизумаб, біватузумаб мертанзин, кантузумаб мертанзин, цеделізумаб, сертолізумаб пегол, цитфуситузумаб, цидтузумаб, даклізумаб, екулізумаб, ефалізумаб, ептатузумаб, ерлізумаб, фелвизумаб, фонтолізумаб, гемтузумаб озогаміцин, інотузумаб озогаміцин, іпілімумаб, лабетузумаб, лінтузумаб, матузумаб, меполізумаб, мотавізумаб, мотовізумаб, наталізумаб, німоіузумаб, ноловізумаб, нумавізумаб, окрелізумаб, омалізумаб, палівізумаб, пасколізумаб, пекфуситузумаб, пектузумаб, пертузумаб, пекселізумаб, ралівізумаб, ранібізумаб, реслівізумаб, реслізумаб, резівізумаб, ровелізумаб, руплізумаб, сибротузумаб, сиплізумаб, сонтузумаб, такатузумаб тетраксетан, тадоцизумаб, талізумаб, тефібазумаб, тоцилізумаб, торазумаб, трастузумаб, тукотузумаб целмолейкін, тукузитузумаб, умавізумаб, уртоксазумаб і візилізумаб. Термін "метаболіт" означає продукт, синтезований внаслідок метаболізму певної сполуки або її солі в організмі. Метаболіти сполуки можна ідентифікувати з використанням звичайних методів, відомих в даній галузі, і їх активність оцінити з використанням тестів, описаних в даному документі. Такі продукти можуть утворитися, наприклад, внаслідок окислення, відновлення, гідролізу, амідування, деамідування, етерифікації, деетерифікації, ферментативного розщеплення і тому подібне, сполуки, що вводиться. Отже, винахід включає метаболіти сполук за винаходом, в тому числі, сполуки, продуковані способом, що включає контактування сполуки за даним винаходом з ссавцем протягом періоду часу, достатнього для утворення продукту його метаболізму. У тому значенні, в якому термін "вкладиш в упаковці" використовується в даному документі, він стосується інструкцій, які звичайно включають в промислові упаковки лікарських продуктів, що містять інформацію про покази, застосування, дозування, введення, протипокази і/або застереження, що стосуються застосування таких лікарських продуктів. У тому значенні, в якому термін "фармацевтично прийнятна сіль" використовується в даному документі, він стосується фармацевтично прийнятних органічних або неорганічних солей сполуки за винаходом. Наведені як приклад солі включають такі солі, не обмежуючись цим, як сульфат, цитрат, ацетат, оксалат, хлорид, бромід, йодид, нітрат, бісульфат, фосфат, гідрофосфат, ізонікотинат, лактат, саліцилат, гідроцитрат, тартрат, олеат, танат, пантотенат, бітартрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкуронат, сахарат, форміат, бензоат, глутамат, метансульфонат, "мезилат", етансульфонат, бензолсульфонат, птолуолсульфонат і памоат (тобто 1,1'-метилен-біс-(2-гідрокси-3-нафтоат)). Фармацевтично прийнятні солі можуть містити включення іншої молекули, такої як іон ацетат, іон сукцинат або інший протиіон. Протиіон може являти собою будь-яку органічну або неорганічну групу, яка стабілізує заряд у вихідній сполуці. Крім того, фармацевтично прийнятні солі можуть містити в своїй структурі більш ніж один заряджений атом. У тих випадках, коли численні заряджені атоми є частиною фармацевтично прийнятної солі, то вони можуть містити численні протиіони. Отже, фармацевтично прийнятна сіль може містити один або декілька заряджених атомів і/або один або декілька протиіонів. У тому випадку, коли сполуки за винаходом є основою, то бажану фармацевтично прийнятну сіль можна отримати за допомогою будь-якого прийнятного методу, відомого в даній галузі, наприклад, обробкою вільної основи неорганічною кислотою, такою як соляна кислота, бромистоводнева кислота, сірчана кислота, азотна кислота, метансульфонова кислота, фосфорна кислота і тому подібне, або органічною кислотою, такою як оцтова кислота, малеїнова кислота, янтарна кислота, мигдалева кислота, фумарова кислота, малонова кислота, піровиноградна кислота, щавлева кислота, гліколева кислота, саліцилова кислота, піранозидильна кислота, така як глюкуронова кислота або галактуронова кислота, альфаоксикислота, така як лимонна кислота або винна кислота, амінокислота, така як аспарагінова кислота або глютамінова кислота, ароматична кислота, така як бензойна кислота або цинамова кислота, сульфонова кислота, така як п-толуолсульфонова кислота або етансульфонова кислота, або тому подібне. Загальні аспекти по кислотах, що підходять для отримання фармацевтично придатних або прийнятних солей з основних фармацевтичних сполук, обговорюються, наприклад, P. Stahl et al., Camille G. (eds.) Handbook of Pharmaceutical Salts. Properties, Selection and Use, 2002, Zurich: Wiley-VCH; S. Berge et al., Journal of Pharmaceutical Sciences, 1977, 66(1), 119; Р. Gould, International J. of Pharmaceutics, 1986, 33:201-217; Anderson et al., the Practice of Medicinal Chemistry, 1996, Academic Press, New York; Remington's th Pharmaceutical Sciences, 18 ed., 1995, Mack Publishing Co., Easton P.A.; і в The Orange Book 10 UA 108832 C2 5 10 15 20 25 30 35 40 45 50 55 (Food&Drug Administration, Washington, D.C. на їх сайті). Вказані джерела включені в даний документ до відома. У тому випадку, коли сполука за винаходом є кислотою, то бажану фармацевтично прийнятну сіль можна отримати за допомогою будь-якого прийнятного методу, наприклад, обробкою вільної кислоти неорганічною або органічною основою, такою як амін (первинний, вторинний або третинний), гідроксид лужного металу або гідроксид лужно-земельного металу або тому подібне. Показові приклади відповідних солей включають, не обмежуючись цим, органічні солі, отримані з амінокислот, таких як гліцин і аргінін, аміаку, первинних, вторинних і третинних амінів і циклічних амінів, таких як піперидин, морфолін і піперазин, і неорганічні солі, отримані з натрію, кальцію, калію, магнію, марганцю, заліза, міді, цинку, алюмінію і літію. Вираз "фармацевтично прийнятні" вказує на те, що сполука або композиція можуть бути сумісними хімічно і/або з точки зору токсикології з іншими інгредієнтами, що входять до складу композиції, або з ссавцем, який зазнає лікування ними. Термін "сольват" стосується фізичної асоціації або комплексу однієї або декількох молекул розчинника і сполуки за винаходом. Сполуки за винаходом можуть знаходитися як в несольватованій формі, так і сольватованій формі. Приклади розчинників, які утворюють сольвати, включають, не обмежуючись цим, воду, ізопропанол, етанол, метанол, ДМСО, етилацетат, оцтову кислоту і етаноламін. Термін "гідрат" стосується комплексу, в якому молекула розчинника являє собою воду. Дана фізична асоціація має різні ступені іонного і ковалентного зв'язування, в тому числі, водневі зв'язки. У деяких випадках сольват можна виділити, наприклад, коли одна або декілька молекул розчинника входять в кристалічну решітку кристалічної твердої речовини. Загалом отримання сольватів відоме, наприклад, воно описане M. Caira et al., J. Pharmaceutical Sci., 93(3), 601-611, 2004. Аналогічні способи отримання сольватів, гемісольватів, гідратів і тому подібне описані E.C. van Tonder et al., AAPS Pharm. Sci. Tech., 5(1), article 12, 2004 і A.L. Bingham et al., Chem. Commun., 603-604, 2001. Типовий, не обмежувальний спосіб включає розчинення сполуки за винаходом в бажаній кількості бажаного розчинника (органічного розчинника або води, або їх сумішей) при більш високій, ніж кімнатна, температурі, і охолоджування розчину з швидкістю, достатньою для утворення кристалів, які потім виділяють звичайними методами. За допомогою аналітичних методів, наприклад, таких як ІК-спектроскопія, визначають присутність розчинника (або води) в кристалах у вигляді сольвату (або гідрату). У тому значенні, в якому в даному документі використовується термін "синергічний", він стосується до терапевтичної комбінації, яка є більш ефективною в порівнянні з адитивною дією двох або декількох агентів. Визначення синергічної взаємодії між трастузумабом-MCC-DM1 і одним або декількома хіміотерапевтичними засобами може бути засноване на результатах тестів, описаних в даному документі. Результати даних тестів аналізують з використанням комбінаційного методу Chou і Talalay і аналізу доза-ефект з використанням програми CalcuSyn для визначення комбінаційного індексу "CI" (Chou and Talalay, 1984, Adv. Enzyme Regul., 22:2755). Комбінації за даним винаходом були оцінені в декількох аналітичних системах і отримані дані можна піддати обробці з використанням стандартної програми для кількісного визначення синергізму, адитивного ефекту і антагонізму у протипухлинних засобів. Переважно використовують програму, описану Chou and Talalay в "New Avenues in Developmental Cancer Chemotherapy", Academic Press, 1987, chapter 2. Значення комбінаційного індексу (CI) нижче за 0,8 вказують на наявність синергізму, значення вище за 1,2 вказують на антагонізм і значення в межах від 0,8 до 1,2 вказують на адитивний ефект. Комбінована терапія може забезпечувати "синергію" і бути "синергічною", тобто коли ефект, що досягається при спільному використанні активних інгредієнтів, вище в порівнянні з сумою ефектів, що забезпечуються з використанням сполук по окремості. Синергічну дію можна забезпечити, коли активні інгредієнти: (1) формулюють разом і вводять або доставляють одночасно в комбінованій разовій лікарській формі; (2) вводять почергово у вигляді окремих лікарських форм або (3) вводять по іншій схемі. При введенні почергово синергічну дію можна забезпечити, коли сполуку вводять або доставляють послідовно, наприклад, за допомогою різних ін'єкцій в окремих шприцах. В основному під час "почергової" терапії ефективну дозу кожного активного інгредієнта вводять послідовно, наприклад, почергово у часі. Трастузумаб-MCC-DM1 Даний винахід стосується терапевтичних комбінацій, що містять трастузумаб-MCC-DM1(TDM1), кон'югат антитіло-лікарський засіб (номер по CAS № 139504-50-0), що має формулу: 11 UA 108832 C2 , 5 10 15 20 25 30 35 40 45 де Tr представляє трастузумаб, зв'язаний через лінкер МСС, з групою лікарського засобу майтансиноїду, DM1 (патент США № 5208020; патент США № 6441163). Співвідношення лікарського засобу і антитіла або навантаження лікарським засобом представлена показником "р" в наведеній вище структурі трастузумабу-MCC-DM1 і межі цілих значень складають від 1 до приблизно 8. Значення навантаження лікарським засобом "р" становить 1-8. Трастузумаб-MCCDM1 містить всі суміші по-різному навантажених і приєднаних кон'югатів антитіло-лікарський засіб, де 1, 2, 3, 4, 5, 6, 7 і 8 груп лікарського засобу ковалентно приєднані до антитіла трастузумаб (патент США № 7097840; заявка на патент США № 2005/0276812; заявка на патент США № 2005/0166993). Кон'югат трастузумаб-MCC-DM1 можна приготувати, слідуючи способу, описаному в прикладі 1. Трастузумаб продукується в суспензійній культурі клітин ссавців (клітин яєчника китайського хом'ячка, СНО). Прото-онкоген HER2 (або c-erbB2) кодує трансмембранний білок рецептора масою 185 kDa, який в структурному відношенні близький до рецептора епідермального фактора росту. Надекспресію білка HER2 відмічають в 25-30 % первинних злоякісних пухлин молочної залози і її можна детектувати з використанням імуногістохімічного методу, заснованого на аналізі фіксованих пухлинних блоків (Press M.F. et al., 1993, Cancer Res., 53:4960-70). Трастузумаб являє собою антитіло, що містить антигензв'язувальні залишки або отримане з мишачого антитіла 4D5 (ATCC CRL 10463, яке депозоване в Американській колекції типових культур, 12301 Parklawn Drive, Rockville, Md. 20852 по Будапештській угоді від 24 травня 1990). Гуманізовані антитіла 4D5, що наводяться як приклад, включають huMAb4D5-1, huMAb4D5-2, huMAb4D5-3, huMAb4D5-4, huMAb4D5-5, huMAb4D5-6, huMAb4D5-7 і huMAb4D5-8 ® (герцептин ), описані в патенті США № 5821337. У фазі I клінічних випробувань було встановлено, що максимально переносима доза (MTD) T-DM1, при внутрішньовенній інфузії кожні 3 тижні, становить 3,6 мг/кг. Значення DLT (токсичність, що обмежує дозу) по тромбоцитопенії ступеня 4 у 2 з 3 пацієнтів дорівнює 4,8 мг/кг. Побічні ефекти ступеня 2, що спостерігаються в дозі 3,6 мг/кг, виявлялися рідко і були незначними. Дана схема лікування добре переносилася хворими і забезпечувала хороший клінічний ефект, як описано раніше. У фазі II клінічних випробувань було показано, що доза 3,6 мг/кг добре переносилася при введенні кожні 3 тижні при невеликому проценті пацієнтів (3 з 112 пацієнтів), для яких було потрібне зниження дозування засобу. Таким чином, дозу T-DM1, що дорівнює 3,6 мг/кг кожні 3 тижні, вибрали для тестування в даному дослідженні, засновуючись на наступному: (1) була показана ефективність і безпека T-DM1 в дозі 3,6 мг/кг кожні 3 тижні і (2) для даної групи пацієнтів зручна схема один раз в 3 тижні. Хіміотерапевтичні засоби Було показано, що деякі хіміотерапевтичні засоби проявляють дивні і несподівані властивості в комбінації з трастузумабом-МСС-DM1 в пригніченні клітинної проліферації в умовах in vitro і in vivo. Такі хіміотерапевтичні засоби включають антитіло-інгібітор димеризації HER2, антитіло до VEGF, 5-FU, карбоплатин, лапатиніб, АВТ-869, доцетаксел, GDC-0941 і GNE390. ® Пертузумаб (номер по CAS 380610-27-5, омнітарг , 2С4, Genentech) представляє рекомбінантне, гуманізоване моноклональне антитіло, яке інгібує димеризацію HER2 (патент США № 6054297; патент США № 6407213; патент США № 6800738; патент США № 6949245; патент США № 7041292). Пертузумаб і трастузумаб направлені на різні позаклітинні області рецептора тирозинкінази HER-2 (Nahta et al., 2004, Cancer Res., 64:2343-2346). Гібридомна клітинна лінія, що експресує 2С4 (пертузумаб) депозована в Американській колекції типових 12 UA 108832 C2 5 10 15 20 25 30 35 40 45 50 55 60 культур (АТСС), 10801 University Boulevard, Manassas, Va. 20110-2209, USA як ATCC HB-12697 8 квітня 1999. Пертузумаб блокує здатність рецептора HER2 сполучатися з іншими членами сімейства рецепторів HER2, тобто HER1/EGFR, HER3 і HER4 (Agus et al., 2002, Cancer Cell, 2:127-137; Jackson et al., 2004, Cancer Res., 64:2601-2609; Takai et al., 2005, Cancer, 104:27012708; патент США № 6949245). У пухлинних клітинах порушення здатності HER2 до взаємодії з іншими членами сімейства рецепторів HER приводить до блокування передачі клітинних сигналів і в кінцевому результаті може привести до пригнічення росту пухлинних клітин і загибелі пухлинних клітин. HDI за рахунок унікального механізму їх дії мають здатність функціонувати в широкому ряді пухлин, включаючи пухлини без надекспресії HER2 (Mullen et al., 2007, Molecular Cancer Therapeutics, 6:93-100). Пертузумаб заснований на послідовностях каркасної області людського IgG1 (κ). Він складається з двох важких ланцюгів і двох легких ланцюгів. Подібно трастузумабу пертузумаб направлений на позаклітинний домен HER2. Однак він відрізняється від трастузумабу по епітопзв'язувальних областях легкого ланцюга і важкого ланцюга. У результаті пертузумаб зв'язується з епітопом всередині, який відомий як субдомен 2 HER2, в той час як епітоп з трастузумабу знаходиться в субдомені 4 (Cho et al., 2003; Franklin et al., 2004). Пертузумаб функціонує за допомогою блокування асоціації HER2 з іншими членами сімейства HER, включаючи HER1 (рецептор епідермального фактора росту; EGFR), HER3 і HER4. Дана асоціація необхідна для передачі сигналів в присутності ліганду через МАР-кіназу і PI3-кіназу. У результаті пертузумаб інгібує ініційовану лігандом внутрішньоклітинну передачу сигналів. Інгібування даних сигнальних шляхів може привести відповідно до зупинки росту і апоптозу (Hanahan and Weinberg, 2000). Внаслідок того, що пертузумаб і трастузумаб зв'язуються з різними епітопами в рецепторі HER2, активована лігандом передача сигналів нижче блокується пертузумабом, але не під дією трастузумабу. Отже, для пертузумабу не потрібна надекспресія HER2 для прояву його активності як протипухлинного засобу. Крім того, внаслідок доповнюючих механізмів їх дії комбінація пертузумабу і T-DM1, має потенційну можливість застосовуватися в лікуванні захворювань, при яких є надекспресія HER2. Пертузумаб оцінювали як препарат для монотерапії в п'яти клінічних випробуваннях в фазі II, проведених на різних злоякісних пухлинах, включаючи MBC з низьким рівнем експресії HER2, недрібноклітинну карциному легень, гормон-стійку злоякісну пухлину передміхурової залози і злоякісну пухлину яєчників. У фазі II клінічних випробувань оцінювали ефективність пертузумабу як самостійного препарату при другій або третій лінії хіміотерапії у пацієнток з метастатичним раком молочної залози (МВС) з нормальною експресією HER2 (Cortes et al., 2005, J. Clin. Oncol., 23:3068). Оцінювали ефективність пертузумабу в фазі II клінічних випробувань в комбінації з трастузумабом (Baselga J. et al., "А Phase II trial of trastuzumab and pertuzumab in patients with HER-2-positive metastatic breast cancer that had progressed during trastuzumab therapy: full response data", European Society of Medical Oncology, Stockholm, Sweden, September 12-16, 2008; Gelmon et al., 2008, J. Clin. Oncol., 26:1026). У першому дослідженні брало участь 11 пацієнток з HER-позитивною МВС, які раніше отримували до трьох курсів лікування з включенням трастузумабу (Portera et al., 2007). ® Бевацизумаб (номер по CAS 216974-75-3, авастин , Genentech) являє собою моноклональне антитіло до VEGF, до васкулярного ендотеліального фактора росту (патент США № 7227004; патент США № 6884879; патент США № 7060269; патент США № 7169901; патент США № 7297334), препарат застосовують для лікування злоякісних пухлин, де він пригнічує їх ріст, блокуючи утворення нових кровоносних судин. Бевацизумаб був першим застосовуваним в клініці інгібітором ангіогенезу в США, дозволеним FDA в 2004 р., для застосування в комбінації із звичайною хіміотерапією для лікування метастатичного раку ободової кишки і більшості форм метастатичної недрібноклітинної карциноми легень. Було проведено декілька завершальних стадій клінічних випробувань для оцінки його безпеки і ефективності у пацієнтів з ад'ювантним/неметастатичним раком ободової кишки, метастатичним раком молочної залози, метастатичним раком нирки, метастатичною мультиформною гліобластомою, метастатичним раком яєчників, метастатичним гормон-стійким раком передміхурової залози і метастатичним або неоперабельним місцево-розповсюдженим раком підшлункової залози. Звичайно анти-VEGF-антитіло не буде зв'язуватися з іншими гомологами VEGF, такими як VEGF-В або VEGF-З, і з іншими факторами росту, такими як PIGF, PDGF або bFGF. Переважні антитіла до VEGF включають моноклональне антитіло, яке зв'язується з тим самим епітопом, що і моноклональне анти-VEGF-антитіло А4.6.1, продуковане гібридомою АТСС НВ 10709; рекомбінантне гуманізоване моноклональне антитіло до VEGF, отримане, як описано Presta et al. 1997, Cancer Res., 57:4593-4599, включаючи, не обмежуючись цим, бевацизумаб. 13 UA 108832 C2 5 10 15 20 Бевацизумаб містить мутантні каркасні області людського IgG1 і антигензв'язувальні області, що визначають комплементарність з мишачого моноклонального анти-hVEGF-антитіла А4.6.1, яке блокує зв'язування людського VEGF з його рецепторами. Приблизно 93 % амінокислотної послідовності бевацизумабу, включаючи велику частину каркасних областей, походить з людського IgG1 і приблизно 7 % послідовності походить з мишачого антитіла А4.6.1. Бевацизумаб має молекулярну масу, що становить приблизно 149000 дальтон, і він глікозильований. Бевацизумаб і інші гуманізовані анти-VEGF-антитіла детально описані в патенті США № 6884879. Додаткові анти-VEGF-антитіла включають антитіла серій G6 і В20 (наприклад, G6-31, В20-4.1), як показано на Фіг. 27-29 в міжнародній заявці WO2005/012359. В одному варіанті здійснення антитіло серії В20 зв'язується з функціональним епітопом в людському VEGF, що містить залишки F17, M18, D19, Y21, Y25, Q89, I91, K101, E103 і С104. Гібридомні лінії, що експресують анти-VEGF-антитіла А4.6.1 (АТСС НВ 10709) і В2.6.2 (АТСС НВ 10710), депозовані і зберігаються в Американській колекції типових культур (АТСС), 10801 University Boulevard, Manassas, VА 20110-2209, USA. Клон, що експресує поліпептид VEGF-E (патент США № 6391311), кодований інсертом нуклеотидної послідовності депозиту АТСС під номером DNA29101-1276, депозований 5 березня 1998 і зберігається під номером АТСС 209653 в Американській колекції типових культур (АТСС), 10801 University Boulevard, Manassas, Va. 20110-2209, USA. 5-FU (фторурацил, 5-фторурацил, номер по CAS № 51-21-8) являє собою інгібітор тимідилатсинтази, і протягом десятиріч його застосовували для лікування раку, включаючи колоректальний рак і рак підшлункової (патент США № 2802005; патент США № 2885396; Barton et al., 1972, Jour. Org. Chem., 37:329; Hansen R.M., 1991, Cancer Invest., 9:637-642). 5-FU представляє 5-фтор-1Н-піримідин-2,4-діон і він має формулу: . 25 30 Карбоплатин (номер за CAS № 41575-94-4) являє собою хіміотерапевтичний засіб, який застосовують для лікування злоякісних пухлин яєчників, легень, голови і шиї (патент США № 4140707). Карбоплатин представляє азанід; циклобутан-1,1-дикарбонової кислоти платину і має формулу: . ® 35 40 Лапатиніб (номер по CAS № 388082-78-8, тикерб , GW572016, Glaxo SmithKline) дозволений ® для застосування в комбінації з капецитабіном (кселода , Roche) для лікування пацієнток з місцево-розповсюдженою або метастатичною злоякісною пухлиною молочної залози із надекспресією HER2 (ErbB2) і пацієнток, що раніше отримували терапію антрацикліном, таксаном і трастузумабом. Лапатиніб є АТФ-конкурентним епідермальним фактором росту (EGFR) і подвійним інгібітором Her2/neu (ErbB-2) тирозинкінази (патент США № 6727256; патент США № 6713485; патент США № 7109333; патент США № 6933299; патент США № 7084147; патент США № 7157466; патент США № 7141576), який інгібує аутофосфорилування і активування рецепторів за допомогою зв'язування з АТФ-зв'язувальною ділянкою домену EGFR/HER2 протеїнкінази. Лапатиніб представляє N-(3-хлор-4-(3-фторбензилокси)феніл)-6-(5((2-(метилсульфоніл)етиламіно)метил)фуран-2-іл)хіназолін-4-амін і він має формулу: 45 14 UA 108832 C2 . 5 АВТ-869 (Abbott and Genentech) є багатомішеневим інгібітором сімейства рецепторів тирозинкіназ VEGF і PDGF для потенційного лікування раку при прийомі препарату перорально (патент США № 7297709; заявка на патент США № 2004/235892; заявка на патент США № 2007/104780). Початі клінічні випробування препарату при лікуванні недрібноклітинного раку легень (NSCLC), гепатоцелюлярної карциноми (НСС) і нирково-клітинної карциноми (RCC). У хімічному відношенні АВТ-869 представляє 1-(4-(3-аміно-1Н-індазол-4-іл)феніл)-3-(2-фтор-5метилфеніл)сечовину (номер по CAS № 796967-16-3) і має формулу: 10 . ® 15 Доцетаксел (таксотер , Sanofi-Aventis) застосовують для лікування раку молочної залози, яєчників і NSCLC (патент США № 4814470; патент США № 5438072; патент США № 5968582; патент США № 5714512; патент США № 5750561). Доцетаксел представляє N-трет-бутиловий ефір (2R, 3S)-N-карбокси-3-фенілізосерину, 13-ефір 5,20-епокси-1,2,4,7,10,13-гексагідрокситакс11-ен-9-ону 4-ацетат-2-бензоату тригідрату (патент США № 4814470; Європейський патент 253738; номер по CAS 114977-28-5) і має формулу: . 20 25 30 35 GDC-0941 (Genentech Inc.) являє собою селективний, що має гарну біодоступність при пероральному прийомі тієнопіримідиновий інгібітор PI3K з обіцяючими фармакокінетичними і фармацевтичними властивостями (Folkes et al., 2008, J. Med. Chem., 51(18):5522-5532; заявка на патент США № 2008/0076768; заявка на патент США № 2008/0207611; Belvin et al., American th Association for Cancer Research Annual Meeting 2008, 99 :April 15, Abstract 4004; Folkes et al., American Association for Cancer Research Annual Meeting 2008, 99th:April 15, Abstract LB-146; th Friedman et al., American Association for Cancer Research Annual Meeting 2008, 99 :April 14, Abstract LВ-110). GDC-0941 демонструє синергічну активність в умовах in vitro і in vivo в комбінації з деякими хіміотерапевтичними засобами на клітинних лініях солідних пухлин (заявка на патент США № 12/208227, Belvin et al. "Combinations of phosphoinositide 3-kinase inhibitor compounds and chemotherapeutic agents and methods of use", подана 10 вересня 2008). У хімічному відношенні GDC-0941 представляє 4-(2-(1Н-індазол-4-іл)-6-((4(метилсульфоніл)піперазин-1-іл)метил)тієно[3,2-d]піримідин-4-іл)морфолін (номер по CAS 957054-30-7) і має формулу: 15 UA 108832 C2 . 5 10 GNE-390 (Genentech Inc.) являє собою селективний, тієнопіримідиновий інгібітор PI3K, що має гарну біодоступність при пероральному прийомі з обіцяючими фармакокінетичними і фармацевтичними властивостями (заявка на патент США № 2008/0242665; міжнародна заявка WO 2008/070740). GNE-390 демонструє синергічну активність в умовах in vitro і in vivo в комбінації з деякими хіміотерапевтичними засобами на клітинних лініях солідних пухлин (заявка на патент США № 12/208227, Belvin et al. "Combinations of phosphoinositide 3-kinase inhibitor compounds and chemotherapeutic agents and methods of use", подана 10 вересня 2008). GDC-390 представляє (S)-1-(4-((2-(2-амінопіримідин-5-іл)-7-метил-4-морфолінотієно[3,2-d]піримідин-6іл)метил)піперазин-1-іл)-2-гідроксипропан-1-он і має формулу: . 15 20 25 30 35 Оцінка біологічної активності Дослідження на клітинних культурах в умовах in vitro з використанням трастузумабу-MCCDM1(T-DM1) в комбінації з різними хіміотерапевтичними засобами або біологічно націленими засобами проводили на ряді клітинних ліній з ампліфікацією HER2. Дані аналізували з використанням методу Chou&Talalay для визначення комбінаційного індексу (CI) для кожної комбінації при кратних значеннях IC50 для кожного лікарського засобу. Значення CI нижче за 0,7 означають наявність синергії; CI в межах 0,7-1,3 - адитивний ефект і значення CI вище за 1,3 антагонізм. Відносно комбінацій з хіміотерапевтичними засобами, T-DM1 в комбінації з доцетакселем або 5-FU приводили до забезпечення адитивної або синергічної антипроліферативної активності, в той час як комбінації з гемцитабіном або карбоплатином були не активні або чинили антагоністичну дію по відношенню до T-DM1. У дослідах з мишачими ксенотрансплантатами були отримані аналогічні результати, де T-DM1 в комбінації з доцетакселем або 5-FU забезпечував істотно більш високу протипухлинну активність в порівнянні з цими засобами окремо. T-DM1 в комбінації з карбоплатином забезпечував більш високу ефективність в порівнянні з одними препаратами, в той час як комбінація T-DM1 з гемцитабіном не була більш ефективною в порівнянні з одним T-DM1. T-DM1 в поєднанні з пертузумабом, лапатинібом або GDC-0941 приводив до прояву адитивної або синергічної антипроліферативної дії на клітинних культурах, і протипухлинна активність істотно підвищувалася в умовах in vivo в порівнянні з лікуванням препаратами по окремості. У протилежність некон'югований трастузумаб виявляв антагоністичну дію у відношенні T-DM1 за рахунок зв'язування з одним і тим самим епітопом на HER2. В експериментах в умовах in vivo з T-DM1 в комбінації з антиангіогенними засобами, такими як антитіло В20-4.1 або інгібітор на основі невеликої молекули АВТ-869, було показане посилення протипухлинної ефективності з всіма тестованими комбінаціями, за винятком найбільш високої дози T-DM1 (10 або 15 мг/кг) в поєднанні з В20-4.1. 16 UA 108832 C2 5 10 15 20 25 30 35 40 45 50 55 60 Оцінювали ефективність комбінацій трастузумабу-MCC-DM1(T-DM1) і численних протипухлинних засобів по визначенню їх антипроліферативної активності на моделях в умовах in vitro на клітинах пухлини молочної залози із надекспресією HER2 і по визначенню протипухлинної ефективності в умовах in vivo на ксенотрансплантатах злоякісної пухлини молочної залози. У даних дослідах трастузумаб-MCC-DM1 додавали до цитотоксичних хіміотерапевтичних засобів, антитіл або інгібіторів кінази на основі невеликої молекули. Комбінація мишачого анти-VEGF-антитіла В20-4.1 (Liang et al., 2006, J. Biol. Chem., 281:951961), аналога бевацизумабу, і трастузумабу-MCC-DM1 при випробуванні на моделі ксенотрансплантатів злоякісної пухлини молочної залози на мишах виявляла більш високу протипухлинну активність в порівнянні з одним В20-4.1. Результати даних досліджень забезпечують прогностичну основу синергічних ефектів і обгрунтування для майбутніх клінічних випробувань лікувальних схем, що включають трастузумаб-MCC-DM1 з різними протипухлинними засобами при HER-2-позитивних злоякісних пухлинах молочної залози. Синергічну дію спостерігали з комбінаціями засобів, направлених на HER2, таких як трастузумаб-DM1 плюс лапатиніб або трастузумаб-DM1 плюс антитіло до HER2 пертузумаб (інгібітор димеризації HER2). Трастузумаб-МСС-DM1 в поєднанні з карбоплатином або 5-FU показував підвищену активність в порівнянні з лікуванням одними цими засобами, в той час як комбіноване лікування з гемцитабіном не приводило до посилення протипухлинної активності. Блокада шляху з участю PI3-кінази з використанням GDC-0941, інгібітора кінази з невеликою молекулою р110 ізоформ (міжнародна заявка WO 2007/129161), посилювала активність трастузумабу-DM1. Використання T-DM1 в поєднанні з інгібітором PI3K GDC-0941 приводило до посилення протипухлинної активності на клітинних лініях HER2-експресуючої злоякісної пухлини молочної залози з мутантною PI3K: BT-474 (K111N), MDA-361.1 (E545K) і KPL4 (H1047R). Комбінована обробка в умовах in vitro приводила до адитивного або синергічного інгібування проліферації клітин, а також підвищеного апоптозу. Аналогічно ефективність в умовах in vivo посилювалася при комбінованій обробці лікарськими засобами в порівнянні з активністю одних препаратів на моделях MDA-MB-361.1 і ксенотрансплантатах Fo5 з ампліфікацією HER2. Результати біохімічного визначення біомаркерів при випробуванні кожного препарату показували, що мало місце інгібування фосфо-Akt і фосфо-ERK під дією обох T-DM1 і GDC-0941, зниження фосфорилування Rb і PRAS40 під дією GDC-0941 і підвищення рівня мітотичних маркерів фосфогістону Н3 і цикліну В1 після обробки T-DM1. Крім того, введення T-DM1 приводило до апоптозу клітин на даних моделях раку молочної залози за даними визначення фрагмента розщеплення PARP масою 23 kDa, зниження рівня Bcl-XL, а також активації каспаз 3 і 7. Додавання GDC-0941 до T-DM1 додатково індукувало посилення апоптозу. У даних дослідженнях була отримана доказова основа для застосування раціональних комбінацій лікарських засобів при лікуванні злоякісної пухлини молочної залози з ампліфікацією HER2 і пропозицій по додаткових терапевтичних підходах для пацієнтів, у яких має місце прогресування захворювання при терапії трастузумабом або лапатинібом. Тести оцінки проліферації клітин в умовах in vitro Активність комбінацій трастузумабу-MCC-DM1 з хіміотерапевтичними засобами оцінювали в умовах in vitro з використанням тесту оцінки проліферації клітин, описаного в прикладі 2; ® промислово доступний тест CellTiter-Glo Luminescent Cell Viability від Promega Corp., Madison, WI. Даний гомогенний тест заснований на рекомбінантній експресії люциферази Coleoptera (патент США № 5583024; патент США № 5674713; патент США № 5700670) і визначенні кількості життєздатних клітин в культурі за кількістю присутньої АТФ, індикатора метаболічно активних клітин (Crouch et al., 1993, J. Immunol. Meth., 160:81-88; патент США № 6602677). Тест ® CellTiter-Glo проводили в форматі 96- або 384-ямкових планшетів, зробивши їх придатними для автоматичного високопропускного скринінгу (HTS) (Cree et al., 1995, AntiCancer Drugs, 6:398404). Гомогенний аналіз включає додавання одного реагенту (реагенту CellTiter-Gloо) безпосередньо до клітин, культивованих в середовищі з додаванням сироватки. Відмивання клітин, видалення середовища і численні стадії піпетування не потрібні. За допомогою даної системи можна детектувати таку невелику кількість клітин, як 15 клітин/ямку в 384-ямковому планшеті протягом 10 хв. після внесення реагенту і перемішування. Гомогенний формат "додавання-перемішування-визначення" приводить до лізису клітин і генерації люмінесцентного сигналу, прямо пропорційного кількості присутньої АТФ. Кількість ® АТФ прямо пропорційна кількості клітин, що знаходяться в культурі. Тест CellTiter-Glo відтворює люмінесцентний сигнал типу свічення, що утворюється в реакції з участю люциферази, який має період напіврозпаду більш, ніж 5 год., в залежності від типу клітин, що 17 UA 108832 C2 5 10 15 20 використовується, і середовища. Життєздатні клітини відбиваються у відносних одиницях люмінесценції (RLU). Субстрат люциферин жуків зазнає окислювального декарбоксилювання, яке каталізується рекомбінантною люциферазою світляків, з одночасним перетворенням АТФ в АМФ і генерацією фотонів. Внаслідок великого періоду напіврозпаду усувається необхідність у використанні інжекторів, і забезпечується гнучкість для безперервного або періодичного способу обробки безлічі планшетів. Даний тест оцінки проліферації клітин можна використати в різних багатоямкових форматах, наприклад, 96- або 384-ямковому форматі. Дані можна реєструвати з допомогою люмінометра або візуалізуючого пристрою з CCD камерою. Вихід люмінесценції виражають у відносних світлових одиницях (RLU) протягом часу. Антипроліферативну дію трастузумабу-MCC-DM1 і комбінацій з хіміотерапевтичними ® засобами оцінювали з використанням тесту CellTiter-Glo (приклад 2) на пухлинних клітинних лініях, результати представлені на Фіг. 1-9 і 18-33. Наведені як приклад варіанти здійснення включають спосіб ідентифікації сполук для застосування в комбінації для лікування раку, що включає: (а) введення терапевтичної комбінації трастузумабу-MCC-DM1 (T-DM1) і хіміотерапевтичного засобу в пухлинну клітинну лінію в умовах in vitro і (b) визначення синергічного або несинергічного ефекту. Значення комбінаційного індексу (CI) вище за 1,3 означає антагонізм; значення CI в межах від 0,7 до 1,3 означає адитивний ефект і значення CI нижче за 0,7 означає синергічну взаємодію препаратів. На Фіг. 1 показана антагоністична дія трастузумабу в комбінації з трастузумабом-MCC-DM1 (T-DM1) в різних концентраціях при кратних окремих значеннях IC 50 (таблиця 1) на клітинах SKBR-3, які є чутливими до трастузумабу. Будували графік залежності кількості життєздатних клітин проти кратних значень IC50. Комбінаційний індекс (CI) в інтервалі від IC 10 до IC90 для кожної комбінації вище за 2, що вказує на наявність антагоністичної дії в умовах in vitro. Однак комбінація T-DM1+трастузумаб не показала антагоністичної дії в умовах in vivo. 25 Таблиця 1 Проліферація клітин SK-BR-3-3 доби Кратні IC50 0,5 X 1X 2X 4X 8X 16 X 30 Трастузумаб нг/мл 20,57 61,72 185,19 555,56 1666,67 5000 T-DM1 нг/мл 2,28 6,86 20,58 61,73 185,19 555,56 Ефект (%) 5,1 26,2 36,3 43,6 45,0 41,7 CI >2 >2 >2 >2 >2 >2 На Фіг. 2 показана антагоністична дія трастузумабу в комбінації з трастузумабом-MCC-DM1 (T-DM1) в різних концентраціях при кратних окремих значеннях IC 50 (таблиця 2) на клітинах BT474 EEI, які є резистентними до трастузумабу. Будували графік залежності кількості життєздатних клітин від кратних значень IC50. Комбінаційний індекс (CI) в інтервалі від IC10 до IC90 для кожної комбінації вище за 2, що вказує на антагоністичну дію. Таблиця 2 Проліферація клітин BT-474-EEI-3 доби Кратні IC50 0,125 X 0,25 X 0,5 X 1X 2X 4X 8X 35 Трастузумаб нг/мл 1,52 4,57 13,71 41,15 123,46 370,4 1111,1 T-DM1 нг/мл 1,52 4,57 13,71 41,15 123,46 370,4 1111,1 Ефект (%) 9,5 4,5 3,1 12,1 10,8 11,6 18,4 CI >2 >2 >2 >2 >2 >2 >2 На Фіг. 3 показана синергічна дія пертузумабу в комбінації з трастузумабом-MCC-DM1 (TDM1) в різних концентраціях при кратних окремих значеннях IC 50 (таблиця 3) на клітинах MDAMB-175. Будували графік залежності кількості життєздатних клітин від кратних значень IC50. 18 UA 108832 C2 Комбінаційний індекс (CI) в інтервалі від IC10 до IC90 для кожної комбінації нижче за 1, що вказує на наявність синергічної дії. Таблиця 3 Проліферація клітин MDA-MB-175-5 діб Кратні IC50 0,0625 X 0,125 X 0,25 X 0,5 X 1X 2X 5 Пертузумаб нг/мл 39,06 78,13 156,3 312,5 625 1250 T-DM1 нг/мл 31,25 62,5 125 250 500 1000 Ефект (%) 21,1 33,3 21,9 33,6 50,7 67,7 CI 0,2 0,107 , 766 0,597 0,391 0,259 На Фіг. 3а наведений графік залежності життєздатності клітин в умовах in vitro на 5 добу від кратних концентрацій IC50 пертузумабу, трастузумабу-MCC-DM1 (T-DM1) і комбінації пертузумабу і T-DM1. Будували графік залежності кількості життєздатних клітин від кратних значень IC50. Комбінаційний індекс (CI) в інтервалі від IC10 до IC90 для кожної комбінації нижче 1 із середнім значенням CI=0,096, що вказує на синергічну дію ( 10 Таблиця 3а Проліферація клітин MDA-MB-175-5 діб Кратні IC50 0,0625х 0,125х 0,25х 0,5х 1x 2x 4x 8x 15 20 25 Ефект (%) 21,3 37,5 40,1 50,3 53,9 57,0 65,5 66,8 CI 0,093 0,037 0,060 0,052 0,078 0,120 0,117 0,208 На Фіг. 4 наведений графік залежності життєздатності клітин BT-474 в умовах in vitro на 5 добу від різних фіксованих концентрацій пертузумабу в комбінації з концентрацією реакції у відповідь трастузумабу-МСС-DM1 (T-DM1) і різних концентрацій одного T-DM1. На Фіг. 4 показаний вплив фіксованих концентрацій T-DM1 в комбінації з різними концентраціями пертузумабу. Додавання пертузумабу до T-DM1 приводить до забезпечення трохи більш високої антипроліферативної активності в порівнянні з одним T-DM1. На Фіг. 5 наведений графік залежності життєздатності клітин BT-474 в умовах in vitro на 5 добу від різних фіксованих концентрацій трастузумабу-МСС-DM1 (T-DM1) в комбінації з концентрацією реакції у відповідь пертузумабу і різних концентрацій одного пертузумабу. На Фіг. 5 показаний вплив фіксованих концентрацій пертузумабу в комбінації з різними концентраціями T-DM1 на проліферацію клітин BT-474. Додавання T-DM1 до пертузумабу приводить до посилення дії одного пертузумабу. НаФіг. 6 показана синергічна дія пертузумабу в комбінації з трастузумабом-МСС-DM1 в різних концентраціях при кратних окремих значеннях IC 50 (таблиця 4) на клітинах BT-474. Будували графік залежності кількості життєздатних клітин від кратних значень IC 50. Комбінаційний індекс (CI) в інтервалі від IC10 до IC90 знаходиться в межах від 0,198 до 1,328. Середнє значення CI для даної межі = 0,658, що вказує на синергічну дію. 19 UA 108832 C2 Таблиця 4 Проліферація клітин BT-474-5 діб Кратні IC50 0,25 X 0,5 X 1X 2X 4X 5 10 Пертузумаб нг/мл 34,29 102,88 308,64 925,93 2777 T-DM1 нг/л 11,43 34,29 102,88 308,64 926 Ефект (%) 3,9 2,0 58,9 64,6 64,9 CI >2 >2 0,198 0,449 1,328 На Фіг. 7 наведений графік залежності життєздатності клітин SK-BR-3 в умовах in vitro на 3 добу від різних концентрацій T-DM1 в комбінації з фіксованими концентраціями лапатинібу (4,5 нМ; 14 нМ; 41 нМ; 123 нМ) і різних концентрацій одного T-DM1 (0-1000 нг/мл). Додавання T-DM1 до лапатинібу приводить до деякого посилення антипроліферативної дії в порівнянні з одним TDM1. На Фіг. 7а наведений графік залежності життєздатності клітин SK-BR-3 в умовах in vitro на 3 добу від кратних концентрацій IC50 T-DM1, лапатинібу і комбінацій з співвідношенням фіксованих концентрацій T-DM1 і лапатинібу, як показано в таблиці 7а. Середнє значення CI в інтервалі від IC10 до IC90=0,793, що вказує на наявність адитивної дії. Таблиця 7а Проліферація клітин SK-BR-3-3 доби Кратні IC50 0,25х 0,5х 1x 2x 4x 8x 15 Лапатиніб нМ 4,57 13,72 41,15 123,44 370,33 1111 T-DM1 нг/мл 1,52 4,57 13,72 41,15 123,44 370,33 Ефект (%) 3,5 22,0 52,5 75,9 81,1 80,1 CI >2 1,384 0,596 0,406 0,787 >2 На Фіг. 8а наведений графік залежності життєздатності клітин BT-474 в умовах in vitro на 3 добу від кратних концентрацій IC50 T-DM1, лапатинібу і комбінацій з співвідношенням фіксованих концентрацій T-DM1 і лапатинібу, як показано в таблиці 8а. Середнє значення CI в інтервалі від IC10 до IC90=0,403, що вказує на наявність синергії. Таблиця 8а Проліферація клітин BT-474-3 доби Кратні IC50 0,125х 0,25х 0,5х lx 2x 4x 8x 20 25 Лапатиніб нМ 0,51 1,52 4,57 13,72 41,15 123,44 370,33 T-DM1 нг/мл 1,52 4,57 13,72 41,15 123,44 370,33 1111 Ефект (%) 1,4 1,2 26,8 62,2 73,9 84,1 89,3 CI >2 >2 0,493 0,201 0,293 0,390 0,638 На Фіг. 8 наведений графік залежності життєздатності клітин BT-474 в умовах in vitro на 3 добу від різних концентрацій T-DM1 в комбінації з фіксованими концентраціями лапатинібу (1,5 нМ; 4,5 нМ; 14 нМ; 41 нМ; 123 нМ) і різних концентрацій одного T-DM1 (0-1000 нг/мл). Додавання лапатинібу до T-DM1 приводить до посилення антипроліферативної дії в порівнянні з одним препаратом. На Фіг. 9 наведений графік залежності життєздатності клітин BT-474-EEI в умовах in vitro на 3 добу від різних концентрацій T-DM1 в комбінації з фіксованими концентраціями лапатинібу (14 20 UA 108832 C2 5 нМ; 41 нМ; 123 нМ; 370 нМ; 1111 нМ) і різних концентрацій одного T-DM1 (0-1000 нг/мл). Додавання лапатинібу до T-DM1 приводить до посилення антипроліферативної дії в порівнянні з одним препаратом. На Фіг. 18 наведений графік залежності життєздатності клітин SK-BR-3 в умовах in vitro на 3 добу від кратних концентрацій IC50 5-FU, трастузумабу-MCC-DM1 (T-DM1) і комбінацій з співвідношенням фіксованих концентрацій 5-FU і T-DM1 (таблиця 18). Комбінація 5-FU і T-DM1 чинить адитивну дію на клітини SK-BR-3 при середньому значенні CI в інтервалі від IC10 до IC90=0,952. Таблиця 18 5-FU+T-DM1: проліферація клітин SK-BR-3-3 доби Кратні IC50 0,5х 1x 2x 4x 5-FU (мкМ) 62,5 125 250 500 T-DM1 нг/мл 1,95 3,91 7,81 15,625 Ефект (%) 38,9 60,3 69,2 74,3 CI 1,035 0,647 0,835 1,292 10 На Фіг. 19 наведений графік залежності життєздатності клітин BT-474 в умовах in vitro на 3 добу від кратних концентрацій IC50 5-FU, трастузумабу-MCC-DM1 (T-DM1) і комбінацій з співвідношенням фіксованих концентрацій 5-FU і T-DM1 (таблиця 19). Комбінація 5-FU і T-DM1 чинить синергічну дію на клітини BT-474 із середнім значенням CI=0,623. 15 Таблиця 19 5-FU+T-DM1: проліферація клітин BT-474-3 доби Кратні IC50 0,25х 0,5х 1x 2x 4x 20 5-FU (мкМ) 0,488 0,976 1,95 3,91 7,81 T-DM1 нг/мл 3,90 7,81 15,62 31,25 62,5 Ефект (%) 17,1 26,8 38,2 46,8 53,6 CI 0,508 0,494 0,513 0,661 0,941 На Фіг. 20 наведений графік залежності життєздатності клітин SK-BR-3 в умовах in vitro на 3 добу від кратних концентрацій IC50 гемцитабіну, трастузумабу-MCC-DM1 (T-DM1) і комбінацій із співвідношенням фіксованих концентрацій гемцитабіну і T-DM1 (таблиця 20). Гемцитабін в комбінації з T-DM1 приводить до антагоністичної взаємодії лікарських засобів при середньому значенні CI>1,3 при всіх тестованих комбінаціях. Таблиця 20 Гемцитабін (GEM) + T-DM1: проліферація клітин SK-BR-3-3 доби Кратні IC50 0,5х 1x 2x 4x 25 GEM (нМ) 3,12 6,25 12,5 25 T-DM1 нг/мл 6,25 12,5 25 50 Ефект (%) 28,7 61,4 69,9 72,2 CI 1,308 1,500 2,588 4,957 На Фіг. 21 наведений графік залежності життєздатності клітин MDA-MD-361 в умовах in vitro на 3 добу від кратних концентрацій IC50 гемцитабіну, трастузумабу-MCC-DM1 (T-DM1) і комбінацій із співвідношенням фіксованих концентрацій гемцитабіну і T-DM1 (таблиця 21). Комбінація препаратів дає антагоністичний ефект при середньому значенні CI=1,706. 21 UA 108832 C2 Таблиця 21 Гемцитабін (GEM) + T-DM1: проліферація клітин MDA-MD-361-3 доби Кратні IC50 0,125х 0,25х 0,5х 1x 2x 4x 5 GEM (нМ) 0,39 0,78 1,56 3,12 6,25 12,5 T-DM1 нг/мл 3,12 6,25 12,5 25 50 100 Ефект (%) 4,5 10,3 30,7 59,2 76,3 80,3 CI 1,420 1,584 1,336 1,280 1,581 2,747 На Фіг. 22 наведений графік життєздатності (проліферації) клітин KPL4 в умовах in vitro на 3 добу після обробки T-DM1, GDC-0941 і комбінаціями з співвідношенням фіксованих концентрацій T-DM1 (від 6,25 до 100 нг/мл) і GDC-0941 (від 62,5 нМ до 1 мкМ) при кратних концентраціях IC50 від 0,25 до 4. У таблиці 22 показана дія в інтервалі інгібування 10-90 % з розрахунковими значеннями CI і середнім значенням CI, що дорівнює 1,111. Будували графік прогнозу адитивної дії Блісса у вигляді пунктирної лінії на Фіг. 22. Графік незалежності Блісса показує розраховану адитивну дію комбінації двох окремих сполук. 10 Таблиця 22 GDC-0941+T-DM1: проліферація клітин KPL4-3 доби Кратні IC50 0,25х 0,5х 1x 2x 4x 15 GDC-0941 (нМ) 62,5 125 250 500 1000 T-DM1 нг/мл 6,25 12,5 25 50 100 Ефект (%) 1,0 33,9 71,8 91,1 93,7 CI 6,319 1,229 1,053 1,051 1,753 На Фіг. 23 наведений графік життєздатності (проліферації) клітин KPL4 в умовах in vitro на 3 добу після обробки T-DM1, GDC-0941 і комбінаціями із співвідношенням фіксованих концентрацій T-DM1 (від 1,25 до 80 нг/мл) і GDC-0941 (від 31,25 нМ до 2 мкМ) при кратних концентраціях IC50 від 0,0625 до 16. Будували графік прогнозу адитивної дії Блісса у вигляді пунктирної лінії. У таблиці 23 показана дія в інтервалі інгібування 10-90 % з розрахунковими значеннями CI і середнім значенням CI, що дорівнює 0,802. Комбінація T-DM1 і GDC-0941 проявляє адитивний ефект на клітинній лінії KPL4. Таблиця 23 GDC-0941+T-DM1: проліферація клітин KPL4-3 доби Кратні IC50 0,125х 0,25х 0,5х 1x 2x 4x 8x GDC-0941 (нМ) 31,25 62,5 125 250 500 1000 2000 T-DM1 нг/мл 1,25 2,5 5 10 20 40 80 Ефект (%) 12,6 20,6 39,2 84,5 94,9 97,1 97,9 CI 1,100 1,344 1,263 0,452 0,350 0,440 0,668 20 25 На Фіг. 24 наведений графік життєздатності (проліферації) клітин KPL4 з ампліфікацією ® Her2, резистентних до герцептину , мутантних по PIK3CA (H1047R) в умовах in vitro через 3 діб після обробки T-DM1, PI103, GDC-0941 і комбінаціями з співвідношенням фіксованих концентрацій T-DM1+PI103 і T-DM1+GDC-0941 при кратних концентраціях IC50 від 0 до 16. У таблиці 24 наведені значення комбінаційного індексу. На основі отриманих результатів можна передбачити, що між T-DM1 і GDC-0941 має місце синергія в умовах in vitro, оскільки значення 22 UA 108832 C2 CI знаходяться в межах від 0,5 до 1, і між T-DM1 і PI103 має місце адитивний ефект, так як значення CI близькі до 1. Таблиця 24 Комбінації: проліферація клітин KPL4 Значення CI при: ED50 ED75 ED90 5 T-DM1+GDC-0941 0,74303 0,63448 0,54179 T-DM1+PI103 1,04069 0,9721 0,91094 PI3K представляє вибірковий інгібітор PI103 (Hayakawa et al., 2007, Bioorg. Med. Chem. Lett., 17:2438-2442; Raynaud et al., 2007, Cancer Res., 67:5850; Fan et al., 2006, Cancer Cell, 9:341-349; патент США № 6608053) і має формулу: . 10 15 20 25 На Фіг. 25 наведений графік апоптозу (запрограмованої клітинної загибелі) клітин KPL4 каспаза 3/7 в умовах in vitro через 24 год. після обробки T-DM1, GDC-0941 і комбінаціями з співвідношенням фіксованих концентрацій T-DM1 і GDC-0941. Комбінація T-DM1 і GDC-0941 приводить до істотного посилення апоптозу в порівнянні з одним препаратом. На Фіг. 26 наведений графік апоптозу (запрограмованої клітинної загибелі) клітин KPL4 в умовах in vitro на 3 добу після обробки T-DM1, GDC-0941 і комбінаціями з співвідношенням фіксованих концентрацій T-DM1 і GDC-0941 в співвідношеннях фіксованих концентрацій. Комбінація T-DM1 і GDC-0941 приводить до істотного збільшення апоптозу в порівнянні з одним препаратом. На Фіг. 27 наведений графік життєздатності (проліферації) клітин MDA-MB-361 в умовах in vitro на 3 добу після обробки T-DM1, GDC-0941 і комбінаціями з співвідношенням фіксованих концентрацій T-DM1 (від 3,125 до 50 нг/мл) і GDC-0941 (від 62,5 нМ до 1 мкМ) при кратних концентраціях IC50 від 0,125 до 8. Будували графік прогнозу адитивної дії Блісса у вигляді пунктирної лінії. У таблиці 27 показана дія в інтервалі інгібування 10-90 % з розрахунковими значеннями CI і середнім значенням CI, що дорівнює 0,888. Комбінація T-DM1 і GDC-0941 приводить до адитивного антипроліферативного ефекту на клітинах MDA-MB-361 із середнім значенням CI=0,889. Таблиця 27 GDC-0941+T-DM1: проліферація клітин MDA-MB-361-3 доби Кратні IC50 0,25х 0,5х 1x 2x 4x 30 35 GDC-0941 (нM) 62,5 125 250 500 1000 T-DM1 нг/мл 3,125 6,25 12,5 25 50 Ефект (%) 21,9 37,3 51,8 73,1 82,3 CI 1,003 0,862 0,920 0,742 0,917 На Фіг. 28 наведений графік життєздатності (проліферації) клітин MDA-MB-361 в умовах in vitro на 3 добу після обробки T-DM1, GDC-0941 і комбінаціями з співвідношенням фіксованих концентрацій T-DM1 (від 3,125 до 100 нг/мл) і GDC-0941 (від 62,5 нМ до 2 мкМ) при кратних концентраціях IC50 від 0,125 до 8. Будували графік прогнозу адитивної дії Блісса у вигляді пунктирної лінії. У таблиці 28 показана дія в інтервалі інгібування 10-90 % з розрахунковими значеннями CI і середнім значенням CI, що дорівнює 0,813. T-DM1 в комбінації з GDC-0941 23 UA 108832 C2 приводить до прояву адитивного антипроліферативного ефекту на клітинах MDA-MB-361 при середньому значенні CI=0,813. Таблиця 28 GDC-0941+T-DM1: проліферація клітин MDA-MB-361-3 доби Кратні IC50 0,25х 0,5х 1x 2x 4x 8x 5 10 GDC-0941 (нM) 62,5 125 250 500 1000 2000 T-DM1 нг/мл 3,125 6,25 12,5 25 50 100 Ефект (%) 28,6 36,7 48,5 66,6 83,2 87,7 CI 0,785 0,960 1,026 0,807 0,590 0,709 На Фіг. 29 наведений графік життєздатності (проліферації) клітин BT-474 в умовах in vitro на 3 добу після обробки T-DM1, GDC-0941 і комбінаціями з співвідношенням фіксованих концентрацій T-DM1 (від 3,125 до 100 нг/мл) і GDC-0941 (від 31,25 нМ до 1 мкМ) при кратних концентраціях IC50 від 0,125 до 4. Будували графік прогнозу адитивної дії Блісса у вигляді пунктирної лінії. У таблиці 29 показана дія в інтервалі інгібування 10-90 % з розрахунковими значеннями CI і середнім значенням CI, що дорівнює 1,2122. У використаних співвідношеннях концентрацій GDC-0941 в комбінації з T-DM1 не виявляють комбінованого ефекту на клітинах BT-474. Таблиця 29 GDC-0941+T-DM1: проліферація клітин BT-474-3 доби Кратні IC50 0,125х 0,25х 0,5х 1x 2x 4x 15 20 GDC-0941 (нM) 31,25 62,5 125 250 500 1000 T-DM1 нг/мл 3,125 6,25 12,5 25 50 100 Ефект (%) 8,0 22,7 31,4 43,9 53,9 71,5 CI >2 1,032 1,178 1,207 1,473 1,171 На Фіг. 30 наведений графік життєздатності (проліферації) клітин BT-474 в умовах in vitro на 3 добу після обробки T-DM1, GDC-0941 і комбінаціями з співвідношенням фіксованих концентрацій T-DM1 (від 6,25 до 100 нг/мл) і GDC-0941 (від 62,5 нМ до 1 мкМ) при кратних концентраціях IC50 від 0,25 до 4. Будували графік прогнозу адитивної дії Блісса у вигляді пунктирної лінії. У таблиці 30 показана дія в інтервалі інгібування 10-90 % з розрахунковими значеннями CI і середнім значенням CI, що дорівнює 0,997, що вказує на адитивну дію. Таблиця 30 GDC-0941+T-DM1: проліферація клітин BT-474-3 доби Кратні IC50 0,25х 0,5х 1x 2x 4x 25 GDC-0941 (нM) 62,5 125 250 500 1000 T-DM1 нг/мл 6,25 12,5 25 50 100 Ефект (%) 19,7 31,5 49,0 66,0 73,9 CI 1,338 1,167 0,886 0,708 0,886 На Фіг. 31 наведений графік життєздатності (проліферації) клітин AU565 з ампліфікацією Her2, мутантних без PI3K в умовах in vitro на 3 добу після обробки T-DM1, PI103, GDC-0941 і комбінаціями з співвідношенням фіксованих концентрацій T-DM1+PI103 і T-DM1+GDC-0941 при кратних концентраціях IC50 від 0 до 16. У таблиці 31 наведені значення комбінаційного індексу. На основі отриманих результатів можна передбачити, що між T-DM1 і GDC-0941 має місце 24 UA 108832 C2 антагонізм в умовах in vitro, оскільки значення CI становлять >1, і між T-DM1 і PI103 існує адитивний ефект або незначний антагонізм, так як значення CI близькі або трохи вищі за 1. Таблиця 31 Комбінації: проліферація клітин AU565 Значення CI при: ED50 ED75 ED90 5 10 T-DM1+GDC-0941 1,19123 1,36342 1,56063 T-DM1+PI 103 1,12269 0,97338 0,84956 На Фіг. 32 наведений графік життєздатності (проліферації) клітин EFM192А з ампліфікацією Her2, мутантних по PIK3CA (C420R) в умовах in vitro на 3 добу після обробки T-DM1, PI103, GDC-0941 і комбінаціями з співвідношенням фіксованих концентрацій T-DM1+PI103 і TDM1+GDC-0941 при кратних концентраціях IC50 від 0 до 16. У таблиці 32 наведені значення комбінаційного індексу. На основі отриманих результатів можна передбачити про наявність помірної синергії між T-DM1 і GDC-0941 в умовах in vitro, оскільки значення CI знаходяться в межах від 0,5 до 1, і синергії між T-DM1 і PI103, так як значення CI близькі до 0,5. Таблиця 32 Комбінації: проліферація клітин EFM192A Значення CI при: ED50 ED75 ED90 15 20 T-DM1+GDC-0941 0,80379 0,66352 0,5485 T-DM1+PI 103 0,53861 0,52087 0,52001 На Фіг. 33 наведений графік життєздатності (проліферації) клітин HCC1954 з ампліфікацією ® Her2, резистентних до герцептину , мутантних по PIK3CA (H1047R) в умовах in vitro на 3 добу після обробки T-DM1, PI103, GDC-0941 і комбінаціями з співвідношенням фіксованих концентрацій T-DM1+PI103 і T-DM1+GDC-0941 при кратних концентраціях IC50 від 0 до 16. У таблиці 33 наведені значення комбінаційного індексу. На основі отриманих результатів можна передбачити про наявність адитивного ефекту або незначну синергію між T-DM1 і GDC-0941 в умовах in vitro, оскільки значення CI близькі до 1, і є незначна синергія між T-DM1 і PI103, так як значення CI
ДивитисяДодаткова інформація
Назва патенту англійськоюCombinations of an anti-her2 antibody-drug conjugate and chemotherapeutic agents, and methods of use
Автори російськоюBerry, Leanne, Phillips, Gail, Lewis, Sliwkowski, Mark, X.
МПК / Мітки
МПК: A61K 31/416, A61K 31/337, A61K 31/517, A61K 31/5355, A61K 31/555, A61K 31/513, A61P 35/00
Мітки: засобів, анти-нer2-антитіло-лікарський, комбінації, засіб, способи, хіміотерапевтичних, застосування, кон'югата
Код посилання
<a href="https://ua.patents.su/65-108832-kombinaci-konyugata-anti-ner2-antitilo-likarskijj-zasib-i-khimioterapevtichnikh-zasobiv-i-sposobi-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Комбінації кон’югата анти-нer2-антитіло-лікарський засіб і хіміотерапевтичних засобів і способи застосування</a>
Попередній патент: Програмно-технічний комплекс автоматизації прикордонного контролю “гарт-1/п”
Наступний патент: Спосіб обробки целюлозних і лігноцелюлозних структурних матеріалів
Випадковий патент: Сироп для лікування бронхопульмональних захворювань