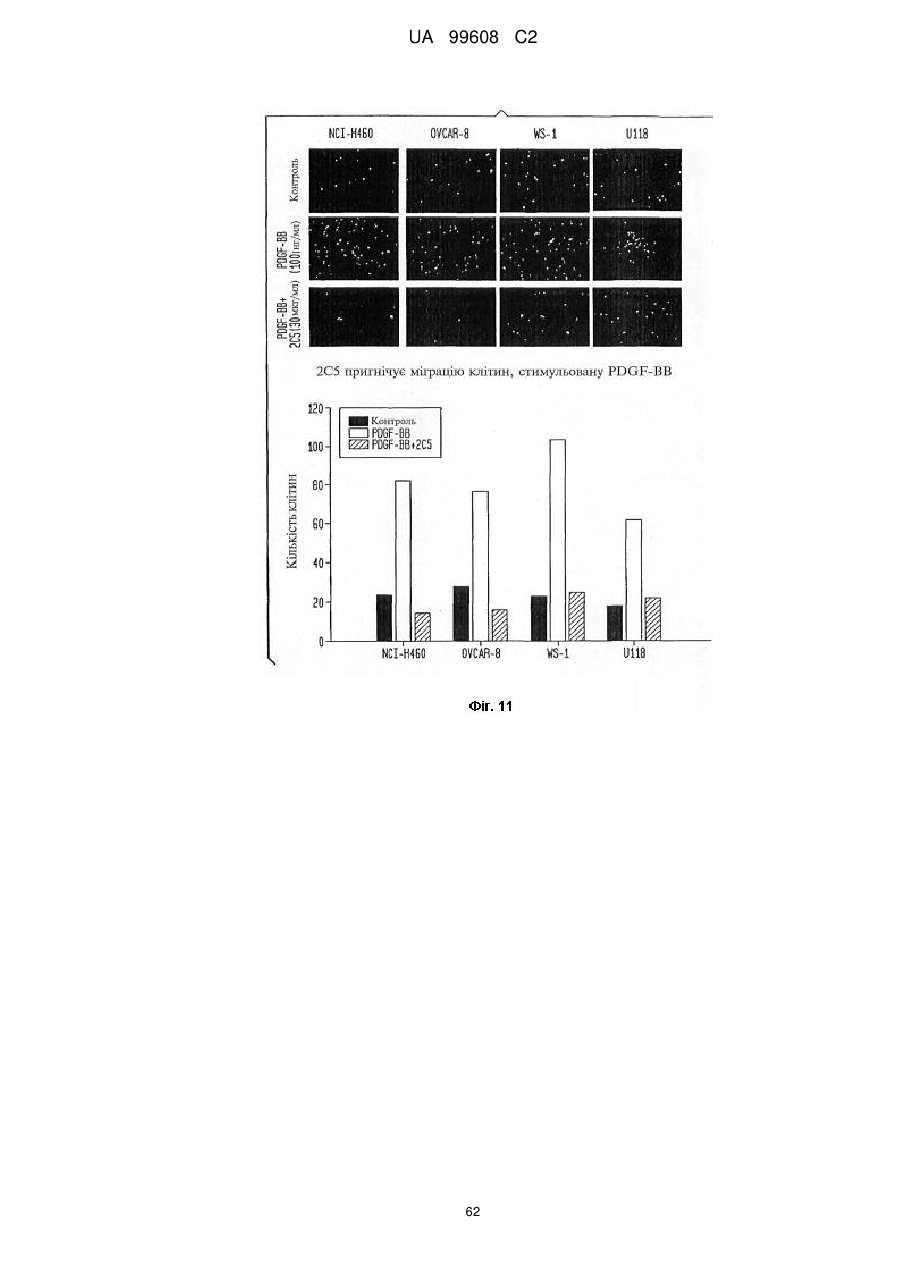
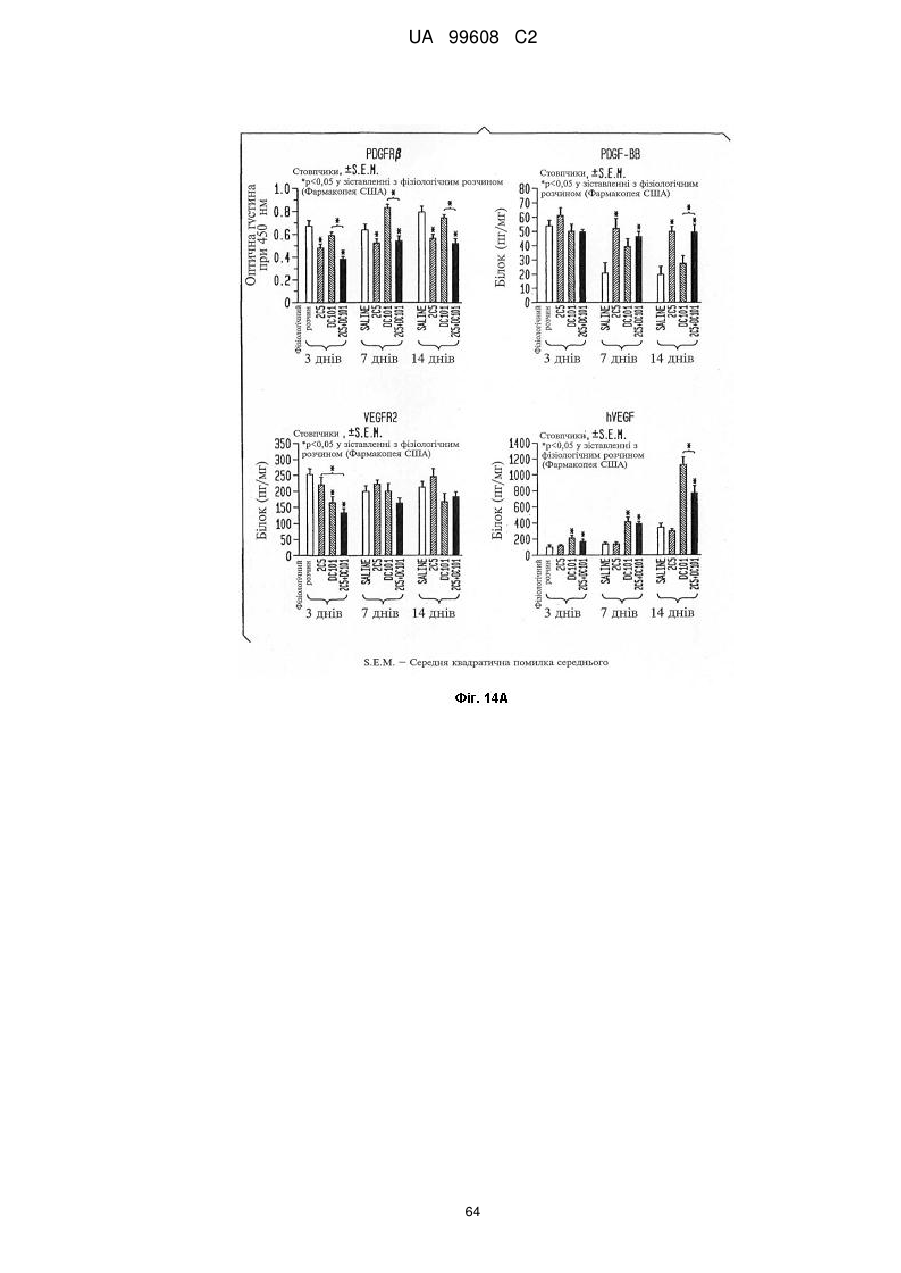
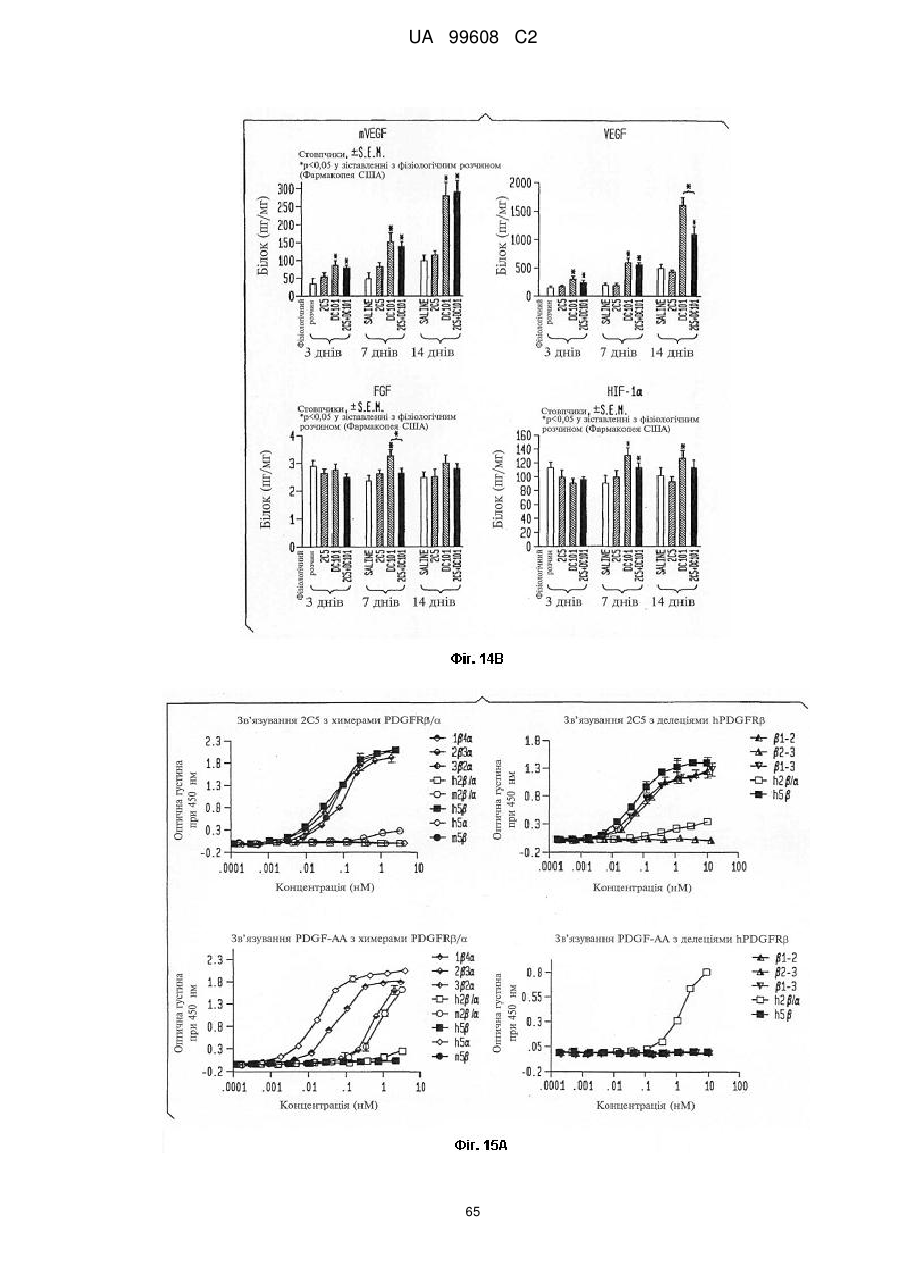
Pdgfrb-специфічні антитіла
Формула / Реферат
1. Антитіло або його функціональний фрагмент, що зв'язує людський PDGFRβ, що містить CDRH1, що має послідовність SYAIS (SEQ ID NO: 20), CDRH2, що має послідовність RIIPILGIANYAQKFQG (SEQ ID NO: 22), CDRH3, що має послідовність DMGSRNYYYFY (SEQ ID NO: 24), CDRL1, що має послідовність RASQSVGRYLA (SEQ ID NO: 28), CDRL2, що має послідовність GASNRAT (SEQ ID NO: 30) та CDRL3, що має послідовність QQRSNWPLT (SEQ ID NO: 32).
2. Антитіло або його функціональний фрагмент за п. 1, що містить амінокислотну послідовність SEQ ID NO: 26 та амінокислотну послідовність SEQ ID NO: 18.
3. Антитіло або його функціональний фрагмент за будь-яким із попередніх пунктів, що містить людську константну ділянку важкого ланцюга g1 та людську константну ділянку легкого ланцюга k.
4. Антитіло або його фрагмент за будь-яким із пп. 1-3 для застосування при лікуванні раку.
5. Антитіло або його фрагмент за п. 4, де раком є рак яєчника, недрібноклітинний рак легень, рак підшлункової залози, рак товстої кишки або гліобластома.
6. Фармацевтична композиція, яка містить антитіло або його функціональний фрагмент за будь-яким із пп. 1-5 спільно з фармацевтично прийнятним носієм.
7. Застосування антитіла або його функціонального фрагмента за будь-яким із пп. 1-5 у поєднанні з додатковим протипухлинним засобом або додатковим протипухлинним заходом, що застосовується одночасно, окремо або послідовно, для лікування.
8. Застосування антитіла за будь-яким із пп. 1-5 для виготовлення лікарського засобу для терапевтичного застосування при лікуванні раку яєчника, недрібноклітинного раку легень, раку підшлункової залози, раку товстої кишки або гліобластоми.
Текст
Реферат: Заявлений винахід належить до нових PDGFR-специфічних антитіл. Антитіла застосовують для зменшення або пригнічення росту пухлин. Згадані антитіла можуть також вводитись у комбінації з додатковими протипухлинними лікарськими засобами. UA 99608 C2 5 10 15 20 25 30 35 40 45 50 55 [0001] Ця заявка претендує на пріоритет за попередньою заявкою на патент США № 60/923,979, поданою 17 квітня 2007 року, зміст якої включено до цього опису шляхом посилання. [0002] Цей винахід спрямований на способи та композиції для пригнічення ангіогенезу та росту пухлин. Цей винахід демонструє вплив специфічного пригнічення бета-рецептора тромбоцитарного фактора росту (PDGFR) на ангіогенез і надає можливість лікування ангіогенезу із застосуванням PDGFR-специфічних антагоністів, окремо або у комбінації з інгібіторами VEGF-рецепторів. Згаданими специфічними інгібіторами можуть бути антитіла або їхні антиген-зв’язувальні фрагменти. Крім того, згадані інгібітори можуть бути біспецифічними. [0003] Тромбоцитарні фактори росту (PDGF) являють собою родину сильнодіючих мітогенів майже для усіх клітин мезенхімального походження. Існує чотири ізоформи PDGF – A, B, C та D, які утворюють п’ять різних сполучених дисульфідними зв’язками димерних білків PDGF-AA, -BB, -AB, -CC та -DD. Ці фактори росту діють на клітини через посередництво двох структурно споріднених тирозинкіназних рецепторів: -рецептор PDGF (PDGFR) та -рецептор PDGF (PDGFR). (Sandy J.R., 1998, Br. J. Orthod. 25:269-274; Betsholtz C. at al., 2001, Bioessays 23:494507). [0004] PDGFR та PDGFR є структурно подібними і можуть утворювати гетеродимери, а також гомодимери. PDGF-BB та PDGF-DD є головними активаторами гомодимерних рецепторів. PDGF-AA активує лише -рецепторні димери, у той час як PDGF-AB, PDGF-BB та PDGF-CC активують - та -рецепторні димери. Молекули димерних лігандів зв’язуються з двома рецепторними білками одночасно і індукують димеризацію рецептора, аутофосфорилування специфічних залишків у межах цитоплазматичного домену рецептора та внутрішньоклітинне передавання сигналу. Зрештою, активація шляху передавання сигналу PDGFR індукує різні клітинні реакції, у тому числі проліферацію та міграцію клітин. [0005] Вважають, що ангіогенез є обов’язковим як для росту, так і для метастазування пухлин. Розвиток судинної системи, або утворення та розвиток судин, включає об’єднання клітин двох головних типів, ендотеліальних клітин (EC) та перицитів/клітин гладеньких м’язів судин (SMC), у зрілі кровоносні судини. На думку про участь PDGF-B/PDGFR-шляху передавання сигналу в утворенні та розвитку судин наводять PDGF-B- та PDGFR-блоковані миші. PDGF-B- та PDGFR-блоковані фенотипи є фактично ідентичними у плані того, що у мишей спостерігаються кровотечі, спричинені втратою судинами покриття, що складається з перицитів та клітин гладеньких м’язів. Дослідження вказують на те, що PDGFR приймають участь у рекрутингу перицитів до капілярів та розвитку клітин гладеньких м’язів у судинах. Рекрутинг перицитів до покриття судин, що знаходяться на стадії виникнення, є необхідним для стабілізації і подальшого розвитку судинної системи. Судини, яким бракує адекватного перицитарного покриття, є більш вразливими до VEGF-пригнічення, ніж добре розвинуті зрілі судини. [0006] Було встановлено, що ряд тирозинкіназних інгібіторів, які знаходяться на стадії розробки як протипухлинні агенти, пригнічує PDGFR. Однак ці сполуки мають численні ® тирозинкіназні мішені. Наприклад, іматинібмезилат (Gleevec /ST571) був розроблений як інгібітор тирозинкінази Абельсона (Abl), але він також пригнічує c-KIT, PDGFR та PDGFR. ® Сунітинібу малат (Sutent /SU11248) являє собою пероральний багатоцільовий інгібітор тирозинкінази широко спектра дії з активністю проти VEGFR, PDGFR, c-KIT та FLT-3. CP673,451 є інгібітором як PDGFR, так і PDGFR. Оскільки ці низькомолекулярні антагоністи не є специфічними для цих рецепторів, неможливо відрізнити внесок передавання сигналу PDGFR до ангіогенезу, у тому числі до пухлиноспецифічного ангіогенезу, стимуляції та росту пухлин або токсичності, пов’язаної із введенням таких сполук, що може викликатись непотрібним спрямованим зв’язуванням численних рецепторів. [0007] Отже, цей винахід пропонує PDGFR-специфічні антагоністи, демонструє роль PDGFR у ангіогенезі, у тому числі у ангіогенезі, що підтримує ріст та виживаність пухлин, і пропонує способи лікування пухлин та ангіогенних захворювань. Цей винахід також демонструє перевагу одночасного пригнічення трансдукції сигналу через PDGFR та VEGFR. [0008] Цей винахід пропонує PDGFR-специфічний антагоніст PDGFR-опосередкованої трансдукції сигналу. За одним із варіантів здійснення цього винаходу PDGFR-специфічним антагоністом є антитіло, яке специфічно зв’язується з -рецептором тромбоцитарного фактора росту (PDGFR). Одне з таких антитіл має гіперваріабельні ділянки, які є на щонайменше приблизно 90% гомологічними або на приблизно 90% ідентичними до послідовності SEQ ID NO: 20 на CDRH1; послідовності SEQ ID NO: 22 на CDRH2; послідовності SEQ ID NO: 24 1 UA 99608 C2 5 10 15 20 25 30 35 40 45 50 55 на CDRH3; послідовності SEQ ID NO: 28 на CDRL1; послідовності SEQ ID NO: 30 на CDRL2; та послідовності SEQ ID NO: 32 на CDRL3. Інше таке антитіло містить амінокислотну послідовність SEQ ID NO: 18 варіабельного домену важкого ланцюга та амінокислотну послідовність SEQ ID NO: 26 варіабельного домену легкого ланцюга. Інший варіант здійснення такого антитіла має гіперваріабельні ділянки, які є на щонайменше приблизно 90% гомологічними або на приблизно 90% ідентичними до послідовності SEQ ID NO: 4 на CDRH1; послідовності SEQ ID NO: 6 на CDRH2; послідовності SEQ ID NO: 8 на CDRH3; послідовності SEQ ID NO: 12 на CDRL1; послідовності SEQ ID NO: 14 на CDRL2 та послідовності SEQ ID NO: 16 на CDRL3. Інше таке антитіло містить амінокислотну послідовність SEQ ID NO: 2 варіабельного домену важкого ланцюга та амінокислотну послідовність SEQ ID NO: 10 варіабельного домену легкого ланцюга. Цей винахід також охоплює PDGFR-специфічне антитіло, яке зв’язується з тією самою антигенною детермінантою або антигенною детермінантою, яка частково співпадає з нею, як одне з вищезгаданих антитіл. [0009] Антитіла за цим винаходом можуть бути химерними, гуманізованими або людськими. Антитіла за цим винаходом можуть також бути антигензв’язувальними фрагментами, такими, наприклад, як одноланцюгові антитіла, Fab- та F(ab’)2-фрагменти, одноланцюгові Fv-фрагменти та однодоменні антитіла. До згаданих антитіл належать також діатіла та триатіла. Крім того, згадані антитіла можуть бути біспецифічними. [0010] Цей винахід також пропонує виділені полінуклеотиди, які кодують такі антитіла, експресійні вектори та клітини-хазяї, що продукують згадані антитіла. [0011] Цей винахід пропонує спосіб модулювання активності -рецептора тромбоцитарного фактора росту (PDGFR) у ссавця, який включає введення в організм ссавця ефективної кількості PDGFR-специфічного антагоніста. За одним із варіантів здійснення цього винаходу ефективну кількість PDGFR-специфічного антагоніста застосовують для пригнічення ангіогенезу у ссавця. За іншим варіантом здійснення ефективну кількість PDGFR-специфічного антагоніста застосовують для зменшення росту пухлин у ссавця. Згаданим PDGFRспецифічним антагоністом може бути антитіло, що зв’язується з PDGFR, або будь-який інший агент, що зв’язується з PDGFR, або ліганд PDGFR, причому згаданий PDGFR-специфічний антагоніст зменшує або блокує PDGFR-опосередковану трансдукцію сигналу. Способи лікування можуть також включати сумісне ведення антагоніста VEGFR. За альтернативним варіантом способи лікування можуть передбачати застосування засобу, який одночасно є PDGFR-специфічним антагоністом та антагоністом VEGFR, наприклад, біспецифічне антитіло. [0012] За цим винаходом лікування пухлин та ангіогенних станів може також включати введення протипухлинного засобу, наприклад, хіміотерапевтичного агента або опромінення. Короткий опис фігур [0013] Фіг. 1 відображає результати кількісних аналізів зв’язування та блокування рецептора антитілом проти PDGFR, 1B3. (A) Очищені Fab-фрагменти або повнорозмірний 1B3 IgG додавали до mPDGFR/Fc-сенсибілізованих планшетів (1 мкг/мл) та інкубували при кімнатній температурі впродовж 1 год. Зв’язані з планшетом антитіла виявляли за допомогою кон’югату козячого антилюдського антитіла-HRP (пероксидаза з хрону). (B) Антитіло 1B3 або Fabфрагмент спочатку змішували з визначеною кількістю mPDGFR/Fc (50 нг) та інкубували при кімнатній температурі впродовж 30 хв. Після цього згадану суміш переносили на планшети, заздалегідь сенсибілізовані PDGF-BB (0,5 мкг/мл), та інкубували при кімнатній температурі впродовж 1 год. Зв’язані з планшетом mPDGFR/Fc виявляли за допомогою кон’югату козячого антилюдського Fc антитіла-HRP. IMC-1121 являє собою антитіло, спрямоване проти людського VEGFR2. Дані являють собою середнє значення ± середнє квадратичне відхилення потрійних зразків. [0014] Фіг. 2 відображає пригнічення PDGF-BB-індукованого фосфорилування рецептора та сигнальних молекул (MAPK (мітогенактивована протеїнкіназа) та Akt (протеїнкіназа В), у напрямку 3-5, що є результатом зв’язування антитіла 1B3 з поверхневоклітинним PDGFR. (A) FACS-аналіз (аналіз збудженої флуоресценції сортованих клітин) клітин NIH/3T3 (фібробласти), клітин D122 (рак легень Льюїса), клітин 4T1 (рак молочної залози), клітин B16 (меланома) та клітин H5V (PmT-трансформовані ендотеліальні клітини), інкубованих з антитілом проти PDGFR, 1B3, та кон’югатом антилюдського Fc антитіла-FITC (флуоресцинізотіоціанат). (B) Пригнічення PDGF-BB-індукованого фосфорилування рецептора клітин NIH-3T3. (C) Пригнічення PDGF-BB-індукованого фосфорилування рецептора клітин D122. (D) Пригнічення PDGF-BB-стимульованого фосфорилування AKT та p44/42 MAP кінази клітин D122. [0015] Фіг. 3 показує вплив обробки антитілом проти mPDGFR, 1B3, на ріст людських 2 UA 99608 C2 5 10 15 20 25 30 35 40 45 50 55 пухлин-ксенотрансплантатів in vivo. Шість моделей ксенотрансплантатів, SK-OV-3, OV-CAR-8, BxPC-3, OV-CAR-5, Caki-1 та NCI-H460 (від A до F, відповідно) застосовували для перевірки впливу 1B3 на пухлини-ксенотрансплантати у безтимусних (“голих”) мишей з мутацією по гену 3 nude. Мишей з розвинутими пухлинами (250-300 мм ) довільно розподіляли на групи і обробляли 1B3, нормальним людським IgG або фізіологічним розчином шляхом внутрішньоочеревинної ін’єкції вказаної на фігурі дози двічі на тиждень (за виключенням моделі BxPC-3, де мишей обробляли тричі на тиждень). Об’єми пухлин визначали двічі на тиждень, і результати представлені у вигляді середнього значення±середня квадратична помилка середнього. *1 означає втрату однієї миші внаслідок тяжкого захворювання. 1B3 зв’язується з мишачим, але не з людським PDGFR. Відповідно, реакції на обробку, які спостерігаються, є результатом пригнічення стимулювання клітин-хазяїв. [0016] Фіг. 4 показує вплив комбінованої обробки антитілом проти mPDGFR, 1B3, та антитілом проти mVEGFR2, DC101, на ріст людських пухлин-ксенотрансплантатів in vivo. 6 Підшкірні ксенотрансплантати BxPC-3 (A) або NCI-H460 (510 ) (B) приживляли “голим” (nu/nu) 3 мишам-самицям. Коли пухлини досягали розміру 300-350 мм , мишей довільно розділяли на чотири групи (n=12) і обробляли фізіологічним розчином (Фармакопея США), 1B3 (40 мг/мг), DC101 (40 мг/мг) або 1B3 (40 мг/мг) плюс DC101 (40 мг/мг), тричі на тиждень. Об’єми пухлин визначали двічі на тиждень, і результати представлені у вигляді середнього значення ± середня квадратична помилка середнього. *1 означає втрату однієї миші внаслідок тяжкого захворювання. 1B3 зв’язується з мишачим, але не з людським PDGFR. DC101 зв’язується з мишачим, але не з людським VEGFR2. Відповідно, реакції на обробку, що спостерігаються, є результатом пригнічення стимулювання клітин-хазяїв. [0017] Фіг. 5 показує результати імуногістохімічного аналізу людських ксенотрансплантатів після обробки 1B3, DC101 або DC101 плюс 1B3. На 34 день (модель BxPC3, Фіг. 5A-Фіг. 5C) або 50 день (модель NCI-H460, Фіг. 5D-Фіг. 5F) після обробки шість мишей з кожної групи умертвляли, і пухлини обробляли для проведення IHC (імуногістохімічного) аналізу. З пухлин одержували зрізи, які піддавали подвійному забарвлюванню як на кровоносні судини (антиCD31), так і на перицитарне/SMC покриття (-SMA, Фіг. 5B та Фіг. 5E). Одержали п’ять цифрових імунофлуоресцентних зображень периферії та центральної частини пухлин кожного + зрізу, які піддали кількісному аналізу на загальну кількість CD31 судин (Фіг. 5A та Фіг. 5D), + + + SMA судин (Фіг. 5B та Фіг. 5E) та відсоток подвійних CD31 /-SMA судин у зіставленні із + загальною кількістю CD31 судин (Фіг. 5C та Фіг. 5F). Для визначення ступеня васкуляризації окремих зрізів пухлин застосовували два різні методи кількісного визначення: густина судин 3 (кількість судин/мм ) та відсоток площини судин (відсоток площини судин у зіставленні із загальною площиною судин). Для статистичного аналізу застосовували двофакторний дисперсійний аналіз з подальшою обробкою за методом мінімальної значущої різниці Фішера для множинних порівнянь (програма Sigma Stat 3.1, виробник Systat Software, Inc., Point Richmond, штат Каліфорнія). * P0,05 100 >0,05 1 OVCAR-5 92 0,7 84 0,06 1 Caki-1 65 0,1004 91 0,6303 10 49 0,0733 OVCAR-8 43 0,0022 39 0,0014 5 NCI-H460 60 0,0235 60 0,0115 2 5 10 [0156] Протипухлинна активність комбінації антитіла проти PDGFR (2C5)/антитіла проти mVEGFR 2 (DC101) у моделях пухлин-ксенотрансплантатів. 2C5, яке зв’язується з людськими та мишачими -рецепторами PDGF (тобто бета-рецепторами PDGF пухлин та судинної сітки людських ксенотрансплантатів у миші-хазяїна), також перевіряли на пригнічення росту пухлин у комбінації з антитілом (DC101), специфічним для мишачого VEGFR2. Лініями клітинксенотрансплантатів були BxPC-3, MIA-PaCa-2, Detroit-562, HCT-8, NCI-H460, NCI-H292 та HCT116. Результатом сумісного введення 2C5 та DC101 було значно більше пригнічення росту пухлин, ніж при самостійному введенні будь-якого зі згаданих антитіл (Фіг. 10 та Таблиця 3). Таблиця 3 Антитіло проти PDGFR у комбінації з антитілом проти VEGFR2 Об'єм пухлин Антитіло Ксенотрансплантат Модель пухлини Р-значення (комбінація/DC101 %) Рак підшлункової 1B3+DC101 BxPC-3 65 0,0346 залози НедрібноNCI-H460 клітинний рак 48 0,1088 легень Сквамозна 2C5+DC101 Detriot562 65 (40 день) 40 (74 день) 0,1146 пухлина Рак підшлункової BxPC-3 31
ДивитисяДодаткова інформація
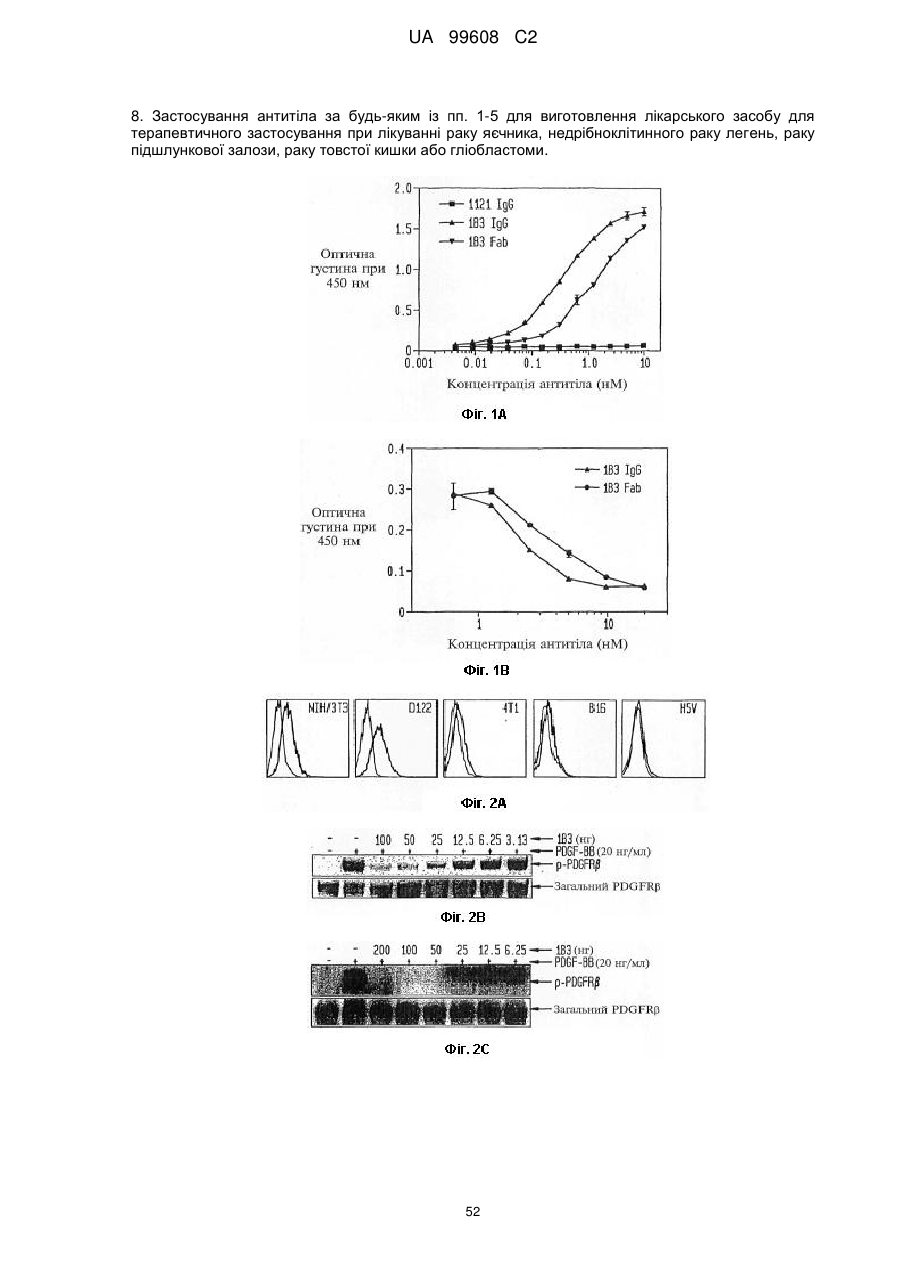
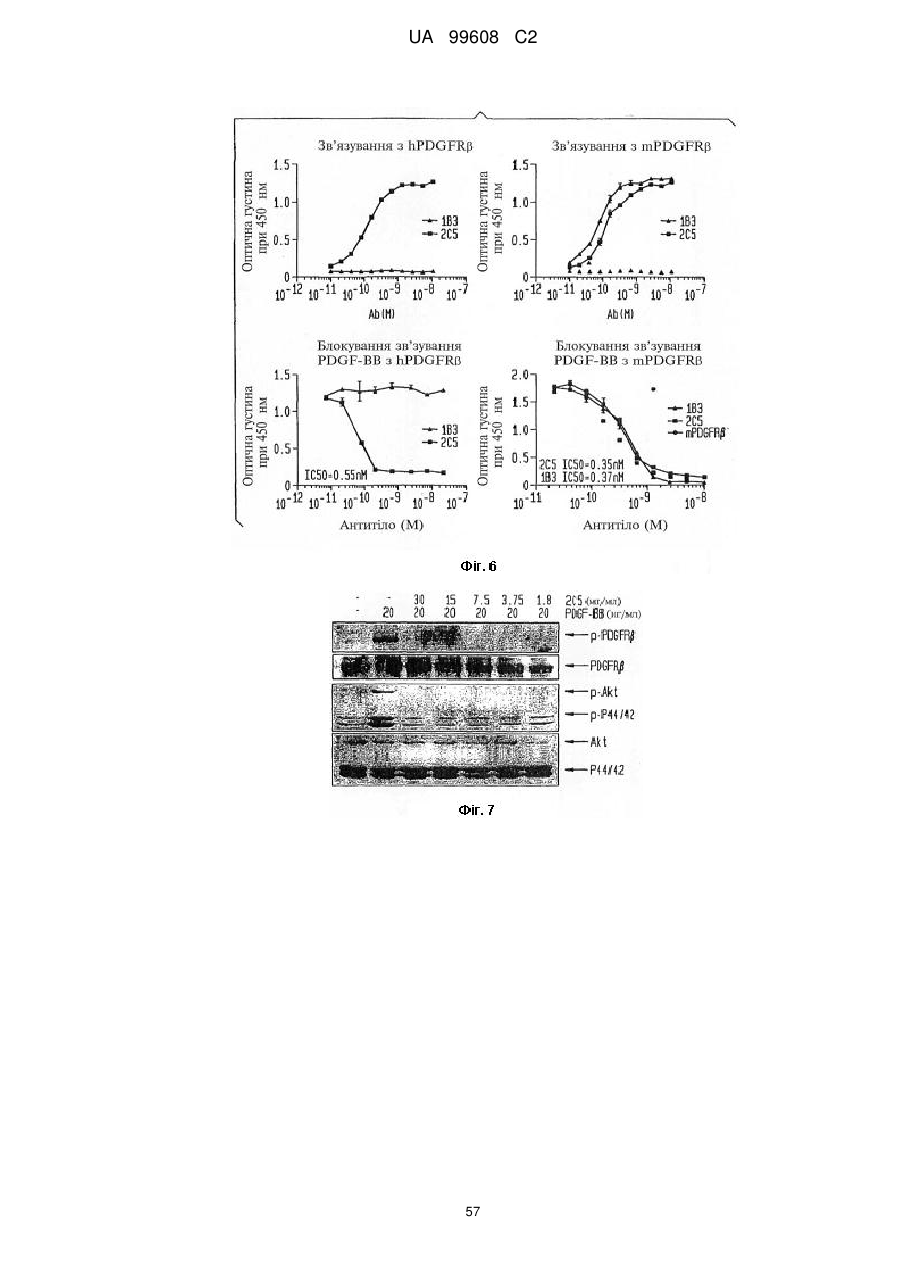
Назва патенту англійськоюPdgfrb-specific inhibitors
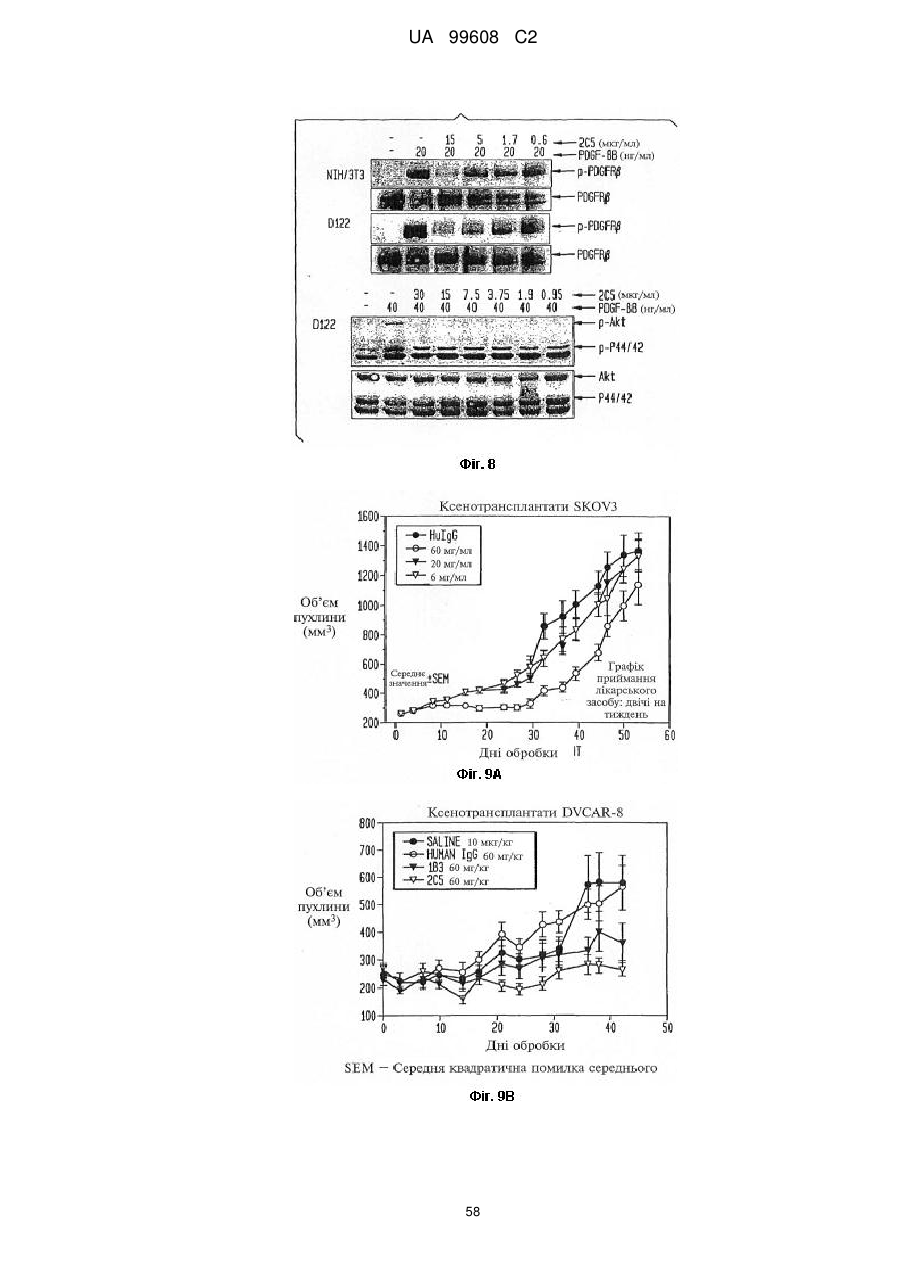
Автори англійськоюZhu, Zhenping, Shen, Juqun
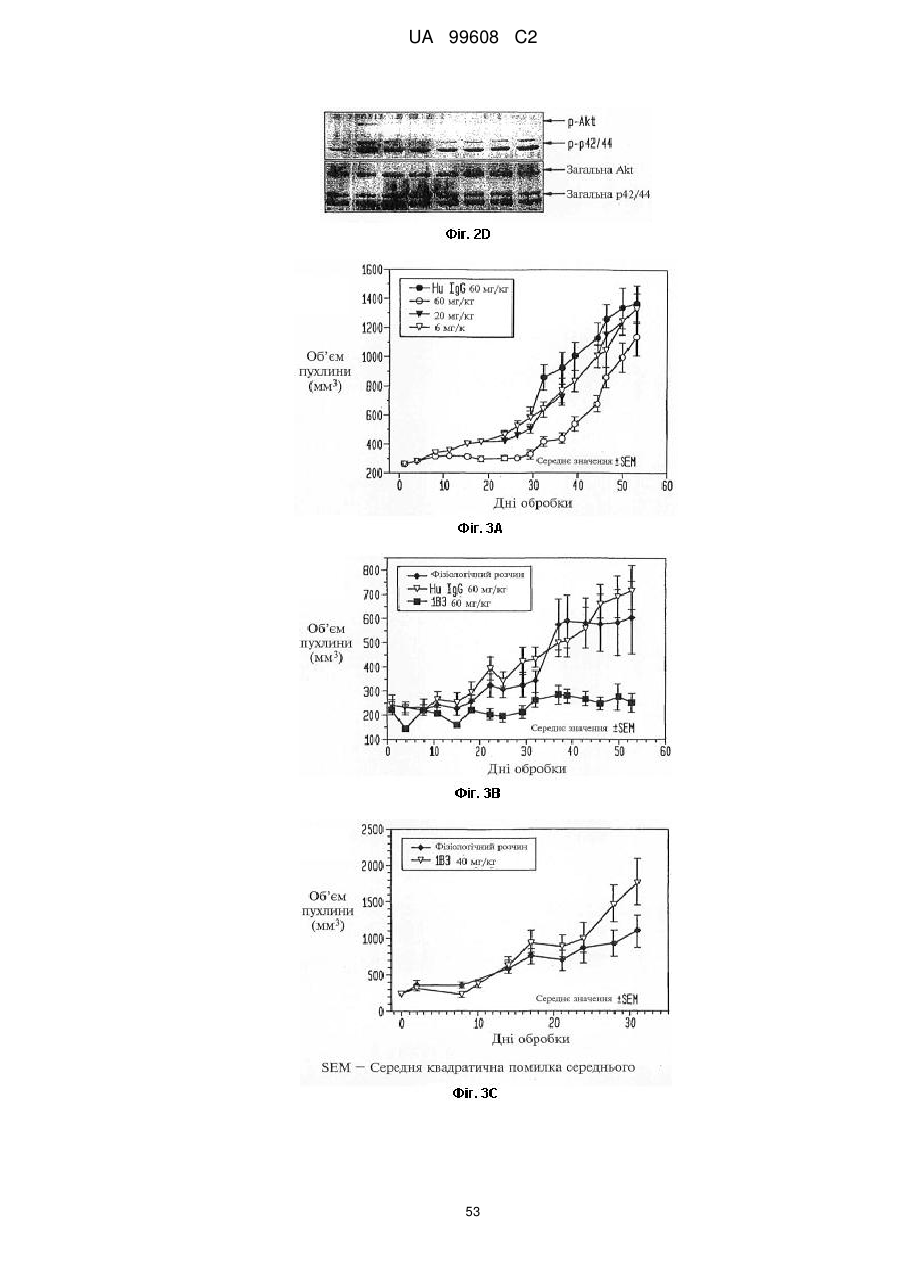
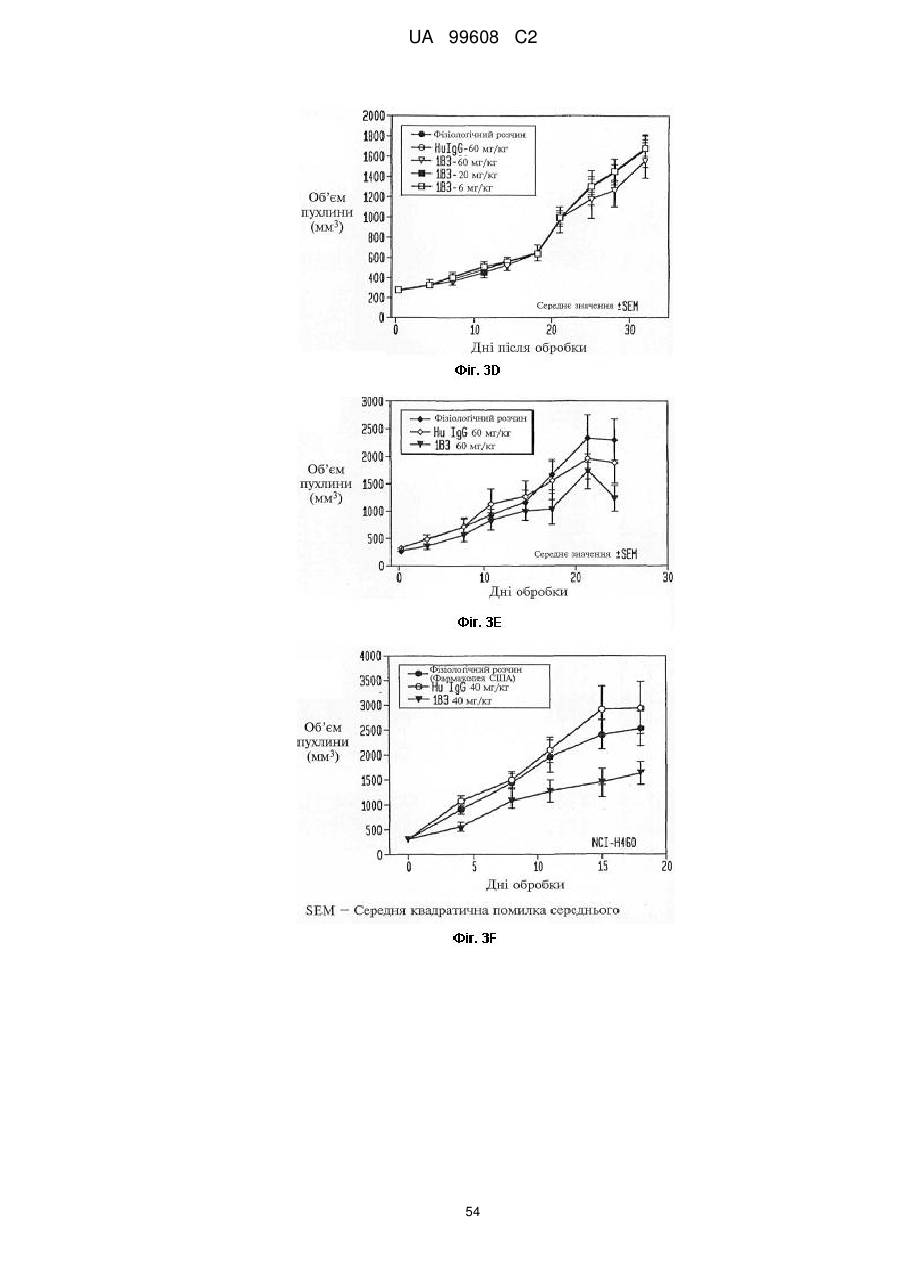
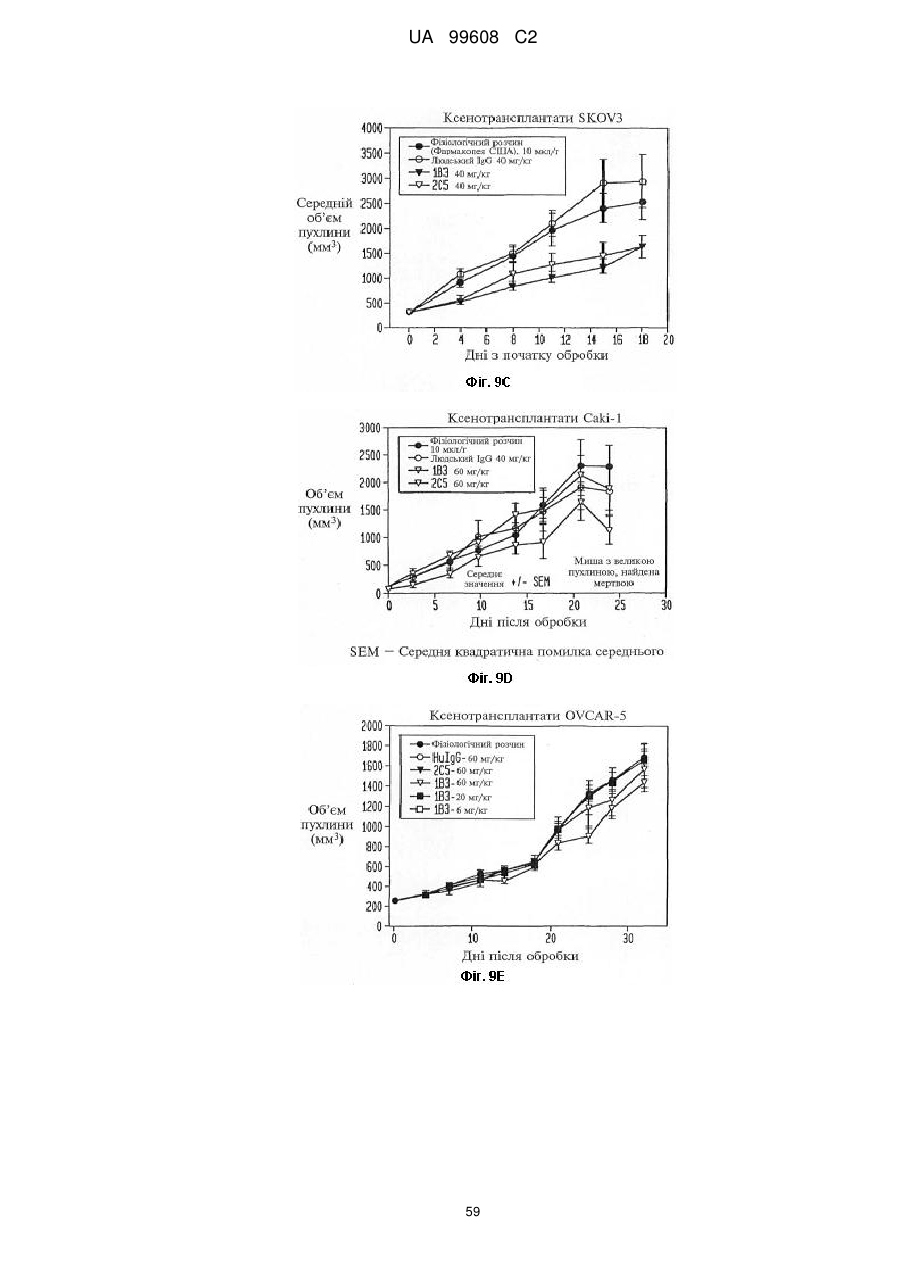
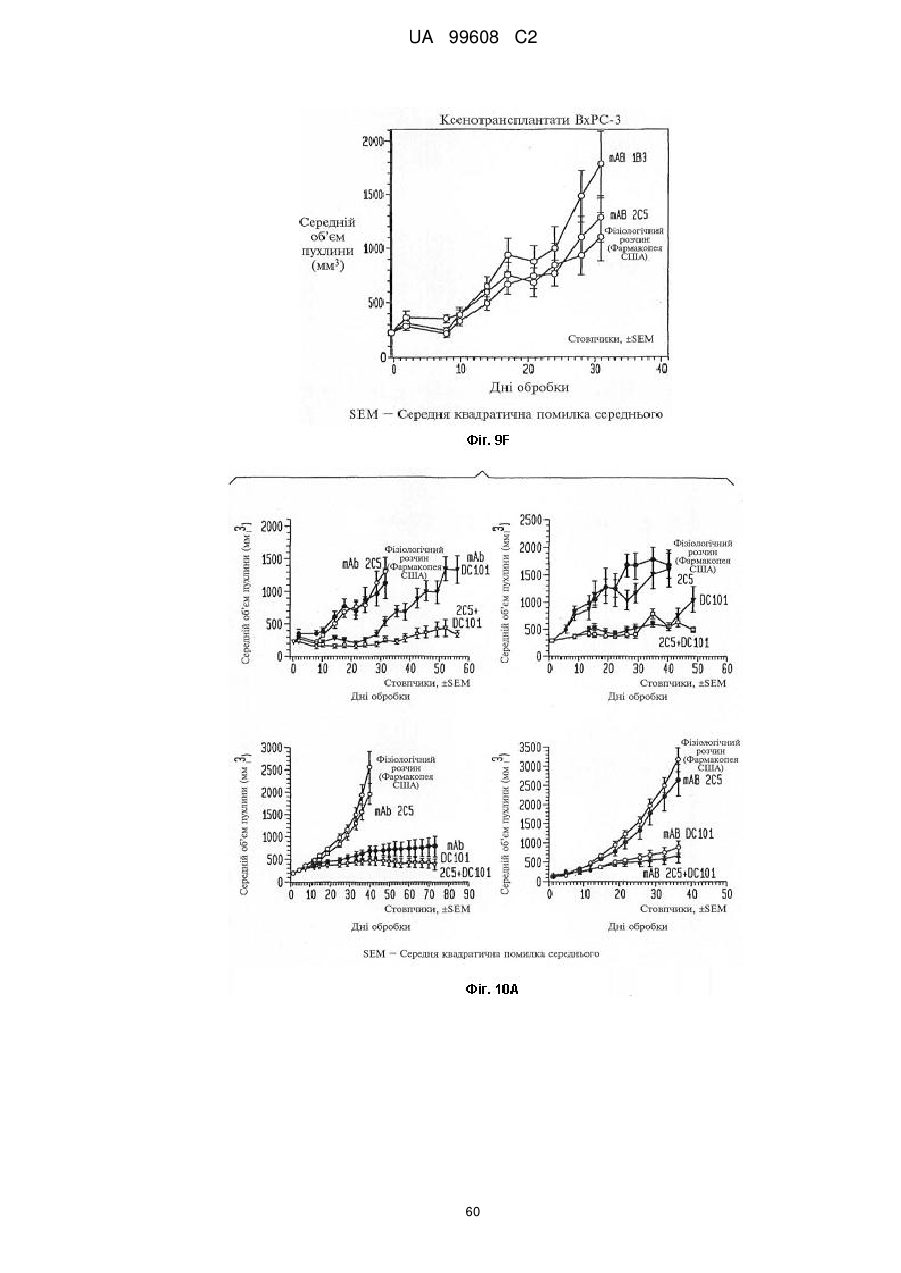
Назва патенту російськоюPdgfrb-специфические антитела
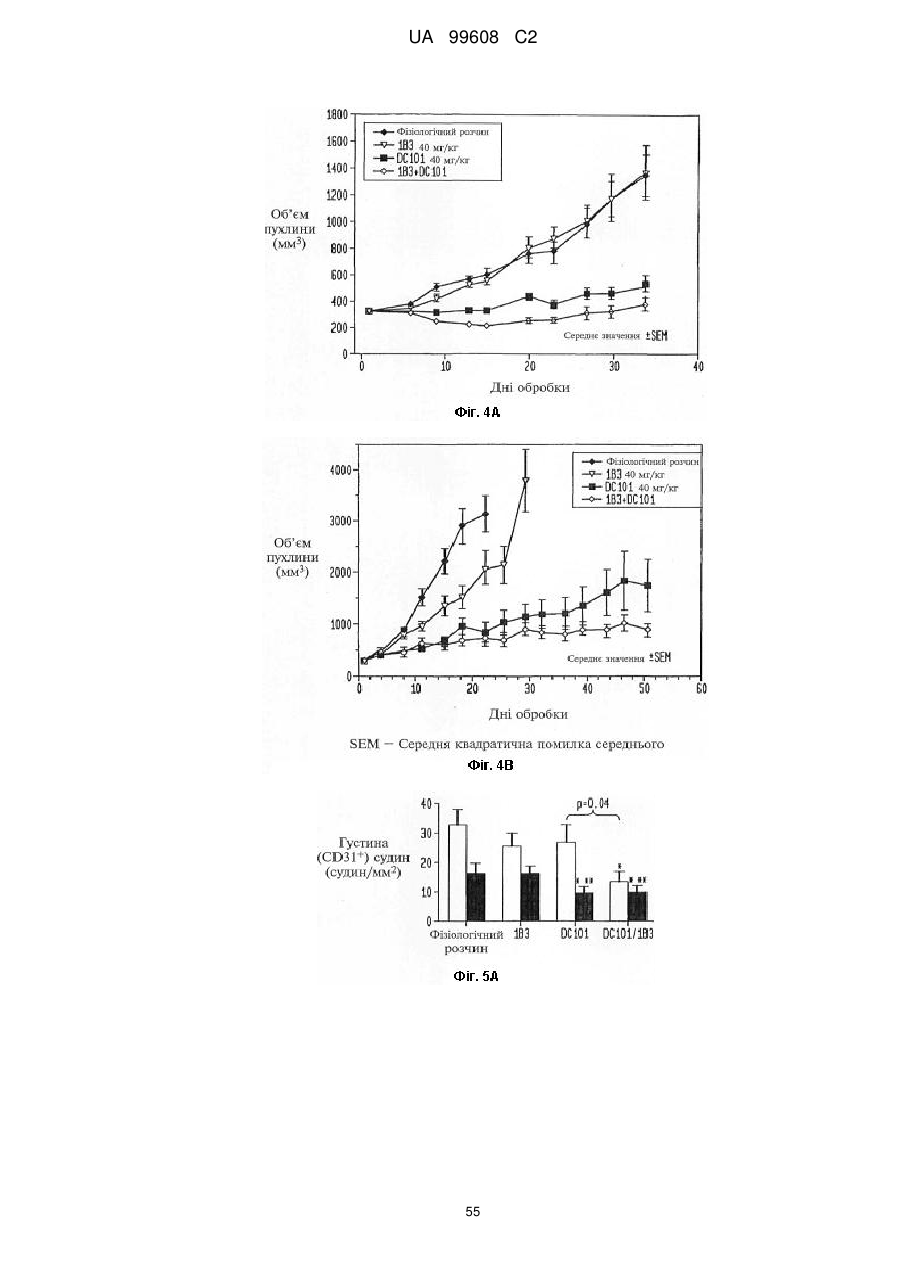
Автори російськоюЧжу Чженьпин, Шень Цзюйцюнь
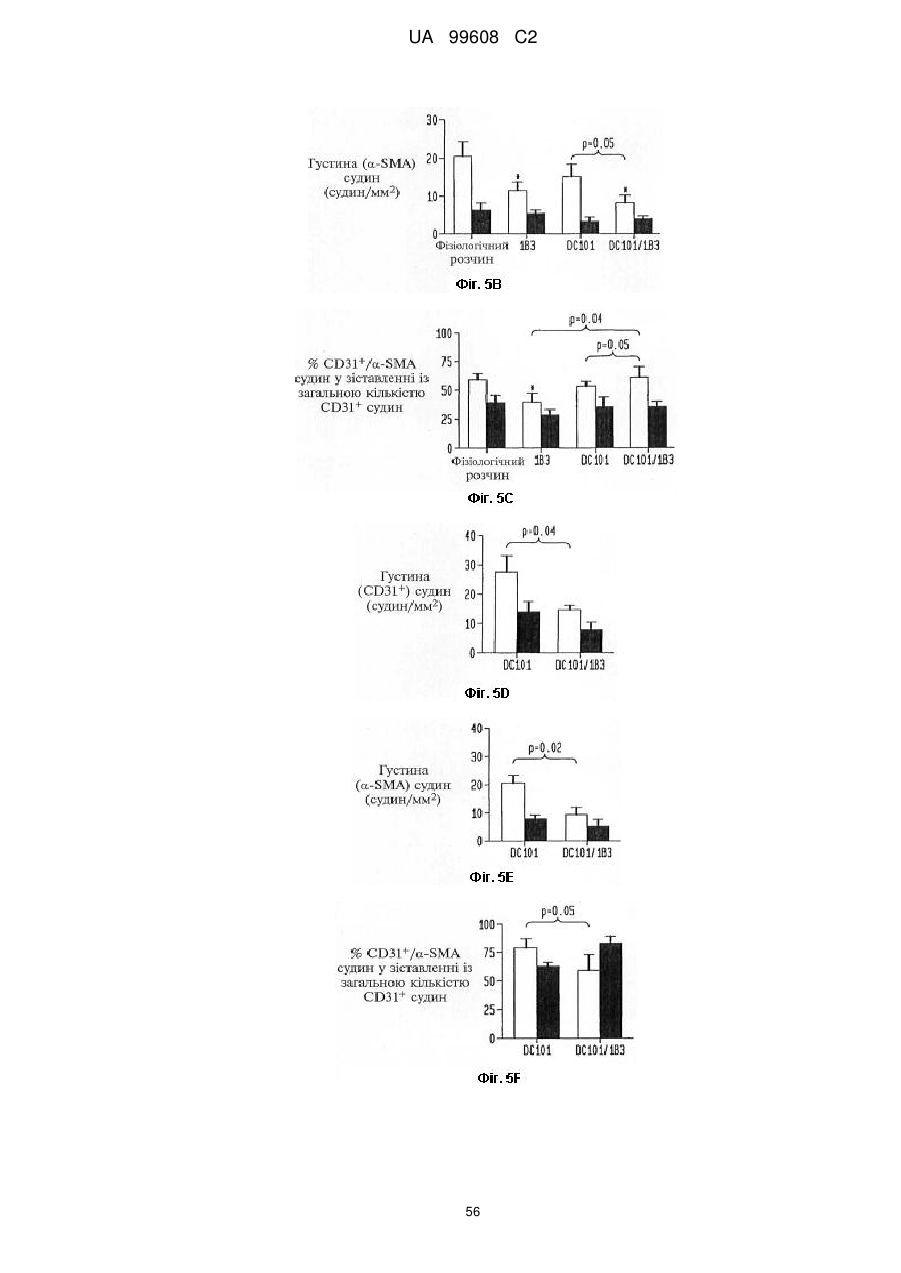
МПК / Мітки
МПК: C07K 16/28, A61P 35/00, C12N 15/13, A61K 39/395
Мітки: pdgfrb-специфічні, антитіла
Код посилання
<a href="https://ua.patents.su/68-99608-pdgfrb-specifichni-antitila.html" target="_blank" rel="follow" title="База патентів України">Pdgfrb-специфічні антитіла</a>
Попередній патент: Спосіб та інструмент для клінчингу товстих листових деталей, а також застосування інструмента
Наступний патент: Селективні модулятори андрогенового рецептора для лікування діабету
Випадковий патент: Лікарський засіб кардіологічної дії