Спосіб одержання циклічних сульфурвмісних амідів
Номер патенту: 100217
Опубліковано: 26.11.2012
Автори: Воловенко Юліан Михайлович, Воловненко Тетяна Анатоліївна, Тарасюк Тарас Миколайович
Формула / Реферат
1. Спосіб одержання циклічних сульфурвмісних амідів загальної формули І
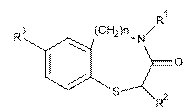 , І
, І
де R1 = Н, Me, Рr, СН2СН2ОМе, CH2Ph, CH2CH2Ph, 3-МеОС6Н4, 4-MeC6H4;
R2=Н, Me;
R3=NO2,
n=0, 1,
який відрізняється тим, що аміни загальної формули VII
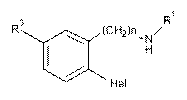 , VII
, VII
де Hal=F, Сl; R1, R3 і n наведені вище, ацилюють хлорангідридами загальної формули VIII 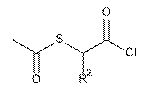 ,VIII
,VIII
де R2=Н, Me
в присутності триетиламіну з наступною обробкою реакційної маси основою - діалкіламінами.
2. Спосіб за п. 1, який відрізняється тим, що утворювані проміжні сполуки загальної формули IX
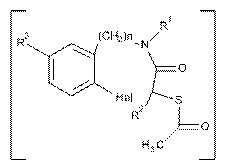 , IX
, IX
де замісники визначені вище,
не виділяються з реакційної маси.
3. Спосіб за п. 1, який відрізняється тим, що як органічний розчинник використовують N,N-диметилформамід.
4. Спосіб за п. 1, який відрізняється тим, що як основу використовують водний розчин диметиламіну.
5. Спосіб за п. 1, який відрізняється тим, що як основу використовують діетиламін.
Текст
Реферат: Даний винахід стосується галузі органічної хімії, зокрема хімії гетероциклічних сполук, а саме: способу одержання циклічних сульфурвмісних амідів загальної формули ,І 1 2 3 де R =Н, Me, Pr, CH2CH2OMe, CН2Ph, CH2CH2Ph, 3-MeOC6H4, 4-MeC6H4; R =Н, Me; R =NO2, n=0, 1, що можуть знайти застосування як фізіологічно активні речовини або проміжні продукти при їх синтезі. Спосіб одержання сульфурвмісних циклічних амідів загальної формули І, полягає в ацилуванні амінів загальної формули 1 3 , VII де Hal=F, Сl; R , R і n UA 100217 C2 (12) UA 100217 C2 наведені вище, ацилують хлорангідридами загальної формули , де 2 R =Н, Me, VIII в присутності триетиламіну з наступною обробкою реакційної маси диалкіламінами. Результатами винаходу є суттєве спрощення процесу одержання сульфурвмісних циклічних амідів, значне підвищення їх доступності та розширення асортименту одержаних сполук. UA 100217 C2 Даний винахід стосується галузі органічної хімії, зокрема хімії гетероциклічних сполук, а саме способу одержання циклічних сульфурвмісних амідів загальної формули І ,І 5 10 1 де R =Н, СН3, СН2СН3, СН2СН2ОСН3, СН2С6Н5, СН2СН2С6Н5, 3-МеОС6Н4, 4-МеС6Н4; 2 3 R =H, CН3; R =NO2; n=0, 1, що можуть знайти застосування як фізіологічно активні речовини або проміжні продукти при їх синтезі. Відомий спосіб одержання циклічних сульфурвмісних амідів II реакцією о-амінотіофенолу III та хлороангідриду хлорооцтової кислоти IV [1]. 1 2 3 4 R =R =Н; R =ОМе, OEt; R =Н n=0 Схема 1 15 Недоліком цього способу є необхідність працювати з о-амінотіофенолом, що є дуже сильним алергеном. Найбільш близьким за технічною суттю є спосіб одержання циклічних сульфурвмісних амідів II взаємодією похідних 2-меркаптобензиламіну гідрохлориду V та галогенозаміщених естерів VI в присутності основи [2]. 1 2 3 4 R =Н, Me; R =Н, Me, Ph, CO2Et; R =R =H, MeO; n=1. Схема 2 20 25 Недоліком даного способу є необхідність працювати з похідними меркаптобензиламіну, що є токсичними речовинами, а також обмежений перелік цільових сполук, обумовлений вузькою базою вихідних сполук. В основу винаходу поставлено задачу створити новий більш зручний спосіб одержання циклічних сульфурвмісних амідів, який забезпечить розширення асортименту бажаних сполук загальної формули і без суттєвих ускладнень процедури їх одержання. 1 UA 100217 C2 Поставлена задача, а саме одержання циклічних сульфурвмісних амідів загальної формули 1 , І де R =Н, Me, Pr, CH2CH2OMe, CH2Ph, CH2CH2Ph, 3-МеОС6Н4, 4МеС6Н4; R =Н, Me; R =NO2, n=0, 1, 2 5 3 вирішується ацилуванням амінів загальної формули Hal=F, Сl; 1 , VII де 3 R , R in наведені вище, хлорангідридами загальної формули , де R =Н, Me, VIII в присутності триетиламіну з наступною обробкою реакційної маси діалкіламінами (диметиламін водн., діетиламін) без виділення проміжних сполук 2 10 , IX замісники визначені вище. При обробці діалкіламінами відбувається зняття ацетильного захисту і циклізація внаслідок внутрішньомолекулярного нуклеофільного заміщення галогену SH-групою. Реакція відбувається в одному реакторі в N, Nдиметилформаміді без виділення проміжних сполук IX. Схема 3 2 UA 100217 C2 Переважні варіанти втілення винаходу згідно схеми 3 при наступних замісниках Хлорангідрид VII, № прикладу II Амін VII, 1 2 3 4 5 6 7 8 9 10 11 12 13 14 5 10 15 20 25 30 35 1 3 R =H, R =NO2, Hal=F, n=0 1 3 R =H, R =NO2, Hal=F, n=0 1 3 R =Me, R =NO2, Hal=Cl, n=1 1 3 R =Pr, R =NO2, Hal=Cl, n=1 1 3 R =CH2CH2OMe, R =NO2, Hal=Cl, n=1 1 3 R =CH2Ph, R =NO2, Hal=Cl, n=1 1 3 R =CH2CH2Ph, R =NO2, Hal=Cl, n=1 1 3 R =3-MeOC6H4, R =NO2, Hal=Cl, n=1 1 3 R =4-MeC6H4, R =NO2, Hal=Cl, n=1 1 3 R =Me, R =NO2, Hal=Cl, n=1 1 3 R =Pr, R =NO2, Hal=Cl, n=1 1 3 R =CH2CH2OMe, R =NO2, Hal=Cl, n=1 1 3 R =CH2Ph, R =NO2, Hal=Cl, n=1 1 3 R =CH2CH2Ph, R =NO2, Hal=Cl, n=1 2 R =H 2 R =H 2 R =H 2 R =H 2 R =H 2 R =H 2 R =H 2 R =H 2 R =H 2 R =Me 2 R =Me 2 R =Me 2 R =Me 2 R =Me Вихідні аміни синтезовано за описаною методикою [3]. Винахід може бути проілюстровано нижченаведеними прикладами. Загальний метод синтезу циклічних сульфурвмісних амідів І До розчину 0.005 моль аміну і 0.01 моль Еt3N в 5 мл сухого ДМФА додають 0.005 моль відповідного хлорангідриду. Витримують при температурі 50-60 °C протягом 5 годин. Додають 0.01 моль основи (диметиламін водн. або діетиламін). Витримують протягом 10-12 годин при температурі 50-60 °C, додають 25 мл води, відфільтровують осад, сушать. Кристалізують з відповідного розчинника. Приклад 1. 6-Нітро-2Н-1,4-бензотіазин-3(4Н)-он. C8H6N2О3S. Вихід 68 %. Т. плав. 245 °C (з ДМФА/Н2О). Знайдено, %: N 13.32; S 15.23. Розраховано, %: N 13.33, S 15.25. 1 ЯМР Н, δ, м. ч., (КССВ, J, Гц у ДМСО-D6): 3.51 с. (2Н, СН2), 7.51 д. (1Н, J=8.8 Гц, 8-Н), 7.77 д. (1Н, 7=8.8 Гц, 7-Н), 7.81 с. (1Н, 5-H), 10.94 с. (1Н, NH). Приклад 2. 2-Метил-6-нітро-2Н-1,4-бензотіазин-3(4Н)-он. C9H8N2O3S. Вихід 66 %. Т. плав. 225 °C (з ДМФА/Н2О). Знайдено, %: N 12.47; S 14.31. Розраховано, %: N 12.49, S 14.30. 1 ЯМР Н, δ, м.ч., (КССВ, J, Гц у ДМСО-D6): 1.40 д. (3Н, J=6.8 Гц, СН3), 3.67 кварт. (1Н, J=4.8 3 Гц, sp -CH), 7.50 д. (1Н, J=8.0 Гц, 8-Н), 7.77 д. (ПІ, J=8.8 Гц, 7-Н), 7.82 с. (1Н, 5-Н), 10.95 с. (1H, NH). Приклад 3. 4-Метил-7-нітро-4,5-дигідро-1,4-бензотіазеиін-3(2H)-он. C10H10N2O3S. Вихід 78 %. Т. плав. 195 °C (з о-ксилолу). Знайдено, %: N 11.73; S 13.44. Розраховано, %: N 11.76, S 13.46. 1 ЯМР Н, δ, м.ч., (КССВ, J, Гц у ДМСО-D6): 2.94 с (3Н, СН3), 4.08 с. (2Н, СН2), 4.76 с. (2Н, 1 2 СН2), 7.34 д. (1Н, J=8.8 Гц, 9-Н), 7.99 д.д. (1H, J =8.8 Гц, J =2.8 Гц, 8-Н), 8.20 с. (1H, 6-Н). Приклад 4. 7-Нітро-4-пропіл-4,5-дигідро-1,4-бензотіазепін-3(2H)-он. C12H14N2O3S. Вихід 74 %. Т. плав. 145 °C (з i-PrOН). Знайдено, %: N 10.54; S 12.06. Розраховано, %: N 10.52. S 12.04. 1 ЯМР Н, δ, м.ч., (КССВ, J, Гц у ДМСО-D6): 0.80 т. (3Н, J=7.6 Гц, СН2СН2СН3), 1.48 м. (2Н, СН2СН2СН3), 3.33 т. (2Н, J=6.8 Гц, СН2СН2СН3), 4.05 с. (2Н, СН2), 4.78 с (2H, СН2), 7.31 д. (1Н, J=8.8 Гц, 9-Н), 7.97 д.(1Н, J=8.8 Гц, 8-Н), 8.23 с (1Н, 6-Н). Приклад 5. 4-(2-Метоксиетил)-7-нітро-4,5-дигідро-1,4-бензотіазепін-3(2H)-он. C12H14N2O4S. Вихід 68 %. Т. плав. 110 °C (з бензолу). Знайдено, %: N 11.55; S 11.34. Розраховано, %: N 11.54, S 11.36. 3 UA 100217 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 ЯМР Н, δ, м.ч., (КССВ, J, Гц у ДМСO-D6): 3.16 с (3Н, ОСН3), 3.37 т. (2Н, J=5.4 Гц, СН2СН2), 3.55 т. (2Н, -СН2СН2, J=5.4 Гц), 4.08 с. (2Н, СН2), 4.82 с, (2Н, СН2), 7.32 д. (1Н, J=8.8 Гц, 9-Н), 1 2 7.97 д.д. (1Н, J =8.8 Гц, J =2.0 Гц, 8-Н), 8.14 д. (1Н, J=2.0 Гц, 6-Н). Приклад 6. 4-Бензил-7-нітро-4,5-дигідро-1,4-бензотіазепін-3(2H)-он. C16H14N2O3S. Вихід 79 %. Т. плав. 197 °C (з i-PrOH). Знайдено, %: N 8.93; S 10.18. Розраховано, %: N 8.91, S 10.20. 1 ЯМР Н, δ, м.ч., (КССВ, J, Гц у ДМСО-D6): 4.16 с. (2Н, СН2), 4.57 с. (2Н, СН2), 4.76 с. (2Н, СН2), 7.20 м. (5Н, CH2Ph), 7.29 д. (1H, J=8.8 Гц, 9-Н), 7.87 д. (1Н, J=2.4 Гц, 8-Н), 7.90 д. (1Н, J=2.4 Гц, 6-Н). Приклад 7. 7-Нітро-4-фенілетил-4,5-дигідро-1,4-бензотіазепін-3(2H)-он. C17H16N2O3S. Вихід 65 %. Т. плав. 142 °C (з ДМФА/Н2О). Знайдено, %: N 8.51; S 9.75. Розраховано, % N: 8.53, S 9.76. 1 ЯМР Н, δ, м.ч., (КССВ, J, Гц у ДМСО-D6): 2.75 т. (2Н, J=7.6 Гц, CH2CH2Ph), 3.61 т. (2Н, J=7.6 Гц, CH2CH2Ph), 4.04 с. (2Н, СН2), 4.77 с. (2Н, СН2), 7.12 м. (5Н, CH2CH2Ph), 7.26 д. (1Н, J=8,4 Гц, 9-Н), 7.93 д. (1Н, J=8.8 Гц, 8-Н), 8.08 с. (1Н, 6-Н). Приклад 8. 7-Нітро-4-(3-метоксифеніл)-4.5-дигідро-1,4-бензотіазепін-3(2H)-он. C16H14N2O4S. Вихід 65 %. Т. плав. 110 °C (з i-РrОН). Знайдено, %: N 8.46; S 9.69. Розраховано, %: N 8.48. S 9.71. 1 ЯМР Н, δ, м.ч., (КССВ, J, Гц у ДМСО-D6): 3.74 с (3Н, ОСН3), 4.26 с (2Н, СН2), 5.18 с. (2Н, СН2), 6.66 д. (1Н, J=5.2 Гц), 6.7 с. (1Н), 6.80 д. (1Н, J=8.0 Гц), 7.23 т. (1H, J=8.0 Гц), 7.41 д. (1H, J=8.8 Гц, 9-Н), 8.02 д. (1H, J=8.0 Гц, 8-Н), 8.09 с. (1Н, 6-Н). Приклад 9. 7-Нітро-4-(4-метилфеніл)-4.5-дигідро-1,4-бензотіазепін-3(2H)-он. C16H14N2O3S. Вихід 64 %. Т. плав. 184 °C (з ацетонітрилу). Знайдено, %: N 8.90; S 10.21. Розраховано, %: N 8.91, S 10.20. 1 ЯМР Н, δ, м.ч., (КССВ, J, Гц у ДМСО-D6): 2.32 с. (3Н, СН3), 4.25 с. (2Н, СН2), 5.14 с. (2Н, СН2), 6.97 д. (2Н, J=7.6 Гц), 7.13 д. (2Н, J=7.6 Гц), 7.40 д. (1H, J=8.0 Гц, 9-Н), 8.01 (2Н, 6-Н, 8-Н). Приклад 10. 2,4-Диметил-7-нітро-4.5-дигідро-1,4-бензотіазепін-3(2H)-он. С11H12N2O3S. Вихід 75 %. Т. плав. 197 °C (з ацетонітрилу). Знайдено, %: N 11.12; S 12.69. Розраховано, %: N 11.10, S 12.71. 1 ЯМР Н, δ, м.ч., (КССВ, J, Гц у ДМСО-D6): 1.32 д. (3Н, J=6.4 Гц, СН3), 2.95 с. (3Н, СН3), 4.20 3 д.(1H, J=16.4 Гц, СН2), 5.23 кварт. (1H, J=5.8 Гц. sp -CH), 5.35 д. (1Н, J=16.8 Гц, CH2), 7.28 д. (1Н, J=8.8 Гц, 9-Н), 7.98 д. (1Н, 8-Н, J=8.4 Гц, ), 8.21 с. (1Н, 6-Н). Приклад 11. 2-Метил-7-нітро-4-пропіл-4,5-дигідро-1,4-бензотіазепін-3(2H)-он. C13H16N2O3S. Вихід 74 %. Т. плав. 171 °C (з діоксану). Знайдено, %: N 10.01; S 11.43. Розраховано, %: N9.99, SI 1.44. ЯМР 'Н, δ, м.ч., (КССВ, J, Гц у ДМСО-D6): 0.80 т. (3Н, J=7.2 Гц, СН2СН2СН3), 1.32 д. (3Н, J=6.8 Гц, СН3), 1.47 м. (2Н, СН2СН2СН3), 3.32 секст. (1Н, СН2СН2СН3), 3.39 секст. (1H, 3 СН2СН2СНз), 4.28 д. (1Н, J=16.8 Гц, СН2), 5.22 кварт. (1Н, J=6.8 Гц, sp -CH), 5.33 д. (1Н, J=16.8 Гц, CH2), 7.27 д. (1Н, J=8.8 Гц, 9-Н), 7.97 д. (1Н, 8-Н, J=8.8 Гц), 8.25 с. (1Н, 6-Н). Приклад 12. 2-Метил-4-(2-метоксіетил)-7-нітро-4,5-дигідро-1,4-бензотіазепін-3(2H)-он. C13H16N2O4S. Вихід 68 %. Т. плав, 110° С (з толуолу). Знайдено, %: N 9.46; S 10.80. Розраховано, %: N9.45, S 10.82. 1 ЯМР Н, δ, м.ч., (КССВ, J, Гц у ДМСО-D6): 1.31 д. (3Н, J=6.4 Гц, СН3), 3.16 с. (3Н, ОСН3), 3.37 т. (2Н, J=5.4 Гц, СН2СН2), 3.55 т. (2Н, J=5.4 Гц, СН2СН2), 4.29 д. (1H, J=16.8 Гц, СН2), 5.23 3 кварт.(1Н, J=6.8 Гц, sp -CH), 5.35 д. (1H, J=16.4 Гц, СН2), 7.27 д. (1H, J=8.4 Гц, 9-Н), 7.95 д. (1Н, J=8.8 Гц, 8-Н), 8.16 с. (1Н, 6-Н). Приклад 13. 4-Бензил-2-метил-7-нітро-4,5-дигідро-1,4-бепзотіазепін-3(2H)-он. C17H16N2O3S. Вихід 68 %. Т. плав. 150 °C (з н-бутанолу). Знайдено, %: N 8.52; S 9.77. Розраховано, %: N 8.53, S 9.76. 1 ЯМР Н, δ, м.ч., (КССВ, J, Гц у ДМСО-D6): 1.38 д. (3Н, У=6.4 Гц, СН3), 4.19 д. (1Н, J=16.8 Гц, 3 СН2), 4.60 с. (2Н, CH2Ph), 5.31 кварт. (1Н, J=6.4 Гц, sp -CH), 5.37 д. (1Н, J=16.4 Гц, СН2), 7.15 м. (5Н, CH2Ph), 7.23 д. (1Н, 9-Н, J=8.8 Гц), 7.90 д. (1Н, 8-Н, J=2.4 Гц), 7.89 д. (1Н, 6-Н, J=1.2 Гц). Приклад 14. 2-Метил-7-нітро-4-фенілетил-4,5-дигідро-1,4-бензотіазепін-3(2H)-он. C18H18N2O3S. Вихід 63 %. Т. плав. 110 °C (з ДМФА/H2О). Знайдено, %: N 8.20; S 9.37. Розраховано, %: N8.18, S 9.36. 1 ЯМР Н, δ, м.ч., (КССВ, J, Гц у ДМСО-D6): 1.32 д. (3Н, J=6.4 Гц, СН3), 2.75 т. (2Н, J=7.6 Гц, CH2CH2Ph), 3.63 т. (2Н, J=7.6 Гц, CH2CH2Ph), 4.28 д. (1H, J=16.4 Гц, СН2), 5.19 кварт. (1Н, J=6.8 3 Гц, sp -CH), 5.30 д. (1Н, J=17.2 Гц, СН2), 7.12 м. (5Н, CH2CH2Ph), 7.24 д. (1H, J=8.4 Гц, 9-Н), 7.93 д. (1Н, J=8.8 Гц, 8-Н), 8.08 с. (1Н, 6-Н). Джерела інформації:: 4 UA 100217 C2 5 [1] J. Med. Chem. 30, 295-303 (1987). G.H. Jones, M.С. Venuti, R. Alvarez, J.J. Bruno, A.H. Berks, and A. Prince. [2] Chem. Ber. 119, 2904-2913 (1986). J. Szabo, L. Fodor, A. Katocs, G. Bernath, P. Sohar. [3] Журнал орг. та фарм. хімії 34, 60-64 (2011) Т.А. Воловненко, Т.М. Тарасюк, Ю.М. Воловенко. ФОРМУЛА ВИНАХОДУ 1. Спосіб одержання циклічних сульфурвмісних амідів загальної формули І 10 15 ,І 1 де R =Н, Me, Рr, СН2СН2ОМе, CH2Ph, CH2CH2Ph, 3-МеОС6Н4, 4-MeC6H4; 2 R =Н, Me; 3 R =NO2, n=0, 1, який відрізняється тим, що аміни загальної формули VII , VII 1 3 де Hal=F, Сl; R , R і n наведені вище, ацилюють хлорангідридами загальної формули VIII 20 25 30 ,VIII 2 де R =Н, Me в присутності триетиламіну з наступною обробкою реакційної маси основою - діалкіламінами. 2. Спосіб за п. 1, який відрізняється тим, що утворювані проміжні сполуки загальної формули IX , IX де замісники визначені вище, не виділяються з реакційної маси. 3. Спосіб за п. 1, який відрізняється тим, що як органічний розчинник використовують N,Nдиметилформамід. 4. Спосіб за п. 1, який відрізняється тим, що як основу використовують водний розчин диметиламіну. 5. Спосіб за п. 1, який відрізняється тим, що як основу використовують діетиламін. Комп’ютерна верстка Л. Ціхановська Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 5
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of cyclic sulfur-containing amides
Автори англійськоюVolovnenko Tetiana Anatoliivna, Tarasiuk Taras Mykolaiovych, Volovenko Yulian Mykhailovych
Назва патенту російськоюСпособ получения циклических сульфурсодержащих амидов
Автори російськоюВоловненко Татьяна Анатолиевна, Тарасюк Тарас Николаевич, Воловенко Юлиан Михайлович
МПК / Мітки
МПК: C07D 281/00
Мітки: циклічних, спосіб, амідів, одержання, сульфурвмісних
Код посилання
<a href="https://ua.patents.su/7-100217-sposib-oderzhannya-ciklichnikh-sulfurvmisnikh-amidiv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання циклічних сульфурвмісних амідів</a>
Попередній патент: Штучна кисть протеза верхньої кінцівки
Наступний патент: Трансмісія повнопривідної амфібії
Випадковий патент: Тест-система на основі мікрометоду реакції нейтралізації для діагностики ринопневмонії коней











