Спосіб одержання амідів (варіанти), проміжні сполуки, їх застосування та спосіб одержання
Номер патенту: 96425
Опубліковано: 10.11.2011
Автори: Боннет Пол, Джордж Нейл, Жіордано Фанні, Шах Шаілеш С., Тоблер Ханс, Корсі Камілла, Вальтер Харальд, Джоунз Ян, Еренфройнд Йозеф, Зайферт Готтфрід, Целлєр Мартін
Формула / Реферат
1. Спосіб одержання сполуки формули І
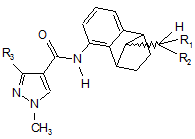 , (I)
, (I)
де R1 і R2 кожний незалежно один від одного означають водень або С1-С5-алкіл, і R3 означає CF3 або CF2H, що включає в себе:
а) взаємодію сполуки формули II
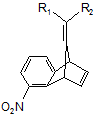 , (II)
, (II)
де R1 і R2 мають значення, які визначені для формули І, щонайменше з одним відновником з утворенням сполуки формули III
 , (III)
, (III)
де R1 і R2 мають значення, які визначені для формули І; і
(b) взаємодію одержаної сполуки щонайменше з одним відновником з утворенням сполуки формули IV, причому відновником, що використовують на стадії (b), є водень у присутності родієвого каталізатора;
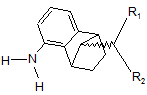 , (IV)
, (IV)
де R1 і R2 мають значення, які визначені для формули І; і
співвідношення сполуки формули IVa (син)
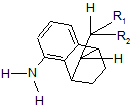 , (IVa, син)
, (IVa, син)
де R1 і R2 мають значення, які визначені для формули І; до сполуки формули IVb (анти)
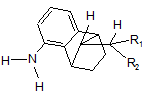 , (IVa, анти)
, (IVa, анти)
де R1 і R2 мають значення, які визначені для формули І, становить більше ніж 90:10; і
(с) перетворення одержаної сполуки в сполуку формули І у результаті взаємодії зі сполукою формули V
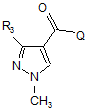 , (V)
, (V)
де Q означає хлор, фтор, бром, йод, гідроксигрупу або С1-С6-алкоксигрупу, і R3 має значення, визначене для формули І.
2. Спосіб за п. 1, в якому в сполуці формули І R1 і R2 означають метил, і R3 означає CF2H.
3. Спосіб за п. 1, в якому на технологічній стадії с) сполуку формули IV піддають взаємодії зі сполукою формули V, де Q означає хлор, фтор або бром, і R3 має значення, визначене для формули І.
4. Спосіб за п. 1, в якому на технологічній стадії с) сполуку формули IV піддають взаємодії зі сполукою формули V, де Q означає хлор, бром, йод або гідроксигрупу, і R3 має значення, визначене для формули І.
5. Спосіб за п. 4, в якому на технологічній стадії а) використовують один відновник.
6. Спосіб за п. 4, в якому сполуку формули III, одержану на технологічній стадії а), піддають взаємодії з утворенням сполуки формули IV безпосередньо без виділення проміжного продукту.
7. Спосіб за п. 4, в якому на технологічній стадії с) сполуку формули IV піддають взаємодії зі сполукою формули V, де Q означає гідроксигрупу, і R3 має значення, визначене для формули І.
8. Спосіб за п. 4, в якому в сполуці формули І R1 і R2 означають метил, і R3 означає CF2H.
9. Спосіб за п. 4, в якому на технологічній стадії b) як відновник використовують водень у присутності родієвого каталізатора, і сполуку формули III
 , (III)
, (III)
де R1 і R2 мають значення, які визначені для формули І, піддають взаємодії з утворенням сполуки формули IV
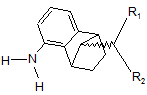 , (IV)
, (IV)
де R1 і R2 мають значення, які визначені для формули І, і де відношення сполуки формули IVa (син)
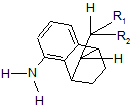 , (IVa, син)
, (IVa, син)
де R1 і R2 мають значення, які визначені для формули І, до сполуки формули IVb (анти)
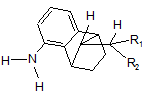 , (IVa, анти)
, (IVa, анти)
де R1 і R2 мають значення, які визначені для формули І, становить більше 90:10.
10. Сполука формули IV
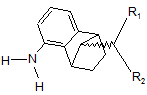 , (IV)
, (IV)
де R1 і R2 мають значення, які визначені для формули І у п. 1, і де відношення сполуки формули IVa (син)
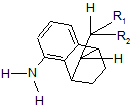 , (IVa, син)
, (IVa, син)
де R1 і R2 мають значення, які визначені для формули І за п. 1, до сполуки формули IVb (анти)
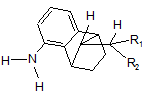 , (IVa, анти)
, (IVa, анти)
де R1 і R2 мають значення, які визначені для формули І у п. 1, становить від 90:10 до 99:1.
11. Застосування сполуки формули IV для одержання сполуки формули І за п. 1
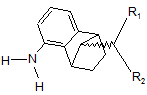 , (IV)
, (IV)
де R1 і R2 мають значення, які визначені для формули І у п. 1, і де відношення сполуки формули IVa (син)
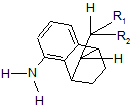 , (IVa, син)
, (IVa, син)
де R1 і R2 мають значення, які визначені для формули І у п. 1, до сполуки формули IVb (анти)
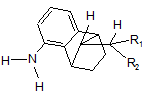 , (IVa, анти)
, (IVa, анти)
де R1 і R2 мають значення, які визначені для формули І у п. 1, становить від 90:10 до 99:1.
12. Спосіб одержання сполуки формули IV
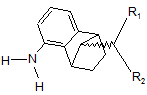 , (IV)
, (IV)
де R1 і R2 кожний незалежно означають водень або С1-С5-алкіл, що включає в себе:
а) взаємодію сполуки формули II
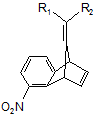 , (II)
, (II)
де R1 і R2 мають значення, які визначені для формули IV, щонайменше з одним відновником з утворенням сполуки формули III
 , (III)
, (III)
де R1 і R2 мають значення, які визначені для формули IV; і (b) перетворення одержаної сполуки з використанням щонайменше одного відновника на сполуку формули IV, причому відновником, що використовують на стадії (b), є водень у присутності родієвого каталізатора.
13. Спосіб за п. 1 одержання сполуки формули І
 , (I)
, (I)
де R1 і R2 кожний незалежно означають водень або С1-С5-алкіл, і R3 означає CF3 або CF2H, що включає в себе перед стадією а) за п. 1:
аа) взаємодію 6-нітроантранілової кислоти з нітритом, вибраним з ізоамілнітриту та трет-бутилнітриту, і зі сполукою формули С
 , (C)
, (C)
де R1 і R2 мають значення, які визначені для формули І, з утворенням сполуки формули II
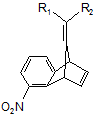 , (II)
, (II)
де R1 і R2 мають значення, які визначені для формули І.
14. Сполука формули II
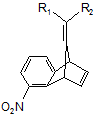 , (II)
, (II)
де R1 і R2 кожний незалежно означають водень або С1-С5-алкіл.
15. Сполука формули IIА
 , (IIA)
, (IIA)
де R1 і R2 кожний незалежно означають водень або С1-С5-алкіл.
16. Спосіб одержання сполуки формули І
 , (I)
, (I)
де R1 і R2 кожний незалежно означають водень або С1-С5-алкіл, і R3 означає CF3 або CF2H, що включає в себе:
а) взаємодію сполуки формули II
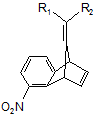 , (II)
, (II)
де R1 і R2 мають значення, які визначені для формули І, з відновником з утворенням сполуки формули III
 , (III)
, (III)
де R1 і R2 мають значення, які визначені для формули І; і
b) взаємодію одержаної сполуки з відновником з утворенням сполуки формули IV, причому відновником, що використовують на стадії (b), є водень у присутності родієвого каталізатора;
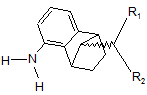 , (IV)
, (IV)
де R1 і R2 мають значення, які визначені для формули І; і
d) взаємодію сполуки формули Va
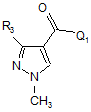 , (Va)
, (Va)
де Q1 означає хлор, фтор, бром, йод або С1-С6-алкоксигрупу, і R3 має значення, визначене для формули І, зі сполукою формули VII
HO-L-OH , (VII)
де L має значення, визначене для формули VI, з утворенням сполуки формули VI
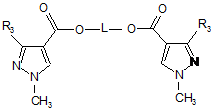 , (VI)
, (VI)
де L означає ланцюг С1-С6-алкілену, і R3 має значення, визначене для формули I; і
e) перетворення сполуки формули VI на сполуку формули І у результаті взаємодії зі сполукою формули IV.
Текст
1. Спосіб одержання сполуки формули І 3 H 96425 4 R1 R1 R2 R2 H N H H , (IVa, син) де R1 і R2 мають значення, які визначені для формули І; до сполуки формули IVb (анти) H H2N , (III) де R1 і R2 мають значення, які визначені для формули І, піддають взаємодії з утворенням сполуки формули IV R1 H R1 N H R2 H H , (IVa, анти) де R1 і R2 мають значення, які визначені для формули І, становить більше ніж 90:10; і (с) перетворення одержаної сполуки в сполуку формули І у результаті взаємодії зі сполукою формули V O R3 N Q , (V) де Q означає хлор, фтор, бром, йод, гідроксигрупу або С1-С6-алкоксигрупу, і R3 має значення, визначене для формули І. 2. Спосіб за п. 1, в якому в сполуці формули І R1 і R2 означають метил, і R3 означає CF2H. 3. Спосіб за п. 1, в якому на технологічній стадії с) сполуку формули IV піддають взаємодії зі сполукою формули V, де Q означає хлор, фтор або бром, і R3 має значення, визначене для формули І. 4. Спосіб за п. 1, в якому на технологічній стадії с) сполуку формули IV піддають взаємодії зі сполукою формули V, де Q означає хлор, бром, йод або гідроксигрупу, і R3 має значення, визначене для формули І. 5. Спосіб за п. 4, в якому на технологічній стадії а) використовують один відновник. 6. Спосіб за п. 4, в якому сполуку формули III, одержану на технологічній стадії а), піддають взаємодії з утворенням сполуки формули IV безпосередньо без виділення проміжного продукту. 7. Спосіб за п. 4, в якому на технологічній стадії с) сполуку формули IV піддають взаємодії зі сполукою формули V, де Q означає гідроксигрупу, і R3 має значення, визначене для формули І. 8. Спосіб за п. 4, в якому в сполуці формули І R1 і R2 означають метил, і R3 означає CF2H. 9. Спосіб за п. 4, в якому на технологічній стадії b) як відновник використовують водень у присутності родієвого каталізатора, і сполуку формули III R2 H , (IV) де R1 і R2 мають значення, які визначені для формули І, і де відношення сполуки формули IVa (син) H R1 R2 H H N H N CH3 N , (IVa, син) де R1 і R2 мають значення, які визначені для формули І, до сполуки формули IVb (анти) H H R1 H N R2 H , (IVa, анти) де R1 і R2 мають значення, які визначені для формули І, становить більше 90:10. 10. Сполука формули IV R1 H N R2 H , (IV) де R1 і R2 мають значення, які визначені для формули І у п. 1, і де відношення сполуки формули IVa (син) H R1 R2 H H N H , (IVa, син) де R1 і R2 мають значення, які визначені для формули І за п. 1, до сполуки формули IVb (анти) 5 H 96425 6 R1 R2 H R1 H N R2 H , (IVa, анти) де R1 і R2 мають значення, які визначені для формули І у п. 1, становить від 90:10 до 99:1. 11. Застосування сполуки формули IV для одержання сполуки формули І за п. 1 R1 H N H2N , (III) де R1 і R2 мають значення, які визначені для формули IV; і (b) перетворення одержаної сполуки з використанням щонайменше одного відновника на сполуку формули IV, причому відновником, що використовують на стадії (b), є водень у присутності родієвого каталізатора. 13. Спосіб за п. 1 одержання сполуки формули І R2 H , (IV) де R1 і R2 мають значення, які визначені для формули І у п. 1, і де відношення сполуки формули IVa (син) H R1 O R3 N R2 N H , (IVa, син) де R1 і R2 мають значення, які визначені для формули І у п. 1, до сполуки формули IVb (анти) H H N CH3 H H N H R1 R2 H , (I) де R1 і R2 кожний незалежно означають водень або С1-С5-алкіл, і R3 означає CF3 або CF2H, що включає в себе перед стадією а) за п. 1: аа) взаємодію 6-нітроантранілової кислоти з нітритом, вибраним з ізоамілнітриту та третбутилнітриту, і зі сполукою формули С R1 R1 H N R2 H , (IVa, анти) де R1 і R2 мають значення, які визначені для формули І у п. 1, становить від 90:10 до 99:1. 12. Спосіб одержання сполуки формули IV R2 , (C) де R1 і R2 мають значення, які визначені для формули І, з утворенням сполуки формули II R1 R2 R1 H N H R2 , (IV) де R1 і R2 кожний незалежно означають водень або С1-С5-алкіл, що включає в себе: а) взаємодію сполуки формули II R1 R2 O2N , (II) де R1 і R2 мають значення, які визначені для формули І. 14. Сполука формули II R1 R2 O2N O2N , (II) де R1 і R2 мають значення, які визначені для формули IV, щонайменше з одним відновником з утворенням сполуки формули III , (II) де R1 і R2 кожний незалежно означають водень або С1-С5-алкіл. 15. Сполука формули IIА 7 R1 96425 8 де R1 і R2 мають значення, які визначені для формули І; і b) взаємодію одержаної сполуки з відновником з утворенням сполуки формули IV, причому відновником, що використовують на стадії (b), є водень у присутності родієвого каталізатора; R2 R1 H2N , (IIA) де R1 і R2 кожний незалежно означають водень або С1-С5-алкіл. 16. Спосіб одержання сполуки формули І N H R2 H H R1 R2 O R3 N N H , (IV) де R1 і R2 мають значення, які визначені для формули І; і d) взаємодію сполуки формули Va O R3 Q1 N CH3 , (I) де R1 і R2 кожний незалежно означають водень або С1-С5-алкіл, і R3 означає CF3 або CF2H, що включає в себе: а) взаємодію сполуки формули II R1 R2 N N CH3, (Va) де Q1 означає хлор, фтор, бром, йод або С1-С6алкоксигрупу, і R3 має значення, визначене для формули І, зі сполукою формули VII HO-L-OH , (VII) де L має значення, визначене для формули VI, з утворенням сполуки формули VI O O R3 R3 L O O O2N , (II) де R1 і R2 мають значення, які визначені для формули І, з відновником з утворенням сполуки формули III R1 R2 H2N N N N N CH3 CH3 , (VI) де L означає ланцюг С1-С6-алкілену, і R3 має значення, визначене для формули I; і e) перетворення сполуки формули VI на сполуку формули І у результаті взаємодії зі сполукою формули IV. , (III) Даний винахід стосується способу одержання бензонорборнен-5-іламідів піразоліл-4-карбонових кислот, а також нових проміжних продуктів для застосування в такому способі. Даний винахід крім того стосується нової кристалічної модифікації (9ізопропіл-1,2,3,4-тетрагідро-1,4-метанонафтален5-іл)аміду син-3-дифторметил-1-метил-1Н-піразол4-карбонової кислоти, композицій, що містять таку модифікацію, і їх застосування для боротьби із зараженням культурних рослин грибами. Бензонорборнен-5-іламіди піразоліл-4карбонових кислот, наприклад (9-ізопропіл-1,2,3,4тетрагідро-1,4-метанонафтален-5-іл)амід 3дифторметил-1-метил-1Н-піразол-4-карбонової кислоти, є корисними фунгіцидами, які описані, наприклад, в WO 04/035589. В WO 04/035589 описаний спосіб одержання бензонорборнен-5-іламідів піразоліл-4-карбонової кислоти (дивися схему 1): 9 Згідно з WO 04/035589 3-нітродегідробензол, утворений, наприклад, з 6-нітроантралінових кис2 3 лот формули (А), де R і R можуть являти собою, у числі іншого, водень, спочатку піддають взаємодії за реакцією Дільса-Альдера із циклічним 1,44 5 6 7 дієном формули (В), де R , R , R і R можуть означати, у числі іншого, водень, і Υ може означати, серед іншого, -СН((і)-С3Н7)-, з утворенням сполуки 5-нітробензонорборнадієну формули (С). Наступне каталітичне відновлення в стандартних умовах (наприклад, Ra/Ni або Pd/C) у розчиннику (наприклад, метанолі) відновлює як нітрогрупу, так і ендоциклічний подвійний зв'язок в 2,3-положенні та дає 5-амінобензонорборнен формули (D). 5амінобензонорборнен формули (D) потім може бути підданий взаємодії з похідним кислоти формули (Е), де Het, серед іншого, може означати заміщений цикл піразолу, і Q означає хлор, фтор, бром або гідроксигрупу, у розчиннику (наприклад, дихлорметані) з утворенням бензонорборнен-5іламіду піразоліл-4-карбонової кислоти формули (F). Взаємодія зі сполуками формули (Е), де Q означає хлор, фтор або бром, має місце, наприклад, у присутності основи (наприклад, триетиламіну). Сполуки формули (F) також можуть бути отримані в результаті взаємодії 5амінобензонорборнену формули (D) з похідним кислоти формули (Е), де Het має значення, визначене вище, і Q означає гідроксигрупу, у присутності активуючого агента (наприклад, хлорангідриду біс(2-оксо-3-оксазолідиніл)фосфінової кислоти) у присутності 2 еквівалентів основи. У випадку такого способу синтезу при одержанні 9-монозаміщених бензонорборнен-5-іламідів піразоліл-4-карбонових кислот утворюється множина регіоізомерів. Наприклад, при одержанні бензонорборнен-5-іламіду піразоліл-4-карбонової 4 5 6 7 кислоти формули (F), де R , R , R і R означають водень, і Υ означає -СН((і)-С3Н7)-, наступні п'ять регіоізомерів утворюються на стадії реакції ДільсаАльдера, в якій утворюється сполука 5нітробензонорбонадієн формули (С): 96425 10 В описаному способі одержання 9монозаміщений регіоізомер (ІА) одержують тільки з невеликим виходом. Поділ регіоізомерів і/або поділ стереоізомерних форм можна здійснити на стадії з'єднання нітробензонорборнадієну формули (С), 5амінобензонорборненів формули (D) або бензонорборнен-5-іламідів піразоліл-4-карбонових кислот формули (F), і звичайний поділ здійснюють із використанням стандартних способів, таких як, наприклад, фракційна кристалізація, фракційна перегонка, або з використанням хроматографічних способів. Через низький вихід 9-заміщеного регіоізомеру такий спосіб реакції не підходить для одержання, особливо у великому масштабі, 9-заміщених бензонорборнен-5-іламідів піразоліл-4-карбонових кислот формули (F). Тому метою даного винаходу є спосіб одержання 9-монозаміщених бензонорборнен-5іламідів піразоліл-4-карбонових кислот, що уможливлює одержання таких сполук економічно вигідним чином з високими виходами й гарною якістю. Відповідно даний винахід стосується способу одержання сполук формули І 11 де R1 і R2 кожний незалежно один від одного означають водень або С1-С5-алкіл, і R3 означає CF3 або CF2H, що включає в себе: а) взаємодію сполуки формули II 96425 12 сигрупу, а також розгалужені ізомери пентилокси- і гексилоксигрупи. 9-монозаміщені бензонорборнени піразоліл-4карбонових кислот формули І є хіральними молекулами й можуть зустрічатися в різних стереоізомерних формах. Вони показані у вигляді енантіомерів формул II, ІII, ІIII і ІIV: де R1 і R2 мають значення, які визначені для формули І щонайменше з одним відновлювачем з утворенням сполуки формули III де R1 і R2 мають значення, які визначені для формули І; і (b) взаємодію вказаної сполуки щонайменше з одним відновлювачем з утворенням сполуки формули IV де R1 і R2 мають значення, які визначені для формули І; і (с) перетворення отриманої сполуки в сполуку формули І у результаті взаємодії зі сполукою формули V де Q означає хлор, фтор, бром, йод, гідроксигрупу або С1-С6-алкоксигрупу, і R3 має значення, визначене для формули І. Алкільні групи у визначеннях замісників можуть мати нерозгалужений або розгалужений ланцюг і являють собою, наприклад, метил (СН3), етил (С2Н5), н-пропіл (Н-С3Н7), ізопропіл (i-С3Н7), Н-бутил (Н-С4Н9), втор-бутил (втор-С4Н9), ізобутил (i-С4Н9), трет-бутил (трeт-С4Н9) і пентил, а також їхні розгалужені ізомери. Алкоксигрупи у визначеннях замісників можуть мати нерозгалужений або розгалужений ланцюг і являють собою, наприклад, метокси-, етокси-, нпропокси-, ізопропокси-, н-бутокси-, втор-бутокси-, ізобутокси-, трет-бутокси-, пентилокси- і гексилок де R1, R2 і R3 мають значення, які визначені для формули І. Спосіб відповідно до винаходу включає одержання таких стереоізомерних форм формул II, ІII, ІIII і ІIV і одержання сумішей таких стереоізомерних форм у будь-якому співвідношенні. У контексті даного винаходу розуміють, що сполуки формули Іа (син) де R1, R2 і R3 мають значення, які визначені для формули І, є сполуками формули ІI, сполуками формули ІII; або сумішшю сполук формули ІI і сполук формули ІII у будь-якому співвідношенні. У контексті даного винаходу розуміють, що сполуки формули Іа (син) переважно являють собою рацемічну суміш сполук формули ІI і сполук формули ІII. У контексті даного винаходу розуміють, що сполуки формули Іb (анти) 13 де R1, R2 і R3 мають значення, які визначені для формули І, являють собою сполуки формули ІIII; сполуки формули IIV; або суміш сполук формули ІIII і сполук формули IIV у будь-якому співвідношенні. У контексті даного винаходу розуміється, що сполуки формули Іb (анти) переважно являють собою рацемічну суміш сполук формули ІIII і сполук формули ΙIV. Сполуки формули IV можуть зустрічатися в різних стереоізомерних формах, які представлені формулами IVI, IVII, IVIII і IVIV: де R1 і R2 мають значення, які визначені для формули І. Спосіб відповідно до винаходу включає одержання таких стереоізомерних форм формул IVI, IVII, IVIII і IVIV і одержання сумішей таких стереоізомерних форм у будь-якому співвідношенні. У контексті даного винаходу розуміють, що сполуки формули IVa (син) де R1 і R2 мають значення, які визначені для формули І, є сполуками формули IVI; сполуками формули ІVII; або сумішшю сполук формули IVI і сполук формули IVII у будь-якому співвідношенні. У контексті даного винаходу розуміють, що сполуки формули IVa (син) переважно являють собою рацемічну суміш сполук формули IVI і сполук формули IVII. У контексті даного винаходу розуміють, що сполуки формули IVb (анти) 96425 14 де R1 і R2 мають значення, які визначені для формули І, є сполуками формули IVIII; сполуками формули IVIV; або сумішшю сполук формули ІVIII і сполук формули IVIV у будь-якому співвідношенні. У контексті даного винаходу розуміють, що сполуки формули IVb (анти) переважно являють собою рацемічну суміш сполук формули IVIII і сполук формули IVIV. У контексті даного винаходу розуміють, що «рацемічна суміш» двох енантіомерів являє собою суміш двох енантіомерів в основному у співвідношенні, рівному 1:1. Спосіб відповідно до винаходу особливо підходить для одержання сполук формули І, в яких R1 і R2 означають метил. Спосіб відповідно до винаходу ще більше підходить для одержання сполук формули І, в яких R1 і R2 означають метил, і R3 означає CF2H. У способі відповідно до винаходу перевага віддається застосуванню сполук формули II, в яких R1 і R2 означають метил. У способі відповідно до винаходу перевага віддається застосуванню сполук формули III, в яких R1 і R2 означають метил. У способі відповідно до винаходу перевага віддається застосуванню сполук формули IV, в яких R1 і R2 означають метил. Технологічна стадія а): в одному варіанті даного винаходу на технологічній стадії а) використовують один відновлювач. Придатним відновлювачем для технологічної стадії а) є, наприклад, водень у присутності металевого каталізатора. Придатні кількості відновлювачі для застосування на технологічній стадії а) у даному варіанті винаходу становлять, наприклад, до 4 еквівалентів, переважно 4 еквіваленти для даної реакції. Технологічну стадію а) переважно здійснюють у закритій посудині. В одному варіанті способу відповідно до винаходу, в якому технологічну стадію а) здійснюють у закритій посудині, надлишок водню, наприклад, вводять у реакційну суміш, в якій уже є присутнім металевий каталізатор. Потім вимірюють витрату водню в ході реакції. У даному варіанті здійснення способу відповідно до винаходу реакцію переважно зупиняють, коли витрачено необхідну кількість водню. Придатними металевими каталізаторами є, наприклад, платинові каталізатори, такі як, наприклад, каталізатори платина/вугілля або РtO2; паладієві каталізатори, такі як, наприклад, Pd/C; каталізатори на основі родію, такі як, наприклад, Rh/C, Rh/Al2O3 або Rh2O3; нікелеві каталізатори, такі як, наприклад, нікель Ренея; або каталізатори на основі іридію, такі як, наприклад, Ir(COD)Py(Pcy); і їх суміші. Переважні платинові каталізатори, паладієві каталізатори, родієві каталізатори або нікелеві каталізатори; особливо пе 15 реважні паладієві каталізатори, родієві каталізатори або нікелеві каталізатори; і найбільш переважні Pd/C, Rh/C або нікель Ренея. Придатні кількості металевого каталізатора для даної реакції становлять, наприклад, від 0,001 до 0,5 еквіваленту, особливо від 0,01 до ОД еквіваленту. Вказану реакцію переважно здійснюють у присутності інертного розчинника. Придатними розчинниками, наприклад, є спирти, такі як метанол, етанол, пропанол або ізопропанол, або апротонні розчинники, такі як тетрагідрофуран, третбутилметиловий ефір, діоксан, толуол або етилацетат і їх суміші. Особливо переважні тетрагідрофуран або метанол. Температури зазвичай становлять від -40°С до 80°С, переважна температура в діапазоні від -20°С до 50°С і особливо переважна температура в діапазоні від 0°С до 30°С. В одному варіанті температури перебувають у діапазоні від 20 до 30°С. Реакція може бути здійснена при атмосферному тиску або при підвищеному тиску, переважний атмосферний тиск або підвищений тиск до 6 бар і особливо переважний атмосферний тиск. Час реакції для даної реакції зазвичай становить від 1 до 60 годин, переважно від 1 до 6 годин. У наступному варіанті здійснення даного винаходу (варіант способу а2), використовують більше одного відновлювана на технологічній стадії а). Переважне застосування двох різних відновлювачів на підстадіях загального способу відновлення, що ідуть одна за одною. Проміжні продукти, одержувані на першій підстадії, можуть бути виділені за допомогою вибору придатних умов реакції й потім можуть бути використані на другий підстадії, щоб одержати сполуки формули III. Варіант способу (а2), перша підстадія: придатним відновлювачем для першої підстадії варіанта способу (а2) є, наприклад, елементарне залізо, олово або цинк у присутності кислоти. Особливо переважним відновлювачем є елементарне залізо в присутності кислоти. В одному варіанті здійснення першої підстадії варіанта способу (а2) сполуку формули II де R1 і R2 мають значення, які визначені для формули І, піддають взаємодії з елементним залізом у присутності кислоти з утворенням сполуки формули IIА де R1 і R2 мають значення, які визначені для формули І. Сполуки формули ІІА можуть бути ви 96425 16 ділені за допомогою підбору придатних умов реакції й потім використані на другий підстадії варіанта способу (а2). Сполуки формули IIA також можуть бути безпосередньо використані на другий підстадії варіанта способу (а2) без виділення. Придатні кількості заліза для першої підстадії варіанта способу (а2) становлять, наприклад, щонайменше 5 еквівалентів; переважно для даної реакції використовують від 5 до 10 еквівалентів. Придатними кислотами є, наприклад, органічні кислоти, такі як, наприклад, мурашина кислота, оцтова кислота або пропіонова кислота; або неорганічні кислоти, такі як, наприклад, соляна або сірчана кислота. Перевага віддається органічним кислотам, і особливо переважна оцтова кислота. Реакцію переважно здійснюють у присутності інертного розчинника. Придатними розчинниками є, наприклад, вода; спирти, такі як метанол, етанол, пропанол або ізопропанол; або апротонні розчинники, такі як тетрагідрофуран, третбутилметиловий ефір, діоксан, толуол або етилацетат; і їх суміші; спирти є особливо переважними. Температури зазвичай становлять від 0°С до 120°С, переважний діапазон температур від 0°С до 100°С і особливо переважний діапазон температур від 20°С до 60°С. В одному варіанті температури перебувають у діапазоні від 20 до 30°С. Реакція може бути здійснена при атмосферному тиску або при підвищеному тиску. Час реакції для даної реакції зазвичай становить від 1 до 60 годин, переважно від 1 до 6 годин. Варіант способу (а2), друга підстадія: на другий підстадії варіанта способу (а2) сполуки, утворені на першій підстадії, піддають взаємодії з наступним відновлювачем, що відрізняється від відновлювача на першій підстадії, з утворенням сполук формули III. Придатними відновлювачами для другої підстадії варіанта способу (а2) є відновлювачі, вказані для технологічної стадії а). Придатні кількості відновлювача для другий підстадії варіанта способу (а2) становлять, наприклад, до 2 еквівалентів; переважно для даної реакції використовують 2 еквіваленти. Другу підстадію варіанта способу (а2) переважно здійснюють у закритій посудині. В одному варіанті способу відповідно до винаходу, в якому другу підстадію варіанта способу (а2) здійснюють у закритій посудині, надлишок водню вводять, наприклад, у реакційну суміш, в якій вже є присутнім металевий каталізатор. Потім вимірюють витрату водню протягом періоду протікання реакції. У даному варіанті здійснення способу відповідно до винаходу реакцію переважно зупиняють, коли витрачена необхідна кількість водню. Придатними металевими каталізаторами є, наприклад, платинові каталізатори, такі як, наприклад, каталізатори платина/вугілля або PtO2; паладієві каталізатори, такі як, наприклад, Pd/C; каталізатори на основі родію, такі як, наприклад, Rh/C, Rh/Al2O3 або Rh2O3; нікелеві каталізатори, такі як, наприклад, нікель Ренея; або каталізатори на основі іридію, такі як, наприклад, 17 Ir(COD)Py(Pcy); і їх суміші. Переважні платинові каталізатори, паладієві каталізатори, родієві каталізатори або нікелеві каталізатори; особливо переважні паладієві каталізатори, родієві каталізатори або нікелеві каталізатори; і найбільш переважні Pd/C, Rh/C або нікель Ренея. Придатні кількості металевого каталізатора для даної реакції становлять, наприклад, від 0,001 до 0,5 еквіваленту, особливо від 0,01 до 0,1 еквіваленту. Реакцію переважно здійснюють у присутності інертного розчинника. Придатними розчинниками, наприклад, є спирти, такі як метанол, етанол, пропанол або ізопропанол, або ацротонні розчинники, такі як тетрагідрофуран, трет-бутилметиловий ефір, діоксан, толуол або етилацетат і їх суміші. Особливо переважні тетрагідрофуран або метанол. Температури зазвичай становлять від -40°С до 80°С, переважна температура в діапазоні від -20°С до 50°С і особливо переважна температура в діапазоні від 0°С до 30°С. В одному варіанті температури перебувають у діапазоні від 20 до 30°С. Реакція може бути здійснена при атмосферному тиску або при підвищеному тиску, переважний атмосферний тиск або підвищений тиск до 6 бар і особливо переважний атмосферний тиск. Час реакції для даної реакції зазвичай становить від 1 до 60 годин, переважно від 1 до 6 годин. Сполуки формули II можуть бути отримані, наприклад, за допомогою послідовності реакцій, що вказана нижче (дивися схему 2): 96425 18 (2001) і R.N. Warrener et al., Molecules, 6, 194 (2001). Придатними апротонними розчинниками для даної стадії є, наприклад, діетиловий ефір, бутилметиловий ефір, етилацетат, дихлорметан, ацетон, тетрагідрофуран, толуол, 2-бутанон або диметоксіетан. Придатні температури реакції перебувають у діапазоні від температури навколишнього середовища до 100°С, переважно від 35°С до 80°С. Фульвени формули С можуть бути отримані відповідно до способу, аналогічного способу, описаному в М. Neuenschwander et al., Helv. Chim. Acta, 54, 1037 (1971), там же 48, 955 (1965), R.D. Little et al., J. Org. Chem. 49, 1849 (1984), I. Erden et al., J. Org. Chem. 60, 813 (1995), S. Collins et al., J. Org. Chem. 55, 3395 (1990), J. Thiele, Chem. Ber. 33, 666 (1900) і Liebigs Ann. Chem. 1, 348 (1906). Фульвени загальної формули (С) де R1 і R2 мають значення, які визначені для формули І, можуть бути отримані за допомогою взаємодії циклопента-1,3-дієну зі сполукою формули (F) 1 5-нітробензонорборнадієни формули II, де R1 і R2 мають значення, які визначені для формули І, можуть бути отримані за допомогою реакції приєднання Дільса-Альдера утвореного in situ дегідробензолу формули В [отриманого, наприклад, виходячи з 6-нітроантранілової кислоти (сполука формули А)] за допомогою діазотування з використанням С1-8-алкілнітриту, такого як, наприклад, ізоамілнітрит, трет-амілнітрит, н-амілнітрит або трет-бутилнітрит, як описано в L. Paquette et al, J. Amer. Chem. Soc. 99, 3734 (1977), або з інших придатних попередників [дивися Н. Pellissier et al., Tetrahedron, 59, 701 (2003), R. Muneyuki and H. Tanida, J. Org. Chem. 31, 1988 (1966)], до фульвену формули С, де R1 i R2 мають значення, які визначені для формули І. Вказана реакція може бути здійснена аналогічно реакції, описаній в R. Muneyuki and H. Tanida, J. Org. Chem. 31, 1988 (1966), P. Knochel et al., Angew. Chem. 116, 4464 (2004), J. W. Сое et al., Organic Letters 6, 1589 (2004), L. Paquette et al, J. Amer. Chem. Soc. 99, 3734 (1977), R.N. Warrener et al., Molecules, 6, 353 2 де R і R мають значення, які визначені для формули І, у присутності основи. Реакцію для одержання сполук формули (С) переважно здійснюють у присутності інертного розчинника. Придатними розчинниками є, наприклад, диметилформамід; диметилсульфоксид; Nметил-2-піролідон; прості ефіри, такі як, наприклад, тетрагідрофуран, трет-бутилметиловий ефір, діетиловий ефір, бутилметиловий ефір, диметоксіетан; спирти, такі як, наприклад, С1-С10-спирти, такі як, наприклад, метанол або етанол; або ароматичні розчинники, такі як, наприклад, толуол, ксилен або дихлорбензол. Придатними основами є, наприклад, амінні основи, такі як, наприклад, піролідин, морфолін, тіоморфолін або піперидин; алканоляти, такі як, наприклад, метанолят натрію або етанолят натрію, або гідроксиди, такі як, наприклад, KOH або NaOH; переважний піролідин. Придатні кількості основи для реакції становлять, наприклад, від 0,01 до 2 еквівалентів, особливо від 0,25 до 0,8 еквіваленту. Температури зазвичай становлять від -20°С до 80°С, переважний діапазон температур від -10°С до температури навколишнього середовища. Час реакції для даної реакції зазвичай становить від 30 хвилин до 24 годин, переважно від 1 до 6 годин. Приклад А1: Одержання 6,6диметилфульвену: 19 950 г (5 еквівалентів) метанолу, 543 г (1,3 еквіваленту) ацетону та 397 г (6 моль) циклопентадієну змішують разом і охолоджують до -5°С. Додають 107 г (0,25 еквіваленту) піролідину. Реакційну суміш перемішують протягом 2 годин при -5°С. Реакцію зупиняють додаванням оцтової кислоти й води. Після поділу фаз органічну фазу екстрагують насиченим розчином хлориду натрію. Розчинник видаляють у вакуумі. Одержують 535 г 6, 6диметилфульвену (чистота: 93%; вихід: 78%). 6-нітроантранілова кислота доступна, наприклад, згідно з Н. Seidel, Chem. Ber. 34,4351(1901). Технологічна стадія b): В одному варіанті даного винаходу на технологічній стадії b) використовують один відновлювач. Придатним відновлювачем для технологічної стадії b) є, наприклад, водень у присутності металевого каталізатора. Придатні кількості відновлювача для даної реакції становлять, наприклад, до 1 еквіваленту, переважно 1 еквівалент для даної реакції. Технологічну стадію b) переважно здійснюють у закритій посудині. В одному варіанті способу відповідно до винаходу, в якому технологічну стадію b) здійснюють у закритій посудині, надлишок водню, наприклад, вводять у реакційну суміш, в якій вже є присутнім металевий каталізатор. Потім контролюють витрату водню протягом періоду протікання реакції. У даному варіанті здійснення способу відповідно до винаходу реакцію переважно зупиняють, коли витрачена необхідна кількість водню. Придатними металевими каталізаторами є, наприклад, платинові каталізатори, такі як, наприклад, каталізатори платина/вугілля (Pt/C) aбo РtO2; паладієві каталізатори, такі як, наприклад, Pd/C; каталізатори на основі родію, такі як, наприклад, Rh/C, Rh/Al2O3 або Rh2O3; нікелеві каталізатори, такі як, наприклад, нікель Ренея; або каталізатори на основі іридію, такі як, наприклад, Ir(COD)Py(Pcy); і їх суміші. Особливо переважні Pd/C або Rh/C. Придатні кількості металевого каталізатора для даної реакції становлять, наприклад, від 0,001 до 0,5 еквіваленту, особливо від 0,01 до 0,1 еквіваленту. Вказану реакцію переважно здійснюють у присутності інертного розчинника. Придатними розчинниками, наприклад, є спирти, такі як метанол, етанол, пропанол або ізопропанол, або апротонні розчинники, такі як тетрагідрофуран, третбутилметиловий ефір, діоксан, толуол, етилацетат або дихлорметан, і їх суміші; особливо переважний тетрагідрофуран або метанол. Температури зазвичай становлять від -40°С до 80°С, переважна температура в діапазоні від -20°С до 50°С і особливо переважна температура в діапазоні від 0°С до 30°С. В одному варіанті температури перебувають у діапазоні від 20 до 30°С. Реакція може бути здійснена при атмосферному тиску або при підвищеному тиску, переважний атмосферний тиск або підвищений тиск до 150 бар і особливо переважний атмосферний тиск або підвищений тиск до 100 бар. 96425 20 Час реакції для даної реакції зазвичай становить від 1 до 100 годин, переважно від 1 до 24 годин. Технологічна стадія с): особливо придатними для застосування на технологічній стадії с) є сполуки формули V, де Q означає хлор, фтор, бром або йод, і R3 має значення, визначене для формули І. Більш придатними є сполуки формули V, де Q означає хлор, фтор або бром, і R3 має значення, визначене для формули І. Особливо придатними є сполуки формули V, де Q означає хлор, і R3 має значення, визначене для формули І. У реакціях відповідно до винаходу зі сполуками формули V, де Q означає хлор, фтор або бром, і R3 має значення, визначене для формули І (варіант способу сі), сполуки формули V використовують в еквімолярній кількості, у кількості меншій, ніж еквімолярна кількість, або в надлишку відносно сполук формули IV, переважно в еквімолярній кількості або в надлишковій кількості аж до 3кратного надлишку, особливо переважне використання еквімолярної кількості або надлишкової кількості аж до 1,5-кратного надлишку, ще більш переважне використання еквімолярної кількості. Реакцію відповідно до варіанта способу сі) переважно здійснюють у присутності інертного розчинника. Придатними розчинниками є, наприклад, хлорбензол, дихлорметан, хлороформ, толуол, тетрагідрофуран, діетиловий ефір, бутилметиловий ефір або вода, і їх суміші, особливо переважними є толуол або дихлорметан. Реакцію відповідно до варіанта способу сі) переважно здійснюють у присутності основи. Придатними основами є, наприклад, амінні основи, такі як, наприклад, триетиламін або піридин; або неорганічні основи, такі як карбонати, наприклад K2СО3 або Na2CO3, або гідроксиди, наприклад NaOH або KOH; переважні триалкіламіни й особливо переважний триетиламін. Придатні кількості основи для реакції становлять, наприклад, від 1 до 1,5 еквівалентів, особливо від 1 до 1,2 еквіваленту. Температури зазвичай становлять від 0°С до 100°С, переважний діапазон температур від 10°С до 50°С і особливо переважний діапазон від 15°С до 30°С. Реакція може бути здійснена при атмосферному тиску або при підвищеному тиску, при цьому переважний атмосферний тиск. Час реакції для даної реакції зазвичай становить від 1 до 48 годин, переважно від 1 до 24 годин. Також особливо придатними для застосування на технологічній стадії с) є сполуки формули V, де Q означає гідроксигрупу й R3 має значення, визначене для формули І. У реакціях відповідно до винаходу зі сполуками формули V, де Q означає гідроксигрупу, і R3 має значення, визначене для формули І (варіант способу с2), сполуки формули V використовують в еквімолярній кількості, у кількості меншій, ніж еквімолярна кількість, або в надлишку стосовно сполук формули IV, переважно в еквімолярній кількості або в надлишковій кількості аж до 3-кратні 21 надлишки, особливо переважне використання еквімолярної кількості або надлишкової кількості аж до 1,5-кратного надлишку, ще більш переважне використання еквімолярної кількості. Реакції відповідно до винаходу у випадку варіанта способу с2), тобто з використанням сполук формули V, де Q означає гідроксигрупу, і R3 має значення, визначене для формули І, переважно здійснюють у присутності активуючого агента. Придатним активуючим агентом є, наприклад, хлорангідрид біс(2-оксо-3оксазолідиніл)фосфінової кислоти. Реакцію відповідно до варіанта способу с2) переважно здійснюють у присутності інертного розчинника. Придатними інертними розчинниками є, наприклад, дихлорметан і хлороформ, і їх суміші; особливо переважним є дихлорметан. Реакцію відповідно до варіанта способу с2) переважно здійснюють у присутності основи. Придатними основами є, наприклад, амінні основи, такі як, наприклад, триетиламін або піридин; особливо переважним є триетиламін. Придатні кількості основи для даної реакції становлять, наприклад, щонайменше 2 еквіваленти, особливо від 2 до 3 еквівалентів. Температури зазвичай становлять від 0°С до 100°С, переважний діапазон температур від 10°С до 50°С і особливо переважний діапазон від 15°С до 30°С. Реакція може бути здійснена при атмосферному тиску або при підвищеному тиску, при цьому переважний атмосферний тиск. Час реакції для даної реакції зазвичай становить від 1 до 48 годин, переважно від 1 до 24 годин. Також придатними для застосування на технологічній стадії с) є сполуки формули V, в яких Q означає С1-С6-алкоксигрупу, і R3 має значення, визначене для формули І. Особливо придатними є сполуки формули V, в яких Q означає метокси- або етоксигрупу, і R3 має значення, визначене для формули І. У реакціях відповідно до винаходу з використанням сполук формули V, в яких Q означає С1-С6алкоксигрупу, і R3 має значення, визначене для формули І (варіант способу с3), сполуки формули V використовують в еквімолярній кількості, у кількості, меншій, ніж еквімолярна кількість, або в надлишку в порівнянні зі сполуками формули IV. Реакцію відповідно до варіанта способу с3) переважно здійснюють у присутності інертного розчинника. Придатними розчинниками є, наприклад, хлорбензол, дихлорметан, хлороформ, толуол, тетрагідрофуран, діетиловий ефір або бутилметиловий ефір і їх суміші; хлорбензол або толуол є переважними як розчинник. Реакція також може бути здійснена у відсутності розчинника. Реакцію відповідно до варіанта способу с3) переважно здійснюють у присутності основи. Придатними основами є, наприклад, амінні основи, такі як, наприклад, триетиламін або піридин; неорганічні основи, такі як карбонати, наприклад K2СО3 або Na2CO3, або гідроксиди, наприклад NaOH або KOH; або алкоксиди, такі як, 96425 22 наприклад, трет-бутоксид калію. Переважним є, наприклад, трет-бутоксид калію. Придатні кількості основи для реакції становлять, наприклад, від 1 до 1,5 еквівалентів, особливо від 1 до 1,2 еквіваленту. Температури зазвичай становлять від 0°С до 120°С, переважний діапазон температур від 50°С до 100°С і особливо переважний діапазон від 70°С до 100°С. Реакція може бути здійснена при атмосферному тиску або при підвищеному тиску, при цьому переважний атмосферний тиск. Час реакції для даної реакції зазвичай становить від 1 до 48 годин, переважно від 1 до 24 годин. Сполуки формули V описані в WO 04/035589 або можуть бути отримані способами, описаними в даній публікації. Переважним варіантом способу відповідно до винаходу є спосіб одержання сполук формули І, в яких R1 і R2 означають метил, і R3 означає CF2H, що включає в себе: (a) взаємодію сполуки формули II, де R1 і R2 означають метил, з воднем у присутності каталізатора родію на куті з утворенням сполуки формули III, де R1 і R2 означає метил, при цьому як розчинник використовують тетрагідрофуран; і (b) взаємодію вказаної сполуки з воднем у присутності каталізатора нікелю Ренея з утворенням сполуки формули IV, де R1 і R2 означають метил, при цьому як розчинник використовують тетрагідрофуран; і (c) перетворення отриманої сполуки в сполуку формули І у результаті взаємодії зі сполукою формули V, де Q означає гідроксигрупу, і R3 означає CF2H, у присутності хлорангідриду біс(2-оксо-3оксазолідиніл)фосфінової кислоти, при цьому як розчинник використовують дихлорметан і реакцію здійснюють у присутності триетиламіну. Вибравши придатні умови реакції для стадії реакції а), сполуку формули III, отриману на стадії реакції а), можна перетворити на сполуку формули IV безпосередньо без виділення проміжних продуктів у результаті повного гідрування. Вказаний переважний варіант здійснення даного винаходу є особливою перевагою способу відповідно до винаходу. У вказаному переважному варіанті більш переважно використовують усього 5 еквівалентів відновлювана на стадіях реакції а) і b) разом. У випадку вказаного переважного варіанта здійснення даного винаходу водень у присутності металевого каталізатора переважно використовують як відновлювач на стадії реакції а) і стадії реакції b). У випадку вказаного переважного варіанта здійснення даного винаходу той самий металевий каталізатор переважно використовують на стадії реакції а) і стадії реакції b). Придатні кількості металевого каталізатора для вказаного переважного варіанта становлять, наприклад, від 0,001 до 0,5 еквіваленту, переважно від 0,01 до 0,1 еквіваленту. Переважно комбінацію стадій реакції а) і b) у даному переважному варіанті здійснення способу 23 відповідно до винаходу здійснюють у закритій посудині. У випадку вказаної комбінації надлишок водню, наприклад, уводять у реакційну суміш, в якій уже є присутнім металевий каталізатор. Витрату водню потім контролюють протягом періоду протікання реакції. У даному переважному варіанті здійснення способу відповідно до винаходу реакцію переважно зупиняють, коли витрачена необхідна кількість водню, що більш переважно становить 5 еквівалентів. У даному варіанті реакція може бути здійснена при атмосферному тиску або при підвищеному тиску до 150 бар, при цьому переважний атмосферний тиск або підвищений тиск до 50 бар, особливо переважний атмосферний тиск або підвищений тиск до 20 бар і ще більш переважний атмосферний тиск або підвищений тиск до 6 бар. Час реакції у випадку вказаного переважного варіанта реакції зазвичай становить від 1 до 100 годин, переважно від 1 до 24 годин. Даний винахід більш докладно пояснюється в наступних прикладах: Приклад Р1: Одержання 5амінобензонорборнену (сполука No. Z2.11): 5,0 г 5-нітробензонорборнадієну (сполуки No. Z1.11) (22 ммоль) гідрували в 50 мл тетрагідрофурану в присутності 1,5 г 5% Rh/C при 25°С і атмосферному тиску. Після поглинання 4 еквівалентів водню (2,01 літри або 102% від теоретичної кількості) суміш фільтрували, розчинник видаляли у вакуумі й залишок очищували хроматографією на колонці із силікагелем, використовуючи суміш гексан/етилацетат (6:1) як елюент. Одержували 2,76 г 5-амінобензонорборнену у формі твердої речовини (т.пл. 81-82°С; вихід: 62,9% від теоретичного). 1 Н-ЯМР (CDCl3), м.ч.: 6,90 (т, 1Н), 6,67 (д, 1Н), 6,46 (д, 1Н), 3,77 (м, 1Н), 3,73 (м, 1Н), 3,35 (уш, беруть участь в обміні D2O, 2Н), 1,89 (м, 2Н), 1,63 13 (2с, 6Н), 1,26 (м, 2Н), С-ЯМР (CDCl3), м.ч.: 148,73, 147,65, 138,30, 131,75, 126,19, 113,12, 110,89, 110,19, 43,97, 39,44, 26,98,26,06, 19,85, 19,75. Приклад Р2: Одержання 5амінобензонорборнену (сполука No. Z2.11): у сталевому автоклаві об'ємом 1 літр 5% родій на активованому куті (43,1 г, вологий, вміст води 70%) додавали до 225 г метанолу. Використовували тиск водню 7 бар і перемішування здійснювали при температурі навколишнього середовища. До отриманої суміші протягом 2 годин додавали розчин 96,7 г 9-ізопропіліден-нітро-1,4-дигідро-1,4метанонафталіну в 120 г тетрагідрофурану й 24 г метанолу. Паралельно продовжували використовувати водень при тиску 7 бар. Реакцію зупиняли через 30 хвилин після припинення додавання. Реакційну суміш фільтрували через целюлозу й промивали метанолом. Фільтрат концентрували досуха шляхом випарювання. До отриманого залишку 96425 24 додавали метанол. Преципітований неочищений продукт відфільтровували й концентрували досуха випарюванням. Залишок піддавали хроматографії на силікагелі, використовуючи суміш етилацетат/гексан (1:6). Одержували 5амінобензонорборнен. Приклад Р3: Одержання 5амінобензонорборнену (сполука No. Z3.11): 0,2 г 5-амінобензонорборнену (Z2.11) гідрували протягом 24 годин в 40 мл тетрагідрофурану в присутності 0,1 г RaNi (обробленого EtOH) при 25°С і тиску 100 бар. Суміш фільтрували, розчинник видаляли у вакуумі й залишок очищували хроматографією на колонці із силікагелем, використовуючи суміш гексан/етилацетат (6:1) як елюент. 5амінобензонорборнен (Z3.11) одержували у формі твердої речовини (співвідношення син/анти 29:71; вихід: 82% від теоретичного). Приклад Р4: Одержання 5амінобензонорборнену (сполука No. Z3.11): 41,4 г 9-ізопропіліден-5нітробензонорборнадієну (сполука No. Z1.11) в 1 літрі тетрагідрофурану повністю гідрували в присутності 22 г 5% Pd/C при 25°С і нормальному тиску протягом 4 годин. Реакційну суміш фільтрували, розчинник видаляли у вакуумі й очищення хроматографією на силікагелі здійснювали, використовуючи суміш етилацетат/гексан (1:7) як елюент. Одержували 29,9 г 5-амінобензонорборнену (сполука No. Z3.11) (співвідношення син/анти 32:68; вихід: 81,5% від теоретичного) у формі масла. 1 Син-епімер: Н-ЯМР (CDCl3), м.ч.: 6,91 (т, 1Н), 6,64 (д, 1Н), 6,48 (д, 1Н), 3,54 (уш. беруть участь в обміні D2O, 2Н), 3,20 (м, 1Н), 3,15 (м, 1Н), 1,92 (м, 2Н), 1,53 (д, 1Н), 1,18 (м, 2Н), 1,02 (м, 1Н), 0,81 (м, 13 6Н); С-ЯМР (CDCl3), м.ч.: 147,73, 140,03, 130,15, 126,41, 113,35, 112,68, 69,00, 46,62, 42,06, 27,74, 1 26,83, 25,45, 22,32, 22,04; анти-епімер Н-ЯМР (CDCl3), м.ч.: 6,89 (т, 1Н), 6,63 (д, 1Н), 6,46 (д, 1Н), 3,55 (уш. беруть участь в обміні D2O, 2Н), 3,16 (м, 1Н), 3,13 (м, 1Н), 1,87 (м,2Н), 1,48 (д, 1Н), 1,42 (м, 13 1Н), 1,12 (м, 2Н), 0,90 (м, 6Н); С-ЯМР (CDCl3), м.ч.: 150,72, 138,74, 133,63, 126,15, 112,94, 111,53, 68,05, 45,21, 40,61, 26,25, 24,47, 23,55, 20,91 (2). Визначення син/анти здійснювали на основі експериментів NOE-ЯМР. Приклад Р5: Одержання (9-ізопропіл-1,2,3,4тетрагідро-1,4-метанонафтален-5-іл)аміду 3дифторметил-1-метил-1Н-піразол-4-карбонової кислоти (сполука No. А.11): 25 1,9 г хлорангідриду біс(2-оксо-3оксазолідиніл)фосфінової кислоти (7,2 ммоль, 1,4 еквіваленти) додавали при температурі навколишнього середовища до розчину 1 г 9-ізопропіл-5амінобензонорборнену (сполука No. Z3.11, співвідношення син/анти 90:10; 5 ммоль), 1,7 мл триетиламіну (12,1 ммоль, 2,4 еквіваленти) і 1,2 г 3дифтерметил-1-метил-1Н-піразол-4-карбонової кислоти (6,2 ммоль, 1,4 еквіваленти) в 40 мл дихлорметану й перемішування здійснювали протягом 20 годин. Після додавання води й насиченого розчину NaНСО3 органічну фазу екстрагували етилацетатом. Очищення на силікагелі в суміші етилацетат/гексан (2:3) і наступна кристалізація з гексану давала 1,31 г (9-ізопропіл-1,2,3,4тетрагідро-1,4-метанонафтален-5-іл)аміду 3дифторметил-1-мтил-1Н-піразол-4-карбонової кислоти (т.пл. 124-125°С; співвідношення син/анти 1 92:8 згідно з Н-ЯМР; вихід: 73%). Кристалічну речовину аналізували, використовуючи диференціальну скануючу калориметрію та дифракцію рентгенівських променів, і ідентифікували у вигляді кристалічної модифікації В (9-ізопропіл-1,2,3,4тетрагідро-1,4-метанонафтален-5-іл)аміду син-3дифторметил-1-метил-1Н-піразол-4-карбонової кислоти (дивися Фіг. 7). Приклад Р6: Одержання (9-ізопропіл-1,2,3,4тетрагідро-1,4-метанонафтален-5-іл)аміду 3дифторметил-1-метил-1Н-піразол-4-карбонової кислоти (сполука No. А.11): До розчину 100 г 9-ізопропіл-5амінобензонорборнену (сполука No. Z3.11, співвідношення син/анти 90:10; 0,5 моль, 50% розчин у хлорбензолі) і 55,7 г триетиламіну (0,55 моль, 1,1 еквіваленту) в 200 г хлорбензолу при 40°С протягом 2 годин додавали 97,3 г 3-дифторметил-1метил-1Н-піразол-4-карбонілхлориду (50% розчин у хлорбензолі, 0,5 моль, 1 еквівалент) і перемішування здійснювали протягом 1 години. Після додавання води й соляної кислоти (встановлюється значення рН 6-7), органічну фазу екстрагували хлорбензолом. Органічну фазу концентрували відгонкою хлорбензолу. Після наступної кристалізації із суміші метанол/вода (3:1) одержували 126 г 96425 26 (9-ізопропіл-1,2,3,4-тетрагідро-1,4метанонафтален-5-іл)аміду 3-дифторметил-1метил-1Н-піразол-4-карбонової кислоти (т.пл. 124125°С; чистота: 99,2%; співвідношення син/анти 95:5 згідно з ГХ, вихід: 70%). Кристалічну речовину аналізували, використовуючи диференціальну скануючу калориметрію й дифракцію рентгенівських променів, і ідентифікували у вигляді кристалічної модифікації В (9-ізопропіл-1,2,3,4-тетрагідро1,4-метанонафтален-5-іл)аміду 1-3-дифторметил1-метил-1Н-піразол-4-карбонової кислоти (дивися Фіг. 8). Приклад Р7: Одержання 5нітробензонорборнадієну: Суміш 110,4 г 6-нітроантранілової кислоти (0,6 моль) і 98,5 г 6, 6-диметилфульвену (1,5 еквіваленту) в 700 мл диметоксіетану по краплях при 72°С додавали до розчину 96,3 г трет-бутилнітриту (1,4 еквіваленти) в 2 літрах 1, 2-диметоксіетану в атмосфері азоту. Починалося виділення газу й температура суміші піднімалася до 79°С. Виділення газу затихало через 30 хвилин. Після перемішування протягом 3 годин при температури флегми розчинника суміш охолоджували до температури навколишнього середовища. Розчинник видаляли у вакуумі й залишок очищували хроматографією на колонці із силікагелем, використовуючи суміш гексан/етилацетат (95:5) як елюент. Одержували 76,7 г 5-нітробензонорборнадієну у формі твердої речовини жовтого кольору, (т.пл. 94-95°С). 1 Н-ЯМР (CDCl3), м.ч.: 7,70 (д, 1Н), 7,43 (д, 1Н), 7,06 (т, 1Н), 6,99 (м, 2Н), 5,34 (уш.с, 1Н), 4,47 13 (уш.с, 1Н), 1,57 (2д, 6Н), С-ЯМР (CDCl3), м.ч.: 159,83, 154,30, 147,33, 144,12, 142,89, 141,93, 125,23 (2), 119,32, 105,68, 50,51, 50,44, 19,05, 18,90. Приклад Р8: Одержання 5нітробензонорборнадієну: 98,5 г 6, 6-диметилфульвену в 500 г метилетилкетону нагрівали до 60°С. Розчин 182 г 6нітроантранілової кислоти в 700 г метилетилкетону додавали протягом 2 годин при 60°С в атмосфері азоту, і паралельно додавали 216 г третамілнітриту протягом 2,5 годин. Розчинник видаляли у вакуумі при 60°С. Додавали 200 г ксилену й потім додавали 1200 г гексану. Отриману суспензію фільтрували й промивали гексаном. Розчинник видаляли у вакуумі при 60°С і до неочищеного продукту додавали 200 г метанолу. Неочищений продукт, що кристалізувався, відфільтровували 27 при 0°С і промивали 100 г метанолу. Після видалення залишкового розчинника у вакуумі при 60°С одержували 120 г 5-нітробензонорборнадієну (т.пл. 93°С). Приклад Р9: Одержання 5амінобензонорборнадієну (сполука No. Z4.11): Порошкове залізо додавали до 2,72 г 5нітробензонорборнадієну (сполука No. Z1.11), розчиненого в 50 мл тетрагідрофурану й 61 мл оцтової кислоти (5% у воді) і перемішування здійснювали протягом 20 годин при 30°С. Неочищений продукт відфільтровували й додавали етилацетат. Потім здійснювали промивання водним розчином NaHCO3 і насиченим розчином хлориду натрію й здійснювали сушіння при додаванні Na2SO4. Сирий продукт очищували на колонці із силікагелем (елюент: 1:3 етилацетаттексан). Одержували 2,01 г 5-амінобензонорборнадієну у формі кристалів бежевого кольору (вихід: 85%; т.пл. 121-123°С). І 1 Н-ЯМР (CDCl3): 6,95 (м, 2Н), 6,80 (м, 2Н), 6,39 (д, 1Н), 4,41 (м, 1Н), 4,37 (м, 1Н), 3,91 (уш. беруть участь в обміні D2O, 2H), 1,58 (с, ЗН), 1,57 (с, ЗН); 13 С-ЯМР (CDCl3): 160,8, 151,6, 143,0, 141,9, 139,1, 134,2, 125,3, 113,2, 112,5, 101,5,50,9,46,3, 19,0, 18,8. Ρ10: Одержання (9-ізопропіл-1,2,3,4тетрагідро-1,4-метанонафтален-5-іл)аміду 3дифторметил-1-метил-1Н-піразол-4-карбонової кислоти (сполука No. A.11): 96425 28 6,2 г 5-амінобензонорборнену (сполука No. Z3.11, співвідношення син/анти 90:10; 30 ммоль, 1,05 еквіваленту) і 1,6 г трет-бутоксиду калію (14,7 ммоль, 0,5 еквіваленту) додавали до розчину 6 г етилового ефіру 3-дифторметил-1-метил-1Нпіразол-4-карбонової кислоти (29 ммоль) в 60 мл хлорбензолу. Реакційну суміш нагрівали до 95°С і розчинник хлорбензол повністю видаляли у вакуумі. Реакційну суміш нагрівали до 120°С і перемішували протягом 20 годин. Потім додавали 30 мл хлорбензолу. Органічну фазу двічі екстрагували водою, спочатку при низькому рН, потім при високому рН. Органічну фазу концентрували відгонкою хлорбензолу. Одержували 8 г (9-ізопропіл-1,2,3,4тетрагідро-1,4-метанонафтален-5-іл)аміду 3дифторметил-1-метил-1Н-піразол-4-карбонової кислоти у формі масла коричневого кольору (грубий вихід: 33%). Одержання вихідних сполук формули V описане в наступному прикладі. Приклад А2: Одержання 3-дифторметил-1метил-1Н-піразол-4-карбонілхлориду: 69,5 г тіонілхлориду (0,58 моль, 1,17 еквіваленту) додавали при 110°С протягом 2 годин до розчину 88 г 3-дифторметил-1-метил-1Н-піразол-4карбонової кислоти (0,5 моль) в 440 г хлорбензолу. Реакційну суміш перемішували протягом 1 години при 110°С. Реакційну суміш концентрували до одержання розчину неочищеного продукту. Одержували 190 г 3-дифторметил-1-метил-1Нпіразол-4-карбонілхлориду (50% у хлорбензолі, вихід: 98%). Розчин неочищеного продукту використовували без додаткового очищення. Наступні сполуки формули І можуть бути отримані на основі наведених вище прикладів: 29 96425 30 Переважні сполуки формули II перелічені в наступній таблиці: 31 96425 32 Переважні сполуки формули III перелічені в наступній таблиці: 33 96425 34 Переважні сполуки формули IV перелічені в наступній таблиці: 35 96425 36 Переважні сполуки формули IIA перелічені в наступній таблиці: 37 Вихідні речовини у випадку способу згідно з даним винаходом відрізняються тим, що вони легко доступні й мають придатні для обробки властивості й, крім того, є недорогими. В особливо переважному варіанті (bb) здійснення даного винаходу відновлювачем, використовуваним на стадії (b), є водень у присутності родієвого каталізатора. Вказаний переважний варіант (bb) уможливлює просте одержання сполук формули І, в яких відношення син-ізомерів формули Іа до антиізомерів формули Іb значно вище, ніж відношення, описане в WO 04/035589; у загальному досягаються відносини син/анти отриманих 9-монозаміщених бензонорборнен-5-іламідів піразоліл-4-карбонової кислоти більше, ніж 90:10. Послідовність реакцій, описана в WO 04/035589 (схема 1) дає відношення син:антиізомерів 9-монозаміщених бензонорборненів піразоліл-4-карбонової кислоти, що є фунгіцидами, зрушене на користь анти-ізомеру. Одержання окремих син/анти-ізомерів відповідно до відомого рівня техніки як правило здійснюють, використовуючи звичайні способи, такі як, наприклад, хроматографічні способи. Навпроти, згідно з особливо переважним варіантом (bb) даного способу можна легко одержати сполуки формули І, в яких відношення сполук формули Іа (син) до сполук формули Іb (анти) становить від 90:10 до 99:1. Тому конкретною перевагою особливо переважного варіанта (bb) даного способу є те, що легко можна одержати суміші сполук формули І, які мають співвідношення син/анти з більшою перевагою син-ізомеру. 96425 38 У контексті даного винаходу «суміш сполук формули І, що має співвідношення син/анти з більшою перевагою син-ізомеру» розуміють як суміш сполук формули І, в якій відношення сполук формули Іа (син) до сполук формули Іb (анти) становить від 90:10 до 99:1. У способі відповідно до винаходу співвідношення син/анти в кінцевих продуктах, отриманих даним способом, 9-монозаміщених бензонорборнен-5-іламідах піразоліл-4-карбонової кислоти формули І, по суті визначають за співвідношенням син/анти аміно-бензонорборненів формули IV, утворених при здійсненні технологічної стадії (b). При здійсненні технологічної стадії (с) амідування 5-амінобензонорборненів з утворенням кінцевих продуктів способу, сполук формули І, частка син-ізомерів залишається по суті без зміни. Після здійснення технологічної стадії (с) частка син-ізомерів сполук формули І може бути збільшена за допомогою фракційної кристалізації з використанням придатних розчинників, наприклад з використанням суміші трет-бутилметилового ефір/гексан або метанолу як розчинника. У вказаному особливо переважному варіанті (bb) способу відповідно до винаходу сполуки формули III, отримані відповідно до технологічної стадії (а) 39 де R1 і R2 мають значення, які визначені для формули І, піддають взаємодії bb) з воднем у присутності родієвого каталізатора з утворенням сполуки формули IV де R1 і R2 мають значення, які визначені для формули І, і де відношення сполук формули IVa (син) до сполук формули IVb (анти) становить більше 90:10. Отримані сполуки потім використовують на технологічній стадії (с). Після здійснення технологічної стадії (с) частка син-ізомерів по суті не змінюється. Вказаний особливо переважний варіант способу відповідно дає сполуки формули І, в яких відношення сполук формули Іа (син) до сполук формули Іb (анти) становить більше 90:10. Технологічна стадія bb): придатними родієвими каталізаторами є, наприклад, Rh/C, RhAI2O3 або Rh2O3 і їх суміші. Особлива перевага віддається Rh/C. Реакцію переважно здійснюють у присутності інертного розчинника. Придатними розчинниками є, наприклад, спирти, такі як метанол, етанол, пропанол або ізопропанол, або апротонні розчинники, такі як тетрагідрофуран, третбутилметиловий ефір, етилацетат, діоксан або толуол, і їх суміші; особливо переважними є етанол або метанол. Температури зазвичай становлять від 0°С до 80°С, при цьому переважний діапазон температур від 0°С до 25°С. Час реакції для даної реакції зазвичай становить від 1 до 100 годин, переважно від 1 до 24 годин. Також в особливо переважному варіанті (bb) здійснення даного винаходу завдяки вибору придатних умов реакції для стадії реакції а) сполуку формули III, отриману на стадії реакції а), можна піддати взаємодії з утворенням сполуки формули IV безпосередньо, без виділення проміжних продуктів, шляхом повного гідрування. Вказаний особливо переважний варіант здійснення даного винаходу забезпечує важливу перевагу способу відповідно до винаходу. У випадку такої переважної схеми здійснення варіанта (bb) усього 5 еквівалентів відновлювачі переважно використовують на стадіях реакції а) і b) разом. У випадку такої переважної схеми здійснення варіанта (bb) той самий металевий каталізатор переважно використовують на стадії реакції а) і стадії реакції b). Придатні кількості металевого каталізатора для вказаної переважної схеми здійснення варіанта (bb) становлять, наприклад, від 0,001 до 0,5 еквіваленту, зокрема від 0,01 до 0,1 еквіваленту. Комбінацію стадій реакції а) і b) у випадку даної переважної схеми здійснення варіанта (bb) переважно здійснюють у закритій посудині. У такій схемі надлишок водень уводять, наприклад, у реак 96425 40 ційну суміш, в якій уже є присутнім металевий каталізатор. Потім контролюють витрату водню протягом періоду протікання реакції. У випадку вказаної переважної схеми здійснення варіанта (bb) реакцію переважно зупиняють, коли витрачена необхідна кількість водню, що більш переважно становить 5 еквівалентів. У випадку вказаної переважної схеми здійснення варіанта (bb) реакція може бути проведена при атмосферному тиску або при підвищеному тиску до 150 бар, при цьому переважним є атмосферний тиск або підвищений тиск до 50 бар, особливо переважний атмосферний тиск і підвищений тиск до 20 бар, і ще більш переважний атмосферний тиск або підвищений тиск до 6 бар. Час реакції в вказаному переважному варіанті здійснення реакції зазвичай становить від 1 до 100 годин, переважно від 1 до 24 годин. Описаний вище особливо переважний варіант (bb) здійснення способу відповідно до винаходу більш докладно пояснюється в наступному прикладі: Приклад Р11: Одержання 9-ізопропіл-5амінобензонорборнену (сполука No. Z3.11): 95 г (0,42 моль) 9-ізопропіліден-5-нітробензонорборнадієну (Z1.11) в 1 літрі тетрагідрофурану повністю гідрували при 25°С і нормальному тиску в присутності 50 г 5% Rh/C. Через 3/4 дня витрата водню закінчувалася. Реакційну суміш фільтрували, розчинник видаляли у вакуумі й здійснювали очищення хроматографією на силікагелі, використовуючи суміш етилацетат/гексан (1:4) як елюент. Одержували 71,8 г (85% від теоретичного) 9-ізопропіл-5-амінобензонорборнену у формі мас1 ла із співвідношенням син/анти 92:8 за даними НЯМР. Сполуки формули IV де R1 і R2 мають значення, які визначені для формули І, і де відношення сполук формули IVa (син) де R1 і R2 мають значення, які визначені для формули І, до сполук формули IVb (анти) 41 96425 42 де R1 і R2 мають значення, які визначені для формули І, становить від 90:10 до 99:1, є корисними проміжними продуктами при одержанні сполук формули І і створені спеціально для даного способу відповідно до винаходу. Даний винахід відповідно також стосується таких сполук. Особливо корисними для одержання сполук формули І є сполуки формули IV, в яких відношення сполук формули IVa (син) до сполук формули IVb (анти) становить від 91:9 до 99:1. Ще більш корисними для одержання сполук формули І є сполуки формули IV, в яких відношення сполук формули IVa (син) до сполук формули IVb (анти) становить від 92:8 до 98:2. Ще більш корисними для одержання сполук формули І є сполуки формули IV, в яких відношення сполук формули IVa (син) до сполук формули IVb (анти) становить приблизно 95:5. Особливо придатними як проміжні продукти для одержання сполук формули І є сполуки формули IV, в яких R1 і R2 означають метил. Як описано на схемі 2,6-нітроантранілова кислота (сполука формули А на схемі 2) може бути використана для одержання сполук формули II. Було виявлено, що 6-нітроантранілова кислота може бути легко й з високим регіоселективним виходом отримана відповідно до наступної схеми (схема 3): На наведеній схемі 3-нітрофталімід (сполука формули Е) перетворюють у результаті взаємодії з водним розчином основи, таким як, наприклад, водний розчин гідроксиду натрію, і наступної взаємодії з водним розчином кислоти, таким як, наприклад, водний розчин соляної кислоти, в 6нітрофталамову кислоту (сполука формули D). 6нітрофталамову кислоту одержують із високим регіоселективним виходом; зазвичай досягають більше 70% на підставі вимірювання відносно вихідної речовини 3-нітрофталіміду. Потім на другій стадії 6-нітрофталамову кислоту перетворюють у необхідну 6нітроантранілову кислоту (сполука формули А). На даній стадії 6-нітрофталамова кислота, наприклад, може бути піддана взаємодії спочатку з водним розчином основи, таким як, наприклад, водний розчин гідроксиду натрію, і гіпохлоритом натрію, і потім водним розчином кислоти, таким як, наприклад, водний розчин соляної кислоти. 3-нітрофталімід є комерційно доступним. Схема 2 більш докладно пояснюється в наступному прикладі: Приклад A3: Одержання 6-нітроантранілової кислоти: a) Одержання 6-нітрофталамової кислоти: Суспензію 57,6 г 3-нітрофталіміду (0,3 моль) в 672 г води охолоджували до 5°С. За максимально короткий період часу додавали 80 г 30% розчину гідроксиду натрію (0,6 моль, 2 еквіваленти). Через 2 години при 5°С реакційну суміш додавали при 5°С до 65 г 32% розчину соляної кислоти (0,57 моль, 1,9 еквіваленту), що перед цим розбавляли 72 мл води. Значення рН доводили до 2-2,5 і неочищений продукт, що випадав у вигляді кристалів, відфільтровували й двічі промивали водою. Одержували 6-нітрофталамову кислоту з виходом 73%. b) Одержання 6-нітроантранілової кислоти: суспензію 126,3 г 6-нітрофталамової кислоти (0,6 моль) в 429 г води охолоджували до 5°С. До давали 80 г 30% розчину гідроксиду натрію (0,6 моль, 1 еквівалент) протягом 0,5 години при 5°С. Реакційну суміш разом з 288 г 15,2% розчину гіпохлориту натрію (0,6 моль, 1 еквівалент) повільно додавали до розчину гідроксиду натрію (235,2 г 30% розчину гідроксиду натрію (1,76 моль, З еквіваленти), розведеного 280 г води), попередньо нагрітого до 43°С. Під час додавання температуру підтримували на рівні 40-45°С. Через 1 годину при 40-45°С реакційну суміш додавали до суміші 268 г 32% соляної кислоти (2,35 моль, 3,9 еквіваленти) і 200 г води. Під час додавання температуру підтримували на рівні 20-45°С. Неочищений продукт, що випадав у вигляді кристалів, відфільтровували й три рази промивали водою. Одержували 6нітроантранілову кислоту з виходом 70%. Даний винахід, крім того, стосується способу одержання сполук формули IV де R1 і R2 кожний незалежно означають водень або С1-С5-алкіл, що включає в себе: а) взаємодію сполуки формули II де R1 і R2 мають значення, які визначені для формули IV щонайменше з одним відновлювачем з утворенням сполуки формули III 43 де R1 і R2 мають значення, які визначені для формули IV; і (b) перетворення отриманої сполуки з використанням щонайменше одного відновлювача на сполуку формули IV. У даному способі відповідно до винаходу для одержання сполук формули IV підстадію (а) (одержання сполук формули III) і підстадію (b) (одержання сполуки формули IV) здійснюють як описано вище. Також у даному способі відповідно до винаходу для одержання сполук формули IV завдяки вибору придатних умов реакції для стадії реакції а) сполука формули III, отримана на стадії реакції а), може бути піддана взаємодії, наприклад описаним вище чином, з утворенням сполуки формули IV безпосередньо, без виділення проміжних продуктів, шляхом повного гідрування. Даний винахід, крім того, стосується способу одержання сполук формули І де R1 і R2 кожний незалежно означає водень або С1-С5-алкіл, і R3 означає CF3 або CF2H, що включає в себе: аа) взаємодію 6-нітроантранілової кислоти з нітритом, вибраним з ізоамілнітриту й третбутилнітрита, і зі сполукою формули С де R1 і R2 мають значення, які визначені для формули І, з утворенням сполуки формули II де R1 і R2 мають значення, які визначені для формули І, і а) взаємодію отриманої сполуки з відновлювачем з утворенням сполуки формули III 96425 44 де R1 і R2 мають значення, які визначені для формули І; і (b) взаємодію отриманої сполуки з відновлювачем з утворенням сполуки формули IV де R1 і R2 мають значення, які визначені для формули І; і (c) перетворення отриманої сполуки на сполуку формули І за допомогою взаємодії зі сполукою формули V де Q означає хлор, бром, йод або гідроксигрупу, і R3 має значення, визначене для формули І. У даному способі одержання сполук формули І стадії реакції (а), (b) і (с) здійснюють як описано вище. Придатними апротонними розчинниками для стадії реакції (аа) є, наприклад, діетиловий ефір, бутилметиловий ефір, етилацетат, дихлорметан, ацетон, тетрагідрофуран, толуол, 2бутанон або диметоксіетан. Придатні температури для стадії реакції (аа) складають від температури навколишнього середовища до 100°С, переважно від 35 до 80°С. Особливо переважним варіантом даного способу є спосіб одержання сполук формули І, в яких R1 і R2 означають метил, і R3 означає CF2H, що включає в себе: (аа) взаємодію 6-нітроантранілової кислоти із трет-бутилнітритом і зі сполукою формули С, де R1 і R2 означають метил, з утворенням сполуки формули II, де R1 і R2 означають метил; і а) взаємодію отриманої сполуки з воднем у присутності каталізатора родій/вугілля з утворенням сполуки формули III, де R1 і R2 означають метил; і (b) взаємодію отриманої сполуки з воднем у присутності каталізатора нікелю Ренея з утворенням сполуки формули IV, де R1 і R2 означають метил; і (c) перетворення отриманої сполуки в сполуку формули І у результаті взаємодії зі сполукою формули V, де Q означає гідроксигрупу, і R3 означає CF2H, у присутності активуючого агента, переважно в присутності хлорангідриду біс(2-оксо-3 45 оксазолідиніл)фосфінової кислоти, при цьому реакцію здійснюють у присутності основи, переважно в присутності триетиламіну. Більш переважним варіантом даного способу є спосіб одержання сполук формули І, де R1 і R2 означають метил, і R3 означає CF2H, що включає в себе: (аа) взаємодію 6-нітроантранілової кислоти із трет-бутилнітритом і зі сполукою формули С, де R1 і R2 означають метил, з утворенням сполуки формули II, де R1 і R2 означають метил, при цьому як розчинник використовують диметоксіетан, і а) взаємодію отриманої сполуки з воднем у присутності каталізатора родій/вугілля з утворенням сполуки формули III, де R1 і R2 означають метил, при цьому як розчинник використовують тетрагідрофуран; і (b) взаємодію отриманої сполуки з воднем у присутності каталізатора нікелю Ренея з утворенням сполуки формули IV, де R1 і R2 означають метил, при цьому як розчинник використовують тетрагідрофуран; і (c) перетворення отриманої сполуки на сполуку формули І у результаті взаємодію сполуки формули V, де Q означає гідроксигрупу, і R3 означає CF2H, у присутності хлорангідриду біс(2-оксо-3оксазолідиніл)фосфінової кислоти, при цьому як розчинник використовують дихлорметан і реакцію здійснюють у присутності триетиламіну. Сполуки формули II де R1 і R2 кожний незалежно означають водень або С1-С5-алкіл, є новими й були створені спеціально для здійснення способу відповідно до винаходу. Відповідно даний винахід також стосується сполук формули II, де R1 і R2 кожний незалежно означає водень або С1-С5-алкіл. Особливо переважні сполуки формули II, де R1 і R2 означають метил. Деякі сполуки формули III де R1 і R2 кожний незалежно означають водень або С1-С5-алкіл, є новими й були створені спеціально для здійснення способу відповідно до винаходу. Відповідно даний винахід також стосується сполук формули II, де R1 і R2 кожний незалежно означають водень або С1-С5-алкіл, за винятком 5-амінобензонорборнену. Деякі сполуки формули IV 96425 46 де R1 і R2 кожний незалежно означають водень або С1-С5-алкіл, є новими й були створені спеціально для здійснення способу відповідно до винаходу. Відповідно даний винахід також стосується сполук формули IV, де R1 і R2 кожний незалежно означають водень або С1-С5-алкіл, за винятком 5-амінобензонорборнену. Сполуки формули IIA де R1 і R2 кожний незалежно означають водень або С1-С5-алкіл, є новими й були створені спеціально для здійснення способу відповідно до винаходу. Відповідно даний винахід також стосується сполук формули IIA, де R1 і R2 кожний незалежно означають водень або С1-С5-алкіл. Особливо переважні сполуки формули IIA, де R1 і R2 означають метил. Крім того, сполуки формули І де R1 і R2 кожний незалежно означають водень або С1-С5-алкіл, і R3 означає CF3 або CF2H, також можуть бути отримані з використанням сполук формули VI де L означає С1-С6-алкіленовий ланцюг, і R3 має значення, визначене для формули І, за допомогою d) взаємодії сполуки формули Va 47 96425 де Q1 означає хлор, фтор, бром, йод або С1С6-алкоксигрупу, і R3 має значення, визначене для формули І, зі сполукою формули VII HO-L-OH (VII) де L має значення, визначене для формули VI, з утворенням сполуки формули VI; і e) перетворення отриманої сполуки на сполуку формули І у результаті взаємодії зі сполукою формули IV де R1 і R2 мають значення, які визначені для формули І. У даному способі сполуки формули IV можуть бути отримані як описано вище. Даний винахід також стосується одержання сполук формули І з використанням сполук формули VI і здійснення технологічних стадій (d) і (e). Алкіленові ланцюги у визначеннях замісників сполук формули VI можуть бути нерозгалужен або розгалуженими і являють собою, наприклад, ланцюг метилену або ланцюг етилену, або нерозгалужені або розгалужені С3-С6-алкіленові ланцюги, такі як -СН2-СН2-СН2- як нерозгалужений ланцюг С3-алкілена або -СН2-С(СН3)2-СН2- як розгалужений ланцюг С5-алкілену. Технологічна стадія d): особливо придатними для застосування на технологічній стадії d) є сполуки формули Va, де Q1 означає хлор, фтор, бром або йод, і R3 має значення, визначене для формули І. Особливо переважними є сполуки формули Va, де Q1 означає хлор, і R3 має значення, визначене для формули І. Особливо придатними для застосування на технологічній стадії d) є сполуки формули VII, де L означає етиленовий ланцюг. У реакціях відповідно до винаходу сполуки формули Va використовують, наприклад, в еквімолярних кількостях або в надлишку в порівнянні зі сполуками формули VII, переважно в надлишку до 4-кратного, особливо переважно в 4-кратному надлишку, ще більш переважно в 2-кратному надлишку. Реакцію переважно здійснюють у присутності інертного розчинника. Придатними розчинниками є, наприклад, хлорбензол, дихлорметан, хлороформ, толуол, тетрагідрофуран, діетиловий ефір, бутилметиловий ефір або вода, і їх суміші, при цьому особливо переважним є хлорбензол. Реакцію переважно здійснюють у присутності основи. 48 Придатними основами є, наприклад, амінні основи, такі як, наприклад, триетиламін або піридин; або неорганічні основи, такі як карбонати, наприклад K2СО3 або Na2CO3, або гідроксиди, наприклад NaOH або KOH, при цьому переважні триалкіламіни та особливо переважний триетиламін. Придатні кількості основи для реакції становлять, наприклад, від 1 до 1,5 еквіваленту, головним чином від 1 до 1,2 еквіваленту. Температури зазвичай становлять від 0°С до 150°С, переважним є діапазон температур від 50°С до 100°С і особливо переважний діапазон температур від 60°С до 100°С. Реакція може бути здійснена при атмосферному тиску або при підвищеному тиску, переважним є атмосферний тиск. Час реакції для даної реакції зазвичай становить від 1 до 48 годин, переважно від 1 до 24 годин. Сполуки формули VII комерційно доступні або можуть бути отримані відповідно до відомих способів. Технологічна стадія e): у реакціях відповідно до винаходу сполуки формули IV використовують, наприклад, в еквімолярних кількостях або в надлишку в порівнянні зі сполуками формули VI, переважно в надлишковій кількості до 4-кратні надлишки, особливо переважний 4-кратний надлишок, ще більш переважний 2-кратний надлишок. Реакція може бути здійснена в присутності інертного розчинника. Придатними розчинниками є, наприклад, хлорбензол, дихлорметан, хлороформ, толуол, ксилен, тетрагідрофуран, діетиловий ефір або бутилметиловий ефір, і їх суміші, особливо переважним є хлорбензол. Реакція також може бути здійснена під час відсутності розчинника. Реакцію переважно здійснюють у присутності основи. Придатними основами є, наприклад, амінні основи, такі як, наприклад, триетиламін або піридин; неорганічні основи, такі як карбонати, наприклад K2СО3 або Na2CO3, або гідроксиди, наприклад NaOH або KOH; або алкоксиди, такі як, наприклад, трет-бутоксид калію, переважний, наприклад, трет-бутоксид калію. Придатні кількості основи для реакції становлять, наприклад, від 1 до 1,5 еквіваленту, особливо від 1 до 1,2 еквіваленту. Температури зазвичай становлять від 0°С до 150°С, при цьому переважним є діапазон температур від 50°С до 150°С і особливо переважний діапазон температур від 80°С до 120°С. Реакція може бути здійснена при атмосферному тиску або при підвищеному тиску, при цьому атмосферний тиск є кращим. Час реакції для даної реакції зазвичай становить від 1 до 48 годин, переважно від 1 до 24 годин. Описаний вище спосіб, до якого також ставиться даний винахід, пояснюється з посиланням на наступні приклади. 49 Приклад Ρ12: Одержання 2-(3-дифторметил-1метил-1Н-піразол-4-карбонілоксі)етилового ефіру 3-дифторметил-1-метил-1Н-піразол-4-карбонової кислоти (сполука No. Z4.02): 6,2 г етиленгліколю (0,1 моль, 0,5 еквіваленту), 22,2 г триетиламіну (0,22 ммоль, 1,1 еквіваленти) і 50 мл хлорбензолу додавали при температурі навколишнього середовища до 49% розчину 38,9 г 3дифторметил-1-метил-1Н-піразол-4карбонілхлориду (0,2 моль) у хлорбензолі. Реакційну суміш перемішували протягом 5 годин при 80°С. Додавали воду й органічну фазу екстрагували метилізобутилкетоном. Додавали 7 г активованого вугілля й реакційну суміш фільтрували. Органічну фазу концентрували. Одержували 35,9 г 2-(3дифторметил-1-метил-1Н-піразол-4карбонілокси)етилового ефіру 3-дифторметил-1метил-1Н-піразол-4-карбонової кислоти (вихід: 95%). 1 Н-ЯМР (CDCl3), м.ч.: 7,91 (с, 2Н), 7,06 (т, 2Н), 4,55 (с, 4Н), 3,96 (с, 6Н). Приклад Р13: Одержання (9-ізопропіл-1,2,3,4тетрагідро-1,4-метанонафтален-5-іл)аміду 3дифторметил-1-метил-1Н-піразол-4-карбонової кислоти (сполука No. A.11): 6,9 г 5-амінобензонорборнену (сполука No. Z3.11, відношення син/анти 90:10; 32,8 ммоль, 2,05 еквіваленти) і 1,9 г трет-бутоксиду калію (16 ммоль, 1 еквівалент) додають до розчину 6 г (16 ммоль) 2-(3-дифторметил-1-метил-1Н-піразол-4карбонілокси)етилового ефіру 3-дифторметил-1метил-1Н-піразол-4-карбонової кислоти (сполука No. Z4.02, отримана відповідно до приклада Ρ12) в 60 мл хлорбензолу. Реакційну суміш нагрівали до 95°С і розчинник хлорбензол повністю видаляли у вакуумі. Реакційну суміш нагрівали до 120°С і перемішували протягом 20 годин. Потім додавали 30 мл хлорбензолу. Органічну фазу двічі екстрагува 96425 50 ли водою, спочатку при низькому рН, потім при високому рН. Органічну фазу концентрували відгонкою хлорбензолу. Одержували 8 г (9-ізопропіл1,2,3,4-тетрагідро-1,4-метанонафтален-5-іл)аміду 3-дифторметил-1-метил-1Н-піразол-4-карбонової кислоти у формі масла коричневого кольору (вихід сирого продукту: 51%). Переважні сполуки формули VI перераховані в наступній таблиці. Сполуки формули VI відрізняються доступністю й гарними властивостями, необхідними для обробки і, крім того, є недорогими. Сполуки формули VI де L означає ланцюг С1-С6-алкілену, і R3 означає CF3 або CF2H, є новими й були створені спеціально для здійснення способу відповідно до винаходу. Відповідно даний винахід також стосується сполук формули VI, де L означає ланцюг С1-С6алкілену, і R3 означає CF3 або CF2H. Переважні сполуки формули VI, де L означає ланцюг етилену. Переважні сполуки формули VI, де R3 означає CF2H. Особливо переважні сполуки формули VI, де L означає ланцюг етилену, і R3 означає CF2H. Для переважного подання вказані вище реакції підсумовані на схемі 4. 51 Як вказано вище, винахід у різних аспектах, поряд із іншим, стосується: (1) одержання сполук формули І, виходячи зі сполук формули II, з використанням стадій а), b) і с); (2) одержання сполук формули І, виходячи зі сполук формули II, з І використанням стадій а2), b) і с); (3) одержання сполук формули IV, виходячи зі сполук формули II, з використанням стадій а) і b); 96425 52 (4) одержання сполук формули IV, виходячи зі сполук формули II, з використанням стадій а2) і b); (5) одержання сполук формули І, виходячи зі сполук формули А, з використанням стадій аа), а), b) і с); (6) одержання сполуки формули І, виходячи зі сполук формули А, з використанням стадій аа), а2), b) і с); 53 96425 54 (7) одержання сполук формули І, виходячи зі сполуки формули І, з використанням стадій a), b), d) і e); і (8) одержання сполук формули І, виходячи зі сполуки формули І, з використанням стадій а2), b), d) і e). Винахід також стосується проміжних продуктів для застосування в зазначені вище способах. Даний винахід, крім того, стосується нової кристалічної модифікації (9-ізопропіл-1,2,3,4тетрагідро-1,4-метанонафтален-5-іл)аміду 1-3дифторметил-1-метил-1Н-піразол-4-карбонової кислоти, композицій, що містять вказану сполуку, і їхнього застосування для боротьби із зараженням культурних рослин грибами. (9-ізопропіл-1,2,3,4-тетрагідро-1,4метанонафтален-5-іл)амід 3-дифторметил-1метил-1Н-піразол-4-карбонової кислоти (сполука No. A.11) є ефективним проти ряду захворювань, викликаних фітопатогенними грибами. Вказаний амід являє собою хіральную молекулу, що може зустрічатися в 4 стереоізомерних формах, показаних у вигляді енантіомерів формул А.11 (сині), А.11 (син2), А.11 (антиі) і А.11 (анти2): Відповідно до винаходу «(9-ізопропіл-1,2,3,4тетрагідро-1,4-метанонафтален-5-іл)амід 1-3дифторметил-1-метил-1Н-піразол-4-карбонової кислоти» означає рацемічну суміш сполук формули А.11 (сині) і сполук формули А.11 (син2). Кристалічна речовина (9-ізопропіл-1,2,3,4тетрагідро-1,4-метанонафтален-5-іл)амід 1-3дифторметил-1-метил-1Н-піразол-4-карбонової кислоти, що має одну точку плавлення 110-112°С (чистота діастереомеру: 90%), описана в WO 04/035589. Вказану кристалічну речовину визначають у даному описі як «кристалічна модифікація А» (9-ізопропіл-1,2,3,4-тетрагідро-1,4метанонафтален-5-іл)аміду 1-3-дифторметил-1метил- 1Н-піразол-4-карбонової кислоти. Різні кристалічні модифікації хімічних сполук можуть мати дуже різні фізичні властивості, що може призводити до непередбачених проблем при промисловому одержанні й обробці таких сполук. Характеристики кристалічних модифікацій часто впливають на можливість виділення (фільтрування), можливість перемішування (об'єм кристала), поверхневу активність (піноутворення), швидкість сушіння, розчинність, якість, можливість готування композицій і стабільність при зберіганні й біологічній ефективності, наприклад, фармацевтично активних сполук і сполук, активних при використанні в сільському господарстві. Властивості, пов'язані наприклад зі подрібнюванням і приготуванням препаратів (наприклад гранулюванням) продуктів, можуть бути зовсім різними, залежно від відповідної кристалічної модифікації. Тому що залежно від передбачуваного способу приготування препарату важливими є різні фізичні властивості відповідних продуктів, особливо корисно знайти оптимально придатну кристалічну форму для відповідного способу приготування препарату. Крім того, модифікація може раптово перетворитися на іншу небажану модифікацію в певних термодинамічних умовах. Кількість поліморфних станів непередбачена. Найбільш стабільний полімерний стан може не утворитися, тому що швидкість утворення нових кристалів з розчину може бути дуже низкою. Тому метою даного винаходу є спеціальне одержання нових кристалічних модифікацій (9ізопропіл-1,2,3,4-тетрагідро-1,4-метанонафтален5-іл)аміду 1-3-дифторметил-1-метил-1Н-піразол4-карбонової кислоти з хорошими властивостями відносно готування препарату активного інгредієнта й можливості його зберігання. Даний винахід стосується кристалічної модифікації В (9-ізопропіл-1,2,3,4-тетрагідро-1,4 55 метанонафтален-5-іл)аміду 1-3-дифторметил-1метил-1Н-піразол-4-карбонової кислоти, при цьому вказана кристалічна модифікація характеризується картиною порошкової дифракції рентгенівських променів, вираженою у вигляді міжплощинних відстаней d і відносних інтенсивностей, при цьому вказана картина порошкової дифракції рентгенівських променів містить наступні характеристичні лінії: 13,42 А (сильна), 9,76 А (середня), 6,93 А (середня), 6,74 А (середня), 4,79 А (середня), 4,73 А (середня) і 3,66 А (середня). Картина порошкової дифракції рентгенівських променів була отримана з використанням удосконаленого рентгенівського дифрактометру для дослідження порошків Bruker-AXS D8, джерело: Cu K1. Кристалічна модифікація В відрізняється від кристалічної модифікації А за термодинамічною стабільністю, фізичними параметрами, таким як картина поглинання ІЧ-випромінювання й спектри комбінаційного розсіювання світла, у рентгенівських структурних дослідженнях і по своїй розчинності у воді та інших рідких носіях, зазвичай використовуваних в агрохімічних препаратах. Модифікація В має значні переваги в порівнянні з модифікацією А. Таким чином, наприклад, ДСК, тести на розчинність і інші експерименти показали, що модифікація В несподівано має значно підвищену термодинамічну стабільність, у порівнянні з модифікацією А. Наприклад, розчинність у воді модифікації В нижче, ніж розчинність у воді модифікації А, у відповідних діапазонах температур. У водних дисперсіях поліморф із найбільш низькою розчинністю є найбільш стабільним. Поліморф із більше високою розчинністю є нестабільним, тому що навколишня водна фаза буде наднасиченою у порівнянні з більш стабільним поліморфом, призводячи до розчинення більш нестабільного поліморфу й кристалізації більш стабільного поліморфу. Виникаюча в результаті зміна розмірів частинок може призводити до зміни стабільності утвореної дисперсії. Для фунгіциду особливо важливо, щоб агрохімічний препарат гарантував високу й відтворену стабільність протягом тривалого періоду часу. Вказані неодмінні умови виконують завдяки включенню сполуки (9-ізопропіл-1,2,3,4тетрагідро-1,4-метанонафтален-5-іл)аміду 1-3дифторметил-1-метил-1Н-піразол-4-карбонової кислоти в кристалічній модифікації В, внаслідок високої термодинамічної стабільності вказаної модифікації в порівнянні із кристалічною модифікацією А. Зокрема, це проявляється у твердій дозованій формі агрохімічного препарату. Якщо активний інгредієнт піддається процесу перетворення, то це також може впливати на стабільність твердого препарату. Відповідно агрохімічно активні інгредієнти або їх поліморфні форми, які становлять особливий інтерес для розробки нових активних інгредієнтів, є інгредієнтами, які мають високу стабільність і не мають вказаних вище недоліків. Кристалічна модифікація В задовольняє такі умови. 96425 56 Кристалічну модифікацію В одержували як описані в прикладах Р5, Р6 і Ρ14. Кристалічну модифікацію А одержували як описані в прикладі А4. Кристалічну модифікацію В також можна одержати кристалізацією на запалах із сумішей метанол/вода; зазвичай можна використовувати введення 10% затравки. Наприклад, кристалічну модифікацію В також можна одержати кристалізацією на затравках із суміші 20% вода/метанол. Модифікація В має картину порошкової дифракції рентгенівських променів з характеристичними лініями з міжплощинними відстанями (dзначеннями в ангстремах) 13,42 Å (сильна), 9,76 Å (середня), 6,93 Å (середня), 6,74 Å (середня), 4,79 Å (середня), 4,73 Å (середня) і 3,66 Å (середня) (дивися таблицю 7 або Фіг. 1). Навпроти, модифікація А має картину порошкової дифракції рентгенівських променів з характеристичними лініями з міжплощинними відстанями (dзначеннями) 21,98 Å (середня), 10,81 Å (слабка), 8,79 Å (слабка), 6,51 Å (слабка), 4,65 Å (середня) і 4,20 Å (середня) (дивися таблицю 8 або Фіг. 2). Картини порошкової дифракціїрентгенівських променів одержували, використовуючи вдосконалений рентгенівський дифрактометр для дослідження порошків Bruker-AXS D8, джерело: Cu K1. У спектрі комбінаційного розсіювання світла модифікація В відрізняється від модифікації А за формою й відносною інтенсивністю багатьох смуг (дивися Фіг. 3 і 4). Наприклад, можна використо 57 вувати мікроскоп для дослідження комбінаційного розсіювання Thermo Electron Almega (785 нм, встановлювальні параметри для високого розділення) для реєстрації кожного з спектрів комбінаційного розсіювання світла. Характеристикою модифікації В також є термограма, отримана в ДСК (диференціальна скануюча калориметрія, дивися Фіг. 5). Модифікація В має ендотермічний пік у діапазоні від 120°С до 128°С залежно від чистоти. Наприклад, кристалічна модифікація В в очищеній формі має пік при температурі 128°С і ендотермічний сигнал близько 90 дж/м. Така термограма характерно відрізняється від термограми модифікації А (дивися Фіг. 6), що має ендотермічний пік близько 112°С і ендотермічний сигнал 76 дж/м. Вимірювання здійснювали на ДСК Metier Toledo 820 у закритому тиглі при швидкості нагрівання 10 К/хвилину. Зазвичай кількість зразка становить близько 5 мг. Даний винахід переважно стосується кристалічної модифікації В (9-ізопропіл-1,2,3,4тетрагідро-1,4-метанонафтален-5-іл)аміду 1-3дифторметил-1-метил-1Н-піразол-4-карбонової кислоти, при цьому вказана кристалічна модифікація характеризується картиною порошкової дифракції рентгенівських променів, вираженою в значеннях міжплощинних відстаней d і відносних інтенсивностях, і вказана картина порошкової дифракції рентгенівських променів містить наступні характеристичні лінії: 13,42 Å (сильна), 9,76 Å (середня), 6,93 Å (середня), 6,74 Å (середня), 6,23 Å (слабка), 5,66 Å (середня), 4,84 Å (середня), 4,79 Å (середня), 4,73 Å (середня), 3,98 Å (середня), 3,81 Å (середня) і 3,66 Å (середня). Даний винахід переважно стосується кристалічної модифікації В (9-ізопропіл-1,2,3,4тетрагідро-1,4-метанонафтален-5-іл)аміду 1-3дифторметил-1-метил-1Н-піразол-4-карбонової кислоти, при цьому вказана кристалічна модифікація характеризується картиною порошкової дифракції рентгенівських променів, зображеною на Фіг. 1. Даний винахід переважно стосується кристалічної модифікації В (9-ізопропіл-1,2,3,4тетрагідро-1,4-метанонафтален-5-іл)аміду 1-3дифторметил-1-метил-1Н-піразол-4-карбонової кислоти, при цьому вказана кристалічна модифікація характеризується наявністю на термограмі, отриманій при диференціальній скануючій калориметрії, ендотермічного сигналу з піком у діапазоні від 120°С до 128°С. Даний винахід переважно стосується кристалічної модифікації В (9-ізопропіл-1,2,3,4тетрагідро-1,4-метанонафтален-5-іл)аміду 1-3дифторметил-1-метил-1Н-піразол-4-карбонової кислоти по суті в чистій формі. Відповідно до винаходу термін «по суті чиста» означає присутність переважно щонайменше 75% мас. кристалічної модифікації В (9-ізопропіл-1,2,3,4-тетрагідро1,4-метанонафтален-5-іл)аміду 1-3дифторметил-1-метил-1Н-піразол-4-карбонової кислоти, більш переважно щонайменше 80% мас. Даний винахід переважно стосується кристалічної модифікації В (9-ізопропіл-1,2,3,4тетрагідро-1,4-метанонафтален-5-іл)аміду 1-3 96425 58 дифторметил-1-метил-1Н-піразол-4-карбонової кислоти в чистій формі. Відповідно до винаходу термін «чиста» означає присутність, щонайменше 90% мас. кристалічної модифікації В (9ізопропіл-1,2,3,4-тетрагідро-1,4-метанонафтален5-іл)аміду 1-3-дифторметил-1-метил-1Н-піразол4-карбонової кислоти, більш переважно щонайменше 95% мас, ще більш переважно щонайменше 98% мас. Даний винахід переважно стосується кристалічної модифікації В (9-ізопропіл-1,2,3,4тетрагідро-1,4-метанонафтален-5-іл)аміду 1-3дифторметил-1-метил-1Н-піразол-4-карбонової кислоти у високо чистій формі. Відповідно до винаходу «високо чиста» означає по суті гомогенну кристалічну модифікацію В (9-ізопропіл-1,2,3,4тетрагідро-1,4-метанонафтален-5-іл)аміду 1-3дифторметил-1-метил-1Н-піразол-4-карбонової кислоти. Кристалічну модифікацію В (9-ізопропіл1,2,3,4-тетрагідро-1,4-метанонафтален-5-іл)аміду 1-3-дифторметил-1-метил-1Н-піразол-4карбонової кислоти можна використовувати проти мікроорганізмів, які викликають захворювання корисних рослин, зокрема проти фітопатогенних грибів. Кристалічна модифікація В особливо ефективна проти фітопатогенних грибів, що відносяться до наступних класів: Ascomycetes (наприклад Venturia, Podosphaera, Erysiphe, Monilinia, Mycosphaerella, Uncinula); Basidiomycetes (наприклад рід Hemileia, Rhizoctonia, Phakopsora, Puccinia, Ustilago, Tilletia); недосконалі гриби (також відомі як Deuteromycetes; наприклад Botrytis, Helminthosporium, Rhynchosporium, Fusarium, Septoria, Cercospora, Altemaria, Pyricularia і Pseudocercosporella); Oomycetes (наприклад Phytophthora, Peronospora, Pseudoperonospora, Albugo, Bremia, Pythium, Pseudosclerospora, Plasmopara). Відповідно до винаходу «корисні рослини» зазвичай включають наступні види рослин: насіннєві плодові; кісточкові плодові; виноград; суницю; томати; картоплю; перець; латук; цукровий буряк; арахіс; пшеницю; жито; ячмінь; тритикале; овес; рис; кукурудзу; бавовну; сою; ріпак; зернобобові культури; соняшник; каву; чай; цукрову тростину; банан; овочі, такі як огірки, боби й гарбузи; тютюн; фруктові й декоративні рослини в садівництві й виноградарстві; дернові й газонні рослини. Варто розуміти, що термін «корисні рослини» також включає (1) рослини, яким надана толерантність до гербіцидів, подібних бромоксинілу, або до класів гербіцидів у результаті звичайних способів селекції або генетичної інженерії; (2) рослини, які були трансформовані з використанням технології рекомбінантних ДНК так, що вони здатні синтезувати один або декілька вибірково діючих токсинів, таких як токсини, відомі, наприклад, із продукуючих токсини бактерій, особливо бактерій роду Bacillus; (3) рослини, які були трансформовані з використанням технології рекомбінантних ДНК так, що вони здатні синтезувати речовини проти патогенів, що мають вибіркову дію, такі як, наприклад, так звані «пов'язані з па 59 тогенезом білки»; і (4) рослини, які також можуть мати одну або декілька «особливостей, пов'язаних із продуктивністю» (особливостей, які забезпечують підвищену якість продукту), таких як особливості, які змінюють склад жирних кислот рослини/насіння, наприклад забезпечують змінені рівні олеїнової кислоти і/або стеаринової кислоти, або особливості, які забезпечують одержання промислових продуктів, таких як, наприклад, фармацевтичні засоби (включаючи антитіла), а також промислові ферменти (наприклад фітаза, ксиланаза, глюканаза). Кристалічна модифікація В також ефективна для захисту природних речовин рослинного й/або тваринного походження, їхніх оброблених форм або технічних матеріалів від ураження грибами. Кількість застосовуваної кристалічної модифікації В буде залежати від різних факторів, таких як об'єкт обробки, такий як, наприклад рослини, ґрунт або насіння; тип обробки, такий як, наприклад, розпилення, запилення або протравлювання насіння; ціль обробки, наприклад профілактична або терапевтична; тип грибів, проти якого ведеться боротьба, або час застосування. Кристалічна модифікація В також може бути використана разом з іншими фунгіцидами, бактерицидами, гербіцидами, інсектицидами, засобами проти нематод, засобами проти молюсків або сумішами декількох таких активних інгредієнтів. Кристалічна модифікація В може застосовуватися в будь-якій звичайній формі, наприклад у формі концентрату суспензії (SC), концентрату емульсії (ЕС) або рідкого концентрату для обробки насіння (FS). При використанні кристалічної модифікації В її наносять на корисні рослини, місце їхнього перебування або матеріал для розмноження, зазвичай у вигляді композиції (у звичайній формі), що описана вище. Кристалічну модифікацію В використовують за допомогою обробки грибів, корисних рослин, місць їхнього перебування або матеріалу для розмноження кристалічною модифікацією В. Кристалічну модифікацію В можна використовувати до або після інфекції корисних рослин або матеріалу для розмноження грибами. Розуміють, що термін «місце перебування» корисної рослини у використовуваному в даному описі змісті охоплює місце, на якому корисні рослини вирощують, де висівають матеріал для розмноження корисних рослин, або де матеріал для розмноження корисних рослин буде поміщений у ґрунт. Прикладом такого місця перебування є поле, на якому вирощують хлібні злаки. Розуміють, що термін «матеріал для розмноження рослин» означає генеративні частини рослини, такі як насіння, які можна використовувати для розмноження рослин, і вегетативний матеріал, наприклад черешки або бульби, наприклад картоплі; переважно термін «матеріал для розмноження рослин» означає насіння. Кристалічна модифікація В застосовна для боротьби з наступними хворобами корисних рослин: види Altenaria на фруктах і овочах; види Ascochyta на бобових культурах; Botrytis cinerea на суниці, томатах, соняшнику, бобових культу 96425 60 рах, овочах і винограді, наприклад Botrytis cinerea на винограді; Cercospora arachidicola на арахісі; Cochliobolus sativus на злакових; види Colletotrichum на бобових культурах; види Erysiphe на злакових; такі як Erysiphe graminis на пшениці й Erysiphe graminis на ячмені; Erysiphe cichoracearum і Sphaerotheca fuliginea на гарбузі; види Fusarium на злакових і кукурудзі; Gaumannomyces graminis на злакових і газонних рослинах; види Helminthosporium на кукурудзі, рисі й картоплі; Hemileia vastatrix на кавi; види Microdochium на пшениці й житі; Mycosphaerella frjiensis на бананах; види Phakopsora на сої, такі як Phakopsora pachyrizi на сої; види Puccinia на злакових, широколистих і багаторічних рослинах; такі як Puccinia recondita на пшениці, Puccinia striiformis на пшениці й Puccinia recondita на ячмені; види Pseudocercosporella на злакових, такі як Pseudocercosporella herpotrichoides на пшениці; Phragmidium mucronatum на трояндах; види Podosphaera на фруктових рослинах; види Pyrenophora на ячмені, такі як Pyrenophora teres на ячмені; Pyricularia oryzae на рисі; Ramularia collo-cygni на ячмені; види Rhizoctonia на бавовні, сої, злакових, кукурудзі, картоплі, рисі й газонних травах, такі як Rhizoctonia solani на картоплі, рисі, дернових і бавовні; Rhynchosporium secalis на ячмені, Rhynchosporium secalis на житі; види Sclerotinia на газонних травах, латуку, овочах і ріпаку, такі як Sclerotinia sclerotiorum на ріпаку й Sclerotinia homeocarpa на дернові; види Septoria на злакових, сої й овочах, такі як Septoria tritici на пшениці, Septoria nodorum на пшениці й Septoria glycines на сої; Sphacelotheca reilliana на кукурудзі; види Tilletia на злакові; Uncinula necator, Guignardia bidwellii i Phomopsis viticola на винограді; Urocystis occulta на житі; види Uromyces на бобах; види Ustilago на злакові й кукурудзі; види Venturia на фруктових рослинах, такі як Venturia inequalis на яблуні; види Monilinia на фруктових рослинах; і/або види Penicillium на цитрусові і яблунях. У випадку застосування на корисних рослинах використовувана норма кристалічної модифікації В становить 5-2000 г активного інгредієнта/га, зокрема від 10 до 1000 г активного інгредієнта/га, наприклад 50, 75, 100 або 200 г активного інгредієнта/га; при використанні у формі композиції норма зазвичай перебуває в діапазоні від 20 до 4000 г сумарної композиції на гектар. При використанні для обробки насіння зазвичай достатньо від 0,001 до 50 г кристалічної модифікації В на кг насіння, переважно від 0,01 до 10 г на кг насіння. Даний винахід, крім того, стосується фунгцидної композиції, що містить як активний інгредієнт кристалічну модифікацію В (9-ізопропіл-1,2,3,4тетрагідро-1,4-метанонафтален-5-іл)аміду 1-3дифторметил-1-метил-1Н-піразол-4-карбонової кислоти в ефективній як фунгіцид кількості разом з придатним носієм. Вказані композиції відповідно до винаходу можна застосовувати в будь-якій звичайній формі, наприклад у формі здвоєної упаковки, концентрату суспензії (SC), суспензійної емульсії (SE),
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of amides, intermediates, use thereof and process for the preparation thereof
Автори англійськоюTobler Hans, Walter Harald, Ehrenfreund Josef, Corsi Camilla, Giordano, Fanny, Zeller Martin, Seifert Gottfried, Shah Shailesh C., George Neil, Jones Ian, Bonnett Paul
Назва патенту російськоюСпособ получения амидов (варианты), промежуточные соединения, их применение и способ получения
Автори російськоюТоблер Ханс, Вальтер Харальд, Эренфройнд Йозеф, Корси Камилла, Жиордано Фанни, Целлер Мартин, Зайферт Готтфрид, Шах Шаилеш С., Джордж Нейл, Джоунз Ян, Боннет Пол
МПК / Мітки
МПК: C07C 205/06, A01N 43/26, C07C 211/45, C07D 231/14
Мітки: сполуки, проміжні, варіанти, амідів, застосування, одержання, спосіб
Код посилання
<a href="https://ua.patents.su/37-96425-sposib-oderzhannya-amidiv-varianti-promizhni-spoluki-kh-zastosuvannya-ta-sposib-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання амідів (варіанти), проміжні сполуки, їх застосування та спосіб одержання</a>
Попередній патент: Циклопропіл аміни як модулятори н3 рецепторів гістаміну
Наступний патент: Виділене людське або гуманізоване антитіло, яке специфічно зв’язується з іl-13
Випадковий патент: Спосіб визначення питомої ефективної внутрішньої поверхні пористого електрода суперконденсатора












