1-[3-нітрозо-3-(2-хлороетил)уреїдо]-поліфлуороалкілфосфонати
Номер патенту: 105576
Опубліковано: 25.03.2016
Автори: Кісельова Олена Іванівна, Онисько Петро Петрович, Єленіч Іванна Петрівна, Рассукана Юлія Вікторівна, Замулко Катерина Анатоліївна
Формула / Реферат
1-[3-Нітрозо-3-(2-хлороетил)уреїдо]-поліфлуороалкілфосфонати загальної формули 1:
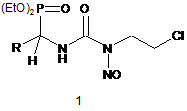 ,
,
де R=CF3, CHF2, CF2Cl, HCF2CF2, H(CF2)4, H(CF2)6.
Текст
Реферат: 1-[3-Нітрозо-3-(2-хлороетил)уреїдо]-поліфлуороалкілфосфонати загальної формули 1: (EtO)2 P R H O O N H N Cl NO 1 . UA 105576 U (54) 1-[3-НІТРОЗО-3-(2-ХЛОРОЕТИЛ)УРЕЇДО]-ПОЛІФЛУОРОАЛКІЛФОСФОНАТИ UA 105576 U UA 105576 U Корисна модель належить до органічної хімії, а саме до нових біологічно перспективних 1-[3нітрозо-3-(2-хлороетил)уреїдо]-поліфлуороалкілфосфонатів загальної формули 1: (EtO)2 P R O O N H H N Cl NO 1 5 10 , де R=CF3, CHF2, CF2Cl, HCF2CF2, H(CF2)4, H(CF2)6 Вказані сполуки, їх властивості і застосування в літературі та патентних виданнях не описані. Сполуки даного типу поєднують в своїй структурі фрагмент α-амінофосфонової кислоти та нітрозосечовини з β-хлороетильним замісником і можуть знайти застосування в дизайні нових ефективних біомедичних препаратів, зокрема антиракових лікарських засобів. Ми припускаємо, що дані речовини мають корисні властивості, які можуть розширити асортимент хімічних сполук для одержання біологічно активних речовин цього напрямку. Найближчим структурним аналогом сполук, які заявляються, є відомий антираковий препарат Фотемустин, що є представником нітрозосечовин третього покоління і знайшов широке застосування для лікування злоякісної меланоми, включаючи церебральні метастази та первинні злоякісні пухлини головного мозку [1]: (EtO)2 P O O H3 C N H H N Cl NO 15 20 25 30 Фотемустин . Описаний в патенті [2] синтез Фотемустину включає реакцію діетил 1-аміноетилфосфонату з 2-хлороетилізоцанатом та наступне нітрозування утвореного діетил 3-(2хлороетил)етилфосфонату. Антиракова активність Фотемустину обумовлена його алкілуючою і карбамоїлуючою дією, а наявність фрагмента фосфоналаніну підвищує ліпофільність і сприяє проникненню через клітинні мембрани і проходженню через гематоенцефалічний бар'єр. Разом з тим, застосування Фотемустину ускладнюється побічними ефектами, вклад яких зростає зі збільшенням дози, тому підвищення його ефективності є надзвичайно актуальною задачею [1]. Відомо, що заміна в молекулі одного або декількох атомів Гідрогену на Флуор, або введення трифлуорометильної групи замість метальної приводить, як правило, до покращення фармакодинамічних та фармакокінетичних характеристик з одночасною зміною електронних, ліпофільних та стеричних параметрів, а також стійкістю до метаболізму [3-5]. З цієї причини синтез селективно флуорованих аналогів біологічно активних сполук є одним із перспективних сучасних підходів до пошуку ефективних біомедичних препаратів. Таким чином, синтез поліфлуорованих аналогів відомого антиракового препарату Фотемустину є особливо важливим, оскільки такі сполуки можуть виявитися більш ефективними біомедичними засобами. Задачею винаходу є пошук нових речовин з потенційною антираковою властивістю, а саме 1-[3-нітрозо-3-(2-хлороетил)уреїдо]-поліфлуороалкілфосфонатів загальної формули 1: (EtO)2 P R H O O N H N Cl NO 35 40 1 , де R=CF3, CHF2, CF2Cl, HCF2CF2, H(CF2)4, H(CF2)6. Спосіб одержання сполук, які заявляються, полягає в тому, що поліфлуоровані амінофосфонати 2а-е вводять в реакцію з комерційно доступним 2-хлороетилізоціанатом в органічному розчиннику, що приводить до утворенням уреїдофосфонатів 3а-е з виходами 7688 %. Реакція уреїдофосфонатів 3а-е з нітритом натрію в безводній мурашиній кислоті 1 UA 105576 U приводить до утворення цільових продуктів 1a-е з виходами 75-83 %, які виділяють звичайними методами. (EtO)2 P O Cl(CH2)2NCO R H NH2 (EtO)2 P R O O N H H Cl N H NaNO2 HCOOH (EtO)2 P R H O O N H Cl N NO 2a-e 1a-e 3a-e 1-3:R=CF3 (а), CHF2 (б), CF2Cl (в), HCF2CF2 (г), H(CF2)4 (д), H(CF2)6 (е) Схема 1 5 10 15 Основою запропонованого підходу є карбамоїлування амінофосфонатів 2 βхлороетилізоціанатом та наступне селективне нітрозування уреїдофосфонатів 3. Метод відкриває ефективний шлях до поліфлуороалкілзаміщених 3-нітрозоуреїдофосфонатів 1, що можуть знайти застосування як біомедичні засоби. Отриманий результат не був заздалегідь передбачуваним, оскільки, по-перше, неочевидною була можливість карбамоїлування флуорованих амінофосфонатів, оскільки електроноакцепторні поліфлуороалкільні замісники зменшують нуклеофільність і реакційну здатність атома Нітрогену амінофосфонатів. По друге, методи синтезу діетил 1аміноетилфосфонату - вихідної сполуки для одержання Фотемустину - неприйнятні для синтезу поліфлуороалкілзаміщених фосфонатів [6, 7], при цьому амінофосфонати 2в-е в літературі та патентних виданнях залишались невідомими. Синтез амінофосфонатів 2а-в здійснено гідруванням імінофосфонатів 4а-в [6] (схема 2): (EtO)2 P O BH3 *Me2S N H ТГФ, -20оС R (EtO)2 P R O NH2 H 2a-в 4a-в 2,4: R=CF3 (а), CHF2 (б), CF2Cl (в) Схема 2 . Діетил α-амінотетрафлуоропропілфосфонати 2г-е одержано за наступною схемою: R OH SOCl2 NHC(O)OCH2Ph 5г-е R Cl (EtO)3P NHC(O)OCH2Ph 6г-е R P(O)(OEt)2 H2, Pd/C 2г-е NHC(O)OCH2Ph 7г-е 5-7: R=HCF2CF2 (г), H(CF2)4 (д), H(CF2)6 (е) Схема 3 20 25 30 . Будова та склад всіх отриманих сполук підтверджується даними ЯМР спектроскопії та елементного аналізу. Винахід пояснюється прикладами одержання амінофосфонатів 2в, г, уреїдофосфонатів 3а-г та цільових сполук 1а-г. Приклад 1 Методика отримання амінофосфонату 2в. До розчину відповідного імідоїлфосфонату (1.00 ммоль) в 2 мл ТГФ при інтенсивному перемішуванні та охолодженні до -20 °C повільно прикапали Me2S•BH3 (2.0 ммоль, 0.23 мл) протягом 30 хв. Реакційну масу витримали при -20 °C 1 годину і повільно довели до кімнатної температури, нейтралізували водним розчином NH4Cl (5 мл) та екстрагували дихлорметаном (3×10 мл). Органічний шар посушили (MgSО 4), випарили у вакуумі. Діетил 1-аміно-2-хлоро-2,2-дифлуороетилфосфонат 2в. 1 3 В'язке масло жовтого кольору; вихід 0.19 г (75 %). Спектр ЯМР Н (CDCl3) δ: 1.35 (т, JHH=7.1 Гц, 6Н, СН3), 1.91 (уш с, 2Н, NH2), 3.60 (ддд, J=19.7, J=13.2, J=6.3 Гц, 1Н, CHP), 4.16-4.28 (м, 4Н, 19 2 2 СН2О) м.ч. Спектр ЯМР F (CDCl3) δ: -55.3 (м, JFAFB=165.7, J=10 Гц, 1F),-59.5 (м, JFBFA=165.7, 31 J=12.6 Гц, 1F) м.ч. Спектр ЯМР P (CDCl3) δ: 16.2-16.7 (м) м.ч. Спектр ІЧ (тонкий шар) νmax: 1065 2 UA 105576 U -1 5 10 15 20 25 30 35 40 45 50 55 (РОС), 1270 (Р=О), 3410 (NH2) см . Обчислено: С 28.64; Н 5.21; N 5.57; Р 12.31. С 6Н13СlF2NO3Р (251.6). Знайдено: С 28.58; Н 5.20; N 5.60; Р 12.29. Приклад 2 Загальна методика одержання сполук 3а-г. До розчину амінофосфонату 2 (1.5ммоль) в 2 мл діетилового етеру при кімнатній температурі додали 1-хлоро-2-ізоціанатоетан (0.16 г, 1.5ммоль). Залишили на ніч. Розчинник випарили, залишок розтерли з петролейним етером. Діетил 1-[3-(2-хлороетил)уреїдо]-2,2,2-трифлуороетилфосфонат 3а. 1 Біла кристалічна сполука; вихід 0.39 г (76 %); Т. топл.=57-58 °C. Спектр ЯМР Н (CDCl3) δ: 3 3 1.30 (т, JHH=7.2 Гц, 3Н, СН3), 1.38 (т, JHH=7.2 Гц, 3Н, СН3), 3.53-3.59 (м, 4Н, СН2СН2), 4.12-4.26 3 (м, 4Н, СН2О), 4.93-5.07 (м, 1Н, СНР), 6.44 (уш с, 1Н, NHCH2), 7.02 (д, JHH=8.0 Гц, 1H, CHNH) 19 31 м.ч. Спектр ЯМР F (CDCl3) δ: -70.2 м.ч. Спектр ЯМР Р (CDCl3) δ: 14.7 м.ч. Спектр ІЧ (КВr) νmax: -1 1060 (РОС), 1260 (Р=О), 3380, 3400 (NH) см . Обчислено: С 32.14; Н 5.08; Сl 10.57; N 8.14; Р 8.91. C9H17ClF3N2O4P (340.7). Знайдено: С 31.73; Н 5.03; Сl 10.41; N 8.22; Р 9.09. Діетил 1-[3-(2-хлороетил)уреїдо]-2,2-дифлуороетилфосфонат 3б. 1 Білий порошок; вихід 0.43 г (88 %); Т. топл.=51-53 °C. Спектр ЯМР Н (CDCl3) δ: 1.30 (т, 3 3 JHH=7.2 Гц, 3Н, СН3), 1.35 (т, JHH=7.2 Гц, 3Н, СН3), 3.52-3.58 (м, 4Н, СН2СН2), 4.19-4.23 (м, 4Н, 2 3 СН2О), 4.67-4.83 (м, 1Н, СНР), 5.94 (тд, JHF=55.0, JHH=6.1 Гц, 1H, CHF2), 6.48 (уш с, 1Н, NHCH2), 3 19 31 6.82 (д, JHH=9.2 Гц, 1Н, CHNH) м.ч. Спектр ЯМР F (CDCl3) δ: -125.0 (м) м.ч. Спектр ЯМР P -1 (CDCl3) δ: 17.9 м.ч. Спектр ІЧ (КВr) νmax: 1055 (РОС), 1260 (Р=О), 3390, 3440 (NH) см . Обчислено: С 33.50; Н 5.62; Сl 10.99; N 8.68; Р 9.60. C 9H18ClF2N2O4P (322.7). Знайдено: С 33.38; Н 5.55; Сl 11.02; N 8.74; Р 9.53. Діетил 2-хлоро-1-[3-(2-хлороетил)уреїдо]-2,2-дифлуороетилфосфонат 3в. 1 Біла кристалічна сполука; вихід 0.46 г (85 %); Т. топл.=90-92 °C. Спектр ЯМР Н (CDCl3) δ: 3 3 1.31 (т, JHH=6.9 Гц, 3Н, СН3), 1.38 (т, JHH=6.9 Гц, 3Н, СН3), 3.55-3.61 (м, 4Н, СН2СН2), 4.12-4.29 3 (м, 4Н, СН2О), 4.99-5.17 (м, 1Н, СНР), 6.58 (уш с, 1Н, NHCH2), 7.17 (д, JHH=10.2 Гц, 1Н, СHNН) 19 2 2 3 м.ч. Спектр ЯМР F (CDCl3) δ: -55.0 (м, JFAFB=165.4 Гц, 1F),-56.5 (м, JFBFA=165.4, JFBH=15.2 Гц, 31 1F) м.ч. Спектр ЯМР Р (CDCl3) δ: 14.9 м.ч. Обчислено: С 30.27; Н 4.80; Сl 19.85; N 7.84; Р 8.67. C9H17Cl2F2N2O4P (357.1). Знайдено: С 30.21; Н 4.78; Сl 19.83; N 7.86; Р 8.64. Діетил 1-[3-(2-хлороетил)уреїдо]-2,2,3,3-тетрафлуоропропілфосфонат 3г. 1 Біла кристалічна сполука; вихід 0.53 г (95 %); Т. топл.=45-47 °C. Спектр ЯМР Н (CDCl3) δ: 3 3 1.33 (т, JHH=7.0 Гц, 3Н, СН3), 1.39 (т, JHH=7.0 Гц, 3Н, СН3), 3.57-3.63 (м, 4Н, СН2СН2), 4.12-4.29 2 3 3 2 3 (м, 4Н, СН2О), 5.02 (м, JHP=21.0, JHF=12.0, JHH=9.5 Гц, 1Н, СНР), 5.96 (м, JHF=53.0, JHFA=7.0, 3 3 JHFB=3.5 Гц, 1Н, CHF2) 6.46 (уш с, 1H, NHСН2), 6.91 (д, JHH=9.5 Гц, 1Н, CHNH) м.ч. Спектр ЯМР 19 2 2 3 F (CDCl3) δ: -122.9 (м, JFAFB=269 Гц, 1F, CFAFB),-125.0 (дд, JFBFA=269, JFBH=12 Гц, 1F, CFAFB),2 2 2 2 136.8 (дд, JFAFB=298, JFAH=53 Гц, 1F, CHFAFB),-142.1 (дд, JFBFA=298, JFBH=53 Гц, 1F, CHFAFB) 31 м.ч. Спектр ЯМР Р (CDCl3) δ: 16.0 м.ч. Обчислено: С 32.23; Н 4.87; Сl 9.51; N 7.52; Р 8.31. C10H18ClF4N2O4P (372.7). Знайдено: С 32.20; Н 4.85; Сl 9.49; N 7.55; Р 8.29. Приклад 3 Загальна методика синтезу сполук 1. До розчину сполуки 3 (1.18ммоль) в 4 мл НСООН при перемішуванні та охолодженні до 5 °C повільно, невеликими порціями, добавили NaNO 2 (0.81 г, 11.8 ммоль). Повільно довели до кімнатної температури і перемішували ще 1.5 години. НСООН випарили (не підігрівати більше 35 °C!). Залишок розчинили в 12 мл СН2Сl2, промили водою (3×3 мл), посушили над MgSO 4, відфільтрували, випарили. Діетил 1-[3-(2-хлороетил)-3-нітрозоуреїдо]-2,2,2-трифлуороетилфосфонат 1а. 1 3 В'язке масло жовтого кольору; вихід 0.33 г (75 %). Спектр ЯМР Н (CDCl3) δ: 1.37 (т, JHH=6.0 3 3 Гц, 3Н, СН3), 1.35 (т, JHH=6.0 Гц, 3Н, СН3), 3.54 (т, JHH=5.0 Гц, 2Н, СН2Сl), 4.18-4.25 (м, 6Н, 3 19 СН2О, NCH2), 5.08-5.21 (м, 1H, СНР), 7.49 (д, JHH=6.4 Гц, 1Н, NH) м.ч. Спектр ЯМР F (CDCl3) δ: 31 -69.6 м.ч. Спектр ЯМР Р (CDCl3) δ: 12.3 м.ч. Спектр ІЧ (тонкий шар) νmax: 1035, 1080 (N-N, -1 РОС), 1255 (P=O), 1540 (N=O), 1730 (C=O), 3020 (NH) см . Обчислено: С 29.82; H 4.32; Сl 9.40; N 11.54; Р 8.42. C9H16ClF3N3O5P (369.7). Знайдено: С 29.24; Н 4.36; Сl 9.59; N 11.37; Р 8.38. Діетил 1-[3-(2-хлороетил)-3-нітрозоуреїдо]-2,2-дифлуороетилфосфонат 1б. 1 3 В'язке масло жовтого кольору; вихід 0.37 г (90 %). Спектр ЯМР Н (CDCl3) δ: 1.34 (т, JHH=6.8 3 3 Гц, 3Н, СН3), 1.35 (т, JHH=6.8 Гц, 3Н, СН3), 3.51 (т, JHH=6.8 Гц, 2Н, СН2Сl), 4.14-4.26 (м, 6Н, 2 3 СН2О, NCH2), 4.85-5.01 (м, 1H, СНР), 6.24 (т, JHF=54.0 Гц, 1H, CHF2), 7.35 (д, JHH=6.0 Гц, 1Н, 19 2 2 3 3 NH) м.ч. Спектр ЯМР F (CDCl3) δ: -124.0 (дддд, JFAFB=285.8, JFAH=57.0, JFAH=30.9, JFAP=9.4 2 2 3 31 Гц, 1F),-127.1 (ддд, JFBFA=285.8, JFBH=57.0, JFBH=30.9 Гц, 1F) м.ч. Спектр ЯМР Р (CDCl3) δ: 15.2 м.ч. Спектр ІЧ (тонкий шар) νmax: 1030, 1080 (N-N, РОС), 1270 (Р=О), 1530 (N=O), 1730 3 UA 105576 U -1 5 10 15 20 25 30 35 40 45 50 55 (С=О), 2980 (NH) см . Обчислено: С 30.74; Н4.87; Сl 10.08; N 11.95; Р 8.85. C 9H17ClF2N3O5P (351.7). Знайдено: С 30.77; Н 4.75; Сl 10.12; N 11.84; Р 8.72. Діетил 2-хлоро-1-[3-(2-хлороетил)-3-нітрозоуреїдо]-2,2-дифлуороетилфосфонат 1в. 1 3 В'язке масло жовтого кольору; вихід 0.38 г (83 %). Спектр ЯМР Н (С6D6) δ: 0.93 (т, JHH=7.1 3 3 Гц, 3Н, СН3), 0.97 (т, JHH=7.1 Гц, 3Н, СН3), 2.92 (т, JHH=6.5 Гц, 2Н, СН2Сl), 3.55-3.66 (м, 2Н, 3 NCH2), 3.83-3.95 (м, 4Н, СН2О), 5.40-5.57 (м, 1Н, СНР), 8.34 (д, JHH=9.3 Гц, 1Н, NH) м.ч. Спектр 19 2 2 3 ЯМР F (C6D6) δ: -53.9 (м, JFAFB=167.9 Гц, 1F),-55.5 (м, JFBFA=167.9, J=15.5 Гц, 1F) м.ч. Спектр 31 ЯМР Р (C6D6) δ: 12.4 м.ч. Спектр ІЧ (тонкий шар) ν max: 1000, 1065 (N-N, РОС), 1280 (Р=О), 1540 -1 (N=O), 1740 (С=О), 3220 (NH) см . Обчислено: С 28.00; Н 4.18; Сl 18.36; N 10.88; Р 8.02. С9Н16Сl2F2N3О5Р (386.1). Знайдено: С 27.93; Н 4.17; Сl 18.362; N 10.85; Р 8.00. Діетил 1-[3-(2-хлороетил)-3-нітрозоуреїдо]-2,2,3,3-тетрафлуоропропілфосфонат 1г. 1 3 В'язке масло жовтого кольору; вихід 0.45 г (95 %). Спектр ЯМР Н (С6D6) δ: 1.06 (т, JHH=7.0 3 3 3 Гц, 3Н, СН3), 1.11 (т, JHH=7.0 Гц, 3Н, СН3), 3.06 (т, JHH=6.0 Гц, 2Н, СН2Сl), 3.73 (м, JHH=6.0 Гц, 2 3 2 2Н, NCH2), 3.98 (м, 4Н, СН2О), 5.66 (м, JHP=21.0, JHF=11.0 Гц, 1Н, СНР), 6.68 (тд, JHF=53.0, 3 3 19 JHF=9.0 Гц, 1Н, CHF2), 7.91 (д, JHH=8 Гц, 1H, CHNH) м.ч. Спектр ЯМР F (C6D6) δ: -121.6 (м, 2 2 2 2 JFAFB=275 Гц, 1F, CFAFB),-125.1 (м, JFBFA=275 Гц, 1F, CFAFB),-137.3 (м, JFAFB=303, JFAH=50 Гц, 2 2 31 1F, CHFAFB),-141.4 (м, JFBFA=303, JFBH=53 Гц, 1F, CHFAFB) м.ч. Спектр ЯМР Р (C6D6) δ: 13.4 м.ч. Обчислено: С 29.90; H 4.27; Сl 8.83; N 10.46; Р 7.71. C10H17ClF4N3O5P (401.7). Знайдено: С 29.87; Н 4.26; Сl 8,84; N 10.44; Р 7.69. Приклад 4 Бензил 1-хлоро-2,2,3,3-тетрафлуоропропілкарбамат 6г. Суміш гідроксикарбамату 5 г (0.82 г, 2.9 ммоль), тіоніл хлориду (3 мл) та краплі ДМФ нагрівали 4 години до припинення виділення НСl. Надлишок SOCl2 випарили у вакуумі. 1 Світло-жовтий порошок; вихід 0.78 г (89 %). Спектр ЯМР Н (CDCl3) δ: 5.20 (с, 2Н, СН2), 5.66 3 2 3 (д, JHH=7.7 Гц, 1Н, NH), 6.09 (дт, JHF=53, JHF=4.8 Гц, 1H, CHF2), 6.20 (м, 1H, CHNH), 7.36 (м, 5Н, 19 2 HPh) м.ч. Спектр ЯМР F (CDCl3) δ: -126.5 (м, CF2),-138.4 (д, JFH=53 Гц, CHF2) м.ч. Обчислено: С 44.09; H 3.36; Сl 11.83; N 4.67. C11H10ClF4NO2 (299.7). Знайдено: С 44.03; Н 3.35; Сl 11.85; N 4.64. Приклад 5 Діетил 1-(бензилоксикарбоніламіно)-2,2,3,3-тетрафлуоропропілфосфонат 7г. Змішали хлорид 6 г (0.73 г, 2.4 mmol) та триетилфосфіт (0.42 мл, 2.4 ммоль) в 5 мл бензолу та залишили при кімнатній температурі на 12 годин. Розчинник випарили у вакуумі, твердий 1 залишок розтерли з петролейним етером. Білий порошок; вихід (92 %). Спектр ЯМР Н (CDCl3) 3 3 δ: 1.28 (т, JHH=7.5 Гц, 3Н, СН3), 1.30 (т, JHH=7.5 Гц, 3Н, СН3), 4.15 (м, 4Н, РОСН2), 4.73 (м, 1H, 2 2 3 СНР), 5.13 (м, JнАнB=12.2 Гц, 1Н, CHAPh), 5.18 (м, JнBнA=12.2 Гц, 1Н, CHBPh), 5.52 (д, JHH=9.8 2 3 3 Гц, 1H, NH), 6.22 (м, JHF=53, JHFA=7.3, JHFB=3.5 Гц, 1H, CHF2), 7.34 (c, 5H, HPh) м.ч. Спектр ЯМР 19 2 2 F (CDCl3) δ: -122.0 (д, JFAFB=269 Гц, 1F, CFAFB),-124.8 (м, JFBFA=269 Гц, 1F, CFAFB),-139.8 (д, 2 2 3I JFAH=53 Гц, 1F, CHFAFB),-139.9 (д, JFBH=53 Гц, 1F, CHFAFB) мл. Спектр ЯМР P (CDCl3) δ: 14.5 м.ч. Обчислено: С 44.90; Н 5.02; N 3.49; Р 7.72. C15H20F4NO5P (401.3). Знайдено: С 44.85; Н 5.00; N 3.47; Р 7.73. Приклад 6 Діетил 1-аміно-2,2,3,3-тетрафлуоропропілфосфонат 2г. До розчину фосфонату 7 (5 г, 10.5 ммоль) в сухому метанолі (10 мл) додали 10 % Pd/C. Суміш перемішували в середовищі водню при атмосферному середовищі протягом 12 годин до припинення поглинання водню. Каталізатор відфільтрували, розчинник випарили. 1 3 В'язке масло жовтого кольору; вихід 2.9 г (71 %). Спектр ЯМР Н (CDCl3) δ: 1.34 (т, JHH=7 Гц, 3 2 3 3Н, СН3), 1.35 (т, JHH=7 Гц, 3Н, СН3), 1.89 (уш с, 2Н, NH2), 3.52 (дт, JHP=19, JHF=15.5 Гц, 1Н, 2 3 13 CHP), 4.20 (м, 4Н, СН2), 6.33 (тт, JHF=53, JHFA=6 Гц, 1H, CHF2) м.ч. Спектр ЯМР С (CDCl3) δ: 3 3 l 2 2 16.29 (д, JCP=5.5 Гц, СН3), 16.32 (д, JCP=5.5 Гц, СН3), 50.7 (ддд, JCP=152, JCFA=27, JCFB=24 Гц, 2 2 l 2 3 CHP), 63.4 (д, JCP=6.5 Гц, СН2), 63.4 (д, JCP=6.5 Гц, СН2), 109.3 (ттд, JCF=250, JCF=32, JCP=4 Гц, l 2 2 19 CHF2), 115.6 (ттд, JCF=252, JCF=26, JCP=4 Гц, CF2CHP) м.ч. Спектр ЯМР F (CDCl3) δ: -124.8 (д, 2 2 2 2 JFAFB=265 Гц, 1F, CFAFB),-126.7 (д, JFBFA=265 Гц, 1F, CFAFB),-138.5 (дд, JFAFB=300, JFAH=53 Гц, 2 2 31 1F, CHFAFB),-139.9 (дд, JFBFA=300, JFBH=53 Гц, 1F, CHFAFB) м.ч. Спектр ЯМР P (CDCl3) δ: 18.2 м.ч. Обчислено: С 31.47; H 5.28; N 5.24; Р 11.59. C7H14F4NO3P (267.2). Знайдено: С 31.45; Н 5.27; N 5.26; Р 11.55. Джерела інформації: 1. Beauchesne P. Fotemustine: a third-generation nitrosourea for the treatment of recurrent malignant gliomas / P. Beauchesne // Cancers. - 2012. - Vol. 4. - P. 77-87. 2. Pat. US 1986/4567169 A USA. Nitrosourea substituted phosphonates and pharmaceutical use: Pat. US 1986/4567169 A USA / G. Lavielle, С Cudennec; publ. 28.01.1986. 4 UA 105576 U 5 10 3. Smart B. E. Fluorine substituent effects (on bioactivity) / В. Е. Smart // Journal of Fluorine Chemistry. - 2001. - Vol. 109. - P. 3-11. 4. Ismail F. M. D. Important fluorinated drugs in experimental and clinical use / F. M. D. Ismail // Journal of Fluorine Chemistry. - 2002. - Vol. 118. - P. 27-33. 5. Filler R. Organic compounds in medicinal chemistry and biomedicinal applications / R. Filler, L. M. Yagupolskii. - Amsterdam: Elsevier, 1993. 6. Rassukana Yu. V. Fluorinated NH-iminophosphonates and iminocarboxylates: novel synthons for the preparation of biorelevant α-aminophosphonates and carboxylates / Yu. V. Rassukana, I. P. Yelenich, A. D. Synytsya, P. P. Onys'ko // Tetrahedron. - 2014. - Vol. 70. - P. 2928-2937. 7. Romanenko V. D. Fluorinated phosphonates: synthesis and biomedical application / V. D. Romanenko, V. P. Kukhar // Chemical Review. - 2006. - Vol. 106. - P. 3868-3935. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 15 1-[3-Нітрозо-3-(2-хлороетил)уреїдо]-поліфлуороалкілфосфонати загальної формули 1: (EtO)2 P R H O O N H N Cl NO 1 , де R=CF3, CHF2, CF2Cl, HCF2CF2, H(CF2)4,H(CF2)6. Комп’ютерна верстка В. Мацело Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 5
ДивитисяДодаткова інформація
Назва патенту англійською1-[3-nitrozo-3-(2-chloroethyl)ureido]-polyfluoroalkylphosphonates
Автори англійськоюOnysko Petro Petrovych, Rassukana Yulia Viktorivna, Kyselova Olena Ivanivna, Yelenich Ivanna Petrivna, Zamulko Kateryna Anatoliivna
Назва патенту російською1-[3-нитрозо-3-(2-хлороэтил)уреидо]-полифлуороалкилфосфонаты
Автори російськоюОнисько Петр Петрович, Рассукана Юлия Викторовна, Киселева Елена Ивановна, Еленич Иванна Петровна, Замулко Екатерина Анатолиевна
МПК / Мітки
МПК: C07F 9/00
Мітки: 1-[3-нітрозо-3-(2-хлороетил)уреїдо]-поліфлуороалкілфосфонати
Код посилання
<a href="https://ua.patents.su/7-105576-1-3-nitrozo-3-2-khloroetiluredo-polifluoroalkilfosfonati.html" target="_blank" rel="follow" title="База патентів України">1-[3-нітрозо-3-(2-хлороетил)уреїдо]-поліфлуороалкілфосфонати</a>
Попередній патент: Спосіб лікування раптової зупинки кровообігу
Наступний патент: Спосіб контактної механічної очистки ран з глибоким рановим каналом
Випадковий патент: Гідродинамічний фільтр











