Кумаринохінолонкарбонові кислоти та спосіб їх одержання
Номер патенту: 45383
Опубліковано: 15.04.2002
Автори: Келнеріч Желйко, Івезіч Зрінка, Полак Льєрка, Трковнік Младен
Формула / Реферат
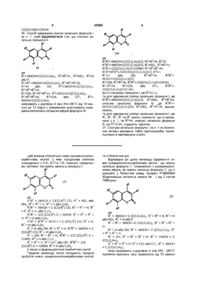
1. Кумаринохінолонкарбонові кислоти, у яких піридонова система знаходиться у 3,4-, 6,7- та 7,8-позиціях кумаринової системи і які мають загальну формулу І
де
R1R2=-NHCH=C(CO2R6)CO, R3=NO2 або NH2, R4=R5=H, R6=H або C2H5;
R1R2=-NHCH=C(CO2R6)CO, R3=R4=H, R5=F, R6=H або C2H5;
R1R2=-CO(CO2R6)C=CHNH, R3=R4=R5=H, R6=H або C2H5;
R1R2=R3R4=-NHCH=C(CO2R6)CO, R5=H, R6=H або C2H5;
R1=H або OH, R2=R5=H, R3R4=-NHCH=C(CO2R6)CO, R6=H або C2H5;
R1=OH, R2=R3=H, R4R5=-CO(CO2R6)C=CHNH, R6=H або C2H5;
R1=R5=H, R2=CH3 або СF3, R3R4=-CО(CO2R6)C=-CHNH=, R6=H або C2H5,
а також їх фармацевтичне прийнятні солі.
2. Сполука загальної формули І за п. 1, яка відрізняється тим, що R1R2=-NHCH=C(CO2C2H5)CO, R3=R4=H, R5=F.
3. Сполука загальної формули І за п. 1, яка відрізняється тим, що R1R2=-CO(CO2C2H5)C=CHNH, R3=R4=R5=H.
4. Сполука загальної формули І за п. 1, яка відрізняється тим, що R1R2=R3=R4=-NHCH=C(CO2C2H5)CO, R5=H.
5. Сполука загальної формули І за п. 1, яка відрізняється тим, що R1=H, R2=R5=H, R3=R4=-NHCH=C(CO2C2H5)CO.
6. Сполука загальної формули І за п. 1, яка відрізняється тим, що R1=OH, R2=R5=H, R3R4=-NHCH=C(CO2C2H5)CO.
7. Сполука загальної формули І за п. 1, яка відрізняється тим, що R1=R5=H, R2=CH3, R3R4=-CO(CO2C2H5)C=CHNH.
8. Сполука загальної формули І за п. 1, яка відрізняється тим, що R1=R5=H, R2=CF3, R3R4=-CO(CO2C2H5)C=CHNH.
9. Сполука загальної формули І за п. 1, яка відрізняється тим, що R1=OH, R2=R3=H, R4R5=- CO(CO2C2H5)C=CHNH.
10. Сполука загальної формули І за п. 1, яка відрізняється тим, що R1R2=-NHCH=C(CO2C2H5)CO, R3=NO2, R4=R5=H.
11. Сполука загальної формули І за п. 1, яка відрізняється тим, що R1R2=-NHCH=C(CO2C2H5)CO, R3=NH2, R4=R5=H.
12. Сполука загальної формули І за п. 1, яка відрізняється тим, що R1R2=-NHCH=C(CO2C2H5)CO, R3=R4=H, R5=F.
13. Сполука загальної формули І за п. 1, яка відрізняється тим, що R1R2=-CO(CO2H)C=CHNH, R3=R4=R5=H.
14. Сполука загальної формули І за п. 1, яка відрізняється тим, що R1R2=R3R4=-NHCH=C(CO2H)CO, R5=H.
15. Сполука загальної формули І за п. 1, яка відрізняється тим, що R1=H, R2=R5=H, R3R4=-NHCH=C(CO2H)CO.
16. Сполука загальної формули І за п. 1, яка відрізняється тим, що R1=OH, R2=R5=H, R3R4=-NHCH=C(CO2H)CO.
17. Сполука загальної формули І за п. 1, яка відрізняється тим, що R1=R5=H, R2=CH3, R3R4=-CО(CO2H)C=CHNH.
18. Сполука загальної формули І за п. 1, яка відрізняється тим, що R1=R5=H, R2=CF3, R3R4=-CО(CO2H)C=CHNH.
19. Сполука загальної формули І за п. 1, яка відрізняється тим, що R1=OH, R2=R3=H, R4R5=-CO(CO2H)C=CHNH.
20. Спосіб одержання сполук загальної формули І за п. 1, який відрізняється тим, що сполуки загальної формули ІІ
де
R1=-NHCH=C(CO2C2H5)2, R2=R4=H, R3=NO2, R5=H або F;
R1=R3=-NHCH=C(CO2C2H5)2, R2=R4=R5=H;
R1=Н або ОН, R3=-NHCH=C(CО2C2H5)2, R2=R4=R5=H;
R1=ОH, R2=R3=R4=H, R5=-NHCH=C(CO2C2H5)2;
R1=R3=R5=H, R2=CH3 або CF3, R4=-NHCH=C(CO2C2H5)2,
нагрівають у даутермі А при 250-260°С від 10 хвилин до 13 годин з утворенням циклізованих кумаринохінолонових складних ефірів формули III
де
R1R2=-NHCH=C(CО2C2H5)СО, R3=R4=H, R5=F;
R1R2=-NHCH=C(CО2C2H5)CO, R3=NO2, R4=R5=H;
R1R2=-CO(CО2C2H5)C=CHNH, R3=R4=R5=H;
R1R2=R3R4=-NHCH=C(CО2C2H5)CO, R5=H;
R1=H або ОН, R2=R5=H, R3R4=-NHCH=C(CО2C2H5)CO;
R1=OH, R2=R3=H, R4R5=-CO(CО2C2H5)C=CHNH;
R1=R5=H, R2=СН3 або СF3, R3R4=-CO(CO2C2H5)C=CHNH,
які є сполуками формули І, де R6=C2H5,
та для одержання сполук загальної формули І, де R1R2=-NHCH=C(CO2C2H5)CO, R3=NH2, R4=R5=H, сполуки загальної формули III, де R1R2=-NHCH=C(CO2C2H5)CO, R3=NO2, R4=R5=H, відновлюють,
та для одержання сполук загальної формули І, де R1, R2, R3, R4 та R5 мають значення, що їх визначено у п. 1, та R6=H, сполуки загальної формули ІІІ, де R6=C2H5, піддають гідролізу.
21. Сполуки загальної формули І за п. 1 як біологічно активні речовини, тобто протимікробні, протипухлинні й противірусні агенти.
Текст
1 Кумаринохшолонкарбонові кислоти, у яких піридонова система знаходиться у 3,4-, 6,7- та 7,8позиціях кумаринової системи і які мають загальну формулу І Де R 1 R 2 =-NHCH=C(CO 2 R 6 )CO, R 3 =NO 2 або NH 2, R 4 =R°=H, R U =H або С 2 Н 5 , R 1 R 2 =-NHCH=C(CO 2 R 6 )CO, R 3 =R 4 =H, R 5 =F, R 6 =H або С 2 Н 5 , R 1 R 2 =-CO(CO 2 R 6 )C=CHNH, R 3 =R 4 =R 5 =H, R 6 =H або C2H5, R 1 R 2 =R 3 R 4 =-NHCH=C(CO 2 R 6 )CO, R 5 =H, R 6 =H або C2H5, R 1 =H або ОН, R 2 =R 5 =H, R 3 R 4 =6 6 NHCH=C(CO 2 R )CO, R =H або С 2 Н 5 , R 1 =OH, R 2 =R 3 =H, R 4 R 5 =-CO(CO 2 R 6 )C=CHNH, R 6 =H або С 2 Н 5 , R 1 =R 5 =H, R 2 =CH 3 або CF 3 , R 3 R 4 =-CO(CO 2 R 6 )C=CHNH=, R 6 = H a 6 o C 2 H 5 , а також їх фармацевтичне прийнятні солі 2 Сполука загальної формули І за п 1, яка відрізняється тим, що R 1 R 2 =-NHCH=C(CO 2 C 2 H 5 )CO, R 3 =R 4 =H, R 5 =F 3 Сполука загальної формули І за п 1, яка відрізняється тим, що R 1 R 2 =-CO(CO 2 C 2 H 5 )C=CHNH, R 3 =R 4 =R 5 =H 4 Сполука загальної формули за п 1 яка відрізняється тим, що R1R2=R3=R4=NHCH=C(CO2C2H5)CO, R5=H 5 Сполука загальної формули I за п 1, яка відрізняється тим, що R1=H, R2=R5=H, R3=R4=NHCH=C(CO2C2H5)CO 6 Сполука загальної формули ІI за п 1, яка відрізняється тим, що R =ОН, R2=R5=H, R3R4=NHCH=C(CO2C2H5)CO 7 Сполука загальної формули І за п 1, яка відрізняється тим, що R1=R5=H, R2=CH3, R R4=CO(CO2C2H5)C=CHNH 8 Сполука загальної формули І за п 1, яка відрізняється тим, що R =R5=H, R2=CF3, R3R4=CO(CO2C2H5)C=CHNH 9 Сполука загальної формули І за п 1, яка відріз2 3 4 5 няється тим, що R =ОН, R =R =H, R R =CO(CO2C2H5)C=CHNH 10 Сполука загальної формули І за п 1, яка відрізняється тим, що R R =-NHCH=C(CO2C2H5)CO, R3=NO2, R4=R5=H 11 Сполука загальної формули І за п 1, яка відрізняється тим, що R R =-NHCH=C(CO2C2H5)CO, 3 4 5 R =NH2, R =R =H 12 Сполука загальної формули І за п 1, яка відрізняється тим, що R R =-NHCH=C(CO2C2H5)CO, R3=R4=H, R5=F 13 Сполука загальної формули І за п 1, яка відрізняється тим, що R1R =-CO(CO2H)C=CHNH, R3=R4=R5=H 14 Сполука загальної формули І за п 1, яка відрізняється тим, що R1R2=R3R4=-NHCH=C(CO2H)CO, R5=H 15 Сполука загальної формули за п 1, яка відрізняється тим, що R1=H, Л — г\ —П, г\ г\ — NHCH=C(CO2H)CO 16 Сполука загальної формули І за п 1, яка відрітс • Я д D D — зняється тим, що R1=OH, R — n — ї ї — Г\ — П, Г\ Г\ — NHCH=C(CO2H)CO 17 Сполука загальної формули І за п 1, яка відріD D— зняється тим, що R1=R =H, R —^LJ — 1^П , К К — CO(CO2H)C=CHNH 18 Сполука загальної формули I за п 1, яка відрізняється тим, що R1=R =H, R 2 =CF 3 , R 3 R 4 =CO(CO2H)C=CHNH 19 Сполука загальної формули за п 1, яка відрізняється тим, що R1=OH, z J 3 О со 00 го ю 45383 CO(CO2H)C=CHNH 20 Спосіб одержання сполук загальної формули І за п 1, який відрізняється тим, що сполуки загальної формули II R 2 Ill Де II Д е R1=-NHCH=C(CO2C2H5)2, R2=R4=H, R3=NO2, R5=H або F R1=R3=-NHCH=C(CO2C2H5)2, R2=R4=R5=H, R1=H або OH, R°=-NHCH=C(CO2C2H5)2, R2=R4=R5=H, R1=OH, R2=R3=R4=H, R5=-NHCH=C(CO2C2H5)2, R1=R3=R5=H, R2=CH3 або CF3, R4=NHCH=C(CO2C2H5)2, нагрівають у даутермі А при 250-260°С від 10 хвилин до 13 годин з утворенням циклізованих кумаринохшолонових складних ефірів формули III Цей винахід стосується нових кумаринхінолонкарбонових кислот, у яких піридонова система знаходиться у 3,4-, 6,7-та 7,8- позиціях кумаринової системи і які мають загальну формулу 1 R2 (1) R1R2=-NHCH=C(CO2C2H5)CO, R3=R4=H, R5=F, R1R2=-NHCH=C(CO2C2H5)CO, R3=NO2, R4=R5=H, R1R2=-CO(CO2C2H5)C=CHNH, R3=R4=R5=H, R1R2=R3R4=-NHCH=C(CO2C2H5)CO R5=H, R1=H або ОН, R2=Re=H, R3R4=NHCH=C(CO2C2H5)CO R1=OH, R ^ R ^ H , R4R^-CO(CO2C2H5)C=CHNH, R1=R5=H, R2=CH3 або CF3, R3R4=CO(CO2C2H5)C=CHNH, які є сполуками формули І, де R6=C2Hs, та для одержання сполук загальної формули І де R1R2=-NHCH=C(CO2C2H5)CO, R3=NH2, R4=R^=H, сполуки загальної формули III, де R1R2=NHCH=C(CO2C2H5)CO, R3=NO2, R4=R5=H, відновлюють, та для одержання сполук загальної формули І, де R1, R2, R , R4 та R5 мають значення, що їх визначено у п 1, та R6=H, сполуки загальної формули III, де R6=C2H5, піддають гідролізу 21 Сполуки загальної формули І за п 1 як біологічно активні речовини, тобто протимікробні, протипухлинні й противірусні агенти та їх біологічна дія ВІДПОВІДНО ДО ЦЬОГО винаходу одержання но вих кумаринхінолонкарбонових кислот, що мають загальну формулу 1, починається з кумаринмалонових ефірів, які мають загальну формулу 2, що м розкрито у Патентній заявці Хорватії Р-960308А (Європейська патентна заявка № ) від 2 липня 1996 року (2) Де R1R2 = -NHCH = C(CO2R6) CO, R3 = NO2 або NH2, R4 = R5 = H, R6 = H або С2Н5, R1R2 = -NHCH = С (CO2R6) CO, R3 = R4 = H, R5 = F, R6 = H, або С2Н5, R1R2 = -CO (CO2R6) С = CHNH, R3 = R4 = R5 = H, R6 = H або С2Н5, R1R2 = R3R4 = -NHCH = С (CO2R6) CO, R6 = H, 5 R = H або С2Н5, R1 = H або OH, R2 = R5 = H, R3R4 = -NHCH = С (CO2R6) CO, R6 = H або С 2 Н 5 , R1 = OH, R2 = R3 = H, R4R5 = -CO (CO2R6) С = CHNH, R 6 = НабоС 2 Н 5 , R1 = R5 = H, R2 = CH 3 або CF3, R3R4 = -CO (CO2R6) С = CHNH, R6 = H або С2Н3, а також їх фармацевтичне прийнятних солей Предмет винаходу також складають процеси здобуття нових кумаринхінолонкарбонових кислот Де R1 = -NHCH = С (СО2С2Н5)2, R2 = R4 = Н, R3 = Н або NO2, R5 = Н або F, R1 = R3 = -NHCH =С (СО2С2Н5)2, R2 = R4 = R5 = Н, R1 = Н або ОН, R3 = -NHCH = С (СО2С2Н5)2, R2 4 = R = R5 = Н, R1 = ОН, R2 = R3 = R4 = Н, R5 = -NHCH = С (СО2С2Н5)2, R1 = R3 = R5 = Н, R2 = СН 3 або CF3, R4 = -NHCH = С (СО2С2Н5)2, котрі нагрівають у даутермі А при 250 - 260°С протягом проміжку часу тривалістю від 10 хвилин 45383 до 13 годин з утворенням циклізованих складних ефірів, що мають загальну формулу З R2 (3) Де R1R2 =-NHCH = С (СО2С2Н5) CO, R3 = R4 = H, R 5 = F, R1R2 = -NHCH = С (CO2C2H5) CO, R3 = NO2, R4 = R5 = H R1R2 = -CO (CO2C2H5) С = CHNH, R3 = R4 = H, R5 = H або F, R1R2 = R3R4 = -NHCH = С (CO2C2H5) CO, R5 = H, R1 = H або ОН, R2 = R5 = H, R4R5 = -NHCH = С (CO2C2H5) CO, R1 = OH, R2 = R3 = H, R4R5 = -CO (CO2C2H5) С = CHNH, R1 = R5 = H, R2 = СНз або CF3, R3R4= -CO (CO2C2H5) С = CHNH Щодо сполуки формули 3, де R1R2 = -CO (СО2С2Н5) С = CHNH, R3 = R4 = H, R5 = H, у D T Connor, P A Young, M von Strandtman, J Heterocychc Chem 18(1981) 697 - 702 прямо говориться, що спроба циклізувати ВІДПОВІДНИЙ кумариномалоновий ефір у складний ефір формули 3 із названими вище замісниками не увінчалася успіхом, таким чином, не вдалося здобути й відповідну кислоту, яка, разом із зазначеним ефіром, що має формулу 3, також є предметом цього винаходу та має загальну формулу 1, де R 1 R 2 = -CO (CO2H) C = CHNH, R3 = R4 = Н, R 5 = H Сполуку, яка має формулу 3 де R1R2 = -NHCH = С (СО2С2Н5) CO, R 3 = R 4 = н, R = Н (що м розкрито раніше у патенті США № 4,210,758 D Т Connor (Warner-Lambert Company)), спочатку нітрують, а потім відновлюють і, нарешті, зливають з діе-тилетоксиметиленмалонатом із утворенням сполуки формули 4 соос 2 н 5 (4) 0 "0 де R = NO2 або NH2 Щоб одержати сполуки, які мають загальну формулу 1, де R 1 R 2 = -NHCH = C(CO2C2H5) CO, R3 = NH2, R4 = R5 = H, сполуки загальної формули З, де R1R2 = -NHCH = С (СО2С2Н5) СО, R3 = NO2, R4 = R5 = Н відновлюють у крижаній оцтовій кислоті під каталізатором - паладієм на активованому вугіллі і у струмені азоту в 3 бари протягом 6 годин Кумаринхінолонкарбонові кислоти, що мають формулу 1, де R1, R2, R3, R4 та R5 мають зазначені вище значення, a R6 = Н, одержують шляхом гідролізу сполук формули З Кумаринхінолонкарбонові кислоти - предмет цього винаходу -, а також їх фармацевтичне прийнятні солі є інгібіторами бактерій штамів, які було досліджено У ході цих досліджень робився експеримент мікророзведення для вивчення сприйнятливості бактерій за методом NCCLS (M7-A2, Vol 10, No 8, 1990, M100-S4, Vol 12, No 20, 1992) У перебігу цих ДОСЛІДІВ для контрольного тесту використовували мікроорганізми S aureus ATCC 29213, Е Faecahs ATCC 29212 та Р aerugmosa ATCC 29213, а також норфлоксацин і енорфлоксацин як ДІЮЧІ стандарти антибіотиків для порівняння Було досліджено такі штами Staphiloc aureus ATCC 6538P, Bacillus subtihs NCTC 8236, Micrococcus flavus ATCC 10240, Preudomonas aerug NCTC 10490, Salmonela Panama 6117, E coh Lac+ 6131, E coh Lac- 6130, b-Haemal, streptococc - В J-22, b-Haemol streptococc - A J-21, Streptococcus pyogenes 20F, Streptococcus faecahs ATCC 8043, E coh ATCC 10536, Staphyloc epidermis ATCC 12228, В cereus AYCC 11778, В pumilus ATCC 8241 та В subtihs ATCC 6633 4,5-діпдро-4,5-дюксо-1Н-[1]бензопірано[4,3Ь]піридин-3-карбонова кислота інгібувала Е coh Lac+6131 та b-Haemol streptococc - A J-21 1,5-діпдро-1,5-дюксо-7-фтор-4Н[1]бензопірано[3,4-Ь]піридин-3-карбонова кислота інгібувала усі штами, що було досліджено 4,7-діпдро-4,7-дюксо-1Н-[1]бензопірано[6,7Ь]тридин-3-карбонова кислота інгібувала Bacillus subtihs NCTC 8236, Streptococcus pyogenes 20F та Streptococcus faecahs ATCC 8043 Кумаринхінолонові кислоти ВІДПОВІДНО ДО ЦЬОГО винаходу та їх фармацевтичне прийнятні солі також було випробувано щодо протипухлинної m vitro дм Протипухлинну дію перевіряли на зростанні клітинних ЛІНІЙ раку молочної залози (MCF7), раку шийки матки (HeLa), раку підшлункової залози (МіаРаСа2), раку гортані (Нер2) та на нормальних фібробластах людини (Hef522) 1,7-діпдро-1,7-дюксо-9-(трифторметил)-4Н[1]бензопірано[6,7-Ь]піридин-3-карбонова кислота інгібувала зростання клітин раку молочної залози (MCF7), раку підшлункової залози (МіаРаСа2) та раку гортані (Нер2) і дещо стимулювала ріст клітин раку шийки матки (HeLa) у більших концентраціях Вона не справляла істотного впливу на зростання фібробластів (Hef522) Зростання MCF7 інгібувалося різною мірою залежно від концентрації Найбільше інгібування досягалося при 10 5 т а 10 8 М При концентраціях від 10 8 до 10 6 М впливу на зростання клітин HeLa не спостерігалося, а більші концентрації (10 5 т а 10 4 М) стимулювали їх ріст Зростання клітин МіаРаСа2 інгібувалося різною мірою залежно від концентрації При концентрації 10 4 М було досягнуто 35%-ве інгібування Речовина, що її тестували, інгібувала зростання клітин Нер2, причому з підвищенням концентрації інгібуюча дія послаблювалась Найкращих результатів було досягнуто при концентраціях від 10Гдо105М Речовина, що її випробували, не справляла будь-якого впливу на зростання нормальних фібробластів (Hef522) Винахід ілюстровано наведеними далі Прикладами, що ніяким чином не можуть тлумачитись 45383 як обмежувальні Приклад 1 Етил-1,5-діпдро-1,5-дюксо-7-фтор-4Н[1]бензопірано[3,4-Ь]піридин-2-карбоксилат о. U) СООС 2 Н 5 Н5С2ООС NH (5) О Розчин діетил-{[(8-фтор-2-оксо-2Н-[1]бензопірано-3-іл)аміно]-метилен}малонату (2,40г, 0,871 ммоль) нагрівали у даутермі А (55мл)протягом 40 хвилин при температурі кипіння До охолодженого розчину додали петролейний ефір з низькою температурою кипіння для сприяння повному випаданню у осад одержаного складного ефіру Одержаний осад етил-1,5-діпдро-1,5дюксо-7-фтор-4Н-[1]-бензопірано[3,4-Ь]піридин-2карбоксилату сіро-коричневого кольору промили спочатку петролейним ефіром, а потім діетиловим ефіром (1,85г, 89%) Т п 288 - 290°САналіз розраховано для C15H10FNO5 С 59,41, Н 3,32, N 4,62 Знайдено С 59,74, Н 2,97, N 4,72 1 Н-ЯМР (DMSO (діметилсульфоксид)-сіб) 5/ррт (і/х) 1,3 (t, СНз), 4,3 (q, CH2), 6,8 - 7,6 ( т , Аг Н), 8,3 (s, РуН), 9,3 (d, NH) Приклад 2 Етил-4,5-діпдро-4,5-дюксо-1Н-[1]бензопірано[3,4-Ь]піридин-3-карбоксилат ,соос 2 н 5 (6) Сполуку було одержано згідно з методом, що його викладено у Прикладі 1, з вихідної речовини діетил-{[(2-оксо-4Н-[1]-бензопірано-3іл)амшо]метилен}малонату (3,96г, 0,012моль) Тривалість реакції 13 годин У результаті було одержано етил-4,5-діпдро-4,5-дюксо-1Н-[1]бензопірано[3,4-Ь]піридин-3-карбоксилат (1,90г, 56%) Аналіз розраховано для C11H15NO5 С 63,16, Н 3,89, N 4,91 Знайдено С 62,98, Н 3,92, N 5,07 1 Н-ЯМР Л Т А (трифтороцтова кислота)) 5 / р р т (і/х) 1,2 (t, СНз), 4,3 (q, СН 2 ), 7,3 - 8,0 ( т , Аг Н), 8,4 (s, Р у Н ) , 11,3(5, NH) Приклад З Діетил-1,5,8-трипдро-1,5,8-триоксо-4,11 Н-[1]бензопірано[3,4-Ь]-[7,6-с] діпіридин- 2,9 - дікарбоксилат о Сполуку було одержано згідно з методом, що його викладено у Приклади, з вихідної речовини тетраетил-{[(2-оксо-2Н-[1]-бензопірано-3,6дмл)діамшо]діметилен}малонату (2,00г, 3,87 моль) Тривалість реакції 50 хвилин Одержаний діетил1,5,8-трипдро-1,5,8-триоксо-4,11 Н-[1]бензопірано[3,4-Ь][7,6-с]діпіридин-2,9дікарбоксилат (речовина коричневого кольору) рекристалізували з абсолютного етанолу (1,43г,87%) Т п 1 7 5 - 1 7 7 ° С Аналіз розраховано для C21H16N2O5 С 59,43, Н 3,80, N 6, 60 Знайдено С 59,72, Н 3,89, N 6,89 1 Н-ЯМР (DMSO (діметилсульфоксид)-сіб) 5/ррт (і/х) 1,3 (2 t, 2 СНз), 4,2 (2 q, 2 СН 2 ), 7 - 10 (т, СН, АгН, РуН), 10,6Ta12,3(2d, 2 NH) Приклад 4 Етил-4,7-діпдро-4,7-дюксо-1Н-[1]бензопірано[6,7-Ь]піридин-3-карбоксилат Н (8) Н5С2 Сполуку було одержано згідно з методом, що його викладено у Прикладі 1, з вихідної речовини діетил-{[(2-оксо-2Н-[1]-бензопірано-3іл)амшо]метилен}малонату (3,10г, 9,357ммоль) Тривалість реакції 45 хвилин Одержаний жовтокоричневого кольору осад етил-4,7-діпдро-4,7дюксо-1Н-[1]-бензопірано[6,7-Ь]піридин-3карбоксилату рекристалізували з N,Nдіметилформаміду (2,23г, 84%) Т п > 300°С Аналіз розраховано для C15H11NO5 С 63,16, Н 3,89, N 4,91 Знайдено С 63,05, Н 3,92, N 4,88 1 Н-ЯМР (DMSO (діметилсульфоксид)^ 6 ) 5/ррт (і/х) 1,3 (t, СНз), 4,2 (q, CH 2 ), 6,5 (d, H8), 7,4 8,0 ( т , Аг Н, Ру Н), 8,4 (d, H9), 10,7 (d, NH) m/z 284 (М), 258, 256, 239, 212, 183, 127, 79 Приклад 5 Етил-4,7-діпдро-4,7-дюксо-3-пдрокси-1Н-[1]бензопірано[6,7-Ь]піридин-3-карбоксилат Н (9) Н5С2ОО Сполуку було одержано згідно з методом, що його викладено у Прикладі 1, з вихідної речовини діетил-{[(3-пдрокси-2-оксо-2Н-[1]-бензопірано-6 45383 І іл)амшо]метилен}малонату (3,63г, 0,011 моль) Тривалість реакції 15 хвилин Внаслідок цього утворився ясно-жовто-коричневого кольору осад етил-4,7-діпдро-4,7-дюксо-3-пдрокси-1Н-[1]бензопірано[6,7-Ь]піридин-3-карбоксилату (3,63 г, 5%) Т п > 300°С Аналіз розраховано для C15H11NO6 С 59,80, Н 3,68, N 4,65 З н а й д е н о С 59,66, Н 3 , 6 1 , N 4,27 1 Н-ЯМР (DMSO (діметилсульфоксид)-сіб) 5 / р р т (і/х) 1,3 (t, СНз) 4,2 (q, CH 2 ), 7,2 - 9,3 ( т , Аг Н, Ру Н), 10,7 (s, ОН), 12,4 (s, NH) m/z 300 ( М ) , 273, 272, 255, 227, 178, 136, 9 1 , 68, 54 Приклад 6 Етил-1,7-діпдро-1,7-дюксо-9-метил-4Н-[1]бензопірано[6,7-Ь]піридин-2-карбоксилат О СНз Н5С2ООС (10) Сполуку було одержано згідно з методом, що його викладено у Прикладі 1, з вихідної речовини діетил-{[(4-метил-2-оксо-2Н-[1]-бензопірано-7іл)амшо]метилен}малонату (5,70г, 0,017моль) Тривалість реакції 10 хвилин У результаті було одержано етил-1,7-діпдро-1,7-дюксо-9-метил-4Н[1]-бензопірано[6,7-Ь]піридин-2-карбоксилат (3,43г, 69%) у вигляді сіро-коричневого осаду Т п > 300°С Аналіз розраховано для C16H13NO5 С 64,21, Н 4,38, N 4,68 Знайдено С 64,36, Н 4,14, N 4,50 1 Н-ЯМР (DMSO (діметилсульфоксид)^є) 5/ррт (і/х) 1,3 (s, СНз), 2,1 (t, CH3), 4,1 (q, CH2), 6,2 (d, Н8), 7,4 (d, Н5), 7,7 (t, НЮ), 10,3 (s, Ру Н), 12,4 (bs, NH) Приклад 7 Етил-4,7-діпдро-4,7-дюксо-9-(трифторметил)1Н-[1]-бензопірано[6,7-Ь]-піридин-2-карбоксилат (11) Сполуку було одержано згідно з методом, що його викладено у Прикладі 1, з вихідної речовини діетил-{[(4-(трифторметил)-2-оксо-2Н-[1]бензопірано-7-іл)аміно]метилен}малонату (2,00г, 0,005моль) Тривалість реакції 15 хвилин У результаті було одержано складний ефір у вигляді ясно-жовтого осаду (1,67г, 94%) Т п > 300°С Аналіз розраховано для C16H10F3NO5 C 54,40, Н 2,85, N 3,97 знайдено С 54,41, Н 2,97, N 3,86 1 Н-ЯМР (DMSO (діметилсульфоксид)^є) 5/ррт (і/х) 1,3 (t, СНз), 4,2 (q, CH2), 7,0 (d, H8), 7,4 (s, Н5), 7,9 (d, НЮ), 8,5 (d, Ру Н), 12,4 (bs, NH) Приклад 8 10 Етил-1,6-діпдро-1,б-дюксо-7-пдрокси-4Н-[1]бензопірано[7,8-Ь]піридин-2-карбоксилат ОН (12) н 5 с 2 оос Сполуку було одержано згідно з методом, що його викладено у Прикладі 1, з вихідної речовини діетил-{[(3-пдрокси-2-оксо-2Н-[1]-бензопірано-8іл)амшо]метилен}малонату (3,15г, 9,070моль) Тривалість реакції 40 хвилин У результаті утворився етил-1,б-діпдро-1,6-дюксо-7-пдрокси-4Н-[1]бензопірано[7,8-Ь]піридин-2-карбоксилат (2,35г, 86%) - речовина жовтогарячо-коричневого кольору Т п > 300°С Аналіз розраховано для C15H11NO6 С 59,80, Н 3,68, N 4,65 Знайдено С 59,45, Н 3,29, N 4,28 1 Н-ЯМР (DMSO (діметилсульфоксид)^є) 5/ррт (і/х) 1,3 (t, СНз), 4,2 (q, CH2), 7,1-8,3 ( т , Аг Н, РуН), 10,4 (s, ОН), 11,8(5, NH) m/z 302 (М+), 171, 155, 141 Приклад 9 Етил-1,5-діпдро-1,5-дюксо-9-нітро-4Я-[1]бензопірано[3,4-Ь]піридин-2-карбоксилат соос 2 н 5 (13) О' 'О До розчину етил-1,5-діпдро-і,5-дюксо-4Н-[1]бензопірано[3,4-Ь]піридин-2-карбоксилату (0,81г, 2,840 ммоль) у концентрованій сірчаній кислоті (3,73г, 0,038моль), охолодженого до 0 - 5°С, при безперервному перемішуванні додали краплями суміш азотної кислоти (d = 1,4, 1,01г, 0,016моль)та концентрованої сірчаної кислоти (1,96г, 0,020 моль) Після ТОГО, ЯК реакційна суміш нагрілася до кімнатної температури, и перемішували ще 10 хвилин, а потім вилили у водно-крижану суміш Одержаний етил-1,5-діпдро-1,5-дюксо-9-нітро-4Н[1]-бензопірано[3,4-Ь]піридин-2-карбоксилат рекристалізували з етанолу (0,89г, 95%) Т п 246 247°С Аналіз розраховано для CisHioN207 С 54,55, Н 3,05, N 8,48 Знайдено С 54,50, Н 2,87, N 8,65 1 Н-ЯМР ЛТА (трифтороцтова кислота)) 5/ррт (і/х) 1,2 (t, СНз), 4,3 (q, CH2), 7,4 (d, H7), 8,3 (d, H8), 9,1 (s, H10), 9,6(5, РуН), 11,3(5, NH) m/z 329 (М), 313, 301, 284, 269, 257, 256, 241, 228, 151 Приклад 10 Етил-1,5-діпдро-1,5-дюксо-9-аміно-4Н-[1]бензопірано[3,4-Ь]піридин-2-карбоксилат 45383 11 COOC2H5 NH (14) "О' О До розчину етил-1,5-діпдро-1,5-діоксо-9-нггро4Н-[1]-бензопірано[3,4-Ь]-піридин-2-карбоксилату (0,50г, 1,514ммоль) у крижаній оцтовій кислоті (150мл) додали каталізатор (4,92% Pd/C, 0,15г), та процес відновлення тривав 6 годин під струменем водню у 3 бари По закінченні реакції оцтову кислоту випарили з реакційної суміші, яку було профільтровано Одержаний амін (0,59г, 100%) рекристалізували з крижаної оцтової кислоти Т п 270 - 272°С Аналіз розраховано для C15H22N2O5XC2H4O2 C 58,18, Н4.28, N8,48 знайдено С 57,94, Н 4,14, N 8,24 1 Н-ЯМР ЛТА (трифтороцтова кислота)) 5/ррт (і/х) 1,3 (t, СНз), 4,4 (q, СН2), 7,4 - 7,8 ( т , Аг Н), 9,2 (т, РуН), 11,3(5, NH) Приклад 11 1,5-діпдро-1,5-дюксо-7-фтор-4Н-[1]бензопірано[3,4-Ь]піридин-2-карбонова кислота соон 12 Розчин етил-4,5-діпдро-4,5-дюксо-4Н-[1]бензопірано[4,3-Ь]піридин-3-карбоксилату (1,90г, 6,661 ммоль) в 1М гідроксиду натрію (50мл) нагрівали протягом 90 хвилин при температурі кипіння, а потім недовго кип'ятили з активованим вугіллям, після чого профільтрували, та фільтрат ацилювали 10%-вим водним розчином соляної кислоти (до рН 2 - 3) з випаданням кислоти у осад (1,54г, 95%) Т п > 300°С Аналіз розраховано для C13H7NO5 С 60,70, Н 2,74, N 5,45 Знайдено С 60,37, Н 2,43, N 5,51 1 Н-ЯМР (DMSO (діметилсульфоксид)-сіб) 5/ррт (і/х) 7,5 (d, H7), 7,8 (t, H9), 8,4 (d, H10), 8,7 (т, Н8, Ру Н), 9,2 (s, NH), 11,3 (s, COOH) m/z 256 (М), 240, 239, 223, 212, 211, 183, 120, 82 Приклад 13 1,5,8-трипдро-1,5,8-триоксо-4,11 Н-[1]бензопірано[3,4-Ь][7,6-с]діпіридин-2,9-дікарбонова д і кислота СООН и (17) ноос І о. (15) Розчин етил-1,5-діпдро-1,5-дюксо-7-фтор-4Н[1]-бензопірано[3,4-Ь]-піридин-2-карбоксилату (1,70г, 5,606ммоль) у 10% водному розчині гідроксиду натрію (22мл) нагрівали протягом 90 хвилин при температурі кипіння, а потім кип'ятили ще близько 5 хвилин з активованим вугіллям У фільтраті кислоту осадили 10%-вим водним розчином соляної кислоти(до рН 2 - 3), та охолоджений розчин залишили на кілька годин при +4°С Одержаний ясно-жовтого кольору осад кислоти (1,50г, 97%) рекристалізували із суміші (1 1) етилацетату/етанолу або з N,Nдіметилформаміду Т п > 300°С Аналіз розраховано для C13H6FNO5 С 56,74, Н 2,20, N 5,09 Знайдено С 56,52, Н 1,84, N 5,11 1 Н-ЯМР ЛТА (трифтороцтова кислота)) 5/ррт (і/х) 7,3 - 7,4 ( т , 3 Аг Н), 8,7 ( т , Ру Н), 9,2 (s, NH), 11,3 (s, СООН) Приклад 12 4,5-діпдро-4,5-дюксо-4Н-[1]-бензопірано[4,3Ь]тридин-3-карбонова кислота .СООН (16) о. О О Сполуку було одержано згідно з методом, що його викладено у Прикладі 12, з вихідної речовини діетил-1,5,8-трипдро-1,5,8-триоксо-4,11 Н-[1]бензопірано[3,4-Ь][7,6-с]діпіридин-2,9дікарбоксилату (0,90г, 121 ммоль) Тривалість реакції 45 хвилин У результаті утворилася кислота речовина жовто-коричневого кольору (0,45г, 58%) Т п > 300°С Аналіз розраховано для С^НзМгОз С 55,44, Н 2,19, N7,61 Знайдено С 55,22, Н 2,58, N 7,50 1 Н-ЯМР (DMSO (діметилсульфоксид)-сіб) 5/ррт (і/х) 7,1 - 9,5 ( т , Аг Н, Ру Н), 12,3 (d, 2 NH), 14,8 (s, СООН), 15,4 (s, COOH) m/z 368 (М+), 341, 264, 256, 213, 198, 188, 156, 137, 129, 91, 81,69 Приклад 14 4,7-діпдро-4,7-дюксо-1Н-[1]-бензопірано[6,7Ь]тридин-3-карбонова кислота (18) НООС Сполуку було одержано згідно з методом, що його викладено у Прикладі 11, з вихідної речовини - етил-4,7-діпдро-4,7-дюксо-1 Н-[1]-бензопірано[6,7Ь]піридин-3-карбоксилату (1,10г, 3,856ммоль) Тривалість реакції 3 години У результаті утворилася кислота у вигляді ясно-жовтого осаду (0,84г, 13 45383 14 85%) Т п > 300°С 5/ррт (і/х) 1,9 (s, СНз), 6,3 (s, H8), 7,6 (d, H5), 8,0 Аналіз розраховано для O13H7NO5 С 60,70, Н (s, H10 9,0 (s, Ру Н), 13,2 (bs, NH), 14,9 (s, COOH) 2,74, N 5,45 Приклад 17 Знайдено С 60,37, Н 2,80, N 5,76 1,7-діпдро-1,7-дюксо-9-(трифторметил)-4Н[1]+ m/z 258 (М ), 254, 249, 213, 151, 138, 125, 109, бензопірано[6,7-Ь]піридин-2-карбонова кислота 98, 74, 62 О CF3 Приклад 15 НООС. 4,7-д1пдро-4,7-дюксо-8-пдрокси-1Н-[1]бензопірано[6,7-Ь]піридин-3-карбонова кислота (21) н (19) ноос О Сполуку було одержано згідно з методом, що його викладено у Прикладі 12, з вихідної речовини етил-4,7-діпдро-4,7-дюксо-8-пдрокси-1Н-[1]бензопірано[6,7-Ь]піридин-3-карбоксилату (2,83г, 9,394ммоль) Тривалість реакції 3 години У результаті було одержано кислоту у вигляді осаду жовтого кольору (2,13г, 83%) Т п > 300°С 1 Н-ЯМР (DMSO (діметилсульфоксид)-сіб) 5/ррт (і/х) 7,6 - 8,7 ( т , Аг Н), 9,4 (s, Ру Н), 13,4 (s, NH), 15,2 (s, COOH) m/z 2 7 3 (M + ), 256, 239, 229, 181, 125, 114, 9 5 , 73 Приклад 16 1,7-діпдро-1,7-дюксо-9-метил-4Н-[1]бензопірано[6,7-Ь]піридин-2-карбонова кислота О Сполуку було одержано згідно з методом, що його викладено у Прикладі 12, з вихідної речовини - етил-1,7-діпдро-1,7-дюксо-9-(трифторметил)-4Н[1]-бензопірано[6,7-Ь]піридин-2-карбоксилату (1,40г, 3,963ммоль) Тривалість реакції 2 години Одержану кислоту рекристалізували з суміші N,Nдіметилформаміду / етанолу (1,28г, 99%) Т п > 300°С Аналіз розраховано для C14H6F3NO5 C 51,70, Н 1,86, N4,31 знайдено С 51,48, Н 1,82, N 4,27 1 Н-ЯМР (DMSO (діметилсульфоксид)-сіб) 5/ррт (і/х) 7,2 (s, H8), 7,8 (s, H5), 8,6 (s, H10), 9,0 (s, Ру Н), 13,4 (bs, NH), 14,5 (bs, COOH) Приклад 18 1,5-діпдро-1,5-діоксо-7-пдрокси-4Н-[1]бензотрано[7,8-Ь]тридин-2-карбонова кислота ,0 Н СНз (22) ноос (20) НООС Сполуку було одержано згідно з методом, що його викладено у Прикладі 11, з вихідної речовини етил-1,7-діпдро-1,7-дюксо-9-метил-4Н-[1]бензопірано[6,7-Ь]піридин-2-карбоксилату (3,40г, 0,011 моль) Тривалість реакції 20 хвилин Одержаний осад сіро-білого кольору рекристалізували з N.N-діметилформаміду (2,32г, 75%) Аналіз розраховано для C14H9KO5XC3H7NO С 59,30, Н4.68, N8,14 знайдено С 59,50, Н 4,61, N 7,81 1 Н-ЯМР (DMSO (діметилсульфоксид)-сіб) Сполуку було одержано згідно з методом, що його викладено у Прикладі 13, з вихідної речовини етил-1,5-діпдро-1,5-дюксо-7-пдрокси-4Н-[1]бензопірано[7,8-Ь]піридин-2-карбоксилату (2,12г, 7,037ммоль) Тривалість реакції 3 години У результаті утворилася кислота -речовина зеленокоричневого кольору (1,27г, 66%) Т п > 300°С 1 Н-ЯМР (DMSO (діметилсульфоксид)-сіб) 5/ррт (і/х) 7,1 - 7,8 ( т , Аг Н, Ру Н), 8,6 (s, OH), 10,6 (s, NH), 15,2 (s, COOH) + m/z 273 (М ), 212, 179, 81, 79, 61, 59, 45, 43 ДП «Український інститут промислової власності» (Укрпатент) вул Сім'ї Хохлових, 15, м Київ, 04119, Україна (044)456-20- 90 ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)216-32-71
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A61K 31/435, C07D 491/14, C07D 411/00, A61P 31/04, C07D 491/147, A61P 31/12, C07D 491/052, A61K 31/47, A61P 35/00
Мітки: кислоти, спосіб, одержання, кумаринохінолонкарбонові
Код посилання
<a href="https://ua.patents.su/7-45383-kumarinokhinolonkarbonovi-kisloti-ta-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Кумаринохінолонкарбонові кислоти та спосіб їх одержання</a>
Попередній патент: 14,17-с2-місточкові стероїди та фармацевтична композиція з гестагенною дією
Наступний патент: Пристрій для затиску тонкостінних деталей
Випадковий патент: Гепатопротекторний засіб для профілактики та лікування токсичного медикаментозного гепатиту, викликаного туберкулостатиками, на основі кверцетину