Спосіб одержання 5-арил-4-арилтіо-1,3,4,5-тетрагідро-2н-1-бензазепін-2-онів
Номер патенту: 72170
Опубліковано: 10.08.2012
Автори: Вовк Михайло Володимирович, Цизорик Назар Михайлович, Васькевич Алла Іржіївна
Формула / Реферат
Спосіб одержання 5-арил-4-арилтіо-1,3,4,5-тетрагідро-2Н-1-бензазепін-2-онів загальної формули :
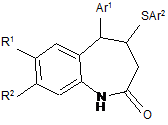 ,
,
де R1 = R2 =МеО; R1R2 = OСН2О; Аr1 = Ph, 4-FC6H4; Аr2 = Ph, 4-MeC6H4,
який відрізняється тим, що N-ариламіди стирилоцтових кислот, які містять сильнодонорні замісники в мета-положенні ароматичного циклу, піддають взаємодії із арилсульфенілхлоридами в оцтовій кислоті при кімнатній температурі в присутності перхлорату літію з подальшим виділенням цільових продуктів звичайними методами.
Текст
Реферат: UA 72170 U UA 72170 U Корисна модель належить до органічної хімії, а саме до способу одержання нових похідних гетероциклічної системи 1,3,4,5-тетрагідро-2H-1-бензазепін-2-ону загальної формули: Ar1 SAr2 R1 R2 5 10 N H 1 2 O 1 , 2 1 2 де R = R =МеО; R R =OCH2O; Аr = Ph, 4-FC6H4; Аr = Ph, 4-MeC6H4. Сполуки такого типу можуть знайти застосування як біоактивні речовини, а також як ключові об'єкти для раціонального дизайну систем із вираженою фармакологічною дією. Названі сполуки, їх властивості та застосування в науковій літературі та патентних виданнях не описані. Найближчими структурними аналогами сполук, які заявляються, є заміщені 1,3,4,5тетрагідро-2H-1-бензазепін-2-ону загальної формули: R3 R2 R4 N O R1 15 20 25 30 35 40 , 1 2 3 де, R = i-Pr, CH2C(O)Alk(Ar), CH2C(O)NHAlk(Ar); R =H, CH2C(O)OAlk, NHC(O)NHAr; R =Ar, 4 OH, C(O)OH; R = H, Cl. Наведені вище полізаміщені частково гідровані 2Н-1-бензазепін-2-они представляють групу сполук із різноманітними і часто дуже важливими фармакологічними властивостями. Нещодавні дослідження показали, що деякі 5-гідроксі-N-ароїлзаміщені бензазепіни можуть виступати в ролі рецепторів антагоністів вазопресину і тим самим бути перспективними для лікування серцевосудинних захворювань [1]. Зокрема, представник цієї групи сполук препарат «толваптан» із 2009 р використовується для лікування гіпонатермії [2]. Серед 1-карбамоїлметил-5гідрокситетрагідро-бензазепін-2-онів виявлені нові селективні інтегрін V3 -антагоністи, які можуть знайти застосування при лікуванні ревматичних артритів, діабетичної ретинопатії, остеропорозу та гострої ниркової недостатності [3]. Низка 1,3,5-тризаміщених бензазепін-2-онів проявила здатність до інгібування сквален синтази, що робить їх безпечними та активними при лікуванні гіперліпідемії [4]. Варто також зазначити, що серія 5-феніл-3-уреїдобензазепін-2-онів зарекомендувала себе ефективними антагоністами рецепторів холецистокініну-В (ССК-В), які є важливими терапевтичними мішенями для виявлення зв'язку між панічними розладами та тривогою [5]. Незважаючи на широкий спектр фармакологічної дії заміщених тетрагідробензазепін-2-онів, описані в літературі методи їх синтезу є багатостадійними (9-11 стадій) і, як правило, ґрунтуються на низці послідовних перетворень важкодоступних похідних антранілової кислоти [3], або оксимів 4-арил-1-тетралону [4-6] і на проміжних стадіях включають використання важкодоступних, дорогих та високотоксичних реагентів. При цьому очищення проміжних та цільових продуктів, як правило, здійснюється за допомогою колонкової хроматографії, що суттєво звужує їх препаративні можливості. Саме тому актуальною проблемою є створення препаративно простих методологій отримання нових типів частково гідрованих бензазепінонових систем, зокрема і тих, які містять схильні до різноманітних модифікацій функціональні замісники в положенні 4 азепінового циклу. Задачею корисної моделі є спосіб одержання нових 1,3,4,5-тетрагідро-2H-1-бензазепін-2онів загальної формули: 1 UA 72170 U Ar1 SAr2 R1 R2 N H 1 5 2 O 1 , 2 1 2 де R = R =MeO; R R =OCH2O; АR = Ph, 4-FC6H4; Аr = Ph, 4-MeC6H4. Спосіб одержання сполук, які заявляються, зводиться до того, що N-ариламіди стирилоцтових кислот, котрі містять сильнодонорні замісники в мета-положенні ароматичного циклу, піддають взаємодії із арилсульфеніл-хлоридами в оцтовій кислоті при кімнатній температурі в присутності перхлорату літію. Виходи цільових продуктів, які виділяють стандартними методами, сягають 51-82 %. Ar1 Ar1 Ar2 H N Ar2SCl O R2 S H N S Ar1 + LiClO4 ClO4 R2 R1 O R1 R1 10 1 15 20 25 30 N H R2 2 1 2 1 Ar2 O , 2 де R = R =MeO; R R =OCH2O; АR = Ph, 4-FC6H4; Ar - Ph, 4-MeC6H4. Знайдена реакція, найочевидніше, реалізується за раніше невідомою схемою електрофільної внутрішньомолекулярної циклізації N-ариламідів стирилоцтових кислот, яка грунтується на використанні N-арильних замісників в ролі С-нуклеофільних складових і є втіленням ефективного одностадійного варіанта синтезу нових похідних 1,3,4,5-тетрагідро-2H-1бензазепін-2-ону. Останні, завдяки функціоналізації азепінового циклу схильною до окиснення арилсульфанільною групою, можуть знайти практичне використання в ролі ключових сполук для дизайну потенційних фармацевтичних препаратів. Отриманий експериментальний результат заздалегідь був важко передбачуваним, оскільки в ролі нуклеофільного центру такого роду електрофільної внутрішньомолекулярної циклізації виступає активоване донорними замісниками фенільне ядро. Сам процес утворення азепінового циклу, найвірогідніше, здійснюється за правилом Марковнікова через стадію проміжного сульфенового катіона, стабілізованого перхлорат-аніоном. Враховуючи закономірності електрофільної циклізації амідів ненасичених карбонових кислот [7], найбільш достовірним видавалось формування циклічних продуктів за рахунок атаки сульфенового катіона як на атом азоту, так і на атом кисню амідної групи, що б приводило до структур лактамного або лактонового типів. В разі ж участі в такому процесі фенільного циклу не виключалась і можливість перебігу реакції проти правила Марковнікова і утворення тетрагідрохінолонів, екзофункціоналізованих арилсульфанілметильними замісниками. Ar2S Ar1 SAr2 Ar2S Ar1 N O R2 Ar1 O O R1 R1 R2 2 N O UA 72170 U 5 Для знайденої реакції характерна висока реrіо- та стереоселективність, свідченням чого є високий вихід цільових продуктів, які утворюються у вигляді одного діастереомера. Такий результат, очевидно, зумовлений сольовим ефектом «допінг-добавки» [8,9] перхлорату літію. Будова та склад отриманих сполук встановлені елементним аналізом, ІЧ-спектрами, 1 13 спектрами ЯМР H та С, а також на прикладі 7,8-диметокси-4-[(4-толіл)тіо]-5-феніл-1,3,4,5тетрагідро-2Н-1-бензазепін-2-ону - рентгеноструктурним дослідженням. Корисна модель ілюструється загальним методом одержання 5-арил-4-арилтіо-1,3,4,5тетрагідро-2Н-1-бензазепін-2-онів та фізико-хімічними характеристиками всіх синтезованих сполук. 10 15 20 25 30 35 Загальний вигляд молекули 7,8-диметокси-4-[(4-толіл)тіо]-5-феніл-1,3,4,5-тетрагідро-2H-1бензазепін-2-ону. Загальний спосіб одержання 4-арилтіо-5-феніл-1,3,4,5-тетрагідро-2/7-1-бензазепін-2-онів. До розчину 1 ммоль відповідного аміду стирилоцтової кислоти в 5 мл оцтової кислоти додавали 0,11 г (1,05 ммоль) перхлорату літію в 5 мл оцтової кислоти, а потім при перемішуванні по краплях розчин 1,05 ммоль арилсульфенілхлориду в 4 мл оцтової кислоти. Реакційну суміш перемішували при кімнатній температурі 3 год. Розчинник упарювали, до залишку додавали 10 мл хлороформу і фільтрували, фільтрат упарювали, залишок кристалізували із діетилового етеру. Приклад 1 7,8-Диметокси-5-феніл-4-(фенілтіо)-1,3,4,5-тетрагідро-2H-1-бензазепін-2-он. Вихід 67 %, -1 1 т.топл. 145 °С. ІЧ спектр, см : 1670, 1515, 1265, 1220. Спектр ЯМР Н, , м.ч.: 2.56-2.62м (1Н, СН), 2.67-2.74м (1Н, СН), 3.64с (3Н, ОСН3), 3.84с (3Н, ОСН3), 4.22-4.27м (2Н, 2СН), 6.38с (1НАr), 13 3 5 6.54с (1HAr), 7.23-7.45м (10НАr), 7.63с (1Н, NH). Спектр ЯМР С, , м.ч.: 38.36 (С ), 51.03 (С ), 4 O-CH O-CH 9 6 53.54 (С ), 56.04 (С 3), 56.15 (С 3), 106.12 (С ), 113.18 (С ), 126.71, 127.34, 127.78, 128.45, 2 128.74, 129.11, 130.05, 133.34, 134.04, 139.98, 146.64, 148.51 (С Аr), 171.58 (С ). Знайдено, %: С + 71.02; Η 5.70; N 3.42; S 7.98. М 406. C24H23NO3S. Вирахувано, %: 71.08; Η 5.72; Ν 3.45; S 7.91. Μ 405.5. Приклад 2 7,8-Диметокси-4-[(4-метилфеніл)тіо]-5-феніл-1,3,4,5-тетрагідро-2H-1-бензазепін-2-он. Вихід -1 1 78 %, т.топл. 216-217 °С. ІЧ спектр, см : 1675-1680, 1510, 1220. Спектр ЯМР H, , м.ч.: 2.262.32м (4Н, СН3+СН), 2.52-2.57м (1Н, СН), 3.50с (3Н, ОСН3), 3.71с (3Н, ОСН3), 4.08д (1Н, СН, J 10 Гц), 4.37-4.43м (1Н, СН), 6.34с (1НAr), 6.65С (1НАr), 7.16Д (2HAr, J 8 Гц), 7.31д (2HAr, J 8 Гц), 7.3413 3 5 7.40м (5НАr), 9.54с (1Н, NH). Спектр ЯМР С, , м.ч.: 20.46 (СН3), 38.17 (С ), 50.45 (С ), 52.31 4 O-CH O-CH 6 9 (С ), 55.55 (С 3), 55.68 (С 3), 106.46 (С ), 113.52 (С ), 125.61, 126.88, 128.43, 128.45, 129.64, 2 130.31, 131.34, 132.32, 136.89, 140.34, 145.28, 147.93 (С Аr), 169.95 (С ). Знайдено, %: С 71.64; Η + 6.09; Ν 3.39; S 7.57. M 420. C24H23NO3S. Вирахувано, %: 71.57; Η 6.01; Ν 3.34; S 7.64. Μ 419.5. 3 UA 72170 U 5 10 15 20 25 30 35 40 45 50 55 Приклад 3 7,8-Диметокси-4-(фенілтіо)-5-(4-фторофеніл)-1,3,4,5-тетрагідро-2H-1-бензазепін-2-он. Вихід -1 1 82 %, т.топл. 161 °С. ІЧ спектр, см : 1680, 1515, 1225. Спектр ЯМР H, , м.ч.: 2.29-2.35м (1Н, СН), 2.58-2.63м (1H, СН), 3.53с (3Н, ОСН3), 3.73с (3Н, ОСН3), 4.13д (1Н, СН, J 10.5 Гц), 4.494.53м (1Н, СН), 6.34с (1НАr), 6.68с (1НАr), 7.20т (2HAr, J 8.5 Гц), 7.24-7.29м (1НАr), 7.33т (2HAr, J 7 13 3 Гц), 7.39д (2HAr, J 7 Гц), 7.42-7.46м (2НАr), 9.57с (1Н, NH). Спектр ЯМР С, , м.ч.: 30.85 (С ), 5 4 O-CH O-CH 6 9 50.38 (С ), 52.70 (С ), 56.14 (С 3), 56.31 (С 3), 107.35 (С ), 114.10 (С ), 115.51, 115.80, 126.02, 127.54, 129.61, 130.92, 130.97, 131.95, 134.69, 136.96, 136.98, 145.97, 148.63 (С Аг), 2 + 161.61д (Capом.-F J 243.9); 170.45 (С ). Знайдено, %: С 68.11; Η 5.27; Ν 3.37; S 7.50. M 424. C24H22FNO3S. Вирахувано, %: 68.07; Η 5.24; Ν 3.31; S 7.57. Μ 423.5. Приклад 4 7,8-Диметокси-4-[4-(метилфеніл)тіо]-5-(4-фторофеніл)-1,3,4,5-тетрагідро-2H-1-бензазепін-2-1 1 он. Вихід 71 %, т.топл. 141-142 °С. ІЧ спектр, см : 1680, 1515, 1220-1225. Спектр ЯМР H, , м.ч.: 2.25-2.31м (4Н, СН3+СН), 2.51-2.57м (1H, СН), 3.52с (3Н, ОСН3), 3.72с (3Н, ОСН3), 4.09д (1Н, СН, J 9.5 Гц), 4.36-4.41м (1Н, СН), 6.33с (1НАr), 6.66с (1НАr), 7.15д (2HAr, J 8 Гц), 7.19т (2НАr, J 9 Гц), 13 7.30д (2HAr, J 8 Гц), 7.39-7.44м (2НАr), 9.54с (1Н, NH). Спектр ЯМР С, , м.ч.: 21.05с (СН3); 38.77 3 5 4 O-CH O-CH 6 9 (С ), 50.44 (С ), 53.35 (С ), 56.21 (С 3), 56.31 (С 3), 107.30 (С ), 114.18 (С ), 115.55, 115.72, 126.07, 130.30, 130.81, 130.93, 131.91, 132.97, 137.06, 137.52, 145.94, 148.60 (САr), 161.59д 2 + (Capом.-F J 242.7); 170.48 (С ). Знайдено, %: С 68.71; Η 5.48; Ν 3.21; S 7.28. M 438. C25H24FNO3S. Вирахувано, %: 68.63; Η 5.53; Ν 3.20; S 7.33. Μ 437.5. Приклад 5 7,8-Діоксиметилен-5-феніл-4-(фенілтіо)-1,3,4,5-тетрагідро-2Н-1-бензазепін-2-он. Вихід 51 %, -1 1 т.топл. 224-225 °С. ІЧ спектр, см : 1670, 1500, 1475-1480, 1215. Спектр ЯМР H, , м.ч.: 2.552.61м (1Н, СН), 2.68-2.75м (1Н, СН), 4.18-4.28м (2Н, 2СН), 5.91д (2Н, СН2, J 7.2 Гц), 6.36с (1НАr), 13 3 5 6.55с (1НАr), 7.24-7.45м (10НАr), 7.91с (1Н, NH). Спектр ЯМР С, , м.ч.: 38.03 (С ), 52.42 (С ), 4 10 7 52.27 (С ), 102.54(СН2), 105.15 (С ), 109.82 (С ), 125.59, 127.16, 129.27, 129.43, 130.14, 131.32, 2 132.15, 132.60, 1387.25, 141.02, 143.98, 146.77 (С Аr), 170.14 (С ).3найдено, %: С 71.02; Η 4.99; Ν + 3.51; S 8.30. M 390. C23H19NO3S. Вирахувано, %: 70.93; Η 4.92; Ν 3.60; S 8.23. Μ 389.5. Приклад 6 7,8-Діоксиметилен-5-феніл-4-[(4-метилфеніл)тіо]-1,3,4,5-тетрагідро-2Н-1-бензазепін-2-он. -1 1 Вихід 56%, т.топл. 222-223 °С. ІЧ спектр, см : 1675, 1500, 1480, 1210. Спектр ЯМР H, , м.ч.: 2.21-2.30м (4Н, СН3+СН), 2.53-2.61м (1Н, СН), 4.03д (1Н, СН, J 10.4 Гц), 4.38-4.46м (1Н, СН), 5.95д (2Н, СН2, J 5.6 Гц), 6.20с (1НАг), 6.61с (1НАr), 7.15д (2HAr, J 7.6 Гц), 7.28-7.38м (7НАr), 9.51с 13 3 5 4 (1Н, NH). Спектр ЯМР С, , м.ч.: 21.08 (СН3), 38.41 (С ), 51.00 (С ), 53.19 (С ), 101.87 (СН2), 10 7 103.70 (С ), 109.12 (С ), 127.59, 127.85, 129.07, 129.18, 130.27, 130.86, 132.75, 132.84, 137.45, 2 + 140.42, 144.52, 146.65 (CAr), 170.52 (С ). Знайдено, %: С 71.51; Η 5.20; Ν 3.35; S 7.91. Μ 404. C24H21NO3S. Вирахувано, %: 71.44; Η 5.25; Ν 3.47; S 7.95. Μ 403.5. Література 1. Kando Κ., Ogawa Η., Shinihara Т., Kurimuta Η., Tonada Υ., Κοη Κ., Yomoshita M., Nakonuta S., Hirano Т., Yamanura Y., Mori I., Tamigata M., Itai A. Novel design nonpeptide AVP V2 receptor agonists : structural requirement for an agonist having l-(4-amonobenzoyl)-2,3,4,5-tetrahydro-Ш-1benzazepine as template.// J. Med. Chem.- 2000.-Vol.43, № 23.- P. 4388-4397. 2. Shoat S.E., Elizari M., Wang Zh., Sekar K., Grinfelg R.R., Borbagelata N.A., Lerman J., Braner S.L., Tronge J., Orlandi G. Tolvaptan administration does not affects steady state amilodatone concentrations in patients with cardiac arrytmies // J. Cardiovascular Pharmacology and Therapeutics.- 2005.- Vol.10, №3.. P. 165-171. 3. Kling Α., Backfisch G., Delzer J., Geneste H., Graef C, Hornber;ger W., Lange U.E.W., Lauterbach Α., Seits W., Subkowski T. Design and synthesis of 1,5- and 2,5-substituted tetrahedrobenzazepinones as novel potent and selective Integrin ανβ3 antalgonists // Bioorg. Med. Chem.-2003.- Vol.11.-№7.-P.1319-1342. 4. Miki Т., Kori M., Fugishima Α., Mabuchi H., Tozawa H., Nakmura M., Sugiayama Y., Yukimasa H. Syntheses of fused heterocyclic compounds and their inhibitory activities for squalene synthese // Bioorg. Med. Chem.-2002.-Vol.10, № 2.- P. 385-400. 5. Lowe J.A., Hageman D.L., Drozda S.E., McLean S., Bryce D.K., Crawford R.T., Zorn S., Morrone J., Bordner J. 5-Phenyl-3-ureidobenzazepin-2-jnes as Cholecystokinin-B receptor antagonists // J. Med. Chem.- 1994.- Vol.37, №22.-P.3789-3811. 6. Goerdo-Vargas Α., Quiclet-Sire В., Zard S.Z. A flexible approach for the preparation of substituted benzazepines: application to the synthesis of tolvaptan // Bioorg. Med. Chem.-2006.-Vol. 14, №18.- P.6165-6173. 4 UA 72170 U 5 7. Robin S., Rousseau G. Electrophilic cyclization of unsatureted amides // Tetrahedron.- 1998.Vol. 54.-№ 13681-13736. 8. Зефиров H.C., Смит В.А., Бодриков И.В., Кример М.З. Механизм присоединения сульфенилгалогенидов к олефинам и свойства стабильных ионов эписульфония. Роль ковалентных интермедиатов и ионных пар для разных условий проведения реакций // ДАН СССР.-1978.-Т. 240, №4.-С. 858-861. 9. Кример М.З., Смит В.А., Шамшурин А.А. Двустадийная схема присоединения серосодержащих электрофилов. Реакция метилсульфенилборфторида с циклогексеном // ДАН СССР.- 1973.-Т.208, № 4.- С. 864-867. 10 ФОРМУЛА КОРИСНОЇ МОДЕЛІ Спосіб одержання формули: 5-арил-4-арилтіо-1,3,4,5-тетрагідро-2Н-1-бензазепін-2-онів Ar1 загальної SAr2 R1 R2 15 20 N H O , 1 2 де R = R =МеО; R R = OСН2О; Аr = Ph, 4-FC6H4; Аr = Ph, 4-MeC6H4, який відрізняється тим, що N-ариламіди стирилоцтових кислот, які містять сильнодонорні замісники в мета-положенні ароматичного циклу, піддають взаємодії із арилсульфенілхлоридами в оцтовій кислоті при кімнатній температурі в присутності перхлорату літію з подальшим виділенням цільових продуктів звичайними методами. 1 2 1 2 Комп’ютерна верстка В. Мацело Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 5
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of 5-aryl-4-arylthio-1,3,4,5-tetrahydro-2h-1-benzazepin-2-ones
Автори англійськоюVovk Mykhailo Volodymyrovych, Vaskevych Alla Irzhiivna, Tsyzoryk Nazar Mykhailovych
Назва патенту російськоюСпособ получения 5-арил-4-арилтио-1,3,4,5-тетрагидро-2н-1-бензазепин-2-онов
Автори російськоюВовк Михаил Владимирович, Васькевич Алла Иржиивна, Цизорик Назар Михайлович
МПК / Мітки
МПК: C07D 223/16
Мітки: спосіб, одержання, 5-арил-4-арилтіо-1,3,4,5-тетрагідро-2н-1-бензазепін-2-онів
Код посилання
<a href="https://ua.patents.su/7-72170-sposib-oderzhannya-5-aril-4-ariltio-1345-tetragidro-2n-1-benzazepin-2-oniv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 5-арил-4-арилтіо-1,3,4,5-тетрагідро-2н-1-бензазепін-2-онів</a>
Попередній патент: Мотовило
Наступний патент: Спосіб прогнозування наслідків запліднення in vitro та переносу ембріонів
Випадковий патент: Двигунна установка











