Похідні заміщеної n-бензиліндол-3-ілгліоксилової кислоти, які мають протипухлинну дію, їх застосування та фармацевтична композиція на їх основі
Номер патенту: 75060
Опубліковано: 15.03.2006
Автори: Гюнтер Екхард, Еміг Петер, Бахер Геральд, Райхерт Дітмар, Нікель Бернд, Ле Бо Гійом
Формула / Реферат
1. Заміщена похідна N-бензиліндол-3-ілгліоксилової кислоти з протипухлинною активністю Формули 1
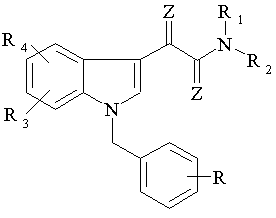 , Формула 1
, Формула 1
у якій
R являє собою
нітро, амінo, моно- або ді(C1-C6)-алкіламінo, моно- або ди(C1-C6)-циклоалкіламінo, (C1-C6)-ациламіно, феніл(C1-C6)-алкіламінo, ароїламінo, (C1-C6)-алкілсульфонамідo, арилсульфонамідo, малеїнімідо, сукцинімідо, фталімідо, бензилоксикарбоніламінo, трет-бутоксикарбоніламінo, 9-флуоренілметоксикарбоніламінo, трифенілметиламінo, дифенілметилсиліламіно,
або
якщо R1 являє собою водень, метил, фенілметильну групу, бензилоксикарбонільний радикал, трет-бутоксикарбонільний радикал або ацетильну групу, R являє собою: -NH-CH2-COOH, -NH-CH(CH3)-COOH, (CH3)2CH-CH2-CH2-CH(NH)-COOH, H3C-CH2-CH(CH3)-CH(NH)-COOH, HOH2C-CH(NH)-COOH, феніл-CH2-CH(NH)-COOH, HN=C(NH2)-NH-(CH2)3-CH(NH)-COOH, H2N-(CH2)4-CH(NH)-COOH, H2N-CO-CH2-CH(NH)-COOH або HOOC-(CH2)2-CH(NH)-COOH;
де R радикали можуть, альтернативно, заміщати по 2, 3 або 4 атомах вуглецю фенільного кільця;
R1 являє собою
водень, (C1-C6)-алкіл, де алкільна група необов’язково моно- або полі-заміщена фенільним кільцем, яке необов’язково моно- або полі-заміщене галогеном, (C1-C6)-алкілом, (C3-C7)-циклоалкілом, карбоксильними групами, карбоксильними групами естерифікованими C1-C6-алканолами, трифторметильними групами, гідроксильними групами, метоксигрупами, етоксигрупами, бензилоксигрупами або бензильною групою, яка моно- або полі-заміщена у фенільній частині (C1-C6)-алкільними групами, атомами галогену або трифторметильними групами; або
бензилоксикарбонільну групу, трет-бутоксикарбонільний радикал або ацетильну групу;
R2 являє собою піридин Формули 2:
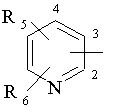 , Формула 2
, Формула 2
або його N-оксид, де піридин, альтернативно, зв’язаний з атомами вуглецю 2, 3 та 4 кільця і необов’язково заміщений замісниками R5 та R6,
де R5 і R6 однакові або різні і являють собою (C1-C6)-алкіл, (C3-C7)-циклоалкіл, (C1-C6)-алкокси, нітро, амінo, гідрокси, галоген, трифторметил, етоксикарбоніламінoрадикал та (C1-C4)-карбоксіалкілоксигрупу;
R3 та R4 однакові або різні і являють собою водень, (C1-C6)-алкіл, (C3-C7)-циклоалкіл, (C1-C6)-алканоїл, (C1-C6)-алкокси, галоген, бензилокси, нітрогрупу, аміногрупу, (C1-C4)-моно- або діалкіл-заміщену аміногрупу, (C1-C6)-алкоксикарбоніламіногрупу або (C1-C6)-алкоксикарбоніламіно-(C1-C6)-алкільну групу; та
Z являє собою O або S,
за умови, що сполука не являє собою N-(3,5-дихлорпірид-4-ил)-[5-метокси-1-(3-нітробензил)-індол-3-іл]-гліоксиламід.
2. N-(піридин-4-іл)-[1-(4-амінобензил)-індол-3-іл]-гліоксиламід.
3. N-(піридин-4-іл)-[1-(4-нітробензил)-індол-3-іл]-гліоксиламід.
4. Кислотно-адитивна сіль сполуки за будь-яким з пп. 1, 2 або 3, де зазначена сіль являє собою сіль неорганічної кислоти, вибраної з групи, яка включає: соляну кислоту, сірчану кислоту або фосфорну кислоту; сіль органічної кислоти, вибраної з групи, яка включає: оцтову кислоту, молочну кислоту, малонову кислоту, малеїнову кислоту, фумарову кислоту, глюконову кислоту, глюкуронову кислоту, лимонну кислоту, аскорбінову кислоту, ембонову кислоту, метансульфонову кислоту, трифтороцтову кислоту, бурштинову кислоту, 2-гідроксіетансульфонову кислоту, нікотинову кислоту та п-толуолсульфонову кислоту.
5. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1, 2 або 3, або її сіль за п. 4, з фізіологічно прийнятними неорганічними або органічними кислотами та необов’язково фармацевтично прийнятні носії, розріджувачі, наповнювачі або їх суміші.
6. Фармацевтична композиція за п. 5, яка відрізняється тим, що представлена у формі таблеток, таблеток з покриттям, капсул, розчинів для вливання або ампул, супозиторіїв, пластирів, порошкових препаратів, придатних для застосування шляхом інгаляції, суспензій, кремів та мазей.
7. Застосування сполуки за будь-яким з пп. 1, 2, 3 для одержання протипухлинних засобів.
8. Застосування сполуки за будь-яким з пп. 1, 2, 3 для лікування пухлинних захворювань.
Текст
1. Заміщена похідна N-бензиліндол-3ілгліоксилової кислоти з протипухлинною активністю Формули 1 C2 2 (19) 1 3 75060 4 сикарбоніламінoрадикал та (C1-C4)лоту, малонову кислоту, малеїнову кислоту, фукарбоксіалкілоксигрупу; марову кислоту, глюконову кислоту, глюкуронову R3 та R4 однакові або різні і являють собою вокислоту, лимонну кислоту, аскорбінову кислоту, день, (C1-C6)-алкіл, (C3-C7)-циклоалкіл, (C1-C6)ембонову кислоту, метансульфонову кислоту, алканоїл, (C1-C6)-алкокси, галоген, бензилокси, трифтороцтову кислоту, бурштинову кислоту, 2нітрогрупу, аміногрупу, (C1-C4)-моно- або діалкілгідроксіетансульфонову кислоту, нікотинову кислозаміщену аміногрупу, (C1-C6)ту та п-толуолсульфонову кислоту. алкоксикарбоніламіногрупу або (C1-C6)5. Фармацевтична композиція, що містить сполуку алкоксикарбоніламіно-(C1-C6)-алкільну групу; та за будь-яким з пп. 1, 2 або 3, або її сіль за п. 4, з Z являє собою O або S, фізіологічно прийнятними неорганічними або орза умови, що сполука не являє собою N-(3,5ганічними кислотами та необов’язково фармацевдихлорпірид-4-ил)-[5-метокси-1-(3-нітробензил)тично прийнятні носії, розріджувачі, наповнювачі індол-3-іл]-гліоксиламід. або їх суміші. 2. N-(піридин-4-іл)-[1-(4-амінобензил)-індол-3-іл]6. Фармацевтична композиція за п. 5, яка відрізнягліоксиламід. ється тим, що представлена у формі таблеток, 3. N-(піридин-4-іл)-[1-(4-нітробензил)-індол-3-іл]таблеток з покриттям, капсул, розчинів для влигліоксиламід. вання або ампул, супозиторіїв, пластирів, порош4. Кислотно-адитивна сіль сполуки за будь-яким з кових препаратів, придатних для застосування пп. 1, 2 або 3, де зазначена сіль являє собою сіль шляхом інгаляції, суспензій, кремів та мазей. неорганічної кислоти, вибраної з групи, яка вклю7. Застосування сполуки за будь-яким з пп. 1, 2, 3 чає: соляну кислоту, сірчану кислоту або фосфордля одержання протипухлинних засобів. ну кислоту; сіль органічної кислоти, вибраної з 8. Застосування сполуки за будь-яким з пп. 1, 2, 3 групи, яка включає: оцтову кислоту, молочну кисдля лікування пухлинних захворювань. Індол-3-гліоксиламіди широко застосовуються у фармацевтичній хімії як фармакодинамічно активні сполуки та ланки для синтезу. У нідерландській патентній заявці №6502481 описано сполуки, які мають протизапальну і жарознижувальну дію та анальгетичну активність. У британській заявці GB-PS 1028812 згадуються похідні індоліл-3-гліоксилової кислоти та їх аміди як сполуки анальгетичної, протисудомної та -адренергічної дії. У роботі [G. Domschke et at. (Ber. 94, 2353 (1961)] описано 3-індоліл-гліоксиламіди, які не було охарактеризовано фармакологічно. [Е. Watton у J.Med.Chem. 11,1252 (1968)] розповідає про похідні індоліл-3-гліоксилової кислоти, які мають інгібуючу дію на гліцерофосфатдегідрогеназу та лактат-дегідрогеназу. У європейській патентній заявці ЕР 675110 описано аміди 1Н-індол-3-гліоксилової кислоти, які виявляють себе як інгібітори sPLA2 і можуть застосовуватися при лікуванні септичного шоку, при панкреатиті, при лікування алергічного риніту та ревматичного артриту. У німецькій патентній заявці за номером 19814838.0. уже пропонувалося застосування сполук згідно з DE- OS 19636150 А1 як протипухлинних засобів. Метою даного винаходу є забезпечення нових сполук ряду індол-3-іл-гліоксилової кислоти загальної формули 1, які виявляють ефективну протипухлинну дію і можуть застосовуватися для одержання протипухлинних засобів; де залишки R, R1, R2, R3, R4 та Ζ мають такі значення: R = нітро, аміно, моно- або ди(С1-С6)алкіламіно, моно- або ди(С1-С6)-циклоалкіламіно, (С1-С6)-ациламіно, феніл (С1-С6)-алкіламіно, ароїламіно, гетероароїламіно, (С1-С6)алкілсульфонамідо, арилсульфонамідо, малеїнімідо, сукцинімідо, фталімідо, бензилоксикарбоніламіно (Z-аміно), трет-бутоксикарбоніламіно (ВОСаміно), 9-флуоренілметоксикарбоніламіно (Fmocаміно), трифенілметиламіно (Tr-аміно), 2-(4'піридил)-етоксикарбоніламіно (Руос-аміно), дифенілметилсиліл-аміно (DPMS-аміно), причому залишки R необов'язково можуть бути заміщені Сатомами 2, 3 та 4 фенільного кільця, R також може, у разі, коли R1 являє собою водень, метильну або фенілметильну групу, а також бензилоксикарбонільний залишок (Z-залишок), трет-бутоксикарбонільний залишок (ВОС-залишок) та ацетильну групу, означати такі залишки: -NH-CH2-COOH; -NН-СН(СН3)-СООН; (СН3)2СН-СН2-СН2-СН(NН)-СООН; Н3С-СН2СН(СН3)-СН(NН)-СООН; НОН2С-СН(NН)-СООН; феніл-CΗ2-ΟΗ(ΝΗ)-ΟΟΟΗ; (4-імідазоїл)-СΗ2ΟΗ(ΝΗ)-ΟΟΟΗ; HN=C(NH2)-NH-(CH2)3-CH(NH) 5 75060 6 COOH; H2N-(CH2)4-CH(NH)-COOH; H2N-CO-CH2імідазоліл)-СН2-СН(СООН)-; НN=С(NН2)-NНCH(NH)-COOH; HOOC-(CH2)2-CH(NH)-COOH (СН2)3-СН(СООН)-; H2N-(CH2)4-CH(COOH)-; H2NR1 є воднем, (С1-С6)-алкілом, причому алкільCO-CH2-CH(COOH)-; HOOC-(CH2)2-CH(COOH)-; на група одно- або кількаразово може бути заміR2 також може, у разі, коли R означає водень, щеною фенільним кільцем, і це фенільне кільце, у Z-групу, ВОС-залишок, ацетильну або бензильну свою чергу, одно- або кількаразово може бути загрупу, бути кислотним залишком природної або міщене галогеном, (С1-С6)-алкілом, (С3-С7)синтетичної амінокислоти, наприклад, являти социклоалкілом, карбоксильними групами, естерифібою -гліцильний, -саркозильний, -аланільний, кованими С1-С6-алканолами карбоксильними гру-лейцильний, -ізолейцильний, -серильний, пами, трифторметильними групами, гідроксильнифенілаланільний, -гістидильний, -пропільний, ми групами, метоксигрупами, етоксигрупами, аргінільний, -лізильний, -аспарагільний та бензилоксигрупами, а також одно- або кількаразоглутамільний залишок, причому аміногрупи відпово заміщеною у фенільній частині (С1-С6)відних амінокислот можуть бути незахищеними алкільними групами, атомами галогенів або триабо захищеними. Як захисну групу амінної функції, фторметильними групами бензильною групою, розглядають карбобензоксизалишок (Z-залишок) R1 також означає бензилоксикарбонільну групу та трет-бутоксикарбонільний залишок (ВОС(Z-групу) та трет-бутоксикарбонільний залишок залишок), а також ацетильну групу. У разі позна(Вос-залишок), а також ацетильну групу. ченого як R2 аспарагільного та глутамільного заR2 може означати фенільне кільце, одно- або лишку друга, незв'язана карбоксильна група існує кількаразово заміщене (С1-С6)-алкілом, (С1-С6)як вільна карбоксильна група або у формі естериалкокси, ціано, галогеном, трифторметилом, гідрофікованої С1-С6-алканолами карбоксильної групи, кси, бензилокси, нітро, аміно, (С1-С6)-алкіламіно, наприклад, як метиловий, етиловий або як трет(С1-С6)-алкоксикарбоніламіно та карбоксильною бутиловий естер. Крім того, R2 може означати алігрупою або естерифікованою С1-С6-алканолами ламінокарбоніл-2-метил-проп-1-ільну групу. R1 та карбоксильною групою, або піридиновий каркас R2 також можуть разом з атомом азоту, з яким воформули 2 ни є зв'язаними, утворювати піперазинове кільце формули 3 або гомопіперазинове кільце, якщо R2 являє собою аміноалкіленову групу, причому та його N-оксид, причому піридиновий каркас необов'язково є зв'язаним з атомами вуглецю 2, 3 та 4 кільця і може бути заміщений замісниками R5 та R6. Залишки R5 та R6 можуть бути однаковими або різними і можуть означати (С1-С6)-алкіл, а також означати (С3-С7)-циклоалкіл, (С1-С6)-алкокси, нітро, аміно, гідрокси, галоген та трифторметил, а також являти собою етоксикарбоніламінозалишок, а також групу карбоксіалкілокси, причому алкілгрупа може мати 1-4 С-атоми. R2 також може бути 2- або 4-піримідинільним гетероциклом, причому 2-піримідинільне кільце одно- або багаторазово може бути заміщене метильною групою, крім того, означати заміщений (С1-С6)-алкілом, галогеном, нітрогрупою, аміногрупою та (С1-С6)-алкіламінозалишком 2-,3-,4-,5-,6-7та 8-хінольний каркас, являти собою 2-, 3- та 4хінолметильну групу, причому атоми вуглецю кільця піридилметильного залишку хінолільної групи та хінолілметильного залишку можуть бути заміщені (С1-С6)-алкілом, (С1-С6)-алкокси, нітро, аміно та (С1-С6)-алкоксикарбоніламіно. R2 також може, у разі, коли R являє собою водень, метильну або бензильнугрупу, а також бензилоксикарбонільний залишок (Z-залишок), третбутоксикарбонільний залишок (ВОС-залишок) та ацетильну групу, означати такі залишки: -СН2СООН; -СН(СН3)-СООН; (СН3)2СН-(СН2)2СН(СООН)-; Н3С-Н2С-СН(СН3)-СН(СООН)-; НОН2С-СН(СООН)-; феніл-СН2-СН(СООН)-; (4 R7 являє собою алкільний залишок, означає фенільне кільце, яке одно- або кількаразово може бути заміщене (С1-С6)-алкілом, (С1-С6)-алкокси, галогеном, нітрогрупою, амінною функцією та (С1С6)-алкіламіногрупою. R7 також означає бензгідрильну групу та біс-р-фторбензгідрильну групу. R3 та R4 можуть бути однаковими або різними і означати водень, (С1-С6)-алкіл, (С3-С7)-циклоалкіл, (С1-С6)-алканоїл, (С1-С6)-алкокси, галоген та бензилокси. Крім того, R3 та R4 можуть означати нітрогрупу, аміногрупу, (С1-С4)-моно- або діалкілзаміщену аміногрупу та (С1-С6)-алкоксикарбоніламінну функцію або (С1-С6)-алкоксикарбоніламіно-(С1-С6)алкільну функцію. Ζ означає О та S. Під алкільною, алканольною, алкокси- або алкіламіногрупою для залишків R, R1, R2, R3, R4, R5, R6, R7, як правило, розуміють як "нерозгалужені", так і "розгалужені" алкільні групи, причому "нерозгалужені алкільні групи" можуть означати, наприклад, такі залишки, як метил, етил, n-пропіл, nбутил, n-пентил, n-гексил, а "розгалужені алкільні групи" означають, наприклад, такі залишки, як ізопропіл або трет-бутил. Під "циклоалкілом" розуміють такі залишки, як, наприклад, циклопропіл, циклобутил, циклопентил, циклогексил або циклогептил. Позначення "галоген" означає фтор, хлор, бром або йод. Позначення "алкоксигрупа" означає таки залишки, як, наприклад, метокси, 7 75060 8 етокси, пропокси, бутокси, ізопропокси, ізобутокси 1-й етап: або пентокси. Під ацилом ациламінозалишків слід Похідна індолу, який є незаміщеним або однорозуміти такі групи, як форміл, ацетил, пропіоніл, або кількаразово може бути заміщений на С-2 або бутирил, валерил та ізовалерил. Позначення ароїл у фенільному каркасі, розчиняють у протонному, ароїламіногруп означає бензоїл, нафтоїл, толуол, диполярному апротонному або неполярному оргафталоїл, а угруповання гетероароїл гетероароїланічному розчиннику, такому, як, наприклад, ізопромінозалишків означає нікониноїл, ізонікотиноїл, панол, тетрагідрофуран, диметилсульфоксид, дитеоніл та фуроїл. Під арилом арилсульфонамідної метилформамід, диметилацетамід, Nгрупи розуміють феніл, толіл та нафтил. метилпіролідон, діоксан, толуол або метиленхлоСполуки також можуть застосовуватись як кирид, і по краплях додають до підготовленої у трислі адиційні солі, наприклад, як солі мінеральних шийковій колбі в атмосфері N2 у молярній або кислот, таких, як соляна кислота, сірчана кислота, надлишковій кількості суспензії основи, такої як, фосфорна кислота, солі органічних кислот, таких, наприклад гідрид натрію, порошкоподібний гідрокяк оцтова кислота, молочна кислота, малонова сид калію, трет-бутилат калію, диметиламінопірикислота, малеїнова кислота, фумарова кислота, дин або амід натрію у підходящому розчиннику. глюконова кислота, глюкуронова кислота, лимонна Після цього додають, наприклад потрібний алкіл-, кислота, аскорбінова кислота, ембонова кислота, аралкіл- або гетероаралкілгалогенід, у відповіднометансульфонова кислота, трифтороцтова кислому разі, з додаванням каталізатора, наприклад, та, бурштинова кислота, 2-гідроксіетансульфонова міді, і залишають на певний час, наприклад, від 30 кислота, нікотинова кислота та рхвилин до 12 годин, знову приводять у реакцію і толуолсульфонова кислота. підтримують температуру в межах від 0°С до Як сполуки формули 1, так і їх солі є біологічно 120°С, в оптимальному варіанті - від 30°С до 80°С, активними. Сполуки формули 1 можуть вводитись краще - від 50°С до 65°С. По завершенню реакції у вільній формі або у формі солей з фізіологічно реакційну суміш додають у воду, розчин екстрагуприйнятними кислотами. ють, наприклад, діетиловим етером, дихлорметаВведення може здійснюватися перорально, ном, хлороформом, метил-трет-бутиловим етером парентерально, внутрішньовенно, крізьшкірно або або тетрагідрофураном і одержані органічні фази через інгаляцію. висушують безводним сульфатом натрію. ОрганіКрім того, винахід стосується фармацевтичних чну фазу звужують у вакуумі, осад, що залишився, композицій з вмістом принаймні однієї зі сполук кристалізують через розтирання або очищують формули 1 або їх солей з фізіологічно прийнятниосад у вигляді олії через перекристалізацію, дисми неорганічними або органічними кислотами та, у тиляцію або через колонкову або флешвідповідному разі, фармацевтично прийнятних хроматографію на силікагелі або оксиді алюмінію. носіїв та/або розріджувачів або допоміжних речоРозчинником служить, наприклад, суміш дихлорвин. метану та діетилового етеру у співвідношенні 8:2 Як форми застосування, придатними є, напри(об'єм/об'єм) або суміш дихлорметану та етанолу клад, таблетки, драже, капсули, розчини для влиу співвідношенні 9:1 (об'єм/об'єм). вання або ампули, супозиторії, пластирі, порошко2-й етап ві композиції для інгаляції, суспензії, креми та мазі. Одержаний за вищенаведеними вказівками 1Спосіб одержання сполук згідно з винаходом го етапу N-заміщений індол в атмосфері азоту описано на нижчеподаних Схемах реакцій 1 та 2 розчиняють в апротонному або неполярному орга(Етапи 1-3), а також у загальних інструкціях. Усі нічному розчиннику, такому як, наприклад, діетисполуки одержують так, як описано, або аналогічловий етер, метил-трет-бутиловий етер, тетрагідним способом: сполуки загальної формули 1 з рофуран, діоксан, толуол, ксилол, метиленхлорид Ζ=О, R=NO2 та NH2 і R2 = арил, аралкіл та гетероабо хлороформ, і додають до приготовленого в арил, одержують згіднозі Схемою 1: атмосфері азоту розчину оксалілхлориду, у кількості від одноразової молярної до 60-відсоткової надлишкової, в апротонному або неполярному розчиннику, наприклад, у діетиловому етері, метил-трет-бутиловому етері, тетрагідрофурані, діоксані, толуолі, ксилолі, метиленхлориді, причому температуру підтримують на рівні від -5°С до 20°С. Після цього реакційнийрозчин нагрівають при температурі від 10°С до 130°С, в оптимальному варіанті - від 20°С до 80°С, краще - від 30°С до 50°С протягом від 30 хвилин до 5 годин, і відразу після цього розчинник упарюють. Осад утвореного таким чином "хлориду індоліл-3-гліоксилової кислоти", що залишився, розчиняють в апротонному розчиннику, такому як, наприклад, тетрагідрофуран, діоксан, діетиловий етер, толуол, або у диполярному апротонному розчиннику, такому як, наприклад, диметилформамід, диметилацетамід або диметилсульфоксид, охолоджують до температури від 10°С до -15°С, в оптимальному варіанті - від -5°С до 0°С, і у присутності кислотної пастки до 9 75060 10 дають до розчину первинного або вторинного аміпісля цього при перемішуванні виливають у 700мл ну в розріджувачі. Як розріджувачі, застосовують води. Порціями екстрагують із загальною кількістю вищезгадані застосовувані для розчинення хлори300мл метиленхлориду, органічну фазу висушуду індоліл-3-гліоксилової кислоти розчинники. Як ють безводним сульфатом натрію, фільтрують і кислотні пастки, застосовують триетиламін, пірифільтрат звужують у вакуумі. Осад очищують на дин, диметиламінопіридин, осн. іонообмінник, карколонці з силікагелем (силікагель 60. Fa. Merck бонат натрію, карбонат калію, порошкоподібний AG, Darmstadt; розчинник метиленхлорид/етанол гідроксид калію, а також надлишковий, застосову9:1, (об'єм/б'єм)). ваний для реакції первинний або вторинний амін. Вихід: 43,9г (87% теор.) Реакція відбувається при температурі від 0°С до MS: m/e 253 (М+Н) 120°С, в оптимальному варіанті - при 20°-80°С, 2-й етап краще - від 40°С до 60°С. Після 1-3 годин реакції Амід N-(піридин-4-іл)-[1-(4-нітробензил)-індолта 24-годинного відстоювання при кімнатній тем3-іл]гліоксилової кислоти (D-68836) пературі гідрохлорид кислотної пастки фільтрують, Розчин 4,50мл оксалілхлориду у 50мл етеру фільтрат звужують у вакуумі і осад перекристаліпри 0°С в атмосфері азоту змішують із розчином зують із органічного розчинника або очищують 10,09г (0,04моль) 1-(4-нітробензил)-індолу у 50мл шляхом колонкової хроматографії на силікагелі етеру. Дві години нагрівають при температурі деабо оксиді алюмінію. Як розчинник, застосовують, флегмації і відразу після цього розчинник упарюнаприклад, суміш дихлорметану та етанолу (95:5, ють. До осаду додають 100мл тетрагідрофурану, (об'єм/об'єм)). охолоджують до -5°С і по краплях додають розчин 3-й етап 9,32г (0,099моль) 4-амінопіридину у 400мл тетраОдержаний за вищенаведеними вказівками (2гідрофурану. Протягом 3 годин нагрівають при го етапу) N-нітробензил-заміщений амід "індолглідефлегмації і залишають стояти при кімнатній теоксилової кислоти" розчиняють у протонному розмпературі до наступного дня. 4чиннику, такому як, наприклад, метанол, етанол, амінопіридингідрохлорид відкачують, осад промипропанол, ізопропанол або бутанол, або у неполявають тетрагідрофураном, фільтрат звужують у рному розчиннику, такому як, наприклад, тетрагідвакуумі і осад перекристалізують з естеру оцтової рофуран, діоксан або глікольдиметиловий етер, кислоти. або у диполярному апротонному розчиннику, таВихід: 13,5г (84% теор.) кому як, наприклад, диметилсульфоксид, диметиMS: m/e 401 (М+Н) лформамід, диметилацетамід або N3-й етап метилпіролідон, і розчин в атмосфері азоту при Амід N-(піридин-4-іл)-Н-(4-амінобензил)-індолперемішуванні змішують із каталізатором гідроге3-іл]гліоксилової кислоти (D-68838) нізації, таким як, наприклад, нікель Ренея, палаСуміш 200мг нікелю Ренея у 50мл діоксану дій/вугіль або платина. У суспензію при помірному змішують із суспензією 320мг (0,8ммоль) аміду Nзбовтуванні в умовах газового тиску 1-15бар, в (піридин-4-іл)-[1-(4-нітробензил)-індол-3-іл]оптимальному варіанті - 2-10бар, ще краще - 4гліоксилової кислоти у суміші розчинників з 150мл 6бар вводять водень і температуру підвищують до діоксану та 20мл ізопропанолу. У цю суспензію при приблизно 20°-80°С, в оптимальному варіанті - до збовтуванні в умовах газового тиску 5бар вводять 30°- 60°С, ще краще - до 45°-55°С. У відповідному водень і температуру утримують на рівні 30-35°С. разі, приблизно через 1 годину додають іще одну Приблизно через 3 години додають іще 400мг ніпорцію каталізатора і продовжують гідрогенізацію. келю Ренея і гідрогенізацію при енергійному збовПісля 4-10 годин реакції гідрогенізацію припиняли. туванні продовжують іще 8 годин при 35°С і 5бар. Каталізатор відфільтровують в атмосфері азоту, Каталізатор відфільтровують в атмосфері N2, фірозчинник звужують у вакуумі до сухого стану і льтрат звужують у вакуумі до сухого стану і осад осад, який має колір від безбарвного до жовтувависушують у вакуумі при 40°С. того, висушують у вакуумі при 40°С. Вихід: 273мг (92% теор.) Приклади втілення MS: m/e 371 (М+Н) Згідно з цією загальною інструкцією для етапів Крім того, сполуки загальної формули 1, де 1-3, в основі яких лежить Схема синтезу 1, було Z=O, R=NO2, і NH2 та R2 = арил, аралкіл, гетероасинтезовано представлені нижче сполуки, які, за рил, гетероаралкіл, і групи аліламінокарбоніл-2наявності відповідного хімічного опису, випливаметил-проп-1-ілу можуть бути синтезовані шляхом ють із нижчеподаного огляду: синтезу за Схемою 2: Приклад 1 Амід N-(піридин-4-іл)-[1-(4-амінобензил)-індол3-іл] гліоксилової кислоти (D-68838) 1-й етап 1-(4-нітробензил)-індол Суміш 5,28г гідриду натрію (0,22моль, суспензія мінеральної олії) у 200мл диметилсульфоксиду змішують із розчином 23,4г (0,2моль) індолу у 100мл диметилсульфоксиду. Протягом 1 години нагрівають до 65°С, після цього охолоджують, а потім по краплях додають 37,7г (0,22моль) 4нітробензилхлориду. Розчин нагрівають до 60°С, 14 годин зберігають при кімнатній температурі, а 11 Амід N-(піридин-4-іл)-Н-(4-амінобензил) індол3-ілі гліоксилової кислоти 1-й етап Амін N-(піридин-4-іл)-(індол-3-іл)гліоксилової кислоти До розчину 9мл оксалілхлориду у 100мл безводного етеру по краплях при 0°С додають розчин 10г (85,3ммоль) індолу у 100мл етеру. Суміш протягом 3 годин тримають при дефлегмації. Після цього при -5°С по краплях додають суспензію 12г (127,9ммоль) 4-аміно-піридину у 500мл тетрагідрофурану, реакційну суміш при перемішуванні протягом 3 годин нагрівають при температурі дефлегмації і залишають стояти при кімнатній температурі до наступного дня. Потім фільтрують, обробляють осад водою і очищують висушену сполуку на колонці з силікагелем (силікагель 60, Fa. Merck AG, Darmstadt) з застосуванням елюенту метиленхлориду/етанолу (10:1, (об'єм/об'єм)). Вихід: 9,8г (43,3% теор.) MS: m/e 266 (М+Н) 2-й етап Амід N-(піридин-4-іл)-[1-(4-нітробензил)-індол3-iл]гліоксилової кислоти (D-68836) Одержаний згідно з 1-м етапом (Схема 2) амід N-(піридин-4-іл)-індол-3-іл))гліоксилової кислоти перетворюють згідно з "вказівками для бензилування" (стор.5) 4-нітробензилхлоридом і виділяють одержану сполуку амід N-(піридин-4-іл)-[1-(4нітробензил) індол-3-іл]гліоксилової кислоти. Вихід: 64% теор. MS: m/e 401 (М+Н) 3-й етап Амід N-(піридин-4-іл)-[1-(4-амінобензил)індол3-іл]гліоксилової кислоти (D-68838) Одержаний згідно з 2-м етапом (Схема 2) амід N-(піридин-4-іл)-[1-(4-нітробензил)-індол-3іл]гліоксилової кислоти гідрогенізують з каталізатором згідно з "вказівками для гідрогенізації" (стор.7) і виділяють одержану сполуку амід N(піридин-4-іл)-[1-(4-амінобензил)індол-3-іл] гліоксилової кислоти. Вихід: 94% теор. 75060 12 MS: m/e 371 (М+Н) Загальна інструкція для одержання сполук загальної формули 1 за Схемою 2 1-й етап: До підготовленого в атмосфері азоту розчину оксалілхлориду, у кількості від одноразової молярної до 60-відсоткової надлишкової, в апротонному або неполярному розчиннику, наприклад, у діетиловому етері, метил-трет-бутиловому етері, тетрагідрофурані, діоксані або дихлорметані, при температурі від -5°С до +5°С по краплях додають розчинену в такому розчиннику, як, наприклад, вказано вище для оксалілхлориду, похідну індолу, яка може бути незаміщеною або заміщеною в С-2 або фенільному кільці. Після цього реакційний розчин нагрівають від 1 до 5 годин до температури від 10°С до 120°С, в оптимальному варіанті - від 20°С до 80°С, краще - від 30°С до 60°С, і відразу після цього розчинник упарюють. Осад хлориду (індол-3-іл)гліоксилової кислоти, що залишився, розчиняють або суспендують в апротонному розчиннику, такому як, наприклад, тетрагідрофуран, діоксан, діетиловий етер, толуол, або у диполярному апротонному розчиннику, такому як, наприклад, диметилформамід, диметилацетамід або диметилсульфоксид, охолоджують до температури від -10°С до +10°С, в оптимальному варіанті від 5°С до 0°С, і у присутності кислотної пастки змішують із розчином первинного або вторинного аміну в розріджувачі. Як розріджувачі, можуть бути придатними застосовувані для розчинення "хлоридів індоліл-3-гліоксилової кислоти" розчинники. Як кислотні пастки, застосовують триетиламін, піридин, диметиламінопіридин, осн. іонообмінник, карбонат натрію, карбонат калію, порошкоподібний гідроксид калію, а також надлишковий, застосовуваний для реакції первинний або вторинний амін. Реакція відбувається при температурі від 0°С до 120°С, в оптимальному варіанті - при 20-80°С, краще - від 40°С до 60°С. Після 1-4-годинної реакції та 24-годинного відстоювання при кімнатній температурі фільтрують, осад дигерують водою, відкачують і висушують у вакуумі. Потрібну сполуку очищують через перекристалізацію в органічному розчиннику або через колонкову хроматографію на силікагелі або оксиді алюмінію. Як розчинник, застосовують, наприклад, суміш дихлорметану та етанолу (10:1, об'єм/об'єм). 2-й етап Одержаний за вищенаведеними вказівками 1го етапу "амід індол-3-іл-гліоксилової кислоти" розчиняють у протонному, диполярному апротонному або неполярному органічному розчиннику, такому як, наприклад, ізопропанол, тетрагідрофуран, диметилсульфоксид, диметилформамід, диметилацетамід, N-метилпіролідон, діоксан, толуол або метиленхлорид, і по краплях додають до підготовленої у тришийковій колбі в атмосфері N2 у молярній або надлишковій кількості суспензії основи, наприклад, гідриду натрію, порошкоподібного гідроксиду калію, трет-бутилату калію, диметиламінопіридину або аміду натрію, у підходящому розчиннику. Після цього додають потрібний алкіл-, аралкіл- або гетероаралкілгалогенід, або нерозріджений, або в розріджувачі, який, наприклад, застосовували для розчину "аміду індол-3-іл 13 75060 14 гліоксилової кислоти", у відповідному разі з додалярному апротонному розчиннику, такому як, наванням каталізатора, такого, наприклад, міді, і приклад, диметилсульфоксид, диметилформамід, залишають на певний час, наприклад, від 30 хвидиметилацетамід або N-метилпіролідон, і розчин в лин до 12 годин, для реакції і підтримують темпеатмосфері азоту при перемішуванні змішують із ратуру в межах від 0°С до 120°С, в оптимальному каталізатором гідрогенізації, таким як, наприклад, варіанті - від 30°С до 80°С, краще - від 50°С до нікель Ренея, паладій/вугіль або платина. У су70°С. По завершенню реакції реакційну суміш доспензію при помірному збовтуванні в умовах газодають у воду, розчин екстрагують, наприклад, діевого тиску 1-15бар, в оптимальному варіанті - 2тиловим етером, дихлорметаном, хлороформом, 10бар, ще краще - 4-6бар вводять водень і темпеметил-трет-бутиловим етером, тетрагідрофураном ратуру підвищують до приблизно 20°-80°С, в опабо n-бутанолом, і відповідну одержану органічну тимальному варіанті - до 30°-60°С, ще краще - до фазу висушують безводним сульфатом натрію. 45°-55°С. У відповідному разі, приблизно через 1 Органічну фазу звужують у вакуумі, осад, що загодину додають іще одну порцію каталізатора і лишився, кристалізують через розтирання або продовжують гідрогенізацію. Після 4-6 годин реакочищують осад у вигляді олії шляхом дистиляції ції гідрогенізацію припиняли. Каталізатор відфільабо шляхом колонкової або флеш-хроматографії тровують в атмосфері азоту, розчинник звужують у на силікагелі або оксиді алюмінію. Розчинником вакуумі до сухого стану і осад, який має колір від служить, наприклад, суміш із метиленхлориду та безбарвного до жовтуватого, висушують у вакуумі діетилового етеру у співвідношенні 8:2 при 40°С. (об'єм/об'єм) або суміш із метиленхлориду та етаЗгідно з цією загальною інструкцією для Етапів нолу у співвідношенні 9:1 (об'єм/об'єм). 1-3, в основі яких лежить Схема синтезу 2, синте3-й етап зували сполуки D-68836 та D-68838, згідно з уже Одержаний за вищенаведеними вказівками (2представленим для Схеми реакції 1 процесом сиго етапу) N-нітробензил-заміщений амід "індолглінтезу. оксилової кислоти" розчиняють у протонному розАктивність даних сполук може бути продемончиннику, такому як, наприклад, метанол, етанол, стрована в аналізі полімеризації тубуліну. Зокрепропанол або бутанол, або у неполярному розма, було доведено, що D-68838 стримує полімеричиннику, такому як, наприклад, тетрагідрофуран, зацію тубуліну і, таким чином, має дестабілізуючий діоксан або глікольдиметиловий етер, або у диповплив на мікроканальці або мітотичні веретена. Комп’ютерна верстка О. Гапоненко Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted n-benzyl-indole-3-yl-glyoxylic acid derivatives having antitumor activity, use thereof and pharmaceutical composition based thereon
Автори англійськоюGuenther Eckhard, Emig Peter, Reichert Dietmar, Nickel Bernd, Bacher Gerald
Назва патенту російськоюПроизводные замещенной n-бензилиндол-3-илглиоксиловой кислоты, которые обладают противоопухолевым действием, их применение и фармацевтическая композиция на их основании
Автори російськоюГюнтер Экхард, Эмиг Петер, Райхерт Дитмар, Никель Бернд, Бахер Геральд
МПК / Мітки
МПК: C07D 401/12, A61K 9/12, A61P 35/00, A61K 9/10, A61K 9/06, A61K 9/20, A61K 31/4439, A61K 9/48, A61K 9/08, A61K 9/02
Мітки: кислоти, n-бензиліндол-3-ілгліоксилової, заміщеної, застосування, дію, мають, протипухлинну, похідні, композиція, фармацевтична, основі
Код посилання
<a href="https://ua.patents.su/7-75060-pokhidni-zamishheno-n-benzilindol-3-ilglioksilovo-kisloti-yaki-mayut-protipukhlinnu-diyu-kh-zastosuvannya-ta-farmacevtichna-kompoziciya-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Похідні заміщеної n-бензиліндол-3-ілгліоксилової кислоти, які мають протипухлинну дію, їх застосування та фармацевтична композиція на їх основі</a>
Попередній патент: Кріоаплікатор для заморожування біологічних об’єктів
Наступний патент: Спосіб виготовлення випромінювача у вигляді полімерної плівки для рентгенофлуоресцентного аналізу водних розчинів
Випадковий патент: Спосіб збільшення приросту бройлерних курей











