Похідні 1,2,4-оксадіазолілфеноксіалкілізоксазолу, що мають противірусну активність та фармацевтична композиція на їх основі
Формула / Реферат
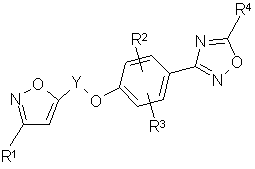
1. 1,2,4-Оксадиазолилфеноксиалкилизоксазолы общей формулы (I):
 ,
,
(I)
где R1 представляет собой алкил, алкокси, гидрокси, циклоалкил, гидроксиалкил, алкоксиалкил или гидроксиалкокси,
Y является алкиленом, содержащим от 3 до 9 атомов улерода,
R2 и R3 независимо являются водородом, алкилом, алкокси, галоидом, трифторметилом или нитрогруппой,
R4 является алкокси, гидрокси, галоидметилом, дигалоидметилом, тригалоидметилом, циклоалкилом, алкоксикарбонилом, гидроксиалкилом, алкоксиалкилом, алканкарбонилоксиалкилом, циано, 2,2,2-трифторэтилом, 4-метилфенилсульфонилоксиметилом, группой Q или C(O)Q,
где Q является амино, алкиламино, диалкиламино,
или его фармацевтически приемлемые аддитивные кислотные соли, обладающие противовирусной активностью.
2. Соединение по п.1, в котором Y является алкиленом, содержащим от 3 до 5 атомов улерода.
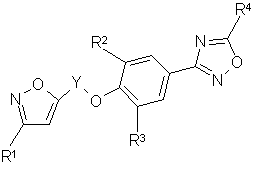
3. Соединение по любому из пп.1-2, которое имеет формулу:
 ,
,
где R1, R2, R3, R4 и Y принимают значения, указанные выше.
4. Соединение по п.З, в котором R4 является (С1-С4)алкокси, фторметилом, дигалоидметилом, тригалоидметилом, циклоалкилом, (С1-С3)алкокси(С1-С3)алкилом.
5. Соединение по п.4, в котором R4 является трифторметилом.
6. Соединение по п.3, представляющее собой 5-[3-(2,6-диметил-4-(5-трифторметил-1,2,4-оксадиазол-3-ил)фенокси)пропил]-3-метилизоксазол.
7. Соединение по п.1, используемое для получения лекарственного средства для борьбы с пикорнавирусной инфекцией у млекопитающих.
8. Соединение по п.3, используемое для получения лекарственного средства для борьбы с пикорнавирусной инфекцией у млекопитающих.
9. Соединение по п.6, используемое для получения лекарственного средства для борьбы с пикорнавирусной инфекцией у млекопитающих.
10. Фармацевтическая композиция против пикорнавирусов, содержащая активный ингредиент и целевые добавки, отличающаяся тем, что в качестве активного ингредиента она содержит производное 1,2,4-оксадиазолилфеноксиалкилизоксазола общей формулы (I):
 ,
,
(I)
где R1 представляет собой алкил, алкокси, гидрокси, циклоалкил,
гидроксиалкил, алкоксиалкил или гидроксиалкокси,
Y является алкиленом, содержащим от 3 до 9 атомов улерода,
R2 и R3 независимо являются водородом, алкилом, алкокси, галоидом, трифторметилом или нитрогруппой,
R4 является алкокси, гидрокси, галоидметилом, дигалоидметилом, тригалоидметилом, циклоалкилом, алкоксикарбонилом, гидроксиалкилом, алкоксиалкилом, алканкарбонилоксиалкилом, циано, 2,2,2-трифторэтилом, 4-метилфенилсульфонилоксиметилом, группой Q или C(O)Q, где
Q является амино, алкиламино, диалкиламино, в терапевтически эффективном количестве.
Текст
1. 1,2,4-Оксадиазолилфеноксиалкилизоксазолы общей формулы (I): 1 где R представляет собой алкил, алкокси, гидрокси, циклоалкил, гидроксиалкил, алкоксиалкил или гидроксиалкокси, Y является алкиленом, содержащим от 3 до 9 атомов углерода, R2 и R3 независимо являются водородом, алкилом, алкокси, галоидом, трифторметилом или нитрогруппой, R является алкокси, гидрокси, галоидметилом, дигалоидметилом, тригало ид метилом, циклоалкилом, алкоксикарбонилом, гид рокси ал килом, алкоксиал килом, алканкарбонилоксиалкилом, циано, 2,2,2-трифторэтилом, 4-метилфенилсульфонилоксиметилом, группой Q или C(O)Q, где Q является амино, алкиламино, диалкиламино, или его фармацевтически приемлемые аддитивные кислотные соли, обладающие противовирусной активностью 2. Соединение по п 1, в котором Y является алкиленом, содержащим от 3 до 5 атомов углерода 3. Соединение по любому из пп. 1-2, которое имеет формулу гдеЯ 1 , R2, R3, R 4 H У принимают значения, указанные выше. 4. Соединение по п 3, в котором R4 является ( С г Сз)алкокси, фторметилом, дигалоидметилом, тригалоид метил ом, циклоалкилом, (С-і-Сз)алкокси(С-г Сз)алкилом 5. Соединение по п. 4, в котором R4 является трифторметилом. 6. Соединение по п. 3, представляющее собой 5[3-(2,6-диметил--4-{5-трифторметил-1,2,4-оксадиазол-3-ил)фенокси)пропил]-3-метилиэоксазол. 7 Соединение по п. 1, используемое для получения лекарственного средства для борьбы с пикорнавирусной инфекцией у млекопитающих. 8. Соединение по п. 3, используемое для получения лекарственного средства для борьбы с пикорнавирусной инфекцией у млекопитающих. 9 Соединение по п. 6, используемое для получения лекарственного средства для борьбы с гшкорнавирусной инфекцией у млекопитающих. 10. Фармацевтическая композиция против пикорнавирусов, содержащая активный ингредиент и целевые добавки, отличающаяся тем, что в качестве активного ингредиента она содержит производное 1,2,4-оксадиазолилфеноксиалкилизоксазола общей формулы (I): .R 4 где R представляет собой алкил, алкокси, гидрокси, циклоалкил, гид рокси ал кил, алкоксиалкил или гидроксиалкокси, Y является алкиленом, содержащим от 3 до 9 атомов углерода, О h (О Ю Ю СО 35557 R2 и R3 независимо являются водородом, алкилом, алкокси, галоидом, трифторметилом или нитрогруплой, R является алкокси, гидрокси, галоидметилом, дигалоидметилом, тригалоидметилом, циклоалкилом, алкоксикарбонилом, гидроксиалкилом, алкок сиал килом, алканкарбонилоксиалкилом, циано, 2,2,2-трифторэтилом, 4-метилфенилсульфонилоксиметилом, группой Q или C(O)Q, Q является амино, алкиламино, диалкиламино, в терапевтически эффективном количестве. Настоящее изобретение относится к новым 1,2,4-оксадиазолилфеноксиалкилизоксазолам, к способу их получения, к содержащим их композициям и способам их применения в качестве противовирусных агентов. Патент США Дайана 4843087 раскрывает гетероциклические феноксиалкилизоксазолы, в которых гетероциклический фрагмент является оксазолом или оксазином, которые демонстрируют противовирусною активность. Патент США 485753915 Дайана с сотр раскрывает активные против вирусов соединения формулы обязательно замещенным одним из членов группы, состоящей из гидрокси, низшей алканоилокси, низшей алкокси, галоида или N=Z', где N^Z' является амино, низшей алканоиламино, низшей алкиламино, ди-низшей алкиламино, 1-пирролидинила, 1-пиперидинила, или 4-морфолинила; при условии, что если Z является N, R не является водородом; Het выбирают из определенных гетероциклических групп, включающих незамещенный 1,3,4-оксадиазол-2-ил В патенте США 4942241 Дайана с сотр. раскрывает противовирусные активные соединения формулы1 Y-0 где Y является апкиленовым мостиком, содержащим от 3 до 9 атомов углерода; Z является N или НС, R является водородом или низшим алкилом, содержащим от 1 до 5 атомов углерода, при условии, что если Z является N, R является низшим алкилом; Ri и R2 являются водородом, галоидом, низшим алкилом, низшим алкокси, нитро, низшим алкоксикарбонилом или трифторметилом, a Het выбирают из специфических гетероциклических групп. В определение Het включены незамещенный 1,3,4-оксадиазол-2-ил и незамещенный 1,2,4оксадиазол-5-ил В патенте США 486179129 Дайана с сотр. раскрыты активные противовирусное соединения формулы inter alia где Y является алкиленовым мостиком, содержащим от 3 до 9 атомов углерода, необязательно прерываемым одним или двумя атомами кислорода, за счет цикл о гексил ьных или олефиновых связей; X является U, S, SO или БОг, 2 является N, или ReC, где Re является водородом или низшим алканоилом; Ri и R2 выбирают из группы, состоящей из водорода, низшего алкила, низшего алкенила, галоида, нитро, низшей алкокси, низшей алкилтио, дифторметила, трифторметила, амино, низшей алканоиламино, ди-ниэшей алкиламино, гидрокси, низшего алкеноила, низшего алканоила, гидроксиметила, и карбокси; R и R3 каждый являются водородом или алкилом, содержащим от 1 до 5 атомов углерода, не Y-0 где Y является алкиленовым мостиком, содержащим от 1 до 9 атомов углерода, R1 является низший алкилом или гидроксинизшим алкилом, содержащим от 1 до 5 атомов углерода; Ri и F 2 представляют водород, галоид, низший ? алкил, низший алкокси, нитро, низшийал ко кси карбон ил или трифторметил; a Re является водородом или низшим алкилом, содержащим от 1 до 5 атомов углерода Дайана в патенте США 4945164 раскрывает антивирусные активные соединения формулы (наряду с другими): где Y является алкиленовым мостиком, содержащим от 5 до 9 атомов углерода; R' является низшим алкилом или гидроксинизшим алкилом, содержащим от 1 до 5 атомов углерода; Ri и R2 является водородом, галоидом, низшим алкилом, низшей алкокси, нитро, низшим алкоксикарбонилом или трифторметилом; a Re является водородом или низшим алкилом, содержащим от 1 до 5 атомов углерода G. D Diana и Т R Bailey в патентной заявке США № 07/731569 раскрывает соединения формулы: 35557 Y-o /A где Y является алкиленом, содержащим от 5 до 9 атомов углерода, Ri представляет низший алкил, низший-алкокси(Сі 3 алкил), низшие алкоксикарбонил, циклопропил или трифторметил, R2 и R3 независимо представляют водород, низший алкил, галоид, низший-алкокси, нитро, трифторметил или гидрокси, a R4 представляет водород или низший алкил, где низший алкил и низшие алкокси каждый содержат от 1 до 5 атомов углерода, при условии, что если Ri является низшим алкилом, по крайней мере, один из F 2 и Яз представляет гидрокси ? В настоящем изобретении предложено соединение формулы о (1} где Ri представляет алкил, алкокси, гидрокси, циклоалкил, гидрокси ал кил, алкоксиалкил или гидрокси алкокси, Y является алкиленом, содержащим от 3 до 9 атомов углерода, R2 и Rs независимо представляют водород, алкил, алкокси, галоид, трифторметил или нитро, а RA является алкокси, гидрокси, гал о ид метил ом, дигалоидметилом, тригалоидметилом, циклоалкилом, алкоксикарбонилом, гидроксиалкилом, алкоксиалкилом алканкарбонилоксиалкилом, циано, 2,2,2-трифторэтилом, (4-метилфенил)сульфонилоксиметилом, N=Q или CON=Q, где N=6 является амино, алкиламино, или их фармацевтически приемлемые соли присоединения кислот В настоящем изобретении предложено также соединение формулы HC=C-Y-0 где Y, R2 и Из имеют указанные ранее значения, а Re представляет алкокси, фторметил, дифторметил, тригалоид метил, циклоалкил, или алкоксиалкил В настоящем изобретении предложено также соединение формулы где R2 и R3 имеют указанные ранее значения, a R? представляет алкокси, фторметил, дифторметил, трифторметил, циклоалкил, алкоксиалкил, или циано В настоящем изобретении предложены также соединения формул XVII и XXI (следуют далее) В настоящем изобретении предложены также композиции для борьбы с пикорнавирусом, которые содержат также эффективное против вируса количество соединения формулы І в смеси с подходящим носителем или разбавителем и способы борьбы с пикорнавирусом, которые включают борьбу с инфекцией пикорнавируса у млекопитающих Соединения формулы I пригодны в качестве агентов против пикорнавируса Соединения формул III, IV, XVII и XXI пригодны в качестве интермедиатов для получения соединений формулы I Предпочтительными соединениями формулы I являются соединения, в которых Ri является Сч залкилом, Сі залкокси, гидрокси, циклопропилом, гидрокси-С-! залкилом, Сі-залкоксиС-, залкилом или гидрокси-Сі Залкокси, Y является алкиленом, содержащим от 3 до 9 атомов углерода, особенно, от 3 до 5 атомов углерода, R2 и Rs независимо являются водородом, Сл залкилом, Сі залкокси или галоидом, а R4 является Сі залкокси, гидрокси, галоидметилом, дигалоидметилом, тригалоидметилом, циклрлропилом Сі эалкоксикарбонилом, гидрокси-С]. залкилом С13алкокси-Сі-залкилом, (Сі залкил)карбонилокси-Сі залкилом, циано, 2,2,2-трифторэтилом,4-(метилфенил)-сульфонилоксиметилом, N=Q или CON=Q, где N=Q является амино, Сі залкиламино или ди-(Сі Залкил)амино Более предпочтительными соединениями формулы I являются соединения формулы R. (ІА) где R1( Y, R2, R3 и R4 имеют указанные ранее для формулы I значения и особенно те, в которых Ri, Y, R2, R3 и R4 имеют значения, указанные в предыдущем пункте для предпочтительных соединений формулы I Особенно предпочтительными являются соединения формулы I или ІА, в которых R4 представляет Сі залкокси, трифторметил, дигалоидметил, тригалоидметил, циклоалкил или Сі залкоксиСі Залкил, особенно, трифторметил Следует учитывать, что соединения настоящего изобретения, в которых 1,2,4-оксодиазольное кольцо замещено гидрокси, амино или алкиламино, могут существовать в любой из трех таутомерных форм л V н или или где R4 представляет гидрокси, амино или алкиламино, а Т представляет U, NH или N-алкил, и такие таутомеры входят в объем настоящего изобретения В том смысле, как здесь использовано, если нет других специальных указаний, алкил, алкан, алкокси, циклоалкил и галоид каждый имеют следующие значения алкил и алкокси относятся к алифатическим радикалам, включая разветвленные радикалы, содержащие от одного до пяти атомов углерода Таким образом, алкильный фрагмент таких радика 35557 лов включает, например, метил, этил, пропил, изопропил, н-бутил, втор-бутил, трет.-бутил и пентил, алкан относится к одновалентным алифатическим радикалам, включая разветвленные радикалы, содержащие от одного до четырех атомов углерода. Так, алкановый фрагмент такого радикала включает, например, метил, этил, пропил, изопропил, н-бутил и втор-бутил; циклоалкил относится к алициклическим радикалам, содержащим от трех до шести атомов, что иллюстрируется циклопропилом, галоид относится к брому, хлору, йоду или фтору. В том смысле, как здесь использовано, гидроксиалкильные, алкоксиалкильные, гидрокси и алкоксигруппы могут находиться в любом доступном положении алкила. Так, гидроксиалкил и алкоксиалкил включают, например, гидроксиметил, 1гидроксиэтил, 2-гидроксиэтил, 2-гидроксипропил, 2-гидроксиизопропил, 2,3,4 и 5-гидроксипенти.л и т. п., и их соответствующие простые алкилэфиры В том смысле, как здесь использовано, в гидроксиалкокси, гидроксильная группа может находиться в любом доступном положении алкокси, отличном от положения С-1 Так, гидроксиалкокси включают, например, 2-гидроксиэтокси, 2гидроксипропокси, 2-гидраксиизопропокси, 2- и 5гидроксипентокси и т. п. Соединения формулы І, в которых Ri является алкилом, алкокси, циклоалкилом или алкоксиалкилом, Y, R2 и R3, имеют указанные ранее значения, a R4 является гидрокси, галоидметилом, дигалоид метилом, тригалоид метил ом, циклоалкилом, алкоксикарбонипом, алкоксиалкипом, алканкарбонилоксиалкилом или 2,2,2-трифторэтилом, можно получить способом, который включает осуществление взаимодействия амидоксима (Nгидроксикарбоксикидамида) формулы R2 \\—ч/_^_ J/ V-C=NOH с галоидангидридом, R4COX, алкипгалоидформиатом, ROCOX в том случае, если R4 в формуле I является гидрокси, где R является метилом или этилом, или галоидангидридом, (R4CO)2O, где R1f Y, R2, R3 и R4 имеют указанные ранее значения в этом пункте, а X является бромом, хлором, фтором или йодом, в безводных условиях до получения со ответствую щего соединения формулы I. Этот способ включает следующие методики. В одном способе амидоксим Y подвергают взаимодействию с галоидангидридом или ангидридом кислоты в присутствии органического или неорганического основания, например, пиридина, триэтиламина или карбоната калия, в инертном растворителе, например, ацетоне, метиленхлориде, хлороформе, толуоле или тетрагидрофуране, или в основании, которое также действует как растворитель, например, пиридине, при повышенной температуре (около 40-130°С), или при пониженной температуре (около 0-15"С) В последнем случае промежуточное 0-ацильное производное {C(NH2)=NOC(=0)-(R4 или OR)] выделяют и нагревают при температуре в интервале от около 10013СГС в течение промежутка времени достаточного для циклизации до оксадиазола формулы I, что обычно происходит за промежуток времени от около 5 минут до 4 часов. В другом способе амидоксим Y подвергают взаимодействию с галоидангидридом или ангидридом кислоты в кислоте, которая соответствует галоидангидриду или ангидриду кислоты при повышенной температуре (около 70-100°С). Соединения формулы I, в которых Ri представляет алкил, алкокси, циклоалкил или алкоксиалкил, Y, R2 и Rs имеют указанные ранее значения, a R4 представляет дигалоидметил, тригалоидметил, циклоалкил, алкоксиалкил, алканкарбонилоксиалкил или 2,2,2-трифторэтил, можно получить способом, который включает осуществление взаимодействия амидоксима Y с продуктом, полученным при взаимодействии карбоновой кислоты, R4CO4H, где Ri, Y, R2 и R4 имеют указанные ранее в этом пункте значения, с сочетающим агентом Г^Ы'-карбонилдиимидззолом, полученным как указано в примерах, в инертном растворителе, например, ацетоне, тетрагидрофуране, хлороформе, метиленхлориде или толуоле, при повышенной температуре (около 40-80°С) до получения соответствующего соединения формулы I. Соединения формулы І, в которых Ri представляет алкил, алкокси, циклоалкил, или алкоксиалкил, Y, R2 и R3 имеют указанные ранее значения, a R4 является аминогруппой, можно получить способом, который включает осуществление взаимодействия амидоксима Y, где R-i, Y, R2 и R3 имеют указанные ранее в этом пункте значения, с галоидцианом, CNXn, где Xi представляет бром, хлор ипи йод, в присутствии основания, например, бикарбоната калия или натрия, в спиртовом растворителе, например, этиловом спирте, при комнатной температуре до получения соединения формулы і, в котором R4 является аминогруппой. Соединения формулы І, в которых Ri представляет алкил, алкокси, циклоалкил или алкоксиалкил, Y, R2 и R3 имеют указанные ранее значения, a R4 является СНгСРз, можно получить, осуществляя взаимодействие амидоксима Y, где Ri имеет указанные ранее в этом пункте значения, а Y, R2 и R3 имеют указанные ранее значения, с кетен-1,3-пропендитиолацеталем формулы. S до получения соответствующего соединения формулы I Амидоксим Y и кетен-1,3-пропендитиолацеталь подвергают взаимодействию в присутствии трифтор ацетата серебра в инертном растворителе, например, тетрагидрофуране, диоксане, диметилформамиде или N-метилпирролидиноне, при температуре в интервале от около 60 до около 100°С. Предпочтительно вести реакцию в темноте Промежуточное соединение - амидоксим Y получают способом, изображенным на следующей схеме: CuCN НО Br VI R* VII 35557 VII о Бромфенол VI взаимодействует с цианидом меди в инертном растворителе при повышенной температуре, например, э диметилформзмиде при температуре кипения с обратным холодильником до получения цианофенола VII Последний подвергают взаимодействию с галоидизоксазолом VIII, где Хг представляет хлор, бром или йод в сухом инертном растворителе, например, ацетонитриле или N-метилпирролидоне, в присутствии основания, например, карбоната калия или гидроксида натрия, необязательно в присутствии каталитического количества йодида калия или йодида натрия, при повышенной температуре (50-120°С) до получения цианосоединения IX Цианосоединение IX реагирует с гидроксидамингидрохлоридом в присутствии основания, например, карбоната калия или натрия, ацетата натрия или гидроксида натрия, в спиртовом растворителе, например, этиловом спирте при повышенной температуре (50-150Х) до получения амидоксима Y Некоторые промежуточные соединения формулы IX, в которых RJ представляет алкил, циклоалкил или алкоксиалкил, a Y, F 2 и R3 имеют ука? занные ранее значения, можно получить при взаимодействии этинильного соединения XII описанного далее, с нитрил оксид ом, R T C H N ^ O , где R-i имеет указанные ранее в этом пункте значения по способу аналогичному тому, который описан далее для получения соединения I из этинильного соединения 1 1 1 Промежуточные бромфенолы формулы VI и цианофенолы формулы VII принадлежат к общеизвестному классу соединений и их легко получить известными способами Промежуточные галоидизоксаэолы формулы VIII можно получить способом, описанным в патенте США 4843087, например, при взаимодействии производного щелочного металла изоксазола формулы значения для R4| с нитрилоксидом формулы RICETN-Ю, который получают in situ из гидроксииминогалида формулы RiC(X3>=NOH, где Хз является хлором или бромом, в присутствии аминового основания, например, триэтиламина, пиридина или N-метилпирролидона Гидроксииминогалиды, которые можно также получить in situ, принадлежат к общеизвестному классу соединений и их легко получить обычными способами, например, при взаимодействии соответствующего альдегидоксима (R-iC=NOH) с галоидирующим агентом, например, N-хлорсукцинимидом или бромом Способ получения соединений формулы I за счет взаимодействия этинильного соединения формулы I!!, имеет место при нагревании реагентов в инертном полярном растворителе, например, диметилформамиде или N-метилпирролидоне, при температуре в интервале от около 20 до около 120°С. Промежуточные соединения формулы III получают по следующей схеме' VII * НС=С~У~Х2 • XI NR,OH'HCI нс=с-у-о—^ V-C=NOH XIII R, £ (R.CO)p CF,CH — I!) Цианофенол VII подвергают взаимодействию с галоидалкином XI, где Хг имеет указанные ранее значения, используя процедуру, описанную ранее для получения цианосоединения IX из соединений VH и Vllt, до получения этинильного соединения формулы XII. Этинильное соединение XII подвергают взаимодействию с гидроксиамингидрохлоридом, по способу аналогичному описанному ранее для получения амидоксима V из цианосоединения (X, до получения амидоксима формулы ХНІ Амидоксим ХЧІ подвергают взаимодействию с галоидангидридом R4 СОХ, ангидридом кислоты (R4CO)2O, карбоновой кислотой R4CO2H или CR (X) где Ri представляет алкил, алкокси, циклоалкил или алкоксиалкил, с дигалидом, X-rY'-Xs, где Y' является алкиленом, содержащим от 2 до 8 атомов углерода, с Х2 имеет указанные ранее значения Производное щелочного металла получают in situ, обрабатывая изоксазол X основанием органе-щелочного металла, таким как бутиллитий или диизопропиламид лития в безводных условиях Соединения формулы I, в которых Ri представляет алкил, циклоалкил или алкоксиалкил, Y, f?2 и R3 имеют указанные ранее значения, a R4 представляет алкокси, три галоид метил, циклоалкил, алкокси кар бо нил, алкоксиалкил или 2,2,2трифторэтил, можно получить способом, который включает осуществление взаимодействия этинильного соединения формулы ІІІ указанного ранее, где R6 имеет указанные ранее в этом пункте по способу, аналогичному описанному ранее для получения соединений формулы I из амидоксима Y Галоидалкины формулы XI принадлежат к общеизвестному классу соединений Соединения формулы І, в которых Ri представляет алкил, алкокси, циклоалкил или алкоксиалкил, Y, R2 и R3 имеют указанные ранее значения, a R4 представляет алкокси, тригалоидметил, циклоалкил, алкокси карбон ил, алкоксиарил или 2,2,2-трифторэтил, можно получить способом, который включает взаимодействие фенола формулы IV, приведенной ранее, где R2 и R3 имеют указанные ранее значения, a R7 имеет указанные ранее в этом пункте значения для R4, с галоидизоксазолом формулы VIII, где Rn имеет указанные ранее в этом пункте значения, a Y и Хг имеют ука 35557 занные ранее значения, до получения соответствующего соединения формулы I. Этот способ используют аналогично тому, который описан ранее для получения цианосоединения IX при взаимодействии цианофенола VII и гало ид изоксазол а VIII. Промежуточное соединение - галоидизоксазол VII можно получить как описано ранее Промежуточные фенолы формулы IV можно получить при взаимодействии цианофенола VII с гид р о ксил а мин гидрохлор ид ом, используя способ аналогичный описанному ранее для получения амидоксима Y из цианосоединения IX до получения амидоксима формулы C=NOH но - & • XIV Амидоксим XIV подвергают взаимодействию с R4COX, (R4CO2)O, R4CO2H или используя процедуру, аналогичную процедуре, описанной ранее для получения соединений формулы I из амидоксима Y, до получения соответствующего фенола формулы IV Соединения формулы \, в которых Ri представляет гидроксиалкил, Y, R2 и R3 имеют указанные ранее значения, a R* является дигалоидметилом, тригалоидметилом, циклоалкилом, алкоксиалкилом, 2,2,2-трифторэтилом или аминогруппой, можно получить из соединения формулы XVII -WVi \ф/ R, N' где Ri 1 представляет трет -бутил диметилсилилоксиалкил ((СН3)зС8і(Ме)2-0-алкил), a Y, R2l R3 и R4 имеют указанные ранее в этом пункте значения, за счет отщепления трет -бутилдиметилсилилового эфира. Отщепление трет -бутилдиметилсилилового эфира проводят, обрабатывая соединение XVII сильной органической кислотой, например, уксусной кислотой или трифторуксусной кислотой, или неорганической кислотой, например, тетрагидрофураном или диоксаном в присутствии воды при температуре в интервале от около 20 до около 60°С Соединение формулы XVII, где R4 представляет дигалоидметил, тригалоидметил, циклоалкил, алкоксиалкил или 2,2,2-трифторэтип, можно получить способом, который включает осуществление взаимодействия фенола IV, в котором R2 и R3 имеют определенные ранее значения, a R7 имеет значения указанные ранее в этом пункте для R4, с изоксазолом формулы XV и XVI Ni. у—(СН,),ОН или 73 О XV XVI где Ri', Y и Хг имеют указанные ранее значения Фенол IV подвергают взаимодействию с галоидизоксазолом XVI, используя способ аналогичный описанному ранее для получения циано соединения IX из цианофенола VII и галоидизоксазола VIII. Фенол IV подвергают взаимодействию с изоксазолом XV в присутствии диэтилазодикарбоксилата (ДЕАД) и трифенилфосфина в инертном растворителе, например, тетрагидрофуране, хлороформе, диметилформамиде или N-метилпирролидиноне, при температуре в интервале от около -20 до около 20°С. Промежуточное соединение фенол IV можно получить по способу, описанному ранее. Промежуточные иэоксаэолы XV и XVI можно получить при взаимодействии изоксазола X, где Ri является гидроксиалкил ом, с третбутилдиметилсилилхлоридом до получения соответствующего трет -бутилдиметилсилилового эфира формулы' о XVIII где Ri' имеет указанные ранее значения и взаимодействия производного щелочного металла соединения XV! И с этиленоксидом или X2-Y'-X2 соответственно. Изоксазол X, где Ri является гидроксиалкилом, подвергают взаимодействию с трет.бутил(диметил)силилклоридом в присутствии 4(диметиламино)пиридина и основания, например, триэтиламина, пиридина или имидазола в сухом инертном растворителе, например, метиленхлориде, хлороформе или тетрагидрофуране, при комнатной температуре до получения соединения XVIII. Изоксазол XV получают при взаимодействии производного щелочного металла соединения XVIII с этиленоксидом, предпочтительно, в присутствии хелатирующего агента, например, МДМ'.Ы'-тетраметилэтилендиамина или гексаметилфосфортриамида в сухом инертном растворителе, например, тетрагидрофуране, при температуре в интервале от около -78 до около 20°С Производное щелочного металла получают in situ за счет взаимодействия соединения ХУШ с органическим основанием щелочного металла, например, бутиллитием - или литийдиизопропиламидом в безводных условиях. Соединение формулы XVII, где R4 представляет дигалоидметил, тригалоидметил, циклоалкил, алкоксиалкил или 2,2,2-трифторэтил, можно получить также, как и соединение формулы, где R4 является аминогруппой в соответствии со схемой 35557 Х\или XVI+VU =NOH R^COX ИЛИ (R 4 CO) 2 O ИЛИ R4CO.jH V XVII S—л ИЛИ CNX, ИЛИ CF 3 CH=( с ) ' Реакцию соединения XV или XVI с цианофенолом VII до получения соединения XIX ведут по способу, аналогичному описанному ранее для получения соединения XVII за счет взаимодействия фенола IV с изоксазолом XV или галоидизоксазолом XVI, соответственно Реакцию цианосоединения XIX с гидроксиламингидрохлоридом до получения амидоксима XX, и последнего с галоидангидридом, ангидридом кислоты, карбоновой кислотой, галоидцианом или кетен-1,3пропандитиолацеталем до получения соединения XV!) можно вести способом, аналогичным описанному ранее для получения амидоксима У из цианосоединения JX и для получения соединения формулы I из амидоксима У Соединения формулы І, где Ri представляет гидрокси, Y, R2 и Яз имеют указанные ранее значения, a R4 представляет циклоалкил или алкоксиалкил, можно получить при взаимодействии соединения формулы XXI где R8 представляет алкил, а У, Яг, Рз и R4 имеют указанные ранее значения в этом пункте, с гидроксиламингидрохлоридом до получения соединения формулы I, где R-t является гидрокси Соединение XXI подвергают взаимодействию с гидроксиламингидрохлоридом в присутствии основания, например, гидроксида натрия и воды в спиртовом растворителе, например, метиловом или этиловом спирте, при комнатной температуре в интервале температур от около 0 до около 25°С Промежуточные соединения формулы XXI можно получить при взаимодействии производного щелочного металла соединения III, где Re имеет значения, указанные для R4 соединения XXI, с алкилгалоидформиатом, ReOCOX, где X имеет указанные ранее значения Реакция идет в сухом инертном растворителе, например, тетрагидрофуране или диоксане, при начальной температуре от около -78 до около -20°С с последующим нагреванием до около 20-25°С Производное щелочного металла можно получить in situ при взаимодействии соединения ІІІ с органо-щелочным металлом, например, бутиллитий или литиидиизопропиламидом в безводных условиях. Некоторые соединения формулы I являются промежуточными для других соединений формулы I, как указано ранее Галоидангидриды, алкилгалоидформиаты и ангидриды кислот используют в ранее описанных способах получения соединений формулы I и их промежуточных соединений, принадлежащих к хорошо известным классам соединений, и их можно легко получить известными способами Соединение формулы I, где Ri представляет алкил, циклоалкил или алкоксиалкил, Y, R2, R3 имеют указанные ранее значения, a R4 является алкокси или N=Q, где N=Q является алкиламино или диалкиламино, можно получить из соответствующих соединений формулы I, где R4 является трихлорметилом В том случае, если R4 является алкокси, трихлорметильное соединение подвергают взаимодействию с алкоксидом щелочного металла, например, метоксидом натрия или этоксидом натрия, и в этом случае, если R4 является N=Q, с амином [ HN=qj, в подходящем растворителе, например, диметилформамиде или Nметилпирролидиноне, при комнатной температуре до получения соответствующего соединения формулы I, где R4 является алкокси, алкиламино или диалкиламино Соединения формулы (, где Ri является гидроксиалкилом, Y, R2 и R3 имеют указанные ранее значения, a R4 представляет гидрокси, дигалоидметил, три галоид метил, циклоалкил, гидроксиалкил, 2,2,2-трифторэтил или амино, можно получить из соответствующего соединения, где Ri является алкоксиалкил ом, за счет эфирного отщепления алкоксиалкильного фрагмента Алкоксиалкильное соединение обрабатывают триметилсилилйодидом в сухом инертном растворителе, например, 1,2-дихлорэтане, хлороформе или ацетонитриле, при температуре в интервале от около 60 до около 80°С до получения соответствующего гидроксиалкильного соединения Соединения формулы I, где Ri представляет алкил, алкокси, циклоалкил или алкоксиалкил, У, R2 и R3 имеют указанные ранее значения, a R4 является CON=Q, где N=Q является амино, алкиламино или диалкиламино, можно получить при взаимодействии соответствующего соединения формулы I, где R4 является алкоксикарбонилом, с амином HN=Q в полярном растворителе, например, этиловом спирте или N-метилпирролидиноне, при комнатной температуре до получения соответствующего соединения, где RA является CON^Q Соединение формулы I, где Ri является алкилом, алкокси, циклоалкилом или алкоксиалкил ом, У, R2 и R3 имеют указанные ранее значения, a R4 является циано, можно получить из соответствующего соединения, где R4 является CON=Q, где N=Q является амино, за счет обработки последнего трифторуксусным ангидридом в присутствии основания, например, пиридина или триэтиламина, в сухом инертном растворителе, например, тетрагидрофуране, хлороформе или 1,2дихлорэтане, при температуре в интервале от около 0 до около 20°С Соединения формулы I, где Ri является алкокси или гидроксиалкокси, У, R2 и Ra имеют указанные ранее значения, a R4 является алкокси, 35557 тригалоид метилом, циклоалкилом, алкоксиалкилом, 2,2,2-трифторэтилом или диалкиламино, можно получить этерификациеи соответствующего соединения формулы I, где Ri является гидрокси. Этерификация протекает при взаимодействии гидроксильного соединения с алкилгалидом или гидроксиалкилгалидом, где галид является бромидом, хлоридом или йодидом в присутствии основания, например, карбоната калия или карбоната натрия в сухом инертном растворителе, например, ацетоне, бутаноне или ацетонитриле, при температуре в интервале от около 50 до около 90°С. Соединения формулы I, где Ri представляет алкил, циклоалкил, гидроксиалкил, алкоксиалкил или гид рокси алкокси, Y, R2 и R3 имеют указанные ранее значения, a R4 является гидроксиалкилом, можно получить трансэтерификацией соответствующего соединения формулы !, где R4 является алканкарбонилоксиалкилом Трансэтерификацию ведут, обрабатывая алканкарбонилоксиалкильное соединение неорганическим или органическим основанием, например, карбонатом калия, бикарбонатом натрия или триэтиламином в спиртовом растворителе, например, метиловом или этиловом спирте при комнатной температуре. Соединения формулы I, где Ri представляет алкил, циклоалкил или під роке и ал кил, Y, R2 и R3 имеют указанные ранее значения, a R< является гидроксиалкилом, можно также получить эфирным отщеплением соответствующего соединения формулы !, где R* является алкоксиалкил ом. Эфирное отщепление можно вести, обрабатывая алкоксисоединение триметилсилилйодидом способом, аналогичным описанному для получения соединения формулы !, где Ri является гидроксиалкилом Соединение формулы I, где Ri представляет алкил, алкокси, циклоалкил, гидроксиалкил, алкоксиалкил или гидроксиалкокси, Y, R2 и R3 имеют указанные ранее значения, a Rj является йодометилом, можно получить из соответствующего соединения формулы I, где R4 представляет хлорметил, при взаимодействии с йодидом щелочного металла, например, йодидом натрия. Реакция идет при обработке хлорметильного соединения йодидом щелочного металла, например, йодидом натрия или калия, в инертном растворителе, например, ацетоне или бутаноне при температуре около 20°С. Соединения формулы I, где R-i представляет алкил, алкокси, циклоалкил или алкоксиалкил, Y, R2 и R3 имеют указанные ранее значения, a R-i представляет (4-метилфенил)сульфонилоксиметил, получают из соответствующего соединения формулы I, где R4 представляет гидроксиметил, при взаимодействии с (4-мети л фен ил) сул ь фон илгалоидом, где галоид является бромом, хлором или йодом, в присутствии неорганического основания, например, карбоната калия или бикарбоната натрия. Реакция идет при взаимодействии реагентов в инертном растворителе, например, метиленхлориде, хлороформе или 1,2-дихлорэтане, при температуре около 20°С, Соединения формулы I являются достаточно основными для образования стабильных солей присоединения кислот, с сильными кислотами, и такие соли также входят в объем настоящего изобретения Природа соли присоединения кислоты несущественна при условии, что она получена из аниона кислоты, которая практически не токсична по отношению к организмам животных. Соответствующие соли присоединения кислот включают гидрохлорид, гидробромид, сульфат, кислый сульфат, малеат, цитрат, тартрат, метансульфонат, пара-тол у ол сул ьфонат, додецилсульфат и циклогексан сул ьфонат Соли присоединения кислот получают обычными способами, известными специалистам В различных способах, описанных ранее, для получения соединений настоящего изобретения, следует учитывать, что реакцию следует вести в течение промежутка времени, достаточного для того, чтобы обеспечить получение целевого продукта, и что для каждого конкретного типа реакции время реакции будет зависеть от одного или более из таких факторов, как например, природа реагентов, используемый растворитель и/или температура проведения этой реакции. Противовирусные соединения настоящего изобретения создают для использования за счет приготовления разбавленного раствора или суспензии в фармацевтически приемлемой водной, органической или водно-органической среде для поверхностного или парентерального введения внутривенной или внутримышечной инъекцией, или офтальмологического применения или через нос, или приготавливают в виде таблеток или водных растворов с соответствующими зкецепиентами для орального приема Структуры соединений настоящего изобретения были установлены с помощью типов синтеза и элементного анализа, а также с помощью ИК спектроскопии, ЯМР и/или масс-спектров Далее настоящее изобретение будет описано со ссылкою на следующие примеры, которые ни коим образом не ограничивают объем изобретения Пример 1. а) 3-(3-метилйзоксазол-5-ил)п рол иловый спирт 3,5-диметилизоксазол (X) (220 г, 2,27 моля) в 2,2 л тетрагидрофурана в атмосфере азота охлаждают при перемешивании до -75°С и за 1 час добавляют 908 мл 2,5М н-бутиллития (2,27 моля) в гексанах, поддерживая при этом температуру менее 65°С Охлажденный раствор перемешивают в течение 30 минут, после завершения добавления, а затем обрабатывают при -70пС раствором 112 г (2,54 моля) этиленоксида в 390 мл тетрагидрофурана за промежуток времени 1,5 часа, поддерживая при этом температуру около -65°С и перемешивая в течение ночи. Смесь при 8°С гасят при продолжении охлаждения в бане при 8°С, добавляя 1,2 и 2,5М соляной кислоты за промежуток времени 20 минут, причем за это время температура повышается до 23аС, и перемешивают в течение 10 минут. Органическую фазу выделяют, промывают 500 мл воды и концентрируют до получения 147 г указанного в заглавии соединения в виде коричневого масла Объединенные водные фазы (исходную'+ фазу промывки) экстрагируют метил-трет.-бутиловым эфиром (3x200 мл) и объединенные органические экстракты концентриру 35557 ют до получения дополнительно 125 г указанного в заглавии соединения в виде коричневого масла b) 3-(3-метилизоксазол-5-ил)пропилхлорид (VIII) К продукту из части (а) (125 г, 0,885 моля) в 1225 мл метиленхлорид а добавляют 192 мл (2,63 моля) тионилхлорида за промежуток времени около 1 часа, причем за это время температура повышается до 40°С при осторожном перемешивании. Нагревание при кипячении с обратным холодильником продолжают в течение 3 часов, реакционною смесь оставляют на ночь, а затем кипятят с обратным холодильником в течение 1 часа Реакционную смесь добавляют равномерной струйкой к 3 кг ледяной воды при интенсивном перемешивании, причем перемешивание продолжают в течение 1 часа, и выделяют водную фазу. К органической базе добавляют 1 л воды, а затем 161 г твердого бикарбоната натрия порциями при интенсивном перемешивании. Органическую фазу выделяют и концентрируют в вакууме до получения черно-коричневого масла, которое очищают пленочной перегонкой до получения 94 г указанного в заглавии соединения в виде желтого масла с т кипения 65°С/0,09 мм со скоростью, которая поддерживает умеренный рефлекс После добавления смеси дают остыть до комнатной температуры и разбавляют водой. Полученный твердый продукт промывают водой, сушат в вакууме и очищают хроматографически (силикагель 60, 15-40% этилацетата в гексанах) до получения 4,76 г чистого указанного в заглавии соединения в виде белого твердого продукта. Т. пл 61-62°С. Пример 2. а) 3,5-дифтор-4-гидроксибензонитрил (VII) Смесь 4-бром-2,6-дифторфенола (VI) (4,00 г, 19,0 ммоля), цианида меди (I) (0,72 г, 19,0 ммоля) и дим етил форм а мида (400 мл) кипятят с обратным холодильником в течение 6 часов, охлаждают до комнатной температуры, разбавляют водой (150 мл) и фильтруют Полученную желтокоричнееую твердую часть промывают водой и оставляют. Объединенные фильтраты подкисляют (1н НСІ) и экстрагируют этилацетатом Объединенные органические экстракты сушат над сульфатом магния, концентрируют в вакууме и очищают хроматографически с мгновенным испарением (силикагель 60, 20% этилацетат в гексанах) до получения 1,03 г чистого указанного в заглавии соединения в виде грязно-белого твердого продукта, т. плавления 195-197°С. c) 3,5-диметил-4-(3-{3-метилизоксазол-5-ил) пропилокси)-бензонитрил (IX) Смесь 3,5-д и метил-4-гидроксибензо нитрила (VII) (7,36 г, 50,0 моля), сухого N-метилпирролидинона (100 мл), измельченного карбоната калия (13,3 г, 100 молей), йодида калия (0,84 г, 5,0 ммоля) и продукта из части (Ь) (12,0 г, 75,0 ммоля) перемешивают при 60°С в течение 18 часов После охлаждения до комнатной температуры полученную смесь разделяют между 200 мл воды и 100 мл этилацетата Водный слой дважды экстрагируют порциями по 50 мл этилацетата Объединенные органические экстракты промывают водой, рассолом, сушат над сульфатом магния и концентрируют в вакууме до получения 18,3 г желтого масла. Жидкостная хроматография среднего давления (силикагель 60, 50x460 мм, 25% этилацетат гексанах) обеспечивает 12,7 г (94,1%) чистого указанного в заглавии соединения в виде твердого белого продукта 46-48аС (метанол), Полученный желто-коричневый твердый продукт суспендируют в этилацетат с небольшим количеством ацетона, фильтруют и концентрируют в вакууме. Полученный остаток разделяют между этилацетатом и 1м НСІ. Водную фазу экстрагируют этилацетатом, и объединенные органические фазы очищают, как было указано ранее, до получения дополнительных 0,45 г (49% полный выход) чистого указанного в заглавии соединения. Нижеследующие соединения получают способами, аналогичными способу примера 1 (с) Пример Соединение 3,5-дифтор-4-(3-(3-метилизоксазол-52Ь ил)пропилокси)-бензонитрил, (IX) т. пл. 23-24,5°С (эфир (гексаны) - полученный из 3,5-дифтор-4-гидроксибензонитрила (VII), и продукт примера 1Ь выход 49,1% 3,5-дифтор-4-(3-(3-метилизоксазол-5За ил)пропилокси)-бензонитрил, (IX) т.пл. 69,5-70,5°С (метанол)/(белый твердый продукт) - полученный из 3,5-дифтор4-гидроксибензонитрила (VII), и продукт примера 1b (V11I), выход 80,7% Нижеследующие соединения получают способом, аналогичным способу примера 1d' Пример Соединение 2с 3,5-дифтор-4-(3-(3-метилизоксазол-5ил)пропилокси)-Ыгидроксибенэолкарбоксимидамид (V), т пл 122-124"С, получен из продукта примера 2Ь (IX), выход 86%. Сырой продукт очищают, суспендируя в 10% этаноле в хлороформе, фильтруя, концентрируя в вакууме и тщательно растирая полученный твердый белый продукт в холодном хлороформе ЗЬ 3,5-дихлор-4-(3-(3-метилизоксазол-5ил)пррпилокси)-М-гидроксибензолкарбоксимидамид (V) получают из d) 3,5-диметил-4-(3-((3-метилизоксазол-5-ил) пропилоксиЭ-М-щдроксибензолкарбоксимидамид^) Смесь продукта, полученного в части (с) (18,4 г, 68,1 ммоля) абсолютированного этанола (200 мл), измельченного карбоната калия (46,9 г, 0,34 моля) и гидроксиамингидрохлорида (23,6 г, 0,34 моля) кипятят с обратным холодильником в течение 18 часов. Горячую смесь фильтруют и оставшуюся твердою часть промывают горячим этанолом. Объединенные фильтраты концентрируют в вакууме до получения 19,4 г (93,9%) указанного в заглавии соединения в виде белого порошка, который был достаточной степени чистоты, чтобы быть использованным на последних стадиях Образец пере кристалл и зовывают из этанола до получения белого твердого продукта с т плавления 129-130,5°С. e) 5-(3-{2,6-диметил-4-(5-трифторметил-1,2,4оксадиазол-3-ил)фенокси)пропил}-3-метилоксаэол (1, Ri=CH 3 , У=(СН2)з, R2 и Вз=2,6-(СН3)2, R4=CF3) К раствору продукта из части (d) (4,38 г, 14,4 моля) в 8,0 мл сухого пиридина добавляют 4,07 мл (28Т8 моля) трифторуксусного ангидрида 9 35557 (5,5 мл) После перемешивания при 0°С в течение часа реакционную смесь разбавляют водой (100 мл) и экстрагируют метиленхлоридом (3x25 мл) Объединенные органические экстракты промывают рассолом, сушат над сульфатом магния, фильтруют через короткую колонку Флорисил и концентрируют в вакууме до получения неочищенного иитермедиата - О-ацильного производного в виде грязно-белого твердого продукта, который затем нагревают при 120-130°С в течение 45 минут до получения указанного в заглавии соединения (2,38 г, 75,4%), т. пл 194-195°С (метанол), (белые иголки). Нижеследующие соединения получают способом примера 8: Соединение Пример 9 5-(3-(2,6-диметил-4-(5-метилкарбонилоксиметил-1,2,4-оксадиазол-3-ил)фенокси)пропил)-3-метилизоксазол (1; R 1 = CH 3 , Y=(CH2)3j R2 и R3 =2,6-(CH3)2l R4=CH2OCOCH3), т. пл. 71-73еС (эфир/гексаны) (белое твердое вещество) из продукта примера 1d (V) и ацетоксиацетилхлорида, выход 71,3%. Неочищенный продукт очищают хроматограф ически (силикагель 60, 35% этилацетат в гексанах) 10 5-(3-(4-(5-хлорметил-1,2,4-оксадиазол3-и л )-2,6-д и мети л фенокси )п ро п ил)- 3метилизоксазол (1; Ri=CH 3 , У=(СН2)з, Я2 и R3 =2,6-(СНз)2, R4=CH2C!), т.пл. 7576°С (метанол), (белый твердый продукт) из продукта примера 1d (V) и хлорацетилхлорида Неочищенный продукт очищают хроматографически {силикагель 60, 20% этилацетат в гексанах), выход 76,2% 5-(3-(2,6-диметил-4-(5-(1-метилкарбо11 нилоксиэтил)-1,2,4-оксадиазол-Зил)фенокси)пропил)-3-метилизоксазол (1; Ri=CH 3 , Y=(CH2)3, R2 и R3 =2,6(СНз)2, R4=CH(CH3)OCOCH3), Т. пл 7777,5°С (белый твердый продукт) из продукта примера 1d (V) и 2ацетоксипропионилхлорида, выход 64,6% продукта примера За (IX) (0,5 г), 0,78 г продукта получают после концентрирования фильтратов в виде маслянистого твердого вещества, и используют на следующей стадии. Нижеследующие соединения получают способом, аналогичным примеру 1е: Пример Соединение 2d 5-(3-(2,6-дифтор-4-(5-трифторметил1,2,4-оксадиазол-3-ил)фенокси)пропил)-3-метилизоксазол (1; Яі=СНз, Y=(CH2b, R2 и R3 =2,6-/F/2, R«=CF3), т. пл 36-37°C (гексаны) (белый твердый продукт) из продукта примера 2с (V) и трифторуксусного ангидрида, выход 44,5% Зс 5-(3-(2,6-дихлор-4-(5-трифторметил1,2,4-оксадиаэол-3-ил)фенокси)пропил)-3-метилизоксазол (1; Ri=CH 3 , Y=(CH2)3, R2 и R3 =2,6-(CI)2, R4=CF3), т. пл. 65-67°С (гексаны) (белый твердый продукт) из продукта примера ЗЬ (V) и трифторуксусного ангидрида, выход 80,5% 4 5-(3-(4-(5-циклопропил-1,2,4-оксадиазол-3-ил)-2,6-диметилфенокси)пропил)3-метилизоксазол (1; Ri=CH3, Y=(CH2)3, R2 и R3 =2,6-(СНз)г, R4 - циклопропил), т. пл. 85-8В°С (метанол), (белый твердый продукт) из продукта примера 1d (V) и циклопропанкарбонилхлорида, выход 71,0% 5 5-(3-(2,6-диметил-4-(5-метоксиметил1,2,4-оксадиазол-3-ил)фенокси)пропил)-3-метилизоксазол (1, Рїі=СНз, Y=(CH2)3, R2 и R3 = 2,6-(СНз)2, R4=CH2OCH3), т. пл. 63-64Х (эфир/гексан) (белый твердый продукт) из продукта примера 1d (V) и метоксиацетилхлорида, выход 76,1% 6 5-(3-(2,6-диметил-4-(5-фторметил1,2,4-оксадиазол-3-ил)фенокси)пропил)-3-метилизоксазол (1, Ri=CH 3 , Y=(CH2)3, R2 и R3 = 2,6-(СНз)2, R4=CH2F), т. пл. 80-80,5°С (метанол) (белый твердый продукт) из продукта примера 1d (V) и фторацетилхлорида, выход 67,8% 7 5-(3-(2,6-диметил-4-(5-этоксикарбонил1,2,4чэксадиазол-3ил)фенокси)пропил)-3-метилизоксазол (1; Ri=CH3, Y=(CH2)3, R2 и R3 = 2,6(СНз)2, R4=CO2CH2CH3), т.пл. 105106аС (этил ацетат/гексан) {белый твердый продукт) из продукта примера 1d (V) и этилоксалилхлорида, выход 67,8% Пример В. 5-{3-(2,6-диметил-4-(5-оксо-4|5-дигидро-1|214оксадиазол-3-ил)фенокси)лролил)-3-метилизоксазол (таутомер 1, где R,=CH3, У=(СН2)з, R2 и Из =2,6-(СН3)2, R4=OH). К охлажденной (0°С) суспензии продукта примера 1d (V) (3,03 г, 10,0 ммоля), сухого ацетона (30 мл) и тонко измельченного карбоната калия (1,52 г, 11 ммоля) прикапывают раствор этилхлорформата (1,05 мл, 11,0 ммоля) в ацетоне Пример 12. 5-(3-(2,6-диметил-4-(5-трихлорметил-1,2,4-оксдиазоп-3-ип)фенокси)пропил)-3-метипизоксазол (1; Ri=CH3, Y=(CH2)3, R 2 H R 3 =2,6-(CH 3 ) 2 , R4=CCI3). Трихлоруксусную кислоту (22,8 г, 140 ммолей) добавляют к продукту примера 1d (V) (10,6 г, 34,8 ммоля) и нагревают при 85"С до получения густого раствора. Трихлорацетилхлорид (14,5 мл, 69,6 ммоля) добавляют тремя равными порциями. После добавления первой порции начинается интенсивная реакция. Смесь нагревают в течение дополнительного часа при 94°С. Охлажденную смесь разбавляют водой и экстрагируют этилацетатом (3x25 мл). Объединенные органические фазы промывают насыщенным раствором бикарбоната натрия, сушат над сульфатом магния и концентрируют в вакууме до получения 10,1 г органического масла. После хроматографической обработки (силикагель 60, метиленхлорид) получают 6,94 г желтого масла, которое кристаллизуется из метанола до получения 5,03 г чистого соединения 10 35557 указанного а заглавии в виде белых иголок. Т пл. 77-77,5°С Пример 13. 5-(3-{4-(5-дихлорметил-1,2,4-оксадиазол-3-ил}2,6-диметилфенокси)пропил)-3-метилизоксазол (1; Ri=CH 3 , Y=(CH2}3, R2 и R3 =2,6-{CH3)2, R4=CHCI2) Дихлоруксусную кислоту(1,24мл, 15,0ммоля) добавляют к продукту примера 1d (V) (1,14 г, 3,76 ммоля) и нагревают при 85°С до получения раствора. Быстро прикапывают дихлоруксусный ангидрид (1,14 мл, 7,52 ммоля) и перемешивают при 85°С в течение дополнительного часа. После обработки по способу примера 12 получают 1,51 г желто-коричневого масла, которое после хроматографической очистки (силикагель 60, 25 этилацетат в гексанах) дает 1,37 г (91,3%) чистого указанного в заглавии продукта в виде бледно-желтого масла, которое при стоянии отверждается. Т. пл 52-53°С (этанол). руют этилацетатом (3 х) Объединенные органические экстракты промывают водой, рассолом, сушат над сульфатом магния и концентрируют в вакууме. Неочищенный остаток (0,64 г) очищают хроматографически (силикагель 60, вначале 2% метанолом в метиленхлориде, а затем 5% этилацетатом в метиленхлориде) до получения чистого указанного в заглавии соединения (308 мг) в виде бесцветного масла, которое кристаллизуют из метанола. Т. пл. 64,5-65,5оС (белое твердое вещество). Пример 17. 5-(3-
ДивитисяДодаткова інформація
Назва патенту англійською1,2,4- oxadiazolyl-phenoxyalkylisoxazole derivatives having antiviral activity and pharmaceutical composition based thereon
Автори англійськоюGuy Dominic Diana, Theodore John Nitz
Назва патенту російськоюПроизводные 1,2,4-оксадиазолилфеноксиалкилизоксазола, обладающие противовирусной активностью и фармацевтическая композиция на их основе
Автори російськоюГай Доминик Диана, Теодор Джон Нитц
МПК / Мітки
МПК: A61P 31/12, C07D 413/14, A61K 31/4245, C07D 413/12, A61K 31/42
Мітки: мають, похідні, основі, противірусну, 1,2,4-оксадіазолілфеноксіалкілізоксазолу, композиція, фармацевтична, активність
Код посилання
<a href="https://ua.patents.su/18-35557-pokhidni-124-oksadiazolilfenoksialkilizoksazolu-shho-mayut-protivirusnu-aktivnist-ta-farmacevtichna-kompoziciya-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Похідні 1,2,4-оксадіазолілфеноксіалкілізоксазолу, що мають противірусну активність та фармацевтична композиція на їх основі</a>
Попередній патент: Спосіб одержання гідрокортизону та проміжні сполуки в синтезі гідрокортизону
Наступний патент: Похідні бензімідазолу і фармацевтична композиція, що має антагоністичну активність по відношенню до ангіотензину
Випадковий патент: Спосіб прогнозування ефективності лікування ураження суглобів у хворих з псоріатичним артритом












