Спосіб одержання ефірів циклопропілкарбонової кислоти та сполуки, одержані цим способом
Номер патенту: 79924
Опубліковано: 10.08.2007
Автори: Джоунс Елфін, Мінідіс Анна, Кларк Адріан, Ларссон Ульф
Формула / Реферат
1. Спосіб одержання проміжної сполуки формули (І):
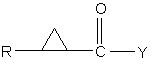 ,(I)
,(I)
в якій:
R представляє феніл, заміщений одним або декількома галогенами;
Y представляє OR1, де R1 являє собою лінійний алкіл, розгалужений алкіл, циклоалкіл або заміщений біциклогептил, який включає:
взаємодію солі триметилсульфоксонію з твердим гідроксидом металу в диметилсульфоксиді при кімнатній або підвищеній температурі з одержанням диметилсульфоксонію метиліду; і
взаємодію сполуки формули (II):
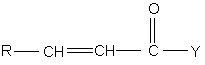 ,(II)
,(II)
де R і Y мають значення, визначені вище, з диметилсульфоксонієм метилідом в присутності розчинника при температурі в межах - 10-90°С.
2. Спосіб одержання проміжної сполуки формули (І):
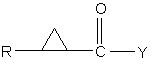 ,(I)
,(I)
в якій:
R представляє феніл, заміщений одним або декількома галогенами;
Y представляє OR1, де R1 являє собою лінійний алкіл, розгалужений алкіл, циклоалкіл або заміщений біциклогептил, який включає:
а) хлорування сполуки формули (III):
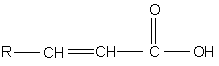 ,(III)
,(III)
де R має значення, визначені в п. 1, взаємодією з хлоруючим реагентом у присутності інертного розчинника і каталізатора при температурі в межах 0-200°С, і потім взаємодією одержаного розчину з YH або Y-, де Y має значення, визначені вище, при підвищеній температурі, з одержанням сполуки формули (II):
 ,(II)
,(II)
де R і Y мають значення, визначені вище;
б) взаємодію солі триметилсульфоксонію з твердим гідроксидом металу в диметилсульфоксиді при кімнатній або підвищеній температурі з одержанням диметилсульфоксонію метиліду; і
в) взаємодію сполуки формули (II) з диметилсульфоксонієм метилідом у присутності розчинника при температурі в межах - 10-90°С.
3. Спосіб одержання проміжної сполуки формули (І):
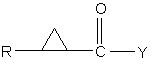 ,(I)
,(I)
у якій:
R являє собою феніл, заміщений одним або декількома галогенами;
Y являє собою OR1, де R1 являє собою лінійний алкіл, розгалужений алкіл, циклоалкіл або заміщений біциклогептил, що включає:
а) взаємодію сполуки формули (IV):
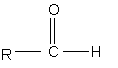 ,(IV)
,(IV)
де R має значення, визначені вище, з малоновою кислотою в присутності піридину і піперидину при підвищеній температурі, з одержанням сполуки формули (III):
 ,(III)
,(III)
де R має значення, визначені вище;
б) хлорування сполуки формули (III) взаємодією з хлоруючим реагентом у присутності інертного розчинника і каталізатора при температурі в межах 0-200°С, і потім взаємодією одержаного розчину з YH або Y-, де Y має значення, визначені вище, при підвищеній температурі, з одержанням сполуки формули (II):
 ,(II)
,(II)
де R і Y мають значення, визначені вище;
в) взаємодію солі триметилсульфоксонію з твердим гідроксидом металу в диметилсульфоксиді при кімнатній або підвищеній температурі з одержанням диметилсульфоксонію метиліду; і
г) взаємодію сполуки формули (II) з диметилсульфоксонієм метилідом у присутності розчинника при температурі в межах - 10-90°С.
4. Спосіб за будь-яким з пп. 1-3, у якому гідроксид металу є гідроксидом натрію.
5. Спосіб за пп. 2 або 3, у якому сполука формули (III) взаємодіє з тіонілхлоридом у присутності інертного розчинника і піридину при температурі в межах 0-200°С, і потім одержаний розчин взаємодіє з YH або Y-, де Y має значення, визначені в п. 1, при підвищеній температурі.
6. Спосіб за пп. 2 або 3, у якому YH являє собою L-ментол.
7. Спосіб за кожним з попередніх пунктів, у якому R являє собою феніл, заміщений одним або декількома атомами фтору.
8. Спосіб за п. 7, у якому R являє собою 3,4-дифторфеніл.
9. Спосіб за будь-яким з попередніх пунктів, у якому Y є хіральним.
10. Спосіб за п. 9, у якому Y являє собою L-ментокси.
11. Спосіб за будь-яким з пп. 1-10, у якому сполуку формули (І) розділяють з одержанням сполук формули (Іа):
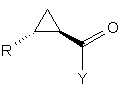 ,(Ia)
,(Ia)
де R і Y мають значення, визначені в п. 1, кристалізацією або хроматографічними методами.
12. Спосіб за п. 11, у якому розділення проводять шляхом екстракції сполуки формули (І) гептаном і потім проведенням кристалізації з гептанових екстрактів.
13. Проміжна сполука формули (І):
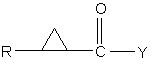 ,(I)
,(I)
у якій:
R являє собою феніл, заміщений одним або декількома галогенами; і Y являє собою OR1, де R1 являє собою лінійний алкіл, розгалужений алкіл, циклоалкіл або заміщений біциклогептил.
14. Проміжна сполука, що являє собою (1R,2S,5R)-2-ізопропіл-5-метилциклогексилтранс-2-(3,4-дифторфеніл)циклопропанкарбоксилат.
15. Проміжна сполука, що являє собою (1R,2S,5R)-2-ізопропіл-5-метилциклогексилтранс-(1R,2R)-2-(3,4-дифторфеніл)циклопропанкарбоксилат.
16. Проміжна сполука, що являє собою (1R,2S,5R)-2-ізопропіл-5-метилциклогексил (Е)-3-(3,4-дифторфеніл)-2-пропеноат.
Текст
1. Спосіб одержання проміжної сполуки формули (І): 3 79924 O (II) R CH CH C Y де R і Y мають значення, визначені вище; б) взаємодію солі триметилсульфоксонію з твердим гідроксидом металу в диметилсульфоксиді при кімнатній або підвищеній температурі з одержанням диметилсульфоксонію метиліду; і в) взаємодію сполуки формули (II) з диметилсульфоксонієм метилідом у присутності розчинника при температурі в межах - 10-90°С. 3. Спосіб одержання проміжної сполуки формули (І): O (I) R C Y у якій: R являє собою феніл, заміщений одним або декількома галогенами; Y являє собою OR1, де R1 являє собою лінійний алкіл, розгалужений алкіл, циклоалкіл або заміщений біциклогептил, що включає: а) взаємодію сполуки формули (IV): O (IV) R C H де R має значення, визначені вище, з малоновою кислотою в присутності піридину і піперидину при підвищеній температурі, з одержанням сполуки формули (III): O (III) R CH CH C OH де R має значення, визначені вище; б) хлорування сполуки формули (III) взаємодією з хлоруючим реагентом у присутності інертного розчинника і каталізатора при температурі в межах 0200°С, і потім взаємодією одержаного розчину з YH або Y-, де Y має значення, визначені вище, при підвищеній температурі, з одержанням сполуки формули (II): O (II) R CH CH C Y де R і Y мають значення, визначені вище; в) взаємодію солі триметилсульфоксонію з твердим гідроксидом металу в диметилсульфоксиді при кімнатній або підвищеній температурі з одержанням диметилсульфоксонію метиліду; і г) взаємодію сполуки формули (II) з диметилсульфоксонієм метилідом у присутності розчинника при температурі в межах - 10-90°С. Даний винахід відноситься до нового способу одержання деяких ефірів циклопропілкарбонової кислоти і інших похідних циклопропілкарбонової кислоти; новому способу одержання диметилсульфоксонію метиліду і диметилсульфонію метиліду; застосуванню деяких ефірів циклопропілкар 4 4. Спосіб за будь-яким з пп. 1-3, у якому гідроксид металу є гідроксидом натрію. 5. Спосіб за пп. 2 або 3, у якому сполука формули (III) взаємодіє з тіонілхлоридом у присутності інертного розчинника і піридину при температурі в межах 0-200°С, і потім одержаний розчин взаємодіє з YH або Y-, де Y має значення, визначені в п. 1, при підвищеній температурі. 6. Спосіб за пп. 2 або 3, у якому YH являє собою Lментол. 7. Спосіб за кожним з попередніх пунктів, у якому R являє собою феніл, заміщений одним або декількома атомами фтору. 8. Спосіб за п. 7, у якому R являє собою 3,4дифторфеніл. 9. Спосіб за будь-яким з попередніх пунктів, у якому Y є хіральним. 10. Спосіб за п. 9, у якому Y являє собою Lментокси. 11. Спосіб за будь-яким з пп. 1-10, у якому сполуку формули (І) розділяють з одержанням сполук формули (Іа): O (Ia) R Y де R і Y мають значення, визначені в п. 1, кристалізацією або хроматографічними методами. 12. Спосіб за п. 11, у якому розділення проводять шляхом екстракції сполуки формули (І) гептаном і потім проведенням кристалізації з гептанових екстрактів. 13. Проміжна сполука формули (І): O (I) R C Y у якій: R являє собою феніл, заміщений одним або декількома галогенами; і Y являє собою OR1, де R1 являє собою лінійний алкіл, розгалужений алкіл, циклоалкіл або заміщений біциклогептил. 14. Проміжна сполука, що являє собою (1R,2S,5R)2-ізопропіл-5-метилциклогексилтранс-2-(3,4дифторфеніл)циклопропанкарбоксилат. 15. Проміжна сполука, що являє собою (1R,2S,5R)2-ізопропіл-5-метилциклогексилтранс-(1R,2R)-2(3,4-дифторфеніл)циклопропанкарбоксилат. 16. Проміжна сполука, що являє собою (1R,2S,5R)2-ізопропіл-5-метилциклогексил (Е)-3-(3,4дифторфеніл)-2-пропеноат. бонової кислоти в способі одержання проміжних сполук, який можна використати в синтезі фармацевтично активних сполук, і до деяких проміжних сполук, що одержуються за допомогою цих способів. Таким чином, в першому аспекті винаходу 5 79924 пропонується спосіб одержання сполуки формули (І): в якій: R представляє феніл, заміщений одним або декількома галогенами; Υ представляє OR1, де R1 представляє нормальний алкіл, розгалужений алкіл, циклоалкіл або заміщений біциклогептил (наприклад, борніл), який включає взаємодію сполуки формули (II): де R і Υ мають значення, визначені вище, з диметилсульфоксонієм метилідом в присутності розчинника. У зручному випадку розчинник є полярним розчинником, переважно диметилсульфоксидом. Відповідно реакцію проводять при -10°С-90°С, переважно при 25°С. Диметилсульфоксоній метилід можна одержати взаємодією солі триметилсульфоксонію з твердою сильною основою, переважно в твердому вигляді, в диметилсульфоксиді при кімнатній або підвищеній температурі. У зручному випадку основа є гідроокисом металу, наприклад, NaOH, LiOH, або гідридом лужного металу, наприклад, NaH. Переважно основа представляє гідроокис натрію. Переважно йодид триметилсульфоксонію перемішують з порошкоподібним гідроокисом натрію в диметилсульфоксиді (за відсутністю міжфазного каталізатора), необов'язково в атмосфері азоту, при 20-25°С протягом 90хв. Альтернативно диметилсульфоксоній метилід можна одержати з солі триметилсульфоксонію (переважно йодиди або хлориди) з використанням гідроокису натрію в диметилсульфоксиді з міжфазним каталізатором, наприклад, бромідом тетрабутил-н-амонію або з іншими сильними основами такими, як гідриди лужного металу, в диметилсульфоксиді. Сполуку формули (II) можна одержати взаємодією сполуки формули (III): в якої R має значення, визначені вище, з відповідним реагентом, що хлорує, в присутності інертного розчинника і необов'язкового каталізатора при температурі 0-200°С. Переважно Υ представляє OR1, реагентом що хлорує, є тіонілхлорид, інертним розчинником є толуол, і каталізатор являє собою піридин. У зручному випадку температура реакції становить 70°С. Потім одержаний хлорангідрид кислоти взаємодіє з YH або Y- (де Υпредставляє аніонні частки Υ), Υ має значення, визначені вище, необов'язково при підвищеній температурі такій, як 100°С. Сполуку формули (III) можна одержати з вико 6 ристанням звичайних хімічних операцій, наприклад, взаємодією сполуки формули (IV): де R має значення, визначені вище, з малоновою кислотою в присутності піридину і піперидину при підвищеній температурі, переважно 50-90°С. Сполуку формули (І) можна гідролізувати з використанням основного гідролізу з одержанням сполуки формули (V): де R має значення, визначені вище. Наприклад, ефірні групи переважно видаляють основним гідролізом з використанням гідроокису лужного металу, такого як гідроокис натрію або гідроокис літію, або гідроокису четвертинного амонію в розчиннику, такому як вода, водний спирт або водний тетрагідрофуран, при температурі в межах 10100°С. Найбільш переважно основою є гідроокис натрію, розчинником є етанол і температура реакції становить 50°С. Сполуку формули (V) можна використати для одержання сполуки формули (VI): де R має значення, визначені вище, взаємодією з тіонілхлоридом або іншим відповідним реагентом, що хлорує, в присутності толуолу або іншого відповідного розчинника і, необов'язково, каталізатора, переважно, піридину, при 0-200°С. Переважно температура становить 65-70°С. Сполуку формули (VI) можна використати в синтезі сполуки формули (VII): де R має значення, визначені вище, взаємодією азиду лужного металу (переважно азиду натрію) в присутності міжфазного каталізатора (переважно броміду тетра-н-бутиламонію), водного розчину карбонату калію і інертного розчинника (переважно толуолу). Переважно температура реакції становить 0-10°С. Сполуку формули (VII) можна використати в синтезі сполуки формули (VIII): де R має значення, визначені вище, перегрупуванням в толуолі при температурі в межах від 0°С до 200°С, переважно при температурі реакції 90-100°С, після чого ізоціанатна проміжна сполука взаємодіє з соляною кислотою при підвищеній температурі, переважно 85-90°С. Непротонований початковий амін (вільна ос 7 79924 нова) формули (IX): де R має значення, визначені вище, можна виділити доведенням значення pH водного розчину солі сполуки формули (VIII) до 10 або вище. Потім його можна перетворити в інші солі органічних кислот або неорганічних кислот, переважно мигдалевої кислоти. Сіль R-(-)-мигдалевої кислоти і сполуки формули (IX) можна одержати доданням R-(-)-мигдалевої кислоти при кімнатній або підвищеній температурі до розчину сполуки формули (IX) в розчиннику, переважно етилацетаті. Переважно температура становить 20°С. У зручному випадку R представляє феніл, необов'язково, заміщений одним або декількома атомами галогену. Переважно R представляє феніл, заміщений одним або декількома атомами фтор у. Більш переважно R є 4-фторфенілом або 3,4-дифторфенілом. Переважно Υ представляє D-ментокси або більш переважне L-ментокси. Сполуки формул (І)-(IX) можуть існувати в різних ізомерних формах (таких, як цис/транс, енантіомери або діастереоізомери). Спосіб згідно з даним винаходом включає всі такі ізомерні форми і їх суміші у всі х співвідношеннях. Там, де Υ є хиральним, сполука формули (І) буде представляти суміш діастереоізомерів, і її можна розділити кристалізацією або хроматографічними методами з одержанням діастереоізомерно збагаченої сполуки формули (Іа): де R і Υ мають значення, визначені вище. Переважно кристалізацію проводять in situ після синтезу сполуки формули (І), описаної вище, нагріванням неочищеної реакційної суміші, поки не буде досягнуто повного або майже повного розчинення, потім охолоджуванням з відповідною швидкістю, поки не утвориться достатня кількість кристалів бажаної якості. Потім кристали збирають фільтруванням. Альтернативно розділення можна провести в будь-якому іншому відповідному розчиннику такому, як вуглеводень, наприклад, гептан, екстракцією сполуки формули (І) відповідною кількістю розчинника, нагріванням екстрактів, поки не буде досягнуто повного розчинення, потім охолоджуванням з відповідною швидкістю, поки не утвориться достатня кількість кристалів бажаної якості. Необов'язково органічні екстракти можна промити водою, висушити над сульфатом магнію і профільтрувати перед кристалізацією, описаною вище. Сполуку формули (Іа) можна гідролізувати з одержанням сполуки формули (Va): 8 де R має значення, визначені вище, з використанням способу, описаного вище для гідролізу сполуки формули (І), з одержанням сполуки формули (V). Сполуку формули (Va) можна використати для одержання сполуки формули (VIa): де R має значення, визначені вище, з використанням способу, описаного вище для перетворення сполуки формули (V), з одержанням сполуки формули (VI). Сполуку формули (VIa) можна використати в синтезі сполуки формули (VIla): де R має значення, визначені вище, з використанням способу, описаного вище для перетворення сполуки формули (VI), з одержанням сполуки формули (VII). Сполуку формули (VIla) можна використати в синтезі сполуки формули (VIIla): де R має значення, визначені вище, з використанням способу, описаного вище для перетворення сполуки формули (VII), з одержанням сполуки формули (VIII). Сполуку формули (VIlla) можна використати в синтезі сполуки формули (ІХа): де R має значення, визначені вище, з використанням способу, описаного вище для перетворення сполуки формули (VIII), з одержанням сполуки формули (IX). Сіль R-(-)-мигдалевої кислоти і сполуки формули (ІХа) можна одержати з використанням способу, описаного вище для одержання солі мигдалевої кислоти і сполуки формули (IX). Нові сполуки утворюють додатковий аспект винаходу. Отже, в додатковому аспекті винаходу пропонуються сполуки формул (І), (Іа), (II), (III), (V), (Va), (VI), (VIa), (VII), (VIla), (VIII), (VIlla), (IX) і (ІХа), визначені вище. Особливо переважні сполуки включають: ((1R,2S,5R)-2-ізопропіл-5метилциклогексил)транс-2-(3,4дифторфеніл)цикло-пропанкарбоксилат; ((1R, 2S, 5R)-2ізопропіл-5метилциклогексил)транс-(1R, 2R)-2-(3,4дифторфеніл) циклопропанкарбоксилат; ((1R,2S,5R)-2-iзoпpoпіл-5-мeтилциклoгeкcил)(E)-3-(3,4-дифтopфeнiл)-2-пропеноат; (Е)-3-(3,4-дифторфеніл)-2-пропенова кислота; (Е)-3-(3,4-дифторфеніл)-2-пропеноїлхлорид; 9 79924 тpaнc-(1R, 2R)-2-(3,4дифторфеніл)циклопропанкарбонова кислота; тpaнc-(1R, 2R)-2-(3,4дифторфеніл)цикпопропанкарбонілхлорид; тpaнс-(1R, 2R)-2-(3,4дифторфеніл)циклопропанкарбонілазид; тpaнс-(1R, 2S)-2-(3,4дифторфеніл)циклопропіламін; і тpaнс-(1R, 2S)-2-(3,4дифторфеніл)циклопропіламіний; (2R)-2- гідрокси-2-фенілетаноат. Приклади Винахід ілюструється наступними необмежувальними прикладами. Приклад 1 Даний приклад показує одержання (Е)-3-(3,4дифторфеніл)-2-пропенової кислоти. Суміш піридину (15,5кг) і піперидину (0,72кг), що перемішується, нагрівали до 90°С. Додавали малонову кислоту (17,6кг) з подальшим повільним доданням протягом 50хв. 3,4дифторбензальдегіду (12,0кг). Реакційну суміш перемішували при 90°С ще протягом 4год. 36хв. Додавали воду (58,5кг) і потім 32л суміші піридин/вода упарювали з реактора при зниженому тиску. Реакційну суміш підкисляли до pH 1 37% соляною кислотою (6,4кг) протягом 40хв., потім охолоджували до 25°С при енергійному перемішуванні. Тверді частки збирали фільтруванням, два рази промивали 1% соляною кислотою (34,8л на порцію), один раз водою (61л) і потім ретельно видаляли рідину пропущенням через фільтр. Потім продукт висушували під вакуумом при 40°С протягом 24год. 40хв. з одержанням 13,7кг кристалічного продукту. Приклад 2 Приклад показує одержання (Е)-3-(3,4дифторфеніл)-2-пропеноїлхлориду. Суміш (Е)-3-(3,4-дифторфеніл)-2-пропенової кислоти (8,2кг], толуолу (7,4кг) і піридину (0,18кг), що перемішується, нагрівали при 65°С і потім додавали тіонілхлорид (7,4кг) протягом 30хв. Реакційну суміш перемішували ще протягом 2год. 15хв. після завершення додання, потім розбавляли толуолом (8,7кг). Потім відганяли надлишок тіонілхлориду, двоокису сірки і хлористого водню разом з толуолом (10л) при зниженому тиску з одержанням розчину (Е)-3-(3,4-дифторфеніл)-2- пропеноїлхлориду (приблизно 9кг) в толуолі. Приклад 3 Даний приклад показує одержання (1R,2S,5R)2-ізопропіл-5-метилциклогексил (Е)-3-(3,4дифторфеніл)-2-пропеноату. Розчин L-ментолу (7,1кг) в толуолі (8,5кг) додавали протягом 20мін. до розчину (Е)-3-(3,4дифторфеніл)-2-пропеноїлхлориду (одержаного в прикладі 2) і піридину (0,18кг, 2,28ммоль), перемішуючи при 65°С. Реакційну суміш перемішували при 65°С ще протягом 4год. 40мін. після завершення додання, потім охолоджували до 25°С і перемішували протягом 14год. Розчин розбавляли толуолом (16кг), промивали 5% водним розчином хлориду натрію (6,4кг), потім 6% бікарбонатом натрію (6,47кг), потім водою (6,1кг). Розчин азеотропно висушували відгонкою розчинника (20л) при 10 зниженому тиску. Додавали диметилсульфоксид (33,9кг) і толуол, що залишився відганяли при зниженому тиску з одержанням 47,3кг розчину (1R,2S,5R)-2-ізопропіл-5-метилциклогексил (Е)-3(3,4-дифторфеніл)-2-пропеноату (приблизно 13,3кг) в диметилсульфоксиді. Приклад 4 Даний приклад показує спосіб одержання диметилсульфоксонію метиліду (диметил(метилен)оксо-l6-сульфан у). Порошкоподібний гідроокис натрію (1,2кг), одержаний подрібненням гранул гідроокису натрію в роторному млині з металевим ситом 1мм, і йодид триметилсульфоксонію (6,2кг) перемішували в диметилсульфоксиді (25,2кг) в атмосфері азоту при 25°С протягом 90хв. Розчин безпосередньо використали для одержання (1R,2S,5R)-2ізопропіл-5-метилциклогексил-транс-2-(3,4дифторфеніл) циклопропанкарбоксилату. Приклад 5 Даний приклад показує спосіб одержання диметилсульфонію метиліду (диметил (метилен) -l4сульфану). Порошкоподібний гідроокис натрію (970мг), одержаний подрібненням гранул гідроокису натрію в роторному млині з металевим ситом 1мм, і йодид триметилсульфонію (4,66г) перемішували в диметилсульфоксиді (17мл) в атмосфері азоту при 20-25°С протягом 10хв. Розчин безпосередньо використали для одержання (1R,2S,5R)-2ізопропіл-5-метилцикпогексил транс-2-(3,4дифторфеніл)циклопропанкарбоксилату. Приклад 6 Даний приклад показує одержання (1R,2S,5R)2-ізопропіл-5-метилциклогексил-транс-2-(3,4дифторфеніл)циклопропанкарбоксилату. Розчин (1R,2S,5R)-2-ізопропіл-5метилциклогексил (3,4-дифторфеніл)-2пропеноату (приблизно 8,6кг) в диметилсульфоксиді (приблизно 27,9кг) додавали при перемішуванні протягом 20хв. до суміші диметилсульфоксонію метиліду (приблизно 2,6кг, одержаного, як описано вище), йодиду натрію ((Е-3) приблизно 4,2кг), води (приблизно 500г) і гідроокису натрію (приблизно 56г) в диметилсульфоксиді (27,7кг) при 25°С. Реакційну суміш·перемішували ще протягом 2год. 50хв. при 25°С, потім безпосередньо використали для одержання (1R, 2S, 5R)-2-ізопропіл-3метилциклогексил-транс-(1R,2R)-2-(3,4дифторфеніл) циклопропанкарбоксилату. Приклад 7 Даний приклад показує одержання (1R,2S,5R)2-ізопропіл-5-мeтилциклoгeкcил-тpaнc-(1R,2R)-2(3,4-дифтopфeнiл)циклoпpoпaнкapбoкcилaтy. Неочищений розчин (1R,2S,5R)-2-ізопропіл-5метилциклогексил-транс-2-(3,4дифторфеніл)циклопропанкарбоксилату, одержаного, як описано в прикладі 6, нагрівали при перемішуванні від 25°С до 50°С протягом 1год. і температуру підтримували ще протягом години. Потім суміш охолоджували при перемішуванні від 50°С до 35°С протягом 4год., витримували при 35°С протягом 1год., потім охолоджували до 26°С протягом 4год., витримували при 26°С протягом 1год., потім охолоджували до 19°С протягом 3год. і ви 11 79924 тримували при 19°С протягом 5год. 10хв. Продукт кристалізували і збирали фільтруванням з одержанням кристалічної твердої речовини (2,7кг), яка, як було показано, включає суміш (1R,2S,5R)-2iзoпpoпiл-5-мeтилциклoгeкcил-тpaнc-(1R,2R)-2(3,4-дифтopфeнiл) циклопропанкарбоксилату (1,99кг) і (1R,2S,5R)-2-ізопропіл-5метилциклогексил-транс-(1S,2S)-2-(3,4дифторфеніл)циклопропанкарбоксилату (85г). Приклад 8 Даний приклад показує альтернативний спосіб одержання (1R, 2S, 5R)-2-ізопропіл-5метилциклогексил-транс-(1R,2R)-2-(3,4дифторфеніл) циклопропанкарбоксилату. н-Гептан (82,5л) відганяли при зниженому тиску з розчину (1R, 2S, 5R) -2-ізопропіл-5метилциклогексил-транс-2-(3,4дифторфеніл)циклопропанкарбоксилату (14,3кг, 44,4моль) в гептані (128,6л). Потім суміш охолоджували від 34°С до 24°С протягом 3год. 20хв. Потім вносили затравкові кристали (1R, 2S, 5R)-2ізопропіл-5-метилциклогексил-транс-(1R, 2R)-2(3,4-дифторфеніл)циклопропан-карбоксилату і суміш о холоджували до 0°С протягом 5год. 50хв. Фільтрування давало продукт у вигляді кристалічної, що містить розчинник твердої речовини (7,05кг), яка, як було показано, містила суміш (1R, 2S, 5R)-2-ізопропіл-5-метилциклогексил-транс-(1R, 2R)-2-(3,4-дифтopфeнiл)циклoпpoпaнкapбoкcилaтy (4,7кг) і (1R,2S,5R)-2-ізопропіл-5метилциклогексил-транс-(1S,2S)-2-(3,4дифторфеніл)циклопропанкарбоксилату (1,1кг). Приклад 9 Даний приклад показує спосіб одержання транс-(1R,2R)-2-(3,4дифторфеніл)циклопропанкарбонової кислоти. (1R,2S,5R)-2-Ізопропіл-5-метилциклогексилтранс-(1R,2R)-2-(3,4-дифторфеніл)циклопропанкарбоксилат (9,6кг, 91,8% надлишок діастереоізомеру) розчиняли в етанолі (13,8кг) і нагрівали при перемішуванні до 46°С. Додавали 45% водний розчин гідроокису натрію (3,1кг) протягом 20хв. і суміш перемішували ще протягом 2год. 27хв. Розчинник (28л) відганяли з суміші при зниженому тиску, потім суміш охолоджували до 24°С і розбавляли водою (29,3кг), після чого ментол, що виділився, екстрагували толуолом (3 порції по 3,3кг кожна). Водну речовину, що залишилася підкисляли до pH 2 37% соляною кислотою (3,3л) і продукт екстрагували толуолом (8,6кг, 2 порції по 4,2кг і 4,3кг). Об'єднані толуольні екстракти промивали 1% соляною кислотою (4,9л), потім розбавляли ще толуолом (4,2кг) і висушували азеотропною відгонкою розчинника (25л) при зниженому тиску. Після кінцевого розбавлення толуолом (24,2кг) розчинник відганяли при зниженому тиску (10л) з одержанням розчину, що містить транс-(1R, 2R)-2-(1,4дифторфеніл)циклопропанкарбонілової кислоти (приблизно 3,45кг), придатну дня одержання тpaнc-(1R,2R)-2-(3,4-дифтoρфeнiл) циклопропанкарбонілхдориду. Приклад 10 Даний приклад показує спосіб одержання транс-(1R,2R)-2-(3,4 12 дифторфеніл)циклопропанкарбонілхдориду. Піридин (70мл) додавали до розчину транс(1R,2R)-2-(3,4дифторфеніл)циклопропанкарбонової кислоти (приблизно 3,45кг) в толуолі (приблизно 12-15кг), одержаної, як описано вище, і потім суміш нагрівали до 65°С. Додавали тіонілхлорид (2,3кг) протягом 1год. і суміш перемішували при 70°С протягом 3год. Додавали тіонілхлорид (0,5кг) і суміш перемішували ще протягом 2 год. при 70°С. Додавали кінцеву порцію тіонілхлориду (0,5кг) і реакційну суміш перемішували протягом 1год. при 70°С, потім охолоджували до 40°С. Під час відгонки розчинника (приблизно 60л) з суміші при зниженому тиску проводили періодичні додавання толуолу (45кг, 3 внесення по 15кг кожне), потім розчин транс-(1R, 2R)-2-(3,4дифторфеніл)циклопропанкарбоніл-хлориду (приблизно 3,8кг) в толуолі (приблизно 6-9л) охолоджували до 20°С. Приклад 11 Даний приклад показує спосіб одержання транс-(1R,2R)-2-(3,4дифторфеніл)циклопропанкарбонілазиду. Розчин транс-(1R,2R)-2-(3,4дифтopфeнiл)циклoпpoпaнкapбoнiлxлopидy (приблизно 3,8кг) в толуолі (приблизно 6-9л; при 1°С додавали протягом 74хв. до суміші азиду натрію (1,24м), броміду тетрабутиламонію (5,6г) і карбонію натрію (922г) у воді (6,2кг) при перемішуванні при 1,5°С. Суміш перемішували при 0°С протягом 1год. 55хв., потім водний шар розбавляли холодною водою (3,8кг), швидко перемішували, потім розділяли. Толуольний шар промивали ще раз при 0°С водою (3,8кг), потім 20% водним розчином хлориду натрію (3,8л), потім зберігали при 3°С для подальшого застосування. Приклад 12 Даний приклад показує спосіб одержання транс-(1R,2S)-2-(3,4дифторфеніл)циклопропіламіну. Холодний розчин тpaнc-(1R,2R)-2-(3,4дифтopфeнiл)циклoпpoпaнкapбo-нілазиду, одержаного, як описано в прикладі 11, додавали протягом 41хв. до толуолу (6,0кг), перемішуючи при 100°С. Суміш перемішували ще 55хв. при 100°С, потім охолоджували до 20°С і додавали протягом 2год. 15хв. до соляної кислоти (З М, 18,2кг), перемішуючи при 80°С. Через 65хв. розчин розбавляли водою (34кг) і охолоджували до 25°С. Толуольний шар видаляли і водний шар підлужували до pH 12 45% розчином гідроокису натрію (3,8кг) і потім продукт екстрагували етилацетатом (31кг) і двічі промивали водою (13,7кг на порцію) з одержанням розчину, що містить транс-(1R,2S)-2-(3,4дифторфеніл) циклопропіламін (2,6кг, 91,8% надлишок енантіомеру) в етилацетаті (29,5л). Приклад 13 Даний приклад показує спосіб одержання транс-(1R,2S)-2-(3,4дифторфеніл)циклопропамінію да)-2-гідрокси-2фенілетаноату. R-(-)мигдалеву кислоту (2,26кг) додавали до розчину, що містить транс-(1R, 2S)-2-(3,4дифторфеніл)циклопропіламін (2,6кг, більше за 13 79924 91,8% надлишок енантіомеру), перемішуючи при 17°С в етилацетаті (45,3 л). Суміш перемішували при 25°С протягом 3год. 8хв., потім фільтрували і двічі промивали етилацетатом (в цілому 13,8кг). Кристалічний продукт висушували при 40°С при Комп’ютерна в ерстка В. Мацело 14 зниженому тиску протягом 23год. з одержанням транс-(1R,2S)-2-(3,4дифторфеніл)циклопропанамінію (2R)-2-гідрокси2-фенілетаноату (4,45кг). Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of cyclopropyl carboxylic acid esters and compounds prepared by this process
Автори англійськоюMinidis Anna
Назва патенту російськоюСпособ получения эфиров циклопропилкарбоновой кислоты и соединения, полученные этим способом
Автори російськоюМинидис Анна
МПК / Мітки
МПК: C07C 67/347, C07C 69/96, C07C 69/003, C07C 233/58, C07C 69/017, C07C 69/743, C07C 61/00, C07C 69/753
Мітки: спосіб, циклопропілкарбонової, одержані, кислоти, одержання, сполуки, способом, цим, ефірів
Код посилання
<a href="https://ua.patents.su/7-79924-sposib-oderzhannya-efiriv-ciklopropilkarbonovo-kisloti-ta-spoluki-oderzhani-cim-sposobom.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання ефірів циклопропілкарбонової кислоти та сполуки, одержані цим способом</a>
Попередній патент: Спосіб і пристрій для адаптації швидкості передачі даних при пакетній передачі даних
Наступний патент: Похідні варіоліну, спосіб їх одержання (варіанти) та застосування вказаних речовин як протиракового засобу
Випадковий патент: Фунгіцидна композиція та спосіб боротьби з мілдью винограду











