Сполука імідазопіридину іі з терапевтичною дією
Формула / Реферат
1. Сполука формули І
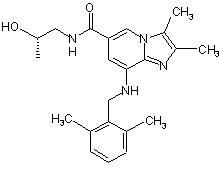 І
І
або її фармацевтично прийнятна сіль.
2. Сполука за п. 1, яка являє собою 8-[(2,6-диметилбензил)аміно]-N-[(2S)-2-гідроксипропіл]-2,3-диметилімідазо[1,2-а]піридин-6-карбоксаміду мезилатну сіль.
3. Спосіб одержання сполуки згідно з пунктом 1 або 2, в якому проводять:
а) обробку сполуки Формули II
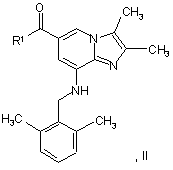
де R1 являє собою C1-C6-алкоксигрупу або -NH2,
у присутності водної кислоти або основи при стандартних умовах до одержання
сполуки Формули III
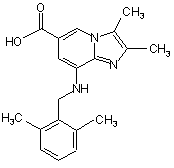 , ІІІ
, ІІІ
b) реакцію сполуки Формули III зі сполукою Формули IV
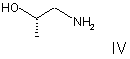
у присутності конденсувального реагенту в інертному розчиннику при стандартних умовах з одержанням сполуки Формули І.
4. Сполука за пп. 1 або 2 для застосування в терапії.
5. Фармацевтична композиція, що містить сполуку згідно з пунктами 1 або 2 як активний інгредієнт у комбінації з фармацевтично прийнятним розчинником або носієм.
6. Застосування сполуки згідно з пунктами 1 або 2 для одержання лікарського засобу для лікування і інгібування захворювань, пов'язаних із шлунковою кислотою, шлунково-кишкових запальних захворювань, симптоматичного шлунково-стравохідного рефлюксного захворювання (GERD), ерозійного езофагіту, захворювань на пептичну виразку, печії, регургітації, кислотних рефлюксних захворювань або нудоти.
7. Спосіб лікування і/або інгібування захворювань, пов'язаних із шлунковою кислотою, шлунково-кишкових запальних захворювань, печії, симптоматичного шлунково-стравохідного рефлюксного захворювання (GERD), ерозійного езофагіту, захворювань на пептичну виразку, регургітації, кислотних рефлюксних захворювань або нудоти у людини або іншого ссавця, що включає введення ефективної кількості сполуки згідно з пунктами 1 або 2 людині або іншому ссавцеві, які мають в цьому потребу.
8. Сполука Формули III
 III .
III .
Текст
1. Сполука формули І O CH у присутності водної кислоти або основи при стандартних умовах до одержання сполуки Формули III O CH 3 N HO N CH 3 NH H 3C CH 3 3 І або її фармацевтично прийнятна сіль. 2. Сполука за п. 1, яка являє собою 8[(2,6-диметилбензил)аміно]-N-[(2S)-2гідроксипропіл]-2,3-диметилімідазо[1,2-а]піридин6-карбоксаміду мезилатну сіль. 3. Спосіб одержання сполуки згідно з пунктом 1 або 2, в якому проводять: а) обробку сполуки Формули II O CH 3 N R1 CH3 N NH H3C CH3 , II 1 де R являє собою C1-C6-алкоксигрупу або -NH2, IV у присутності конденсувального реагенту в інертному розчиннику при стандартних умовах з одержанням сполуки Формули І. 4. Сполука за пп. 1 або 2 для застосування в терапії. 5. Фармацевтична композиція, що містить сполуку згідно з пунктами 1 або 2 як активний інгредієнт у комбінації з фармацевтично прийнятним розчинником або носієм. 6. Застосування сполуки згідно з пунктами 1 або 2 для одержання лікарського засобу для лікування і інгібування захворювань, пов'язаних із шлунковою кислотою, шлунково-кишкових запальних захворювань, симптоматичного шлунково-стравохідного рефлюксного захворювання (GERD), ерозійного езофагіту, захворювань на пептичну виразку, печії, регургітації, кислотних рефлюксних за хворювань або нудоти. 7. Спосіб лікування і/або інгібування захворювань, пов'язаних із шлунковою кислотою, шлунково-кишкових запальних захворювань, печії, симптоматичного шлунково-стравохідного рефлюксного захворювання (GERD), ерозійного C2 CH3 (13) NH b) реакцію сполуки Формули III зі сполукою Формули IV HO NH2 81953 N H3C , ІІІ CH3 (11) N UA N H (19) HO 3 81953 езофагіту, захворювань на пептичну виразку, регургітації, кислотних рефлюксних за хворювань або нудоти у людини або іншого ссавця, що HO включає введення ефективної кількості сполуки згідно з пунктами 1 або 2 людині або іншому ссавцеві, які мають в цьому потребу. 8. Сполука Формули III H 3C 4 O CH 3 N N CH 3 NH CH 3 III Представлений винахід стосується нової сполуки і її терапевтично прийнятних солей, які інгібують екзогенно або ендогенно стимульовану секрецію шлункові кислоти і таким чином можуть використовува тися в попередженні і лікуванні шлунково-кишкових запальних захворювань. У подальших аспектах винахід стосується сполуки згідно з винаходом для використання в терапії; способів одержання такої нової сполуки; фармацевтичних композицій, що містять сполуку згідно з винаходом або її терапевтично прийнятної солі, як активного інгредієнта; і застосування сполуки згідно з винаходом у виробництві лікарських засобів для вищезазначеного медичного використання. Заміщені імідазо[1,2-а]піридини, придатні для використання в лікуванні захворювань на пептичну виразку, відомі в цій галузі, наприклад, з [патенту ЕР-В-0033094 і патенту США 4,450,164 (Schering Corporation); з патенту ЕР-В-0204285 і патенту США 4,725,601 (Fujisawa Pharmaceutical Co.); з міжнародних публікацій патентних заявок W099/55706 і W099/55705 (AstraZeneca); з міжнародної публікації патентної заявки WO 03/018582 (AstraZeneca); і з публікацій J. J. Kaminski і інші в Journal of Medical Chemistry (Журналі Медичної Хімії) (том 28, 876-892, 1985; том 30, 2031-2046, 1987; том 30, 2047-2051, 1987; том 32, 1686-1700, 1989; і том 34, 533-541, 1991]. Для огляду фармакології шлункового кислотного виділення (Н+, K+-ATPase), дивіться [Sachs і інші (1995) Anna Rev. Pharmacol. Toxicol. 35: 277-305]. Від недавнього часу знайдено заміщений імідазо[1,2-а]піридин, придатний для використання в лікуванні захворювань на пептичну виразку, що виявляє корисні властивості, наприклад, швидкий прояв, високу ефективність і/або тривалу дію, високу розчинність і високу швидкість розщеплення. Неочікувано було знайдено, що сполука Формули І є особливо ефективною як інгібітор шлунково-кишкових Н +, K+-ATPase і таким чином як інгібітор шлункової кислотної секреції. В першому аспекті, представлений винахід таким чином стосується сполуки Формули І . або її фармацевтично прийнятної солі. В залежності від умов процесу кінцевий продукт Формули І одержують або у нейтральній формі або у формі солі. І вільна основа і солі кінцевого продукту знаходяться у межах винаходу. При одержанні кислотно-адитивних солей, переважним чином використовуються такі кислоти, що утворюють терапевтично прийнятні солі. Прикладами таких кислот є галогенводневі кислоти такі як хлорводнева кислота, сірчана кислота, фосфорна кислота, азотна кислота, аліфатична, аліциклічна, ароматична або гетероциклічна карбонова або сульфонова кислоти, такі як мурашина кислота, оцтова кислота, пропіонова кислота, бурштинова кислота, гліколева кислота, молочна кислота, яблучна кислота, винна кислота, лимонна кислота, аскорбінова кислота, малеїнова кислота, гідроксималеїнова кислота, піровиноградна кислота, п-гідроксибензойна кислота, ембонова кислота, метансульфонова кислота, етансульфонова кислота, гідроксиетансульфонова кислота, галогенбензолсульфонова кислота, толуолсульфонова кислота або нафталенсульфонова кислота. Представлений винахід також забезпечує наступний спосіб одержання сполуки згідно з Формулою І. Спосіб одержання сполуки Формули І містить наступні стадії: а) сполука Формули II 5 81953 де R1 представляє собою С 1-С6-алкокси групу або -NH2, може бути гідролізована при стандартних умовах в присутності водної кислоти або основи з одержанням відповідної сполуки карбонової кислоти Формули III Кислота і основа можуть бути вибрані з НСІ, H2SO4 і NaOH. b) сполука Формули III може бути піддана взаємодії з аміносполукою Формули IV у присутності конденсувального реагента такого як тетрафторборат о-бензотриазол-1-ілΝ,Ν,Ν',Ν'-тетраметилуронію (ТБТУ) з одержанням відповідного аміду, тобто сполуки Формули І. Реакція може бути виконана в інертному розчиннику, такому як диметилформамід (ДМФ), метиленхлорид і ацетонітрил або їх суміш при стандартних умовах. В першому втіленні винаходу, реакція відповідно до вищезгаданої стадії а) може бути виконана шляхом гідролізації сполуки Формули II з одержанням відповідної кислоти в присутності NaOH у водному спирті такому як водний метанол або етанол при кипінні протягом від 1 до 3 годин. Подальший спосіб одержання сполуки згідно з винаходом включає наступну стадію а) сполука Формули V, 6 де R1 представляє собою С 1-С6-алкокси групу, може бути піддана взаємодії з аміносполукою Формули IV з одержанням відповідного аміду, тобто сполуки Формули І. Реакція може бути виконана шляхом нагрівання реагентів в чистій аміносполуці або розчиненням у інертному розчиннику при стандартних умовах, наприклад, в спирті такому як метанол при підвищеній температурі такій як в діапазоні між від 40 до 60°С або при кип'ятінні. Реакція може бути виконана в присутності основи або солі ціаніду. В першому втіленні представленого винаходу реакцію виконують в присутності основи, вибраної з 1,8-діазабіцикло(5.4.0)ундец-7-ену (DBU) або 1,5діазабіцикло(4.3.0)нон-5-ену (DBN). У подальшому втіленні представленого винаходу, реакцію виконують в присутності алкоксиду, такому як метоксид натрію, метоксид калію або етоксид калію. В першому втіленні винаходу сполуку Формули V змішують зі сполукою Формули IV у розчиннику, такому як спирт, наприклад метанол або етанол. До нагрітої реакційної суміші додавали основу і реакцію завершували при підвищеній температурі, наприклад в діапазоні між від 40 до 60°С або при кипінні. Основа може бути вибрана з серед інших, метоксиду калію або метоксиду натрію. Медичне застосування У подальшому аспекті, винахід стосується сполуки Формули І для застосування в терапії. Зокрема винахід забезпечує застосування сполуки Формули І у виробництві лікарського засобу для інгібування шлункової кислотної секреції або для лікування шлунково-кишкових запальних захворювань. Сполука згідно з винаходом може таким чином використовува тися для попередження і лікування шлунково-кишкових запальних захворювань і захворювань пов'язаних з шлунковою кислотою у ссавців, включаючи людину, таких як гастрит, рефлюксний езофагіт, синдром ЗоллінгераЕллісона і захворювання на пептичну виразку, включаючи шлункову виразку і виразку дванадцятипалої кишки. Крім того, сполука може використовува тися для лікування інших шлунковокишкових розладів, де є бажаною шлункова антисекреторна дія, наприклад, у пацієнтів з гастриномою і у пацієнтів з гострою вер хньою шлунково-кишковою кровотечією. Сполука може також використовуватися для ефективного контролю і лікування печії та інших симптомів Шлунково-стравохідного рефлюксного захворювання (GERD) (гострого і хронічного симптоматичного GERD, лікування ерозійного езофагіту та відновлення), регургітації, короткої і тривалої терапії кислотного рефлюксного захворювання і нудоти. Вона може також використовува тися у пацієнтів з станами, що 7 81953 8 підлягають інтенсивній терапії і перед і після Одиниці дозування для ректального введення операцій для попередження кислотної аспірації та можуть бути одержані (і) у формі супозиторіїв, що утворення стресової виразки. містять сполуку згідно з винаходом змішану з Типова добова доза активної речовини нейтральною жирною основою; (іі) у формі змінюється у широких межах і буде залежати від желатинової капсули для ректального введення, різних факторів таких як, наприклад, конкретна що містить сполуку згідно з винаходом в суміші з потреба кожного пацієнта, шлях введення і рослинною олією, парафіновим маслом або іншим захворювання. Як правило, дозування для придатним наповнювачем для желатинових перорального і перентерального введення будуть ректальних капсул; (ііі) у формі готової знаходитися у діапазоні від 5 до 1000мг на добу мікроклізми; або (iv) у формі мікроклізми з сухою активної речовини, переважно в діапазоні від 20 композицією, що буде відтворена у придатному до 60мг, наприклад, 50мг. Сполука згідно з розчиннику безпосередньо перед введенням. винаходом може вводитися пацієнтові при Рідкі рецептури для перорального введення довготривалому лікуванні також як за звертанням можуть бути одержані у формі сиропів або пацієнта, в залежності від конкретних потреб і суспензій, наприклад, розчинів або суспензій, що захворювання. Завдяки сполуці згідно з винаходом містять від 0,1% до 20мас% сполуки згідно з надаються можливості для поліпшення якості винаходом і залишку, що містить цукор або цукрові життя індивідів, що страждають від захворювань спирти і суміш етанолу, води, гліцерину, пов'язаних з шлунковою кислотою і/або шлунковопропіленгліколю і поліетиленгліколю. Якщо кишкових запальних захворювань. бажано, такі рідкі рецептури можуть містити Фармацевтичні композиції фарбувальні агенти, ароматизатори, сахарин і Ще в одному подальшому аспекті винахід карбоксиметилцелюлозу або інший загусник. Рідкі стосується фармацевтичних композицій, що рецептури для перорального введення можуть містять сполуку згідно з винаходом або її також бути одержані у формі сухого порошку, що терапевтично прийнятну сіль як активний буде відтворений з придатним розчинником перед інгредієнт. застосуванням. Для клінічного застосування, сполуку згідно з Розчини для парентерального введення винаходом, формують у фармацевтичні композиції можуть бути одержані у вигляді розчину сполуки для перорального, ректального, перентерального згідно з винаходом у фармацевтично прийнятному або іншого способу введення. Фармацевтична розчиннику, переважно в концентрації від 0,1мас% композиція містить сполуку згідно з винаходом в до 10мас%. Ці розчини можуть також містити комбінації з одним або більшою кількістю стабілізуючі інгредієнти і/або буферні інгредієнти і фармацевтично прийнятних інгредієнтів. Носій розподілені в одиничні дози у формі ампул або може бути у формі твердої речовини, напівтвердої пляшечок. Розчини для парентерального речовини або рідкого розчинника, або капсули. Ці введення можуть також бути одержані у вигляді фармацевтичні рецептури є подальшим об'єктом сухої композиції, що буде відтворена з придатним винаходу. Зазвичай кількість сполуки згідно з розчинником безпосередньо перед застосуванням. винаходом знаходиться в діапазоні між 0,1Сполука згідно з винаходом може також 95мас% рецептури, переважно між 0,1-20мас% в використовува тися в композиціях разом з іншими рецептурах для перентерального застосування і активними інгредієнтами, наприклад, для переважно між 0,1-50мас% в рецептурах для лікування або профілактики станів, викликаних перорального введення. внаслідок Helicobacter pylori інфекції шлункової При одержанні фармацевтичних композицій, слизової оболонки у людини. Такими іншими що містять сполуку згідно з винаходом у формі активними інгредієнтами можуть бути антимікробні одиниць дозування для перорального введення агенти, зокрема: вибрана сполука може бути змішана з твердими, - b-лактам антибіотики такі як амоксицилін, порошковими інгредієнтами такими як лактоза, ампіцилін, цефалотін, цефаклор або цефіксим; сахароза, сорбіт, маніт, крохмаль, амілопектин, - макроліди такі як еритроміцин або похідні целюлози, желатин або з іншим придатним кларітроміцин; інгредієнтом, також як з дезінтегрантами і - тетрацикліни такі як тетрациклін або лубрикантами такими як стеарат магнію, стеарат доксициклін; кальцію, стеарилфумарат натрію і - аміноглікозиди такі як гентаміцин, канаміцин поліетиленгліколеві воски. Потім з суміші або амікацин; виробляють гранули або пресують таблетки. хінолони такі як норфлоксацин, М'які желатинові капсули можуть бути ципрофлоксацин або еноксацин; виготовлені з капсулами, що містять активну - інші такі як метронідазол, нітрофурантоїн або сполуку згідно з винаходом, рослинну олію, жир хлорамфенікол; або або інший придатний наповнювач для м'я ких - композиції, що містять солі вісмуту такі як желатинових капсул. Тверді желатинові капсули субцитрат вісмуту, субсаліцилат вісмуту, можуть містити гранули сполуки згідно з субкарбонат висмуту, субнітрат вісмуту або винаходом. Тверді желатинові капсули можуть субгалат вісмуту. також містити сполуку згідно з винаходом в Сполука згідно з винаходом може також комбінації з твердими порошковими інгредієнтами використовува тися разом або в комбінації для такими як лактоза, сахароза, сорбіт, маніт, одночасного, окремого або послідовного картопляний крохмаль, кукурудзяний крохмаль, застосування з антацидними засобами такими як амілопектин, похідні целюлози або желатин. гідроксид алюмінію, карбонат магнію і гідроксид 9 81953 10 магнію або альгінова кислота, або разом або в 0,274моль) додавали до метанолу (900мл) і води комбінації для одночасного, окремого або (100мл). послідовного застосування з фармацевтичними Додавали гідроксид натрію (45г, 1,13моль) і препаратами, що інгібують кислотну секрецію, суміш кип'я тили протягом 2 годин. Приблизно такими як, Н2-блокатори (наприклад, циметидин, половина розчинника випаровувалася і продукт ранітидин), Н+, K+-ATPase інгібітори (наприклад, осаджували шля хом додавання оцтової кислоти омепразол, пантопразол, ланзопразол або (100мл) і води (1000мл). Суміш перемішували рабепразол) або разом, або в комбінації для протягом ночі при кімнатній температурі. Продукт одночасного, окремого або послідовного фільтрували і промивали за допомогою води і застосування з гастрокинетичними засобами ацетону. Одержували 88г (99 %) сполуки згідно з (наприклад, цизапрідом або мозапрідом). винаходом. 1 Сполука згідно з винаходом може також Н ЯМР (ДМСО, 400МГц) d 2,22 (с, 3H), 2,33 (с, використовува тися разом або в комбінації для 6Н), 2,36 (с, 3H), 4,36 (д, 2Н), 5,03 (т, 1Η), 6,64 (с, одночасного, окремого або послідовного 1Н), 7,04-7,15 (м, 3H), 8,05 (с, 1Н). застосування з іншими активними інгредієнтами, Приклад 2 наприклад, для лікування або попередження 8-1(2,6-диметилбензил)аміно]-N-[(2S)-2станів, що викликаються лікарськими засобами, гідроксипропіл]-2,3-диметилімідазо[1,2-а]піридинщо викликають виразку шлунку. Такими іншими 6-карбоксамід активними інгредієнтами можуть бути NSAID, NSAID з NO-вивільненням, СОХ-2 інгібітор або бісфосфонат. Сполука згідно з винаходом може також використовува тися разом або в комбінації для одночасного, окремого або послідовного застосування з антагоністом гастрину таким як ССК2 антагоніст. Проміжні сполуки Подальшим аспектом винаходу є нова проміжна сполука, що є придатною для використання в синтезі сполуки згідно з 8-[(2,6-диметилбензил)аміно]-2,3винаходом. диметилімідазо[1,2-а]піридин-6-карбонову кислоту Таким чином, винахід включає сполуку (30г, 0,0928моль) і 30г діізопропілетиламіну (30г, Формули III 0,233моль) додавали до диметилформаміду (ДМФ) (250мл). До одержаної суміші додавали тетрафторборат о-бензотриазол-1-іл-N,N,N',N'тетраметилуронію (ТБТУ) (36г, 0,112моль). Суміш перемішували протягом 15 хвилин при кімнатній температурі. Додавали (S)-1-аміно-2-пропанол (8,4г, 0,112моль) і продовжували перемішува ти протягом 1 години при кімнатній температурі. Додавали воду (100мл) і реакційну суміш нагрівали до 70°С. Продукт осаджували шляхом повільного додавання більшої кількості води (200мл). Потім суміш перемішували протягом 5 годин при 65-70°С. Після охолодження до кімнатної температури продукт фільтрували і Приклади промивали за допомогою 40% розчину метанолу. 1. Одержання сполуки згідно з винаходом Одержували 33,7г сполуки згідно з винаходом. Приклад 1 1 Н ЯМР (CDCI3, 300МГц) d 1,20 (д, 3H), 2,29 (с, Синтез 8-[(2,6-диметилбензил)аміно]-2,33H), 2,32 (с, 3H), 2,35 (с, 6Н), 3,12-3,21 (м, 1Н), диметилімідазо[1,2-а]піридин-6-карбонової 3,58-3,66 (м, 2Н), 3,96-4,06 (м, 1Н), 4,29 (д, 2Н), кислоти 5,00 (т, 1Н), 6,41 (с, 1Н), 6,89 (т, 1Η), 7,02-7,15 (м, 3H), 7,71 (с, 1Н). Приклад 3 8-[(2,6-диметилбензил)аміно]-N-[(2S)-2гідроксипропіл]-2,3-диметилімідазо[1,2-а]піридин6-карбоксаміду мезилатна сіль 8-ізопропіл [(2,6-диметилбензил)аміно]-2,3диметилімідазо[1,2-а]піридин-6-карбоксилат (100г, 11 81953 12 гідроксиетил)-2,3-диметилімідазо[1,2-а]піридин-6карбоксамідом як сполукою, на яку є посилання. 8[(2,6-диметилбензил)аміно]-N-(2-гідроксиетил)-2,3диметилімідазо[1,2-]піридин-6-карбоксамід детально розкритий у [WO 99/55705]. 1. Експерименти In Vitro Інгібування кислотної секреції в ізольованих кролячих шлункових залозах. Інгібувальна дія на кислотну секрецію in vitro в ізольованих кролячих шлункових залозах вимірювали як описано у [Berglindh і інші (1976) Acta Physiol. Scand. 97, 401414]. Значення інгібувального ефекту ІС 50 для сполуки згідно з винаходом було визначено до 8-[(2,6-диметилбензил)аміно]-N-[(2S)-20,26мкмоль/л. ІС50 для 8-[(2,6гідроксипропіл]-2,3-диметилімідазо[1,2-а]піридиндиметилбензил)аміно]-N-(2-гідроксиетил)-2,36-карбоксамід (29,0г, 0,0762моль) розчиняли при диметилімідазо[1,2-а]піридин-6-карбоксаміду було кипінні в ізопропанолі (280мл). До розчину визначено до 0,28мкмоль/л. додавали метансульфонову кислоту (7,4г, Визначення Н+, K+-ATPase активності. 0,0770моль), розчинену в ізопропанолі (20мл). Мембранні везикули (від 2,5 до 5мкг) Після охолодження осаджувалася кристалічна інкубували протягом 15 хвилин при +37°С у 18мМ речовина. Суміш залишали протягом ночі при Ріреs/Trіs буфера з рН 7,4, що містить 2мМ МgСІ2, кімнатній температурі. Продукт фільтрували і 10мМ KСІ і 2мМ АТФ. ATPase активність промивали за допомогою ізопропанолу. оцінювали як вивільнення неорганічного фосфату Одержували 29,9г сполуки згідно з винаходом у з АТФ, як описано у [LeBel і інші (1978) Anal. вигляді мезилатної солі. 1 Biochem. 85, 86-89]. Н ЯМР (ДМСО, 500МГц) d 1,10 (д, 3H), 2,25 (с, Виміряне значення інгібувального ефекту ІС 50 3H), 2,36 (с, 6Н), 2,42 (с, 3H), 2,48 (с, 3H), 3,21-3,33 сполуки згідно з винаходом складало (м, 2Н), 3,82-3,85 (м, 1Н), 4,42 (д, 2Н), 6,16 (с, 1Н), 0,69мкмоль/л. Значення ІС50 8-[(2,67,13-7,21 (м, 3H), 7,36 (с, 1Н), 8,42 (с, 1Н) 8,79 (т, диметилбензил)аміно]-N-(2-гідроксиетил)-2,31Н) 13,68 (шс, 1Н). диметилімідазо[1,2-а]піридин-6-карбоксаміду Приклад 4 складало до 0,75мкмоль/л. 8-[(2,6-диметилбензил)аміно]-N-[(2S)-22. Експерименти In Vivo гідроксипропіл]-2,3-диметилімідазо[1,2-а]піридинІнгібувальна дія на кислотну секрецю у 6-карбоксамід пацюків жіночої статі Використовували пацюків жіночої статі штаму Sprague-Dawly. їх обладнували канюльованою фістулою у шлунку (порожнині) і верхній частині дванадцятипалої кишки, для збирання шлункових секрецій і введення тестових речовин, відповідно. Після хірургічного втручання для відновлення перед початком експериментів надавали 14денний період. Перед секреторними тестами тварин позбавляли їжі, але не обмежували доступ до води протягом 20 годин. Шлунок неодноразово промивали через шлункову канюлю Суміш 8-ізопропіл-[(2,6-диметилбензил)аміно]водопровідною водою (+37°С) і вводили підшкірно 2,3-диметилімідазо[1,2-а]піридин-6-карбоксилату 6мл Ringer-глюкози. Кислотну секрецію (5г, 13ммоль) і (S)-1-аміно-2-пропанолу (3,8г, стимулювали за допомогою вливання протягом 50ммоль) у метанолі (10мл) і толуолі (10мл) 2,5-4 годин (1,2мл/годину, підшкірно) нагрівали до 40-45°С. Додавали метоксид калію пентагастрину і карбахолу (20 і (0,57г, 2,6ммоль) у вигляді розчину у метанолі 110нмоль/кг·годину, відповідно), під час вливання, (32мас/мас%). Реакційну суміш нагрівали до шлункові секреції збирали фракціями кожні 30 кипіння (67-68°С) і підтримували при цій хвилин. Тестову речовину або розчинник вводили температурі до бажаного перетворення (2-4 або через 60 хвилин після початку стимулювання години), контролюючи за допомогою ВЕРХ. (внутрішньовенне і інтрадуоденальне дозування, Після охолодження і додавання води (15мл) 1мл/кг) або за 2 години перед початком продукт осаджувався. Продукт фільтрували, стимулювання (пероральне дозування, 5мл/кг, промивали за допомогою води і сушили під шлункова канюля закрита). Для вивчення вакуумом. Одержували 4,1г (80%) сполуки згідно з тривалості дії часовий інтервал між дозуванням і винаходом у вигляді твердої речовини білого стимулюванням може бути збільшений. Зразки кольору. шлункового соку титрували до рН 7,0 за Біологічні тести допомогою NaOH, 0,1Μ і вихід кислоти Біологічні тести сполуки згідно з винаходом обчислювали як продукт обсягу титранту і були виконані як описано нижче. Тести також були концентрації. виконані з 8-[(2,6-диметилбензил)аміно]-N-(2 13 81953 14 Подальші обчислення засновані на кислоти, що секретується основним шлунком середньому значенні відповідей групи пацюків від кармана Хайденхама собаки. Кислотність зразків 4-6 особин. У випадку введення під час шлункового соку визначали титруванням до рН 7,0 стимулювання; кислотний вихід протягом періодів і обчислювали вихід кислоти. Кислотний вихід у після введення тестової речовини або розчинника періоди збирання після введення тестової виражали як відповіді стосовно окремих фракцій, речовини або розчинника виражали як відповіді приймаючи, що кислотний вихід у період з 30 стосовно окремих фракцій, приймаючи кислотний хвилинним попереднім введенням складає до 1,0. вихід в попередній фракції введення до 1,0. Відсоток інгібування обчислювали з відповідей Відсоток інгібування обчислювали з відповідей стосовно окремих фракцій, що виявляються стосовно окремих фракцій, виявлених тестовою тестовими сполуками і розчинником. У випадку сполукою і розчинником. Зразки крові для аналізу введення перед стимулюванням; відсоток концентрації тестової сполуки в плазмі забирали в інгібування обчислювали безпосередньо з інтервалах до 4 годин після дозування. Плазму кислотного виходу, зареєстрованого після відділяли і заморожували в межах 30 хвилин після введення тестової сполуки і розчинника. збирання і пізніше аналізували. Системну Біодоступність у пацюка біодостуність (F %) після перорального або i.d. Використовували дорослих пацюків штаму введення розраховували як описано вище в Sprague-Dawley. Від одного до трьох днів до моделі пацюка. Було виявлено дію на початку експериментів всіх пацюків підготовували модельовану гістаміном кислотну секрецію катетеризацією лівої сонної артерії під анестезією. кармана Хайденхайна собаки при введенні Пацюків, використовуваних для внутрішньовенних 0,25мкмоль/л сполуки згідно з винаходом, середнє експериментів також катетеризували у яремну значення відсотка інгібування через 1-3 години вену [Popovic (1960) J. Appl. Physiol. 15, 727-728]. (середня величина, n=2) складало 91%. Катетери виводили на поверхню задньої частини Біодоступність 8-[2,6-диметилбензил)аміно]-N-(2шиї. Зразки крові (0,1-0,4г) неодноразово брали з гідроксиетил)-2,3-диметилімідазо[1,2-а]піридин-6сонної артерії в інтервалах до 5,5 годин після карбоксаміду (0,25мкмоль/л) складала 61%. введеної дози. Зразки заморожували до початку Розчинність в Модельному розчині Кишкової аналізу тестової сполуки. Біодоступність рідини, взятої натщесерце (FaSSIF). оцінювали обчисленням частки від ділення площі Методика описує процедуру для вимірювання кривої визначеної концентрацією в крові/плазмі розчинності твердого матеріалу в FaSSIF (ПВК) після (і) інтрадуоденального (i.d.) або (Модельному розчині Кишкової рідини взятої, перорального (р.о.) введення і (іі) натщесерце). FaSSIF розчин представляє собою внутрішньовенного (i.v.) введення, відповідно ізотонічний фосфатний буфер, в якому показник пацюка або собаки. Площу кривої визначену рН доводили до 6,5, для відображення значення концентрацією в крові в залежності від часу, ПВК, рН у порожній кишці. Додавали таурохолінову обчислювали по логарифму/лінійної формули кислоту і лецитин до концентрації 3ммоль/л і трапецій і екстраполювали до нескінченності, 0,75ммоль/л відповідно. 1мг твердого матеріалу, шляхом ділення останньої визначеної концентрації тобто сполуки згідно з винаходом, додавали до в крові на швидкість спадання кривої в кінцевій 1мл FaSSIF розчину і врівноважували при 37°С. стадії. Системну біодоступність (F %) після Зразки забирали через 1 і 24 години. Зразки інтрадуоденального або перорального введення переносили до пробірок еппендорфа і розраховували як F(%)=(ПВК(р.о. або центрифугували при 10000G і 37°С протягом 10 хвилин. Прийнятний об'єм надосадкової рідини і.d\)/ПВК(ілл))´100. видаляли і розводили до придатної концентрації. Інгібування шлункової кислотної секреції і Концентрації сполук у зразках аналізували за біодоступність у собаки, яку не піддавали допомогою РХ/УФ/МС. Розчинність сполуки згідно анестезії. з винаходом, що вимірювали через 24 години, Використовували собак породи Лабрадор ретрівер або Хар'єр будь-якої статі. Їх складала 48мкмоль/л і розчинність сполуки згідно з винаходом у вигляді мезилатної солі, що обладнували дуоденальною фістулою для вимірювали через 24 години складала введення тестових сполук або розчинника і 218мкмоль/л. катетеризували шлунковою фістулою або карманом Хайденхайна для збирання шлункової секреції. Перед секреторними тестами тваринам не давали їжі протягом приблизно 18 годин, але дозволяли необмежений доступ до води. Шлункову кислотну секрецію стимулювали протягом до 6,5 годин вливанням дигідрохлориду гістаміну (12мл/годину) при створенні дози приблизно 80% від конкретної максимальної секреторної відповіді і шлунковий сік збирали послідовно фракціями кожні 30 хвилин. Тестову речовину або розчинник надавали перорально, i.d. або і.ν., через 1 або 1,5 години після початку вливання гістаміну, в об'ємі 0,5мл/кг маси тіла. У випадку перорального введення, повинно бути зазначено, що тестову сполуку вводили до
ДивитисяДодаткова інформація
Назва патенту англійськоюImidazopyridine compound ii with therapeutic effect
Автори англійськоюNordberg Peter
Назва патенту російськоюСоединение имидазопиридина іі с терапевтическим действием
Автори російськоюНордберг Петер
МПК / Мітки
МПК: A61P 1/04, C07D 471/04
Мітки: терапевтичною, імідазопіридину, дією, сполука
Код посилання
<a href="https://ua.patents.su/7-81953-spoluka-imidazopiridinu-ii-z-terapevtichnoyu-diehyu.html" target="_blank" rel="follow" title="База патентів України">Сполука імідазопіридину іі з терапевтичною дією</a>
Попередній патент: Спосіб випалювання грудкового матеріалу, зокрема вапняку
Наступний патент: Спосіб виготовлення виробів із карбіду кремнію на нітридкремнієвій зв’язці
Випадковий патент: Пристрій для іонно-електронної обробки поверхонь у вакуумі











