Спосіб визначення генотоксичного впливу на клітини організму
Формула / Реферат
Спосіб визначення генотоксичного впливу на клітини організму, що включає забір крові; фіксацію клітин; їх забарвлення; підрахунок частоти утворення мікроядер у клітинах; визначення за цим показником генотоксичногу впливу на генетичний апарат клітини організму, який відрізняється тим, що готують мазок крові, фіксують його у парах формаліну, забарвлюють клітини розчином основного фуксину; промивають препарат у воді і висушують; підрахунок частоти утворення мікроядер проводять із одночасним отриманням цифрових зображень клітин і порівняльним комп'ютерним аналізом кольорів ядра та мікроядер на їх цифрових зображеннях.
Текст
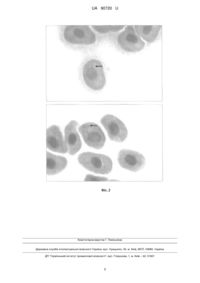
Реферат: UA 90720 U UA 90720 U 5 10 15 20 25 30 35 40 45 50 55 60 Спосіб належить до біологічної медицини та екології і може бути використаний для моніторингу генотоксичного ефекту низьких доз радіації і хімічних забруднювачів, які знаходяться в навколишньому середовищі. Відомо, що мікроядерний тест є швидким способом оцінки генотоксичності (здатності викликати ушкодження спадкового апарату клітини) середовища або окремих хімічних сполук. Суть методу полягає у підрахунку кількості клітин, які містять мікроядра (фрагменти хромосом, хроматид або навіть цілі хромосоми, які потрапили в ядра дочірніх клітин під час мітозу). При підвищенні частоти утворення мікроядер у порівнянні з контрольною групою роблять висновок про наявність генотоксичного впливу на організм. Перевагами способу є простота виконання та невеликий проміжок часу, потрібний для проведення, тому він широко застосовується як у лабораторних, так і в польових дослідженнях. Для мікроядерного тесту можна використовувати еритроцити хребетних (риб, рептилій, птахів), гепатоцити, клітини епітелію зябер риб, клітини кісткового мозку ссавців, лейкоцити та клітини букального епітелію людини. Найбільш зручним об'єктом для оцінки генотоксичності середовища або окремих хімічних сполук, з огляду на вартість модельних організмів, нескладність безпосереднього моделювання генотоксичного впливу та простоту виготовлення, є еритроцити риб та амфібій. Відомий спосіб визначення генотоксичного впливу на генетичний апарат клітин організму людини [An application of Acridine Orange fluorescent staining to the micronucleus test / Hayashi M., Sofuni Т., Ishidate M. Jr. // Mutat. Res. - 1983. - Vol. 120, № 4. - P. 241-247], який включає забір крові, виготовлення та фіксацію мазків, забарвлення їх акридиновим оранжевим, мікроскопічний аналіз препаратів для підрахунку частоти утворення мікроядер щонайменше в 1000 клітин та визначення за цим показником генотоксичного впливу на клітини організму. Ознаками спільними з аналогом, є: - забір крові; - виготовлення мазка; - фіксація мазка; - забарвлення мазка; - підрахунок частоти утворення мікроядер щонайменше в 1000 клітин; - визначення генотоксичного впливу на клітини організму за цим показником. Основним недоліком, який обмежує широке застосування цього способу, є використання люмінесцентного мікроскопу, вартість якого значно вища за звичайний біологічний мікроскоп, він є доволі громіздким і потребує джерела живлення значної потужності, що практично унеможливлює його використання в польових умовах. Акридиновий оранжевий, хімічна сполука, яку використовують як люмінесцентний барвник в цьому способі, є надзвичайно сильним канцерогеном, що може загрожувати здоров'ю дослідників. Відомий спосіб визначення генотоксичного впливу на генетичний апарат клітин організму людини [Пат. 2093811 Российской Федерации ΜΠΚ G01Ν1/28. Способ определения интоксикации, вызванной неконтролируемым хроническим радиационным облучением человека / Михалевич Л.C., Перепецкая Г.Α., Чеботарева Н.В.; заявитель Институт генетики и цитологии (Беларусь), патентообладатель Институт генетики и цитологии (Беларусь). - № 5068369/14, заявл. 17.03.1992, опубл. 20.10.1997], який включає забір крові у мешканців радіаційно забруднених районів, отримання плазми крові, обробку нею клітин диплоїдної культури ембріональних шкірно-м'язових клітин людини, їх фіксацію сумішшю етилового спирту та оцтової кислоти (у співвідношенні за об'ємом 3:1), забарвлення клітин 3-5 % водним розчином барвника Гімзи, підрахунок кількості мікроядер у 1000 клітин та визначення генотоксичного впливу на клітини організму за цим показником. Недоліками цього способу є те, що як тестовий об'єкт використовують проміжну культуру клітин людини; це значно ускладнює проведення мікроядерного тесту, оскільки в цьому випадку потрібне обладнання та поживні середовища для підтримання культури цих клітин. Також неможливо виключити вірогідність потрапляння часток пилу або барвника з повітря на поверхню препарату; ці часточки можуть бути помилково прийняті за мікроядра. Використання барвника Гімзи, при якому ядро клітини забарвлюється в темно-синій колір, є причиною того, що важко диференціювати мікроядра в цитоплазмі клітин від часточок забруднень. Оскільки утворення мікроядер є досить нечастою подією (від 1 до 5 на 1000 клітин), то навіть декілька хибних визначень здатні суттєво вплинути на результати дослідження. Спільними ознаками з прототипом є: - забір крові; - фіксація клітин; - забарвлення клітин; - підрахунок частоти утворення мікроядер щонайменше в 1000 клітин; 1 UA 90720 U 5 10 15 2025 30 35 40 45 50 55 - визначення за цим показником генотоксичиогу впливу на генетичний апарат клітини організму. В основу корисної моделі поставлена задача розробити спосіб визначення генотоксичного впливу на клітини організму, який шляхом використання для забарвлення ядер клітин барвника червоного кольору та комп'ютерного колориметричного аналізу дозволяє спростити розпізнавання мікроядер у різних типах клітин організму та зменшує вірогідності помилкових визначень за рахунок усунення суб'єктивного фактору. Суттєвими ознаками способу є: - забір крові; - виготовлення мазка; - фіксація мазка в парах формаліну; - забарвлення ядер клітин 0,05 % розчином основного фуксину; - промивання забарвленого препарату у воді; - висушування препарату; - підрахунок кількості мікроядер щонайменше в 1000 клітин із одночасним отриманням їх цифрових зображень та проведенням порівняльного комп'ютерного аналізу кольорів ядра та мікроядер; - визначення за цим показником генотоксичного впливу на генетичний апарат клітини організму. Відмінними від прототипу ознаками способу є: - виготовлення мазка крові; - фіксація мазка в парах формаліну; - забарвлення клітин 0,05 % розчином основного фуксину; - промивання забарвленого препарату у воді; - висушування препарату; - підрахунок кількості мікроядер щонайменше в 1000 клітин із одночасним отриманням їх цифрових зображень та проведенням порівняльного комп'ютерного аналізу кольорів ядра та мікроядер. Спосіб здійснюють таким чином: беруть кров, з якої роблять мазок на предметному склі, висушують його протягом 30-60 хв., фіксують 5 хв. у висхідних парах формаліну, забарвлюють ядра клітин 0,05 % водним розчином основного фуксину впродовж 15-20 с., промивають у воді, висушують на повітрі та досліджують щонайменше в 1000 клітин під мікроскопом із загальним збільшенням ×1000-1600 для визначення кількості клітин із мікроядрами. При виявлені клітини із мікроядром отримують її цифрове зображення для комп'ютерного колориметричного аналізу: порівнюють колір ядра із кольором мікроядер із використанням формули кольорової відмінності CIEDE2000 [The CTEDE2000 color-difference formula: Implementation notes, supplementary test data, and mathematical observations / Sharma G., Wu W., Dalal E.N. // Color Research & Applications. - 2005. - Vol. 30, № 1. P. 21-30]. Кольорове зображення переводять з режиму RGB в режим Lab у растровому графічному редакторі і вимірюють значення каналів зображення ядра (L1, а1*, b1*) та мікроядра (L2, а2*, b2*). У електронній таблиці Excel за отриманими даними по формулі кольорової відмінності CTEDE2000 вираховують різницю між кольорами (dE) ядра та мікроядра; чим менше значення dE, тим більша ймовірність того, що утворення дійсно є мікроядром. Так, наприклад нами було встановлено, що максимальне значення відмінності кольорів ядер та мікроядер у серії зі 100 знімків клітин із мікроядрами дорівнює 2,49, а мінімальне значення відмінності кольору цитоплазми від кольору ядра дорівнює 14,67. Отже, якщо отримане значення dE, більше ніж встановлена дослідником межа (в нашому дослідженні не більше 3,0), то можна стверджувати, що дане утворення не є мікроядром, оскільки його забарвлення суттєво відрізняється від забарвлення ядра. Для оцінки заявленого способу мікроядерного тестування впливу біхромату калію на генетичний апарат еритроцитів риб гупі (Роесіlliа reticulata), були проведенні дослідження, в яких риби знаходились у середовищі з підвищеним вмістом шестивалентного хрому. У дослідженні було використано 84 риби з довжиною тіла 30-40 мм, вагою 1-2 г. Усі риби були поділені на 4 групи, по 21 особині в кожній. Тварин утримували в скляних акваріумах об'ємом 18-22 л, які заповнювали відстояною протягом 24 год. водопровідною водою. Температуру підтримували за допомогою автоматичного нагрівача на рівні 20-22 °C, забезпечували фільтрацію та аерацію води за допомогою внутрішнього фільтру. Годували риб один раз на добу кормом Tetramin. Перша група тварин слугувала контролем, а до акваріумів, у яких знаходились тварини другої-четвертої груп, додавали біхромат калію у вигляді 1 % розчину в такому об'ємі, щоб концентрація хрому у воді складала 2,5 мг/л, 5,0 мг/л та 10,0 мг/л 2 UA 90720 U 5 10 15 20 25 30 35 40 45 50 55 відповідно. Воду в усіх акваріумах змінювали в повному об'ємі щодобово, розчин біхромату калію додавали при кожній зміні води. На 7, 14 та 21 добу від початку дослідження по 7 тварин з кожної групи анестезували за допомогою 0,1 % розчину новокаїну протягом 5-10 хв., після втрати рибою рефлексів сухою серветкою видаляли залишки вологи з тіла та за допомогою гострих ножиць декапітували, набирали в скляний капіляр краплю крові, яку наносили на предметне скло, робили мазок, висушували його на повітрі протягом 45 хв. Висушені мазки фіксували 5 хв. у висхідних парах формаліну, для чого у чашку Петрі наливали 10-15 мл 10 % формаліну та розміщували скельця мазками донизу на скляних паличках. Фіксовані мазки ополіскували в дистильованій воді та забарвлювали 0,05 % розчином основного фуксину протягом 25-30 с, промивали у воді, висушували на повітрі протягом 45 хв. Для мікроскопічного аналізу препаратів використовували мікроскоп MICROmed XS-5520, оснащений камерою-окуляром UDM-130, приєднаною до ПЕОМ через інтерфейс USB 2.0. На препаратах локалізували еритроцити із мікроядрами. При цьому, для того, щоб уникнути помилок, при підрахунку мікроядер дотримувались таких критеріїв: - діаметр мікроядра не більший за 1/5 діаметра ядра; - мікроядро розташоване на достатньому віддалені від ядра, що характеризує його як самостійну структуру; - забарвлення мікроядра суттєво не відрізняється від забарвлення ядра клітини. При знаходженні еритроцита із мікроядром отримували його цифрове зображення, яке аналізували за допомогою растрового графічного редактора GIMP. Для порівняння відповідності кольору ядра кольору мікроядер, цифрове зображення переводили з кольорової моделі RGB у кольорову модель Lab. Вимірювали значення кожного з каналів (L, а, b) на зображенні ядра та мікроядра клітини, значення заносили до електронної таблиці Excel і вираховували значення dE. У випадку, коли розрахований показник був більшим, ніж 3 одиниці, вважали, що колір утворення не відповідав кольору ядра, тому такі включення не враховували. Кількість проаналізованих клітин дорівнювала 1000 для кожної риби. Результати мікроядерного тесту виражали у проміле (‰). Статистичну обробку даних проводили з використанням методів варіаційної статистики та рангового дисперсійного аналізу Краскела-Уолліса. Рівень статистичної значущості був прийнятий на рівні 0,05. Розрахунки проводили за допомогою пакету прикладних програм Statistica 6.1. На фіг. 1 наведені результати впливу концентрації хрому у воді на частоту утворення мікроядер (а - 7 доба, б - 14 доба, в - 21 доба дослідження). На фіг. 2 наведені мікрофотографії мікроядер у еритроцитах гупі Роесіllіа reticulata. Кількість мікроядер у еритроцитах риб першої (контрольної) групи на сьому добу дослідження складала 1,0±0,58 ‰. Частота утворення мікроядер у риб, які знаходились у середовищі із підвищеним вмістом хрому (2,5 мг/л, 5,0 мг/л та 10,0 мг/л), була вищою за показники першої (контрольної) групи і відповідно складала для тварин другої групи 2,0±0,58 ‰, третьої групи - 2,4±0,53 ‰, четвертої - 2,6±0,53 ‰. При проведенні рангового дисперсійного аналізу Краскела-Уолліса була встановлена наявність достовірної статистичної розбіжності між групами I-IV за кількістю мікроядер (р=0,0014). Кількість мікроядер у еритроцитах риб контрольної групи на чотирнадцятий день складала 0,9±0,69 ‰, а частота утворення мікроядер у риб при підвищеному вмісті хрому складала для тварин другої групи - 2,6±0,53 ‰, третьої групи - 3,1±0,69 ‰, четвертої - 3,7±0,49 ‰. При проведенні рангового дисперсійного аналізу була встановлена наявність достовірної статистичної розбіжності між групами I-IV (р=0,0002). У результаті мікроядерного тесту, проведеного на двадцять перший день дослідження, було встановлено, що кількість мікроядер у еритроцитах риб контрольної групи складала 0,9±0,69 ‰, а частота мікроядер у еритроцитах риб, які знаходились у середовищі із підвищеним вмістом хрому відповідно дорівнювала для тварин другої групи - 3,1±0,38 ‰, третьої групи - 3,6±0,53 ‰, четвертої - 3,9±0,69 ‰. Проведення рангового дисперсійного аналізу підтвердило наявність достовірної статистичної розбіжності між групами I-IV (р=0,0002). Отримані результати дослідження вказують на те, що підвищена концентрація хрому у воді впливає на частоту утворення мікроядер у еритроцитах гупі, що підтверджує генотоксичну дію шестивалентного хрому на генетичний апарат клітин організму Роесіllіа reticulata. Завдяки використанню барвника червоного кольору під час проведення візуального підрахунку мікроядер в еритроцитах не було зроблено хибних визначень, що було підтверджено результатами комп'ютерного колориметричного аналізу. 3 UA 90720 U 5 Заявлений спосіб проведення та оцінки результатів мікроядерного тесту є достатньо простим і більш точним за існуючі аналоги, а для його проведення не потрібна наявність вартісного лабораторного обладнання та реактивів; тому він може бути рекомендований як для інтегральної оцінки генотоксичності середовища шляхом мікроядерного тестування природних популяцій, так і для оцінки генотоксичності окремих сполук за допомогою лабораторних ліній модельних організмів. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 10 15 Спосіб визначення генотоксичного впливу на клітини організму, що включає забір крові; фіксацію клітин; їх забарвлення; підрахунок частоти утворення мікроядер у клітинах; визначення за цим показником генотоксичногу впливу на генетичний апарат клітини організму, який відрізняється тим, що готують мазок крові, фіксують його у парах формаліну, забарвлюють клітини розчином основного фуксину; промивають препарат у воді і висушують; підрахунок частоти утворення мікроядер проводять із одночасним отриманням цифрових зображень клітин і порівняльним комп'ютерним аналізом кольорів ядра та мікроядер на їх цифрових зображеннях. 4 UA 90720 U Комп’ютерна верстка Г. Паяльніков Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 5
ДивитисяДодаткова інформація
Автори англійськоюHorokhovskyi Yehor Yuriiovych
Автори російськоюГороховский Егор Юрьевич
МПК / Мітки
МПК: G01N 1/28
Мітки: спосіб, визначення, клітині, організму, впливу, генотоксичного
Код посилання
<a href="https://ua.patents.su/7-90720-sposib-viznachennya-genotoksichnogo-vplivu-na-klitini-organizmu.html" target="_blank" rel="follow" title="База патентів України">Спосіб визначення генотоксичного впливу на клітини організму</a>
Попередній патент: Спосіб інтенсифікації просівання продовгуватих компонентів на решетах з прямокутними отворами
Наступний патент: Контрольний пристрій для заміру сферичних поверхонь
Випадковий патент: Одсорбент для освітлення і стабілізації виноградних напоїв "флотосорб-1"