2-(3-хлоротетрагідрофуран-2-іл)-4-тозил-5-(трифторометил)-2н-1,2,3-триазол
Номер патенту: 93023
Опубліковано: 10.09.2014
Автори: Гудзь Ганна Петрівна, Повниця Ольга Юріївна, Білявська Любов Олексіївна, Нестерова Надія Віталіївна, Шермолович Юрій Григорович
Формула / Реферат
2-(3-хлоротетрагідрофуран-2-іл)-4-тозил-5-(трифторометил)-2Н-1,2,3-триазол структурної формули:
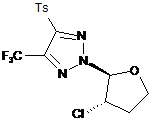 ,
,
який виявляє антивірусну активність стосовно аденовірусу людини.
Текст
Реферат: 2-(3-Хлоротетрагідрофуран-2-іл)-4-тозил-5-(трифторометил)-2Н-1,2,3-триазол формули: Ts N F3C N N Cl O , який виявляє антивірусну активність стосовно аденовірусу людини. структурної UA 93023 U (12) UA 93023 U UA 93023 U Корисна модель належить до органічної хімії, а саме до нової сполуки фторовмісного аналога нуклеозиду, що може знайти своє застосування у медицині. Зокрема, заявлено сполуку 2-(3-хлоротетрагідрофуран-2-іл)-4-тозил-5-(трифторометил)-2Н1,2,3-триазол структурної формули: 5 Ts N N F3C N O Cl 10 15 20 25 30 , що виявляє антивірусну активність стосовно аденовірусу людини. Запропонована нова сполука, її властивості, структура та спосіб одержання в літературі не описані. Є відомими аналоги нуклеозидів, які є ефективними відносно ряду вірусів: грипу А і В, PCвірусу, вірусу Ласа, гепатиту С та аденовірусу. Зокрема, фосфоніл ациклічний нуклеотид (S)-9(3-гідрокси-2-фосфонометоксипропіл) цитозин дегідрат, який також відомий як S-HPMPC або цидофовір, виявляє антивірусну ефективність стосовно аденовірусу 5 серотипу (Gordon, Y.J., Romanowski, E. et al. Pretreatment with Topical 0.1 % (S)-1-(3-hydroxy-2phosphonylmethoxypropil)cytosine inhibits adenovirus type-5 replication in the New-Zeland rabbit ocular model // Cornea. - 1992.- 11. - P. 529-533). Зазначена сполука знижує титр аденовірусу як при терапевтичному, так і профілактичному застосуванні. Проте ізольовано аденовіруси, які є стійкими до цидофовіру та, крім того, зазначена сполука має низьке співвідношення ефективність/токсичність. Найближчим аналогом заявленої сполуки за хімічною структурою та антивірусною активністю вибрано рибавірин, який відноситься до групи аналогів нуклеозидів на основі триазолів. Рибавірин - 1--D-рибофуранозил-1,2,4-триазол-3-карбоксамід є ефективним проти ряду вірусів: грипу А і В, PC-вірусу, вірусу Ласа, гепатиту С (Paul R. Kinchington, et al. Prospects for adenovirus antivirals // Journal of Antimicrobial Chemotherapy. - 2005. - 55. - P. 424-429). Проте у дослідах було продемонстровано обмежену активність стосовно аденовірусу. Задачею корисної моделі є створення нової ефективної сполуки з вираженою активністю стосовно аденовірусу людини. Вирішення поставленої задачі досягається за допомогою синтезу фторовмісного аналога нуклеозиду 2-(3-хлоротетрагідрофуран-2-іл)-4-тозил-5-(трифторометил)-2H-1,2,3-триазолу структурної формули: Ts N F3C N N Cl 35 40 45 O , який виявляє антивірусну активність стосовно аденовірусу людини. Аденовіруси людини (HAdV) посідають третє місце за своєю поширеністю у групі гострих респіраторних вірусних інфекцій. На сьогоднішній день противірусні препарати, які використовуються у медицині, поставляються переважно зарубіжними виробниками. Стосовно аденовірусної інфекції слід сказати, що у світі поки що взагалі не створено високоефективних специфічних ліцензованих препаратів для її лікування. Тому актуальним є пошук препаратів на основі сполук синтетичного походження, які були б не тільки ефективними та безпечними при тривалому застосуванні, а й доступними для широкого кола пацієнтів. Особливістю аденовірусної інфекції є її здатність викликати поліклінічні прояви з різним ступенем тяжкості. Віруси викликають гострі та хронічні респіраторні захворювання, пневмонії, кон'юнктивіти, гастроентерити, геморагічні цистити. У деяких випадках аденовіруси можуть викликати гепатити, міокардити, менінгоенцефаліти, лімфаденіти, гайморити. Тяжкий перебіг захворювання спостерігається у дітей молодшого віку, осіб з імунодефіцитом та пацієнтів після 1 UA 93023 U 5 10 15 20 25 30 35 40 45 50 55 60 трансплантації. HAdV можуть тривалий час знаходитися у латентному стані у лімфоїдних органах, виявляти імунодепресивний вплив та піддаватися активації під впливом різних факторів. Мішенню антивірусного впливу лікарських засобів можуть бути різні етапи циклу репродукції аденовірусів: адсорбція віріонів на мембрані клітини, "роздягання" вірусів, транспорт вірусної ДНК у ядро клітини, реплікація вірусної ДНК, функціонування вірусної ДНК-полімерази, рання та пізня транскрипція та трансляція нуклеїнової кислоти, посттранскрипційні модифікації мРНК, фосфорилування структурного білка, що контролює "роздягання" віріонів, глікозилування білків, "дозрівання" віріонів. Передбачається, що механізм антиаденовірусної активності заявленої сполуки пов'язаний із порушенням процесу реплікації вірусної ДНК. Корисна модель ілюструється наступними прикладами. Приклад 1. Спосіб синтезу 2-(3-хлоротетрагідрофуран-2-іл)-4-тозил-5-(трифторометил)-2H1,2,3-триазолу Розчин 2,3-дигідро-2H-фурану (1,29 мл 17 ммоль) в 1,4-діоксані (15 мл) прикапували при перемішуванні до розчину 4-тозил-5-(трифторометил)-2-хлоро-2H-1,2,3-триазолу (6,8 ммоль) в 1,4-діоксані (25 мл) при кімнатній температурі. Реакційну суміш перемішували протягом 4 годин при кімнатній температурі, потім - 7 год. при 80 °C, після чого розчинник упарювали у вакуумі. Отримували продукт приєднання у вигляді суміші двох діастереомерів (60/40 транс-/цис-), які розділяли за допомогою колонкової хроматографії. Вихід транс-ізомеру 2-(3-хлоротетрагідрофуран-2-іл)-4-тозил-5-(трифторометил)-2Н-1,2,3триазолу: 0,95 г (59 %), Rf 0,95 (ЕtOАс/гептан, 1:1), безбарвний порошок, т.пл. 87-92 °C (ЕtOАс/гептан). Дана сполука легкорозчинна у полярних розчинниках, хлороформі. 1 19 Структура сполуки була підтверджена даними спектрів ЯМР Н, F. 1 3 3 Спектр ЯМР Н (CDCl3), , м. ч.: 7,90 д (2Н, С6Н4, JHH=8,0 Гц), 7,37 д (2Н, С6Н4, JHH=8,0 Гц), 6,33 д (1Н, CHN, J=0,8 Гц), 4,7 д (1Н, СНСl, J=5,8 Гц), 4,47-4,36 м (2Н, СН2О), 2,89 д.д.д.д (1Н, СН2СНСl, J=5,8, 6,1, 8,6, 15,0 Гц), 2,45 с (3Н, СН3(Ar)), 2,36 д.д.д.д (1Н, СН2СНСl, J=1,6, 4,9, 4,9, 14,0 Гц). 19 Спектр ЯМР F (CDCl3), , м. ч.: - 60,80 с (3F, CF3). 13 Спектр ЯМР С (CDCl3), , м. ч.: 147,81 (C(Het)SO2), 146,20 (С(Ar)СН3), 137,73 кв (C(Het)CF, 2 JCF=42,0 Гц), 136,20 (C(Ar)SO2), 130,31 (2C(Ar)H), 128,81 (2C(Ar)H), 119,10 кв (CF3, JCF=270,0 Гц), 99,74 (CHN), 70,30 (CH2O), 59,82 (CHCl), 34,22 (СH2СНСl), 21,84 (СН3(Ar)). Знайдено, %: С, 42,67; Н, 3,45; Сl, 9,26; N, 10,84. C 14H13ClF3N3O3S. Вирахувано, %: С, 42,49; Н, 3,31; Сl, 8,96; N, 10,62. Приклад 2. Антиаденовірусна активність 2-(3-хлоротетрагідрофуран-2-іл)-4-тозил-5(трифторометил)-2H-1,2,3-триазолу У дослідженнях використовували культури клітин Нер-2 (клітини карциноми гортані людини) та HeLa (карциноми шийки матки). Клітини культивували у відповідності із загальноприйнятою методикою (Носач Л.Н., Дяченко Н.С., Тарасишин Л.А. и др. Влияние рибамидила на экспрессию аденовирусного генома // Мол. генетика, микробиол. и вирусол. - 1984. - № 11. - С. 41-45) Еталонний штам аденовірусу людини 5 серотипу (HAdV5) отриманий із колекції Інституту мікробіології Будапештського медичного університету. Вірус накопичували на культурі клітин Нер-2 та зберігали при температурі -20 °C. Клітини вирощували на ростовому середовищі, що складалось з 45 % RPMI-1640 (Sigma, США), 45 % ДМЕМ (БіоТестМед, Україна) та 10 % сироватки ембріона теляти (Sigma, США). Для дослідження використовували ряд синтезованих сполук з різними замісниками у нуклеїновій основі 2N-заміщених-4-тозил-5-(поліфтороалкіл)-1,2,3-триазолів (Таблиця 1). Сполуки розчиняли у ДМСО (DMSO, Sigma, США) до концентрації 20 мг/мл та зберігали до використання при +4 °C. Робочі серійні двократні розведення сполук від 1 мг/мл до 64 мкг/мл готували на середовищі без сироватки (RPMI-1640, Sigma, США) безпосередньо перед використанням. Розчини піддавали стерилізації шляхом фільтрування через шприцеві мембранні фільтри з діаметром пор 0,22 мкм (Sarstredt, Німеччина). У досліді вивчали цитотоксичний вплив сполук, який виявляли за допомогою МТТ-тесту за стандартною методикою (Mosmann Т. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays // J. Immunol. Methods. - 1983. - 65. - P. 55-63). Використовуючи програму лінійної регресії Microsoft Excel 10 для Pentium Pro, визначали концентрацію сполуки, яка інгібує життєздатність клітин на 50 % у порівнянні із контролем (CC50). Для виявлення інфікованих аденовірусом клітин, що містять вірусоспецифічні включення, клітини Нер-2 та HeLa вирощували у пробірках із смугами покривних скелець. Через 24 години ростове середовище видаляли та інфікували клітини аденовірусом із розрахунку 10-20 2 UA 93023 U 5 10 15 ВУО/клітину. Після адсорбції вірусу протягом 1,5 годин при кімнатній температурі клітини відмивали розчином Хенкса та додавали підтримуюче середовище без сироватки, що містить сполуки, які піддають дослідженню, у різних концентраціях. Для кожної концентрації використовували 3 пробірки з клітинами. Як контроль використовували клітини, інфіковані аденовірусом за відсутності сполук у середовищі (контроль вірусу). Результати підраховували через 48 годин. Клітини відмивали розчином Хенкса, фіксували 96° етиловим спиртом та зберігали при кімнатній температурі до подальшого дослідження. Для виявлення внутрішньоядерних ДНК-вмісних вірусоспецифічних включень клітини відмивали розчином Хенкса, піддавали флуорохромуванню 0,01 % розчином акридинового оранжевого протягом 1-5 хвилин та досліджували методом люмінесцентної мікроскопії (МЛ-2, ЛОМО, Росія), використовуючи об'єктив 40х. На кожному із 3 скелець визначали кількість клітин із включеннями з 500 підрахованих клітин моношару. Інгібуючий вплив сполук на репродукцію вірусу визначали за редукцією числа інфікованих клітин у досліді у порівнянні із контролем, цей показник виражали у відсотках та визначали за формулою: відсоток інгібування = 100 (О*100/К), де К - кількість клітин із включеннями у контролі, О - кількість клітин із включеннями у досліді. За ефективну концентрацію (EC50) приймали ту, що викликала зменшення на 50 % кількості клітин із включеннями. Для визначення EC50 використовували програму лінійної регресії Microsoft Excel 10 для Pentium Pro. 20 Таблиця Біологічна активність фторовмісних сполук Позначення сполуки Структурна формула Розчинність* Цитотоксичність сполуки (СС50), мкг/мл HeLa Нер-2 Антиаденовірусна активність (EC50), мкг/мл Ts N G6 N F3C O N погана 194 941 Н.а. погана 218 665 186±5,9 добра 473 1461 16±3,6 погана 310 640 Н.а. Cl Ts N G7 N C3F7 O N Cl Ts N G8 (заявлена F3C сполука) N N O Cl Ts N G9 C3F7 N N O Cl 3 UA 93023 U Ts N G10 F3C N O добра 387 573 70±4,9 погана 536 2127 Н.а. погана 298 535 Н.а. O добра 309 500 Н.а. O погана 339 650 Н.а. N Ts N G11 C3F7 N O N Ts N G12 F3C N N O Ts N G13 C3F7 N N Ts N G14 F3C N N Примітки: * - розчинність в середовищі (RPMI-1640, Sigma, США), Н.а. - не активна 5 10 15 Критерієм оцінки специфічної активності лікарських засобів у культурі тканин є індекс селективності (SI), що визначається як відношення СС 50 (цитотоксичної концентрації, яка на 50 % пригнічує життєздатність клітин) до EC50 (ефективна концентрація, яка на 50 % інгібує репродукцію вірусу). Слаботоксичні препарати, які значним чином пригнічують репродукцію вірусу, мають високий показник SI та мають значний лікувальний ефект. Як видно з Таблиці, заявлена згідно з даною корисною моделлю сполука 2-(3-хлоротетрагідрофуран-2-іл)-4-тозил-5(трифторометил)-2H-1,2,3-триазол (G8) характеризується слабкою цитотоксичністю. При цьому індекс селективності для заявленої сполуки був найвищим серед усіх досліджених сполук та складав 91. Крім того, було встановлено, що ефективна антивірусна концентрація сполуки, яка викликає 50 %-ву редукцію вірусоспецифічних внутрішньоядерних включень (EC 50), для запропонованої сполуки складала 16 мкг/мл. Такий показник перевершував відповідні значення для усіх інших сполук, які використовувалися в експерименті. Для дослідження антивірусної активності сполук використовували нетоксичні концентрації, нижче CC50, та наступні схеми внесення досліджуваних сполук: обробка клітин за 1-2 години до зараження (1); присутність під час адсорбції вірусу (2); внесення сполук після адсорбції вірусу, у складі поживного середовища (3); спільна інкубація вірусу та сполук з подальшим інфікуванням цією сумішшю клітин - віруліцидна активність (4). 4 UA 93023 U 5 При використанні 1, 2 та 4 схем обробки не виявлено жодного впливу сполук на репродукцію аденовірусу (дані не представлені). При проведені дослідження за схемою 3 було виявлено, що 2-(3-хлоротетрагідрофуран-2-іл)-4-тозил-5-(трифторометил)-2H-1,2,3-триазол (G8) у концентрації 20 мкг/мл інгібував репродукцію HAdV5 на 62 %, а у концентрації 4 мкг/мл - на 16 %. Ці результати були найкращими серед усіх проаналізованих сполук. Таким чином, заявлена у відповідності із даною заявкою нова сполука 2-(3хлоротетрагідрофуран-2-іл)-4-тозил-5-(трифторометил)-2H-1,2,3-триазол характеризується низькою цитотоксичністю та високим показником антиаденовірусної активності, що робить її перспективним кандидатом для створення фармацевтичних препаратів. 10 ФОРМУЛА КОРИСНОЇ МОДЕЛІ 2-(3-Хлоротетрагідрофуран-2-іл)-4-тозил-5-(трифторометил)-2Н-1,2,3-триазол формули: структурної 15 Ts N F3C N N Cl O , який виявляє антивірусну активність стосовно аденовірусу людини. Комп’ютерна верстка В. Мацело Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 5
ДивитисяДодаткова інформація
Автори англійськоюPovnytsia Olha Yuriivna, Shermolovych Yurii Hryhorovych, Nesterova Nadia Vitaliivna
Автори російськоюПовница Ольга Юрьевна, Шермолович Юрий Григорьевич, Нестерова Надежда Витальевна
МПК / Мітки
МПК: A61K 31/34, A61K 31/41, C07D 307/00, A61P 31/20, C07D 249/00
Мітки: 2-(3-хлоротетрагідрофуран-2-іл)-4-тозил-5-(трифторометил)-2н-1,2,3-триазол
Код посилання
<a href="https://ua.patents.su/7-93023-2-3-khlorotetragidrofuran-2-il-4-tozil-5-triftorometil-2n-123-triazol.html" target="_blank" rel="follow" title="База патентів України">2-(3-хлоротетрагідрофуран-2-іл)-4-тозил-5-(трифторометил)-2н-1,2,3-триазол</a>
Попередній патент: Спосіб прогнозування швидкості рентгенологічного прогресування раннього ревматоїдного артриту
Наступний патент: Спосіб лікування опорно-рухового апарату людини
Випадковий патент: Спосіб аерації стічних вод в аеротенках











