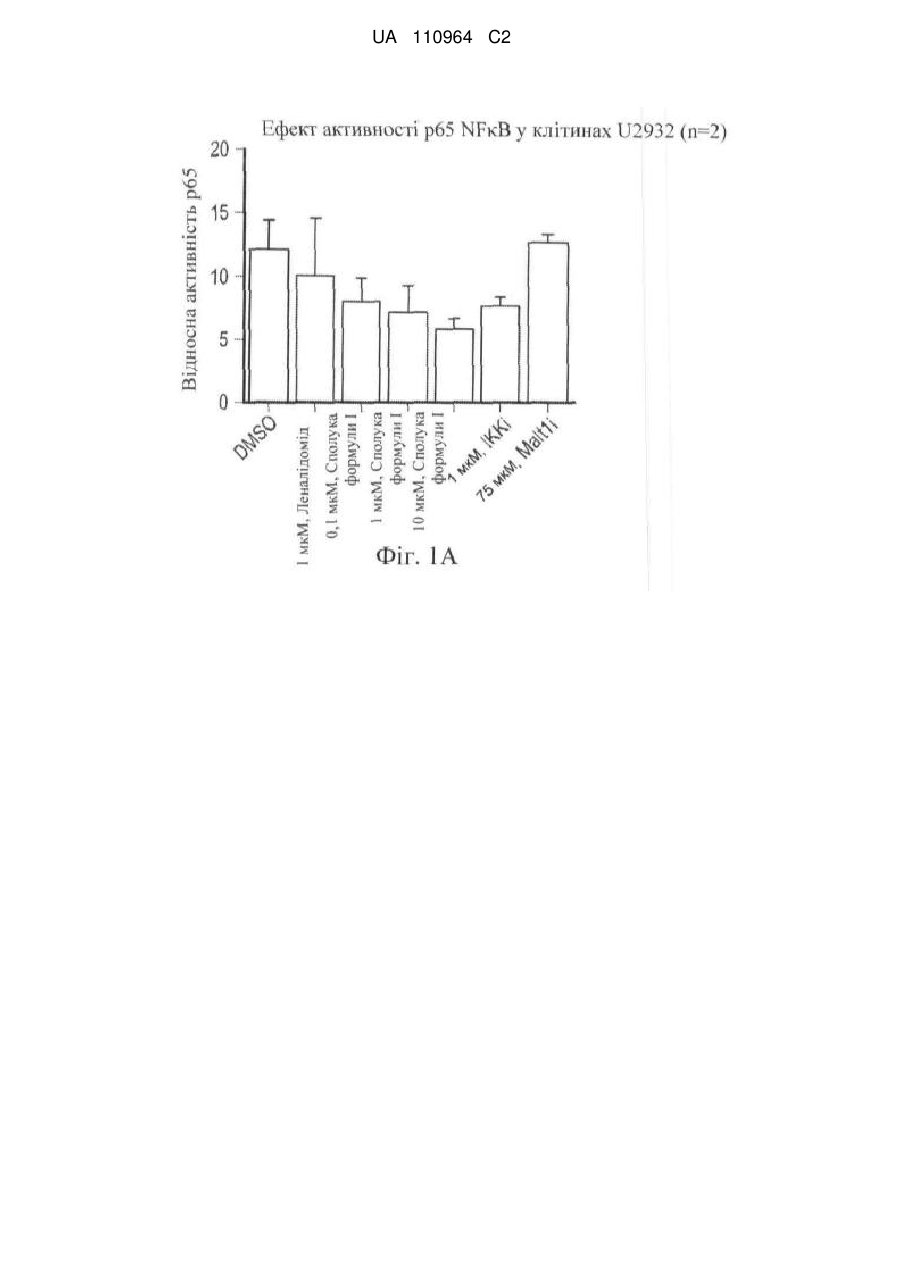
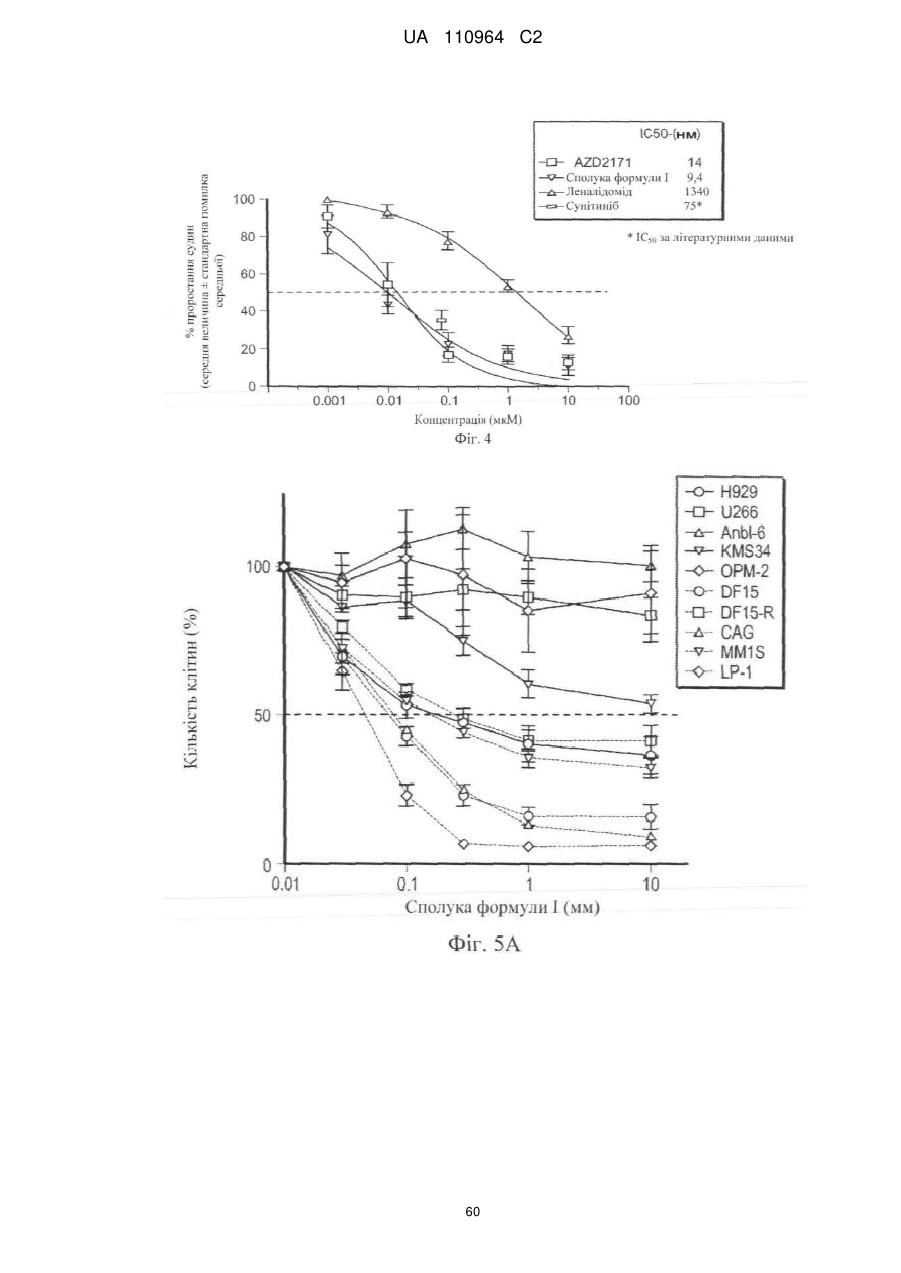
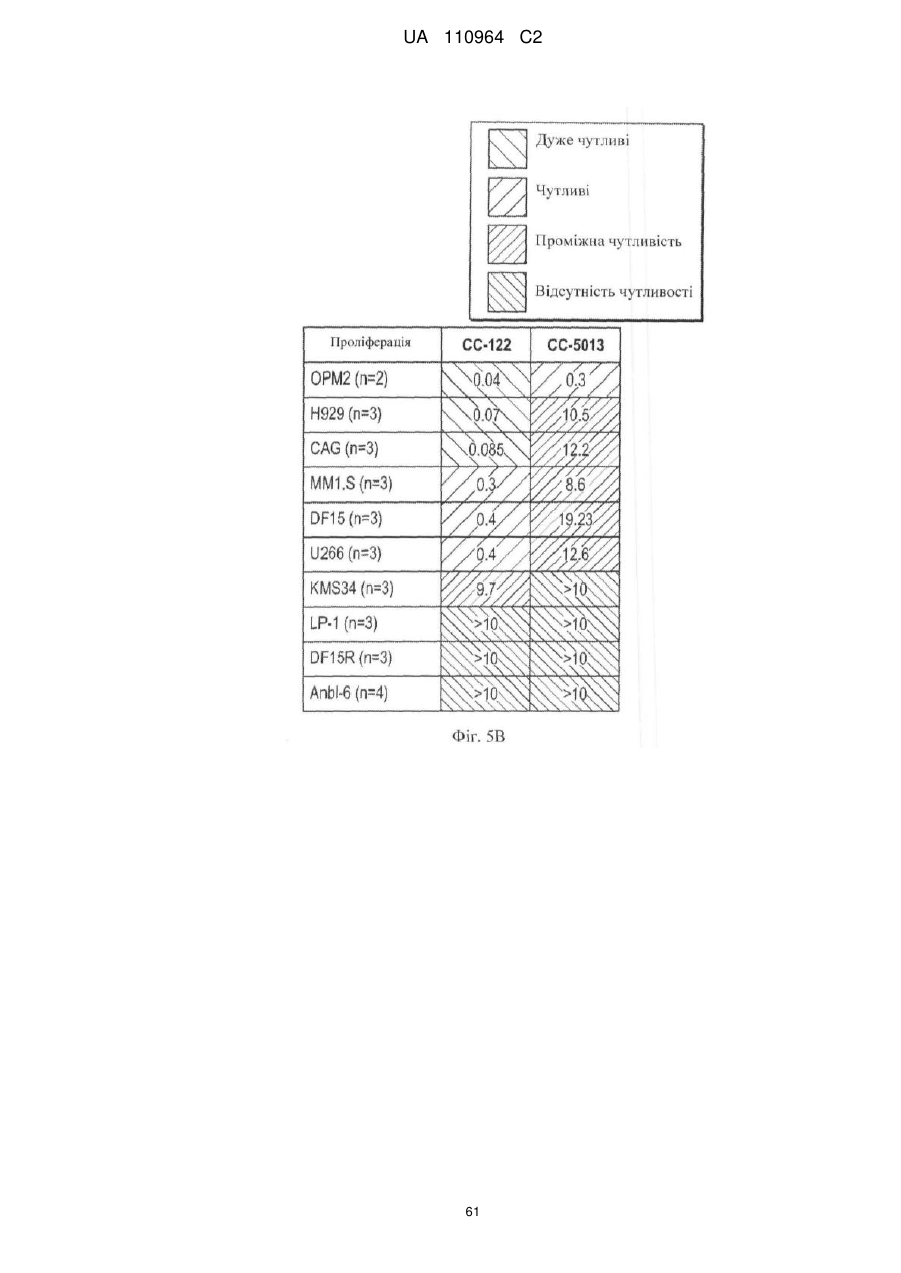
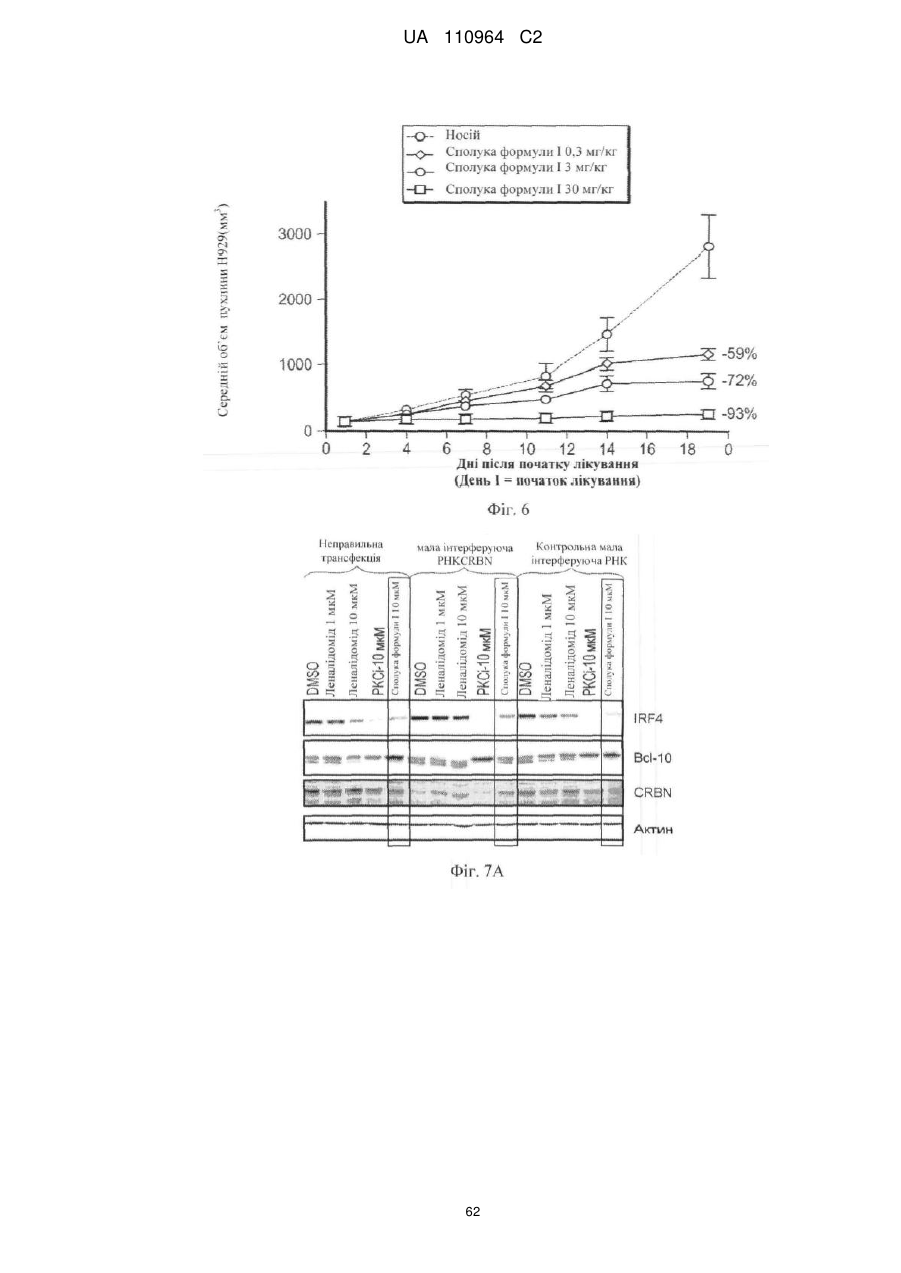
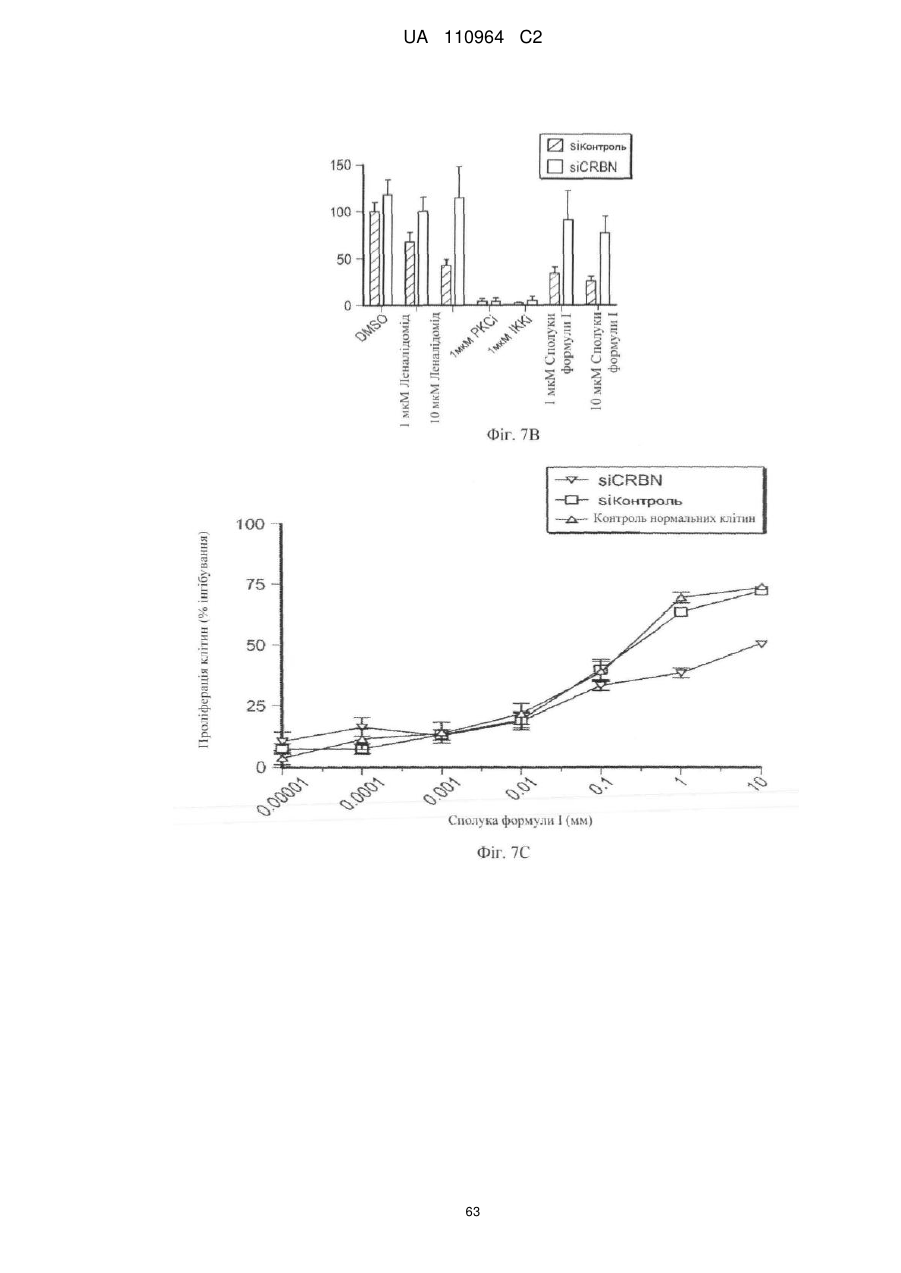
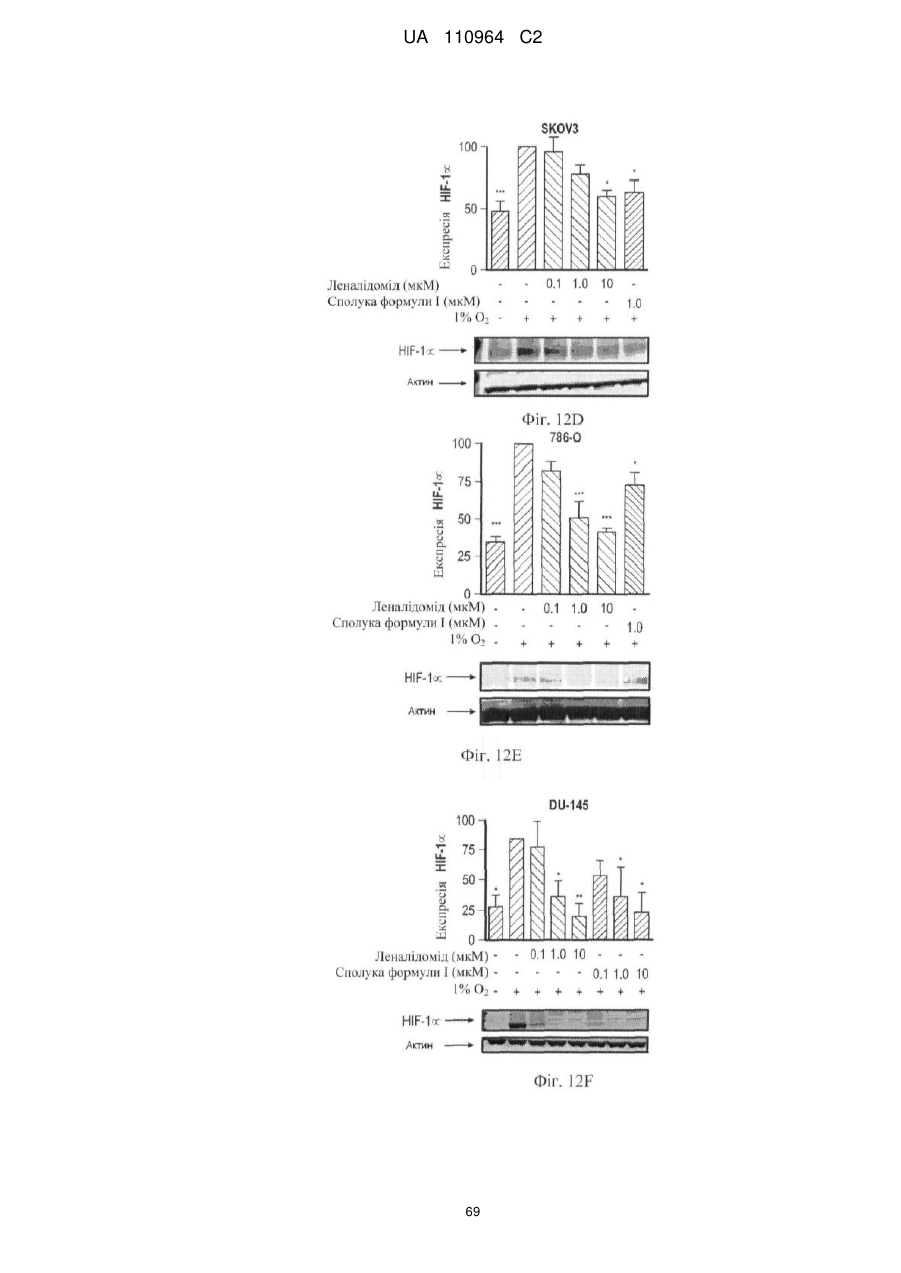
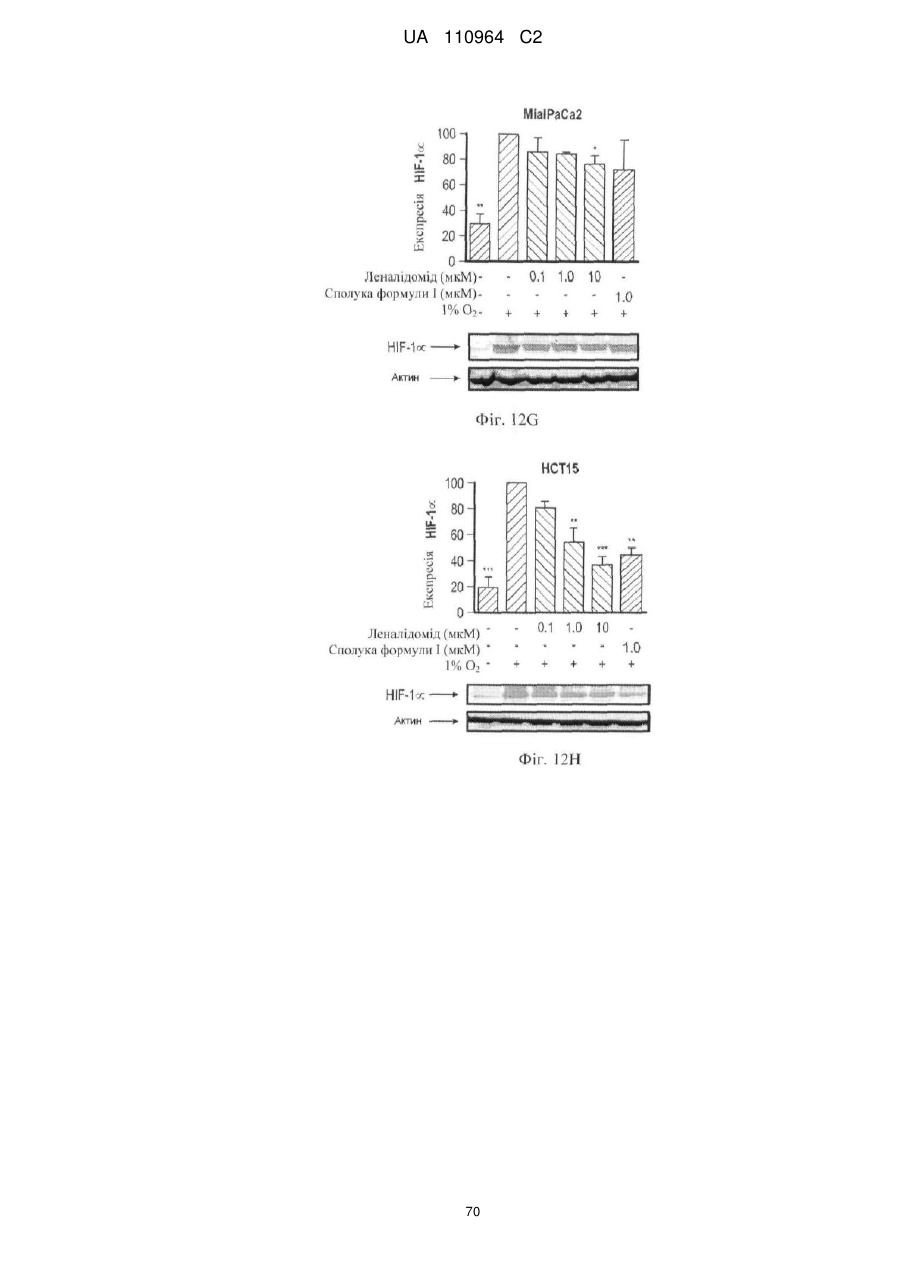
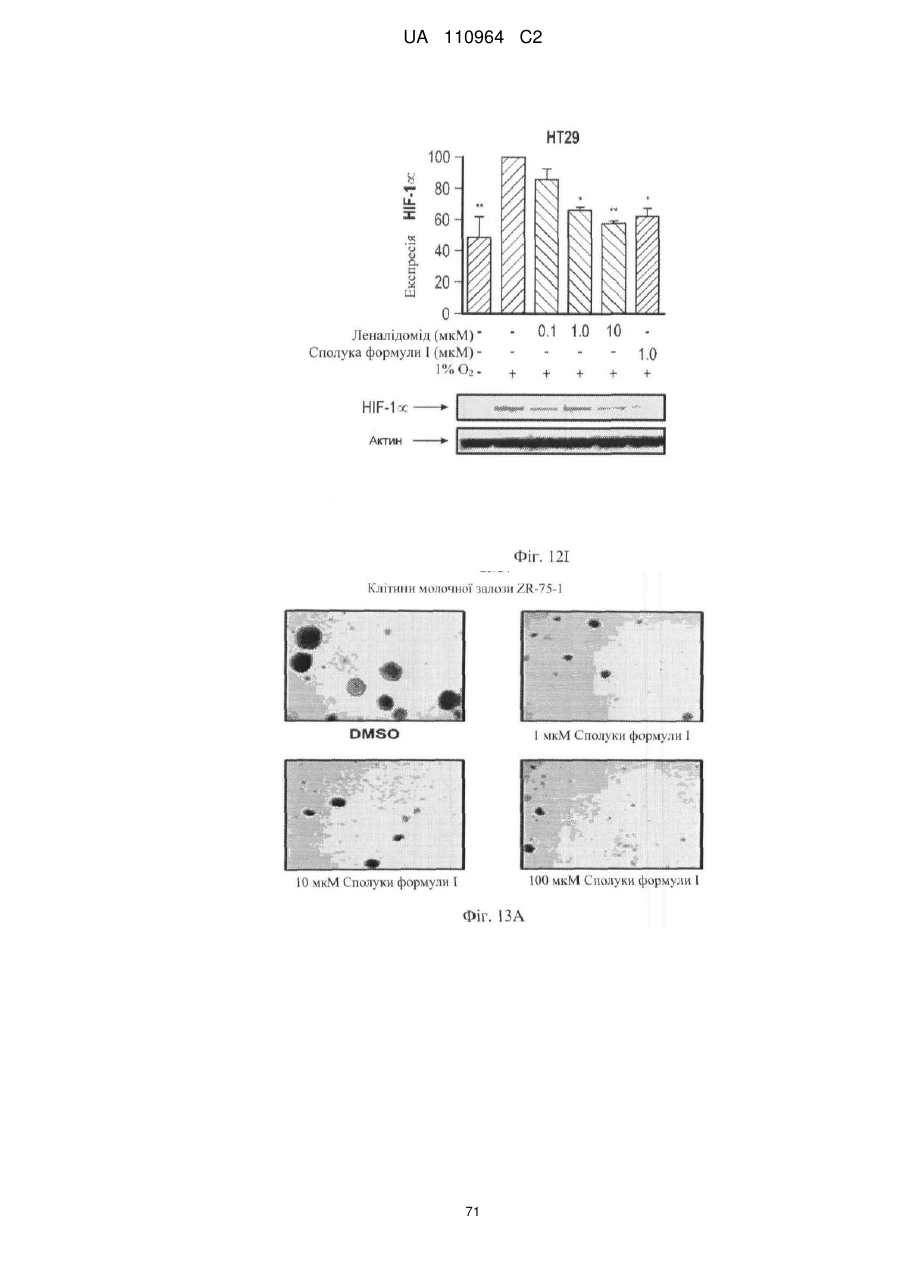
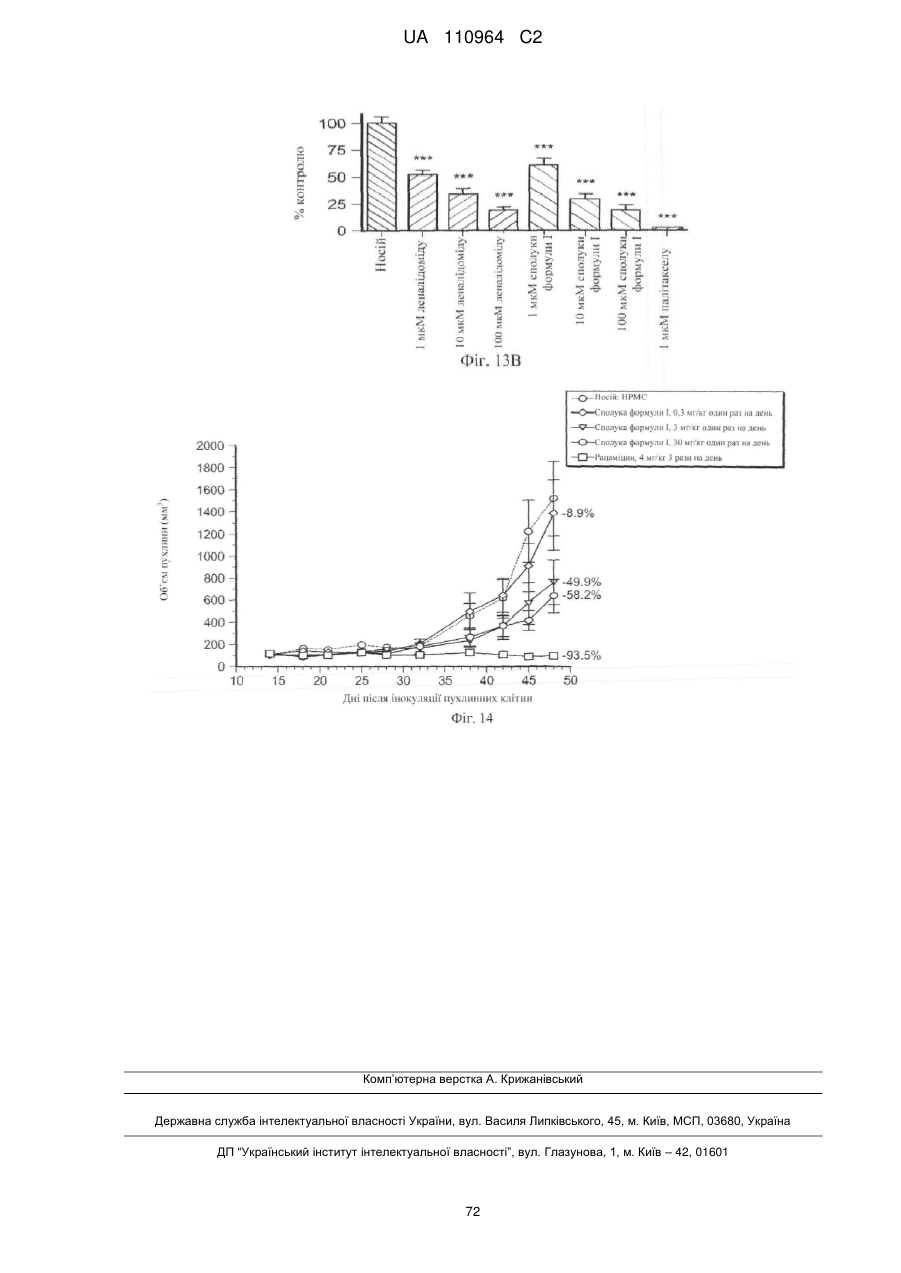
Застосування 3-(5-аміно-2-метил-4-оксо-4н-хіназолін-3-іл)піперидин-2,6-діону для лікування раку
Номер патенту: 110964
Опубліковано: 10.03.2016
Автори: Чопра Раджеш, Ман Хон-Вах, Гандхі Аніта, Чжан Лін-Хуа, Шефер Пітер Х., Мюллер Джордж В.
Формула / Реферат
1. Застосування терапевтично ефективної кількості 3-(5-аміно-2-метил-4-оксо-4Н-хіназолін-3-іл)піперидин-2,6-діону, який має наступну структуру:
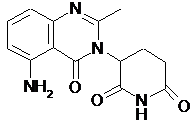 ,
,
або його енантіомера, або суміші його енантіомерів, або його фармацевтично прийнятної солі, сольвату, гідрату, співкристала, клатрату або поліморфу для виготовлення лікарського засобу для лікування або ведення страждаючого на рак пацієнта, де лікарський засіб придатний для введення потребуючому такого лікування або ведення пацієнту.
2. Застосування за п. 1, де рак являє собою запущене злоякісне захворювання, амілоїдоз, нейробластому, менінгіому, гемангіоперицитому, множинні метастази в мозок, мультиформну гліобластому, гліобластому, гліому стовбура мозку, злоякісну пухлину мозку з несприятливим прогнозом, злоякісну гліому, анапластичну астроцитому, анапластичну олігодендрогліому, нейроендокринну пухлину, аденокарциному прямої кишки, колоректальний рак стадії С і D за Дьюксом, неоперабельну колоректальну карциному, метастатичну гепатоцелюлярну карциному, саркому Капоші, каротиповий гострий мієлобластний лейкоз, лімфому Ходжкіна, неходжкінську лімфому, шкірну Т-клітинну лімфому, шкірну В-клітинну лімфому, дифузну великоклітинну В-клітинну лімфому, низькодиференційовану фолікулярну лімфому, злоякісну меланому, злоякісну мезотеліому, синдром злоякісної мезотеліоми із плевральним випотом, карциному очеревини, папілярну серозну карциному, гінекологічну саркому, саркому м'яких тканин, склеродермію, шкірний васкуліт, гістіоцитоз із клітин Лангерганса, лейоміосаркому, прогресуючу осифікуючу фібродисплазію, рак передміхурової залози, рефракторний до гормонів, резектовану саркому м'яких тканин з високим ризиком, неоперабельну печінковоклітинну карциному, макроглобулінемію Вальденстрема, млявоплинну мієлому, мієлому, яка повільно розвивається, рак фаллопієвих труб, андрогеннезалежний рак передміхурової залози, андрогензалежний неметастатичний рак передміхурової залози IV стадії, нечутливий до гормональної терапії рак передміхурової залози, нечутливий до хіміотерапії рак передміхурової залози, папілярну карциному щитовидної залози, фолікулярну карциному щитовидної залози, медулярну карциному щитовидної залози й лейоміому.
3. Застосування за п. 1, де рак являє собою гематологічну пухлину.
4. Застосування за п. 1, де рак являє собою мієлому або лімфому.
5. Застосування за п. 1, де рак являє собою солідну пухлину.
6. Застосування за п. 1, де рак являє собою рак молочної залози, колоректальний рак, рак яєчників, рак передміхурової залози, рак підшлункової залози або рак нирок.
7. Застосування за п. 1, де рак являє собою гепатоцелюлярну карциному, рак передміхурової залози, рак яєчників або гліобластому.
8. Застосування за п. 1, де рак являє собою неходжкінську лімфому.
9. Застосування за п. 8, де неходжкінська лімфома являє собою дифузну великоклітинну В-клітинну лімфому.
10. Застосування за п. 9, де дифузна великоклітинна В-клітинна лімфома належить до активованого В-клітинного фенотипу.
11. Застосування за п. 10, де дифузна великоклітинна В-клітинна лімфома характеризується експресією одного або декількох біомаркерів, надекспресованих у клітинних лініях RIVA, U2932, TMD8 або OCI-Ly10.
12. Застосування за будь-яким з пп. 1-11, де рак є рецидивуючим або рефракторним.
13. Застосування за будь-яким з пп. 1-12, де рак є стійким до медикаментозної терапії.
14. Застосування терапевтично ефективної кількості 3-(5-аміно-2-метил-4-оксо-4Н-хіназолін-3-іл)піперидин-2,6-діону або його фармацевтично прийнятної солі, сольвату або гідрату для одержання лікарського засобу для лікування або ведення пацієнта з неходжкінською лімфомою, де лікарський засіб придатний для введення пацієнту, і де пацієнт ідентифікований як страждаючий на неходжкінську лімфому, чутливу до лікування 3-(5-аміно-2-метил-4-оксо-4Н-хіназолін-3-іл)піперидин-2,6-діоном.
15. Застосування за п. 14, де неходжкінська лімфома являє собою дифузну великоклітинну В-клітинну лімфому.
16. Застосування за п. 14, де неходжкінська лімфома належить до активованого В-клітинного фенотипу.
17. Застосування за п. 15, де дифузна великоклітинна В-клітинна лімфома належить до активованого В-клітинного фенотипу.
18. Застосування за п. 17, де дифузна великоклітинна В-клітинна лімфома характеризується експресією одного або декількох біомаркерів, надекспресованих у клітинних лініях RIVA, U2932, TMD8 або OCI-Ly10.
19. Застосування за п. 14, де ідентифікація пацієнта, що має неходжкінську лімфому, чутливу до лікування 3-(5-аміно-2-метил-4-оксо-4Н-хіназолін-3-іл)піперидин-2,6-діоном або його сіллю, сольватом або гідратом, включає характеристику фенотипу неходжкінської лімфоми пацієнта як активованого В-клітинного підтипу.
20. Застосування за п. 19, де фенотип неходжкінської лімфоми характеризується як активований В-клітинний підтип дифузної великоклітинної В-клітинної лімфоми.
21. Застосування за п. 19, де фенотип неходжкінської лімфоми характеризується експресією одного або декількох біомаркерів, надекспресованих у клітинних лініях RIVA, U2932, TMD8 або OCI-Ly10.
22. Застосування за п. 14, де ідентифікація фенотипу неходжкінської лімфоми включає одержання біологічного зразка в пацієнта, що має лімфому.
23. Застосування за п. 22, де біологічний зразок являє собою біоптат лімфовузла, біоптат кісткового мозку або зразок пухлинних клітин периферичної крові.
24. Застосування за п. 14, де ідентифікація пацієнта, що має неходжкінську лімфому, чутливу до лікування 3-(5-аміно-2-метил-4-оксо-4Н-хіназолін-3-іл)піперидин-2,6-діоном або його сіллю, сольватом або гідратом, включає ідентифікацію гена, пов'язаного з активованим В-клітинним фенотипом.
25. Застосування за п. 24, де ген, пов'язаний з активованим В-клітинним фенотипом, вибраний із групи, яка складається з IRF4/MUM1, FOXP1, SP1B, CARD11 і BLIMP/PDRM1.
26. Застосування за п. 14, де ідентифікація пацієнта, що має неходжкінську лімфому, чутливу до лікування 3-(5-аміно-2-метил-4-оксо-4Н-хіназолін-3-іл)піперидин-2,6-діоном або його сіллю, сольватом або гідратом, включає вимірювання рівня активності NF-κВ у біологічному зразку, отриманому в пацієнта.
27. Застосування за п. 26, де біологічний зразок являє собою біоптат лімфовузла, біоптат кісткового мозку або зразок пухлинних клітин периферичної крові.
28. Застосування за п. 19, де характеристика фенотипу неходжкінської лімфоми пацієнта як активованого В-клітинного підтипу включає вимірювання одного або декількох з наступних показників:
(і) надекспресія SPIB, специфічного для гематопоезу сімейства факторів транскрипції Ets, необхідних для виживання клітин активованого В-клітинного підтипу;
(іі) вища конститутивна експресія IRF4/MUM1, ніж в клітинах підтипу GCB;
(ііі) вища конститутивна експресія FOXP1, стимульована трисомією 3;
(iv) вища конститутивна експресія Blimp1, тобто PRDM1;
(v) вища конститутивна експресія гена CARD11; і
(vi) підвищений рівень активності NF-κВ відносно клітин DLBCL не активованого В-клітинного підтипу.
29. Застосування за будь-яким з пп. 1-28, де сполука являє собою гідрохлорид 3-(5-аміно-2-метил-4-оксо-4Н-хіназолін-3-іл)-піперидин-2,6-діону або його сіль, сольват або гідрат.
30. Застосування за будь-яким з пп. 1-29, що додатково включає введення терапевтично ефективної кількості одного або декількох додаткових активних засобів.
31. Застосування за п. 30, де додатковий активний засіб вибраний із групи, яка складається з алкілуючого агента, аналога аденозину, глюкокортикоїду, інгібітору кінази, інгібітору SYK, інгібітору PDE3, інгібітору PDE7, доксорубіцину, хлорамбуцилу, вінкристину, бендамустину, форсколіну й ритуксимабу.
32. Застосування за будь-яким з пп. 1-31, де 3-(5-аміно-2-метил-4-оксо-4Н-хіназолін-3-іл)піперидин-2,6-діон або його фармацевтично прийнятна сіль, сольват або гідрат призначені для введення в кількості від приблизно 0,5 до приблизно 50 мг на день або від приблизно 0,5 до приблизно 5 мг на день, або приблизно 0,5, 1, 2, 4, 5, 10, 15, 20, 25 або 50 мг на день.
33. Застосування за п. 32, де сполука призначена для перорального введення в капсулі або таблетці.
34. Застосування за будь-яким з пп. 1-33, де дифузна великоклітинна В-клітинна лімфома є рецидивуючою, рефракторною або стійкою до звичайного лікування.
35. Застосування за будь-яким з пп. 1-34, де сполука вводиться протягом 21 дня з наступною семиденною перервою в 28-денному циклі.
Текст
Реферат: Винахід стосується застосування 3-(5-аміно-2-метил-4-оксо-4Н-хіназолін-3-іл)піперидин-2,6діону або його енантіомеру, або суміші його енантіомерів, або його фармацевтично прийнятної солі, сольвату, гідрату, співкристалу, клатрату або поліморфу для виготовлення лікарського засобу для лікування або ведення пацієнта, що страждає на рак, у т.ч. неходжкінську лімфому. UA 110964 C2 (12) UA 110964 C2 UA 110964 C2 5 10 15 20 25 30 35 40 45 50 55 60 Дана заявка заявляє пріоритет попередньої заявки на патент США № 61/451,995, поданої 11 березня 2011 року, і попередньої заявки на патент США № 61/480,272, поданої 28 квітня 2011 року, повні змісти яких включені в даний опис шляхом посилання. 1. Галузь, до якої належить винахід Даний винахід стосується способів лікування, попередження і/або ведення пацієнтів, які страждають на різні форми раку, які включають уведення пацієнту 3-(5-аміно-2-метил-4-оксо4H-хіназолін-3-іл)піперидин-2,6-діону або його енантіомеру або суміші його енантіомерів або його фармацевтично прийнятної солі, сольвату, гідрату, співкристалу, клатрату або поліморфу. 2. Передумови винаходу 2.1 Патобіологія раку Рак характеризується в першу чергу збільшенням кількості патологічних клітин, які походять з даної нормальної тканини, інвазією цих патологічних клітин у прилягаючі тканини або поширенням злоякісних клітин по лімфатичній або кровоносній системі в регіональні лімфовузли й у віддалені ділянки (метастазуванням). Клінічні дані й молекулярно-біологічні дослідження вказують на те, що рак являє собою багатоетапний процес, який починається невеликими пренеопластичними змінами, які можуть у певних умовах прогресувати в неоплазію. Неопластичне ураження може виникати клонально й розвивати зростаючу здатність до інвазії, росту, метастазування й гетерогенності, зокрема, в умовах, при яких неопластичні клітини уникають імунного контролю з боку організму хазяїна. Див. Roitt, I., Brostoff J and Kale, D., Immunology, 17.1-17.12 (3rd ed., Mosby, St. Louis, Mo., 1993). Існує величезна різноманітність форм раку, які докладно описані в медичній літературі. Приклади включають рак легенів, ободової кишки, прямої кишки, передміхурової залози, молочної залози, мозку й кишечнику. Захворюваність раком продовжує зростати, оскільки загальна популяція старіє, оскільки розвиваються нові форми раку й оскільки ростуть сприйнятливі популяції (наприклад, людей, інфікованих ВІЛ, або підданих надлишковому впливу сонячного випромінювання). Тому існує величезна потреба в нових способах і композиціях, які можуть застосовуватися для лікування пацієнтів, що страждають на рак. Багато типів раку пов'язані з утворенням нових судин, процесом, відомим як ангіогенез. Були з'ясовано декілька механізмів, задіяних в ангіогенезі, викликаному пухлинами. Найбільш безпосереднім із цих механізмів є секреція пухлинними клітинами цитокінів з ангіогенними властивостями. Приклади цих цитокінів включають кислотний і основний фактор росту фібробластів (a, b-FGF), ангіогенін, судинний ендотеліальний фактор росту (VEGF) і TNF-α (фактор некрозу пухлин-альфа). Альтернативно, пухлинні клітини можуть вивільняти ангіогенні пептиди за допомогою продукції протеаз і наступного руйнування позаклітинної матриці, де накопичуються деякі цитокіни (наприклад, b-FGF). Ангіогенез може бути викликаний також опосередковано за рахунок залучення запальних клітин (зокрема, макрофагів) і наступного вивільнення з них ангіогенних цитокінів (наприклад, TNF-α, b-FGF). Лімфома стосується форм раку, які розвиваються в лімфатичній системі. Лімфома характеризується злоякісними новоутвореннями з лімфоцитів — B лімфоцитів і T лімфоцитів (тобто, B-клітин і T-клітин). Лімфома в цілому починається в лімфовузлах або скупченнях лімфатичної тканини в органах, включаючи без обмеження шлунок або кишечник. Лімфома може залучати кістковий мозок і в деяких випадках кров. Лімфома може поширюватися з однієї ділянки на інші частини тіла. Лікування різних форм лімфом описане, наприклад, у патенті США № 7468363, повний зміст якого включений в дану заявку шляхом посилання. Такі лімфоми включають без обмеження лімфому Ходжкіна, неходжкінську лімфому, шкірну B-клітинну лімфому, активовану B-клітинну лімфому, дифузну великоклітинну B-клітинну лімфому (DLBCL), мантійноклітинну лімфому (MCL), фолікулярну лімфому (лімфому із клітин фолікулярного центру), трансформовану лімфому, лімфоцитарну лімфому проміжної диференціації, проміжну лімфоцитарну лімфому (ILL), дифузну низькодиференційовану лімфоцитарну лімфому (PDL), центроцитарну лімфому, дифузну лімфому з малих розщеплених клітин (DSCCL), периферичні T-клітинні лімфоми (PTCL), шкірну T-клітинну лімфому й лімфому зони мантії й низькодиференційовану фолікулярну лімфому. Неходжкінська лімфома (NHL) є п'ятою по частоті формою раку й у чоловіків, і в жінок у США, причому, по оцінках, в 2007 році було зареєстровано 63190 нових випадків захворювання й 18660 випадків смерті. Див. Jemal A, et al., CA Cancer J Clin 2007; 57(1):43-66. Імовірність розвитку NHL збільшується з віком, і захворюваність NHL у літніх осіб неухильно зростала за останнє десятиліття, викликаючи заклопотаність у зв'язку із трендом старіння населення США. Див. Id. Clarke C A, et al. Cancer 2002; 94(7):2015-2023. Дифузна великоклітинна B-клітинна лімфома (DLBCL) становить приблизно одну третину 1 UA 110964 C2 5 10 15 20 25 30 35 40 45 50 55 60 неходжкінських лімфом. Хоча деякі пацієнти з DLBCL виліковуються традиційною хіміотерапією, інші вмирають від цього захворювання. Протиракові лікарські засоби викликають швидку й стійку деплецію лімфоцитів, можливо, прямою індукцією апоптозу в зрілих T- і B-клітин. Див. K. Stahnke. et al, Blood 2001, 98:3066-3073. Було показано, що абсолютна кількість лімфоцитів (ALC) є прогностичним чинником при фолікулярній неходжкінській лімфомі, і нещодавно отримані результати свідчили про те, що ALC при діагностиці є важливим прогностичним фактором при дифузній великоклітинній B-клітинній лімфомі. Див. D. Kim et al, Journal of Clinical Oncology, 2007 ASCO Annual Meeting Proceedings Part I. Vol 25, No. 18S (June 20 Supplement), 2007: 8082. Лейкоз стосується злоякісних новоутворень кровотворних тканин. Різні форми лейкозів описані, наприклад, у патенті США № 7393862 і в попередній заявці на патент США № 60/380,842, поданій 17 травня 2002 року, повні змісти яких включені в даний опис шляхом посилання. Хоча за повідомленнями віруси викликають декілька форм лейкозу у тварин, th причини лейкозу в людей у значній мірі невідомі. Див. посібник The Merck Manual, 944-952 (17 ed. 1999). Злоякісна трансформація звичайно відбувається в одиночній клітині за допомогою двох або більше стадій з наступною проліферацією й клональним поширенням. При деяких лейкозах були ідентифіковані специфічні хромосомні транслокації з відповідною морфологією лейкозних клітин і особливими клінічними ознаками (наприклад, транслокаціями 9 і 22 при хронічному мієлоцитарному лейкозі, і 15 і 17 при гострому промієлоцитарному лейкозі). Гострі лейкози являють собою переважно недиференційовані клітинні популяції, а хронічні лейкози більш зрілі клітинні форми. Гострі лейкози діляться на лімфобластичний (ALL) і не лімфобластичний (ANLL) типи. Див. th посібник The Merck Manual, 946-949 (17 ed. 1999). Вони можуть додатково підрозділятися по їхньому морфологічному й цитохімічному виду відповідно до Франко-Американо-Британської (FAB) класифікації або відповідно до їхнього типу й ступеня диференціації. Найбільше класифікації допомагає використання антигенфспецифічних B- і T-клітин і моноклональних антитіл до мієлоїдного антигену. ALL являє собою переважно захворювання дитячого віку, яке діагностується лабораторними даними й дослідженням кісткового мозку. ANLL, також відомий як гострий мієлогенний лейкоз або гострий мієлобластичний лейкоз (AML), виникає в людей будь-якого віку і являє собою гострий лейкоз серед дорослих, що найчастіше зустрічається: він являє собою форму, звичайно пов'язану з опроміненням як етіологічним фактором. Хронічні лейкози описані як такі, що є лімфоцитарними (CLL) або мієлоцитарними (CML). th Див. посібник The Merck Manual, 949-952 (17 ed. 1999). CLL характеризується появою зрілих лімфоцитів у крові, кістковому мозку й лімфоїдних органах. Відмітною ознакою CLL є стійкий абсолютний лімфоцитоз (>5000/мкл) і збільшення кількості лімфоцитів у кістковому мозку. У більшості пацієнтів з CLL також є клональне поширення лімфоцитів з B-клітинними характеристиками. CLL являє собою захворювання середнього або літнього віку. При CML характерною ознакою є перевага гранулоцитарних клітин усіх стадій диференціації в крові, кістковому мозку, печінці, селезінці й інших органах. У пацієнта з наявністю симптомів при діагностиці загальна кількість лейкоцитів (WBC) звичайно становить приблизно 200000/мкл, але може досягати 1000000/мкл. CML відносно легко діагностувати через присутність філадельфійської хромосоми. На додаток до категорій гострих і хронічних, новоутворення також класифікуються на основі розділення клітин, що викликають такі розлади, на попередники або периферичні. Див., наприклад, опубліковану заявку на патент США № 2008/0051379, опис якої повністю включений в дану заявку шляхом посилання. Новоутворення із клітин-попередників включають ALL і лімфобластичні лімфоми, і вони виникають у лімфоцитах перед тем як вони диференціювалися в T- або B-клітини. Новоутворення з периферичних клітин являють собою ті, які виникають у лімфоцитах, що диференціювалися або в T-, або в B-клітини. Такі периферичні новоутворення включають без обмеження B-клітинний CLL, B-клітинний пролімфоцитарний лейкоз, лімфоплазмацитарну лімфому, мантійноклітинну лімфому, фолікулярну лімфому, позавузлову B-клітинну лімфому маргінальної зони лімфоїдної тканини, зв'язаної зі слизовими оболонками, вузлову лімфому маргінальної зони, селезінкову лімфому маргінальної зони, волосатоклітинний лейкоз, плазмацитому, дифузну великоклітинну B-клітинну лімфому й лімфому Беркітта. Більше ніж в 95 % випадків CLL відбувається клональне поширення B-клітинної лінії диференціації. Див. Cancer: Principles & Practice of Oncology (3rd Edition) (1989) (pp. 1843-1847). Менше ніж в 5 % випадків CLL пухлинні клітини мають T-клітинний фенотип. Однак незважаючи на ці класифікації, патологічне порушення нормального гематопоезу є відмітною ознакою всіх лейкозів. Множинна мієлома (MM) являє собою злоякісне захворювання, що розвивається в 2 UA 110964 C2 5 10 15 20 25 30 35 40 45 50 55 60 кістковому мозку й характеризується надлишковою кількістю плазматичних клітин. У нормі, плазматичні клітини продукують антитіла й відіграють ключову роль в імунній функції. Однак неконтрольований ріст цих клітин веде до виникнення болю в кістках і їх переломів, анемії, інфекції й інших ускладнень. Множинна мієлома є другим по частоті гематологічним злоякісним захворюванням, хоча точні причини множинної мієломи залишаються невідомими. Множинна мієлома викликає високі рівні білків у крові, сечі й органах, включаючи без обмеження M-білок і інші імуноглобуліни (антитіла), альбумін і бета-2- мікроглобулін. M-білок, короткий для моноклонального білка, також відомий як парапротеїн, являє собою, зокрема, патологічний білок, який продукується мієломними плазматичними клітинами, і може бути виявлений у крові або в сечі майже всіх пацієнтів із множинною мієломою. Симптоми з боку кісток скелета, включаючи біль у кістках, є одними з найбільш клінічно значущих симптомів множинної мієломи. Злоякісні плазматичні клітини вивільняють фактори, що стимулюють остеокласти (включаючи IL-1, IL-6 і TNF), які викликають вимивання кальцію з кісток, обумовлюючи літичні ураження; іншим симптомом є гіперкальцемія. Фактори, що стимулюють остеокласти, які також називаються цитокінами, можуть відвернути апоптоз або загибель мієломних клітин. В 50 % пацієнтів при діагностиці є рентгенологічно виявлюваними пов'язані з мієломою ураження кісток скелета. Інші звичайні клінічні симптоми множинної мієломи включають полінейропатію, анемію, підвищену в'язкість крові, інфекції й ниркову недостатність. Солідні пухлини являють собою патологічні об'ємні утворення із тканини, які можуть містити, але звичайно не містять кісти або області скупчення рідини. Солідні пухлини можуть бути доброякісними (не раковими) або злоякісними (раковими). Різні типи солідних пухлин називаються по типу клітин, які їх утворюють. Приклади типів солідних пухлин включають без обмеження злоякісну меланому, карциному надниркової залози, карциному молочної залози, нирково-клітинний рак, карциному підшлункової залози, недрібноклітинну карциному легенів (NSCLC) і карциному невідомої первинної локалізації. Лікарські засоби, що звичайно вводяться пацієнтам з різними типами або стадіями солідних пухлин, включають без обмеження целебрекс, етопозид, циклофосфамід, доцетаксел, апецитабін, IFN (інтерферон), тамоксифен, IL-2 (інтерлейкін-2), GM-CSF (фактор, який стимулює колонії гранулоцитів-макрофагів) або їх комбінацію. Хоча в пацієнтів, які досягають повної ремісії після первинної терапії, є достатня ймовірність лікування, менше ніж 10 % пацієнтів, у яких первинна терапія неефективна, або в яких відзначається рецидив захворювання, досягають лікування або ефективності терапії, що триває довше ніж 3 роки. Див. Cerny T, el al., Ann Oncol 2002; 13 Suppl 4:211-216. Відомо, що ритуксимаб викликає делецію нормальних B-клітин в організмі. Див. M. Aklilu et al., Annals of Oncology 15:1109-1114, 2004. Віддалені імунологічні делеції B-клітин під дією ритуксимабу й характеристики відновлення пулу B-клітин у пацієнтів з лімфомою недостатньо визначені, незважаючи на широко поширене використання цієї терапії. Див. Jennifer H. Anolik et al., Clinical Immunology, vol. 122, issue 2, February 2007, pages 139-145. Підхід до лікування пацієнтів з рецидивуючим або рефракторним захворюванням у значній мірі оснований на експериментальних способах лікування з наступною трансплантацією стовбурових клітин, що може не бути доцільним для пацієнтів з несприятливим функціональним статусом або літнім віком. Тому, існує величезна потреба в нових способах, які можна застосовувати для лікування пацієнтів з NHL. Зв'язок між раком і зміненим клітинним метаболізмом був достатньо встановлений. Див. Cairns. R.A., et al. Nature Rev., 2011, 11:85-95. Розуміння метаболізму пухлинних клітин і їх зв'язаних генетичних змін може привести до ідентифікації вдосконалених способів лікування раку. Див. те ж посилання. Наприклад, виживання й проліферацію пухлинних клітин за допомогою підвищеного метаболізму глюкози зв'язували із сигнальним шляхом PIK3 (фосфатидилінозит-3-кінази), у результаті чого, мутації в пухлинних генах-супресорах пухлинного росту, таких як PTEN, активують метаболізм пухлинних клітин. Див. те ж посилання. AKT1 (також відомий як PKB (протеїнкіназа B)) стимулює метаболізм глюкози, пов'язаний з ростом пухлинних клітин, різними взаємодіями з генами PFKFB3, ENTPD5, mTOR і TSC2 (також відомі як туберин). Див. те ж посилання. Фактори транскрипції HIF1 і HIF2 у значній мірі відповідальні за клітинну реакцію на стани низького вмісту кисню, часто пов'язані з пухлинами. Див. те ж посилання. Після активації, HIF1 стимулює здатність пухлинних клітин здійснювати гліколіз. Див. те ж посилання. Таким чином, інгібування HIF1 може сповільнити або викликати зворотний розвиток метаболізму пухлинних клітин. Активація HIF1 зв'язувалася з PI3K, білками-супресорами пухлин, такими як VHL (ген фон Гіппеля-Ландау), сукцинатдегідрогеназою (SDH) і фумаратгідратазою. Див. те ж посилання. 3 UA 110964 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фактор онкогенної транскрипції MYC також зв'язувався з метаболізмом пухлинних клітин, зокрема, із гліколізом. Див. те ж посилання. MYC також стимулює клітинну проліферацію метаболічними шляхами глутаміну. Див. те ж посилання. АМФ-активована протеїнкіназа (AMPK) функціонує як метаболічний контрольний пункт, який пухлинні клітини повинні подолати для проліферації. Див. те ж посилання. Були ідентифіковано декілька мутацій, які пригнічують передачу сигналів AMPK у пухлинних клітинах. Див. Shackelford, D.B. & Shaw, R.J., Nature Rev. Cancer, 2009, 9:563-575. STK11 (серин/треонінкіназа 11) була ідентифікована як гена-супресора пухлинного росту, пов'язаного з роллю AMPK. Див. Cairns, R.A., et at. Nature Rev., 2011, 11:85-95. Фактор транскрипції p53, супресор пухлинного росту, також відіграє важливу роль у регуляції клітинного метаболізму. Див. те ж посилання. Втрата p53 у пухлинних клітинах може являти собою істотний фактор, який бере участь у змінах метаболізму пухлинних клітин на гліколітичний шлях. Див. те ж посилання. Фактор транскрипції OCT1, ще одна потенційна мішень для хіміотерапевтичних засобів, може кооперуватися з p53 у регуляції метаболізму пухлинних клітин. Див. те ж посилання. Піруваткіназа M2 (PKM2) стимулює зміни клітинного метаболізму, які надають раковим клітинам метаболічні переваги, підтримуючи клітинну проліферацію. Див. те ж посилання. Наприклад, було виявлено, що клітини раку легенів, які більше експресують PKM2, ніж PKM1, мають таку перевагу. Див. те ж посилання. У клінічних умовах, PKM2 була ідентифікована як надекспресована при ряді типів раку. Див. те ж посилання. Таким чином, PKM2 може бути корисним біомаркером для раннього виявлення пухлин. Мутації в ізоцитратдегідрогеназах IDH1 і IDH2 зв'язували з онкогенезом, зокрема, при гліобластомі й гострому мієлоїдному лейкозі. Див. Mardis, E.R. et al., N. Engl. J. Med, 2009, 361: 1058-1066; Parsons, D.W. et al, Science, 2008, 321: 1807-1812. Захворюваність раком продовжує зростати, оскільки загальна популяція старіє, оскільки виникають нові випадки раку й оскільки росте сприйнятлива популяція (наприклад, людей, інфікованих ВІЛ, літніх осіб або осіб, підданих надлишковому впливу сонячного випромінювання). Тому існує величезна потреба в нових способах, видах лікування й композиціях, які можуть застосовуватися для лікування пацієнтів, які страждають на рак, включаючи без обмеження пацієнтів з лімфомою, NHL, множинною мієломою, AML, лейкозами й солідними пухлинами. Відповідно, сполуки, які можуть стримувати і/або інгібувати небажаний ангіогенез, або інгібувати продукцію певних цитокінів, включаючи TNF-α, можуть застосовуватися при лікуванні й профілактиці різних форм раку. 2.2 Способи лікування раку Сучасне лікування раку може включати хірургічне втручання, хіміотерапію, гормональну терапію і/або променеву терапію для знищення пухлинних клітин у пацієнта (див., наприклад, Stockdale, 1998, Medicine, vol. 3, Rubenstein and Federman, eds. Chapter 12, Section IV). Останнім часом, лікування раку могло також включати біологічну терапію або імунотерапію. Усі ці підходи можуть мати істотні недоліки для пацієнта. Хірургічне втручання може бути, наприклад, протипоказане внаслідок стану здоров'я пацієнта або може бути неприйнятно для пацієнта. Крім того, при операції може бути зроблене неповне видалення пухлинної тканини. Променева терапія ефективна тільки коли пухлинна тканина проявляє більш високу чутливість до опромінення, ніж здоровіша тканина. Променева терапія може також часто викликати тяжкі побічні ефекти. Гормональна терапія рідко призначається у вигляді окремого засобу. Хоча гормональна терапія може бути ефективною, її часто застосовують для запобігання або затримки рецидиву раку після того як більшість ракових клітин була вилучена із застосуванням інших видів лікування. Певні види біологічного й інших типів лікування обмежені по кількості й можуть викликати побічні ефекти, такі як висип або набряки, подібні до грипу симптоми, включаючи лихоманку, озноб і утома, проблеми зі шлунково-кишковим трактом або алергійні реакції. Що стосується хіміотерапії, то існують різноманітні хіміотерапевтичні засоби, доступні для лікування раку. Ряд хіміотерапевтичних засобів діють шляхом інгібування синтезу ДНК або безпосередньо, або опосередковано шляхом інгібування біосинтезу попередників дезоксирибонуклеотид-трифосфату, для запобігання реплікації ДНК і супутнього клітинного розподілу. Див. Gilman et al, Goodman and Gilman's: The Pharmacological Basis of Therapeutics, Tenth Ed. (Mcgraw Hill, New York). Незважаючи на доступність різноманітних хіміотерапевтичних засобів, хіміотерапія має багато недоліків. Див. Stockdale, Medicine, vol. 3, Rubenstein and Federman, eds., ch. 12, sect. 10, 1998. Майже всі хіміотерапевтичні засоби токсичні, і хіміотерапія викликає істотні й часто 4 UA 110964 C2 5 10 15 20 25 30 35 40 45 50 55 небезпечні побічні ефекти, включаючи тяжку нудоту, придушення кісткового мозку й імуносупресію. Крім того, навіть при введенні комбінацій хіміотерапевтичних засобів, багато пухлинних клітин стійкі або в них розвивається стійкість до хіміотерапевтичних засобів. Дійсно, ті клітини, які стійкі до певних хіміотерапевтичних засобів, застосовуваних у протоколі лікування, часто виявляються стійкими до інших лікарських засобів, навіть якщо ці засоби діють механізмом, відмінним від тих лікарських засобів, які застосовуються при певному лікуванні. Цей феномен називається стійкістю до множини лікарських засобів. Через стійкість до лікарських засобів, багато форм раку виявляються стійкими до стандартних протоколів хіміотерапевтичного лікування. Існує значна потреба в безпечних і ефективних способах лікування, попередження й ведення пацієнтів, які страждають на рак, зокрема, форми раку, які стійкі до стандартних способів лікування, таких як хірургічне лікування, променева терапія, хіміотерапія й гормональна терапія, у той же час зменшуючи або виключаючи токсичні впливи і/або побічні ефекти, пов'язані зі звичайними способами лікування. 2.3 Цереблон Білок Цереблон (CRBN) являє собою білок, який складається з 442 амінокислот, еволюційно консервативний від рослини до людини. У людей ген CRBN був ідентифікований як ген«кандидат", можливо, відповідальний за розвиток аутосомальної рецесивної несиндромної затримки психічного розвитку (ARNSMR). Див. Higgins, J J. et al., Neurology, 2004, 63:1927-1931. CRBN спочатку характеризувався як новий білок, що містить RGS (регулятор передачі сигналів через G-білки), який взаємодіяв з активованим кальцієм білком калієвих каналів (SLO1) у мозку щурів, і пізніше було показано, що він взаємодіє з потенціалозалежним хлоридним каналом (CIC-2) у сітківці з AMPK7 і білком DDB1. Див. Jo, S. et al., J. Neurochem, 2005, 94: 1212-1224; Hohberger B. et al., FEBS Lett, 2009, 583:633-637; Angers S. et al., Nature, 2006, 443:590-593. DDB1 був спочатку ідентифікований як білок ексцизійної репарації нуклеотидів, який асоційований зі зв'язуючим ушкоджену ДНК білком 2 (DDB2). Його дефектна активність викликає дефект репарації в пацієнтів з пігментною ксеродермією групи комплементації E (XPE). Представляється також, що DDB1 функціонує як компонент численних окремих комплексів убіквітину-протеїнлігази DCX (DDB1-CUL4-X-box) E3, які опосередковують убіквітинування й наступне протеосомальне розщеплення білків-мішеней. CRBN також був ідентифікований як мішень для розробки терапевтичних засобів із приводу захворювань кори головного мозку. Див. опубліковану заявку на Міжнародний патент WO 2010/137547 A1. Нещодавно цереблон був ідентифікований як ключова молекулярна мішень, яка зв'язується з талідомідом, викликаючи вроджені вади розвитку. Див. Ito, T. et al., Science, 2010, 327: 13451350. Було виявлено, що DDB1 взаємодіє з CRBN і, таким чином, був побічно пов'язаний з талідомідом. Крім того, талідомід був здатний інгібувати авто-убіквітинацію CRBN in vitro, свідчачи про те, що талідомід є інгібітором убіквітинлігази E3. Важливо, що ця активність інгібувалася талідомідом у клітинах дикого типу, але не в клітинах з ділянками зв'язування мутованого CRBN, які запобігають зв'язуванню талідоміду. Ділянка зв'язування талідоміду був картований у високо консервативну C-кінцеву область, яка складається з 104 амінокислот, в CRBN. Обидві окремі точкові мутації в CRBN, Y384A і W386A були дефектними по зв'язуванню талідоміду, причому подвійний точковий мутант має найнижчу активність зв'язування талідоміду. Зв'язок між CRBN і тератогенним ефектом талідоміду була підтверджена в експериментальних моделях у смугастого даніо й на курячих ембріонах. Розпізнавання мішеней талідоміду й інших лікарських засобів дозволить визначити молекулярні механізми ефективності і/або токсичності й може привести до одержання лікарських засобів з поліпшеними профілями ефективності й токсичності. 3. Короткий виклад суті винаходу Даний винахід стосується способів лікування й попередження раку, включаючи первинний і метастатичний рак, а також рак, який є рефракторним або стійким до звичайної хіміотерапії, причому способи включають уведення потребуючому такого лікування або профілактики пацієнту терапевтично або профілактично ефективної кількості 3-(5-аміно-2-метил-4-оксо-4Hхіназолін-3-іл)піперидин-2,6-діону, що має структурну формулу I: або його енантіомеру або суміші його енантіомерів, або його фармацевтично прийнятної 5 UA 110964 C2 5 10 15 20 25 30 35 40 45 50 55 60 солі, сольвату, гідрату, співкристалу, клатрату або поліморфу як окремого засобу або як частини комбінованого лікування. Даний винахід також стосується способів ведення пацієнтів, які страждають на рак (наприклад, запобігання його рецидиву або подовження часу ремісії), які включають уведення пацієнту, який потребує такого введення, терапевтично або профілактично ефективної кількості 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діону або його енантіомеру або суміші його енантіомерів, або його фармацевтично прийнятної солі, сольвату, гідрату, співкристалу, клатрату або поліморфу. Крім того, даний винахід також стосується способів лікування, попередження або ведення пацієнтів, які страждають на рак, що включають уведення пацієнту, який потребує такого лікування, профілактики або ведення, терапевтично або профілактично ефективної кількості 3(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діону або його енантіомеру або суміші його енантіомерів, або його фармацевтично прийнятної солі, сольвату, гідрату, співкристалу, клатрату або поліморфу в комбінації з лікуванням, звичайно застосовуваним для лікування, попередження або ведення пацієнтів, які страждають на рак. Приклади таких звичайних способів лікування включають без обмеження хірургічне лікування, хіміотерапію, променеву терапію, гормональну терапію, біологічну терапію й імунотерапію. Даний винахід стосується способів лікування, попередження або ведення пацієнтів, які страждають на рак, що включають уведення пацієнту, який потребує такого лікування, профілактики або ведення, терапевтично або профілактично ефективної кількості 3-(5-аміно-2метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діону або його енантіомеру або суміші його енантіомерів, або його фармацевтично прийнятної солі, сольвату, гідрату, співкристалу, клатрату або поліморфу, у кількості, яка достатня для забезпечення концентрації сполуки в плазмі в стаціонарному стані від приблизно 0,001 до приблизно 100 мкМ. В іншому варіанті здійснення, кількість достатня для забезпечення максимальної концентрації сполуки в плазмі в стаціонарному стані від приблизно 0,001 до приблизно 100 мкМ. В іншому варіанті здійснення, кількість достатня для забезпечення концентрації сполуки в плазмі безпосередньо перед уведенням її чергової дози в стаціонарному стані від приблизно 0,01 до приблизно 100 мкМ. В іншому варіанті здійснення, кількість достатня для забезпечення площі під кривою (AUC) концентрації сполуки в плазмі в діапазоні від приблизно 100 до приблизно 100000 нг*год./мл. У певних варіантах здійснення, винахід стосується способів лікування або ведення пацієнтів, які страждають на лімфому, множинну мієлому, лейкоз і солідні пухлини. У деяких варіантах здійснення, лімфома вибрана із групи, яка складається з лімфоми Ходжкіна, неходжкінської лімфоми, лімфом, позв'язаних зі СНІДом, анапластичної великоклітинної лімфоми, ангіоімунобластної лімфоми, бластної NK-клітинної лімфоми, лімфоми Беркітта, лімфоми, подібної до лімфоми Беркітта, лімфоми із дрібних не розщеплених клітин, дрібноклітинної лімфоцитарної лімфоми, шкірної T-клітинної лімфоми, дифузної великоклітинної B-клітинної лімфоми, T-клітинної лімфоми ентеропатичного типу, лімфобластичної лімфоми, мантійноклітинної лімфоми, лімфоми маргінальної зони, назальної T-клітинної лімфоми, дитячої лімфоми, периферичних T-клітинних лімфом, первинної лімфоми центральної нервової системи, трансформованих лімфом, пов'язаних з лікуванням T-клітинних лімфом і макроглобулінемії Вальденстрема. У деяких варіантах здійснення, лейкоз вибраний із групи, яка складається з гострого мієлоїдного лейкозу (AML), T-клітинного лейкозу, хронічного мієлоїдного лейкозу (CML), хронічного лімфоцитарного лейкозу (CLL) і гострого лімфобластичного лейкозу (ALL). У деяких варіантах здійснення, солідна пухлина вибрана із групи, яка складається з меланоми, пухлин голови й шиї, карциноми молочної залози, недрібноклітинної карциноми легенів, карциноми яєчників, карциноми підшлункової залози, карциноми передміхурової залози, колоректальної карциноми й гепатоцелюлярної карциноми. У деяких варіантах здійснення, винахід стосується способів лікування або ведення пацієнтів, які страждають на неходжкінські лімфоми, включаючи без обмеження дифузну великоклітинну B-клітинну лімфому (DLBCL), з використанням прогностичних факторів. У деяких варіантах здійснення, винахід стосується способів застосування генних і білкових біомаркерів як прогностичного показника клінічної чутливості до лімфоми, неходжкінської лімфоми, множинної мієломи, лейкозу, AML і/або солідних пухлин і ефективності лікування пацієнта 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)-піперидин-2,6-діоном або його енантіомером або сумішшю його енантіомерів або його фармацевтично прийнятною сіллю, сольватом, гідратом, співкристалом, клатратом або поліморфом. Способи за даним винаходом включають способи скринінгу або ідентифікації пацієнтів, які страждають на рак, наприклад, лімфому, неходжкінську лімфому, множинну мієлому, лейкоз, 6 UA 110964 C2 5 10 15 20 25 30 35 40 45 50 55 60 AML і пацієнтів із солідними пухлинами, для лікування 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3іл)-піперидин-2,6-діоном або його енантіомером або сумішшю його енантіомерів або його фармацевтично прийнятною сіллю, сольватом, гідратом, співкристалом, клатратом або поліморфом. Зокрема, даний винахід стосується способів відбору пацієнтів, що мають більш високу частоту ефективності лікування 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин2,6-діоном. В одному варіанті здійснення, даний винахід стосується способу прогнозування ефективності лікування пухлини в пацієнта з лімфомою, неходжкінською лімфомою, множинною мієломою, лейкозом, AML або солідною пухлиною, причому спосіб включає одержання в пацієнта пухлинної тканини, очищення білка або РНК із пухлини й визначення присутності або відсутності біомаркера, наприклад, аналізом експресії білка або гена. Експресія, моніторинг якої здійснюється, може являти собою, наприклад, експресію мРНК або експресію білка. У певних варіантах здійснення, біомаркер являє собою ген, пов'язаний з активованим Bклітинним фенотипом DLBCL. Гени вибираються із групи, яка складається з IRF4/MUM1, FOXP1, SPIB, CARD11 і BLIMP/PDRM1. В одному варіанті здійснення, біомаркер являє собою NF-κB (ядерний фактор "каппа бі"). В одному варіанті здійснення, мРНК або білок очищають із пухлини, і присутність або відсутність біомаркера визначають аналізом експресії генів або білків. У певних варіантах здійснення, присутність або відсутність біомаркера визначають кількісною ПЛР у реальному часі (PCR (QRT-PCR)), мікрочипом, протоковою цитометрією або імунофлуоресценцією. В інших варіантах здійснення, присутність або відсутність біомаркера визначають методологіями на основі ферментного імуносорбентного аналізу (ELISA) або іншими подібними способами, відомими в даній галузі. В іншому варіанті здійснення, винахід стосується способу прогнозування ефективності лікування пухлини в пацієнта з неходжкінською лімфомою, причому спосіб включає одержання пухлинних клітин у пацієнта, культивування клітин у присутності або під час відсутності 3-(5аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діону, очищення білка або РНК із культивованих клітин і вимірювання присутності або відсутності біомаркера, наприклад, аналіз експресії білків або генів. Експресія, моніторинг якої здійснюється, може являти собою, наприклад, експресію мРНК або експресію білка. В іншому варіанті здійснення, винахід стосується способу моніторингу ефективності лікування пухлини 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діоном у пацієнта з лімфомою, неходжкінською лімфомою, множинною мієломою, лейкозом, AML або солідною пухлиною. Спосіб включає одержання біологічного зразка в пацієнта, вимірювання експресії біомаркера в біологічному зразку, уведення пацієнту 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3іл)піперидин-2,6-діону, після чого одержання другого біологічного зразка в пацієнта, вимірювання експресії біомаркера в другому біологічному зразку й порівняння рівнів експресії, причому збільшення рівня експресії біомаркера після лікування вказує на ймовірність ефективності лікування пухлини. В одному варіанті здійснення, знижений рівень експресії біомаркера після лікування вказує на ймовірність ефективності лікування пухлини. Експресія, моніторинг якої здійснюється, може являти собою, наприклад, експресію мРНК або експресію білка. Експресія в обробленому зразку може збільшуватися, наприклад, приблизно в 1,5, 2,0, 3, 5 або більше разів. У ще одному варіанті здійснення, винахід стосується способу моніторингу дотримання пацієнтом протоколу медикаментозного лікування. Спосіб включає одержання біологічного зразка в пацієнта, вимірювання рівня експресії щонайменше одного біомаркера в зразку й визначення, підвищений або чи знижений рівень експресії, у порівнянні з рівнем експресії в контрольному необробленомому зразку, причому збільшена або зменшена експресія біомаркера вказує на дотримання пацієнтом протоколу медикаментозного лікування. В одному варіанті здійснення, експресія одного або декількох біомаркерів збільшена. Експресія біомаркера, моніторинг якої здійснюється, може являти собою, наприклад, експресію мРНК або експресію білка. Експресія в обробленому зразку може збільшуватися, наприклад, приблизно в 1,5, 2,0, 3, 5 або більше разів. В іншому варіанті здійснення, винахід стосується способу прогнозування чутливості до лікування 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діоном у пацієнта з лімфомою, неходжкінською лімфомою, множинною мієломою, лейкозом, AML або солідною пухлиною. В одному варіанті здійснення, пацієнт являє собою пацієнта з неходжкінською лімфомою, зокрема, пацієнта з DLBCL. Спосіб включає одержання біологічного зразка в пацієнта, необов'язково, виділення або очищення мРНК із біологічного зразка, ампліфікацію транскриптів мРНК, наприклад, RT-PCR, причому більш високий вихідний рівень специфічного 7 UA 110964 C2 5 10 15 20 25 30 35 40 45 50 55 60 біомаркера вказує на більш високу ймовірність того, що дана форма раку буде чутлива до лікування 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)-піперидин-2,6-діоном. У певних варіантах здійснення, біомаркер являє собою ген, пов'язаний з активованим B-клітинним фенотипом. Гени вибрані із групи, яка складається з IRF4/MUM1, FOXP1, SPIB, CARD11 і BLIMP/PDRM1. Винахід також стосується способів лікування або ведення страждаючих на рак пацієнтів застосуванням 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діону з використанням CRBN як прогностичного фактора. У певних варіантах здійснення, винахід стосується способів скринінгу або ідентифікації страждаючих на рак пацієнтів для лікування 3-(5-аміно-2-метил-4оксо-4H-хіназолін-3-іл)піперидин-2,6-діоном з використанням рівнів CRBN як прогностичного фактора. У деяких варіантах здійснення, винахід стосується способів відбору пацієнтів, що мають більш високу частоту ефективності лікування 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3іл)піперидин-2,6-діоном з використанням рівнів CRBN як прогностичного фактора. В одному варіанті здійснення, винахід стосується способу прогнозування ефективності лікування страждаючого раком пацієнта 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин2,6-діоном, причому спосіб включає одержання біологічного матеріалу в пацієнта й визначення присутності або відсутності CRBN. В одному варіанті здійснення, спосіб включає одержання ракових клітин у пацієнта, культивування клітин у присутності або під час відсутності 3-(5-аміно-2-метил-4-оксо-4Hхіназолін-3-іл)піперидин-2,6-діону, очищення білка або РНК із культивованих клітин і визначення присутності або відсутності біомаркера аналізом експресії білка або гена. Експресія, моніторинг якої здійснюється, може являти собою, наприклад, експресію мРНК або експресію білка. В одному варіанті здійснення, рак являє собою лімфому, лейкоз, множинну мієлому, солідну пухлину, неходжкінську лімфому або меланому. В іншому варіанті здійснення, винахід стосується способу моніторингу ефективності медикаментозного лікування пухлини у страждаючого на рак пацієнта. Спосіб включає одержання біологічногозразка в пацієнта, вимірювання експресії біомаркера в біологічному зразку, уведення одного або декількох лікарських засобів пацієнту, потім одержання другого біологічного зразка в пацієнта, вимірювання експресії біомаркера в другому біологічному зразку й порівняння рівнів експресії, причому підвищений рівень експресії біомаркера після лікування вказує на ймовірність ефективності лікування пухлини. В одному варіанті здійснення пацієнт, який страждає на рак, являє собою пацієнта з лімфомою, лейкозом, множинною мієломою, солідною пухлиною, неходжкінською лімфомою або меланомою. В одному варіанті здійснення, знижений рівень експресії біомаркера після лікування вказує на ймовірність ефективності лікування пухлини. Експресія біомаркера, моніторинг якої здійснюється, може являти собою, наприклад, експресію мРНК або експресію білка. Експресія в обробленому зразку може збільшуватися, наприклад, приблизно в 1,5, 2,0, 3, 5 або більше разів. В одному варіанті здійснення, пухлина являє собою лімфому, лейкоз, множинну мієлому, солідну пухлину, неходжкінську лімфому або меланому. В іншому варіанті здійснення, даний винахід стосується способу прогнозування чутливості до медикаментозної терапії в страждаючого на рак пацієнта, зокрема, пацієнта із множинною мієломою або неходжкінською лімфомою. Спосіб включає одержання біологічного зразка в пацієнта, необов'язково, виділення або очищення мРНК із біологічного зразка, ампліфікацію транскриптів мРНК, наприклад, RT-PCR, де більш високий вихідний рівень специфічного біомаркера вказує на більш високу ймовірність того, що злоякісне захворювання буде чутливо до лікування лікарським засобом. У певних варіантах здійснення, біомаркер являє собою ген або білок, пов'язаний із множинною мієломою або неходжкінською лімфомою. В одному варіанті здійснення, гени являють собою те гени, які пов'язані з CRBN, і вибрані із групи, яка складається з DDB1, DDB2, GSK3B, CUL4A, CUL4B, XBP-1, FAS1, RANBP6, DUS3L, PHGDH, AMPK, IRF4 і NFκB. В іншому варіанті здійснення, гени вибрані із групи, яка складається з DDB1, DDB2, IRF4 і NFκB. В одному варіанті здійснення, винахід стосується способу ідентифікації пацієнта, що має лімфому, лейкоз, множинну мієлому, солідну пухлину, неходжкінську лімфому, дифузну великоклітинну B-клітинну лімфому або меланому, чутливу до лікування 3-(5-аміно-2-метил-4оксо-4H-хіназолін-3-іл)піперидин-2,6-діоном; ідентифікації гена або білка, зв'язаного з CRBN, причому присутність гена або білка, зв'язаного з CRBN, указує на наявність лімфоми, лейкозу, множинної мієломи, солідної пухлини, неходжкінської лімфоми, дифузної великоклітинної Bклітинної лімфоми або меланоми, чутливої до лікування 3-(5-аміно-2-метил-4-оксо-4H-хіназолін3-іл)піперидин-2,6-діоном. В одному варіанті здійснення, ген або білок, пов'язаний з CRBN, вибраний із групи, яка складається з DDB1, DDB2, IRF4 і NFκB. В одному варіанті здійснення, ідентифікація пацієнта, що має лімфому, лейкоз, множинну 8 UA 110964 C2 5 10 15 20 25 30 35 40 45 50 55 60 мієлому, солідну пухлину, неходжкінську лімфому або меланому, чутливу до лікування 3-(5аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діоном, включає вимірювання рівня активності CRBN у пацієнта. В іншому варіанті здійснення, вимірювання рівня активності CRBN у пацієнта включає вимірювання DDB1, DDB2, IRF4 і/або NFκB у клітинах, отриманих у пацієнта. В одному варіанті здійснення, винахід стосується способу лікування або ведення пацієнта, який страждає на неходжкінську лімфому, що включає: (i) ідентифікацію пацієнта, який має лімфому, неходжкінську лімфому, множинну мієлому, лейкоз, AML або солідну пухлину, чутливу до лікування 3-(5-аміно-2-метил-4-оксо-4H-хіназолін3-іл)піперидин-2,6-діоном, і (ii) уведення пацієнту терапевтично ефективної кількості 3-(5-аміно-2-метил-4-оксо-4Hхіназолін-3-іл)піперидин-2,6-діону або його фармацевтично прийнятної солі або сольвату (наприклад, гідрату). В одному варіанті здійснення, пацієнт страждає на неходжкінську лімфому. В одному варіанті здійснення, неходжкінська лімфома являє собою дифузну великоклітинну B-клітинну лімфому. В іншому варіанті здійснення, неходжкінська лімфома стосується активованого Bклітинного фенотипу. В одному варіанті здійснення, ідентифікація пацієнта, що має неходжкінську лімфому, чутливу до лікування 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діоном, включає ідентифікацію гена, пов'язаного з активованим B-клітинним фенотипом. В одному варіанті здійснення, ген, пов'язаний з активованим B-клітинним фенотипом, вибраний із групи, яка складається з IRF4/MUM1, FOXP1, SPIB, CARD11 і BLIMP/PDRM1. В одному варіанті здійснення, ідентифікація пацієнта, що має неходжкінську лімфому, чутливу до лікування 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діоном, включає вимірювання рівня активності NF-κΒ у пацієнта. В іншому варіанті здійснення, вимірювання рівня активності NF-κΒ у пацієнта включає вимірювання вихідного рівня активності NF-κB у пухлинних клітинах, отриманих у пацієнта. Винахід також стосується наборів, які використовуються для прогнозування ймовірності ефективного лікування лімфоми, неходжкінської лімфоми, множинної мієломи, лейкозу, AML або солідної пухлини або для моніторингу ефективності лікування 3-(5-аміно-2-метил-4-оксо-4Hхіназолін-3-іл)піперидин-2,6-діоном. Набір включає тверду підкладку й засіб для виявлення експресії білка щонайменше одного біомаркера в біологічному зразку. У такому наборі може використовуватися, наприклад, індикаторна смужка, мембрана, чип, диск, тест-смужка, фільтр, мікросфера, предметне скло, багатоямковий планшет або оптичне волокно. Тверда підкладка набору може являти собою, наприклад, пластик, силікон, метал, смолу, скло, мембрану, частинку, осад, гель, полімер, листок, сферу, полісахарид, капіляр, плівку, пластину або предметне скло. Біологічний зразок може являти собою, наприклад, клітинну культуру, лінію клітин, тканину, тканину ротової порожнини, тканину шлунково-кишкового тракту, орган, органелу, біологічну рідину, зразок крові, зразок сечі або зразок шкіри. Біологічний зразок може являти собою, наприклад, біоптат лімфовузла, біоптат кісткового мозку або зразок пухлинних клітин периферичної крові. У додатковому варіанті здійснення, даний винахід стосується набору, який використовується для прогнозування ймовірності ефективного лікування або моніторингу ефективності лікування 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діоном. Набір включає тверду підкладку, нуклеїнові кислоти, що контактують із підкладкою, причому нуклеїнові кислоти комплементарні щонайменше 20, 50, 100, 200, 350 або більше основам мРНК, і засіб для виявлення експресії мРНК у біологічному зразку. В іншому варіанті здійснення, даний винахід стосується набору, який використовується для прогнозування ефективності лікування або для моніторингу ефективності лікування 3-(5-аміно2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діоном. Набір включає тверду підкладку, щонайменше одну нуклеїнову кислоту, що контактує з підкладкою, причому нуклеїнові кислоти комплементарні щонайменше 20, 50, 100, 200, 350, 500 або більше основам мРНК, і засіб для виявлення експресії мРНК у біологічному зразку. У певних варіантах здійснення, у наборах за даним винаходом використовується засіб для виявлення експресії біомаркера кількісної ПЛР у реальному часі (PCR (QRT-PCR)), мікрочипом, протоковою цитометрією або імунофлуоресценцією. В інших варіантах здійснення, експресія біомаркера вимірюється методологіями на основі ELISA або інших аналогічних способів, відомих у даній галузі. Даний винахід також стосується фармацевтичних композицій, що містять приблизно від 1 до 1000 мг 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діону або його енантіомеру або суміші його енантіомерів або його фармацевтично прийнятної солі, сольвату, гідрату, 9 UA 110964 C2 5 10 15 20 25 30 35 40 45 50 55 60 співкристалу, клатрату або поліморфу. Даний винахід додатково стосується фармацевтичних композицій, що містять приблизно від 1 до 1000 мг 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діону або його енантіомеру або суміші його енантіомерів або його фармацевтично прийнятної солі, сольвату, гідрату, співкристалу, клатрату або поліморфу; і один або декілька додаткових активних інгредієнтів. У певних варіантах здійснення, один або декілька додаткових активних інгредієнтів вибрані з облімерсену, мелфалану, G-CSF (фактора, що стимулює колонії гранулоцитів), GMCSF (фактора, що стимулює колонії гранулоцитівомакрофагів), EPO, інгібітору cox-2 (циклооксигенази-2), топотекану, пентоксифіліну, ципрофлоксацину, таксотере, іритотекану, дексаметазону, доксорубіцину, вінкристину, IL 2, IFN, дакарбазину, Ara-C (арабінофуранозилуцитидину), вінорелбіну й ізотретинону. Даний винахід також стосується наборів, використовуваних для прогнозування ймовірності ефективного лікування лімфоми, лейкозу, множинної мієломи, солідної пухлини, неходжкінської лімфоми, дифузної великоклітинної B-клітинної лімфоми або меланоми або для моніторингу ефективності лікування одним або декількома лікарськими засобами, наприклад, 3-(5-аміно-2метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діоном. Набір включає тверду підкладу й засіб для виявлення експресії білка щонайменше одного біомаркера в біологічному зразку. У такому наборі може використовуватися, наприклад, індикаторна смужка, мембрана, чип, диск, тестуюча смужка, фільтр, мікросфера, предметне скло, багатоямковий планшет або оптичне волокно. Тверда підкладка набору може являти собою, наприклад, пластик, силікон, метал, смолу, скло, мембрану, частинку, осад, гель, полімер, листок, сферу, полісахарид, капіляр, плівку, пластину або предметне скло. Біологічний зразок може являти собою, наприклад, клітинну культуру, лінію клітин, тканину, тканину ротової порожнини, тканину шлунково-кишкового тракту, орган, органелу, біологічну рідину, зразок крові, зразок сечі або зразок шкіри. Біологічний зразок може являти собою, наприклад, біоптат лімфовузла, біоптат кісткового мозку або зразок пухлинних клітин периферичної крові. В іншому варіанті здійснення, набір включає тверду підкладку, нуклеїнові кислоти, що контактують із підкладкою, причому нуклеїнові кислоти комплементарні щонайменше до 20, 50, 100, 200, 350 або більше основам мРНК, і засіб для виявлення експресії мРНК у біологічному зразку. У певних варіантах здійснення, у наборах за даним винаходом використовується засіб для виявлення експресії біомаркера кількісної ПЛР у реальному часі (PCR (QRT-PCR)), мікрочипом, протоковою цитометрією або імунофлуоресценцією. В інших варіантах здійснення, експресія біомаркера вимірюється методологіями на основі ELISA або інших аналогічних способів, відомих у даній галузі. Даний винахід також стосується набору, що включає (i) фармацевтичну композицію, яка містить 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діон або його енантіомер або суміш його енантіомерів або його фармацевтично прийнятну сіль, сольват, гідрат, співкристал, клатрат або поліморф; і (ii) фармацевтичну композицію, що містить гематопоетичний фактор росту, цитокін, протираковий засіб, антибіотик, інгібітор cox-2, імуномодулюючий засіб, імуносупресивний засіб, кортикостероїд або його фармакологічно активний мутант або похідне, або їх комбінацію. В одному варіанті здійснення, даний винахід стосується набору, який включає: (i) фармацевтичну композицію, що містить 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин2,6-діон або його енантіомер або суміш його енантіомерів або його фармацевтично прийнятну сіль, сольват, гідрат, співкристал, клатрат або поліморф; і (ii) фармацевтичну композицію, яка містить облімерсен, мелфалан, G-CSF, GM-CSF, EPO, інгібітор cox-2, топотекан, пентоксифілін, таксотере, іритотекан, ципрофлоксацин, дексаметазон, доксорубіцин, вінкристин, IL 2, IFN, дакарбазин, Ara-C, вінорелбін або ізотретинон. В іншому варіанті здійснення, даний винахід стосується набору, що включає: (i) фармацевтичну композицію, що містить 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин2,6-діон або його енантіомер або суміш його енантіомерів або його фармацевтично прийнятну сіль, сольват, гідрат, співкристал, клатрат або поліморф; і (ii) кров з пупкового канатика, плацентарну кров, стовбурові клітини периферичної крові, препарат гематопоетичних стовбурових клітин периферичної крові або кісткового мозку. 4. Короткий опис креслень Фіг. з 1A по 1D: інгібіторний ефект 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6діону (сполука формули I) на активність NFκB у клітинах DLBCL. Фіг. 2: Антипроліферативний ефект 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин2,6-діону (сполука формули I) в аналізі in vitro на основі клітин DLBCL. 10 UA 110964 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фіг. 3: 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діон (сполука формули I) спільно стимулює T клітини й підвищує продукцію цитокінів. Фіг. 4: Антиангіогенний ефект 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6діону в аналізі in vitro експлантата людського пупкового канатика. Фіг. 5A і 5B: Антипроліферативний ефект 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3іл)піперидин-2,6-діону в аналізі in vitro на основі клітин множинної мієломи (MM). Фіг. 6: Інгібування пухлини in vitro під дією антипроліферативного ефекту 3-(5-аміно-2-метил4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діону на моделі ксенотрансплантата N929. Фіг. 7A-7C: Експресія цереблону модулює ефекти 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3іл)піперидин-2,6-діону на лінії клітин ABC-DLBCL. Фіг. 8: Нокаут CRBN усуває зупинку G1, викликану 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3іл)піперидин-2,6-діоном. Фіг. 9: Нокаут CRBN усуває ефект 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6діону на фосфорилування pRb і IRF-4 у клітинах H929. Фіг. 10: Антипроліферативна активність 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3іл)піперидин-2,6-діону інгібується в чутливих до CRBN клітинах мієломи. Фіг. 11: Експресія цереблону модулює антиінвазивну активність 3-(5-аміно-2-метил-4-оксо4H-хіназолін-3-іл)піперидин-2,6-діону. Фіг. 12A-12I: 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діон інгібує викликану гіпоксією експресію HIF1-α у лініях клітин солідних пухлин. Фіг. 13A і 13B: 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діон інгібує утворення колонії клітин раку молочної залози. Фіг. 14: 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діон інгібує ріст пухлинних клітин гліобластоми U87. 5. Докладний опис винаходу Даний винахід стосується способів лікування, ведення пацієнтів або попередження раку, які включають уведення потребуючому такого лікування, ведення або попередження пацієнту терапевтично або профілактично ефективної кількості 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3іл)піперидин-2,6-діону або його енантіомеру або суміші енантіомерів або його фармацевтично прийнятної солі, сольвату, гідрату, співкристалу, клатрату або поліморфу у вигляді окремого засобу або у вигляді частини комбінованого лікування. У певних варіантах здійснення, 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6діон або його енантіомер або суміш енантіомерів або його фармацевтично прийнятна сіль, сольват, гідрат, співкристал, клатрат або поліморф уводиться в комбінації з одним або декількома додатковими лікарськими засобами (або "другими активними засобами") для застосування при лікуванні, веденні пацієнтів або попередженні раку. Другі активні засоби включають дрібні молекули й великі молекули (наприклад, білки й антитіла), деякі приклади яких наведені в даному описі, а також стовбурові клітини. Способи або види лікування, які можуть застосовуватися в комбінації із уведенням сполуки за даним винаходом, включають без обмеження хірургічне лікування, переливання крові, імунотерапію, біологічну терапію, променеву терапію й інші види не медикаментозного лікування, застосовувані в цей час для лікування, попередження й ведення пацієнтів, які страждають на рак. У певних варіантах здійснення, сполука за даним винаходом може застосовуватися як вакцинний ад'юванта. У деяких варіантах здійснення, способи за даним винаходом основані частково на відкритті того, що експресовані певні гени або білки, пов'язані з певними раковими клітинами, можуть використовуватися як біомаркери для вказівки на ефективність або хід лікування захворювання. Такі форми раку включають без обмеження лімфому, неходжкінську лімфому, множинну мієлому, лейкоз, гострий мієлоїдний лейкоз (AML) і солідні пухлини. У певних варіантах здійснення, злоякісне захворювання стосується активованого B-клітинного фенотипу при неходжкінській лімфомі. Зокрема, ці біомаркери можуть застосовуватися для прогнозування, оцінки й простежування ефективності лікування пацієнтів 3-(5-аміно-2-метил-4-оксо-4Hхіназолін-3-іл)піперидин-2,6-діоном. У деяких варіантах здійснення, способи за даним винаходом частково основані на відкритті того, що цереблон (CRBN) пов'язаний з видами антипроліферативної активності певних лікарських засобів, таких як 3-(5-аміно-2-метил-4-оксо-4-хіназолін-3-іл)піперидин-2,6-діон. У деяких варіантах здійснення, CRBN може застосовуватися як біомаркер для вказівки на ефективність або успіхи лікування захворювання 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3іл)піперидин-2,6-діоном. Без обмеження конкретною теорією, зв'язування CRBN може вносити внесок або навіть вимагатися для антипроліферативної або інших видів активності певних сполук, таких як 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діон. 11 UA 110964 C2 5 10 15 20 25 30 35 40 45 50 55 60 Без обмеження конкретною теорією, 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин2,6-діон може опосередковувати інгібування росту, апоптоз і інгібування ангіогенних факторів при певних типах раку, таких як лімфома, неходжкінська лімфома, множинна мієлома, лейкоз, AML і солідні пухлини. Після дослідження експресії декількох пов'язаних з раком генів у декількох типах клітин до й після обробки 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин2,6-діоном, було виявлено, що рівні експресії декількох пов'язаних з раком генів або білків можуть використовуватися як біомаркери для прогнозування й моніторингу способів лікування раку. Було також виявлено, що рівень активності NF-κΒ підвищений у клітинах активованого Bклітинного фенотипу при неходжкінській лімфомі, що стосується інших клітин лімфоми, і що такі клітини можуть бути чутливі до обробки 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин2,6-діоном. Це свідчить про те, що вихідна активність NF-κΒ у клітинах лімфоми може являти собою прогностичний біомаркер для лікування 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3іл)піперидин-2,6-діоном у пацієнтів з неходжкінською лімфомою. Тому, у певних варіантах здійснення, даний винахід стосується способів прогнозування ефективності лікування пухлини в пацієнта з неходжкінською лімфомою. В одному варіанті здійснення, даний винахід стосується способу прогнозування ефективності лікування пухлини в пацієнта з неходжкінською лімфомою, причому спосіб включає одержання пухлинної тканини в пацієнта, очищення білка або РНК із пухлини й визначення присутності або відсутності біомаркера, наприклад, аналізом експресії білків або генів. Експресія, яка піддається моніторингу, може являти собою, наприклад, експресію мРНК або експресію білка. У певних варіантах здійснення, біомаркер являє собою ген, пов'язаний з активованим B-клітинним фенотипом DLBCL. Гени вибираються із групи, яка складається з IRF4/MUM1, FOXP1, SPIB, CARD11 і BLIMP/PDRM1. В одному варіанті здійснення, біомаркер являє собою NF-κB. В іншому варіанті здійснення, спосіб включає одержання пухлинних клітин у пацієнта, культивування клітин у присутності або під час відсутності 3-(5-аміно-2-метил-4-оксо-4Hхіназолін-3-іл)піперидин-2,6-діону, очищення РНК або білка з культивованих клітин і визначення присутності або відсутності біомаркера, наприклад, аналізом експресії генів або білків. У певних варіантах здійснення, присутність або відсутність біомаркера визначається кількісною ПЛР у реальному часі (QRT-PCR), мікрочипом, протоковою цитометрією або імунофлуоресценцією. В інших варіантах здійснення, присутність або відсутність біомаркера визначається методологіями на основі ELISA або інших аналогічних способів, відомих у даній галузі. Способи за даним винаходом включають способи скринінгу або ідентифікації страждаючих на рак пацієнтів, наприклад, пацієнтів з неходжкінською лімфомою, для лікування 3-(5-аміно-2метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діоном. Зокрема, даний винахід стосується способів відбору пацієнтів, що мають, або, що ймовірно мають більш високу частоту ефективності лікування 3-(5-аміно-2-метил-4-оксо-4-хіназолін-3-іл)піперидин-2,6-діоном. В одному варіанті здійснення, спосіб включає ідентифікацію пацієнтів із імовірною ефективністю лікування одержанням пухлинних клітин у пацієнта, культивування клітин у присутності або під час відсутності 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6діону, очищення РНК або білка з культивованих клітин і визначення присутності або відсутності специфічного біомаркера. Експресія, яка піддається моніторингу, може являти собою, наприклад, експресію мРНК або експресію білка. Експресія в обробленому зразку може збільшуватися або в деяких випадках зменшуватися, наприклад, приблизно в 1,5, 2,0, 3, 5 або більше разів. У певних варіантах здійснення, біомаркер являє собою ген, пов'язаний з активованим B-клітинним фенотипом. Гени вибрані із групи, яка складається з IRF4/MUM1, FOXP1, SPIB, CARD11 і BLIMP/PDRM1. В одному варіанті здійснення, біомаркер являє собою NF-κΒ. Вихідні рівні експресії цих генів можуть бути прогностичними відносно чутливості раку до лікування 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діоном. В одному варіанті здійснення, експресія IRF4/MUM1 у ракових клітинах, наприклад, клітинах лімфоми підтипу ABC, може бути зменшена лікуванням 3-(5-аміно-2-метил-4-оксо-4H-хіназолін3-іл)піперидин-2,6-діоном. У деяких варіантах здійснення, інгібуюча регуляція IRF4 3-(5-аміно-2метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діоном може являти собою потенційний фармакодинамічний біомаркер. В іншому варіанті здійснення, даний винахід стосується способу моніторингу ефективності лікування пухлини 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діоном у пацієнта з лімфомою, неходжкінською лімфомою, множинною мієломою, лейкозом, AML або із солідною пухлиною. Спосіб включає одержання біологічного зразка в пацієнта, вимірювання експресії одного або декількох біомаркерів у біологічному зразку, уведення пацієнту 3-(5-аміно-2-метил-4 12 UA 110964 C2 5 10 15 20 25 30 35 40 45 50 55 60 оксо-4H-хіназолін-3-іл)піперидин-2,6-діону, потім, одержання другого біологічного зразка в пацієнта, вимірювання експресії біомаркера в другому біологічному зразку й порівняння рівнів експресії біомаркера, причому підвищений рівень експресії біомаркера після лікування вказує на ймовірність ефективності лікування пухлини. В одному варіанті здійснення, знижений рівень експресії біомаркера після лікування вказує на ймовірність ефективності лікування пухлини. У певних варіантах здійснення, біомаркер являє собою ген, пов'язаний з активованим B-клітинним фенотипом неходжкінської лімфоми. Гени вибрані із групи, яка складається з IRF4/MUM1, FOXP1, SPIB, CARD11 і BLIMP/PDRM1. В одному варіанті здійснення, біомаркер являє собою NF-κΒ. У певних варіантах здійснення, спосіб включає вимірювання експресії одного або декількох генів-біомаркерів, пов'язаних з активованим B-клітинним фенотипом. Гени вибрані із групи, яка складається з IRF4/MUM1, FOXP1, SPIB, CARD11 і BLIMP/PDRM1. Підлягаюча моніторингу експресія може являти собою, наприклад, експресію мРНК або експресію білка. Експресія в обробленому зразку може збільшуватися, наприклад, приблизно в 1,5, 2,0, 3, 5 або більше разів. У ще одному варіанті здійснення, винахід стосується способу моніторингу дотримання пацієнтом протоколу медикаментозної терапії. Спосіб включає одержання біологічного зразка в пацієнта, вимірювання рівня експресії щонайменше одного біомаркера в зразку й визначення того, чи збільшений або знижений рівень експресії в зразку, отриманому в пацієнта, у порівнянні з рівнем експресії в контрольному необробленомому зразку, причому збільшена або зменшена експресія вказує на дотримання пацієнтом протоколу медикаментозної терапії. В одному варіанті здійснення, експресія одного або декількох біомаркерів збільшується. Підлягаюча моніторингу експресія може являти собою, наприклад, експресію мРНК або експресію білка. Експресія в обробленому зразку може збільшуватися, наприклад, приблизно в 1,5, 2,0, 3, 5 або більше разів. У певних варіантах здійснення, біомаркер являє собою ген, пов'язаний з активованим B-клітинним фенотипом. Гени вибрані із групи, яка складається з IRF4/MUM1, FOXP1, SPIB, CARD11 і BLIMP/PDRM1. В одному варіанті здійснення, біомаркер являє собою NF-κB. В іншому варіанті здійснення, винахід стосується способу прогнозування чутливості до лікування 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діоном у пацієнта з лімфомою, неходжкінською лімфомою, множинною мієломою, лейкозом, AML або солідною пухлиною. В одному варіанті здійснення, пацієнт являє собою пацієнта з неходжкінською лімфомою, зокрема, пацієнта з DLBCL. Спосіб включає одержання біологічного зразка в пацієнта, необов'язково, виділення або очищення мРНК із біологічного зразка, ампліфікацію транскриптом мРНК, наприклад, RT-PCR, причому більш високий вихідний рівень одного або декількох специфічних біомаркерів указує на більш високу ймовірність того, що ракове захворювання буде чутливо до лікування 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин2,6-діоном. В одному варіанті здійснення, біомаркер являє собою ген, пов'язаний з активованим B-клітинним фенотипом, вибраний із групи, яка складається з IRF4/MUM1, FOXP1, SPIB, CARD11 і BLIMP/PDRM1. В іншому варіанті здійснення, спосіб прогнозування чутливості до лікування 3-(5-аміно-2метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діоном у пацієнта з NHL, наприклад, пацієнта з DLBCL, включає одержання зразка в пацієнта, заливання зразка пухлини в залитий у парафін, фіксований формаліном блок і фарбування зразка антитілами до CD20, CD10, bcl-6, IRF4/MUM1, bcl-2, цикліну D2 і/або FOXP1, як описано у публікації Hans et al, Blood, 2004, 103: 275-282, яка повністю включена в даний опис шляхом посилання. В одному варіанті здійснення, фарбування CD10, bcl-6 і IRF4/MUM-1 може використовуватися для розподілу DLBCL на підгрупи GCB і не-GCB для прогнозування результату. В одному варіанті здійснення, даний винахід стосується способу прогнозування ефективності лікування пухлини в пацієнта з неходжкінською лімфомою, що включає: (i) одержання біологічного зразка в пацієнта; (ii) вимірювання активності шляхи NF-κΒ у біологічному зразку й (iii) порівняння рівня активності NF-κΒ у біологічному зразку з рівнем активності NF-κΒ біологічного зразка підтипу лімфоми з не активованих B-клітин; причому збільшений рівень активності NF-κΒ відносно підтипу лімфоми з не активованих Bклітин указує на ймовірність ефективності лікування пухлини в пацієнта на лікування 3-(5-аміно2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діоном. В одному варіанті здійснення, вимірювання активності шляхи NF-κΒ у біологічному зразку включає вимірювання рівня NF-κΒ у біологічному зразку. В одному варіанті здійснення, даний винахід стосується способу моніторингу ефективності 13 UA 110964 C2 5 10 15 20 25 30 35 40 45 50 55 60 лікування пухлини в пацієнта з неходжкінською лімфомом, що включає: (i) одержання біологічного зразка в пацієнта: (ii) вимірювання рівня активності NF-κΒ у біологічному зразку; (iii) уведення пацієнту терапевтично ефективної кількості 3-(5-аміно-2-метил-4-оксо-4Hхіназолін-3-іл)піперидин-2,6-діону, або його сольвату або гідрату; (iv) одержання другого біологічного зразка в пацієнта; (v) вимірювання рівня активності NF-κΒ у другому біологічному зразку; і (vi) порівняння рівня активності NF-κΒ у першому біологічному зразку з рівнем активності NF-κΒ у другому біологічному зразку; причому знижений рівень активності NF-κΒ у другому біологічному зразку відносно першого біологічного зразка вказує на ймовірність ефективності лікування пухлини в пацієнта. В одному варіанті здійснення, даний винахід стосується способу моніторингу дотримання пацієнтом протоколу медикаментозного лікування, що включає: (i) одержання біологічного зразка в пацієнта; (ii) вимірювання рівня активності NF-κΒ у біологічному зразку; і (iii) порівняння рівня активності NF-κΒ у біологічному зразку з контрольним необробленим зразком; причому знижений рівень активності NF-κΒ у біологічному зразку відносно контролю вказує на дотримання пацієнтом протоколу медикаментозного лікування. В одному варіанті здійснення, неходжкінська лімфома являє собою дифузну великоклітинну B-клітинну лімфому. В іншому варіанті здійснення, рівень активності NF-κΒ вимірюється ферментним імуносорбентним аналізом. В одному варіанті здійснення, даний винахід стосується способу прогнозування ефективності лікування пухлини в пацієнта з неходжкінською лімфомою, що включає: (i) одержання біологічного зразка в пацієнта; (ii) культивування клітин з біологічного зразка; (iii) очищення РНК із культивованих клітин; і (iv) ідентифікацію збільшеної експресії гена, пов'язаного з активованим B-клітинним фенотипом неходжкінської лімфоми відносно контрольного не активованого B-клітинного фенотипу неходжкінської лімфоми; причому збільшена експресія гена, пов'язаного з активованим B-клітинним фенотипом неходжкінської лімфоми, указує на ймовірність ефективності лікування пацієнта на лікування 3(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діоном. В одному варіанті здійснення, збільшена експресія являє собою збільшення приблизно в 1,5, 2,0, 3, 5 або більше разів. В одному варіанті здійснення, ген, пов'язаний з активованим B-клітинним фенотипом, вибраний із групи, яка складається з IRF4/MUM1, FOXP1, SPIB, CARD11 і BLIMP/PDRM1. В одному варіанті здійснення, ідентифікація експресії гена, пов'язаного з активованим Bклітинним фенотипом неходжкінської лімфоми, виконується кількісною ПЛР у реальному часі. Даний винахід також стосується способу лікування або ведення пацієнта з неходжкінською лімфомою, що включає: (i) ідентифікацію пацієнта, що має неходжкінську лімфому, чутливу до лікування 3-(5-аміно2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діоном; і (ii) уведення пацієнту терапевтично ефективної кількості 3-(оксо-4-хіназолін-3-іл)-піперидин2,6-діону або його фармацевтично прийнятної солі, сольвату або гідрату. В одному варіанті здійснення, неходжкінська лімфома являє собою дифузну великоклітинну B-клітинну лімфому. В іншому варіанті здійснення, неходжкінська лімфома стосується активованого B-клітинного фенотипу. В іншому варіанті здійснення, дифузна великоклітинна B-клітинна лімфома характеризується експресією одного або декількох біомаркерів, надекспресованих у клітинних лініях RIVA, U2932, TMD8, OCI-Ly3 або OCI-Ly10. В іншому варіанті здійснення, дифузна великоклітинна B-клітинна лімфома характеризується експресією одного або декількох біомаркерів, надекспресованих у клітинних лініях RIVA, U2932, TMD8 або OCI-Ly10. В одному варіанті здійснення, ідентифікація пацієнта, що має лімфому, чутливу до лікування 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діоном, включає визначення характеристик фенотипу лімфоми пацієнта. В одному варіанті здійснення, фенотип лімфоми характеризується як активований B 14 UA 110964 C2 5 10 15 20 25 30 35 40 45 50 55 60 клітинний підтип. В одному варіанті здійснення, фенотип лімфоми характеризується як активований Bклітинний підтип дифузної великоклітинної B-клітинної лімфоми. У певних варіантах здійснення, ідентифікація фенотипу лімфоми включає одержання біологічного зразка в пацієнта, що має лімфому. В одному варіанті здійснення, біологічний зразок являє собою клітинну культуру або зразок тканини. В одному варіанті здійснення, біологічний зразок являє собою зразок пухлинних клітин. В іншому варіанті здійснення, біологічний зразок являє собою біоптат лімфовузла, біоптат кісткового мозку або зразок пухлинних клітин периферичної крові. В одному варіанті здійснення, біологічний зразок являє собою зразок крові. В одному варіанті здійснення, ідентифікація пацієнта, що має неходжкінську лімфому, чутливу до лікування 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діоном, включає ідентифікацію гена, пов'язаного з активованим B-клітинним фенотипом. В одному варіанті здійснення, ген, пов'язаний з активованим B-клітинним фенотипом, вибраний із групи, яка складається з IRF4/MUM1, FOXP1, SPIB, CARD11 і BLIMP/PDRM1. В одному варіанті здійснення, ідентифікація пацієнта, що має неходжкінську лімфому, чутливу до лікування 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діоном, включає вимірювання рівня активності NF-κΒ у пацієнта. В іншому варіанті здійснення, вимірювання рівня активності NF-κΒ у пацієнта включає вимірювання рівня вихідної активності NF-κB у пухлинних клітинах, отриманих у пацієнта. В іншому варіанті здійснення, дифузна великоклітинна B-клітинна лімфома характеризується однією або декількома з наступних ознак: (i) надекспресія SPIB, специфічного для гематопоезу сімейства факторів транскрипції Ets, необхідних для виживання клітин активованого B-клітинного підтипу; (ii) вища конститутивна експресія IRF4/MUM1, ніж в клітинах підтипу GCB; (iii) вища конститутивна експресія FOXP1, стимульована трисомією 3; (iv) вища конститутивна експресія Blimp1, тобто, PRDM1; і (v) вища конститутивна експресія гена CARD11; і (vi) підвищений рівень активності NF-κΒ відносно клітин DLBCL не активованого B-клітинного підтипу. Додаткові прогностичні фактори, які можуть використовуватися одночасно із представленими в даному описі, являють собою прогностичні фактори: тяжкість захворювання (пухлини), абсолютне число лімфоцитів (ALC), час, який пройшов від останнього лікування ритуксимабом із приводу лімфом, або всі зазначені вище фактори. Даний винахід також стосується способу відбору групи пацієнтів, які страждають на рак, на основі рівня експресії CRBN або рівнів експресії DDB1, DDB2, IRF4 або NFκB у межах даної форми раку з метою прогнозування клінічної ефективності лікування, моніторингу клінічної ефективності лікування або моніторингу дотримання пацієнтом схеми введення 3-(5-аміно-2метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діону, його стереоізомера або його фармацевтично прийнятної солі, сольвату, гідрату, співкристалу, клатрату або поліморфу; причому пацієнти, які страждають на рак, вибрані з пацієнтів із множинною мієломою, неходжкінською лімфомою, дифузною великоклітинною B-клітинною лімфомою, меланомою й солідними пухлинами. Вихідні рівні експресії цих генів можуть прогнозувати чутливість раку до лікування 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діоном. В одному варіанті здійснення, експресія IRF4/MUM1 у ракових клітинах, наприклад, лімфоми підтипу ABC, може бути зменшена лікуванням 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3іл)піперидин-2,6-діоном. У деяких варіантах здійснення, пригнічуюча регуляція IRF4 3-(5-аміно2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діоном може являти собою потенційний фармакодинамічний біомаркер. В одному варіанті здійснення пацієнти, які страждають на рак, являють собою пацієнтів із множинною мієломою. В одному варіанті здійснення пацієнти, які страждають на рак, являють собою пацієнтів з неходжкінською лімфомою. В одному варіанті здійснення, спосіб відбору групи страждаючих на рак пацієнтів оснований на рівні експресії DDB1 у межах даної форми раку. В одному варіанті здійснення, спосіб відбору групи страждаючих на рак пацієнтів оснований на рівні експресії DDB2 у межах даної форми раку. В одному варіанті здійснення, спосіб відбору групи страждаючих на рак пацієнтів оснований на рівні експресії IRF4 у межах даної форми раку. В одному варіанті здійснення, спосіб відбору групи страждаючих на рак пацієнтів оснований 15 UA 110964 C2 5 10 15 20 25 30 35 40 45 50 55 60 на рівні експресії NFκB у межах даної форми раку. В іншому варіанті здійснення, спосіб включає відбір групи страждаючих на рак пацієнтів, що реагують на лікування 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діоном, його стереоізомером або його фармацевтично прийнятною сіллю, сольватом, гідратом, співкристалом, клатратом або поліморфом, на основі рівня експресії CRBN або рівнів експресії DDB1, DDB2, IRF4 або NFκB усередині T клітин пацієнта, B клітин або плазматичних клітин, з метою прогнозування клінічної ефективності лікування, моніторингу клінічної ефективності лікування або моніторингу дотримання пацієнтом схеми введення 3-(5-аміно-2-метил-4-оксо-4Hхіназолін-3-іл)піперидин-2,6-діону, його стереоізомера або його фармацевтично прийнятної солі, сольвату, гідрату, співкристалу, клатрату або поліморфу. В одному варіанті здійснення пацієнти, які страждають на рак, вибрані з пацієнтів із множинною мієломою, неходжкінською лімфомою, дифузною великоклітинною B-клітинною лімфомою, меланомою й солідними пухлинами. Даний винахід також стосується способів лікування раку, наприклад, лімфоми, неходжкінської лімфоми, множинної мієломи, лейкозу, гострого мієлоїдного лейкозу (AML) і солідних пухлин, які приводять до збільшення загального виживання пацієнтів. У деяких варіантах здійснення, збільшення загального виживання пацієнтів спостерігається в популяції пацієнтів, чутливій до лікування 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6діоном. У деяких варіантах здійснення, популяція пацієнтів, чутлива до лікування 3-(5-аміно-2метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діоном, характеризується одним або декількома біомаркерами, зазначеними в даному описі. В інших варіантах здійснення, даний винахід стосується способів лікування раку, наприклад, лімфоми, неходжкінської лімфоми, множинної мієломи, лейкозу, гострого мієлоїдного лейкозу (AML) і солідних пухлин, які приводять до виживання пацієнта без захворювання. У деяких варіантах здійснення, виживання пацієнтів без захворювання спостерігається в популяції пацієнтів, чутливих до лікування 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6діоном. У деяких варіантах здійснення, популяція пацієнтів, чутливих до лікування 3-(5-аміно-2метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діоном, характеризується одним або декількома біомаркерами, зазначеними в даному описі. В інших варіантах здійснення, даний винахід стосується способів лікування раку, наприклад, лімфоми, неходжкінської лімфоми, множинної мієломи, лейкозу, гострого мієлоїдного лейкозу (AML) і солідних пухлин, які приводять до збільшення частоти об'єктивної ефективності лікування в популяції пацієнтів. У деяких варіантах здійснення, виживання пацієнтів без захворювання спостерігається в популяції пацієнтів, чутливих до лікування 3-(5-аміно-2-метил4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діоном. У деяких варіантах здійснення, популяція пацієнтів, чутливих до лікування 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6діоном, характеризується одним або декількома біомаркерами, зазначеними в даному описі. В інших варіантах здійснення, даний винахід стосується способів лікування раку, наприклад, лімфоми, неходжкінської лімфоми, множинної мієломи, лейкозу, гострого мієлоїдного лейкозу (AML) і солідних пухлин, які приводять до збільшення часу до прогресування або до виживання пацієнтів без прогресування захворювання. У деяких варіантах здійснення, збільшення часу до прогресування або до виживання пацієнтів без прогресування захворювання спостерігається в популяції пацієнтів, чутливих до лікування 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3іл)піперидин-2,6-діоном. У деяких варіантах здійснення, популяція пацієнтів, чутливих до лікування 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діоном, характеризується одним або декількома біомаркерами, зазначеними в даному описі. Даний винахід також стосується наборів, використовуваних для прогнозування ймовірності ефективного лікування лімфоми, неходжкінської лімфоми, множинної мієломи, лейкозу. AML або солідної пухлини 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діоном. Набір включає тверду підкладку й засіб для виявлення експресії біомаркера в біологічному зразку. У такому наборі може використовуватися, наприклад, індикаторна смужка, мембрана, чип, диск, тестуюча смужка, фільтр, мікросфера, предметне скло, багатоямковий планшет або оптичне волокно. Тверда підкладка набору може являти собою, наприклад, пластик, силікон, метал, смолу, скло, мембрану, частинку, осад, гель, полімер, листок, сферу, полісахарид, капіляр, плівку, пластину або предметне скло. Біологічний зразок може являти собою, наприклад, клітинну культуру, лінію клітин, тканина, тканина ротової порожнини, тканина шлунковокишкового тракту, орган, органелу, біологічну рідину, зразок крові, зразок сечі або зразок шкіри. Біологічний зразок може являти собою, наприклад, біоптат лімфовузла, біоптат кісткового мозку або зразок пухлинних клітин периферичної крові. В одному варіанті здійснення, набір включає тверду підкладку, нуклеїнові кислоти, що 16 UA 110964 C2 5 10 15 20 25 30 35 40 45 50 55 60 контактують із підкладкою, причому нуклеїнові кислоти комплементарні щонайменше 20, 50, 100, 200, 350 або більше основам мРНК гена, пов'язаного з активованим B-клітинним фенотипом при NHL, і засіб для виявлення експресії мРНК у біологічному зразку. В одному варіанті здійснення, ген, пов'язаний з активованим B-клітинним фенотипом, вибраний із групи, яка складається з IRF4/MUM1, FOXP1, SPIB, CARD11 і BLIMP/PDRM1. В одному варіанті здійснення, винахід стосується набору, який використовується для прогнозування ймовірності ефективного лікування лімфоми, неходжкінської лімфоми, множинної мієломи, лейкозу, AML або солідної пухлини або для моніторингу ефективності лікування 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діоном. Набір включає тверду підкладку й засіб для виявлення експресії NF-κΒ у біологічному зразку. В одному варіанті здійснення, біологічний зразок являє собою культуру клітин або зразок тканини. В одному варіанті здійснення, біологічний зразок являє собою зразок пухлинних клітин. В іншому варіанті здійснення, біологічний зразок являє собою біоптат лімфовузла, біоптат кісткового мозку або зразок пухлинних клітин периферичної крові. В одному варіанті здійснення, біологічний зразок являє собою зразок крові. В одному варіанті здійснення, NHL являє собою DLBCL. У певних варіантах здійснення, у наборах за даним винаходом використовується засіб для виявлення експресії біомаркера кількісної ПЛР у реальному часі (QT-PCR), мікрочип, протокову цитометрію або імунофлуоресценцію. В інших варіантах здійснення, експресія біомаркера вимірюється методологіями на основі ELISA або іншими аналогічними способами, відомими в даній галузі. Додаткові методики визначення експресії мРНК і білка можуть використовуватися у зв'язку зі способами й наборами за даним винаходом, наприклад, способи гібридизація CDNA і цитометричного аналізу на основі флуоресценції мікрочастинок. В одному варіанті здійснення, даний винахід стосується набору прогнозування ефективності лікування пухлини 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діоном у страждаючого на неходжкінську лімфому пацієнта, що включає: (i) тверду підкладку й (ii) засіб для виявлення експресії біомаркера активованого B-клітинного фенотипу неходжкінської лімфоми в біологічному зразку. В одному варіанті здійснення, біомаркер являє собою NF-κΒ. В одному варіанті здійснення, біомаркер являє собою ген, пов'язаний з активованим Bклітинним фенотипом, і вибраний із групи, яка складається з IRF4/MUM1, FOXP1, SPIB, CARD11 і BLIMP/PDRM1. У певних способах за винаходом, 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6діон уводиться в комбінації з терапією, звичайно застосовуваною для лікування, попередження або ведення пацієнтів, які страждають на рак. Приклади таких звичайних способів терапії включають без обмеження хірургічне лікування, хіміотерапію, променеву терапію, гормональну терапію, біологічну терапію й імунотерапію. Даний винахід також стосується фармацевтичних композицій, окремих стандартних лікарських форм, схем уведення й наборам, які містять 3-(5-аміно-2-метил-4-оксо-4H-хіназолін3-іл)піперидин-2,6-діон або його фармацевтично прийнятну сіль, сольват, гідрат, стереоізомер, клатрат або проліки й другий або додатковий активний засіб. Другі активні засоби включають певні комбінації або "коктейлі" лікарських засобів. У деяких варіантах здійснення, способи лікування, попередження і/або ведення страждаючих на лімфоми пацієнтів за даним винаходом можуть застосовуватися в пацієнтів, які не реагували на стандартне лікування. В одному варіанті здійснення, лімфома є рецидивуючою, рефракторною або стійкою до звичайної терапії. В інших варіантах здійснення, способи лікування, попередження і/або ведення страждаючих лімфомами пацієнтів за даним винаходом можуть застосовуватися при лікуванні інтактних пацієнтів, тобто, пацієнтів, які ще не одержували лікування. У певних варіантах здійснення, 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6діон або його енантіомер або суміш енантіомерів, або його фармацевтично прийнятна сіль, сольват, гідрат, співкристал, клатрат або поліморф уводиться в комбінації або по черзі з терапевтично ефективною кількістю одного або декількох додаткових активних засобів. Другі активні засоби включають дрібні молекули й великі молекули (наприклад, білки й антитіла), приклади яких наведені в даному описі, а також стовбурові клітини. Способи лікування, які можна застосовувати в комбінації із уведенням сполуки за даним винаходом, включають без обмеження хірургічне лікування, переливання крові, імунотерапію, біологічну терапію, променеву терапію й інші види лікування, не основані на медикаментозних засобах, застосовувані в цей час для лікування, попередження або ведення пацієнтів із захворюваннями й станами, пов'язаними з небажаним ангіогенезом, або які характеризуються ним. 17 UA 110964 C2 5 10 15 20 25 30 35 40 45 50 55 60 В одному варіанті здійснення, додатковий активний засіб вибраний із групи, яка складається з алкілуючого агента, глюкокортикоїду, інгібітору кінази, інгібітору SYK, інгібітору PDE3, інгібітору PDE7, доксорубіцину, хлорамбуцилу, вінкристину, бендамустину, форсколіну, ритуксимабу або їх комбінації. В одному варіанті здійснення, додатковий активний засіб являє собою ритуксимаб. В одному варіанті здійснення, глюкокортикоїд являє собою гідрокортизон або дексаметазон. В одному варіанті здійснення, 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діон уводиться в кількості від приблизно 5 до приблизно 50 мг на день. В одному варіанті здійснення, 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діон уводиться в кількості від приблизно 5 до приблизно 25 мг на день. В іншому варіанті здійснення, 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діон уводиться в кількості приблизно 5, 10, 15, 25, 30 або 50 мг на день. В іншому варіанті здійснення, на день уводиться 10 або 25 мг 3-(5-аміно-2-метил-4-оксо-4Hхіназолін-3-іл)піперидин-2,6-діону. В одному варіанті здійснення, 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діон уводиться двічі на день. Даний винахід стосується фармацевтичних композицій (наприклад, окремих стандартних лікарських форм), які можуть застосовуватися в способах, описаних у даній заявці. У певних варіантах здійснення, фармацевтичні композиції містять 3-(5-аміно-2-метил-4-оксо-4H-хіназолін3-іл)піперидин-2,6-діон або його енантіомер, або суміш його енантіомерів, або його фармацевтично прийнятну сіль, сольват, гідрат, співкристал, клатрат або поліморф, і другий активний засіб. В одному варіанті здійснення, 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діон уводиться перорально. В одному варіанті здійснення, 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діон уводиться в капсулі або в таблетці. В одному варіанті здійснення, 3-(5-аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діон уводиться протягом 21 дня з наступними сьома днями відпочинку в 28-денному циклі. 5.1 Визначення Для полегшення розуміння представленого описі, нижче визначаються ряд термінів. Термін "індивід" або "пацієнт" стосується тварини, включаючи без обмеження ссавця, включаючи примата (наприклад, людину), корову, вівцю, козу, коня, собаку, кішку, кролика, щура або мишу. Терміни "індивід" і "пацієнт" використовуються в даному описі взаємозамінно при посиланні, наприклад, на ссавця індивіда, такого як людина. Використовуваний у даному описі й поки немає інших визначень, термін "лікувати", "лікування" і "обробка" стосуються усунення або полегшення протікання захворювання або розладу або одного або декількох симптомів, пов'язаних із захворюванням або розладом. У певних варіантах здійснення, ці терміни стосуються мінімізації поширення або посилювання захворювання або розладу в результаті введення одного або декількох профілактичних або терапевтичних засобів пацієнту з таким захворюванням або розладом. У деяких варіантах здійснення, ці терміни стосуються введення сполуки за даним винаходом з іншими додатковим активним засобом або без нього після появи симптомів конкретного захворювання. Використовувані в даному описі й поки немає інших визначень, терміни "запобігти", "запобігання" і "профілактика" стосуються запобігання початку, рецидиву або поширення захворювання або розладу або одного або декількох його симптомів. У певних варіантах здійснення, ці терміни стосуються лікування із застосуванням або до введення сполуки за винаходом, з додатковою активною сполукою або без неї, перед початком симптомів, зокрема, пацієнтам з ризиком захворювань або розладів, описаних у даній заявці. Ці терміни включають інгібування або зменшення симптому конкретного захворювання. У певних варіантах здійснення, пацієнти із сімейним анамнезом захворювання є, зокрема, претендентами на проведення схем профілактичного лікування. Крім того, пацієнти, у яких в анамнезі є рецидив симптомів, також є потенційними претендентами на профілактику. Відносно цього, термін "профілактика" може взаємозамінно використовуватися з терміном "профілактичне лікування". Використовувані в даному описі й поки немає інших визначень, терміни "вести пацієнта із захворюванням або розладом" і "ведення пацієнта із захворюванням або розладом" стосуються запобігання або вповільнення прогресування, поширення й посилювання захворювання або розладу або одного або декількох його симптомів. Часто, сприятливі ефект, які впливають на пацієнта в результаті застосування профілактичного і/або терапевтичного засобу, не приводять до лікування захворювання або розладу. Відносно цього, термін "ведення пацієнта із захворюванням або розладом" включає лікування пацієнта, який страждав на конкретне 18 UA 110964 C2 5 10 15 20 25 30 35 40 45 50 55 60 захворювання, зі спробою запобігання або мінімізації рецидиву захворювання, або подовження часу, протягом якого триває ремісія захворювання або розладу. Використовуваний у даному описі й поки немає інших визначень, термін "терапевтично ефективна кількість" сполуки являє собою кількість, достатню для забезпечення терапевтичного ефекту при лікуванні або веденні пацієнта із захворюванням або розладом, або для затримки або мінімізації одного або декількох симптомів, пов'язаних із захворюванням або розладом. Терапевтично ефективна кількість сполуки означає кількість терапевтичного засобу, окремо або в комбінації з іншими способами лікування, яка забезпечує терапевтичний сприятливий ефект при веденні пацієнта із захворюванням або розладом. Термін "терапевтично ефективна кількість" може включати деяку кількість, яка поліпшує лікування в цілому, зменшує або усуває симптоми або причини захворювання або розладу або підвищує терапевтичну ефективність іншого терапевтичного засобу. Використовуваний у даному описі й поки немає інших визначень, термін "профілактично ефективна кількість" сполуки позначає кількість, достатню для запобігання захворювання або розладу або запобігання його рецидиву. Профілактично ефективна кількість сполуки означає кількість терапевтичного засобу, окремо або в комбінації з іншими засобами, яка забезпечує профілактичний сприятливий ефект при профілактиці захворювання. Термін "профілактично ефективна кількість" може включати кількість, яка поліпшує профілактику в цілому, або підвищує профілактичну ефективність іншого профілактичного засобу. Термін "фармацевтично прийнятний носій", "фармацевтично прийнятний ексципієнт", "фізіологічно прийнятний носій" або "фізіологічно прийнятний ексципієнт" стосується фармацевтично прийнятного матеріалу, композиції або основи, такої як рідкий або твердий наповнювач, розріджувач, ексципієнт або інкапсулюючий матеріал. В одному варіанті здійснення, кожний компонент є "фармацевтично прийнятним" у значенні сумісності з іншими інгредієнтами фармацевтичної препаративної форми й придатним для застосування в контакті із тканиною або органом людей або тварин, без надлишкової токсичності, подразнення, алергійної реакції, імуногенності або інших проблем або ускладнень, що відповідає доцільному відношенню вигоди/ризику. Див. посібники Remington: The Science and Practice of Pharmacy, 21st Edition; Lippincott Williams & Wilkins: Philadelphia, PA, 2005; Handbook of Pharmaceutical Excipients, 5th Edition; Rowe et al. Eds., The Pharmaceutical Press and the American Pharmaceutical Association: 2005; і Handbook of Pharmaceutical Additives, 3rd Edition; Ash and Ash Eds., Gower Publishing Company: 2007; Pharmaceutical Preformulation and Formulation, Gibson Ed., CRC Press LLC: Boca Raton, FL, 2004). Використовуваний у даному описі термін "пухлина" стосується всього неопластичного клітинного росту й проліферації, злоякісного або доброякісного, і всіх передракових і ракових клітин і тканин. Використовуваний у даному описі термін "неопластичний" стосується будь-якої форми злоякісного або доброякісного клітинного росту при його порушеній або відсутній регуляції, що приводить до патологічного росту тканини. Таким чином, "неопластичні клітини" включають злоякісні й доброякісні клітини, що мають клітинний ріст при його порушеній або відсутній регуляції. Термін "рецидивуючий" стосується ситуації, коли в індивіда або ссавця, у якого була ремісія раку після лікування, є повернення ракових клітин. Використовуваний у даному описі термін "ефективність лікування пухлини в пацієнта" стосується будь-якого збільшення сприятливого терапевтичного ефекту для пацієнта. "Ефективність лікування пухлини в пацієнта" може являти собою, наприклад, зменшення на 5 %, 10 %, 25 %, 50 % або 100 % фізикальних симптомів раку. "Ефективність лікування пухлини в пацієнта" може також являти собою, наприклад, збільшення на 5 %, 10 %, 25 %, 50 %, 100 %, 200 % ефективності лікування пацієнта, за даними вимірювання будь-яким придатним засобом, таким як експресія гена, кількість клітин, результати кількісного аналізу і т. д. Термін "імовірність" у цілому стосується збільшення ймовірності явища. Термін "імовірність" при використанні відносно ефективності лікування пухлини в пацієнта в цілому передбачає збільшену ймовірність того, що частота прогресування пухлини або росту пухлинних клітин знизиться. Термін "імовірність" при використанні відносно ефективності лікування пухлини в пацієнта може також у цілому означати збільшення індикаторів, таких як експресія мРНК або білка, які можуть свідчити про збільшення успіху в лікуванні пухлини. Термін "прогнозувати" у цілому означає визначити або повідомити заздалегідь. При використанні, наприклад, для "прогнозування" ефективності лікування раку, термін "прогнозувати" може означати, що ймовірність результату лікування раку можна визначити на початковому етапі, перед тим як лікування почалося, або перед тим як період лікування суттєво 19 UA 110964 C2 5 10 15 20 25 30 35 40 45 50 55 60 просунувся. Використовуваний у даному описі термін "контролювати" у цілому стосується моніторингу, спостереження, регулювання, простежування, спостереження або нагляду над діяльністю. Наприклад, термін "моніторинг ефективності сполуки" стосується простежування ефективності при лікуванні раку в пацієнта або в культурі пухлинних клітин. Аналогічним чином, термін "моніторинг" при використанні у зв'язку з дотриманням пацієнтом запропонованого лікування або індивідуально, або в клінічному випробуванні, стосується простежування або підтвердження того, що пацієнт дійсно приймає тестовану імуномодуляторну сполуку відповідно до призначення. Моніторинг може виконуватися, наприклад, спостереженням за експресією мРНК або білковими біомаркерами. Ефект лікування раку або пов'язаного з ним захворювання може характеризуватися як повна або часткова ефективність лікування. "Повна ефективність лікування" стосується відсутності захворювання, що клінічно виявляється, з нормалізацією будь-яких раніше патологічних даних рентгенологічних досліджень, досліджень кісткового мозку й спинномозкової рідини (CSF) або даних досліджень білка, що відхиляються від норми. "Часткова ефективність лікування" стосується зменшення щонайменше приблизно на 10 %, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 % або 90 % усього вимірюваного пухлинного навантаження (тобто, числа злоякісних клітин, які присутні в індивіда, або виміряного об'єму пухлинних утворень або кількості патологічного моноклонального білка) під час відсутності нових уражень. Термін "лікування" передбачає й повну, і часткову його ефективність. Термін "рефракторний або стійкий" стосується обставини, коли в індивіда або ссавця, навіть після інвазивного лікування, в організмі є залишкові ракові клітини. Термін "лікарська стійкість" стосується стану, коли захворювання не реагує на лікування лікарським засобом або лікарськими засобами. Лікарська стійкість може бути або ендогенною, і це значить, що захворювання ніколи не реагувало на лікування лікарським засобом або лікарськими засобами, або вона може бути набутою, і це значить, що захворювання перестає реагувати на лікування лікарським засобом або лікарськими засобами, на яке захворювання раніше реагувало. У певних варіантах здійснення, лікарська стійкість є ендогенною. У певних варіантах здійснення, лікарська стійкість є набутою. Термін "чутливість" і "чутливе" при посиланні на лікування сполукою являє собою відносний термін, який стосується ступеня ефективності сполуки відносно зниження або зменшення прогресування пухлини, яка піддається лікуванню, або захворювання. Наприклад, термін "підвищена чутливість" при використанні з посиланням на обробку клітини або пухлини у зв'язку зі сполукою стосується підвищення ефективності лікування пухлини щонайменше на 5 % або більше. Термін "експресований" або "експресія", використовуваний у даному описі, стосується транскрипції з гена для одержання молекули нуклеїнової кислоти РНК щонайменше частково комплементарної області однієї із двох ниток нуклеїнової кислоти гена. Термін "експресований" або "експресія", використовуваний у даному описі, стосується трансляції з молекули РНК для одержання білка, поліпептиду або їх частини. Вміст мРНК, яка піддана "підвищувальній регуляції", у цілому збільшується після даного лікування або стану. мРНК, яка піддана "знижувальній регуляції", у цілому стосується зменшення рівня експресії мРНК у відповідь на дане лікування або стан. У деяких ситуаціях рівень мРНК може залишатися незмінним після даного лікування або стану. мРНК зі зразка, отриманого в пацієнта, може бути піддана "підвищувальній регуляції" при обробці імуномодуляторною сполукою, у порівнянні з необробленим контролем. Ця підвищувальна регуляція може являти собою, наприклад, збільшення приблизно на 5 %, 10 %, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 90 %, 100 %, 200 %, 300 %, 500 %, 1000 %, 5000 % або більше рівня порівняльної контрольної мРНК. Альтернативно, мРНК може піддаватися "знижувальній регуляції" або експресована на більш низькому рівні у відповідь на введення певних імуномодуляторних сполук або інших засобів. Піддана "знижувальній регуляції" мРНК може, наприклад, бути присутньою на рівні, що становить приблизно 99 %, 95 %, 90 %, 80 %, 70 %, 60 %, 50 %, 40 %, 30 %, 20 %, 10 %, 1 % або менше порівняльного контрольного рівня мРНК. Аналогічним чином, рівень поліпептидного або білкового біомаркера зі зразка пацієнта може бути збільшений при обробці імуномодуляторною сполукою, у порівнянні з необробленим контролем. Це збільшення може становити приблизно 5 %, 10 %, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 90 %, 100 %, 200 %, 300 %, 500 %, 1000 %, 5000 % або більше рівня порівняльного контрольного білка. Альтернативно, рівень білкового біомаркера може зменшуватися у відповідь на введення 20 UA 110964 C2 5 10 15 20 25 30 35 40 45 50 55 60 певних імуномодуляторних сполук або інших засобів. Це зменшення може, наприклад, бути присутнім на рівні приблизно 99 %, 95 %, 90 %, 80 %, 70 %, 60 %, 50 %, 40 %, 30 %, 20 %, 10 %, 1 % або менше рівня порівняльного контрольного білка. Використовувані в даному описі терміни "визначення", "вимірювання", "оцінка" і "кількісний аналіз" у цілому стосуються будь-якої форми вимірювання й включають визначення того, чи присутній елемент чи ні. Ці терміни включають і кількісні, і/або якісні визначення. Оцінка може бути відносною або абсолютною. "Оцінка присутності чого-небудь" може включати визначення присутньої кількості чого-небудь, а також визначення того, чи присутнє воно чи відсутнє. Використовуваний у даному описі й поки немає інших вказівок термін "фармацевтично прийнятна сіль" включає нетоксичні кислотно- і основно-адитивні солі сполуки, якої стосується термін. Прийнятні нетоксичні кислотно-адитивні солі включають ті, які отримані з органічних і неорганічних кислот, відомих у даній галузі, які включають, наприклад, хлористоводневу кислоту, бромистоводневу кислоту, фосфорну кислоту, сірчану кислоту, метансульфонову кислоту, оцтову кислоту, винну кислоту, молочну кислоту, бурштинову кислоту, лимонну кислоту, яблучну кислоту, малеїнову кислоту, сорбінову кислоту, аконітову кислоту, саліцилову кислоту, фталеву кислоту, емболову кислоту, енантову кислоту й тому подібні. Сполуки, які є кислотними по природі, здатні утворювати солі з різними фармацевтично прийнятними основами. Основи, які можуть використовуватися для одержання фармацевтично прийнятних основно-адитивних солей таких кислотних сполук, являють собою ті, які утворюють нетоксичні основно-адитивні солі, тобто, солі, що містять фармакологічно прийнятні катіони, такі як без обмеження солі лужних металів або лужноземельних металів і, зокрема, солі кальцію, магнію, натрію або калію. Придатні органічні основи включають без обмеження N, Nдибензилетилендіамін, хлорпрокаїн, холін, діетаноламін, етилендіамін, меглумаїн(Nметилглюкамін), лізин і прокаїн. Використовуваний у даному описі й поки немає інших вказівок термін "сольват" означає сполуку за даним винаходом або її сіль, яка додатково включає стехіометричну або не стехіометричну кількість розчинника, зв'язаного не ковалентними міжмолекулярними силами. Коли розчинником є вода, то сольват являє собою гідрат. Використовуваний у даному описі й поки немає інших вказівок термін "проліки" означає похідну сполуки, яка може гідролізуватися, окиснюватися або іншими чином взаємодіяти в біологічних умовах (in vitro або in vivo) для одержання сполуки. Приклади проліків включають без обмеження похідні сполуки формули I за даним винаходом, які містять біогідролізовані частини, такі як біогідролізовані аміди, біогідролізовані складні ефіри, біогідролізовані карбамати, біогідролізовані карбонати, біогідролізовані уреїди й біогідролізовані фосфатні аналоги. Інші приклади проліків включають похідні сполуки формули I за даним винаходом, які містять частини -NO, -NO2, -ONO або -ΟΝО2. Проліки можуть бути отримані з використанням таких способів, як описані в посібниках Burger's Medicinal Chemistry and Drug Discovery, 172-178, 949-982 (Manfred E. Wolff 5th ed. 1995) і Design of Prodrugs (H. Bundgaard ed., Elselvier, New York 1985). Використовувані в даному описі й поки немає інших вказівок, терміни "біогідролізований амід", "біогідролізований складний ефір", "біогідролізований карбамат", "біогідролізований карбонат", "біогідролізований уреїд" і "біогідролізований фосфат" означають відповідно амід, складний ефір, карбамат, карбонат, уреїд або фосфат сполуки, який або: 1) не втручається в біологічну активність сполуки, але може додати цій сполуці переважних властивостей in vivo, таких як захоплення, тривалість дії або початок дії; або 2) є біологічно неактивним, але перетворюється in vivo у біологічно активну сполуку. Приклади біогідролізованих складних ефірів включають без обмеження нижчі складні алкілові ефіри, нижчі складні ацилоксіалкілові ефіри (такі як складні ацетоксиметиловий, ацетоксіетиловий, амінокарбонілоксиметиловий, півалоїлоксиметиловий і півалоїлоксиетиловий ефіри), лактонілові складні ефіри (такі як фталідиловий і тіофталідиловий складні ефіри), нижчі алкоксіацилоксіалкілові складні ефіри (такі як метоксикарбоніліoксиметиловий, етоксикарбонілоксіетиловий і ізопропоксикарбонілоксіетиловий складні ефіри), алкоксіалкілові складні ефіри, холінові складні ефіри й ациламіноалкілові складні ефіри (такі як ацетамідометилові складні ефіри). Приклади біогідролізованих амідів включають без обмеження нижчі алкіламіди, аміди α-амінокислот, алкоксіациламіди й алкіламіноалкілкарбоніламіди. Приклади біогідролізованих карбаматів включають без обмеження нижчі алкіламіни, заміщені етилендіаміни, амінокислоти, гідроксіалкіламіни, гетероциклічні й гетероароматичні аміни й поліефіраміни. Використовуваний у даному описі й поки немає інших вказівок, термін "стереомерно чиста" означає композицію, яка містить один стереоізомер сполуки й по суті не містить інші стереоізомери сполуки. Наприклад, стереомерно чиста композиція сполуки, що має один 21 UA 110964 C2 5 10 15 20 25 30 35 40 45 50 55 60 хіральний центр, буде по суті вільна від протилежного енантіомеру сполуки. Стереомерно чиста композиція сполуки, що має два хіральні центри, буде по суті вільна від інших діастереоізомерів сполуки. У певних варіантах здійснення, стереомерно чиста сполука містить більше ніж приблизно 80 % мас. одного стереоізомера сполуки і менше ніж приблизно 20 % мас. інших стереоізомерів сполуки, більш ніж приблизно 90 % мас. одного стереоізомера сполуки і менше ніж приблизно 10 % мас. інших стереоізомерів сполуки, більш ніж приблизно 95 % мас. одного стереоізомера сполуки і і менше ніж приблизно 5 % мас. інших стереоізомерів сполуки, або більш ніж приблизно 97 % мас. одного стереоізомера сполуки і менше ніж приблизно 3 % мас. інших стереоізомерів сполуки. Використовуваний у даному описі й поки немає інших вказівок, термін "стереомерно збагачена" означає композицію, яка містить більше ніж приблизно 60 % мас. одного стереоізомера сполуки, більше ніж приблизно 70 % мас. або більше ніж приблизно 80 % мас. одного стереоізомера сполуки. Використовуваний у даному описі й поки немає інших вказівок, термін "енантіомерно чиста" означає стереомерно чисту композицію сполуки, що має один хіральний центр. Аналогічно, термін "стереомерно збагачена" означає стереомерно збагачену композицію сполуки, що має один хіральний центр. Термін "приблизно" або "приблизно" означає прийнятну помилку для конкретної величини, що визначається середнім фахівцем у даній галузі, яка частково залежить від того, як вимірюється або визначається ця величина. У певних варіантах здійснення, термін "приблизно або "приблизно" означає в межах 1, 2, 3 або 4 стандартних відхилень. У певних варіантах здійснення, термін "приблизно" або "приблизно" означає в межах 50 %, 20 %, 15 %, 10 %, 9 %, 8 %, 7 %, 6 %, 5 %, 4 %, 3 %, 2 %, 1 %, 0,5 % або 0,05 % даної величини або діапазону. 5.2 Кінцеві точки клінічних випробувань для реєстрації як протиракового лікарського засобу "Загальне виживання" визначається як час від рандомізації до смерті з будь-якої причини, і воно вимірюється в популяції, яка включена в групу з початково передбачуваним способом лікування. Загальне виживання повинне оцінюватися в рандомізованих контрольованих дослідженнях. Демонстрація статистично значущого збільшення загального виживання може вважатися клінічно значущим, якщо профіль токсичності прийнятний, і цей показник часто підтримував реєстрацію нових лікарських засобів. Декілька кінцевих точок основані на оцінці пухлини. Ці кінцеві точки включають виживання без клінічно виражених ознак захворювання (DFS), об'єктивну частоту ефективності лікування (ORR), час до прогресування захворювання (TTP), виживання без прогресування захворювання (PFS) і час до виявлення неефективності лікування (TTF). Збір і аналіз даних по цих залежних від часу кінцевих точках оснований на непрямих оцінках, розрахунках і показниках (наприклад, вимірюваннях пухлин). У цілому, "виживання без клінічно виражених ознак захворювання" (DFS) визначається як час від рандомізації до рецидиву пухлини або до смерті з будь-якої причини. Хоча загальне виживання являє собою звичайну кінцеву точку для досліджень більшості ад'ювантних засобів, DFS може бути важливою кінцевою точкою в ситуаціях, коли виживання може продовжуватися, роблячи кінцеву точку виживання непрактичною. DFS може бути сурогатною точкою клінічної ефективності, або воно може бути прямим доказом клінічної ефективності. Це визначення основане на величині ефекту, його співвідношенні ризику-вигоди й виді патології. Визначення DFS може бути складним, особливо коли випадки смерті відзначаються без попередньої документації прогресування захворювання. Ці явища можуть оцінюватися в балах або як рецидиви захворювання, або як цензуровані явища. Хоча всі способи статистичного аналізу випадків смерті мають деякі обмеження, урахування усіх випадків смерті (випадків смерті від усіх причин) як рецидивів може мінімізувати погрішність. DFS може переоцінюватися при використанні цього визначення, зокрема, у пацієнтів, які вмирають після тривалого періоду без спостереження. Погрішність може вноситися, якщо частота відвідувань при тривалому спостереженні неоднакова в різних групах досліджуваних пацієнтів, або якщо випадки вибування з дослідження є не випадковими через токсичність. "Об'єктивна частота ефективності лікування" (ORR) визначається як частка пацієнтів зі зменшенням розміру пухлини на задану величину й протягом мінімального періоду часу. Тривалість ефективності лікування звичайно вимірюється від часу первинного прояву ефективності лікування до документованого прогресування пухлини. У цілому, FDA (Адміністрація харчових продуктів і лікарських засобів США) визначила ORR як суму випадків часткової ефективності лікування плюс випадків повної ефективності лікування. При такому способі визначення, ORR являє собою прямий показник протипухлинної активності лікарського засобу, яку можна оцінити в одногруповому дослідженні. Для підтвердження ефективності лікування, слід використовувати стандартизовані критерії, якщо вони доступні. Доцільними вважалися різноманітні критерії ефективності лікування (наприклад, критерії RECIST (критерії 22 UA 110964 C2 5 10 15 20 25 30 35 40 45 50 оцінки ефективності лікування при солідних пухлинах)) (Therasse et al., (2000) J Natl. Cancer Inst, 92:205-16). Значимість ORR оцінюється по її величині й тривалості, і процентній частці випадків повної ефективності лікування (відсутність виявлюваних доказів наявності пухлини). "Час до прогресування захворювання" (TTP) і "виживання без прогресування захворювання" (PFS) служили як первинні кінцеві точки для реєстрації лікарських засобів. TTP визначається як час від рандомізації до об'єктивного прогресування пухлини; TTP не включає випадки смерті. PFS визначається як час від рандомізації до об'єктивного прогресування пухлини або смерті. У порівнянні з TTP, PFS є переважним нормативною кінцевою точкою. PFS включає випадки смерті й, таким чином, може краще корелюватися із загальним виживанням. PFS допускає, що випадки смерті пацієнтів випадково пов'язані із прогресуванням пухлини. Однак у ситуаціях, коли більшість випадків смерті не пов'язані з раком, TTP може являти собою прийнятну кінцеву точку. Як кінцева точка для обґрунтування реєстрації лікарського засобу, PFS може відбивати ріст пухлини й оцінюватися перед визначенням сприятливого впливу на виживання. Його визначення не спотворюється наступним лікуванням. Для даного розміру зразка величина впливу на PFS може бути більше, ніж вплив на загальне виживання. Однак формальна валідація PFS як сурогату для виживання при багатьох різних існуючих злоякісних захворюваннях може бути важкою. Дані іноді недостатні для забезпечення можливості належної оцінки кореляції між впливами на виживання й PFS. Випробування способів лікування раку часто малі, і кількість доведених сприятливих ефектів на виживання існуючих лікарських засобів у цілому невелике. Роль PFS як кінцевої точки для обґрунтування реєстрації ліцензування варіюється при різних формах раку. Те, чи представляє поліпшення PFS безпосередній клінічний ефект або сурогат для клінічного ефекту, залежить від величини ефекту й ризикувигоди нового способу лікування, у порівнянні з доступними способами лікування. "Час до виявлення неефективності лікування" (TTF) визначається як складена кінцева точка, що вимірює час від рандомізації до припинення лікування з будь-якої причини, включаючи прогресування захворювання, токсичність лікування й смерть. TTF не рекомендується як нормативна кінцева точка для реєстрації лікарського засобу. TTF неадекватно диференціює ефективність від цих додаткових параметрів. Нормативна кінцева точка повинна зрозуміло відрізняти ефективність лікарського засобу від токсичності, припинення участі в клінічному випробуванні з причини, пов'язаної з пацієнтом або лікарем або непереносимістю пацієнтом випробуваного лікарського засобу. 5.3 Сполука Сполука, придатна для застосування в способах за даним винаходом, являє собою 3-(5аміно-2-метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діон, що має структурну формулу I: або його енантіомер або суміш енантіомерів; або його фармацевтично прийнятну сіль, сольват, гідрат, співкристал, клатрат або поліморф. Сполука формули I може бути отримана відповідно до способів, описаних в розділі "Приклади", у даному описі, або як описано в патенті США № 7635700, повністю включеному в даний опис шляхом посилання. Ця сполука може бути також синтезована відповідно до способів, очевидних для фахівців у даній галузі, на основі положень даного опису. Сполука формули I суттєво інгібує TNF-α, IL-1β і інші запальні цитокіни в стимульованих LPS (ліпополісахаридом) hPBMC (мононуклеарних клітинах периферичної крові людину) і в цільній крові людини. TNF-α являє собою запальний цитокін, продукований макрофагами й моноцитами, під час гострого запалення. TNF-α відповідальний за різноманітний діапазон явищ передачі сигналів усередині клітин. TNF-α може відігравати патологічну роль при раку. Без обмеження теорією, одним з біологічних ефектів, надаваних імуномодуляторною сполукою формули I, є зменшення синтезу TNF-α. Імуномодуляторна сполука формули I підсилює руйнування мРНК TNF-α. Сполука формули I також потужно інгібує IL-1β і стимулює IL-10 у цих умовах. Крім того, без обмеження теорією, сполука формули I є потужним костимулятором T клітин і збільшує клітинну проліферацію тісно залежним чином у відповідних умовах. У певних варіантах здійснення, без обмеження теорією, біологічні ефекти, надавані 23 UA 110964 C2 5 10 15 20 25 30 35 40 45 50 55 60 імуномодуляторною сполукою формули I, включають без обмеження антиангіогенні й імуномодулюючі ефекти. У певних варіантах здійснення, сполука формули I являє собою тверду речовину. У певних варіантах здійснення, сполука формули I є гідрованою. У певних варіантах здійснення, сполука формули I є сольватованою. У певних варіантах здійснення, сполука формули I є безводною. У певних варіантах здійснення, сполука формули I є негігроскопічною. У певних варіантах здійснення, тверда сполука формули I є аморфною. У певних варіантах здійснення, тверда сполука формули I є кристалічною. У певних варіантах здійснення, тверда сполука формули I презентована в кристалічній формі, описаній в попередній заявці на патент США № 61/451,806, поданій 11 березня 2011 року, яка повністю включена в даний опис шляхом посилання. Тверді форми сполуки формули I можуть бути отримані відповідно до способів, описаних в описі попередньої заявки на патент США № 61/451,806. Тверді форми можуть бути також отримані відповідно до інших способів, очевидних для фахівців у даній галузі. У певних варіантах здійснення, сполука формули I являє собою гідрохлорид 3-(5-аміно-2метил-4-оксо-4H-хіназолін-3-іл)піперидин-2,6-діону або його енантіомер або суміш енантіомерів; або його фармацевтично прийнятний сольват, гідрат, співкристал, клатрат або поліморф. У певних варіантах здійснення, гідрохлорид є твердим. У певних варіантах здійснення, гідрохлорид є безводним. У певних варіантах здійснення, гідрохлорид є негігроскопічним. У певних варіантах здійснення, гідрохлорид є аморфним. У певних варіантах здійснення, гідрохлорид є не гігроскопічним. У певних варіантах здійснення, гідрохлорид є аморфним. У певних варіантах здійснення, гідрохлорид є кристалічним. У певних варіантах здійснення, гідрохлорид представлений у кристалічній формі A. Гідрохлорид сполуки формули I і його тверді форми можуть бути отримані відповідно до способів, описаних в описі попередньої заявки на патент США № 61/451,806. Гідрохлорид і його тверді форми можуть бути також отримані відповідно до інших способів, очевидних для фахівців у даній галузі. Сполука формули I за даним винаходом містить один хіральний центр і може існувати у вигляді суміші енантіомерів, наприклад, рацемічної суміші. Даний опис включає застосування стереомерно чистих форм такої сполуки, а також застосування сумішей цих форм. Наприклад, суміші, що містять однакові або неоднакові кількості енантіомерів сполуки формули I за даним винаходом, можуть застосовуватися в способах і композиціях, описаних у даній заявці. Ці ізомери можуть бути асиметрично синтезовані або розділені з використанням стандартних технологій, таких як хіральні колонки або хіральні розділювальні агенти. Див., наприклад, публікації Jacques, J., et al., Enantiomers, Racemates and Resolutions (Wiley-Interscience, New York, 1981); Wilen, S. H., et al, Tetrahedron 33:2725 (1977); Eliel, E. I. Stereochemistry of Carbon Compounds (Mcgraw-hill, NY, 1962); і Wilen, S. H., Tables of Resolving Agents and Optical Resolutions p. 268 (E.L. Eliel, Ed., Univ. of Notre Dame Press, Notre Dame, IN, 1972). Слід зазначити, що якщо існує розбіжність між зображеною структурою й назвою, привласненою цій структурі, то перевага віддається зображеній структурі. Крім того, якщо стереохімія структури або частини структури не зазначена, наприклад, жирними або пунктирними лініями, то структуру або частину структури слід трактувати як таку, що як включає всі стереоізомери цієї структури. 5.4. Другі активні засоби Сполука за даним винаходом, наприклад, сполука формули I, або її енантіомер або суміш енантіомерів, або її фармацевтично прийнятна сіль, сольват, гідрат, співкристал, клатрат або поліморф може комбінуватися з однією або декількома іншими фармакологічно активними сполуками ("другими активними засобами") у способах і композиціях за даним винаходом. Уважається, що певні комбінації працюють синергічно при лікуванні конкретних типів раку й певних захворюваннях і станах, пов'язаних з небажаним ангіогенезом, або які характеризуються ним. Сполука формули I за даним винаходом може також працювати для полегшення побічних ефектів, пов'язаних з визначеними другими активними засобами, і деякі другі активні засоби можуть застосовуватися для полегшення побічних ефектів, пов'язаних зі сполукою формули I за даним винаходом. Один або декілька других активних інгредієнтів або засобів можуть застосовуватися в способах і композиціях за даним винаходом зі сполукою формули I за даним винаходом. Другі активні засоби можуть являти собою великі молекули (наприклад, білки) або дрібні молекули (наприклад, синтетичні, неорганічні, металоорганічні або органічні молекули). Приклади великомолекулярних активних засобів включають без обмеження гематопоетичні фактори росту, цитокіни й моноклональні й поліклональні антитіла. У певних варіантах 24 UA 110964 C2 5 10 15 20 25 30 35 40 45 50 55 60 здійснення, великомолекулярні активні засоби являють собою біологічні молекули, такі як штучно отримані білки, що природно зустрічаються. Білки, які зокрема можуть використовуватися в даному винаході, включають білки, які стимулюють виживання і/або проліферацію гематопоетичних клітин-попередників і імунологічно активних поетичних клітин in vitro або in vivo. Інші стимулюють ділення і диференціацію комітованих еритроїдних попередників у клітинах in vitro або in vivo. Конкретні білки включають без обмеження: інтерлейкіни, такі як IL-2 (включаючи рекомбінантний IL-II ("rIL2") і IL-2 вірусу віспи канарок), IL10, IL-12 і IL-18; інтерферони, такі як інтерферон альфа-2a, інтерферон альфа-2b, інтерферон альфа-n1, інтерферон альфа-n3, інтерферон бета-Ia і інтерферон гама-Ib; GM-CF (фактор, що утворює колонії гранулоцитів-макрофагів) і GM-CSF (фактор, що стимулює колонії гранулоцитівмакрофагів; і EPO (еритропоетин). Конкретні білки, які можуть застосовуватися в способах і композиціях за винаходом, включають без обмеження: філгастрим, який продається в США під торговельною назвою NEUPOGEN® (Amgen, Thousand Oaks, CA); сарграмостим, який продається в США під торговельною назвою LEUKINE® (Immunex, Seattle, WA); і рекомбінантний EPO, який продається в США під торговельною назвою EPGEN® (Amgen. Thousand Oaks, CA). Інгібітори рецепторів ActRII або інгібітори активіну-ActRII можуть використовуватися в способах і композиціях за даним винаходом. Рецептори ActRII включають інгібітори ActRIIA і інгібітори ActRII. Інгібітори рецепторів ActRII можуть являти собою поліпептиди, що містять зв'язуючі активін домени ActRII. У певних варіантах здійснення, зв'язуючий активін домен, що містить поліпептиди, зв'язані із частиною Fc антитіла (тобто, генерується кон'югат, що містить зв'язуючий активін домен, що містить поліпептид рецептора ActRII, і частину Fc антитіла). У певних варіантах здійснення, зв'язуючий активін домен зв'язаний із частиною Fc антитіла через лінкер, наприклад, пептидний лінкер. Приклади таких білків, які не є антитілом, вибраних для зв'язування активіну або ActRIIA, і способи для їхнього конструювання й відбору можна знайти в заявках на Міжнародні патенти WO/2002/088171, WO/2006/055689, WO/2002/032925, WO/2005/037989 і заявках на патенти США US 2003/0133939 і US 2005/0238646, кожна з яких повністю включена в даний опис шляхом посилання. Рекомбінантні й мутовані форми GM-CSF можуть бути отримані, як описано в патентах США №№ 5391485; 5393870 і 5229496, опис кожного з яких повністю включений в дану заявку шляхом посилання. Рекомбінантні й мутовані форми G-CSF (фактора, що стимулює колонії гранулоцитів) можуть бути отримані, як описано в патентах США №№ 4810643; 4999291; 5528823 і 5580755, опис кожного з яких повністю включений в дану заявку шляхом посилання. Даний опис включає використання нативних, які природно зустрічаються й рекомбінантних білків. Опис, крім того, включає мутанти й похідні (наприклад, модифіковані форми) білків, що природно зустрічаються, які проявляють in vivo щонайменше деяку фармакологічну активність білків, на яких вони основані. Приклади мутантів включають без обмеження білки, які мають один або кілька амінокислотних залишків, які відрізняються від відповідних залишків у формах білків, що природно зустрічаються. Терміном "мутанти" також охоплюються білки, які не мають вуглеводневої частини, яка звичайно присутня у їх формах, що природно зустрічаються (наприклад, негліколізованих формах). Приклади похідних включають без обмеження пегиловані похідні й злиті білки, такі як білки, утворені злиттям IgG1 або IgG3 з білком або активною частиною білка, що представляє інтерес. Див, наприклад, публікацію Penichet, M.L. and Morrison, S.L., J. Immunol. Methods 248:91-101 (2001). Антитіла, які можуть застосовуватися в комбінації зі сполукою формули I за даним винаходом, включають моноклональні й поліклональні антитіла. Приклади антитіл включають ® ® без обмеження трастузумаб (ГЕРЦЕПТИН ), ритуксимаб (РИТУКСАН ), бевацизумаб (АВАСТИН™), пертузумаб (OMN1TARG™), тоситумомаб (BEXXAR®), едреколомаб ® (ПАНОРЕКС ), панітумумаб і G250. Сполука формули I за даним винаходом може також комбінуватися або застосовуватися в комбінації з антитілами до TNF-α. Великомолекулярні активні засоби можуть уводитися у формі протиракових вакцин. Наприклад, вакцини, які секретують або викликають секрецію цитокінів, таких як IL-2, SCF, CXC14 (тромбоцитарний фактор 4), G-CSF і GM-CSF, можуть застосовуватися в способах, фармацевтичних композиціях і наборах за винаходом. Див., наприклад, публікацію Emens, L.A., et al, Curr. Opinion Mol. Ther. 3(1):77-84 (2001). Другі активні засоби, які являють собою дрібні молекули, також можуть застосовуватися для полегшення побічних ефектів, пов'язаних із уведенням сполуки формули I за даним винаходом. Однак уважається, що подібно до деяких великих молекул, вони здатні забезпечити синергічний ефект при введенні зі сполукою формули I (наприклад, перед нею, після неї або одночасно з нею). Приклади дрібномолекулярного другого активного засобу включають без обмеження 25 UA 110964 C2 5 10 15 20 25 30 35 40 45 50 55 60 протиракові засоби, антибіотики, імуносупресивні засоби й стероїди. Приклади протиракових засобів включають без обмеження: абраксан; ace-11; ацивіцин; акларубіцин; акодазол гідрохлорид; акронін; адозелесинальдеслейкін; алтретамін; амбоміцин; аметантрон ацетат; амрубіцин; амсакрин; анастрозол; антраміцин; аспрагіназу; асперлін; азацитидин; азетепа; азотоміцин; батимастат; бензодепа; бікалутамід; бісантрен гідрохлорид; біснафід димесилат: бізелесин; блеоміцин сульфат; бреквінар натрію; бропіримін; бусульфан; актиноміцин; калустерон; карацемід; карбетимер; карбоплатин; кармустин; карубіцин гідрохлорид; карзелічин; цедефінгол; целекоксиб (інгібітор COX-2); хлорамбуцил; циролеміцин; цисплатин; кладрибін; криснатол мезилат; циклофосфамід; цитарабін; дакарбазин; дактиноміцин; даунорубіцин гідрохлорид; децитабін; дексормаплатин; дезагуанін; дезагуанін мезилат; діазиквон; доцетаксел; доксорубіцин; доксорубіцин гідрохлорид; дролоксифен; дролоксифен цитрат; дромостанолон пропіонат; дуазоміцин; едатрексат; ефлорнітин гідрохлорид; елсамітруцин; енлоплатин; енпромат; епіпропідин; епірубіцин гідрохлорид; ербулозол; есорубіцин гідрохлорид; естрамустин; естрамустин фосфат натрію; етанідазол; етопозид; етопозид фосфат; етоприн; фадрозол гідрохлорид; фазарабин; фенретинід; флоксуридин; флударабін фосфат; фторурацил; флуроцитабін; фосквідон; форстриецин натрію; гемцитабін; гемцитабін гідрохлорид; герцептин; гідроксисечовину; ідарубіцин гідрохлорид; іфосфамід; ілмофозин; іпроплатин; іринотекан; іринотекан гідрохлорид; ланреотид ацетат; лапатиніб; летрозол; лейпролід ацетат; ліарозол гідрохлорид; лометрексол натрію; ломустин; лосоксантрон гідрохлорид; масопрокол; мейтансин; мехлоретамін гідрохлорид; мегестрол ацетат; меленгестрол ацетат; мелфалан; меногарил; меркаптопурин; метотрексат; метотрексат натрію; метоприн; метуредепа; мітиндомід; мітокарцин; мітокромін; мітогілін; мітомалцин; мітоміцин; мітоспер; мітотан; мітоксантрон гідрохлорид; мікофенолову кислоту; нокодазол; ногаламіцин; ормаплатин; оксисуран; паклітаксел; пегаспаргазу; пеліоміцин; пентамустин; пепломіцин сульфат; перфосфамід; піпоброман; піпосульфан; піроксантрон гідрохлорид; плікаміцин; пломестан; порфімер натрію; порфіроміцин; преднімустин; прокарбазин гідрохлорид; пуроміцин; уроміцин гідрохлорид; піразофурин; рибоприн; ромідепсин; сафінгол; сафінгол гідрохлорид; семустин; симптразен; спарфосат натрію; спарсоміцин; спірогерманій гідрохлорид; спіромустин; спіроплатин; терапевтичні засоби зі стовбурових клітин, такі як PDA-001; стрептонігрин; стрептозоцин; сулофенур; талісоміцин; текогалан натрію; таксотере; тегафур; телоксантрон гідрохлорид; темопорфін; теніпозид; тероксирон; тестолактон; тіаміприн; тіогуанін; тіотепа; тіазофурин; тирапазамін; тореміфен цитрат; трестолон ацетат; трицирибін фосфат; триметрексат; триметрексат глюкуронат; трипторелін; тубулозол гідрохлорид; урациліприт; уредепа; вапреотид; вертепорфин; синбластин сульфат; вінкристин сульфат; віндезин; віндезин сульфат; вінепідин сульфат; вінгліцинат сульфат; вінлейрозин сульфат; вінорелбін тартрат; вінросидин сульфат; вінзолідин сульфат; ворозол; зениплатин; зиностатин і зорубіцин гідрохлорид. Інші протиракові лікарські засоби включають без обмеження: 20-епі-1,25-дигідроксивітамін D3; 5-етинілурацил; абіратерон; акларубіцин; ацилфульвен; алеципенол; адозелезин; альдеслейкін; антагоністи ALL-TK; алтретамін; амбамустин; амідокс; аміфостин; амінолевулінову кислоту; амрубіцин; амсакрин; анагрелід; анастрозол; андрографолід; інгібітори ангіогенезу; антагоніст D; антагоніст G; антарелікс; анти-дорсалізуючий морфогенний білок-1; антиандроген, карцинома передміхурової залози; антиестроген; антинеопластон; антисмислові олігонуклеотиди; афідиколін гліцинат; модулятори генів апоптозу; регулятори апоптозу; апуринову кислоту; ara-CDP-DL-PTBA (1-бета-D-Арабінофуранозилцитозин-5'дифосфат-рац-1-S-октадецил-2-O-пальмітоїл-1-тіогліцерол); аргініндеаміназу; асулакрин; атаместан; атримустин; аксинастатин 1; аксинастатин 2; аксинастатин 3; азхасетрон; азатоксин; азатирозин; похідні бакатину III; баланол; батимастат; антагоністи онкопротеїну BCR/ABL; бензохлорини; бензоїлстауроспорин; похідні бета-лактаму; бета-алетин; бетакламіцин B; бетулінову кислоту; інгібітор b-FGF (основного фактора росту фібробластів); бікалутамід; бісантрен; бісазиридинілспермін; біснафід; бістратен A; бізелесин; брефлат; бропіримін; будотитан; бутіонін сульфоксимін; кальципотриол; калфостин C; похідні камптотецину; капецитабін; карбоксамід-аміно-триазол; карбоксіамідотриазол; CaRest M3; CARN 700; отриманий із хряща інгібітор; карзелезин; інгібітори казеїнкінази (ICOS); кастаноспермін; цекропін B; цетрорелікс; хлорини; хлорохіноксалін сульфнамід; цикапрост; цисіпорфірин; кладрибін; аналоги кломіфену; клотримазол; колісміцин A; колісміцин B; комбретастатин A4; аналог комбретастатину; конагенін; крамбесцидин 816; криснатол; криптофіцин 8; похідні криптофіцину A; курацин A; циклопентантрахінони; циклоплатам; ципеміцин; цитарабін окфосфат; цитолітичний фактор; цитостатин; дакліксимаб; децитабін; дегідродидемнін B; деслорелін; дексаметазон; дексифосфамід; дексразоксан; дексверапаміл; діазиквон; дидемнін 26 UA 110964 C2 5 10 15 20 25 30 35 40 45 50 55 60 B; дидокс; діетилнорспермін; дигідро-5-азацитидин; дигідротаксол, 9-; діоксаміцин; дифеніл спіромустин; доцетаксел; докозанол; доласетрон; доксифлуридин; доксорубіцин; дролоксифен; дронабінол; дуокарміцин SA; ебселен; екомустин; еделфозин; едреколомаб; ефлорнітин; елемен; емітефур; епірубіцин; епристерид; аналог естрамустину; агоністи естрогенів; антагоністи естрогенів; етанідазол; етопозид фосфат; ексземестан; фадрозол; фазарабін; фенретинід; філграстим; фінастерид; флавопіридол; флезеластин; флуастерон; флударабін; фтордауноруніцин гідрохлорид; форфенімекс; форместан; фостриецин; фотемустин; гадоліній тексафірин; нітрат галію; галоцитабін; ганірелікс; інгібітори желатинази; гемцитабін; інгібітори глутатіону; гепсульфам; герегулін; гексаметилен бісацетамід; гіперицин; ібандронову кислоту; ® ідарубіцин; ідоксифен; ідрамантон; ілмофозин; іломастат; іматиніб (наприклад, ГЛІВЕК ), іміквімод; імуностимулюючі пептиди; інгібітор рецепторів інсуліноподібного фактора росту-1; агоністи інтерферону; інтерферони; інтерлейкіни; йобенгуан; йоддоксорубіцин; 4-іпомеанол; іроплакт; ірсогладин; ізобенгазол; ізогомогалікондрин B; ітасетрон; джасплакінолід; кагалалід F; ламелларин-N триацетат; ланреотид; лейнаміцин; ленограстим; лентинан сульфат; лептолстатин; летрозол; інгібуючий лейкоз фактор; лейкоцитарний альфа-інтерферон; лейпролід+естроген+прогестерон; лейпрорелін; левамізол; ліарозол; аналог лінійного поліаміну; ліпофільний дисахаридний пептид; ліпофильні сполуки платини; лісоклінамід 7; лобаплатин; ломбрицин; лометрексол; лонідамін; лосоксантрон; локсорибін; луртотекан; лютецію тексафірин; лізофілін; літичні пептиди; мейтансин; маностатин A; маримастат; масопрокол; маспін; інгібітори матрилізину; інгібітори матричної металопротеїнази; меногарил; мербарон; метерелін; метіониназу; метоклопрамід; інгібітор MIF (фактора, інгібуючого міграцію); міфепристон; мілтефозин; міримостим; мітогуазон; мітолактол; аналоги мітоміцину; мітонафід; мітотоксин-фактор росту фібробластів-сапорин; мітоксантрон; мофаротен; молграмостим; ербитукс, людський хоріонічний гонадотропін; монофосфорилоліпід A+sk (стрептокіназа) мікобактеріальної клітинної стінки; мопідамол; іпритний протираковий засіб; мікапероксид B; екстракт мікобактеріальної клітинної стінки; міріапрон; N-ацетилдиналін; N-заміщені бензаміди; нафарелін; нагрестип; налоксон+пентазоцин; напавін; нафтерпін; нартограстим; недаплатин; неморубіцин; неридронову кислоту; нілутамід; нізаміцин; модулятори оксиду азоту; 6 нітроксидний антиоксидант; нітрулін; облімерсен (GENASENSE®); О -бензилгуанін; октреотид; окиценон; олігонуклеотиди; онапристон; ондансетрон; орацин; пероральний індуктор цитокінів; ормаплатин; осатерон; оксаліплатин; оксауноміцин; паклітаксел; аналоги паклітакселу; похідні паклітакселу; палауамін; пальмітоїлризоксин; памідронову кислоту; панакситриол; паноміфен; парабактин; пазеліптин; пегаспаргазу; пелдезин; натрію пентозану полісульфат; пентостатин; пентрозол; перфлуброн; перфосфамід; периліловий спирт; феназиноміцин; фенілацетат; інгібітори фосфатази; піцибаніл; пілокарпін гідрохлорид; пірарубіцин; піритрексим; плацетин A; плацетин B; інгібітор активатора плазміногену; комплекс платини; сполуки платини; комплекс платини-триаміну; порфімер натрію; порфіроміцин; преднізон; пропіл біс-акридон; простагландин J2; інгібітори протеасоми; імуномодулятор на основі білка A; інгібітор протеїнкінази C; інгібітори протеїнкінази C, мікроалгал; інгібітори протеїн-тирозин-фосфатази; інгібітори пурин-нуклеозид-фосфорилази; пурпурини; піразолоакридин; кон'югат піридоксилованого гемоглобіну й поліоксіетилену; антагоністи raf (рекомбінантного активованого фактора); ралтитрексед; рамосетрон; інгібітори фарнезил протеїн ras трансферази; інгібітори ras; інгібітор ras-GAP (гліцеральдегідфосфата); деметилований ретеліптин; етидронат ренію Re 186; ризоксин: рибозими; ретинамід RII; рогітукин; ромуртид; роквінимекс; рубігінон B1; рубоксил; сафінгол; сейнтопин; SarCNU; саркофітол A; сарграмостим; міметики Sdi 1; семустин; зв'язаний зі старінням інгібітор 1, смислові олігонуклеотиди; інгібітори передачі сигналів; сизофіран; собузоксан; боркаптат натрію; фенілацетат натрію; сольверол; білок, що зв'язує соматомедин; сонермин; спарфосову кислоту; спікаміцин D; спіромустин; спленопентин; спонгістатин 1; скваламін; стипіамід; інгібітори стромелізину; сульфінозин; надактивний антагоніст вазоактивного кишкового пептиду; сурадисту; сурамін; свейнсонін; талімустин; тамоксифен метийодид; тауромустин; тазаротен; текогалан натрію; тегафур; телурапірилій; інгібітори теломерази: темопорфін; теніпозид; тетрахлордекаоксид; тетразомін; талібластин; тіокоралін; тромбопоетин; міметик тромбопоетину; тималфазин; агоніст рецепторів тимопоетину; тимотринан; тиреостимулюючий гормон; етилетіопурпурин олова; тирапазамін; титаноцен біхлорид; топсентин; тореміфен; інгібітори трансляції; третиноїн; триацетилуридин; трицирибін; триметрексат; трипторелін; тропісетрон; туростерид; інгібітори тирозинкінази; тирфостини; інгібітори UBC; убенімекс; інгібуючий фактор росту, що походить з урогенітального синуса; антагоністи рецепторів урокінази; вапреотид; варіолін B; веларезол; верамін; вердини; вертепорфін; вінорелбін; вінксалтин; вітаксин; ворозол; занотерон; зеніплатин; зиласкорб і зиностатин стималамер. 27 UA 110964 C2 ® 5 10 15 20 25 30 35 40 45 50 55 60 Певні другі активні засоби включають без обмеження облімерсен (ГЕНАСЕНС ), ремікад, ® доцетаксел, целекоксиб, мелфалан, дексаметазон (ДЕКАДРОН ), стероїди, гемцитабін, цисплатин, темозоломід, етопозид, циклофосфамід, темодар, карбоплатин, прокарбазин, гліадел, тамоксифен, топотекан, метотрексат, ARISA®, таксол, таксотере, фторурацил, лейковорин, іринотекан, кселода, CPT-11, інтерферон альфа, пегилований інтерферон альфа (наприклад, ПЕГ ІНТРОН-A), капецитабін, цисплатин, тіотепа, флударабін, карбоплатин, ліпосомальний даунорубіцин, цитарабін, доксетаксол, пацилітаксел, вінбластин, IL-2, GM-CSF, дакарбазин, вінорелбін, золедронову кислоту, пальмітронат, біаксин, бусульфан, преднізон, ® бісфосфонат, миш'яковий триоксид, вінкристин, доксорубіцин (ДОКСИЛ ), паклітаксел, ® ганцикловір, адріаміцин, естрамустину натрію фосфат (ЕМЦИТ ), суліндак і етопозид. 5.5 Біомаркери Даний винахід стосується способів, пов'язаних із застосуванням мРНК або білків, як біомаркерів для встановлення ефективності лікування раку. Рівні мРНК або білка можуть використовуватися для визначення того, чи ймовірний успіх застосування конкретного засобу при лікуванні певного типу раку, наприклад, неходжкінської лімфоми. Біологічний маркер або "біомаркер" являє собою речовину, виявлення якої вказує на певний біологічний стан, такий як, наприклад, присутність раку. У деяких варіантах здійснення, біомаркери можуть визначатися або окремо, або вміст декількох біомаркерів може вимірюватися одночасно. У деяких варіантах здійснення, "біомаркер" указує на зміну рівня експресії мРНК, що може корелюватися з ризиком або прогресуванням захворювання, або зі сприйнятливістю захворювання до даного лікування. У деяких варіантах здійснення, біомаркер являє собою нуклеїнову кислоту, таку як мРНК або кДНК. У додаткових варіантах здійснення "біомаркер" указує на зміну рівня експресії поліпептиду або білка, що може корелюватися з ризиком, сприйнятливістю до лікування або прогресуванням захворювання. У деяких варіантах здійснення, біомаркер може являти собою поліпептид або білок або їх фрагмент. Відносний рівень певних білків може визначатися способами, відомими в даній галузі. Наприклад, можуть використовуватися способи на осові антитіл, такі як імуноблотинг, ферментний імуносорбентний аналіз (ELISA) або інші способи. 5.6 Способи лікування й попередження В одному варіанті здійснення, даний винахід стосується способу лікування й попередження раку, який включає введення пацієнту сполуки за даним винаходом, наприклад, сполуки формули I, або її енантіомеру або суміші енантіомерів, або її фармацевтично прийнятної солі, сольвату, гідрату, співкристалу, клатрату або поліморфу. В іншому варіанті здійснення, даний винахід стосується способу ведення пацієнтів, які страждають на рак, який включає введення пацієнту сполуки за даним винаходом, наприклад, сполуки формули I або її енантіомеру, або суміші її енантіомерів, або її фармацевтично прийнятної солі, сольвату, гідрату, співкристалу, клатрату або поліморфу. Даний винахід стосується способів лікування або ведення пацієнтів з лімфомою, зокрема, неходжкінською лімфомою. У деяких варіантах здійснення, даний винахід стосується способів лікування або ведення пацієнтів з неходжкінською лімфомою (NHL), включаючи без обмеження дифузну великоклітинну B-клітинну лімфому (DLBCL), з використанням прогностичних факторів. Даний винахід також стосується способів лікування пацієнтів, які раніше одержували лікування із приводу раку, але в яких стандартні способи лікування неефективні, а також тих, які раніше не одержували лікування. Винахід також включає способи лікування пацієнтів, незалежно від віку пацієнта, хоча деякі захворювання або розлади частіше зустрічаються в певних вікових групах. Винахід, крім того, включає способи лікування пацієнтів, які були піддані хірургічному лікуванню зі спробою лікування розглянутого захворювання або стану, а також тих, які не піддалися хірургічному лікуванню. Через те, що в пацієнтів, які страждають на рак, є неоднорідні клінічні прояви й варійовані клінічні результати, лікування, яке призначається пацієнту, може варіюватися залежно від прогнозу в пацієнта або пацієнтки. Досвідчений клініцист зможе легко визначити без непотрібного експериментування певні вторинні засоби, типи хірургічного втручання й типи не медикаментозного стандартного лікування, які можуть ефективно застосовуватися для лікування окремого пацієнта, що страждає на рак. Використовуваний у даному описі термін "рак" включає без обмеження солідні пухлини й гематологічні пухлини. Термін "рак" стосується захворювання шкірних тканин, органів, крові й судин, включаючи без обмеження ракові ураження сечового міхура, кісток, крові, мозку, молочної залози, шийки матки, грудної клітки, ободової кишки, ендометрія, ока, голови, нирок, печінки, лімфовузлів, легенів, ротової порожнини, шиї, яєчників, підшлункової залози, передміхурової залози, прямої кишки, шлунку, сім'яників, горла й матки. Певні форми раку 28
ДивитисяДодаткова інформація
Назва патенту англійськоюMethods of treating cancer using 3-(5-amino-2-methyl-4-oxo-4h-quinazolin-3-yl)-piperidine-2,6-dione
Автори англійськоюMuller, George, W., Schafer, Peter, H., Man, Hon-Wah, Zhang, Ling-Hua, Gandhi, Anita, Chopra, Rajesh
Автори російськоюМюллер Джордж В., Шэфер Питер Х., Ман Хон-Вах, Чжан Лин-Хуа, Гандхи Анита, Чопра Раджеш
МПК / Мітки
МПК: A61P 35/00, A61K 31/517
Мітки: раку, 3-(5-аміно-2-метил-4-оксо-4н-хіназолін-3-іл)піперидин-2,6-діону, застосування, лікування
Код посилання
<a href="https://ua.patents.su/74-110964-zastosuvannya-3-5-amino-2-metil-4-okso-4n-khinazolin-3-ilpiperidin-26-dionu-dlya-likuvannya-raku.html" target="_blank" rel="follow" title="База патентів України">Застосування 3-(5-аміно-2-метил-4-оксо-4н-хіназолін-3-іл)піперидин-2,6-діону для лікування раку</a>