Тетрагідроімідазо[1,5-d][1,4]оксазепінова похідна
Номер патенту: 114950
Опубліковано: 28.08.2017
Автори: Такахаші Йошінорі, Браунтон Алан, Такаіші Мамору, Шібугучі Томоюкі, Сато Нобухіро, Сасакі Такео, Мотокі Такафумі
Формула / Реферат
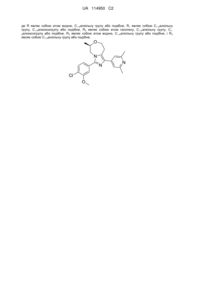
1. Сполука, представлена наступною формулою (І), або її фармацевтично прийнятна сіль приєднання кислоти:
 , (I)
, (I)
де R являє собою атом водню або С1-6алкільну групу, необов'язково заміщену 1-3 атомами фтору, де, якщо R являє собою атом водню,
R1 являє собою атом хлору, атом брому, трифторметильну групу, етильну групу, трифторметоксигрупу, метоксигрупу, заміщену фенільною групою, метоксигрупу, заміщену С3-8циклоалкільною групою, етоксигрупу, необов'язково заміщену 1-3 атомами фтору, або С3-8циклоалкілоксигрупу,
R2 являє собою атом фтору, атом хлору, метильну групу, необов'язково заміщену 2-3 атомами фтору, метоксигрупу, необов'язково заміщену 1-3 атомами фтору, або етоксигрупу, необов'язково заміщену 1-3 атомами фтору,
R3 являє собою атом водню або метильну групу, та
R4 являє собою атом фтору або метильну групу, необов'язково заміщену 1-3 атомами фтору, або, якщо R являє собою С1-6алкільну групу, необов'язково заміщену 1-3 атомами фтору,
R1 являє собою атом водню, атом галогену, С1-6алкільну групу, необов'язково заміщену 1-3 атомами фтору, С1-6алкоксигрупу, необов'язково заміщену 1-3 замісниками, вибраними з атома фтору та С3-8циклоалкільної групи, С3-8циклоалкілоксигрупу або 4-6-членну гетероциклоалкілоксигрупу,
R2 являє собою атом водню, ціаногрупу, атом галогену, С1-6алкільну групу, необов'язково заміщену 1-3 замісниками, вибраними з атома фтору і гідроксильної групи, або С1-6алкоксигрупу, необов'язково заміщену 1-3 замісниками, вибраними з атома фтору, С3-8циклоалкільної групи і 4-6-членної гетероциклоалкільної групи,
R3 являє собою атом водню або С1-6алкільну групу, та
R4 являє собою С1-6алкільну групу, необов'язково заміщену 1-3 замісниками, вибраними з атома фтору та гідроксильної групи, або С1-6алкоксигрупу.
2. Сполука або її фармацевтично прийнятна сіль приєднання кислоти за п. 1, де
R являє собою С1-6алкільну групу, необов'язково заміщену 1-3 атомами фтору,
R1 являє собою атом водню, атом галогену, С1-6алкільну групу, необов'язково заміщену 1-3 атомами фтору, С1-6алкоксигрупу, необов'язково заміщену 1-3 замісниками, вибраними з атома фтору та С3-8циклоалкільної групи, С3-8циклоалкілоксигрупу або 4-6-членну гетероциклоалкілоксигрупу,
R2 являє собою атом водню, ціаногрупу, атом галогену, С1-6алкільну групу, необов'язково заміщену 1-3 замісниками, вибраними з атома фтору та гідроксильної групи, або С1-6алкоксигрупу, необов'язково заміщену 1-3 замісниками, вибраними з атома фтору, С3-8циклоалкільної групи та 4-6-членної гетероциклоалкільної групи,
R3 являє собою атом водню або С1-6алкільну групу, та
R4 являє собою С1-6алкільну групу, необов'язково заміщену 1-3 замісниками, вибраними з атома фтору та гідроксильної групи, або С1-6алкоксигрупу.
3. Сполука або її фармацевтично прийнятна сіль приєднання кислоти за п. 2, де R являє собою метильну групу, етильну групу, фторметильну групу або дифторметильну групу.
4. Сполука або її фармацевтично прийнятна сіль приєднання кислоти за п. 3,
де R1 являє собою атом водню, атом фтору, атом хлору, метильну групу, фторметильну групу, дифторметильну групу, трифторметильну групу, етильну групу, 1,1-дифторетильну групу, метоксигрупу, фторметоксигрупу, дифторметоксигрупу, трифторметоксигрупу, етоксигрупу, 2-фторетоксигрупу, 2-пропілоксигрупу, циклопропілметоксигрупу, циклопропілоксигрупу або (оксетан-3-іл)оксигрупу.
5. Сполука або її фармацевтично прийнятна сіль приєднання кислоти за п. 4,
де R2 являє собою атом водню, ціаногрупу, атом фтору, атом хлору, метильну групу, фторметильну групу, дифторметильну групу, трифторметильну групу, гідроксиметильну групу, етильну групу, метоксигрупу, фторметоксигрупу, дифторметоксигрупу, трифторметоксигрупу, етоксигрупу, 2-фторетоксигрупу, 2-пропілоксигрупу, циклопропілметоксигрупу, циклобутилметоксигрупу або (тетрагідро-2Н-піран-4-іл)метоксигрупу.
6. Сполука або її фармацевтично прийнятна сіль приєднання кислоти за п. 5,
де R3 являє собою атом водню або метильну групу.
7. Сполука або її фармацевтично прийнятна сіль приєднання кислоти за п. 6, де R4 являє собою метильну групу, фторметильну групу, дифторметильну групу, гідроксиметильну групу або метоксигрупу.
8. Сполука, вибрана з наступних сполук або їх фармацевтично прийнятних солей приєднання кислоти:
(R)-3-(4-хлор-3-метоксифеніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін,
(R)-1-(2,6-диметилпіридин-4-іл)-3-(3-метокси-4-(трифторметил)феніл)-6-метил-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін,
(R)-6-метил-3-(3-метил-4-(трифторметокси)феніл)-1-(2-метилпіридин-4-іл)-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін,
(R)-3-(4-(дифторметокси)-3-метилфеніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін,
(R)-3-(4-(дифторметокси)-3-метилфеніл)-6-метил-1-(2-метилпіридин-4-іл)-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін,
(S)-1-(2,6-диметилпіридин-4-іл)-6-(фторметил)-3-(3-метокси-4-(трифторметокси)феніл)-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін,
(S)-6-(фторметил)-3-(3-метокси-4-(трифторметокси)феніл)-1-(2-метилпіридин-4-іл)-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін,
(R)-3-(3-хлор-4-циклопропоксифеніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін,
(R)-3-(4-циклопропокси-3-метилфеніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін,
(R)-3-(3-хлор-4-(дифторметокси)феніл)-6-метил-1-(2-метилпіридин-4-іл)-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін,
(S)-3-(4-циклопропокси-3-метилфеніл)-1-(2,6-диметилпіридин-4-іл)-6-(фторметил)-5,6,8,9-тетрагідроімідазо[1,5-d][l,4]оксазепін,
(R)-3-(3-метокси-4-(трифторметокси)феніл)-6-метил-1-(2-метилпіридин-4-іл)-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін,
(R)-1-(2,6-диметилпіридин-4-іл)-3-(3-метокси-4-(трифторметокси)феніл)-6-метил-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін,
(S)-3-(4-(дифторметокси)-3-метилфеніл)-1-(2,6-диметилпіридин-4-іл)-6-(фторметил)-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін,
(S)-1-(2,6-диметилпіридин-4-іл)-6-(фторметил)-3-(3-метокси-4-(трифторметил)феніл)-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін,
(R)-3-(3-хлор-4-(дифторметокси)феніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9-тетрагідроімідазо[1,5-d][l,4]оксазепін,
(R)-3-(3-хлор-4-метоксифеніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін,
(R)-3-(3-хлор-4-етоксифеніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін,
(R)-3-(3-хлор-4-ізопропоксифеніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін,
(S)-3-(3-хлор-4-метоксифеніл)-1-(2,6-диметилпіридин-4-іл)-6-(фторметил)-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін,
(S)-3-(3-хлор-4-етоксифеніл)-1-(2,6-диметилпіридин-4-іл)-6-(фторметил)-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін,
(S)-3-(3-хлор-4-ізопропоксифеніл)-1-(2,6-диметилпіридин-4-іл)-6-(фтopмeтил)-5,6,8,9-тeтpaгiдpoiмiдaзo[l,5-d][l,4]oкcaзeпiн,
(R)-3-(3-(фторметил)-4-(трифторметокси)феніл)-6-метил-1-(2-метилпіридин-4-іл)-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін,
(S)-3-(4-(дифторметокси)-3-метилфеніл)-6-(фторметил)-1-(2-метилпіридин-4-іл)-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін та
(S)-6-(фторметил)-3-(3-метокси-4-(трифторметил)феніл)-1-(2-метилпіридин-4-іл)-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін,
(R)-3-(4-хлор-3-фторфеніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін,
(R)-3-(3,4-дихлорфеніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін,
(R)-3-(4-хлор-3-(дифторметил)феніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін та
(S)-3-(3,4-дихлорфеніл)-1-(2,6-диметилпіридин-4-іл)-6-(фторметил)-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін.
9. Сполука або її фармацевтично прийнятна сіль приєднання кислоти за п. 8, яка являє собою (R)-1-(2,6-диметилпіридин-4-іл)-3-(3-метокси-4-(трифторметил)феніл)-6-метил-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін, представлений наступною формулою:
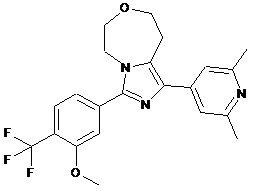 ,
,
або його фармацевтично прийнятну сіль приєднання кислоти.
10. Сполука або її фармацевтично прийнятна сіль приєднання кислоти за п. 8, яка являє собою (R)-3-(3-хлор-4-(дифторметокси)феніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін, представлений наступною формулою:
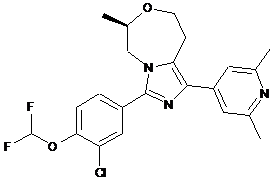 ,
,
або його фармацевтично прийнятну сіль приєднання кислоти.
11. Сполука або її фармацевтично прийнятна сіль приєднання кислоти за п. 8, яка являє собою (R)-3-(3-хлор-4-циклопропоксифеніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін, представлений наступною формулою:
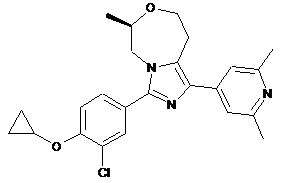 ,
,
або його фармацевтично прийнятну сіль приєднання кислоти.
12. Сполука або її фармацевтично прийнятна сіль приєднання кислоти за п. 8, яка являє собою (S)-3-(3-хлор-4-(дифторметокси)феніл)-1-(2,6-диметилпіридин-4-іл)-6-(фторметил)-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін, представлений наступною формулою:
 ,
,
або його фармацевтично прийнятну сіль приєднання кислоти.
13. Сполука або її фармацевтично прийнятна сіль приєднання кислоти за п. 8, яка являє собою (R)-3-(4-хлор-3-фторфеніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін, представлений наступною формулою:
 ,
,
або його фармацевтично прийнятну сіль приєднання кислоти.
14. Сполука або її фармацевтично прийнятна сіль приєднання кислоти за п. 8, яка являє собою (R)-3-(3,4-дихлорфеніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін, представлений наступною формулою:
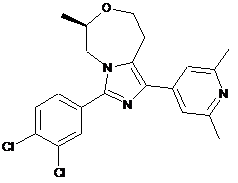 ,
,
або його фармацевтично прийнятну сіль приєднання кислоти.
15. Сполука або її фармацевтично прийнятна сіль приєднання кислоти за п. 8, яка являє собою (R)-3-(4-хлор-3-(дифторметил)феніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін, представлений наступною формулою:
 ,
,
або його фармацевтично прийнятну сіль приєднання кислоти.
16. Сполука або її фармацевтично прийнятна сіль приєднання кислоти за п. 8, яка являє собою (S)-3-(3,4-дихлорфеніл)-1-(2,6-диметилпіридин-4-іл)-6-(фторметил)-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін, представлений наступною формулою:
 ,
,
або його фармацевтично прийнятну сіль приєднання кислоти.
17. Фармацевтична композиція, яка містить сполуку або фармацевтично прийнятну сіль приєднання кислоти за будь-яким з пп. 1-16 та один або декілька фармацевтично прийнятних допоміжних наповнювачів.
18. Фармацевтична композиція за п. 17 для лікування захворювання або симптому, при яких антагоністична дія відносно метаботропного рецептора глутамату групи II є ефективною.
19. Фармацевтична композиція за п. 18, яка відрізняється тим, що захворюванням або симптомом є хвороба Альцгеймера.
Текст
Реферат: Сполука, представлена наступною формулою (І), або її фармацевтично прийнятна сіль діє як антагоніст mGluR2 і застосовується як терапевтичний засіб при неврологічних порушеннях, пов'язаних з порушенням обміну глутамату, та при захворюваннях, пов'язаних з mGluR2, таких як хвороба Альцгеймера: R O N R4 N R1 N R2 R3 , (I) UA 114950 C2 (12) UA 114950 C2 де R являє собою атом водню, С1-6алкільну групу або подібне, R1 являє собою С1-6алкільну групу, С1-6алкоксигрупу або подібне, R2 являє собою атом галогену, С1-6алкільну групу, С16алкоксигрупу або подібне, R3 являє собою атом водню, С1-6алкільну групу або подібне, і R4 являє собою С1-6алкільну групу або подібне. UA 114950 C2 5 10 15 20 25 30 35 40 45 50 Галузь винаходу Даний винахід відноситься до тетрагідроімідазо[1,5-d][1,4]оксазепінової похідної, що характеризується антагоністичною дією щодо метаботропного рецептора глутамату групи II, або до її фармацевтично прийнятної солі приєднання кислоти. Даний винахід також відноситься до фармацевтичної композиції, яка містить сполуку в якості активного інгредієнта. Рівень техніки винаходу Відомо, що глутамінова кислота є одним з головних збудливих нейротрансмітерів, що функціонують для регулювання розширених функцій пам’яті, навчання тощо, в центральній нервовій системі ссавця. Рецептори глутамату приблизно класифікують на два типи, тобто: іонотропні рецептори глутамату (рецептори iGlu) та метаботропні рецептори глутамату (рецептори mGlu), з'єднані з G-білком (див. непатентний документ 1). Рецептори iGlu класифікують, виходячи з типів їх агоністів, на три типи, тобто: рецептори Nметил-D-аспартату (NMDA), рецептори α-аміно-3-гідрокси-5-метил-4-ізоксазолпропіонової кислоти (AMPA) та каїнатні рецептори. З іншого боку, рецептори mGlu мають 8 підтипів (mGluR1-8) і їх класифікують, виходячи з системи передачі сигналу, з якою вони об'єднані, та фармакологічних характеристик, на групу I (mGluR1, mGluR5), групу II (mGluR2, mGluR3) та групу III (mGluR4, mGluR6, mGluR7 і mGluR8). mGluR групи II і групи III експресуються як ауторецептор або гетерорецептор, головним чином, в нервовому закінченні, для того щоб + пригнічувати аденілатциклазу за допомогою Gi-білка та регулювати активність специфічного K 2+ або Ca -каналу (див. непатентний документ 2). Антагоністи mGluR групи II, серед цих рецепторів глутамату, характеризуються дією, пов'язаною з поліпшенням когнітивної функції, у тваринних моделях, а також характеризуються антидепресивною дією та седативною дією, та, таким чином, передбачається, що антагоністи mGluR групи II є ефективними в якості нового підсилювача когнітивної функції або антидепресанту (див. непатентні документи 3, 4 і 5). Список використаної літератури Непатентна література [Непатентна література 1] Science, 258, 597-603, 1992 [Непатентна література 2] Trends Pharmacol. Sci., 14, 13 (1993) Непатентна література 3] Neuropharmacol., 46 (7), 907-917 (2004) Непатентна література 4] Pharmacol. Therapeutics, 104(3), 233-244 (2004) [Непатентна література 5] Neuropharmacol., 66, 40-52 (2013) СТИСЛИЙ ОПИС ВИНАХОДУ Метою даного винаходу є забезпечення тетрагідроімідазо[1,5-d][1,4]оксазепінової похідної або її фармацевтично прийнятної солі, що характеризуються антагоністичною дією щодо метаботропних рецепторів глутамату групи II, та фармацевтичної композиції, яка містить їх. Даний винахід відноситься до пунктів [1] - [29], представлених нижче. [1] Сполука, представлена наступною формулою (I), або її фармацевтично прийнятна сіль приєднання кислоти: (I), де R являє собою атом водню або C1-6алкільну групу, необов’язково заміщену 1-3 атомами фтору, де якщо R являє собою атом водню, то R1 являє собою атом хлору, атом брому, трифторметильну групу, етильну групу, трифторметоксигрупу, метоксигрупу, заміщену фенільною групою, метоксигрупу, заміщену C38циклоалкільною групою, етоксигрупу, необов’язково заміщену 1-3 атомами фтору, або C38циклоалкілоксигрупу, R2 являє собою атом фтору, атом хлору, метильну групу, необов’язково заміщену 2-3 атомами фтору, метоксигрупу, необов’язково заміщену 1-3 атомами фтору, або етоксигрупу, необов’язково заміщену 1-3 атомами фтору, R3 являє собою атом водню або метильну групу, та R4 являє собою атом фтору або метильну групу, необов’язково заміщену 1-3 атомами фтору, або 1 UA 114950 C2 5 10 15 20 25 30 35 40 45 50 55 60 якщо R являє собою C1-6алкільну групу, необов’язково заміщену 1-3 атомами фтору, то R1 являє собою атом водню, атом галогену, C1-6алкільну групу, необов’язково заміщену 13 атомами фтору, C1-6алкоксигрупу, необов’язково заміщену 1-3 замісниками, вибраними з атома фтору та C3-8циклоалкільної групи, C3-8циклоалкілоксигрупу або 4-6-членну гетероциклоалкілоксигрупу, R2 являє собою атом водню, ціаногрупу, атом галогену, C1-6алкільну групу, необов’язково заміщену 1-3 замісниками, вибраними з атома фтору та гідроксильної групи, або C16алкоксигрупу, необов’язково заміщену 1-3 замісниками, вибраними з атома фтору, C38циклоалкільної групи та 4-6-членної гетероциклоалкільної групи, R3 являє собою атом водню або C1-6алкільну групу, та R4 являє собою C1-6алкільну групу, необов’язково заміщену 1-3 замісниками, вибраними з атома фтору та гідроксильної групи, або C1-6алкоксигрупу. [2] Сполука або її фармацевтично прийнятна сіль приєднання кислоти за пунктом [1], де R являє собою C1-6алкільну групу, необов’язково заміщену 1-3 атомами фтору, R1 являє собою атом водню, атом галогену, C1-6алкільну групу, необов’язково заміщену 1-3 атомами фтору, C1-6алкоксигрупу, необов’язково заміщену 1-3 замісниками, вибраними з атома фтору та C3-8циклоалкільної групи, C3-8циклоалкілоксигрупу або 4-6-членну гетероциклоалкілоксигрупу, R2 являє собою атом водню, ціаногрупу, атом галогену, C1-6алкільну групу, необов’язково заміщену 1-3 замісниками, вибраними з атома фтору та гідроксильної групи, або C16алкоксигрупу, необов’язково заміщену 1-3 замісниками, вибраними з атома фтору, C 38циклоалкільної групи та 4-6-членної гетероциклоалкільної групи, R3 являє собою атом водню або C1-6алкільну групу, та R4 являє собою C1-6алкільну групу, необов’язково заміщену 1-3 замісниками, вибраними з атома фтору та гідроксильної групи, або C1-6алкоксигрупу. [3] Сполука або її фармацевтично прийнятна сіль приєднання кислоти за пунктом [2], де R являє собою метильну групу, етильну групу, фторметильну групу або дифторметильну групу. [4] Сполука або її фармацевтично прийнятна сіль приєднання кислоти за пунктом [3], де R1 являє собою атом водню, атом фтору, атом хлору, метильну групу, фторметильну групу, дифторметильну групу, трифторметильну групу, етильну групу, 1,1-дифторетильну групу, метоксигрупу, фторметоксигрупу, дифторметоксигрупу, трифторметоксигрупу, етоксигрупу, 2фторетоксигрупу, 2-пропілоксигрупу, циклопропілметоксигрупу, циклопропілоксигрупу або (оксетан-3-іл)оксигрупу. [5] Сполука або її фармацевтично прийнятна сіль приєднання кислоти за пунктом [4], де R2 являє собою атом водню, ціаногрупу, атом фтору, атом хлору, метильну групу, фторметильну групу, дифторметильну групу, трифторметильну групу, гідроксиметильну групу, етильну групу, метоксигрупу, фторметоксигрупу, дифторметоксигрупу, трифторметоксигрупу, етоксигрупу, 2-фторетоксигрупу, 2-пропілоксигрупу, циклопропілметоксигрупу, циклобутилметоксигрупу або (тетрагідро-2H-піран-4-іл)метоксигрупу. [6] Сполука або її фармацевтично прийнятна сіль приєднання кислоти за пунктом [5], де R3 являє собою атом водню або метильну групу. [7] Сполука або її фармацевтично прийнятна сіль приєднання кислоти за пунктом [6], де R4 являє собою метильну групу, фторметильну групу, дифторметильну групу, гідроксиметильну групу або метоксигрупу. [8] Сполука або її фармацевтично прийнятна сіль приєднання кислоти за пунктом [2], де R являє собою метильну групу, необов’язково заміщену 1-2 атомами фтору, R1 являє собою атом водню, атом хлору, метильну групу, необов’язково заміщену 1-3 атомами фтору, етильну групу, C1-6алкоксигрупу, необов’язково заміщену 1-3 атомами фтору, або C3-6циклоалкілоксигрупу, R2 являє собою ціаногрупу, атом хлору, C1-6алкільну групу, необов’язково заміщену 1-3 атомами фтору, або C1-6алкоксигрупу, необов’язково заміщену 1-3 атомами фтору, R3 являє собою атом водню або метильну групу, та R4 являє собою метильну групу, необов’язково заміщену 1-3 атомами фтору. [9] Сполука або її фармацевтично прийнятна сіль приєднання кислоти за пунктом [2], де R являє собою метильну групу, необов’язково заміщену 1-2 атомами фтору, R1 являє собою атом водню, атом галогену, C1-6алкільну групу, необов’язково заміщену 1-3 атомами фтору, C1-6алкоксигрупу, необов’язково заміщену 1-3 атомами фтору, або C36циклоалкілоксигрупу, R2 являє собою ціаногрупу, атом галогену, C1-6алкільну групу, необов’язково заміщену 1-3 атомами фтору, або C1-6алкоксигрупу, необов’язково заміщену 1-3 атомами фтору, 2 UA 114950 C2 5 10 15 20 25 30 35 40 45 50 55 R3 являє собою метильну групу, та R4 являє собою метильну групу, необов’язково заміщену 1-3 атомами фтору, за умови, що, якщо R1 являє собою незаміщену метоксигрупу, R 2 не є атомом фтору. [10] Сполука, вибрана з наступних сполук або їх фармацевтично прийнятних солей приєднання кислоти: (R)-3-(4-хлор-3-метоксифеніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (R)-1-(2,6-диметилпіридин-4-іл)-3-(3-метокси-4-(трифторметил)феніл)-6-метил-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (R)-6-метил-3-(3-метил-4-(трифторметокси)феніл)-1-(2-метилпіридин-4-іл)-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (R)-3-(4-(дифторметокси)-3-метилфеніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (R)-3-(4-(дифторметокси)-3-метилфеніл)-6-метил-1-(2-метилпіридин-4-іл)-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (S)-1-(2,6-диметилпіридин-4-іл)-6-(фторметил)-3-(3-метокси-4-(трифторметокси)феніл)5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін, (S)-6-(фторметил)-3-(3-метокси-4-(трифторметокси)феніл)-1-(2-метилпіридин-4-іл)-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (R)-3-(3-хлор-4-циклопропоксифеніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (R)-3-(4-циклопропокси-3-метилфеніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (R)-3-(3-хлор-4-(дифторметокси)феніл)-6-метил-1-(2-метилпіридин-4-іл)-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (S)-3-(4-циклопропокси-3-метилфеніл)-1-(2,6-диметилпіридин-4-іл)-6-(фторметил)-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (R)-3-(3-метокси-4-(трифторметокси)феніл)-6-метил-1-(2-метилпіридин-4-іл)-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (R)-1-(2,6-диметилпіридин-4-іл)-3-(3-метокси-4-(трифторметокси)феніл)-6-метил-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (S)-3-(4-(дифторметокси)-3-метилфеніл)-1-(2,6-диметилпіридин-4-іл)-6-(фторметил)-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (S)-1-(2,6-диметилпіридин-4-іл)-6-(фторметил)-3-(3-метокси-4-(трифторметил)феніл)-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (R)-3-(3-хлор-4-(дифторметокси)феніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (R)-3-(3-хлор-4-метоксифеніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (R)-3-(3-хлор-4-етоксифеніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (R)-3-(3-хлор-4-ізопропоксифеніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (S)-3-(3-хлор-4-метоксифеніл)-1-(2,6-диметилпіридин-4-іл)-6-(фторметил)-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (S)-3-(3-хлор-4-етоксифеніл)-1-(2,6-диметилпіридин-4-іл)-6-(фторметил)-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (S)-3-(3-хлор-4-ізопропоксифеніл)-1-(2,6-диметилпіридин-4-іл)-6-(фторметил)-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (R)-3-(3-(фторметил)-4-(трифторметокси)феніл)-6-метил-1-(2-метилпіридин-4-іл)-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (S)-3-(4-(дифторметокси)-3-метилфеніл)-6-(фторметил)-1-(2-метилпіридин-4-іл)-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін та (S)-6-(фторметил)-3-(3-метокси-4-(трифторметил)феніл)-1-(2-метилпіридин-4-іл)-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін. [11] (R)-3-(4-хлор-3-метоксифеніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, представлений наступною формулою: 3 UA 114950 C2 , або його фармацевтично прийнятна сіль приєднання кислоти. [12] (R)-1-(2,6-диметилпіридин-4-іл)-3-(3-метокси-4-(трифторметил)феніл)-6-метил-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, представлений наступною формулою: 5 10 15 20 , або його фармацевтично прийнятна сіль приєднання кислоти. [13] (R)-3-(3-метокси-4-(трифторметокси)феніл)-6-метил-1-(2-метилпіридин-4-іл)-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, представлений наступною формулою: , або його фармацевтично прийнятна сіль приєднання кислоти. [14] (R)-3-(4-(дифторметокси)-3-метилфеніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, представлений наступною формулою: , або його фармацевтично прийнятна сіль приєднання кислоти. [15] (R)-3-(3-хлор-4-(дифторметокси)феніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, представлений наступною формулою: , або його фармацевтично прийнятна сіль приєднання кислоти. [16] (S)-3-(4-(дифторметокси)-3-метилфеніл)-1-(2,6-диметилпіридин-4-іл)-6-(фторметил)5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін, представлений наступною формулою: , або його фармацевтично прийнятна сіль приєднання кислоти. [17] (S)-1-(2,6-диметилпіридин-4-іл)-6-(фторметил)-3-(3-метокси-4-(трифторметил)феніл)5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін, представлений наступною формулою: 4 UA 114950 C2 5 10 15 20 25 30 35 40 45 50 55 , або його фармацевтично прийнятна сіль приєднання кислоти. [18] Фармацевтична композиція, яка містить сполуки або фармацевтично прийнятну сіль приєднання кислоти за будь-яким з пунктів [1] - [17] та один або декілька фармацевтично прийнятних допоміжних засобів. [19] Фармацевтична композиція за пунктом [18] для лікування захворювання або симптому, за яких антагоністична дія щодо метаботропного рецептора глутамату групи II є ефективною. [20] Фармацевтична композиція за пунктом [19], де захворюванням або симптомом є хвороба Альцгеймера. [21] Спосіб лікування захворювання або симптому, за яких ефективною є антагоністична дія щодо метаботропного рецептора глутамату групи II, який включаєвведення сполуки або фармацевтично прийнятної солі приєднання кислоти за будь-яким із пунктів [1] - [17] суб`єкту, який потребує цього. [22] Спосіб лікування за пунктом [21], де захворюванням або симптомом є хвороба Альцгеймера. [23] Сполука або фармацевтично прийнятна сіль приєднання кислоти за будь-яким із пунктів [1] - [17] для застосування при лікуванні захворювання або симптому, за яких антагоністична дія щодо метаботропного рецептора глутамату групи II є ефективною. [24] Сполука або фармацевтично прийнятна сіль приєднання кислоти за пунктом [23], де захворюванням або симптомом є хвороба Альцгеймера. [25] Застосування сполуки або фармацевтично прийнятної солі приєднання кислоти за будьяким із пунктів [1] - [17] при одержанні фармацевтичної композиції для лікування захворювання або симптому, за яких антагоністична дія щодо метаботропного рецептора глутамату групи II є ефективною. [26] Застосування за пунктом [25], де захворюванням або симптомом є хвороба Альцгеймера. [27] Сполука або фармацевтично прийнятна сіль приєднання кислоти за будь-яким із пунктів [1] - [17] для застосування в якості активного інгредієнта фармацевтичної композиції. [28] Сполука або фармацевтично прийнятна сіль приєднання кислоти за пунктом [27], де фармацевтичною композицією є фармацевтична композиція для лікування захворювання або симптому, за яких антагоністична дія щодо метаботропного рецептора глутамату групи II є ефективною. [29] Сполука або фармацевтично прийнятна сіль приєднання кислоти за пунктом [27], де захворюванням або симптомом є хвороба Альцгеймера. КОРИСНІ ЕФЕКТИ ВИНАХОДУ Сполука за даним винаходом, представлена формулою (I) (що також далі називається тетрагідроімідазо[1,5-d][1,4]оксазепіновою похідною) або її фармацевтично прийнятна сіль приєднання кислоти характеризуються антагоністичною дією щодо метаботропних рецепторів глутамату групи II. Таким чином, тетрагідроімідазо[1,5-d][1,4]оксазепінова похідна за даним винаходом або її фармацевтично прийнятна сіль приєднання кислоти має потенціал застосування в якості терапевтичного засобу проти захворювань або симптомів, за яких ефективною є антагоністична дія щодо метаботропних рецепторів глутамату групи II, наприклад, хвороби Альцгеймера. ОПИС ПЕРЕВАЖНИХ ВАРІАНТІВ ЗДІЙСНЕННЯ Далі будуть пояснюватися значення символів, термінів тощо, використовуваних у даному документі, і даний винахід буде детально описаний. У даному документі структурна формула сполуки для зручності може представляти конкретний ізомер, але сполука за даним винаходом охоплює ізомери, такі як усі геометричні ізомери, структурно утворені зі сполуки, оптичні ізомери на основі асиметричного вуглецю, стереоізомери та таутомери, а також суміші цих ізомерів. Сполука не обмежується наведеною для зручності формулою та може являти собою будь-що з ізомерів та сумішей. Відповідно, сполука за даним винаходом може містити асиметричний атом вуглецю в своїй молекулі та існувати у вигляді оптично активної речовини та рацемічної форми. Однак даний винахід не обмежується цим, а охоплює всі випадки. Між іншим, будь-що з ізомерів, рацемічних сполук та сумішей ізомерів може демонструвати більш сильну активність, ніж інші ізомери. Більш того, 5 UA 114950 C2 5 10 15 20 25 30 35 40 45 50 55 60 можуть існувати поліморфізми кристалів, які також не обмежують даний винахід, і сполука може являти собою будь-що з монокристалів або їх сумішей і може бути гідратом або сольватом, а також ангідридом, усі з яких охоплюються обсягом формули винаходу в даному документі. Даний винахід передбачає мічену ізотопом сполуку формули (I). Мічена ізотопом сполука еквівалентна сполуці формули (I) за винятком того, що один або декілька атомів заміщені атомом(ами) з атомною масою або масовим числом, відмінним від таких, що зазвичай зустрічаються в природі. Приклади ізотопу, який може бути вбудований в сполуку за даним винаходом, включає ізотопи водню, вуглецю, азоту, кисню, фтору, хлору, фосфору, сірки та 2 3 11 14 13 15 18 32 35 123 125 йоду, такі як H, H, C, C, N, O, F, P, S, I та I. Сполука за даним винаходом, яка містить будь-який з вищезгаданих ізотопів та/або інший ізотоп, а також її фармацевтично прийнятна похідна (така як сіль) охоплюється обсягом формули винаходу в даному документі. Мічену ізотопом сполуку за даним винаходом, 3 14 наприклад, таку, в яку включені радіоактивні ізотопи, такі як H та/або C, можна застосовувати 3 14 в аналізах розподілення в тканях лікарського засобу та/або субстрату. Ізотопи H та C вважаються застосовуваними, оскільки ці ізотопи можна легко одержувати та виявляти. Ізотопи 11 18 125 C та F вважаються застосовуваними для PET (позитрон-емісійної томографії); ізотоп I вважається застосовуваним для SPECT (однофотонної емісійної комп`ютерної томографії); та усі ці ізотопи є застосовуваними для візуалізації головного мозку. Заміна на більш важкий 2 ізотоп, такий як H, забезпечує, за рахунок його більш високої метаболічної стабільності, деякі види переваг при лікуванні, наприклад, продовження періоду напівжиття in vivo або зниження необхідної дози, і, таким чином, вважається застосовуваною за конкретних обставин. Мічену ізотопом сполуку формули (I) за даним винаходом можна одержувати аналогічним чином, з використанням легкодоступного міченого ізотопом реагента замість неміченого ізотопом реагента та шляхом виконання процедур, розкритих в схемах та/або прикладах, описаних нижче. У даному документі "атом галогену" означає атом фтору, атом хлору, атом брому, атом йоду тощо, і переважно є атомом фтору або атомом хлору. "C1-6алкільна група" означає лінійну або розгалужену алкільну групу з 1-6 атомами вуглецю, та конкретні приклади включають метильну групу, етильну групу, н-пропільну групу, ізопропільну групу, н-бутильну групу, ізобутильну групу, трет-бутильну групу, н-пентильну групу, ізопентильну групу, неопентильну групу, н-гексильну групу, 1-метилпропільну групу, 1,2диметилпропільну групу, 1-етилпропільну групу, 1-метил-2-етилпропільну групу, 1-етил-2метилпропільну групу, 1,1,2-триметилпропільну групу, 1-метилбутильну групу, 2-метилбутильну групу, 1,1-диметилбутильну групу, 2,2-диметилбутильну групу, 2-етилбутильну групу, 1,3диметилбутильну групу, 2-метилпентильну групу та 3-метилпентильну групу, а більш переважні приклади включають метильну групу, етильну групу та н-пропільну групу. "C1-6алкоксигрупа" означає оксигрупу, зв’язану з "C1-6алкільною групою", і конкретні приклади включають метоксигрупу, етоксигрупу, 1-пропілоксигрупу, 2-пропілоксигрупу, 2-метил-1пропілоксигрупу, 2-метил-2-пропілоксигрупу, 1-бутилоксигрупу, 2-бутилоксигрупу, 1пентилоксигрупу, 2-пентилоксигрупу, 3-пентилоксигрупу, 2-метил-1-бутилоксигрупу, 3-метил-1бутилоксигрупу, 2-метил-2-бутилоксигрупу, 3-метил-2-бутилоксигрупу, 2,2-диметил-1пропілоксигрупу, 1-гексилоксигрупу, 2-гексилоксигрупу, 3-гексилоксигрупу, 2-метил-1пентилоксигрупу, 3-метил-1-пентилоксигрупу, 4-метил-1-пентилоксигрупу, 2-метил-2пентилоксигрупу, 3-метил-2-пентилоксигрупу, 4-метил-2-пентилоксигрупу, 2-метил-3пентилоксигрупу, 3-метил-3-пентилоксигрупу, 2,3-диметил-1-бутилоксигрупу, 3,3-диметил-1бутилоксигрупу, 2,2-диметил-1-бутилоксигрупу, 2-етил-1-бутилоксигрупу, 3,3-диметил-2бутилоксигрупу і 2,3-диметил-2-бутилоксигрупу, а переважні приклади включають метоксигрупу, етоксигрупу та 1-пропілоксигрупу. "C3-8циклоалкільна група" означає циклічну алкільну групу з 3-8 атомами вуглецю, і конкретні приклади включають циклопропільну групу, циклобутильну групу, циклопентильну групу, циклогексильну групу, циклогептильну групу та циклооктильну групу. "C1-6алкільна група, необов’язково заміщена 1-3 атомами фтору" означає незаміщену "C16алкільну групу" або "C1-6алкільну групу", в якій 1-3 атоми водню заміщені атомом фтору. Конкретні приклади C1-6алкільної групи, заміщеної 1-3 атомами фтору, включають фторметильну групу, 1-фторетильну групу, 2-фторетильну групу, 3-фторпропільну групу, дифторметильну групу, 1,1-дифторетильну групу, 2,2-дифторетильну групу, трифторметильну групу та 2,2,2-трифторетильну групу. "C1-6алкоксигрупа, необов’язково заміщена 1-3 замісниками, вибраними з атома фтору та C3циклоалкільної групи" означає незаміщену "C1-6алкоксигрупу" або "C1-6алкоксигрупу", в якій 1-3 8 атоми водню заміщені атомом фтору або C3-8циклоалкільною групою. Конкретні приклади C1 6 UA 114950 C2 6алкоксигрупи, 5 10 15 20 25 30 35 40 45 50 заміщеної одним або декількома атомами фтору, включають фторметоксигрупу, 1-фторетоксигрупу, 2-фторетоксигрупу, 3-фторпропілоксигрупу, дифторметоксигрупу, 1,1дифторетоксигрупу, 2,2-дифторетоксигрупу, трифторметоксигрупу та 2,2,2-трифторетоксигрупу. Конкретні приклади C1-6алкоксигрупи, заміщеної C3-8циклоалкільною групою, включають циклопропілметоксигрупу, циклобутилметоксигрупу, циклопентилметоксигрупу, циклогексилметоксигрупу, циклопропілетоксигрупу, циклобутилетоксигрупу, циклопентилетоксигрупу та циклогексилетоксигрупу. "C3-8циклоалкілоксигрупа" означає оксигрупу, зв’язану з "C3-8циклоалкільною групою", і конкретні приклади включають циклопропілоксигрупу, циклобутилоксигрупу, циклопентилоксигрупу, циклогексилоксигрупу, циклогептилоксигрупу та циклооктилоксигрупу. "4-6-Членна гетероциклоалкільна група" означає 4-6-членну кільцеву групу, яка містить один або декілька гетероатомів азоту, кисню, сірки тощо, і конкретні приклади включають 3азетидинільну групу, 1-метил-3-азетидинільну групу, 3-піролідинільну групу, 1-метил-3піролідинільну групу, 1-метил-3-піперидинільну групу, 1-метил-4-піперидинільну групу, 3оксетанільну групу, 3-тетрагідрофурильну групу, 3-тетрагідропіранільну групу, 4тетрагідропіранільну групу, 3-тетрагідротієнільну групу та 4-тетрагідротіопіранільну групу. "4-6-Членна гетероциклоалкілоксигрупа" означає оксигрупу, зв’язану з "4-6-членною гетероциклоалкільною групою", та конкретні приклади включають 3-азетидинілоксигрупу, 1метил-3-азетидинілоксигрупу, 3-піролідинілоксигрупу, 1-метил-3-піролідинілоксигрупу, 1-метил3-піперидинілоксигрупу, 1-метил-4-піперидинілоксигрупу, 3-оксетанілоксигрупу, 3тетрагідрофурилоксигрупу, 3-тетрагідропіранілоксигрупу, 4-тетрагідропіранілоксигрупу, 3тетрагідротієнілоксигрупу та 4-тетрагідротіопіранілоксигрупу. Тетрагідроімідазо[1,5-d][1,4]оксазепінова похідна формули (I) за даним винаходом може мати форму фармацевтично прийнятної солі приєднання кислоти. Конкретні приклади фармацевтично прийнятної солі приєднання кислоти включають солі неорганічних кислот (такі як сульфат, нітрат, перхлорат, фосфат, карбонат, бікарбонат, гідрофторид, гідрохлорид, гідробромід і гідройодид), органічні карбоксилати (такі як ацетат, оксалат, малеат, тартрат, фумарат і цитрат), органічні сульфонати (такі як метансульфонат, трифторметансульфонат, етансульфонат, бензолсульфонат, толуолсульфонат і камфорсульфонат), а також солі амінокислот (такі як аспартат і глутамат). Варіант здійснення даного винаходу передбачає сполуку, представлену наступною формулою (I), або її фармацевтично прийнятну сіль приєднання кислоти: (I), де R, R1, R2, R3 і R4 мають такі ж значенння, що і в пункті [1] вище. Переважний варіант здійснення даного винаходу передбачає тетрагідроімідазо[1,5d][1,4]оксазепінову похідну або її фармацевтично прийнятну сіль приєднання кислоти, в яких, якщо R являє собою атом водню в формулі (I), то R1 являє собою атом хлору, атом брому, трифторметильну групу, етильну групу, трифторметоксигрупу, метильну групу, заміщену фенільною групою, метоксигрупу, заміщену C3-8циклоалкільною групою, етоксигрупу, необов’язково заміщену 1-3 атомами фтору, або C3-8циклоалкілоксигрупу; R2 являє собою атом фтору, атом хлору, метильну групу, необов’язково заміщену 2-3 атомами фтору, метоксигрупу, необов`язково заміщену 1-3 атомами фтору, або етоксигрупу, необов’язково заміщену 1-3 атомами фтору; R3 являє собою атом водню або метильну групу; а R 4 являє собою атом фтору або метильну групу, необов’язково заміщену 1-3 атомами фтору. Інший переважний варіант здійснення даного винаходу передбачає тетрагідроімідазо[1,5d][1,4]оксазепінову похідну або її фармацевтично прийнятну сіль приєднання кислоти, в яких, якщо R являє собою C1-6алкільну групу, необов’язково заміщену 1-3 атомами фтору в формулі (I), то R1 являє собою атом водню, атом галогену, C1-6алкільну групу, необов’язково заміщену 13 атомами фтору, C1-6алкоксигрупу, необов`язково заміщену 1-3 замісниками, вибраними з атома фтору та C3-8циклоалкільної групи, C3-8циклоалкілоксигрупу або 4-6-членну гетероциклоалкілоксигрупу; R2 являє собою атом водню, ціаногрупу, атом галогену, C1-6алкільну групу, необов`язково заміщену 1-3 замісниками, вибраними з атома фтору та гідроксильної групи, або C1-6алкоксигрупу, необов`язково заміщену 1-3 замісниками, вибраними з атома 7 UA 114950 C2 5 10 15 20 25 30 35 40 45 50 55 фтору, C3-8циклоалкільної групи та 4-6-членної гетероциклоалкільної групи; R3 являє собою атом водню або C1-6алкільну групу; а R4 являє собою C1-6алкільну групу, необов`язково заміщену 1-3 замісниками, вибраними з атома фтору та гідроксильної групи, або C16алкоксигрупу. В формулі (I) R переважно являє собою метильну групу, етильну групу, фторметильну групу або дифторметильну групу; R1 переважно являє собою атом водню, атом фтору, атом хлору, метильну групу, фторметильну групу, дифторметильну групу, трифторметильну групу, етильну групу, 1,1-дифторетильну групу, метоксигрупу, фторметоксигрупу, дифторметоксигрупу, трифторметоксигрупу, етоксигрупу, 2-фторетоксигрупу, 2-пропілоксигрупу, циклопропілметоксигрупу, циклопропілоксигрупу або (оксетан-3-іл)оксигрупу; R2 переважно являє собою атом водню, ціаногрупу, атом фтору, атом хлору, метильну групу, фторметильну групу, дифторметильну групу, трифторметильну групу, гідроксиметильну групу, етильну групу, метоксигрупу, фторметоксигрупу, дифторметоксигрупу, трифторметоксигрупу, етоксигрупу, 2фторетоксигрупу,2-пропілоксигрупу, циклопропілметоксигрупу, циклобутилметоксигрупу або (тетрагідро-2H-піран-4-іл)метоксигрупу; R3 переважно являє собою атом водню або метильну групу; а R4 переважно являє собою метильну групу, фторметильну групу, дифторметильну групу, гідроксиметильну групу або метоксигрупу. У формулі (I) переважна комбінація R, R1, R2, R3 і R4 є наступною: R являє собою метильну групу, необов’язково заміщену 1-2 атомами фтору; R1 являє собою атом водню, атом галогену, C1-6алкільну групу, необов’язково заміщену 1-3 атомами фтору, C1-6алкоксигрупу, необов’язково заміщену 1-3 атомами фтору, або C3-6циклоалкілоксигрупу; R2 являє собою ціаногрупу, атом галогену, C1-6алкільну групу, необов’язково заміщену 1-3 атомами фтору, або C1-6алкоксигрупу, необов’язково заміщену 1-3 атомами фтору; R3 являє собою метильну групу; R 4 являє собою метильну групу, необов’язково заміщену 1-3 атомами фтору, за умови, що, якщо R1 являє собою незаміщену метоксигрупу, то R2 не є атомом фтору. Зокрема, тетрагідроімідазо[1,5-d][1,4]оксазепінова похідна або її фармацевтично прийнятна сіль приєднання кислоти згідно з даним винаходом переважно вибрані з наступних сполук: (R)-3-(4-хлор-3-метоксифеніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (R)-1-(2,6-диметилпіридин-4-іл)-3-(3-метокси-4-(трифторметил)феніл)-6-метил-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (R)-6-метил-3-(3-метил-4-(трифторметокси)феніл)-1-(2-метилпіридин-4-іл)-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (R)-3-(4-(дифторметокси)-3-метилфеніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (R)-3-(4-(дифторметокси)-3-метилфеніл)-6-метил-1-(2-метилпіридин-4-іл)-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (S)-1-(2,6-диметилпіридин-4-іл)-6-(фторметил)-3-(3-метокси-4-(трифторметокси)феніл)5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін, (S)-6-(фторметил)-3-(3-метокси-4-(трифторметокси)феніл)-1-(2-метилпіридин-4-іл)-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (R)-3-(3-хлор-4-циклопропоксифеніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (R)-3-(4-циклопропокси-3-метилфеніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (R)-3-(3-хлор-4-(дифторметокси)феніл)-6-метил-1-(2-метилпіридин-4-іл)-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (S)-3-(4-циклопропокси-3-метилфеніл)-1-(2,6-диметилпіридин-4-іл)-6-(фторметил)-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (R)-3-(3-метокси-4-(трифторметокси)феніл)-6-метил-1-(2-метилпіридин-4-іл)-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (R)-1-(2,6-диметилпіридин-4-іл)-3-(3-метокси-4-(трифторметокси)феніл)-6-метил-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (S)-3-(4-(дифторметокси)-3-метилфеніл)-1-(2,6-диметилпіридин-4-іл)-6-(фторметил)-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (S)-1-(2,6-диметилпіридин-4-іл)-6-(фторметил)-3-(3-метокси-4-(трифторметил)феніл)-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (R)-3-(3-хлор-4-(дифторметокси)феніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, 8 UA 114950 C2 5 10 15 20 25 30 (R)-3-(3-хлор-4-метоксифеніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (R)-3-(3-хлор-4-етоксифеніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (R)-3-(3-хлор-4-ізопропоксифеніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (S)-3-(3-хлор-4-метоксифеніл)-1-(2,6-диметилпіридин-4-іл)-6-(фторметил)-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (S)-3-(3-хлор-4-етоксифеніл)-1-(2,6-диметилпіридин-4-іл)-6-(фторметил)-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (S)-3-(3-хлор-4-ізопропоксифеніл)-1-(2,6-диметилпіридин-4-іл)-6-(фторметил)-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (R)-3-(3-(фторметил)-4-(трифторметокси)феніл)-6-метил-1-(2-метилпіридин-4-іл)-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, (S)-3-(4-(дифторметокси)-3-метилфеніл)-6-(фторметил)-1-(2-метилпіридин-4-іл)-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін або (S)-6-(фторметил)-3-(3-метокси-4-(трифторметил)феніл)-1-(2-метилпіридин-4-іл)-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін. Більш переважними прикладами тетрагідроімідазо[1,5-d][1,4]оксазепінових похідних або їх фармацевтично прийнятних солей приєднання кислоти є (R)-3-(4-хлор-3-метоксифеніл)-1-(2,6диметилпіридин-4-іл)-6-метил-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін, представлений наступною формулою: , або його фармацевтично прийнятна сіль приєднання кислоти, (R)-1-(2,6-диметилпіридин-4-іл)-3-(3-метокси-4-(трифторметил)феніл)-6-метил-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, представлений наступною формулою: , або його фармацевтично прийнятна сіль приєднання кислоти, (R)-3-(3-метокси-4-(трифторметокси)феніл)-6-метил-1-(2-метилпіридин-4-іл)-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, представлений наступною формулою: , або його фармацевтично прийнятна сільприєднання кислоти, (R)-3-(4-(дифторметокси)-3-метилфеніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, представлений наступною формулою: 35 , або його фармацевтично прийнятна сіль приєднання кислоти, (R)-3-(3-хлор-4-(дифторметокси)феніл)-1-(2,6-диметилпіридин-4-іл)-6-метил-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, представлений наступною формулою: 9 UA 114950 C2 , або його фармацевтично прийнятна сіль приєднання кислоти, (S)-3-(4-(дифторметокси)-3-метилфеніл)-1-(2,6-диметилпіридин-4-іл)-6-(фторметил)-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, представлений наступною формулою: 5 10 15 20 25 30 35 , або його фармацевтично прийнятна сіль приєднання кислоти та (S)-1-(2,6-диметилпіридин-4-іл)-6-(фторметил)-3-(3-метокси-4-(трифторметил)феніл)-5,6,8,9тетрагідроімідазо[1,5-d][1,4]оксазепін, представлений наступною формулою: , або його фармацевтично прийнятна сіль приєднання кислоти. Далі буде описаний спосіб одержання сполуки, представленої формулою (I) (що далі називається сполукою (I), при цьому вираз подібним чином використовується для інших сполук, представлених іншими формулами), за даним винаходом або її фармацевтично прийнятної солі приєднання кислоти. Схема 1 Сполука (I) (де R, R1, R2, R3 і R4 мають такі ж значення, як визначено вище) може бути одержана згідно зі схемою 1, наприклад, за допомогою реакції Судзукі-Міяура сполуки (II) зі сполукою (III). Реакція Судзукі-Міяура може бути здійснена шляхом нагрівання сполуки (II) та сполуки (III) в розчиннику в присутності, наприклад, паладієвого каталізатора та основи, причому ліганд, що містить фосфор, додають за необхідності. В якості паладієвого каталізатора можна використовувати, наприклад, тетракіс(трифенілфосфін)паладій(0), паладію(II) ацетат, Pd2DBA3 або (A-taPhos)2PdCl2. В якості основи можна використовувати, наприклад, калію фосфат, натрію гідроксид, калію гідроксид, барію гідроксид, натрію карбонат або цезію карбонат. Крім того, в якості ліганду, що містить фосфор, можна використовувати, наприклад, трифенілфосфін, бутил-ді(1-адамантил)фосфін або 2-дициклогексилфосфіно-2',4',6'триізопропілбіфеніл. Розчинник, використовуваний в реакції, особливо не обмежується за умови, що він є інертним розчинником, і можна використовувати, наприклад, THF, DME, DMF, 1,4-діоксан, воду або змішаний з них розчинник. Реакція прискорюється нагріванням, але зазвичай здійснюється при температурі, що варіює від кімнатної температури до температури кипіння розчину, і можна використовувати нагрівання мікрохвилями за обставинами. Якщо R4 являє собою, наприклад, гідроксиметильну групу, то сполука також може бути одержана зі сполуки, в якій R4 являє собою метил, шляхом окиснення за допомогою mCPBA або подібного, реакції перегрупування за допомогою оцтового ангідриду або подібного та лужного гідролізу. Якщо R2 являє собою, наприклад, гідроксиметильну групу, то сполука також може бути одержана шляхом зняття захисної групи у відповідної сполуки, в якій гідроксиметильна група захищена за допомогою MOM або подібного. 10 UA 114950 C2 5 10 15 20 25 30 35 40 45 Якщо R1 або R2 являє собою, наприклад, алкоксигрупу, то сполука також може бути одержана шляхом алкілування сполуки, одержаної за допомогою зняття захисної групи у відповідної спиртової сполуки, захищеної за допомогою MOM, бензилу, метилу або подібного, алкілбромідом, алкілйодидом, алкілтрифлатом або подібним у розчиннику, такому як DMF або THF, у присутності основи, такої як калію карбонат або цезію карбонат. Цю реакцію зазвичай здійснюють при температурі, що варіює від кімнатної температури до температури кипіння розчину. Якщо R4 або R2 являє собою, наприклад, фторметильну групу, то сполука може бути одержана шляхом фторування гідроксиметильної групи за допомогою DAST, BAST або подібного. Схема 2 Сполука (II) (де R, R1 і R2 мають такі ж значення, як визначено вище) може бути одержана згідно зі схемою 2, наприклад, шляхом складноефірного гідролізу сполуки (IV) та декарбоксилювального бромування одержаної в результаті сполуки (V). Розчинник, використовуваний в складноефірному гідролізі сполуки (IV), особливо не обмежується за умови, що він є інертним розчинником, і можна використовувати, наприклад, метанол, етанол, THF або водний розчинник. Крім того, в якості основи можна використовувати, наприклад, натрію гідроксид або калію гідроксид. Ця реакція прискорюється нагріванням, але зазвичай здійснюється при температурі, що варіює від кімнатної температури до температури кипіння розчину. Розчинник, використовуваний в декарбоксилювальному бромуванні сполуки (V), особливо не обмежується, і можна використовувати, наприклад, DMF, етанол або змішаний розчинник з DMF і етанолу. Більш того, джерелом брому може бути, наприклад, NBS. Якщо калію карбонат або подібне використовують в якості основи, то реакцію прискорюють, та реакцію зазвичай здійснюють при температурі, що варіює від кімнатної температури до температури кипіння розчину. Якщо R1 або R2 являє собою, наприклад, алкоксигрупу, то сполука також може бути одержана шляхом алкілування сполуки, одержаної за допомогою зняття захисної групи у відповідної спиртової сполуки, захищеної за допомогою MOM, бензилу, метилу або подібного, алкілбромідом, алкілйодидом, алкілтрифлатом або подібним в розчиннику, такому як DMF або THF, в присутності основи, такої як калію карбонат або цезію карбонат. Цю реакцію зазвичай здійснюють при температурі, що варіює від кімнатної температури до температури кипіння розчину. Схема 3 Сполука (IV) (де R, R1 і R2 мають такі ж значення, як визначено вище) може бути одержана згідно зі схемою 3, наприклад, шляхом конденсації сполуки (VI) зі сполукою (VII) та обробкою одержаної в результаті сполуки (VIII) основою. Розчинник, що використовується при конденсації сполук (VI) та (VII), особливо не обмежується за умови, що він є інертним розчинником, і можна використовувати, наприклад, толуол, THF, DME або змішаний з них розчинник. Реакція прискорюється нагріванням, але зазвичай здійснюється при температурі, що варіює від кімнатної температури до температури кипіння розчину, і при цьому можна використовувати нагрівання мікрохвилями за обставинами. Розчинник, використовуваний при обробці сполуки (VIII) основою, особливо не обмежується за умови, що він є інертним розчинником, і можна використовувати, наприклад, метанол. Основою може бути, наприклад, натрію метоксид. Реакція прискорюється нагріванням, але зазвичай здійснюється при температурі, що варіює від кімнатної температури до температури кипіння розчину, і можна використовувати нагрівання мікрохвилями за обставинами. 11 UA 114950 C2 5 10 15 20 25 30 35 40 45 Якщо R1 або R2 являє собою, наприклад, алкоксигрупу, то сполука також може бути одержана шляхом алкілування сполуки, одержаної за допомогою зняття захисної групи у відповідної спиртової сполуки, захищеної за допомогою MOM, бензилу, метилу або подібного, алкілбромідом, алкілйодидом, алкілтрифлатом або подібним в розчиннику, такому як DMF або THF, в присутності основи, такої як калію карбонат або цезію карбонат. Цю реакцію зазвичай здійснюють при температурі, що варіює від кімнатної температури до температури кипіння розчину. Схема 4 Сполука (VI) (де R1 і R2 мають такі ж значення, як визначено вище) може бути одержана згідно зі схемою 4, наприклад, шляхом кислотного хлорування сполуки (IX), амідування одержаної в результаті сполуки (X) і сполуки (XI) в основних умовах, а також циклізації одержаної в результаті сполуки (XII). Розчинник, використовуваний при кислотному хлоруванні сполуки (IX), особливо не обмежується за умови, що він є інертним розчинником, і можна використовувати, наприклад, толуол або DCM. Крім того, для реакції можна використовувати, наприклад, оксалілхлорид або тіонілхлорид, і реакція прискорюється додаванням DMF. Реакція прискорюється нагріванням, але зазвичай здійснюється при температурі, що варіює від температури охолодження льодом до температури кипіння розчину. Розчинник, використовуваний при амідуванні сполук (X) і (XI), особливо не обмежується за умови, що він є інертним розчинником, і можна використовувати, наприклад, толуол, THF, DCM, воду або змішаний з них розчинник. Крім того, в якості основи можна використовувати, наприклад, натрію гідроксид або калію гідроксид. Цю реакцію зазвичай здійснюють при температурі, що варіює від температури охолодження льодом до температури кипіння розчину. Розчинник, використовуваний в циклізації сполуки (XII), особливо не обмежується за умови, що він є інертним розчинником, і можна використовувати, наприклад, толуол або THF. Крім того, для циклізації можна використовувати метилхлорформіат, ізопропілхлорформіат, DCC або подібне. Цю реакцію зазвичай здійснюють при температурі, що варіює від 78C до температури кипіння розчину. Схема 5 Сполука (IV) (де R, R1 і R2 мають такі ж значення, як визначено вище) може бути одержана також згідно зі схемою 5, наприклад, шляхом реакції Судзукі-Міяура сполуки (XIII) (де X являє собою галоген) і сполуки (XIV). Реакція Судзукі-Міяура може бути здійснена шляхом нагрівання сполуки (XIII) і сполуки (XIV) в розчиннику в присутності, наприклад, паладієвого каталізатора і основи, причому ліганд, що містить фосфор, додають за необхідності. В якості паладієвого каталізатора можна використовувати, наприклад, тетракіс(трифенілфосфін)паладій(0), паладію(II) ацетат, Pd2DBA3 або (A-taPhos)2PdCl2. В якості основи можна використовувати, наприклад, калію фосфат, натрію гідроксид, калію гідроксид, барію гідроксид, натрію карбонат або цезію карбонат. Крім того, в якості ліганду, що містить фосфор, можна використовувати, наприклад, трифенілфосфін, бутил-ді(1-адамантил)фосфін або 2-дициклогексилфосфіно2',4',6'-триізопропілбіфеніл. Розчинник, використовуваний в реакції, особливо не обмежується за умови, що він є інертним розчинником, і можна використовувати, наприклад, THF, DME, DMF, 1,4-діоксан або бензол. Реакція прискорюється нагріванням, але зазвичай здійснюється при температурі, що варіює від кімнатної температури до температури кипіння розчину, і можна використовувати нагрівання мікрохвилями за обставинами. Схема 6 12 UA 114950 C2 O R O (VII) 15 20 25 30 35 40 45 O R O R O O (XV) N O O 10 R NH2 HN N 5 O H2N O (XVI) O O N H O (XVII) N O X O N O (XIII) Сполука (XIII) (де R має таке ж значення, як визначено вище, а X являє собою галоген) може бути одержана згідно зі схемою 6, наприклад, шляхом конденсації сполуки (VII) зі сполукою (XV), шляхом реакції Гофмана з перегрупуванням одержаної в результаті сполуки (XVI) і галогенуванням одержаної в результаті сполуки (XVII). Розчинник, використовуваний при конденсації сполук (VII) і (XV), особливо не обмежується за умови, що він є інертним розчинником, і можна використовувати, наприклад, толуол, THF, DMF, DME або змішаний з них розчинник. Реакція прискорюється нагріванням, але зазвичай здійснюється при температурі, що варіює від кімнатної температури до температури кипіння розчину, і можна використовувати нагрівання мікрохвилями за обставинами. Розчинник, використовуваний в реакції перегрупування сполуки (XVI), особливо не обмежується за умови, що він є інертним розчинником, і можна використовувати, наприклад, толуол, THF, DME або змішаний з них розчинник. Крім того, в реакції можна використовувати йодбензолдіацетат або подібне. Реакцію зазвичай здійснюють при температурі, що варіює від кімнатної температури до температури кипіння розчину. Розчинник, використовуваний при галогенуванні сполуки (XVII), особливо не обмежується за умови, що він є інертним розчинником, і можна використовувати, наприклад, толуол. Крім того, в реакції можна використовувати оксихлорид фосфору або оксибромід фосфору. Реакція прискорюється нагріванням, але зазвичай здійснюється при температурі, що варіює від кімнатної температури до температури кипіння розчину. Схема 7 Сполука (VII) (де R має такі ж значення, як визначено вище) може бути одержана згідно зі схемою 7, наприклад, за чотири етапи, шляхом реакції 1,4-приєднання сполуки (XVIII) та сполуки (XIX), алкоголізу одержаної в результаті сполуки (XX) при кислотних умовах, циклізації одержаної в результаті сполуки (XXI) в основних умовах і O-алкілування одержаної в результаті сполуки (XXII). У реакції 1,4-приєднання сполуки (XVIII) в якості розчинника можна використовувати сполуку (XIX). В якості основи можна використовувати DBU, TEA, DIPEA або подібне. Цю реакцію зазвичай здійснюють при температурі, що варіює від температури охолодження льодом до температури кипіння розчину. Розчинник, що використовується в алкоголізі сполуки (XX), особливо не обмежується за умови, що він є інертним розчинником, і можна використовувати, наприклад, 1,4-діоксан. В якості кислоти можна використовувати соляну кислоту або подібне. Ця реакція прискорюється нагріванням, але зазвичай здійснюється при температурі, що варіює від кімнатної температури до температури кипіння розчину. Розчинник, що використовується при циклізації сполуки (XXI), особливо не обмежується за умови, що він є інертним розчинником, і можна використовувати, наприклад, метанол або подібне. В якості основи можна використовувати DBU, TEA, калію карбонат або цезію карбонат. Ця реакція прискорюється нагріванням, але зазвичай здійснюється при температурі, що варіює від кімнатної температури до температури кипіння розчину. Розчинник, що використовується в O-алкілуванні сполуки (XXII), особливо не обмежується за умови, що він є інертним розчинником, і можна використовувати, наприклад, толуол. В якості алкілювального засобу можна використовувати триметилоксонію тетрафторборат, диметилсульфат або подібне. Цю реакцію зазвичай здійснюють при температурі, що варіює від температури охолодження льодом до температури кипіння розчину. Схема 8 13 UA 114950 C2 5 10 15 20 25 30 35 40 45 Сполука (XXII) (де R має такі ж значення, як визначено вище) також може бути одержана згідно зі схемою 8, наприклад, за чотири етапи, шляхом конденсації з дегідратацією сполуки (XXIII) зі сполукою (XXIV), циклізації одержаної в результаті сполуки (XXV), виконаної при кислотних умовах, гідрогенізації одержаної в результаті сполуки (XXVI) і зняття захисту з одержаної в результаті сполуки (XXVII). Розчинник, використовуваний при конденсації з дегідратацією сполуки (XXIII) зі сполукою (XXIV), особливо не обмежується за умови, що він є інертним розчинником, і можна використовувати, наприклад, THF, DMF або DCM. Крім того, засобом для конденсації може бути DCC, EDC, HOBt, HATU, HBTU або комбінація будь-якого з них. Крім того, в якості добавки в реакції можна використовувати DIPEA, TEA або подібне. Цю реакцію зазвичай виконують при температурі, що варіює від температури охолодження льодом до температури кипіння розчину. Розчинник, використовуваний при циклізації сполуки (XXV), особливо не обмежується за умови, що він є інертним розчинником, і можна використовувати, наприклад, THF, ацетонітрил, толуол або ксилол. Крім того, кислота може являти собою, наприклад, PTS або PPTS. Реакція прискорюється нагріванням, але зазвичай здійснюється при температурі, що варіює від кімнатної температури до температури кипіння розчину. Розчинник, використовуваний при гідрогенізації сполуки (XXVI), особливо не обмежується за умови, що він є інертним розчинником, і можна використовувати, наприклад, метанол, етанол або THF. В якості каталізатора можна використовувати паладій на вугіллі, паладію гідроксид на вугіллі, платини оксид або подібне. Цю реакцію зазвичай здійснюють при температурі, що варіює від кімнатної температури до температури кипіння розчину. Зняття захисту зі сполуки (XXVII) можна виконувати, наприклад, в розчиннику, такому як TFA. В якості добавки можна використовувати, наприклад, акцептор, такий як триетилсилан. Ця реакція прискорюється нагріванням, але зазвичай здійснюється при температурі, що варіює від кімнатної температури до температури кипіння розчину. Сполука (I) за даним винаходом, одержана таким чином, може бути одержана у вигляді фармацевтично прийнятної солі традиційним способом залежно від обставин. Спосіб одержання може передбачати придатну комбінацію, наприклад, способів, традиційно використовуваних в галузі хімії органічного синтезу. Конкретний приклад способу включає нейтралізаційне титрування розчину вільної форми сполуки за даним винаходом розчином кислоти. Крім того, сполука (I) за даним винаходом може бути перетворена на сольват за допомогою відомої реакції утворення сольвату, в залежності від обставин. Дотепер були описані типові приклади способу одержання сполуки (I), а також сполукиматеріали та різні реагенти, використовувані в способі одержання сполуки (I), можуть мати форму солі або гідрату та є різними залежно від передбачуваних для використання вихідних матеріалів, розчинників тощо, і, отже, особливо не обмежуються, за умови, що реакції не сповільнюються. Також передбачувані для використання розчинники відрізняються в залежності від вихідних матеріалів, реагентів тощо, і, що само собою розуміється, не особливо обмежуються, за умови, що вони не сповільнюють реакцію і в деякій мірі розчиняють вихідні матеріали. Якщо сполуку (I) одержують в вільній формі, то вона може бути перетворена, традиційним способом, в форму солі, яка може бути утворена сполукою (I). Подібним чином, якщо сполуку (I) одержують в формі солі сполуки (I), то вона може бути перетворена, традиційним способом, у вільну форму сполуки (I). Крім того, різні ізомери (такі як геометричний ізомер, оптичний ізомер на основі асиметричного вуглецю, стереоізомер та таутомер), одержані як сполука (I), можуть бути очищені та виділені загальними способами розділення, такими як перекристалізація, метод утворення діастереомерних солей, ферментативне розділення і різні типи хроматографії (в тому числі тонкошарова хроматографія, колонкова хроматографія та газова хроматографія). 14 UA 114950 C2 5 10 15 20 25 30 35 40 45 50 55 60 Використовуваний в даному документі термін "композиція" включає продукт, який містить конкретний інгредієнт в конкретній кількості та будь-який продукт, безпосередньо або опосередковано одержаний шляхом комбінування конкретних інгредієнтів в конкретних кількостях. Такий термін, використовуваний щодо фармацевтичної композиції, передбачає включення продукту, що містить активний інгредієнт та неактивний інгредієнт, що утворює носій, і всіх продуктів, одержаних безпосередньо або опосередковано шляхом комбінування, комплексоутворення або агрегації будь-яких двох або більше інгредієнтів, або дисоціації, іншого типу реакції або взаємодії одного або декількох інгредієнтів. Отже, фармацевтична композиція за даним винаходом включає всі композиції, одержані шляхом змішування тетрагідроімідазо[1,5-d][1,4]оксазепінової похідної за даним винаходом з будь-яким з фармацевтично прийнятних носіїв. Термін "фармацевтично прийнятний" означає, що носій, розріджувач або допоміжний засіб повинні бути сумісними з іншими інгредієнтами складу та не повинні бути шкідливими для тих, хто приймає композицію. Сполуки за даним винаходом, головним чином, характеризуються здатністю зв’язування з метаботропними рецепторами глутамату групи II, значенням IC50, що становить 100 нM або менше, а також характеризуються значенням IC50, що становить переважно 30 нM або менше та більш переважно 10 нM або менше. Тетрагідроімідазо[1,5-d][1,4]оксазепінова похідна за даним винаходом або її фармацевтично прийнятна сіль приєднання кислоти характеризуються антагоністичною дією щодо метаботропних рецепторів глутамату групи II. Отже, воно є застосовним в якості терапевтичного засобу проти захворювань, за яких антагоністична дія щодо метаботропних рецепторів глутамату групи II є ефективною. Приклади захворювань, за яких антагоністична дія щодо метаботропних рецепторів глутамату групи II є ефективною, включають хворобу Альцгеймера. Тетрагідроімідазо[1,5-d][1,4]оксазепінова похідна за даним винаходом або її фармацевтично прийнятна сіль приєднання кислоти можуть бути складені загальним способом, і готовою лікарською формою може бути, наприклад, пероральний склад (такий як таблетка, гранула, порошок, капсула або сироп), ін’єкційний склад (для внутрішньовенного введення, внутрішньом’язового введення, підшкірного введення, внутрішньоочеревинного введення тощо) або склад для зовнішнього застосування (такий як черезшкірний лікарський засіб, здатний піддаватися абсорбції (у тому числі мазь, пластир тощо), очні краплі, назальні краплі або супозиторій). Для одержання перорального твердого складу до тетрагідроімідазо[1,5-d][1,4]оксазепінової похідної за даним винаходом або її фармацевтично прийнятної солі приєднання кислоти, за необхідності, можна додавати допоміжний засіб, зв’язувальну речовину, розпушувач, мастильну речовину, барвник тощо, і одержану в результаті суміш можна традиційним способом перетворити на таблетки, гранули, порошки або капсули. Крім того, таблетки, гранули, порошки або капсули, за необхідності, можуть бути покриті плівкою. Приклади допоміжного засобу включають лактозу, кукурудзяний крохмаль та кристалічну целюлозу; приклади зв’язувальної речовини включають гідроксипропілцелюлозу та гідроксипропілметилцелюлозу; приклади розпушувача включають карбоксиметилцелюлозу кальцію і кроскармелозу натрію; приклади мастильної речовини включають магнію стеарат і кальцію стеарат; приклади барвника включають титану оксид; і приклади плівкоутворювача включають гідроксипропілцелюлозу, гідроксипропілметилцелюлозу та метилцелюлозу, але ці інгредієнти, звичайно, не обмежені вищезгаданими прикладами. Твердий склад, такий як таблетка, капсула, гранула або порошок, може містити тетрагідроімідазо[1,5-d][1,4]оксазепінову похідну за даним винаходом, її фармацевтично прийнятну сіль або її сольват, як правило, в кількості 0,001-99,5 % за вагою, переважно 0,00190 % за вагою тощо. Для одержання ін’єкційного складу (для внутрішньовенного введення, внутрішньом’язового введення, підшкірного введення, внутрішньоочеревинного введення тощо) до тетрагідроімідазо[1,5-d][1,4]оксазепінової похідної за даним винаходом або її фармацевтично прийнятної солі приєднання кислоти, за необхідності, додають регулятор pH, буфер, суспендувальний засіб, солюбілізувальний засіб, антиоксидант, консервант (антисептичний засіб), засіб, що регулює тонічність, тощо, та з одержаної в результаті суміші традиційним способом можна одержати ін’єкційний склад. Крім того, одержаний в результаті склад може бути висушений виморожуванням для використання в якості ліофілізованого продукту, що підлягає розчиненню перед застосуванням. Приклади регулятора pH і буфера включають органічні кислоти, неорганічні кислоти та/або їх солі; приклади суспендувального засобу включають метилцелюлозу, полісорбат 80 і 15 UA 114950 C2 5 10 15 20 25 30 35 40 45 50 55 60 карбоксиметилцелюлозу натрію; приклади солюбілізувального засобу включають полісорбат 80 і поліоксіетиленсорбітанмонолаурат; приклади антиоксиданту включають α-токоферол; приклади консерванту включають метилпараоксибензоат і етилпараоксибензоат; і приклади засобу, що регулює тонічність, включають глюкозу, натрію хлорид і маніт, але ці інгредієнти, звичайно, не обмежені вищезгаданими прикладами. Такий ін'єкційний склад може містити тетрагідроімідазо[1,5-d][1,4]оксазепінову похідну за даним винаходом, її фармацевтично прийнятну сіль або її сольват, як правило, в кількості 0,000001-99,5 % за вагою, переважно 0,000001-90 % за вагою тощо. Для одержання складу для зовнішнього застосування до тетрагідроімідазо[1,5d][1,4]оксазепінової похідної або її фармацевтично прийнятної солі приєднання кислоти за даним винаходом додають матеріал-основу та, за необхідності, додатково додають, наприклад, консервант, стабілізатор, регулятор pH, антиоксидант, барвник тощо, описані вище, та з одержаної в результаті суміші традиційним способом одержують, наприклад, трансдермальний лікарський засіб, здатний піддаватися абсорбції (наприклад, мазь або пластир), очні краплі, назальні краплі або супозиторій. У якості використовуваного матеріалу-основи можна застосовувати різні матеріали, зазвичай використовувані, наприклад, для медицинських препаратів, квазилікарських засобів та косметичних засобів. Конкретні приклади матеріалу включають масла, тваринного та рослинного походження, мінеральні масла, складноефірні масла, віск, емульгатори, вищі спирти, жирні кислоти, силіконові масла, поверхнево-активні речовини, фосфоліпіди, спирти, багатоатомні спирти, водорозчинні полімери, глинисті мінерали та очищену воду. Такий склад для зовнішнього застосування може містити тетрагідроімідазо[1,5d][1,4]оксазепінову похідну за даним винаходом або її фармацевтично прийнятну сіль, або її сольват, як правило, в кількості 0,000001-99,5 % за вагою, переважно 0,000001-90 % за вагою тощо. Дозування тетрагідроімідазо[1,5-d][1,4]оксазепінової похідної за даним винаходом або її фармацевтично прийнятної солі приєднання кислоти залежить від рівня важкості симптому, віку, статі та ваги пацієнта, форми введення і виду солі, конкретного виду захворювання тощо, і дорослому пацієнту його вводять за один раз або поділеним на декілька разів на день при дозі для перорального введення, як правило, що становить приблизно 30 мкг - 10 г, переважно 100 мкг - 5 г і більш переважно 100 мкг - 1 г, або при дозі для ін`єкційного введення, як правило, що становить приблизно 30 мкг - 1 г, переважно 100 мкг - 500 мг і більш переважно 100 мкг - 300 мг. Сполуку за даним винаходом можна використовувати в якості хімічного зонда для захоплювання цільового білка біологічно активної низькомолекулярної сполуки. Зокрема, сполука за даним винаходом може бути перетворена на зонд для афінної хроматографії, фотоафінний зонд тощо шляхом введення групи-мітки, лінкера або подібного в частину, відмінну від структурної частини, необхідної для виявлення активності сполуки, за допомогою способу, описаного в J. Mass Spectrum. Soc. Jpn. Vol. 51, No. 5, 2003, p. 492-498, в WO2007/139149, або подібного. Приклади групи-мітки, лінкера або подібного, використовуваних в такому хімічному зонді, включають групи, що належать до наступних груп (1) - (5): (1) групи-мітки для білків, такі як фотоафінні групи-мітки (такі як бензоїльна група, бензофенонова група, азидогрупа, карбонілазидогрупа, діазиридинова група, енонова група, діазогрупа і нітрогрупа) та хімічні афінні групи (такі як кетонна група, в якій альфа-вуглецевий атом заміщений атомом галогену, карбамоїльна група, складноефірна група, алкілтіогрупа, рецептор Міхаеля α,β-ненасиченого кетону, складного ефіру та подібного, а також оксиранова група); (2) відщепні лінкери, такі як SS, OSiO, моносахарид (такий як глюкозна група або галактозна група) та дисахарид (такий як лактоза), а також олігопептидні лінкери, які можуть відщеплюватися ферментативною реакцією; (3) групи з міткою для флуоресцентної in situ гібридизації, такі як біотин і 3-(4,4-дифтор-5,7диметил-4H-3a, 4a-діаза-4-бора-s-індацен-3-іл)пропіонільна група; 125 32 3 14 (4) радіоактивні групи-мітки, такі як I, P, H і C; флуоресцентні групи-мітки, такі як флуоресцеїн, родамін, дансил, умбеліферон, 7-нітрофуразаніл і 3-(4,4-дифтор-5,7-диметил-4H3a, 4a-діаза-4-бора-s-індецен-3-іл)пропіонільна група; хемілюмінесцентні групи, такі як люміферин і люмінол; а також маркери, які можна виявляти, такі як іони важких металів, наприклад, іони металів-лантаноїдів та іони радію; та (5) групи для зв`язування з твердофазним носієм, таким як скляні гранули, скляна пластина, титраційний мікропланшет, агарозні гранули, агарозний шар, полістирольні гранули, полістирольний шар, нейлонові гранули та нейлоновий шар. 16 UA 114950 C2 5 10 15 20 25 30 35 40 45 50 55 60 Зонд, одержаний при введенні в сполуку за даним винаходом групи-мітки тощо, вибраної з описаних вище груп (1) - (5), за допомогою способу, описаного у будь-якому з вищезазначених літературних джерел, або подібного, можна використовувати в якості хімічного зонда для ідентифікації маркерного білка, застосовуваного для дослідження цілі нових потенційних лікарських засобів або подібного. Далі даний винахід буде докладно описаний з посиланням на приклади, приклади одержання та приклади тестів. Однак даний винахід не обмежується ними. Крім того, абревіатури, що використовуються в прикладах, являють собою традиційно використовувані абревіатури, добре відомі фахівцю в даній галузі техніки, і деякі з цих абревіатур будуть описані нижче. (A-taPhos)2PdCl2: біс(ди-трет-бутил(4-диметиламінофеніл)фосфін)дихлорпаладій(II) BAST: біс(2-метоксіетил)аміносірки трифторид Bn: бензил Boc: трет-бутоксикарбоніл CSA: камфорсульфонова кислота DAST: діетиламіносірки трифторид DBN: 1,5-діазабіцикло[4.3.0]нон-5-ен DBU: 1,8-діазабіцикло[5.4.0]ундец-7-ен DCC: 1,3-дициклогексилкарбодіімід DCE: 1,2-дихлоретан DCM: дихлорметан DIPEA: діізопропілетиламін DME: диметоксіетан DMF: N, N-диметилформамід DMPI: перйодинан Деса-Мартіна DMSO: диметилсульфоксид EDC: 1-етил-3-(3-диметиламінопропіл)карбодііміду гідрохлорид HATU: O-(7-азабензотриазол-1-іл)-N, N,N',N'-тетраметилуронію гексафторфосфат HBTU: O-бензотриазол-N, N,N',N'-тетраметилуронію гексафторфосфат HFIP: 1,1,1,3,3,3-гексафтор-2-пропанол HOBT: 1-гідроксибензотриазол mCPBA: 3-хлорпербензойна кислота MOM: метоксиметил н-: нормальний NBS: N-бромсукцинімід NMM: N-метилморфолін Pd(dppf)Cl2CH2Cl2: комплекс (1,1'-біс(дифенілфосфіно)фероцен-дихлорпаладіюдихлорметан Pd2(DBA)3: трис(дибензиліденацетон)дипаладій PPTS: піридинію паратолуолсульфонат PTS: паратолуолсульфонова кислота трет-: третинний TBAF: третрабутиламонію фторид TBS: трет-бутилдиметилсиліл TBSCl: трет-бутилдиметилсилілхлорид TBME: складний трет-бутилметиловий ефір TEA: триетиламін TFA: трифтороцтова кислота THF: тетрагідрофуран Ts: паратолуолсульфоніл 1 H-ЯМР: спектрометрія на основі протонного ядерного магнітного резонансу Хімічні зрушення спектрів протонного ядерного магнітного резонансу реєструються в одиницях вимірювання δ (ppm) відносно тетраметилсилану, а константи взаємодії реєструються в одиницях вимірювання герц (Гц). Патерни включають: s; синглет, d; дублет, t; триплет, q; квартет, br; широкий, і sep; септет. Термін "кімнатна температура" в прикладах та прикладах одержання, описаних нижче, зазвичай означає температуру в діапазоні від приблизно 10C до 35C. Символ "%" означає % за вагою, якщо не описано інше. Хімічну назву сполук в прикладах і прикладах одержання визначали на підставі їх хімічних структур згідно "E-Notebook", версія 12 (PerkinElmer Inc.). 17 UA 114950 C2 Приклад одержання 1 Синтез (R)-5-метокси-2-метил-2,3,6,7-тетрагідро-1,4-оксазепіну 5 10 15 20 25 30 35 40 (1) Синтез (R)-1-((2,4-диметоксибензил)аміно)пропан-2-олу 2,4-Диметоксибензальдегід (№ CAS 613-45-65; 55,8 г, 336 ммоль) додавали до розчину (R)(-)-1-аміно-2-пропанолу (№ CAS 2799-16-8; 24,0 г, 320 ммоль) та оцтової кислоти (40,2 мл, 703 ммоль) в THF (440 мл) при кімнатній температурі та суміш перемішували при кімнатній температурі протягом 1 години. Натрію триацетоксиборгідрид (102 г, 479 ммоль) додавали до реакційної рідини при кімнатній температурі та суміш перемішували протягом 18 годин. Розчинник концентрували при пониженому тиску після припинення реакції. 5 н. водний розчин натрію гідроксиду (100 мл) та етилацетат (500 мл) додавали до одержаного в результаті залишку для відокремлення органічного шару. Додавали хлороформ (300 мл) до одержаного в результаті водного шару для відокремлення органічного шару. Одержані в результаті органічні шари об`єднували і одержане в результаті промивали насиченим водним розчином натрію хлориду, а потім сушили над безводним сульфатом магнію. Осушувач відфільтровували, а потім розчинник випарювали при пониженому тиску. Одержаний в результаті залишок фільтрували через NH-силікагель (етилацетат) для очищення з одержанням неочищеної названої сполуки (72 г). 1 H-ЯМР (400МГц, CDCl3) δ (ppm): 1,13 (d, J=6,3 Гц, 3H), 2,34 (dd, J=9,4, 12,1 Гц, 1H), 2,68 (dd, J=3,1, 12,1 Гц, 1H), 3,72 (d, J=2,0 Гц, 2H), 3,75-3,79 (m, 1H), 3,80 (s, 3H), 3,82 (s, 3H), 6,39-6,48 (m, 2H), 7,10 (d, J=8,2 Гц, 1H). (2) Синтез (R)-N-(2,4-диметоксибензил)-N-(2-гідроксипропіл)-3,3-диметоксипропанаміду DIPEA (173 мл, 995 ммоль) додавали до розчину сполуки, одержаної в прикладі одержання 1-(1) (74,7 г, 332 ммоль), 3,3-диметоксипропіонової кислоти (№ CAS 6191-98-6; 38,5 г, 287 ммоль), EDC (95 г, 497 ммоль) і HOBT (67,2 г, 497 ммоль) в DMF (500 мл) при кімнатній температурі і суміш перемішували протягом 14 годин. Воду (1 л) і етилацетат (1 л) додавали до реакційної суміші для відокремлення органічного шару. Одержаний в результаті органічний шар промивали водою (1 л) і насиченим водним розчином натрію хлориду, потім сушили над безводним сульфатом магнію, осушувач відфільтровували, а розчинник випарювали при пониженому тиску. Одержаний в результаті залишок очищали за допомогою колонкової хроматографії з NH-силікагелем (н-гептан/етилацетат) з одержанням названої сполуки (61 г, 179 ммоль). + ESI-MS маса/заряд 342 [M+H] (3) Синтез (R)-4-(2,4-диметоксибензил)-2-метил-3,4-дигідро-1,4-оксазепін-5(2H)-ону PPTS (19,7 г, 78,4 ммоль) додавали до розчину сполуки, одержаної в прикладі одержання 1(2) (53,5 г, 157 ммоль), в толуолі (900 мл) при кімнатній температурі, а потім суміш нагрівали зі зворотним холодильником протягом 7 годин. Реакційну суміш охолоджували до кімнатної температури, а потім насичений водний розчин натрію бікарбонату та етилацетат додавали для відокремлення органічного шару. Одержаний в результаті органічний шар промивали насиченим водним розчином натрію хлориду, а потім сушили над безводним сульфатом магнію, осушувач відфільтровували, а потім розчинник випарювали при пониженому тиску. Одержаний 18 UA 114950 C2 5 10 15 20 25 30 35 40 45 50 55 в результаті залишок очищали за допомогою колонкової хроматографії з силікагелем (нгептан/етилацетат) з одержанням названої сполуки (30,5 г, 110 ммоль). 1 H-ЯМР (400МГц, CDCl3) δ (ppm): 1,19 (d, J=6,6 Гц, 3H), 3,39-3,44 (m, 2H), 3,80 (s, 3H), 3,82 (s, 3H), 4,03-4,11 (m, 1H), 4,44 (d, J=14,5 Гц, 1H), 4,73 (d, J=14,5 Гц, 1H), 5,08 (d, J=8,2 Гц, 1H), 6,43-6,48 (m, 3H), 7,24 (d, J=9,0 Гц, 1H). (4) Синтез (R)-4-(2,4-диметоксибензил)-2-метил-1,4-оксазепан-5-ону 20 % паладію гідроксиду на вугіллі (3 г, включаючи 50 % вміст води) додавали до розчину сполуки, одержаної в прикладі одержання 1-(3) (30,5 г, 110 ммоль), в метанолі (500 мл) при кімнатній температурі та суміш перемішували в атмосфері водню при 40C протягом 18 годин. Реакційну суміш охолоджували до кімнатної температури, а потім фільтрували через Celite (товарний знак) і фільтрат концентрували при пониженому тиску. Одержаний в результаті залишок очищали за допомогою колонкової хроматографії з силікагелем (етилацетат) з одержанням названої сполуки (29,1 г, 104 ммоль). 1 H-ЯМР (400МГц, CDCl3) δ (ppm): 1,05 (d, J=6,6 Гц, 3H), 2,60 (dd, J=5,1, 15,6 Гц, 1H), 2,92 (ddd, J=2,2, 11,0, 15,4 Гц, 1H), 3,20 (d, J=15,2 Гц, 1H), 3,29-3,38 (m, 1H), 3,40-3,50 (m, 1H), 3,563,66 (m, 1H), 3,81 (s, 3H), 3,82 (s, 3H), 3,96 (ddd, J=2,3, 5,5, 12,5 Гц, 1H), 4,37 (d, J=14,5 Гц, 1H), 4,70 (d, J=14,5 Гц, 1H), 6,43-6,48 (m, 2H), 7,21 (d, J=8,6 Гц, 1H). (5) Синтез (R)-2-метил-1,4-оксазепан-5-ону Триетилсилан (26,2 мл, 164 ммоль) додавали до розчину сполуки, одержаної в прикладі одержання 1-(4) (30,5 г, 110 ммоль), в TFA (150 мл) при кімнатній температурі та суміш перемішували при 60C протягом 3 годин. Реакційну суміш охолоджували до кімнатної температури і потім концентрували при пониженому тиску. Одержаний в результаті залишок очищали за допомогою колонкової хроматографії з силікагелем (етилацетат/метанол) з одержанням названої сполуки (12,3 г, 95 ммоль). 1 H-ЯМР (400МГц, CDCl3) δ (ppm): 1,19 (d, J=6,3 Гц, 3H), 2,48-2,58 (m, 1H), 2,89 (ddd, J=2,5, 10,9, 15,4 Гц, 1H), 3,03 (ddd, J=0,9, 7,6, 15,3 Гц, 1H), 3,35 (ddd, J=3,9, 8,4, 15,4 Гц, 1H), 3,57-3,76 (m, 2H), 4,01 (ddd, J=2,5, 5,3, 12,7 Гц, 1H), 5,85-6,07 (m, 1H). (6) Синтез (R)-5-метокси-2-метил-2,3,6,7-тетрагідро-1,4-оксазепіну Триметилоксонію тетрафторборат (16,8 г, 114 ммоль) додавали до розчину сполуки, одержаної в прикладі одержання 1-(5) (13,4 г, 103 ммоль), в DCM (500 мл) при кімнатній температурі та суміш перемішували протягом 18 годин. Насичений водний розчин натрію бікарбонату додавали до реакційної суміші та відокремлювали органічний шар. DCM додавали до одержаного в результаті водного шару і відокремлювали органічний шар. Одержані в результаті органічні шари об`єднували, одержане в результаті промивали насиченим водним розчином натрію хлориду, потім одержане в результаті сушили над безводним сульфатом магнію, а потім осушувач відфільтровували і розчинник випарювали при пониженому тиску з одержанням названої сполуки (13,7 г, 96 ммоль). 1 H-ЯМР (400МГц, CDCl3) δ (ppm): 1,19 (d, J=6,4 Гц, 3H), 2,42 (ddd, J=1,2, 4,5, 15,6 Гц, 1H), 2,81-2,92 (m, 1H), 3,33-3,42 (m, 1H), 3,47-3,59 (m, 3H), 3,61 (s, 3H), 3,85-3,93 (m, 1H). Приклад одержання 2 Синтез (R)-2-метил-1,4-оксазепан-5-ону (1) Синтез (R)-трет-бутил(2-(2-ціанетокси)пропіл)карбамату DBU (27,3 мл, 182 ммоль) додавали до розчину (R)-трет-бутил(2-гідроксипропіл)карбамату (№ CAS 119768-44-4; 71,0 г, 405 ммоль) в акрилонітрилі (400 мл) при кімнатній температурі і суміш перемішували при тій же температурі протягом 5 годин. Оцтову кислоту (10,4 мл, 182 ммоль) додавали до реакційної суміші та суміш концентрували при пониженому тиску. Одержаний в результаті залишок очищали за допомогою колонкової хроматографії з силікагелем (н-гептан/етилацетат) з одержанням названої сполуки (63,1 г, 276 ммоль). 1 H-ЯМР (400МГц, CDCl3) δ (ppm): 1,10-1,20 (m, 3H), 1,45 (s, 9H), 2,59 (dd, J=6,3, 6,3 Гц, 2H), 2,96-3,11 (m, 1H), 3,23-3,41 (m, 1H), 3,52-3,66 (m, 1H), 3,61 (td, J=6,3, 9,2 Гц, 1H), 3,75 (td, J=6,3, 9,2 Гц, 1H), 4,88 (brs, 1H). (2) Синтез (R)-метил-3-((1-амінопропан-2-іл)окси)пропанoату гідрохлориду Сполуку, одержану в прикладі одержання 2-(1) (63,1 г, 276 ммоль), розчиняли в 4 M розчині хлороводню/1,4-діоксану (691 мл) та 5-10 % розчині хлороводню/метанолу (140 мл) і суміш перемішували при 50C протягом 3 годин. 4 M розчин хлороводню/1,4-діоксану (311 мл) додатково додавали до реакційної суміші, суміш перемішували при 50C протягом 3 годин, а потім одержане в результаті концентрували при пониженому тиску. Діетиловий ефір додавали 19 UA 114950 C2 5 10 15 20 25 30 35 40 45 до залишку і одержане в результаті концентрували при пониженому тиску з одержанням неочищеної названої сполуки (76,9 г). ESI-MS маса/заряд 162 [M+H]+ (3) Синтез (R)-2-метил-1,4-оксазепан-5-ону DBU (132 мл, 884 ммоль) додавали до розчину сполуки, одержаної в прикладі одержання 2(2) (76,9 г), в метанолі (693 мл) при кімнатній температурі та суміш нагрівали зі зворотним холодильником протягом 16 годин. Реакційну суміш охолоджували до кімнатної температури та потім концентрували при пониженому тиску. Одержаний в результаті залишок двічі очищали за допомогою колонкової хроматографії з силікагелем (етилацетат/метанол) з одержанням названої сполуки (21,5 г, 166 ммоль). 1 H-ЯМР (400МГц, CDCl3) δ (ppm): 1,19 (d, J=6,3 Гц, 3H), 2,48-2,58 (m, 1H), 2,89 (ddd, J=2,5, 10,9, 15,4 Гц, 1H), 3,03 (ddd, J=0,9, 7,6, 15,3 Гц, 1H), 3,35 (ddd, J=3,9, 8,4, 15,4 Гц, 1H), 3,57-3,76 (m, 2H), 4,01 (ddd, J=2,5, 5,3, 12,7 Гц, 1H), 5,85-6,07 (m, 1H). ESI-MS маса/заряд 130 [M+H]+ Приклад одержання 3 Синтез (S)-2-(фторметил)-5-метокси-2,3,6,7-тетрагідро-1,4-оксазепіну (1) Синтез (S)-1-(бензилокси)-3-((2,4-диметоксибензил)аміно)пропан-2-олу Літію біс(трифторметансульфоніл)імід (87 г, 304,5 ммоль) додавали до розчину 2,4диметоксибензиламіну (№ CAS 20781-20-8; 46,7 мл, 310,6 ммоль) і (S)-(+)-бензилгліцидилового ефіру (№ CAS 16495-13-9; 50,0 г, 304,5 ммоль) в DCM (1,0 л) при охолодженні водою. Реакційну суміш перемішували при кімнатній температурі протягом 20 годин. Воду додавали до реакційної суміші для відокремлення органічного шару. Органічні шари сушили над безводним сульфатом магнію. Розчинник випарювали при пониженому тиску з одержанням неочищеної названої сполуки (119,4 г). ESI-MS маса/заряд 332 [M+H]+ (2) Синтез (S)-N-(3-(бензилокси)-2-гідроксипропіл)-N-(2,4-диметоксибензил)-3,3диметоксипропанаміду EDC (88 г, 456,7 ммоль) і HOBT (456,7 ммоль) додавали до розчину сполуки, одержаної в прикладі одержання 3-(1) (119,4 г), 3,3-диметоксипропіонової кислоти (47,0 г, 350,1 ммоль) і DIPEA (159 мл) в DMF (800 мл) при кімнатній температурі. Реакційну суміш перемішували протягом 16 годин, а потім додавали етилацетат і насичений водний розчин натрію хлориду. Органічний шар відокремлювали та промивали насиченим водним розчином натрію хлориду. Органічний шар сушили над безводним сульфатом магнію. Органічний шар фільтрували через подушку силікагелю (NH-силікагель + силікагель, етилацетат). Одержаний у результаті фільтрат концентрували при пониженому тиску з одержанням неочищеної названої сполуки (125,5 г). ESI-MS маса/заряд 470 [M+Na]+ (3) Синтез (S)-2-((бензилокси)метил)-4-(2,4-диметоксибензил)-3,4-дигідро-1,4-оксазепін5(2H)-ону Розчин сполуки, одержаної в прикладі одержання 3-(2) (125,5 г), і PPTS (35,2 г, 140,2 ммоль) в ксилолі (1 л) нагрівали зі зворотним холодильником протягом 6 годин. Реакційну суміш охолоджували до кімнатної температури і додавали етилацетат і насичений водний розчин натрію бікарбонату до реакційної суміші для відокремлення органічного шару. Органічний шар промивали насиченим водним розчином натрію хлориду, а потім сушили над безводним сульфатом магнію. Органічний шар концентрували при пониженому тиску та одержаний в результаті залишок очищали колонковою хроматографією (н-гептан/етилацетат) з одержанням названої сполуки (57,7 г, 150 ммоль). 20 UA 114950 C2 5 10 15 20 25 30 35 40 45 50 ESI-MS маса/заряд 384 [M+H]+, 406 [M+Na]+ (4) Синтез (S)-4-(2,4-диметоксибензил)-2-(гідроксиметил)-1,4-оксазепан-5-ону Суміш сполуки, одержаної в прикладі одержання 3-(3) (57,7 г, 150,5 ммоль), 20 % паладію гідроксиду на вугіллі (6 г, включаючи 50 % вміст води), оцтової кислоти (20 мл) та етанолу (600 мл) перемішували в атмосфері водню при 4-5 MПа і 70C протягом 50 годин. Реакційну суміш охолоджували до кімнатної температури. Нерозчинні речовини відфільтровували через Celite (товарний знак) і одержане в результаті промивали етилацетатом. Фільтрат концентрували при пониженому тиску. Одержаний в результаті залишок очищали за допомогою колонкової хроматографії з силікагелем (н-гептан/етилацетат етилацетат/метанол) з одержанням названої сполуки (33,7 г). 1 H-ЯМР (400МГц, CDCl3) δ (ppm): 1,83 (dd, J=5,1, 7,0 Гц, 1H), 2,63 (dd, J=5,1, 15,2 Гц, 1H), 2,95 (ddd, J=2,7, 11,3, 15,6 Гц, 1H), 3,22-3,30 (m, 2H), 3,40-3,45 (m, 2H), 3,51 (dd, J=8,2, 16,0 Гц, 1H), 3,62-3,67 (m, 1H), 3,80 (s, 3H), 3,81 (s, 3H), 4,04 (ddd, J=2,3, 5,1, 12,5 Гц, 1H), 4,36 (d, J=14,5 Гц, 1H), 4,73 (d, J=14,5 Гц, 1H), 6,43-6,47 (m, 2H), 7,22 (d, J=8,6 Гц, 1H). ESI-MS маса/заряд 296 [M+H]+, 318 [M+Na]+ (5) Синтез (S)-4-(2,4-диметоксибензил)-2-(фторметил)-1,4-оксазепан-5-ону Перфторбутансульфонілфторид (45,1 мл, 251,0 ммоль) додавали до розчину сполуки, одержаної в прикладі одержання 3-(4) (33,7 г, 114,1 ммоль), DIPEA (49,2 мл, 285,3 ммоль) і тетрабутиламонію дифтортрифенілсилікату (73,9 г, 136,9 ммоль) в THF (600 мл) при кімнатній температурі. Реакційну суміш перемішували при кімнатній температурі протягом 64 годин. Реакційну суміш концентрували при пониженому тиску. Змішаний розчинник толуол/етилацетат (5/1) і насичений водний розчин натрію хлориду додавали до одержаного в результаті залишку для відокремлення органічного шару. Далі органічний шар двічі промивали насиченим водним розчином натрію хлориду. Органічний шар концентрували при пониженому тиску та одержаний в результаті залишок послідовно очищали за допомогою колонкової хроматографії з силікагелем (н-гептан/етилацетат) і колонкової хроматографії з NH-силікагелем (нгептан/етилацетат) з одержанням неочищеної названої сполуки (41 г). 1 H-ЯМР (400МГц, CDCl3) δ (ppm): 2,62 (dd, J=5,5, 15,2 Гц, 1H), 2,96 (ddd, J=2,3, 11,3, 15,2 Гц, 1H), 3,35-3,68 (m, 4H), 3,80 (s, 3H), 3,81 (s, 3H), 4,00 (ddd, J=2,3, 5,1, 12,5 Гц, 1H), 4,09-4,36 (m, 2H), 4,40 (d, J=14,5 Гц, 1H), 4,74 (d, J=14,5 Гц, 1H), 6,44-6,47 (m, 2H), 7,24 (d, J=8,2 Гц, 1H). ESI-MS маса/заряд 298 [M+H]+ (6) Синтез (S)-2-(фторметил)-1,4-оксазепан-5-ону Триетилсилан (27,4 мл, 171,7 ммоль) додавали до розчину сполуки, одержаної в прикладі одержання 3-(5) (41 г), в TFA (300 мл) при кімнатній температурі. Реакційну суміш перемішували при 60C протягом 3 годин. Реакційну суміш концентрували при пониженому тиску. Одержаний в результаті залишок очищали за допомогою колонкової хроматографії з силікагелем (нгептан/етилацетат етилацетат/метанол) з одержанням названої сполуки (15 г, 101,94 ммоль). 1 H-ЯМР (400МГц, CDCl3) δ (ppm): 2,54 (ddd, J=2,0, 5,1, 15,6 Гц, 1H), 2,93 (ddd, J=2,7, 11,3, 15,6 Гц, 1H), 3,23-3,31 (m, 1H), 3,46 (ddd, J=3,5, 8,6, 15,2 Гц, 1H), 3,66-3,78 (m, 2H), 4,07 (ddd, J=2,7, 5,1, 12,5 Гц, 1H), 4,24-4,53 (m, 2H), 6,50 (brs, 1H). (7) Синтез (S)-2-(фторметил)-5-метокси-2,3,6,7-тетрагідро-1,4-оксазепіну Триметилоксонію тетрафторборат (17,34 г, 117,2 ммоль) додавали до розчину сполуки, одержаної в прикладі одержання 3-(6) (15 г, 101,94 ммоль), в DCM (400 мл) при кімнатній температурі. Реакційний розчин перемішували при кімнатній температурі протягом 14 годин. Насичений водний розчин натрію бікарбонату додавали до реакційної суміші та суміш перемішували при кімнатній температурі протягом 30 хвилин. До суміші додавали хлороформ для відокремлення органічного шару. Органічний шар сушили над безводним сульфатом магнію. Органічний шар концентрували при пониженому тиску з одержанням названої сполуки (14,9 г, 93 ммоль). 1 H-ЯМР (400МГц, CDCl3) δ (ppm): 2,47 (ddd, J=1,2, 4,3, 15,6 Гц, 1H), 2,87-2,96 (m, 1H), 3,453,70 (m, 4H), 3,63 (s, 3H), 3,98 (ddd, J=3,1, 4,3, 12,1 Гц, 1H), 4,30-4,50 (m, 2H). Приклад одержання 4 Синтез (S)-2-(фторметил)-1,4-оксазепан-5-ону 21 UA 114950 C2 5 10 15 20 25 30 35 40 45 (1) Синтез (S)-3-фтор-2-гідроксипропіл-4-метилбензолсульфонату Діетиловий ефір (1,00 л), (2R)-(-)-гліцидилтозилат (№ CAS 113826-06-5; 50,0 г, 219 ммоль) і бензоїлфторид (33,4 мл, 307 ммоль) додавали до суміші (R, R)-(-)-N, N'-біс(3,5-ди-третбутилсаліциліден)-1,2-циклогександіамінокобальту(II) (9,26 г, 15,3 ммоль), HFIP (64,4 мл, 613 ммоль) і DBN (1,51 мл, 12,3 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом ночі, а потім додавали 7 M розчин аміак/метанол (150 мл). Суміш перемішували при кімнатній температурі протягом 2 годин і розчинник випарювали при пониженому тиску. До одержаного в результаті залишку додавали етилацетат (300 мл) і одержане в результаті послідовно промивали водою та насиченим водним розчином натрію хлориду. Органічний шар сушили над безводним сульфатом магнію і розчинник випарювали при пониженому тиску. Одержаний в результаті залишок очищали за допомогою колонкової хроматографії з силікагелем (н-гептан/етилацетат) з одержанням названої сполуки (45,5 г, 183 ммоль). 1 H-ЯМР (400МГц, CDCl3) δ (ppm): 2,28-2,42 (m, 1H), 2,46 (s, 3H), 4,03-4,18 (m, 3H), 4,34-4,54 (m, 2H), 7,37 (d, J=8,2 Гц, 2H), 7,81 (d, J=8,2 Гц, 2H). ESI-MS маса/заряд 271 [M+Na]+ (2) Синтез (S, E)-метил-3-((1-фтор-3-(тозилокси)пропан-2-іл)окси)акрилату Розчин сполуки, одержаної в прикладі одержання 4-(1) (45,5 г, 183 ммоль), NMM (12,1 мл, 110 ммоль) і метилпропіонату (№ CAS 922-67-8; 19,8 мл, 238 ммоль) в THF (315 мл) перемішували при охолодженні льодом протягом 3 годин. Оцтову кислоту (6,29 мл, 110 ммоль) додавали до реакційної суміші, а потім додавали воду і етилацетат. Органічний шар відокремлювали та послідовно промивали водою і насиченим водним розчином натрію хлориду. Органічний шар сушили над безводним сульфатом магнію, а потім концентрували при пониженому тиску. Одержаний в результаті залишок очищали за допомогою колонкової хроматографії з силікагелем (н-гептан/етилацетат) з одержанням названої сполуки (49,2 г, 148 ммоль). 1 H-ЯМР (400МГц, CDCl3) δ (ppm): 2,46 (s, 3H), 3,70 (s, 3H), 4,11-4,37 (m, 3H), 4,42-4,66 (m, 2H), 5,26 (d, J=12,5 Гц, 1H), 7,33-7,42 (m, 3H), 7,76-7,83 (m, 2H). ESI-MS маса/заряд 355 [M+Na]+ (3) Синтез (S)-метил-3-((1-фтор-3-(тозилокси)пропан-2-іл)окси)пропаноату Суспензію сполуки, одержаної в прикладі одержання 4-(2) (48,8 г, 147 ммоль), і 5 % паладію на вугіллі (6,25 г, включаючи 50 % вміст води) в етанолі (279 мл) перемішували в атмосфері водню при кімнатній температурі протягом 2 годин. Нерозчинні речовини видаляли, а потім фільтрат концентрували при пониженому тиску з одержанням неочищеної названої сполуки (45,8 г). 1 H-ЯМР (400МГц, CDCl3) δ (ppm): 2,46 (s, 3H), 2,53 (t, J=6,3 Гц, 2H), 3,68 (s, 3H), 3,27-3,87 (m, 3H), 4,08 (dt, J=1,6, 5,5 Гц, 2H), 4,29-4,53 (m, 2H), 7,36 (d, J=8,2 Гц, 2H), 7,80 (d, J=8,2 Гц, 2H). ESI-MS маса/заряд 357 [M+Na]+ (4) Синтез (S)-2-(фторметил)-1,4-оксазепан-5-ону Суміш сполуки, одержаної в прикладі одержання 4-(3) (45,8 г, 137 ммоль), і 7 M розчину аміак/метанол (391 мл, 2,74 моль) перемішували в автоклаві при 130C протягом 2 годин. Реакційну суміш охолоджували до кімнатної температури, а потім суміш концентрували при пониженому тиску. Метанол (300 мл) і DBU (41,0 мл, 274 ммоль) додавали до залишку при кімнатній температурі. Реакційну суміш перемішували при 100C протягом 3 годин. Реакційну суміш охолоджували до кімнатної температури і потім концентрували при пониженому тиску. Одержаний в результаті залишок очищали за допомогою колонкової хроматографії з силікагелем (н-гептан/етилацетат етилацетат/метанол) з одержанням названої сполуки (10,4 г, 70,7 ммоль). 22 UA 114950 C2 1 5 10 15 20 25 30 35 40 45 50 H-ЯМР (400МГц, CDCl3) δ (ppm): 2,54 (ddd, J=2,0, 5,1, 15,6 Гц, 1H), 2,93 (ddd, J=2,7, 11,3, 15,6 Гц, 1H), 3,23-3,31 (m, 1H), 3,46 (ddd, J=3,5, 8,6, 15,2 Гц, 1H), 3,66-3,78 (m, 2H), 4,07 (ddd, J=2,7, 5,1, 12,5 Гц, 1H), 4,24-4,53 (m, 2H), 6,50 (brs, 1H). ESI-MS маса/заряд 295 [M+M+H]+ Приклад одержання 5 Синтез (S)-2-(дифторметил)-5-метокси-2,3,6,7-тетрагідро-1,4-оксазепіну (1) Синтез (S)-2-(дифторметил)-4-(2,4-диметоксибензил)-1,4-оксазепан-5-ону Оксалілхлорид (1,18 мл, 14,0 ммоль) додавали до розчину DMSO (1,03 мл, 14,5 ммоль) в THF (60 мл) в атмосфері азоту при -78C. Суміш перемішували при -78C протягом 10 хвилин і розчин сполуки, одержаної в прикладі одержання 3-(4) (3,30 г, 11,2 ммоль), в THF (40 мл) по краплях додавали при тій же температурі. Після перемішування суміші при тій же температурі протягом 1 години по краплях додавали DIPEA (7,79 мл, 44,7 ммоль). Через 10 хвилин реакційну суміш нагрівали до кімнатної температури і додатково перемішували протягом 1 години. До суміші додавали водний розчин амонію хлориду і етилацетат для відокремлення органічного шару. Органічний шар промивали насиченим водним розчином натрію хлориду та сушили над безводним сульфатом магнію. Органічний шар концентрували при пониженому тиску. Одержаний в результаті залишок розчиняли в DCM (66 мл) і одержане в результаті охолоджували до -78C. До суміші додавали BAST (6,18 мл, 33,5 ммоль) при тій же температурі, потім одержане в результаті повільно нагрівали до кімнатної температури і перемішували протягом 15 годин. Насичений водний розчин натрію хлориду і етилацетат додавали до реакційної суміші для відокремлення органічного шару. Органічний шар промивали насиченим водним розчином натрію хлориду та сушили над безводним сульфатом магнію. Органічний шар концентрували при пониженому тиску. Одержаний в результаті залишок очищали за допомогою колонкової хроматографії з силікагелем (н-гептан/етилацетат) з одержанням названої сполуки (1,13 г, 3,58 ммоль). 1 H-ЯМР (400МГц, CDCl3) δ (ppm): 2,63 (dd, J=5,1, 15,6 Гц, 1H), 2,97 (ddd, J=2,4, 11,4, 15,6 Гц, 1H), 3,26-3,36 (m, 1H), 3,60 (d, J=4,7 Гц, 2H), 3,77-3,84 (m, 1H), 3,80 (s, 3H), 3,81 (s, 3H), 4,04-4,10 (m, 1H), 4,36 (d, J=14,1 Гц, 1H), 4,75 (d, J=14,1 Гц, 1H), 5,47-5,76 (m, 1H), 6,44-6,47 (m, 2H), 7,247,27 (m, 1H). ESI-MS маса/заряд 316 [M+H]+ (2) Синтез (S)-2-(дифторметил)-1,4-оксазепан-5-ону Триетилсилан (0,881 мл, 5,52 ммоль) додавали до розчину сполуки, одержаної в прикладі одержання 5-(1) (1,16 г, 3,68 ммоль), в TFA (10 мл) при кімнатній температурі. Реакційну суміш перемішували при 60C протягом 3 годин. Реакційну суміш охолоджували до кімнатної температури і розчинник випарювали при пониженому тиску. Одержаний в результаті залишок очищали за допомогою колонкової хроматографії з силікагелем (н-гептан/етилацетат етилацетат/метанол) з одержанням названої сполуки (472 мг, 2,86 ммоль). 1 H-ЯМР (400МГц, CDCl3) δ (ppm): 2,57 (ddd, J=1,9, 4,8, 15,7 Гц, 1H), 2,95 (ddd, J=2,7, 11,3, 15,6 Гц, 1H), 3,35 (dd, J=7,8, 15,4 Гц, 1H), 3,54 (ddd, J=3,7, 8,8, 15,5 Гц, 1H), 3,63-3,78 (m, 2H), 4,14 (ddd, J=2,7, 5,0, 12,8 Гц, 1H), 5,63-5,92 (m, 1H), 6,00 (brs, 1H). (3) Синтез (S)-2-(дифторметил)-5-метокси-2,3,6,7-тетрагідро-1,4-оксазепіну Триметилоксонію тетрафторборат (597 мг, 4,04 ммоль) додавали до розчину сполуки, одержаної в прикладі одержання 5-(2) (580 мг, 3,51 ммоль), в DCM (100 мл) при охолодженні льодом. Реакційну суміш перемішували при охолодженні льодом протягом 20 хвилин, потім нагрівали до кімнатної температури і додатково перемішували протягом 14 годин. Насичений водний розчин натрію бікарбонату додавали до реакційної суміші і суміш перемішували при кімнатній температурі протягом 30 хвилин. До суміші додавали хлороформ для відокремлення органічного шару. Органічний шар сушили над безводним сульфатом магнію. Органічний шар концентрували при пониженому тиску з одержанням названої сполуки (450 мг, 2,51 ммоль). 1 H-ЯМР (400МГц, CDCl3) δ (ppm): 2,47 (ddd, J=1,2, 4,2, 15,6 Гц, 1H), 2,89-2,97 (m, 1H), 3,463,61 (m, 3H), 3,64 (s, 3H), 3,77 (d, J=14,5 Гц, 1H), 3,98-4,05 (m, 1H), 5,57-5,86 (m, 1H). Приклад одержання 6 Синтез (R)-2-етил-5-метокси-2,3,6,7-тетрагідро-1,4-оксазепіну 23 UA 114950 C2 5 10 15 20 25 30 (1) Синтез (R)-1-((2,4-диметоксибензил)аміно)бутан-2-олу Згідно зі способом з прикладу одержання 3-(1) одержували неочищену названу сполуку (15,7 г) з (R)-(+)-1,2-епоксибутану (№ CAS 3760-95-0; 5,0 г, 69 ммоль) і 2,4диметоксибензиламіну (15,7 г, 65,8 ммоль). ESI-MS маса/заряд 240 [M+H]+ (2) Синтез (R)-N-(2,4-диметоксибензил)-N-(2-гідроксибутил)-3,3-диметоксипропанаміду Згідно зі способом з прикладу одержання 1-(2) названу сполуку (16,3 г, 45,9 ммоль) одержували зі сполуки, одержаної в прикладі одержання 6-(1) (15,7 г), і 3,3диметоксипропіонової кислоти (8,80 г, 65,6 ммоль). ESI-MS маса/заряд 378 [M+Na]+ (3) Синтез (R)-4-(2,4-диметоксибензил)-2-етил-3,4-дигідро-1,4-оксазепін-5(2H)-ону Згідно зі способом з прикладу одержання 1-(3) названу сполуку (5,88 г, 20,2 ммоль) одержували зі сполуки, одержаної в прикладі одержання 6-(2) (16,3 г, 45,9 ммоль). ESI-MS маса/заряд 292 [M+H]+ (4) Синтез (R)-4-(2,4-диметоксибензил)-2-етил-1,4-оксазепан-5-ону Згідно зі способом з прикладу одержання 1-(4) названу сполуку (5,92 г, 20,2 ммоль) одержували зі сполуки, одержаної в прикладі одержання 6-(3) (5,88 г, 20,2 ммоль). ESI-MS маса/заряд 316 [M+Na]+ (5) Синтез (R)-2-етил-1,4-оксазепан-5-ону Згідно зі способом з прикладу одержання 1-(5) названу сполуку (2,78 г, 19,4 ммоль) одержували зі сполуки, одержаної в прикладі одержання 6-(4) (5,92 г, 20,2 ммоль). 1 H-ЯМР (400МГц, CDCl3) δ (ppm): 0,96 (t, J=7,6 Гц, 3H), 1,38-1,50 (m, 1H), 1,52-1,62 (m, 1H), 2,54 (dd, J=4,5, 15,4 Гц, 1H), 2,82-2,94 (m, 1H), 3,08 (dd, J=7,4, 14,1 Гц, 1H), 3,27-3,41 (m, 2H), 3,63-3,74 (m, 1H), 4,04 (ddd, J=2,3, 5,3, 12,7 Гц, 1H), 6,02-6,22 (m, 1H). (6) Синтез (R)-2-етил-5-метокси-2,3,6,7-тетрагідро-1,4-оксазепіну Згідно зі способом з прикладу одержання 1-(6) названу сполуку (2,51 г, 16,0 ммоль) одержували зі сполуки, одержаної в прикладі одержання 6-(5) (2,78 г, 19,4 ммоль). 1 H-ЯМР (400МГц, CDCl3) δ (ppm): 0,95 (t, J=8,0 Гц, 3H), 1,44-1,57 (m, 2H), 2,43 (ddd, J=1,2, 4,5, 15,4 Гц, 1H), 2,87 (ddd, J=3,1, 11,5, 15,0 Гц, 1H), 3,24-3,32 (m, 1H), 3,33-3,41 (m, 1H), 3,473,57 (m, 2H), 3,62 (s, 3H), 3,87-3,95 (m, 1H). Приклад одержання 7 Синтез (S)-2-((бензилокси)метил)-5-метокси-2,3,6,7-тетрагідро-1,4-оксазепіну 24 UA 114950 C2 5 10 15 20 25 30 35 40 45 50 (1) Синтез (R)-3-(бензилокси)-2-гідроксипропіл-4-метилбензолсульфонату Комплекс бору трифторид-етиловий ефір (0,694 мл, 5,48 ммоль) додавали до суміші (2R)-()-гліцидилтозилату (25,0 г, 109 ммоль), бензилового спирту (22,7 мл, 219 ммоль) і толуолу (200 мл) при охолодженні льодом. Реакційну суміш перемішували при кімнатній температурі протягом ночі. Реакційну суміш двічі промивали насиченим водним розчином натрію бікарбонату (50,0 мл) і додатково двічі водою (50,0 мл). Етанол додавали до органічного шару, доки суспензія не ставала прозорою. Розчинник випарювали при пониженому тиску та залишок очищали за допомогою колонкової хроматографії з силікагелем (н-гептан/етилацетат) з одержанням названої сполуки (28,0 г, 83,0 ммоль). 1 H-ЯМР (400МГц, CDCl3) δ (ppm): 2,40 (d, J=5,5 Гц, 1H), 2,44 (s, 3H), 3,46-3,57 (m, 2H), 3,964,15 (m, 3H), 4,50 (s, 2H), 7,26-7,39 (m, 7H), 7,75-7,82 (m, 2H). (2) Синтез (R, E)-метил-3-((1-(бензилокси)-3-(тозилокси)пропан-2-іл)окси)акрилату Суміш сполуки, одержаної в прикладі одержання 7-(1) (28,0 г, 83,2 ммоль), метилпропіолату (15,3 мл, 183 ммоль), NMM (9,15 мл, 83,2 ммоль) і THF (280 мл) перемішували при кімнатній температурі протягом ночі. Розчинник випарювали при пониженому тиску та залишок очищали за допомогою колонкової хроматографії з силікагелем (н-гептан/етилацетат) з одержанням названої сполуки (34,7 г, 82,5 ммоль). 1 H-ЯМР (400МГц, CDCl3) δ (ppm): 2,44 (s, 3H), 3,57 (dd, J=1,8, 4,9 Гц, 2H), 3,69 (s, 3H), 4,144,30 (m, 3H), 4,44-4,55 (m, 2H), 5,20 (d, J=12,5 Гц, 1H), 7,24-7,40 (m, 8H), 7,75-7,78 (m, 2H). (3) Синтез (R)-метил-3-((1-(бензилокси)-3-(тозилокси)пропан-2-іл)окси)пропаноату Додавали 10 % паладій на вугіллі (4,39 г, включаючи 50 % вміст води) до розчину сполуки, одержаної в прикладі одержання 7-(2) (34,7 г, 82,5 ммоль), в етанолі (347 мл). Реакційну суміш перемішували в атмосфері водню протягом 7 годин. Нерозчинні речовини відфільтровували через Celite (товарний знак). Розчинник випарювали при пониженому тиску з одержанням названої сполуки (34,5 г, 82,0 ммоль). 1 H-ЯМР (400МГц, CDCl3) δ (ppm): 2,44 (s, 3H), 2,51 (t, J=6,3 Гц, 2H), 3,43-3,52 (m, 2H), 3,66 (s, 3H), 3,68-3,72 (m, 1H), 3,74-3,85 (m, 2H), 4,02-4,08 (m, 1H), 4,11-4,18 (m, 1H), 4,46 (s, 2H), 7,217,26 (m, 2H), 7,28-7,40 (m, 5H), 7,74-7,82 (m, 2H). (4) Синтез (S)-2-((бензилокси)метил)-1,4-оксазепан-5-ону Сполуку, одержану в прикладі одержання 7-(3) (22,0 г, 52,1 ммоль), розчиняли в 7 M розчині аміак/метанол (100 мл, 700 ммоль). Реакційну суміш перемішували в закоркованій пробірці при 100C протягом ночі. Реакційну суміш переносили в колбу в формі баклажана та додавали DBU (24,9 мл, 167 ммоль). Реакційну суміш перемішували при 80C протягом 6 годин. Одержане в результаті охолоджували до кімнатної температури та розчинник випарювали при пониженому тиску. Залишок очищали за допомогою колонкової хроматографії з силікагелем (нгептан/етилацетат) з одержанням названої сполуки (5,56 г, 23,6 ммоль). 1 H-ЯМР (400МГц, CDCl3) δ (ppm): 2,48-2,56 (m, 1H), 2,91 (ddd, J=2,7, 11,0, 15,5 Гц, 1H), 3,243,33 (m, 1H), 3,35-3,44 (m, 2H), 3,53 (dd, J=4,7, 9,8 Гц, 1H), 3,61-3,76 (m, 2H), 4,04 (ddd, J=2,7, 5,2, 12,8 Гц, 1H), 4,49-4,60 (m, 2H), 5,92 (brs, 1H), 7,27-7,41 (m, 5H). (5) Синтез (S)-2-((бензилокси)метил)-5-метокси-2,3,6,7-тетрагідро-1,4-оксазепіну Триметилоксонію тетрафторборат (1,51 г, 10,2 ммоль) додавали до розчину сполуки, одержаної в прикладі одержання 7-(4) (2,00 г, 8,50 ммоль), в DCM (40,0 мл) при кімнатній температурі та суміш перемішували при кімнатній температурі протягом 15 годин. Насичений водний розчин натрію бікарбонату додавали до реакційної суміші та суміш перемішували при кімнатній температурі протягом 20 хвилин. Органічний шар відокремлювали та сушили над безводним сульфатом магнію. Розчинник випарювали при пониженому тиску з одержанням названої сполуки (2,12 г, 8,50 ммоль). 1 H-ЯМР (400МГц, CDCl3) δ (ppm): 2,44 (ddd, 1,2, 4,4, 15,5 Гц, 1H), 2,90 (ddd, J=3,1, 11,6, 15,3 Гц, 1H), 3,41-3,65 (m, 9H), 3,97 (ddd, J=3,1, 4,6, 12,2 Гц, 1H), 4,53-4,60 (m, 2H), 7,27-7,42 (m, 5H). Приклад одержання 8 Синтез (R)-метил-3-хлор-6-метил-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін-1карбоксилату O O (1) N (2) HN O O H2N O 55 O O O (3) N O N H O O N Cl O N O (1) Синтез (R)-метил-3-аміно-2-(2-метил-1,4-оксазепан-5-іліден)-3-оксопропаноату Розчин сполуки, одержаної в прикладі одержання 1-(6) (16,0 г, 156 ммоль), і метилкарбамоїлацетат (№ CAS 51513-29-2; 18,3 г, 156 ммоль) в THF (40 мл)/DMF (10 мл) 25 UA 114950 C2 5 10 15 20 25 30 35 40 45 перемішували при 90C протягом 15 годин. Реакційну суміш охолоджували до кімнатної температури і розчинник випарювали при пониженому тиску. Одержаний в результаті залишок очищали хроматографією на силікагелі (н-гептан/етилацетат етилацетат/метанол) з одержанням названої сполуки (14,2 г, 62,2 ммоль). 1 H-ЯМР (400МГц, CDCl3) δ (ppm): 1,20 (d, J=6,3 Гц, 3H), 2,73-2,81 (m, 1H), 3,33-3,66 (m, 5H), 3,77 (s, 3H), 4,04-4,10 (m, 1H). (2) Синтез (R)-метил-6-метил-3-оксо-2,3,5,6,8,9-гексагідроімідазо[1,5-d][1,4]оксазепін-1карбоксилату Йодбензолдіацетат (24,1 г, 74,7 ммоль) додавали до розчину сполуки, одержаної в прикладі одержання 8-(1) (14,2 г, 62,2 ммоль), в THF (100 мл)/толуолі (100 мл) і суміш перемішували при кімнатній температурі протягом 60 годин. Насичений водний розчин натрію бікарбонату (60 мл) і насичений водний розчин натрію сульфіту (60 мл) додавали до реакційної суміші та суміш перемішували при кімнатній температурі протягом 1 години. Суміш три рази екстрагували етилацетатом. Об’єднані органічні шари сушили над безводним сульфатом магнію та концентрували при пониженому тиску. Одержаний в результаті залишок очищали за допомогою колонкової хроматографії з силікагелем (н-гептан/етилацетат етилацетат/метанол) з одержанням названої сполуки (9,97 г, 44,1 ммоль). 1 H-ЯМР (400МГц, CDCl3) δ (ppm): 1,27 (d, J=6,3 Гц, 3H), 2,86 (ddd, J=2,4, 11,0, 16,3 Гц, 1H), 3,45 (dd, J=9,0, 14,7 Гц, 1H), 3,53-3,70 (m, 3H), 3,83 (s, 3H), 4,13-4,19 (m, 1H), 4,29 (d, J=14,7 Гц, 1H), 8,03 (brs, 1H). ESI-MS маса/заряд 227 [M+H]+ (3) Синтез (R)-метил-3-хлор-6-метил-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін-1карбоксилату Суміш сполуки, одержаної в прикладі одержання 8-(2) (9,97 г, 44,1 ммоль), і фосфору оксихлориду (60 мл) перемішували при 110C протягом 4 годин. Реакційну суміш охолоджували до кімнатної температури і концентрували при пониженому тиску. Одержаний в результаті залишок очищали за допомогою колонкової хроматографії з NH-силікагелем (нгептан/етилацетат) з одержанням названої сполуки (5,94 г, 24,3 ммоль). 1 H-ЯМР (400МГц, CDCl3) δ (ppm): 1,30 (d, J=6,5 Гц, 3H), 3,02 (ddd, J=2,7, 10,8, 16,4 Гц, 1H), 3,55-3,62 (m, 1H), 3,66-3,74 (m, 1H), 3,87 (s, 3H), 3,88-3,98 (m, 2H), 4,13-4,19 (m, 1H), 4,26-4,31 (m, 1H). ESI-MS маса/заряд 245 [M+H]+ Приклад одержання 9 Синтез (S)-метил-3-хлор-6-(фторметил)-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін-1карбоксилату Згідно зі способом з прикладів одержання 8-(1), 8-(2) і 8-(3) названу сполуку (1,77 г, 6,74 ммоль) одержували зі сполуки, одержаної в прикладі одержання 3-(7) (9,39 г, 58,3 ммоль). 1 H-ЯМР (400МГц, CDCl3) δ (ppm): 3,02 (ddd, J=2,7, 11,4, 16,4 Гц, 1H), 3,58-3,65 (m, 1H), 3,713,80 (m, 1H), 3,88 (s, 3H), 3,98-4,09 (m, 2H), 4,23-4,28 (m, 1H), 4,33-4,65 (m, 3H). ESI-MS маса/заряд 263 [M+H]+ Приклад одержання 10 Синтез метил-3-хлор-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін-1-карбоксилату (1) Синтез метил-3-оксо-2,3,5,6,8,9-гексагідроімідазо[1,5-d][1,4]оксазепін-1-карбоксилату Згідно зі способами з прикладів одержання 8-(1) і 8-(2) названу сполуку (13,0 г, 6,74 ммоль) одержували з 5-метокси-2,3,6,7-тетрагідро-1,4-оксазепіну (№ CAS 384330-36-3; 25,0 г, 194 ммоль). 26 UA 114950 C2 1 5 10 15 20 25 30 35 40 45 H-ЯМР (400МГц, CDCl3) δ (ppm): 3,26-3,30 (m, 2H), 3,76-3,85 (m, 4H), 3,83 (s, 3H), 4,00-4,03 (m, 2H), 8,20 (brs, 1H). ESI-MS маса/заряд 213 [M+H]+ (2) Синтез метил-3-хлор-5,6,8,9-гексагідроімідазо[1,5-d][1,4]оксазепін-1-карбоксилату Згідно зі способом з прикладу одержання 8-(3) названу сполуку (7,58 г, 32,9 ммоль) одержували зі сполуки, одержаної в прикладі одержання 10-(1) (11 г, 51,8 ммоль). 1 H-ЯМР (400МГц, CDCl3) δ (ppm): 3,51-3,55 (m, 2H), 3,85-3,89 (m, 4H), 3,89 (s, 3H), 4,25-4,28 (m, 2H). Приклад одержання 11 Синтез метил-3-бром-5,6,8,9-тетрагідроімідазо[1,5-d][1,4]оксазепін-1-карбоксилату Фосфору оксибромід (25,0 г, 87,2 ммоль) додавали до розчину сполуки, одержаної в прикладі одержання 10-(1) (7,64 г, 36,0 ммоль), в толуолі (140 мл) та суміш перемішували і нагрівали зі зворотним холодильником протягом 24 годин. Реакційну суміш охолоджували до кімнатної температури, додавали лід і насичений водний розчин натрію бікарбонату та суміш перемішували протягом 3 годин. Тверду речовину відфільтровували і фільтрат три рази екстрагували хлороформом. Одержаний в результаті органічний шар сушили над безводним сульфатом натрію, а потім одержане в результаті концентрували при пониженому тиску. Одержаний в результаті залишок три рази промивали етилацетатом з одержанням названої сполуки (3,18 г, 11,6 ммоль). Фільтрат концентрували й одержаний в результаті залишок очищали за допомогою колонкової хроматографії з NH-силікагелем (н-гептан/етилацетат) з одержанням названої сполуки (0,84 г, 3,1 ммоль). 1 H-ЯМР (400МГц, CDCl3) δ (ppm): 3,42-3,61 (m, 2H), 3,80-3,89 (m, 4H), 3,86 (s, 3H), 4,25 (t, J=3,5 Гц, 2H). Приклад одержання 12 Синтез (3-хлор-4-циклопропоксифеніл)боронової кислоти По краплях додавали розчин н-бутиллітій/н-гексан (2,69 моль/л, 1,70 мл) до розчину 4-бром2-хлор-1-циклопропоксибензолу (CAS 869569-68-6; 1,10 г, 4,44 ммоль) в THF (8,5 мл) при -78C і суміш перемішували при тій же температурі протягом 30 хвилин. Триетилборат (0,980 мл, 5,79 ммоль) повільно додавали до реакційної суміші, потім сухий лід видаляли з охолоджувальної бані, і потім суміш перемішували, доки внутрішня температура не підвищилася до 0C. Насичений водний розчин амонію хлориду і етилацетат додавали до суміші для відокремлення органічного шару. Одержане в результаті промивали насиченим водним розчином натрію хлориду, сушили над безводним сульфатом магнію і концентрували при пониженому тиску. До одержаного в результаті залишку додавали ефір і одержану в результаті тверду речовину збирали фільтрацією з одержанням названої сполуки (520 мг, 2,45 ммоль). 1 H-ЯМР (400МГц, CDCl3) δ (ppm): 0,85-0,98 (m, 4H), 3,87-3,98 (m, 1H), 7,43 (d, J=8,2 Гц, 1H), 8,09 (dd, J=1,6, 8,2 Гц, 1H), 8,14 (d, J=1,6 Гц, 1H). Приклад одержання 13 Синтез 2-(3-хлор-4-(метоксиметокси)феніл)-4,4,5,5-тетраметил-1,3,2-діоксаборолану Суміш 4-бром-2-хлор-1-(метоксиметокси)бензолу (CAS 1301146-84-8; 4,85 г, 19,3 ммоль), біс(пінаколат)дибору (6,87 г, 27,1 ммоль), калію ацетату (5,73 г, 58,4 ммоль) і Pd(dppf)Cl2CH2Cl2 (0,788 г, 0,964 ммоль) перемішували в DMSO (76 мл) при 80C протягом 5 годин. Воду та діетиловий ефір додавали до реакційної суміші для відокремлення органічного шару. Органічний шар промивали насиченим водним розчином натрію хлориду, сушили над 27 UA 114950 C2 5 10 15 20 25 30 35 40 безводним сульфатом магнію та концентрували при пониженому тиску. Одержаний в результаті залишок очищали за допомогою колонкової хроматографії з силікагелем (н-гептан/етилацетат) з одержанням названої сполуки (4,50 г, 15,1 ммоль). 1 H-ЯМР (400МГц, CDCl3) δ (ppm): 1,33 (s, 12H), 3,51 (s, 3H), 5,28 (s, 2H), 7,15 (d, J=8,2 Гц, 1H), 7,64 (dd, J=1,6, 8,2 Гц, 1H), 7,82 (d, J=1,6 Гц, 1H). Приклад одержання 14 Синтез 2-(4-циклопропокси-3-(трифторметокси)феніл)-4,4,5,5-тетраметил-1,3,2діоксаборолану Згідно зі способом з прикладу одержання 13 названу сполуку (1,05 г, 3,05 ммоль) одержували з 4-бром-1-циклопропокси-2-(трифторметокси)бензолу (CAS 1337606-89-9; 1,30 г, 4,38 ммоль). 1 H-ЯМР (400МГц, CDCl3) δ (ppm): 0,76-0,84 (m, 4H), 1,33 (s, 12H), 3,76-3,90 (m, 1H), 7,31 (d, J=8,2 Гц, 1H), 7,63 (qd, J=1,3, 1,5 Гц, 1H), 7,70 (dd, J=1,5, 8,2 Гц, 1H). Приклад одержання 15 Синтез 2-(3-хлор-4-циклопропоксифеніл)-4,4,5,5-тетраметил-1,3,2-діоксаборолану Згідно зі способом з прикладу одержання 13 названу сполуку (1,10 г, 3,73 ммоль) одержували з 4-бром-2-хлор-1-циклопропоксибензолу (CAS 869569-68-6; 1,10 г, 4,44 ммоль). 1 H-ЯМР (400МГц, CDCl3) δ (ppm): 0,74-0,96 (m, 4H), 1,33 (s, 12H), 3,71-3,94 (m, 1H), 7,28 (d, J=8,2 Гц, 1H), 7,67 (dd, J=1,6, 8,2 Гц, 1H), 7,78 (d, J=1,6 Гц, 1H). Приклад одержання 16 Синтез 2-(4-циклопропокси-3-метилфеніл)-4,4,5,5-тетраметил-1,3,2-діоксаборолану Згідно зі способом з прикладу одержання 13 названу сполуку (1,20 г, 4,38 ммоль) одержували з 4-бром-1-циклопропокси-2-метилбензолу (CAS 1243345-41-6; 2,00 г, 8,81 ммоль). 1 H-ЯМР (400МГц, CDCl3) δ (ppm): 0,62-0,85 (m, 4H), 1,33 (s, 12H), 2,16 (s, 3H), 3,71-3,81 (m, 1H), 7,19 (d, J=8,2 Гц, 1H), 7,58 (brs, 1H), 7,65 (brd, J=8,2 Гц, 1H). Приклад одержання 17 Синтез 2-(4-(дифторметокси)-3-((метоксиметокси)метил)феніл)-4,4,5,5-тетраметил-1,3,2діоксаборолану (1) Синтез 4-бром-1-(дифторметокси)-2-((метоксиметокси)метил)бензолу Додавали натрію боргідрид (113 мг, 2,99 ммоль) до розчину 5-бром-2(дифторметокси)бензальдегіду (№ CAS 329269-64-9; 750 мг, 2,99 ммоль) в метанолі (15 мл) при охолодженні льодом. Реакційну суміш перемішували при охолодженні льодом протягом 30 хвилин. До реакційної суміші додавали оцтову кислоту, суміш нагрівали до кімнатної температури, а потім розчинник випарювали при пониженому тиску. Залишок змішували з метанолом для трикратного азеотропного випарювання та додатково змішували з хлороформом для азеотропного випарювання. Одержаний в результаті залишок розчиняли в DCM. До одержаного в результаті розчину додавали диметоксиметан (5,29 мл, 59,8 ммоль). Дифосфору пентаоксид (4,24 г, 29,9 ммоль) додавали до реакційної суміші при охолодженні льодом. Реакційну суміш перемішували при охолодженні льодом протягом 30 хвилин. Калію 28
ДивитисяДодаткова інформація
Назва патенту англійськоюTetrahydroimidazo[1,5-d][1,4]oxazepine derivative
Автори англійськоюTakaishi, Mamoru, Sato, Nobuhiro, Shibuguchi, Tomoyuki, Motoki, Takafumi, Takahashi, Yoshinori, Sasaki, Takeo, Braunton, Alan
Автори російськоюТакаиши Мамору, Сато Нобухиро, Шибугучи Томоюки, Мотоки Такафуми, Такахаши Йошинори, Сасаки Такео, Браунтон Алан
МПК / Мітки
МПК: C07D 498/04, A61K 31/553
Мітки: тетрагідроімідазо[1,5-d][1,4]оксазепінова, похідна
Код посилання
<a href="https://ua.patents.su/77-114950-tetragidroimidazo15-d14oksazepinova-pokhidna.html" target="_blank" rel="follow" title="База патентів України">Тетрагідроімідазо[1,5-d][1,4]оксазепінова похідна</a>
Попередній патент: Пристрій для виявлення виткових замикань в котушках індуктивностей
Наступний патент: Спосіб керування “динамічним конденсатором” для компенсації реактивної потужності
Випадковий патент: Спосіб одержання лігнінвмісного ентеросорбенту (варіанти)