Спосіб одержання 7,8-анельованих 6,6-диціанозаміщених піридо[2,3-d]піримідинів
Номер патенту: 102984
Опубліковано: 27.08.2013
Автори: Черненко Віталій Миколайович, Десенко Сергій Михайлович, Гладков Євгеній Станіславович, Афанасіаді Людмила Михайлівна
Формула / Реферат
Спосіб одержання 7,8-анельованих 6,6-диціанозаміщених піридо[2,3-d]піримідинів формули
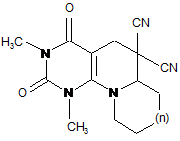 ,
,
де n = 0, СН2, О, СНСН3, СНСН2С6Н5,
в якому здійснюють конденсацію рівномолярних кількостей 5-форміл-6-діалкіламіно-1,3-диметилурацилу формули
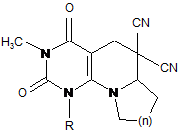 ,
,
де n = 0, СН2, О, СНСН3, СНСН2С6Н5
і малондинітрилу в органічному розчиннику у присутності каталізатора при кип'ятінні, який відрізняється тим, що як розчинник використовують метанол, як каталізатор - триетиламін, одержаний продукт циклізують кип'ятінням у безводному диметилформаміді протягом 2-3 годин, після чого осаджують ацетоном.
Текст
Реферат: Пропонується спосіб одержання 7,8-анельованих 6,6-диціанозаміщених піридо[2,3d]піримідинів формули І O CN H3 C N CN O N CH3 N (n) , де n = 0, СН2, О, СНСН3, СНСН2С6Н5, який включає взаємодію рівномолярних кількостей відповідного 5-форміл-6-діалкіламіно-1,3диметилурацилу з малондинітрилом в метанолі у присутності каталізатора - триетиламіну при кип'ятінні протягом 10-15 хвилин, одержаний продукт циклізують кип'ятінням у безводному диметилформаміді протягом 2-3 годин, і осаджують ацетоном до утворення цільового продукту. UA 102984 C2 (12) UA 102984 C2 Технічне рішення дозволяє підвищити виходи сполук формули І і їх якість, забезпечує створення значного асортименту одержання 7,8-анельованих 6,6-диціанозаміщених піридо[2,3d]піримідинів для медицини, біології, фармації. O CN H3C N CN O N CH3 N (n) UA 102984 C2 Винахід стосується області органічної хімії, а саме до способу одержання 7,8-анельованих 6,6-диціанозаміщених піридо[2,3-d]піримідинів формули І O CN H3 C N CN O N N (n) CH3 5 10 15 I , де n=0, СН2, О, СНСН3, СНСН2С6Н5. Сполуки такого складу вже тривалий час привертають увагу хіміків-синтетиків. Обумовлено це декількома причинами, одна з яких - можливість маніпулювати їх структурою для досягнення необхідних фізичних, хімічних та фармокологічних властивостей. Не менш важливим фактором є їх широке розповсюдження у природі і важливість для живих систем. Особливий інтерес представляють сполуки, що вміщують у своєму складі піримідиновий фрагмент. Це викликано тим унікальним значенням, яке мають представники цього класу у біологічних процесах живих організмів. Слід також зазначити, що відомі із літератури способи одержання подібних структур характеризуються трудомісткістю, тривалістю, малими виходами та інше. Це слугувало одною із причин розробки зручного та ефективного методу синтезу похідних піридо[2,3-d]піримідину. Відомий спосіб одержання структурного аналога сполук формули І - 6-аміно-5-(β,β-диціано)N, N-диметил-5,6,7,8-тетрагідропіридо[2,3-d]піримідини формули II (назву сполук дано за номенклатурою авторів інформації) O CN H3C N CN O N II N (n) R , 20 25 де n= СН2; (СН2)2; СН2О; R = Н; СН3; описаний у [Pulak J. Bhuyan, Kushal.C. Lekhok, et. al., J. Chem. Res.Miniprint, 9, 1998,p.20282036]. Спосіб одержання відомої структури складається з 2-ох стадій і здійснюється за схемою: O H3C O CH2(CN)2 N N R 30 O O піперидин N (n) H3C O CN NC O н-бутанол N N R N H3C O (n) CN N CN N R N (n) На першій стадії до суміші 10 ммоль 5-форміл-6-діалкіламіно-1,3-диметилурацилу і 10 ммоль малононітрилу в 15 мл етанолу додають каталітичну кількість піперидину, масу перемішують 1 годину, потім нагрівають протягом 10 хвилин. Розчинник упарюють під вакуумом. Одержують 5-(β,β-диціановініл)-1,3-диметилурацил, який очищають на хроматографічній колонці (елюент - хлороформ). Виходи складають 70-85 %. 1 UA 102984 C2 5 10 На другій стадії (циклізація) 1 ммоль технічного 5-(β,β-диціановініл)-1,3-диметилурацилу в 15 мл н-бутанолу нагрівають 12 годин. Розчинник упарюють під вакуумом, залишок очищають хроматографічно (елюент - хлороформ-етилацетат). Одержують 6-аміно-5-(β,β-диціано)-N, Nдиметил-5,6,7,8-тетрагідропіридо[2,3-d]піримідини з виходами 75-80 %. Загальна тривалість технологічного процесу складає 14-15 годин (без урахування хроматографічної очистки). Одним із недоліків способу одержання сполук формули II є тривалість технологічного процесу. Спосіб одержання потребує очистки як проміжного, так і кінцевого продуктів із застосуванням хроматографічної колонки, що ускладнює процес і збільшує його тривалість. Крім того, одним із недоліків способу одержання є перегонка під вакуумом для упарювання розчинника, що також збільшує тривалість процесу. Відомий спосіб одержання структурного аналога формули І - 9,9-диціанозаміщені піридо[5,4с]хінолізини формули III O H3C CN N N O = N N CN N O , , де N III CH3 N CH3 , CH2C6H5 . N , 15 описаний у [Wamhoff Η., Kramer-Ηοββ V., Liebigs Ann./Recuel., 1997, p.p. 1619-1625]. Спосіб одержання сполук формули III складається з двох стадій і реалізується за схемою: O H3C O O O CH2(CN)2 N N CH3 N H3C CN NC толуол H3C N піперидин O O N CH3 N ZnCl2 O CN N CN N N CH3 20 25 30 35 40 На першій стадії рівномолярну суміш відповідного 5-форміл-6-діалкіламіно-1,3диметилурацилу і малононітрилу перемішують в абсолютному етанолі, додають 2-3 краплі піперидину, перемішування продовжують в інтервалі від 10 хвилин до 3,5 годин при кипінні. Після перекристалізації із етанолу одержують 2-[6-третаміно-1,3-диметил-2,4-(1Н, 3Н)діоксопіримідин-5-іл-метилен]малонодинітрил з виходами 43-93 %. На другій стадії відповідний 2-[6-третаміно-1,3-диметил-2,4-(1Н,3Н)-діоксопіримідин-5-ілметилен]малонодинітрил, одержаний на попередній стадії, нагрівають у 50 мл абсолютного толуолу у присутності двох еквівалентів плавленого ZnCl 2 протягом 48 годин. Після фільтрації розчинник видаляють під вакуумом. Продукт, що утворився, очищають на хроматографічній колонці (елюент - ацетонітрил). Виходи складають 3-5 %, лише 1 сполуку одержують з виходом 29 %. Указаний авторами вихід 65 % є помилкою розрахунку, насправді він складає 6,5 %. Загальна тривалість процесу складає приблизно 52 години (без урахування хроматографування). Недоліками способу одержання сполук формули III є тривалість технологічного процесу і дуже малі виходи кінцевих продуктів. Низькі виходи на другій стадії (3-5 %) в органічній хімії називаються слідовими, це може бути лише похибка або помилка при вимірюванні. Навпаки, дуже великий вихід проміжного продукту (93 %) після перекристалізації (на першій стадії) може означати, що в процесі реакції в реакційній суміші знаходилися або вихідні сполуки, що частково не вступили в реакцію, або побічні речовини. Тоді очистка технічного продукту може дати такий високий майже кількісний вихід реакції, що не відповідає істинному виходу кінцевих продуктів. Тривалість технологічного процесу (приблизно 52 години) обумовлена використанням такого розчинника толуолу із Т кип=110,6 °C, який не відповідає умовам циклізації і потребує 2 UA 102984 C2 5 10 наявності кислоти Льюїса (ZnCl2), причому у подвійній кількості. Крім того, продукти, одержані на першій стадії, потребують перекристалізації із етанолу, а на другій - хроматографічної очистки, що збільшує енергозатрати і робочий час. Використання вогненебезпечного розчинника - толуолу - не забезпечує пожежобезпечність одержання сполук за відомим способом. Вказані недоліки відомого способу одержання не дають можливості використовувати його у широких масштабах як у лабораторних дослідженнях, так і на виробництві хімічних речовин. Як прототип нами вибрано останній із наведених аналогів. В основу винаходу поставлено задачу розробки простого і доступного способу одержання 7,8-анельованих 6,6-диціанозаміщених піридо[2,3-d]піримідинів, який дозволяє підвищити вихід і якість кінцевих продуктів, зменшити тривалість технологічного процесу. Рішення поставленої задачі вирішується також тим, що у способі одержання 7,8анельованих 6,6-диціанозаміщених піридо[2,3-d]піримідинів, який включає конденсацію рівномолярних кількостей 5-форміл-6-діалкіламіно-1,3-диметилурацилу формули 15 O H3C O O N N N CH3 20 25 30 35 40 45 50 (n) , де n=0, СН2, О, СНСН3, СНСН2С6Н5, і малондінітрилу в органічному розчиннику у присутності каталізатора при кипінні, згідно з винаходом, як розчинник використовують метанол, як каталізатор - триетиламін, одержаний продукт циклізують кип'ятінням у безводному диметилформаміді протягом 2-3 годин, після чого осаджують ацетоном до утворення цільового продукту. Вибір як середовища для реакції на другій стадії диметилформаміду обумовлений не тільки тим, що він вогнебезпечний, але і високою температурою кипіння (Т кип=153 °C) у порівнянні з толуолом і бутанолом. Це сприяє прискореному протіканню хімічної реакції, що в свою чергу, приводить до значного зменшення часу синтезу до 2-3 годин. Висококиплячий, полярний, основний розчинник сприяє також значному підвищенню виходів цільових продуктів. Крім того, виключається процес очистки кінцевих продуктів. В зв'язку з цим, основні продукти - 7,8-анельовані 6,6-диціанозаміщені піридо[2,3-d]піримідини вже у процесі синтезу одержують достатньо чистими і не потребують додаткових перекристалізацій. Таким чином, виключаються додаткові витрати органічних розчинників для очистки цільових продуктів, здешевлюється їх вартість. Вихід кінцевих продуктів складає 85-97 %. Загальний час синтезу складає 2,5-3,5 години. Хімічну структуру сполук формули і за цим способом легко модифікувати, використовуючи відповідні заміщені 6-аміноскладової сполуки. Це дає можливість розширювати асортимент перспективних речовин даної структури з різними біологічними активностями. Експериментальним шляхом було установлено, що використання в якості розчинника низько киплячого спирту - метанолу (Ткип=65 °C) сумісно з новим основним каталізатором триетиламіном у процесі синтезу сполук формули І дозволяє одержувати проміжні продукти чистими без додаткових перекристалізацій. Така композиція "розчинник-основний каталізатор" дала можливість одержувати на першій стадії сполуки при кімнатній температурі протягом 1 години. До такого позитивного результату привела також заміна розчинника на другій стадії. Збільшення або зменшення часу кип'ятіння реакційної маси недоцільно, оскільки за цей проміжок часу реакція утворення цільових продуктів проходить повністю з високими виходами. 1 Після виділення їх із реакційної маси дані Н ЯМР спектроскопії підтверджують їх чистоту. У таблиці 1 наведено порівняльні дані способу, що заявляється, і способів одержання відомих аналогів. У таблиці 2 дано характеристики сполук формули І, одержаних за способом, що заявляється. Спосіб одержання 7,8-анельованих 6,6-диціанозаміщених піридо[2,3-d]піримідинів здійснюється за схемою: 3 UA 102984 C2 O H3C O 10 15 20 25 30 35 40 45 50 O метанол N(C2H5)3 N N CH3 5 O N H3C O (n) CN NC O ДМФА H3C N N CH3 O N (n) CN N CN N N CH3 На першій стадії до розчину рівномолярних кількостей відповідного 5-форміл-6-діалкіламіно1,3-диметилурацилу і малонодинітрилу у метанолі з 2-3 краплями триетиламіну нагрівають 1015 хвилин. Осад, що утворився, фільтрують, сушать. Одержаний на першій стадії продукт розчиняють в 1мл диметилформ-аміду кип'ятять протягом 2-3 години. Реакційну суміш охолоджують, обробляють 10 мл ацетону, осад відфільтровують та сушать. Одержують 7,8-анельовані 6,6-диціанозаміщені піридо[2,3d]піримідини з виходами 85-97 %. Нижче наведено приклад конкретного виконання синтезу. Приклад 1. Спосіб одержання 1,3-диметилпергідропіримідо[5',4':5,6]-піридо[2,1-с][1,4]оксазин-4а, 11а-ен-2,4-діон-6,6-дикарбонітрилу. До суміші 0,5г (2ммоль) 5-форміл-6,N-морфоліно-1,3-диметилурацилу та 0,15г (2ммоль) малонодинітрилу в 10мл метанолу додають 2-3 краплі триетиламіну. Реакційну масу нагрівають протягом 10 хвилин. Осад, що утворився, фільтрують та сушать. Одержаний 2-(1,3-диметил-6морфоліно-2,4-діон-1,2,3,4-тетрагідропіримідин-5-ілметилен)малононітрил не потребує додаткової очистки. Вихід 83 %. 0,5 г 2-(1,3-Диметил-6-морфоліно-2,4-діон-1,2,3,4-тетрагідропіримідин-5ілметилен)малононітрил в 1 мл безводного диметилформаміду нагрівають протягом 2-3 годин. Реакційну суміш охолоджують та обробляють 10 мл ацетону. Осад відфільтровують та сушать. Вихідні дані: вихід 0,49г (97 %), Т. пл 259-261 °C. Елементний аналіз - знайдено %: N 23,27. Обчислено %: 23,24. Спектри ядерного магнітного 1 резонансу (ЯМР Н ) виміряно на спектрометрі VARIAN Mercury VX-200 (200 МГц) у розчинах дейтеродиметилсульфоксиду (ДМСО-d6), внутрішній стандарт - тетраметилсилан; δ (м.ч.): 3,30 (3Н, с, СН3), 3,19(3Н, с, СН3). Приклад 2. Спосіб одержання 1,3-диметилпергідропіримідо[5,4-с]хіналізин-4а, 11а-ен-2,4діон-6,6-дикарбонітрилу. До суміші 0,5 г (2 ммоль) 5-форміл-6,N-піперидино-1,3-диметилурацилу та 0,15г (2 ммоль) малонодинітрилу в 10 мл метанолу додають 2-3 краплі триетиламiну. Реакційну масу нагрівають протягом 15 хвилин. Осад, що утворився, фільтрують та сушать. Одержаний 2-(1,3диметил-6-піперидино-2,4-діон-1,2,3,4-тетрагідропіримідин-5-ілметилен)малононітрил не потребує додаткової очистки. Вихід 92 %. 0,5г 2-(1,3-диметил-6-морфоліно-2,4-діон-1,2,3,4-тетрагідропіримідин-5ілметилен)малононітрил в 1 мл безводного диметилформаміду нагрівають протягом 3 годин. Реакційну суміш охолоджують та обробляють 10 мл ацетону. Осад відфільтровують та сушать. Вихідні дані: вихід 0,44г (87 %), Т. пл 300-301 °C. Елементний аналіз - знайдено %: N 23,23. Обчислено %: 23,20. 1 Спектри ядерного магнітного резонансу (ЯМР Н ) виміряно на спектрометрі VAR1AN Mercury VX-200 (200МГц) у розчинах дейтеродиметил-сульфоксиду (ДМСО-d6), внутрішній стандарт - тетраметилсилан; δ (м.ч.):3.29 (3Н, с, СН 3), 3,16 (3Н, с, СН3). Решту прикладів зведено в таблиці 2. Як видно із тексту матеріалів винаходу, що заявляється, технічне рішення має наступні переваги. Спосіб одержання сполук формули І дозволяє: - зменшити тривалість процесу до 2,5-3,5 годин; - збільшити виходи і якість сполук формули І за рахунок використання висококиплячого, вогнебезпечного, полярного, основної природи органічного розчинника диметилформаміду без застосування плавленого ZnCl2; - широко варіювати 6-аміну складову в 7,8-анельованих 6,6-диціанозаміщених піридо[2,3d]піримідинах; - зменшити шкідливі технологічні стоки диметилформаміду шляхом утилізації їх водою. Всі ці переваги способу одержання 7,8-анельованих 6,6-диціанозаміщених піридо[2,3d]піримідинів розширяють можливості його потенційного використання. 4 (n) UA 102984 C2 Таблиця 1 Очищення Розчинник Кількість Тривалість, Вихід, Застосування проміжних і кінцевих для стадій годин % каталізатора продуктів циклізації Безводний Перекристалізація Не 2 ~2,5-3,5 85-97 диметилкінцевого продукту потребується формамід Спосіб, що заявляється Pulak J. Bhuyan, Kushal.C. Lekhok, et. al., J. Chem. Res.Miniprint., 9, 1998, p. 2028-2036 Спосіб за [Wamhoff Η., Kramer-Ηοββ V., Liebigs Ann./Recuel., 1997, p.p. 1619-1625] 3-5, Перекристалізація і 29, хроматографування (6,5 %)* 2 ~52 2 ~14-15 ZnCl2 плавлений Толуол 75-85 Хроматографування н-Бутанол Не потребується *Авторами припущено помилку при розрахунку виходу (із 1г вихідного продукту одержано 65мг, що складає 6,5 %) Таблиця 2 O CN H3 C N CN Вихід, % 0 234-236 83 СН2 300-301 87 О 259-261 97 СНСН3 216-220 90 СНСН2С6H5 O Т. пл., °C 274-276 92 N 1 Спектр H ЯМР* N CH3 (n) n= 3,33 (3Н, с, СН3), 3,18(3Н, с.,СН3) 3,29 (3Н, с, СН3), 3,16 (3Н, с, СН3) 3,30 (3Н, с, СН3), 3,19 (3Н, с, СН3) 3,34 (3Н, с, СН3), 3,18 (3Н, с, СН3) 3,31 (3Н, с, СН3), 3,17 (3Н, с, СН3) * Зважаючи на складність мультиплетів та їх неіформативність, доцільно наводити лише значення хімічних зсувів метильних груп урацильного фрагменту при відсутності синглетів в області 8,0 м.ч. (сигнали вихідних сполук) 5 UA 102984 C2 ФОРМУЛА ВИНАХОДУ Спосіб одержання 7,8-анельованих 6,6-диціанозаміщених піридо[2,3-d]піримідинів формули O CN H3 C N CN O 5 N N (n) CH3 , де n = 0, СН2, О, СНСН3, СНСН2С6Н5, в якому здійснюють конденсацію рівномолярних кількостей 5-форміл-6-діалкіламіно-1,3диметилурацилу формули O CN H3C N CN O N R 10 N (n) , де n = 0, СН2, О, СНСН3, СНСН2С6Н5 і малондинітрилу в органічному розчиннику у присутності каталізатора при кип'ятінні, який відрізняється тим, що як розчинник використовують метанол, як каталізатор - триетиламін, одержаний продукт циклізують кип'ятінням у безводному диметилформаміді протягом 2-3 годин, після чого осаджують ацетоном. 15 Комп’ютерна верстка Л. Ціхановська Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 6
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of 7,8- annelated 6,6-dicyanosubstituted pyrido[2,3-d]pyrimidines
Автори англійськоюChernenko Vitalii Mykolaiovych, Hladkov Yevhenii Stanislavovych, Desenko Serhii Mykhailovych, Afanasiadi Liudmyla Mykhailivna
Назва патенту російськоюСпособ получения 7,8-аннелированных 6,6-дицианозамещенных пиридо[2,3-d]пиримидинов
Автори російськоюЧерненко Виталий Николаевич, Гладков Евгений Станиславович, Десенко Сергей Михайлович, Афанасиади Людмила Михайловна
МПК / Мітки
МПК: C07D 498/14, C07D 239/545, C07D 471/14
Мітки: одержання, піридо[2,3-d]піримідинів, спосіб, 7,8-анельованих, 6,6-диціанозаміщених
Код посилання
<a href="https://ua.patents.su/8-102984-sposib-oderzhannya-78-anelovanikh-66-dicianozamishhenikh-pirido23-dpirimidiniv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 7,8-анельованих 6,6-диціанозаміщених піридо[2,3-d]піримідинів</a>
Попередній патент: 7,8-анельовані 6-спірозаміщені піридо[2,3-d]піримідини і спосіб їх одержання
Наступний патент: Перев’язувальний засіб для профілактики гнійно-септичних ускладнень післяопераційної рани
Випадковий патент: Біогазова установка з тепловим насосом