7,8-анельовані 6-спірозаміщені піридо[2,3-d]піримідини і спосіб їх одержання
Номер патенту: 102983
Опубліковано: 27.08.2013
Автори: Афанасіаді Людмила Михайлівна, Десенко Сергій Михайлович, Черненко Віталій Миколайович, Гладков Євгеній Станіславович
Формула / Реферат
1. 7,8-Анельовані 6-спірозаміщені піридо[2,3-d]піримідини формули І
 , I
, I
де n=CH2; (CH2)2; CH2O.
2. 7,8-Анельовані 6-спірозаміщені піридо[2,3-d]піримідини формули II
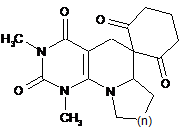 , II
, II
де n=CH2; (CH2)2; CH2O.
3. Спосіб одержання 7,8-анельованих 6-спірозаміщених піридо[2,3-d]піримідинів формули І або II, за яким здійснюють конденсацію рівномолярних кількостей 5-форміл-6-діалкіламіно-1,3-диметилурацилу формули
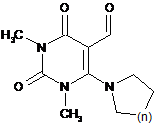 ,
,
де n=CH2; (CH2)2; CH2O;
і метиленактивної сполуки в органічному розчиннику у присутності каталізатора при кипінні, де як метиленактивну сполуку використовують відповідно 1,3-диметилбарбітурову кислоту або циклогексан-1,3-діон, як розчинник використовують метанол, як каталізатор - триетиламін, одержаний продукт циклізують кип'ятінням у безводному диметилформаміді протягом 2-3 годин, після чого осаджують ацетоном до утворення цільового продукту.
Текст
Реферат: Пропонуються 7,8-анельовані 6-спірозаміщені піридо[2,3-d]піримідини формули І та II H3C O H3C O O N N N CH3 та O N CH3 O N (n) I UA 102983 C2 (12) UA 102983 C2 O H3C O O N N CH3 O N (n) , II де n=CH2; (CH2)2; CH2O; і спосіб їх одержання конденсацією рівномоляних кількостей 5-форміл-6-діалкіламіно-1,3диметилурацилу і метиленактивної сполуки в органічному розчиннику у присутності каталізатора при кип’ятінні. Конденсацію проводять протягом 1 години. Одержаний продукт циклізують кип’ятінням у безводному диметилформаміді протягом 2-3 годин і осадженням ацетоном до утворення цільових продуктів. Технічне рішення дозволяє зменшити тривалість процесу, підвищити якість сполук і їх виходи реакції, забезпечує створення широкого асортименту 7,8-анельованих 6-спірозаміщених піридо[2,3-d]піримідинів для медицини, сільського господарства, фармації і т.ін. UA 102983 C2 Винахід стосується області органічної хімії і представляє нові 7,8-анельовані 6-спірозаміщені піридо[2,3-d]піримідини формули І та II H3C O H3C O N O N N O N O N CH3 CH3 (n) I 5 та O H3C O N O N CH3 10 15 20 25 O N (n) , II де n=CH2; (CH2)2; CH2O; Сполуки такого складу вже тривалий час привертають увагу хіміків-синтетиків. Обумовлено це декількома причинами, одна з яких - можливість маніпулювати їх структурою для досягнення необхідних фізичних, хімічних та фармокологічних властивостей. Не менш важливим фактором є їх широке розповсюдження у природі і важливість для живих систем. Особливий інтерес представляють сполуки, що вміщують у своєму складі піримідиновий фрагмент. Це викликано тим унікальним значенням, яке мають представники цього класу у біологічних процесах живих організмів. Відомо, що похідні піримідинів є основною субстанцією лікарських препаратів, що успішно використовують для лікування захворювань, викликаних вірусними ВІЛ та герпесу [Иванский В.И. Химия гетеро-циклических соединений, - М.: Высшая школа, 1978, 560 с], виявляють високу гіпнотичну активність, ефективні при лікуванні захворювань серцево-судинної і ендокринної систем [заявка ЕР № 203721, C07D 473/06]; [заявка ЕР № 267607, C07D 473/06], виявляють антиалергічну активність [G. Baziard-Mongsset et. Al., Eur. J. Med. Chem., 1995, 30, № 3, p. 253], діуретичний ефект антидепресивні властивості [Патент США № 5290782, C07D 473/02]. Відомий структурний аналог сполук, що заявляються, 6-аміно-5-(β,β-диціано)-N, N-диметил5,6,7,8-тетрагідропіридо[2,3-d]піримідини формули III (назву сполук наведено за номенклотурою авторів джерела) O H3C O 30 35 CN N CN N R N (n) , III де n=CH2; (CH2)2; CH2O; R=H; CH3; і спосіб його одержання [Pulak J. Bhuyan, Kushal. C. Lekhok, et. al., J. Chem. Res. Miniprint, 9, 1998, p. 2028-2036]. Спосіб одержання відомої структури складається з 2-ох стадій і здійснюється за схемою: 1 UA 102983 C2 O H3C N 15 20 25 піперидин N R 10 H3C CH2(CN)2 N O 5 O O CN NC O н-бутанол N O N N R (n) CN H3C N CN O N N R (n) (n) На першій стадії до суміші 10 ммоль 5-форміл-6-діалкіламіно-1,3-диметилурацилу і 10 ммоль малононітрилу в 15 мл етанолу додають каталітичну кількість піперидину і масу перемішують 1 годину, потім нагрівають протягом 10 хвилин. Розчинник упарюють під вакуумом. Одержують 5-(β,β-диціановініл)-1,3-диметилурацил, який очищають на хроматографічній колонці (елюент - хлороформ). Виходи складають 70-85 %. На другій стадії 1 ммоль технічного 5-(β,β-диціановініл)-1,3-диметилурацилу в 15 мл нбутанолу нагрівають 12 годин. Розчинник упарюють під вакуумом, залишок очищають хроматографією (елюент - хлороформ-етил-ацетат). Одержують тетрагідропіридо[2,3d]піримідини з виходами 75-80 %. Загальна тривалість технологічного процесу складає 14-15 годин. Одним із недоліків способу одержання сполук формули III є тривалість технологічного процесу. Спосіб також потребує очистки як проміжного, так і кінцевого продуктів із застосуванням хроматографічної колонки, що ускладнює процес і його тривалість. Крім того, одним із недоліків способу одержання є перегонка під вакуумом, що також збільшує тривалість процесу. Невідомо, чи може бути застосований спосіб одержання сполуки формули III, якщо як 6амінну складову буде використано циклічні шестичленні аміни. Температури кипіння розчинника (н-бутанолу), в якому походить циклізація, недостатньо для одержання таких сполук. Проведене нами дослідження за цією методикою підтвердило цей сумнів. Все це робить спосіб одержання сполуки формули III виборчим і не дозволяє розширити набір важливих фізіологічно активних речовин. Відомий аналог сполук, що заявляється, - за хімічною структурою і способом одержання 9,9диціанозаміщені піридо[5,4-с]хінолізини формули IV O H3C CN N O CN N N CH3 N 30 IV = N N де N O N CH3 , , CH2C6H5 , , і спосіб його одержання [Wamhoff H., Kramer-Hoßß V., Liebigs Ann. / Recuel., 1997, p.p. 16191625]. Спосіб одержання сполук формули IV складається з двох стадій і реалізується за схемою: 35 O H3C O O O N N CH3 N CH2(CN)2 піперидин H3C O CN NC N толуол N ZnCl2 N O CN N CN N N CH3 R 40 O H3C На першій стадії рівномолярну суміш відповідного 5-форміл-6-діалкиламіно-1,3диметилурацилу і малононітрилу перемішують в абсолютному етанолі, додають 2-3 краплі піперидину, перемішування продовжують в інтервалі від 10 хвилин до 3,5 годин при кипінні. 2 UA 102983 C2 5 10 15 20 25 Після перекристалізації із етанолу одержують 2-[6-третаміно-1,3-диметил-2,4-(1Н, 3Н)діоксопіримідин-5-іл-метилен]малонодинітрил з виходами 43-93 %. На другій стадії відповідний 2-[6-третаміно-1,3-диметил-2,4-(1Н, 3Н)-діоксопіримідин-5-ілметилен]малонодинітрил, одержаний на попередній стадії, нагрівають у 50 мл абсолютного толуолу у присутності двох еквівалентів ZnCl2 протягом 48 годин. Після фільтрації розчинник видаляють під вакуумом. Продукт, що утворився, очищають на хроматографічній колонці (елюент - ацетонітрил). Виходи складають 3-5 %, лише 1 сполуку одержують з виходом 29 %. Указаний авторами вихід 65 % є помилкою розрахунку, насправді він складає 6,5 %. Загальна тривалість процесу складає приблизно 52 години. Недоліками способу одержання сполук формули IV є тривалість технологічного процесу і дуже малі виходи кінцевих продуктів. Низькі виходи на другій стадії (3-5 %) в органічній хімії називаються слідовими, це може бути лише похибка або помилка при вимірюванні. Навпаки, дуже великий вихід проміжного продукту (93 %) після перекристалізації (на першій стадії) може означати, що в процесі реакції в реакційній суміші знаходилися або вихідні сполуки, що частково не вступили в реакцію, або побічні речовини. Тоді очистка технічного продукту може дати такий високий майже кількісний вихід реакції, що не відповідає істинному виходу кінцевих продуктів. Тривалість технологічного процесу (52 години) обумовлена використанням такого розчинника толуолу з Т кип=110,6 °C, який не відповідає умовам циклізації і потребує наявності кислоти Льюїса (ZnCl2), причому у подвійній кількості. Крім того, продукти, одержані на першій стадії, потребують перекристалізації із етанолу, а на другій - хроматографічної очистки, що збільшує енергозатрати і робочий час. Як прототип до сполук, що заявляються, вибрано останній із наведених аналогів. В основу винаходу поставлено задачу пошуку нових сполук у низці піридо[2,3-d]піримідинів, а також простого способу одержання таких сполук, що дозволяє скоротити тривалість процесу, підвищити виходи реакції і їх якість. Рішення поставленої задачі забезпечується розробкою нових 7,8-анельованих 6спірозаміщених піридо[2,3-d]піримідинів формули І H3C O H3C O N O N N O N O N CH3 CH3 (n) .I 30 Рішення поставленої задачі забезпечується спірозаміщених піридо[2,3-d]піримідинів формули II O H3C O розробкою нових 7,8-анельованих 6 O N N CH3 O N (n) . II 35 Рішення поставленої задачі вирішується також тим, що у способі одержання сполук формули І та II, який включає конденсацію рівномолярних кількостей 5-форміл-6-диалкіламіно1,3-диметилурацилу формули 3 UA 102983 C2 O H3C O O N N N CH3 5 10 15 20 25 30 35 (n) де n=CH2; (CH2)2; CH2O; і метиленактивної сполуки в органічному розчиннику у присутності каталізатора при кипінні, згідно з винаходом, як метиленактивну сполуку використовують відповідно 1,3диметилбарбітурову кислоту або циклогексан-1,3-діон, як розчинник використовують метанол, як каталізатор - триетиламін, одержаний продукт циклізують кип'ятінням у безводному диметилформаміді протягом 2-3 годин, і після чого осаджують ацетоном до утворення цільвого продукту. Експериментальним шляхом було установлено, що використання як розчинника низькокиплячого спирту - метанолу - сумісно з новим основним каталізатором - триетиламіном у процесі синтезу сполук, що заявляються, дозволяє одержувати проміжні продукти чистими без додаткових перекристалізацій. Така композиція "розчинник-основний каталізатор" дала можливість одержувати на першій стадії сполуки при кімнатній температурі протягом 1 години (у прототипі композиція "етанол-піперидин" забезпечує проведення конденсації при кип'ятінні протягом від 10 хвилин до 3,5 годин в залежності від характеру 6-амінної складової). До такого позитивного ефекту привела також заміна розчинника на другій стадії. Використання диметилформаміду виключає використання кислоти Льюіса (ZnCl 2), як у прототипі. У способі одержання сполук, що заявляються, диметилформамід з Т кип=153 °C виконує функцію високополярного висококиплячого розчинника. Така заміна розчинника забезпечує високу швидкість протікання реакції і дає можливість не тільки суттєво зменшити тривалість синтезу (у способі-прототипі 48 годин нагрівання, а в способі, що заявляється, 3,03,5 години в тих же умовах), але і одержувати чисті сполуки відразу у процесі синтезу без хроматографування кінцевих продуктів. Це забезпечує також одержання стабільно високих виходів реакції 85-97 %. Спосіб одержання сполук формули І та II, що заявляються, дозволяє видозмінювати структуру сполук і вводити у 10-положення молекули піридо[2,3-d]піримідину складні гетероциклічні залишки (у прототипі - лише нітрильні групи). Збільшення або зменшення часу кип'ятіння реакційної маси недоцільно, оскільки за цей проміжок часу реакція утворення цільових продуктів проходить повністю з високими виходами. 1 Після виділення їх із реакційної маси дані Н ЯМР-спектроскопії підтверджують їх чистоту. У таблиці 1 наведено порівняльні дані способу, що заявляється, і способів одержання відомих аналогів. У таблиці 2 дано характеристики сполук формули І та II, що заявляються. Спосіб одержання анельованих піридо[2,3-d]піримідинів здійснюється за схемою: 4 UA 102983 C2 H3C O N O O CH3 O H3C N O H3C O CH3 O R ДМФА H3C N N O N CH3 (n) І O O O H3C O CH3 (n) O метанол N(C2H5)3 O N N CH3 N (n) O N N O O метанол N(C2H5)3 N O N O N CH3 O N O H3C N O O N ДМФА H3C O N N N (n) O N CH3 N CH3 O (n) ІІ . 5 10 15 20 25 30 35 40 На першій стадії до розчину рівномолярних кількостей відповідного 5-форміл-6-діалкіламіно1,3-диметилурацилу і метиленактивної сполуки (1,3-диметилбарбітурова кислота або циклогексан-1,3-діон) в 10 мл метанолу, при перемішуванні додають 2-3 краплі триетиламіну. Суміш перемішують 1 годину при кімнатній температурі. Після фільтрації одержують метиліденові похідні (продукти конденсації Кновенагєля). На другій стадії відповідний урацил (5 ммоль), що одержано на попередній стадії, кип'ятять 2-3 години в 1 мл безводного диметилформаміду. Реакційну суміш при охолодженні висаджують 10 мл ацетону. Одержують анельовані піридо[2,3-d]піримідини І та II з виходми 8597 %. Нижче наведно приклади конкретного виконання синтезу. Приклад 1. Спосіб одержання 1",3'-диметилпергідроспіро[циклогексан-2,6'піримідо[5',4':5,6]піридо[2,1-с][1,4]оксазин]-4а',11а'-ен-1,2',3,4'-тетраону формули І. До суміші 0,5 г (2 ммоль) 5-форміл-6,N-морфоліно-1,3-диметилурацилу та 0,23 г (2 ммоль) циклогексан-1,3-діону в 10 мл метанолу додають 2-3 краплі триетиламіну. Реакційну масу нагрівають протягом 10-15 хвилин. Осад, що утворився, фільтрують та сушать. Одержаний 5(2,6-дициклогексиліденметил)-1,3-диметил-6-морфолінопіримідин-2,4-(1Н, 3Н)-діон не потребує додаткової очистки. Вихід складає 89 %. 0,45 г 5-(2,6-Дициклогексиліденметил)-1,3-диметил-6-морфолінопіримідин-2,4-(1Н, 3Н)-діону в 1 мл безводного диметилформаміду нагрівають протягом 2-3 годин. Реакційну суміш охолоджують та обробляють 10 мл ацетону. 1",3'-Диметилпергідроспіро[циклогексан-2,6'піримідо[5',4':5,6]піридо[2,1-с][1,4]оксазин]-4а',11а'-ен-1,2",3,4'-тетраон фільтрують та перекристалізовують (ацетон-бензол). Вихідні дані: вихід 0,37 г (81 %), Т. пл 250-254 °C Елементний аналіз - знайдено %: N 12,11 Обчислено %: 12,10. 1: Спектр ЯМР Н 3,26 (3Н, с, СН3), 3,12 (3Н, с, СН3). При цьому, зважаючи на складність мультиплетів та їх неіформативність, доцільно наводити лише значення хімічних зсувів метильних груп при відсутності синглетів в області 8,0 м.ч. (сигнали вихідних сполук). Приклад 2. Спосіб одержання 1,1",3,3'-тетраметилпергідроспіро[піримідин-5,6'піримідо[5',4':5,6]піридо[2,1-с][1,4]оксазин]-4а',11а'-ен-1,2',3,4'-тетра-ону формули II. До суміші 0,5 г (2 ммоль) 5-форміл-6,N-морфоліно-1,3-диметилурацилу та 0,3 г (2 ммоль) 1,3-диметилбарбітурової кислоти в 10 мл метанолу додають 2-3 краплі триетиламіну. Реакційну масу нагрівають протягом 10-15 хвилин. Осад, що утворився, фільтрують та сушать. Одержаний 5-(1,3-диметил-6,N-морфоліно-2,4-діоксо-1,2,3,4-тетрагідропіримідин-5-ілметилен)1,3-диметилпіримідин-2,4,6(1H, 3Н, 5Н)трион не потребує додаткової очистки. Вихід складає 95 %. 0,5 г 5-(1,3-Диметил-6,N-морфоліно-2,4-діоксо-1,2,3,4-тетрагідропіримідин-5-ілметилен)-1,3диметилпіримідин-2,4,6(1Н, 3Н, 5Н)-триону в 1 мл безводного диметилформаміду нагрівають протягом 2-3 годин. Реакційну суміш охолоджують та обробляють 10 мл ацетону. 1,1",3,3' 5 UA 102983 C2 5 10 15 20 25 Тетраметилпергідроспіро[піримідин-5,6'-піримідо[5',4':5,6]піридо[2,1-с][1,4]оксазин]-4а',11а'-ен1,2',3,4'-тетраон фільтрують та перекристалізовують (ацетон-бензол). Вихідні дані: вихід 0,46 г (93 %), Т. пл 257-258 °C. Елементний аналіз - знайдено %: N 17,89. Обчислено %: 17,89. 1 Спектри ядерного магнітного резонансу (ЯМР Н ) виміряно на спектрометрі VARIAN Mercury VX-200 (200 МГц) у розчинах дейтеро-диметилсульфоксиду (ДМСО-d6), внутрішній стандарт тетраметилсилан; δ (м.ч.): 3,25 (3Н, с, СН3), 3,17(3Н, с, СН3), 3,16(3Н, с, СН3), 3,07(3Н, с, СН3). Решту прикладів зведено в таблиці 2. Як видно із тексту матеріалів, що заявляються,технічне рішення, що пропонується, має наступні переваги: - структура, що заявляється, забезпечує одержання широкого набору анельованих піридо[2,3-d]піримідинів з покращеними характеристиками і високим ступенем чистоти, що не потребують додаткової хроматографічної очистки. Спосіб одержання сполук формули І та II, що заявляються, дозволяє: - зменшити тривалість процесу; - збільшити виходи і якість сполук формули І та II за рахунок проведення конденсації у безводному диметилформаміді; - широко варіювати як метиленактивну сполуку у 6-положенні піридо[2,3-d]піримідину, так і амінну складову; - зменшити шкідливі технологічні стоки диметилформаміду шляхом утилізації його водою (у прототипі розчинник толуол не змішується з водою). Всі ці переваги нових складних гетероциклічних сполук і способу їх одержання розширяють можливості їх потенційного використання як фізіологічно активних речовин, хімічних засобів захисту рослин і т. ін. Спосіб одержання сполук формули І та II простий, енергоекономічний і може застосовуватися в умовах як лабораторії, так і промисловості. Таблиця 1 Спосіб, що заявляється Спосіб за прототипом Спосіб за [Wamhoff Н., KramerHoßß V., Liebigs Ann. / Recuel., 1997, p.p. 1619-1625] Очищення Кількість Тривалість, Розчинник для Застосування Вихід, % проміжних і кінцевих стадій годин циклізації каталізатора продуктів Перекристалізація Безводний Не 2 ~3-3,5 85-97 кінцевого продукту диметилформамід потребується 3-5, Перекристалізація і ZnCl2 2 ~52 29, Толуол хроматографування плавлений (6,5 %)* 2 ~14-15 75-85 Хроматографування н-Бутанол Не потребується * Авторами припущено помилку при розрахунку виходу (із 1 г вихідного продукту одержано 65 мг, що складає 6,5 %) 6 UA 102983 C2 Таблиця 2 Сполука Структура Т. пл., °C 1 H3C N N O N CH3 257-258 93 3,25 (3Н, с.,СН3), 3,17 (3Н, с.,СН3), 3,16 (3Н, с, СН3), 3,07 (3Н, с, СН3). 79 3,25 (3Н, с, СН3), 3,15 (3Н, с, СН3). 76 3,24 (3Н, с, СН3), 3,13 (3Н, с, СН3). O N O N N O 89 3,24 (3Н, с, СН3), 3,16 (3Н, с, СН3), 3,15 (3Н, с, СН3), 3,09 (3Н, с, СН3). 225-227 (n) H3C H3C CH3 O N O 80 O N O 3,23 (3Н, с.,СН3), 3,15 (3Н, с, СН3), 3,14 (3Н, с, СН3), 3,10 (3Н, с.,СН3). 243-246 O Спектр Н ЯМР* 220-221 H3C Вихід, % N CH3 238-240 O N CH3 H3C O H3C O N O N N O N O N CH3 O H3C O O N O N O O O N CH3 H3C CH3 (n) O N N N O CH3 7 UA 102983 C2 O H3C O N 250-254 O N O N CH3 81 3,26 (3Н, с, СН3), 3,12 (3Н, с, СН3). O * Зважаючи на складність мультиплетів та їх неіформативність, доцільно наводити лише значення хімічних зсувів метильних груп при відсутності синглетів в області 8,0 м.ч. (сигнали вихідних сполук). ФОРМУЛА ВИНАХОДУ 1. 7,8-Анельовані 6-спірозаміщені піридо[2,3-d]піримідини формули І 5 H3C O H3C O N O N N O N O N CH3 CH3 (n) ,I де n=CH2; (CH2)2; CH2O. 2. 7,8-Анельовані 6-спірозаміщені піридо[2,3-d]піримідини формули II 10 O H3C O N O N CH3 15 (n) , II де n=CH2; (CH2)2; CH2O. 3. Спосіб одержання 7,8-анельованих 6-спірозаміщених піридо[2,3-d]піримідинів формули І або II, за яким здійснюють конденсацію рівномолярних кількостей 5-форміл-6-діалкіламіно-1,3диметилурацилу формули O H3C O O N N N CH3 20 O N (n) , де n=CH2; (CH2)2; CH2O; і метиленактивної сполуки в органічному розчиннику у присутності каталізатора при кипінні, де як метиленактивну сполуку використовують відповідно 1,3-диметилбарбітурову кислоту або циклогексан-1,3-діон, як розчинник використовують метанол, як каталізатор - триетиламін, 8 UA 102983 C2 одержаний продукт циклізують кип'ятінням у безводному диметилформаміді протягом 2-3 годин, після чого осаджують ацетоном до утворення цільового продукту. Комп’ютерна верстка Л. Бурлак Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 9
ДивитисяДодаткова інформація
Назва патенту англійською7,8-annelated 6-spirosubstituted pyrido[2,3-d]pyrimidines and a process for the preparation thereof
Автори англійськоюChernenko Vitalii Mykolaiovych, Hladkov Yevhenii Stanislavovych, Desenko Serhii Mykhailovych, Afanasiadi Liudmyla Mykhailivna
Назва патенту російською7,8-аннелированные 6-спирозамещенные пиридо[2,3-d]пиримидины и способ их получения
Автори російськоюЧерненко Виталий Николаевич, Гладков Евгений Станиславович, Десенко Сергей Михайлович, Афанасиади Людмила Михайловна
МПК / Мітки
МПК: C07D 471/22, C07D 239/545, C07D 498/14, C07D 471/14, C07D 498/22
Мітки: піридо[2,3-d]піримідини, 6-спірозаміщені, одержання, спосіб, 7,8-анельовані
Код посилання
<a href="https://ua.patents.su/11-102983-78-anelovani-6-spirozamishheni-pirido23-dpirimidini-i-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">7,8-анельовані 6-спірозаміщені піридо[2,3-d]піримідини і спосіб їх одержання</a>
Попередній патент: Спосіб хірургічного лікування ускладнених дивертикулів стравоходу
Наступний патент: Спосіб одержання 7,8-анельованих 6,6-диціанозаміщених піридо[2,3-d]піримідинів
Випадковий патент: Насадка для відстрілу спеціальних пристроїв несмертельної дії












