Спосіб отримання каталітично активних антитіл (абзимів) із сіалідазною активністю
Номер патенту: 105278
Опубліковано: 25.04.2014
Автори: Біла Євгенія Євгенівна, Кіт Юрій Ярославович, Білий Ростислав Олександрович
Формула / Реферат
1. Спосіб отримання каталітично активних антитіл з сіалідазною активністю, шляхом імунізації організму кроля кон’югатами гаптену та високомолекулярного (білкового) носія, який відрізняється тим, що як гаптен використовуються похідні інгібітора(ів) сіалідазної реакції.
2. Спосіб отримання каталітично активних антитіл з сіалідазною активністю за п. 1, який відрізняється тим, що для імунізації використовують похідні інгібітора 2,3-дегідро-2-деокси-N-ацетилнейрамінової кислоти чи інших інгібіторів нейрамінідаз.
Текст
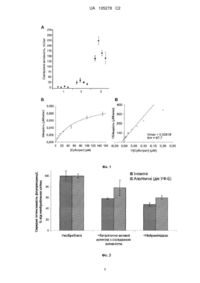
Реферат: Винахід належить до галузі імунології, клітинної біології, клінічної діагностики, біоорганічної хімії і може використовуватись для створення каталітично активних антитіл з сіалідазною активністю. Відповідно до заявленого способу каталітично активні антитіла з сіалідазною активністю отримують внаслідок імунізації організму кон'югатами гаптену та UA 105278 C2 (12) UA 105278 C2 високомолекулярного (білкового) носія, причому як гаптен використовують похідні інгібітора(ів) сіалідазної реакції. UA 105278 C2 5 10 15 20 25 30 35 40 45 50 55 60 Винахід належить до галузі імунології, клітинної біології, клінічної діагностики, біоорганічної хімії і може використовуватись для створення каталітично-активних антитіл з сіалідазною активністю. Антитіла (імуноглобуліни, здатні специфічно розпізнавати певний антиген), які виявляють каталітичні властивості отримали назву абзимів. Дані антитіла можуть бути виділені із сироватки крові людини при різних захворюваннях (природні абзими) [Paul, Voile, Beach, Johnson, Powell and Massey, Catalytic hydrolysis of vasoactive intestinal peptide by human autoantibody. Science, 1989. 244.1158-62], або створені штучних (індукованих) абзимів шляхом імунізації тварин кон'югатами низькомолекулярних синтетичних аналогів сполук, що імітують перехідний стан певної хімічної реакції (гаптенами) із високомолекулярним полімерним носієм (білком) [Tramontane Janda and Lemer, Catalytic antibodies. Science, 1986. 234.1566-70, Pollack, Jacobs and Schultz, Selective chemical catalysis by an antibody. Science, 1986. 234.1570-3]. Відомі каталітично активні-антитіла з сіалідазною активністю, виділені з сироватки пацієнтів із захворюваннями, пов'язаними з гіперфункцією В-лімфоцитів при деяких захворюваннях, зокрема множинної мієломи [Bilyy, Tomin, Mahorivska, Shalay, Lohinskyy, Stoika and Kit, Antibodymediated sialidase activity in blood serum of patients with multiple myeloma. J Моl Recognit, 2011. 24.576-84] та системного червоного вовчака [Bilyy, Tomin, Tolstyak, Havrylyuk, Chopyak, Kit and Stoika, Cell surface glycans at SLE. changes during cells death, utilization for disease detection and molecular mechanism underlying their modification. Autoimmune Disorder / Book 1, 2011. 89-110]. Дані абзими здатні десіалувати ряд біологічних мішеней, серед яких гангліозиди, глікопротеїни мембран еритроцитів, глікокалікс евкаріотичних клітин. Десіалування вуглеводневих детермінант апоптичних клітин здатне посилювати їх фагоцитоз, що може слугувати запобіжним механізмом виникнення деяких автоімунних захворювань у людини [Meesmann, Fehr, Kierschke, Herrmann, Bilyy, Heyder, Blank, Krienke, Lorenz and Schiller, Decrease of sialic acid residues as an eat-me signal on the surface of apoptotic lymphocytes. J Cell Sci, 2010. 123.3347-3356] і може стати перспективним підходом до терапії автоімунних захворювань [Bilyy, Shkandina, Tomin, Munoz, Franz, Antonyuk, Kit, Zirngibl, Furnrohr, Janko, Lauber, Schiller, Schett, Stoika and Herrmann, Macrophages discriminate glycosylation patterns of apoptotic cell-derived microparticles. J Biol Chem, 2012. 287.496-503, Munoz, Lauber, Schiller, Manfredi and Herrmann, The role of defective clearance of apoptotic cells in systemic autoimmunity. Nat Rev Rheumatol, 2010. 6.280-9]. Оскільки абзими із сіалідазною активністю присутні в сироватці крові хворих на автоімунні і онкогематологічні захворювання, природа яких є недостатньо вивченими, терапевтичне використання препаратів антитіл очищених із сироватки крові пацієнтів є клінічно ризикованим і недоцільним із біоетичних міркувань. Використання вірусних і бактерійних нейрамінідаз є обмеженим у зв'язку із їх імуногенністю і високою патогенністю [Kim, Oh, Kang and Kwon, Features and applications of bacterial sialidases. Applied Microbiology and Biotechnology, 2011. 91.1-15] [Shtyrya, Mochalova and Bovin, Influenza virus neuraminidase: structure and function. Acta Naturae, 2009. 1.26-32], a використання людських рекомбінантних сіалідаз обмежене через їх нестійкість у зберіганні та високою собівартістю [Miyagi and Yamaguchi, Mammalian sialidases: Physiological and pathological roles in cellular functions. Glycobiology, 2012. 22.880-896]. За технічною суттю запропонований спосіб отримання штучних каталітично-активних антитіл із сіалідазною активністю є типовим для отримання індукованих абзимів і здійснюється шляхом імунізації тварин (у даному випадку кролів) гаптенами, що імітують перехідний стан каталізованої ензиматичної реакції; Введення в організм таких кон'югованих з білками гаптенів призводить до утворення спектру антитіл, серед яких є і ті, що стабілізують сполуку у перехідному стані каталізованої реакції і в такий спосіб знижують енергію активації каталізованої реакції та забезпечують її проходження. Прикладом отримання індукованих абзимів можуть слугувати зокрема: А. спосіб отримання штучних каталітично-активних антитіл здатних розщеплювати фосфорорганічні сполуки (напр. зарин) [Міжнародна заявка WO/2003/039471 від 06.11.2002, МПК С07К 16/40 (2006.01), C12N 5/16 (2006.01), Catalytic Antibodies Raised Against Sarin And Process For The Preparation Thereof // Опубл. 15.05.2003]. Даний спосіб базуються на синтезі гаптену, який б імітував сполуки перехідного стану розщеплення зарину, шляхом кон'югації 12 6 Сr(ІІІ) трієну з N ,N -ди(О,О-діізопропіл)фосфорил-L-лізином, його кон'югацією з гемоціаніном та проведенням наступною імунізації. Недоліком даного способу є його обмеженість щодо вибору відподних-сполук-антигенів, які здатні мімікувати лише фосфорорганічні сполуки як субстрати каталізованої ензиматичної реакції. Б. спосіб отримання штучних каталітично-активних антитіл здатних розщеплювати кокаїн [Міжнародна заявка WO/1993/020076 від 02.04.1993, МПК А61К 47/48 (2006.01), C07D 451/02 (2006.01), C07F 9/6561 (2006.01), C07F 9/6571 (2006.01), C07F 9/6584 (2006.01), С07К 16/44 1 UA 105278 C2 5 10 15 20 25 (2006.01), C12N 9/00 (2006.01), А61К 38/00 (2006.01), Catalytic Antibodies Against Cocaine And Methods Of Using And Producing Same // Опубл. 14.10.1993, патент Канади СА2132982 від 26.09.1994, патент США US 08313291 від 03.10.1994, Європейський патент ЕРО 1993910571 від 03.11.1994]. Даний спосіб базуються на синтезі гаптену, який б імітував сполуки перехідного стану розщеплення кокаїну - кокаїн бензоїл естерів, шляхом багатостадійного синтезу з ряду попередників; метод передбачає імунізацію тварин отриманими гаптенами чи їх кон'югатами з білками та наступну імунізацію тварин з метою отримання каталітично-активних антитіл до кокаїну. Недоліком даного способу є його направленість на утворення лише каталітичноактивних антитіл, здатних розщеплювати кокаїн та складна багатостадійна схема синтезу гаптенів. Спільним недоліком даних підходів щодо отримання індукованих абзимів є оригінальний спосіб синтезу гаптенів направлених на індукцію абзимів із заданою каталітичною активність (фосфорорганічні сполуки чи кокаїн) та відсутністю технічних рішень для забезпечення індукції каталітично-активних антитіл з сіалідазною активністю чи представлення уніфікованих підходів, які могли б бути використані для утворення каталітично-активних антитіл з сіалідазною активністю. В основу винаходу поставлено задачу розробки способу отримання каталітично-активних антитіл з сіалідазною активністю. Поставлена задача вирішується тим, що для отримання каталітично-активних антитіл з сіалідазною активністю, для імунізації кролів як антигену, згідно з винаходом, як гаптен (імуногенний агент), використовують синтетичне похідне інгібітора сіалідаз, кон'югованого із високомолекулярним носієм - молекулою білка. Спосіб індукції антитіл з каталітичною активністю полягає в наступному. Авторами вперше для індукції каталітично-активних антитіл з сіалідазною активністю запропоновано спосіб використання як гаптену похідних інгібіторів сіалідаз (нейрамінідаз), що базується на кон'югації молекули інгібітора, який містить карбоксильну чи амідну групу, з молекулою білка-носія, шляхом реакції перехресної-зшивки нульової довжини за схемою: O N O O N O O O O O DANA O O N O O H H N+ N C O OH + H3C O O H3 C Cl H3C CH3 N N + Cl N H3 C H CH3 активний інтермедіат О-ацилізосечовини EDC O + H3 C 40 N+ N H ізосечовина 30 35 N Cl CH3 CH3 де DANA-2,3-дегідро-2-деокси-N-ацетилнейрамінова кислота, інгібітор нейрамінідаз, що містить карбоксильну групу, EDC-1-етил-3-(3-диметиламінопропіл)карбодіімід гідрохлорид, R високомолекулярний носій, наприклад, молекула білка. Дана схема може бути модифікована для кон'югації інгібітора нейрамінідаз, що містить амінну групу, з карбоксильною групою у складі білка. Для індукції антитіл з каталітичною сіалідазною активністю створюють синтетичний гаптен, який використовують для імунізації. Розчиняють білок-носій (бичачий сироватковий альбумін чи гемоціанін Megathura crenulata, чи будь-який інший білок) у концентрації 10 мг/мл в реакційному середовищі 0,1 MES (2-(N-морфоліно)етансульфонової кислоти), рН 4,7. Розчиняють інгібітор, 2 UA 105278 C2 5 10 15 20 25 30 35 40 45 50 55 60 який слід кон'югувати з білком (DANA чи озельтамівіру чи будь-якого іншого інгібітора нейрамінідазної активності), в 1М буфері MES, рН 4,7. Додають розчин інгібітора до реакційної суміші з білком у принаймні 10-ти кратному (молярному) надлишку щодо вмісту білка. Додають EDC до реакційної суміші у принаймні 10-ти кратному молярному надлишку щодо кількості білка. Перемішують до розчинення та інкубують 2 години при 25 °C. Кон'югат очищають гельфільтрацією на сефадексі G-50 чи діалізом, використовуючи розчин 0,01 М натрій фосфату, 0,15 М натрій хлориду, рН 7,4. Отримані гаптени використовують для імунізації тварин, наприклад кролів. Імунізацію кролів здійснюють шляхом змішування гаптену DANA-білок (20 г/ін'єкцію) та ад'юванта Фрейнда (50 г/ін'єкцію) у забуференому фізіологічному розчині (ЗФР) із загальним об'ємом 400 мкл. Для серії імунізації використовували повний ад'ювант Фрейнда при першій імунізації, неповний ад'ювант Фрейнда при другій та третій імунізаціях та лише розчин гаптену при четвертій імунізації. Період між імунізаціями становив два тижні. Через 10 днів після четвертої імунізації забирали зразки крові та проводили виділення антитіл як описано раніше [Kit, Bilyy, Stoika, Mitina and Zaichenko, Immunogenicity and Adjuvant Properties of Novel Biocompatible Nanoparticles. Biocompatible Nanomaterials: Synthesis, Characterization and Applications, 2010. 209-223]. Запропонований метод відрізняється від раніше описаних тим, що: - Дозволяє отримати каталітично-активні антитіла з сіалідазною активністю - Для індукції даних антитіл як гаптен використовується кон'югат похідного інгібітора сіалідаз (нейрамінідаз), наприклад, DANA чи іншої сполуки, та високомолекулярного (білкового) носія. На Фіг. 1 зображено: А - Результати визначення сіалідазної активності в зразках: 1 сироваток контрольних кролів; 2 - фракціях імуноглобулінів імунізованих кролів; 3 - фракціях імуноглобулінів класу IgG імунізованих кролів. Б - результати аналізу кінетичних властивостей сіалідазної реакції, каталізованої очищеними імуноглобулінами класу IgG. Графік МіхаелісаМентен. В - результати аналізу кінетичних властивостей сіалідазної реакції, каталізованої очищеними імуноглобулінами класу IgG. Графік Лайнуївера-Берка На Фіг. 2 зображено аналіз вмісту сіалілвмісних глікокон'югатів на поверхні Т-клітин лейкемії 2 людини лінії Jurkat, інтактних та апоптичних (опромінених ультрафіолетом УФ-Б, 180 мДж/см за 14 годин до початку експерименту): необроблених, оброблених каталітично-активними антитілами з сіалідазною активністю та нейрамінідазою. В усіх випадках обробка здійснена -1 зразком з активністю 30 mU (30 нМоль*хв. ) протягом 4 год. Можливість реалізації способу показано на наступних прикладах. Приклад 1. Отримання каталітично-активних антитіл з сіалідазною активністю. Розчиняли білки-носії (бичачий сироватковий альбумін та гемоціанін Megathura crenulata) у концентрації 10 мг/мл в реакційному середовищі 0,1 MES, рН 4,7. Розчиняли інгібітор DANA в 1 М буфері MES, рН 4,7. Додавали розчин інгібітора до реакційної суміші з білком у 10-ти кратному молярному надлишку щодо вмісту білка. Додавали EDC до реакційної суміші у 10-ти кратному молярному надлишку щодо кількості білка. Перемішували до розчинення та інкубували 2 години при 25 С. Кон'югат очищали діалізом, використовуючи розчин 0,01 М натрій фосфату, 0,15 М натрій хлориду, рН 7,4. Отримані гаптени використовують для імунізації кролів. Імунізацію кролів здійснювали шляхом змішування гаптену DANA-білок (20 г/ін'єкцію) та ад'юванта Фрейнда (50 л/ін'єкцію) у забуференому фізіологічному розчині (ЗФР) із загальним об'ємом 400 мкл. Для серії імунізації використовували повний ад'ювант Фрейнда при першій імунізації, неповний ад'ювант Фрейнда при другій та третій імунізаціях та лише розчин гаптену при четвертій імунізації. Тваринам контрольної групи проводили таку ж схему імунізацій, але замість гаптену використовували ЗФР. Період між імунізаціями становив два тижні. Через 10 днів після четвертої імунізації забирали зразки крові та проводили виділення антитіл сироватки крові як описано раніше [Kit, Bilyy, Stoika, Mitina and Zaichenko, Immunogenicity and Adjuvant Properties of Novel Biocompatible Nanoparticles. Biocompatible Nanomaterials: Synthesis, Characterization and Applications, 2010. 209-223]. Для імунізації використовували 4 контрольних тварин, та 4 тварин, яких імунізували гаптеном. За потреби з фракції антитіл сироватки крові додатково очищали фракцію імуноглобулінів класу IgG, використовуючи афінну хроматографію на пpoтeїн-G-сефарозі за стандартними процедурами [Bilyy, Tomin, Mahorivska, Shalay, Lohinskyy, Stoika and Kit, Antibody-mediated sialidase activity in blood serum of patients with multiple myeloma. J Моl Recognit, 2011. 24.576-84]. Результати визначення сіалідазної активності в зразках сироваток кролів контрольної групи (1); фракціях імуноглобулінів кролів, імунізованих гаптеном (2), та фракціях імуноглобулінів класу IgG кролів, імунізованих гаптеном (3), представлені на Фіг. 1 (А). Для отриманих препаратів каталітично-активних антитіл IgG з сіалідазною активністю визначали кінетичні параметри сіалідазної реакції, використовуючи як субстрат 4-метилумбеліферил--D-N-ацетилнейрамінову кислоту (4-MU-NANA), як описано 3 UA 105278 C2 5 10 15 20 25 раніше [Bilyy, Tomin, Mahorivska, Shalay, Lohinskyy, Stoika and Kit, Antibody-mediated sialidase activity in blood serum of patients with multiple myeloma. J Моl Recognit, 2011. 24.576-84]. Результати аналізу кінетичних властивостей сіалідазної реакції, каталізованої очищеними імуноглобулінами класу IgG, представлені на Фіг. 1 (Б) та Фіг. 1 (В). Визначені параметри кінетичної реакції становлять: Km=67,7 M та Vmax=0,02818 M/хв/мг. Приклад 2. Використання каталітично-активних антитіл для десіалування поверхні клітин. Лімфоцити людини лінії Jurkat вирощували в середовищі RPMI-1640 (Flow Laboratories, Шотландія) в присутності декомплементованої сироватки крові великої рогатої худоби ("Sigma", США) і 50 мкг/мл гентаміцину ("Sigma", США). Клітини пасажували через кожні два-три дні розведенням клітинної суспензії у співвідношенні 1:5-1:2. Клітини вирощували у зволоженій атмосфері при 37 °C та 5 % СО2. За потреби в клітин індукували апоптоз, опромінюючи їх 2 ультрафіолетом типу Б, 180 мДж/см , з наступним періодом інкубації 14 годин в повному культуральному середовищі. Клітини відмивали (в кінцевій концентрації 3 млн/мл) і поміщали в розчин Рінгена. Клітини обробляли препаратом каталітично-активних антитіл з сіалідазною активністю, 30 mU, упродовж 3 год. при 37 С чи препаратом нейрамінідази з Clostridium perfringens, 30 mU, упродовж 3 год. при 37 °C. Клітини двічі відмивали розчином Рінгера і додавали до клітин розчин -2,6-сіалоспецифічного пектину бузини чорної (SNA), мічений флуоресцеїнізоціанатом, до кінцевої концентрації 5 мкг/мл та прорідій йодид до кінцевої концентрації 1 мкг/мл. Клітини інкубували 30 хв. при 4 °C та проводили аналіз вмісту сіалільних залишків на поверхні клітин за зв'язуванням пектину SNA. Популяцію некротичних клітин виявляли за позитивним фарбуванням з прорідій йодидом. Інтенсивність зв'язування лектину визначали за параметром середньої інтенсивності флуоресценції інтактних та апоптичних клітин, нормалізовані значення яких представлені на Фіг. 2. Отримані дані свідчать, що як обробка нейрамінідазою (як позитивний контроль), так і обробка каталітично-активними антитілами з сіалідазною активністю призводить до зменшення вмісту залишків сіалових кислот на поверхні як інтактних так і апоптичних клітин. ФОРМУЛА ВИНАХОДУ 30 35 1. Спосіб отримання каталітично активних антитіл з сіалідазною активністю, шляхом імунізації організму кроля кон’югатами гаптену та високомолекулярного (білкового) носія, який відрізняється тим, що як гаптен використовуються похідні інгібітора(ів) сіалідазної реакції. 2. Спосіб отримання каталітично активних антитіл з сіалідазною активністю за п. 1, який відрізняється тим, що для імунізації використовують похідні інгібітора 2,3-дегідро-2-деоксі-Nацетилнейрамінової кислоти чи інших інгібіторів нейрамінідаз. 4 UA 105278 C2 5 UA 105278 C2 Комп’ютерна верстка С. Чулій Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 6
ДивитисяДодаткова інформація
Автори англійськоюBilyi Rostyslav Oleksandrovych, Kit Yurii Yaroslavovych
Автори російськоюБилый Ростислав Александрович, Кит Юрий Ярославович
МПК / Мітки
МПК: C07K 16/18, C12N 9/24
Мітки: спосіб, отримання, каталітичної, абзимів, сіалідазною, антитіл, активністю, активних
Код посилання
<a href="https://ua.patents.su/8-105278-sposib-otrimannya-katalitichno-aktivnikh-antitil-abzimiv-iz-sialidaznoyu-aktivnistyu.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання каталітично активних антитіл (абзимів) із сіалідазною активністю</a>
Наступний патент: Маніпулятор дробоструменевого очищення
Випадковий патент: Спосіб виготовлення комбінованого препарату інсуліну людини