Похідні 4,7-дигідро-5-аміно-3-карбоксамідо-6-ціано[1,2,3]триазоло[1,5-а]піримідину і спосіб їх одержання
Номер патенту: 107549
Опубліковано: 12.01.2015
Автори: Сірко Світлана Миколаївна, Десенко Сергій Михайлович, Афанасіаді Людмила Михайлівна, Гладков Євгеній Станіславович, Черненко Віталій Миколайович
Формула / Реферат
1. Похідні 4,7-дигідро-5-аміно-3-карбоксамідо-6-ціано[1,2,3]триазоло[1,5-a]піримідину
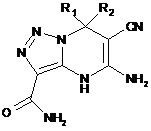 ,
,
де R1=H, CH3;
R2 = СН3, C6H5, С6Н4-СН3, С6Н4-ОСН3, С6Н4-Cl;
R1-R2 = циклогексил, циклопентил, циклогептил.
2. Спосіб одержання сполук загальної формули
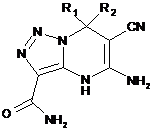 ,
,
де R1=H, CH3;
R2 = СН3, C6H5, С6Н4-СН3, С6Н4-ОСН3, С6Н4-Cl;
R1-R2 = циклогексил, циклопентил, циклогептил,
що включає конденсацію рівномолекулярних співвідношень амінотриазолу, малонодинітрилу та карбонільної сполуки в органічному розчиннику при мікрохвильовому опромінюванні, який відрізняється тим, що як амінотриазол використовують 4-аміно-5-карбоксамідо-1,2,3-триазолу, як карбонільну сполуку використовують відповідний кетон формули R1COR2, як органічний розчинник - етанол, мікрохвильове опромінювання ведуть при 150 °C протягом 30-60 хвилин до утворення кінцевого продукту.
Текст
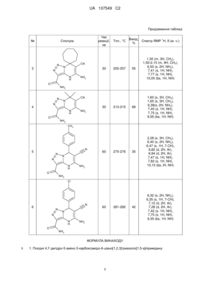
Реферат: Пропонуються а]піримідину: нові похідні 4,7-дигідро-5-аміно-3-карбоксамідо-6-ціано[1,2,3]триазоло[1,5 UA 107549 C2 (12) UA 107549 C2 R1 N N R2 CN N N H O NH2 NH2 , де R1=H, CH3; R2 = СН3, C6H5, С6Н4-СН3, С6Н4-ОСН3, С6Н4-Сl; R1-R2 = циклогексил, циклопентил, циклогептил, та спосіб їх одержання, що включає конденсацію рівномолярних кількостей 4-аміно-5карбоксамідо-1,2,3-триазолу, малондинітрілу і відповідного кетону в етанолі як розчинника, у закритому сосуді при мікрохвильовому опромінюванні при 150 °C протягом 30 хвилин. Технічне рішення дозволяє зменшити тривалість технологічного процесу, підвищити якість сполук і виходи реакцій, забезпечує створення широкого асортименту нових похідних триазолопіримідинів для медицини, біології, сільського господарства і т. ін. UA 107549 C2 Винахід стосується галузі хімії і являє собою нові похідні 4,7-дигідро-5-аміно-3-карбоксамідо6-ціано[1,2,3]триазоло[1,5-а]піримідину загальної формули І R1 N N R2 CN N N H O NH2 NH2 I 5 10 15 20 , де R1=H, CH3; R2 = СН3, C6H5, С6Н4-СН3, С6Н4-ОСН3, С6Н4-Сl; R1-R2 = циклогексил, циклопентил, циклогептил. Сполуки формули І мають високу реакційну здатність до різних хімічних реакцій. Наявність вільних аміно- і нітрильної груп припускає використання сполук, що заявляються, при вирішенні низки практичних задач у препаративному органічному синтезі, а саме, у синтезі кислот, амідів, естерів, азометанів. Серед азотовмісних гетероциклів азолопіримідини являють собою важливий клас сполук для фармацевтичної і медичної хімії. Наявність фармакофорних фрагментів обумовлює перспективність пошуку у низці сполук формули І речовин з різними видами біологічної активності. Так, вони використовуються як терапевтичні засоби проти раку [J. Natural Products, 1997, 60, № 4, p. 356]; проти гострих і хронічних запалень ішемічних процесів, призначені для лікування патологічних станів-лікування розсіяного склерозу, астми, ревматоїдного артриту, запалення кишечника [Пат. РФ № 2266901 C07D 239/54; А61К 31/513]; ефективні при лікуванні захворювань серцево-судинної і ендокринної систем [заявка ЕР № 203721, C07D 473/06; заявка ЕР № 267607, С07В 473/06] і т. інші. Відомий структурний аналог сполук, що заявляються, 4,5,6,7,8,9гексагідро[1,2,3]триазоло[5,1-b]хіназолін-3-карбоксаміди загальної формули II: R N N O N R1 N H O 25 R2 NH2 II , де R1=H, CH3; R=C6H5, 4-СН3-С6Н4, 4-Br-С6Н4, 4-Cl- С6Н4, наведений в [E.S.Gladkov et al., Beilstein J. Of Organic Chemistry, 2012, 8, 2100-2105]. Сполуки формули II одержано багатокомпонентною реакцією 4-аміно-5-карбоксамідо-1,2,3триазолу з відповідними альдегідами і циклічними кетонами в умовах мікрохвильового або ультразвукового опромінення в метанолі за схемою: R N H N N NH2 N R + NH2 N O N R1 + O R2 O 30 O O R1 N H O NH2 Відомий структурний аналог сполук, що заявляються, гексагідро[1,2,3]триазоло[5,1-b]хіназолін-3-карбоксаміди загальної формули III 1 R2 4,5,6,7,8,9 UA 107549 C2 R2 N N O N R3 N H R1 R3 III 5 , де R1=C6H5, 4-CH3-С6Н4NHCO, 2-CH3-С6Н4NHCO; R2=C6H5, R3 = Н, СН3, описаний в [E.S.Gladkov et al., Monatsh.Chem., 2010, 141, 773-779]. Спосіб одержання сполук формули III складається з однієї стадії і здійснюється за схемою R2 N O H N N NH2 N R2 + O R3 конденсацією 4-аміно-5-карбоксамідо-1,2,3-триазолу з альдегідами і циклогександіоном у диметилформаміді при нагріванні протягом 5-15 хвилин. Авторами описано три сполуки з виходами 45 % і 65 %. Недоліком структури сполук формули III є те, що можливість широкої модифікації молекули обмежена лише введенням замісників R1 у п'ятичленному триазольному фрагменті, що значно скорочує кількість нових потенційних біологічно активних речовин. Відомий структурний аналог сполук, що заявляються, - 7-аміно-8'Н-спіроциклогексан1,5'[1,2,4]триазоло[4,3-а]піримідин-6'-карбонітрил H N NH2 N CN IV, наведений у [Anshee Dandia et al., ARKІVOC, 2006 (xvi) 83-92]. Сполуки формули IV одержано багатокомпонентною конденсацією 4-аміно-1,2,4-триазолу, малононітрилу і карбонільних сполук (альдегідів і циклічних кетонів) в умовах мікрохвильового опромінення в етанолі при 100 °C у присутності каталізатора - триетиламіну: O N H N H N N CN NH2 + N 25 N H R1 R3 N 20 R3 R3 N 15 N N + O R1 10 O MW + (C2H5)3N CN N N NH2 CN Як амінну складову авторами використано ізомерний 1,2,4-амінотриазол. Як прототип за хімічною будовою сполук, що заявляються, вибрано останній із наведених аналогів. В основу винаходу поставлено задачу пошуку нових сполук у низці похідних 5аміно[1,2,3]триазоло[1,5-а]піримідину-6-карбонітрилу з широкою варіацією замісників в карбонільній складовій (альдегідів і циклічних карбонільних сполук). Рішення поставленої задачі забезпечується розробкою похідних 5-аміно[1,2,3]триазоло[1,5а]піримідину-6-карбонітрилу загальної формули І 2 UA 107549 C2 R1 N N R2 CN N N H O NH2 NH2 I 5 10 15 20 25 30 , де R1=H, CH3; R2 = СН3, C6H5, С6Н4-СН3, С6Н4-ОСН3, С6Н4-Сl; R1-R2 = циклогексил, циклопентил, циклогептил. Рішення поставленої задачі забезпечується також тим, що в способі одержання сполук формули І, який включає конденсацію рівномолярних співвідношень амінотриазолу, малонодинітрилу та карбонільної сполуки в органічному розчиннику при мікрохвильовому опромінюванні, згідно винаходу, як амінотриазол використовують 4-аміно-5-карбоксамідо-1,2,3триазол, як карбонільну сполуку - відповідний кетон формули R1COR2, як органічний розчинник етанол, мікрохвильове опромінювання проводять при температурі 150 °C протягом 30-60 хвилин до утворення кінцевого продукту. Сполуки, що отримано, є кристалічні речовини світло-коричневого кольору, не розчиняються у воді та неполярних розчинниках, легко розчинні у диметилформаміді та диметилсульфоксиді. Можливість видозміни хімічної структури карбонільної складової як з симетричними і несиметричними замісниками, так і циклічними сполуками відкриває перспективи синтезу широкого асортименту нових речовин даного класу з новими властивостями. Так, наявність вільної аміногрупи поряд з імунною групою зумовлює здатність проходження різноманітних гетероциклізацій з утворенням імідазолів та інших гетероциклічних структур. Введення у структуру сполук формули І карбоксамідного замісника у 5-положення 4-аміно1,2,3-триазолу додає сполукам, що заявляються, подібність білкових структур, що може позитивно позначатися на появі нових фізіологічних властивостях у речовин, а також відкриває нові можливості по модифікації отриманих сполук. При проведенні досліджень виявлено оптимальний температурно-часовий режим синтезу. Проведення реакції в умовах, що заявляються, при температурі 150 °C та часу реакції - 3060 хвилин забезпечує високу швидкість реагування та високу конверсію реакції, що приводить до зменшення тривалості технологічного процесу. Підвищення температури більше 150 °C не призводить до збільшення виходу кінцевих продуктів. При зниженні температури (нижче за 150 °C) необхідно збільшити час реакції в умовах мікрохвильового опромінення, оскільки швидкість реакції зменшується і реакція утворення відповідного кінцевого продукту іде повільніше. Час реакції 30-60 хвилин зумовлений тим, що вихідні карбонільні сполуки з різними замісниками проявляють різну реакційну здатність. У таблиці наведено характеристики сполук, що заявляються. Сполуки формули І отримують способом за схемою: N R1 H N NH2 N CN + NH2 + CN N R1 40 CN N N H N(C2H5)3 R2 O O 35 N EtOH,MW,150 oC O R2 NH2 NH2 Синтез проходить в одну стадію конденсацією амінотриазолу, активної метиленової сполуки і карбонільних речовин при мікрохвильовому опроміненні у середовищі етанолу у присутності каталізатора - триетиламіну - до утворення цільових продуктів. Будова усіх отриманих сполук доведена за допомогою спектроскопії ПМР. Будова сполуки 1 однозначно підтверджена рентгеноструктурним аналізом (PCА). Приклад 1: Одержання 4,7-дигідро-5-аміно-3-карбоксамідо-7,7'-спіроциклогекан-6ціано[1,2,3]триазоло[1,5-a]піримідину (Сполука 1): 1,27 г (0,01 моль) 4-аміно-5-карбоксамідо-1,2,3-триазолу, 0,66 г (0,01 моль) малонодинітрілу та 0,98 г (0,01 моль) циклогексанону розчиняють у 10 мл сухого етанолу та додають 3-5 крапель 3 UA 107549 C2 5 10 15 20 25 триетиламіну та опромінюють у 20-мл товстостінному зачиненому сосуді у закритому мікрохвильовому реакторі при 150 °C упродовж 30 хвилин. Після охолодження до кімнатної температури, фільтрують осад що випав. Промивають на фільтрі етанолом та сушать. Вихідні дані: Тпл. - 250-252 °C, вихід - 1,94 г (71 %). 1 Спектр Н ЯМР (DMSO-d6, м. ч.): 1,35 (m, 1Н, СН2), 1,53-2,18 (m, 9Н, СН2), 6,52 (s, 2Н, NH2), 7,46 (s, 1H, NH), 7,82 (s, 1H, NH), 9,61 (bs, 1H, NH). Приклад 2: Одержання 4,7-дигідро-5-аміно-3-карбоксамідо-7,7'-диметил-6ціано[1,2,3]триазоло[1,5-a]піримідину (Сполука 4): 1,27 г (0,01 моль) 4-аміно-5-карбоксамідо-1,2,3-триазолу, 0,66 г (0,01 моль) малонодинітрілу та 0,98 г (0,01 моль) ацетону розчинають у 10 мл сухого етанолу та додають 3-5 крапель триетиламіну та опромінюють у 20-мл товстостінному зачиненому сосуді у закритому мікрохвильовому реакторі при 150 °C упродовж 30 хвилин. Після охолодження до кімнатної температури, фільтрують осад, що випав. Промивають на фільтрі етанолом та сушать. При необхідності продукт кристалізують з етанолу. Вихідні дані: Тпл. - 213-215 °C, вихід - 1,58 г (68 %). 1 Спектр Н ЯМР (DMSO-d6, м. ч.):1,60 (s, 3Н, СН3), 1,65 (s, 3Н, СН3), 6,38 (s, 2Н, NH2), 7,40 (s, 1Н, NH), 7,75 (s, 1H, NH), 9,55 (bs, 1H, NH) 1 У таблиці 1 наведено характеристики (температура плавлення, виходи і спектри Н ЯМР) деяких основних продуктів реакції, які одержані за способом, що заявляється. Спектри ядерного магнітного резонансу виміряно на спектрометрі VARIAN Mercury VX200(200 Мгц) у розчинах ДМСО-d6. Як видно із опису матеріалів винаходу і даних таблиці, структура сполук формули І, що заявляються, забезпечує одержання великого набору заміщених триазолопіримідинів з високим ступенем чистоти. Нові сполуки формули І представляють інтерес як біологічно активні речовини, можуть використовуватися в медицині і фармакології (як нові лікарські препарати), у препаративному органічному синтезі (як вихідна сполука для створення нових органічних речовин різних класів). Таблиця № Час реакції, хв Сполука N 1 N N N 30 250-252 65 1,32-2,15 (m, 8H, CH2), 6,37 (s, 2H, NH2), 7,42 (s, 1H, NH), 7,82 (s, 1H, NH), 9,20 (bs, 1H, NH) NH2 CN N 30 N H O 71 1,35 (m, 1H, СН2), 1,53-2,18 (m, 9Н, СН2), 6,52 (s, 2H, NH2), 7,46 (s, 1H, NH), 7,82 (s, 1H, NH), 9,61 (bs, 1H, NH) NH2 N 2 Вихід, 1 Спектр ЯМР Н, δ (м. ч.) % CN N H O Тпл., °C NH2 NH2 4 236-237 UA 107549 C2 Продовження таблиці № Час реакції, хв Сполука N 3 N 55 1,30 (m, 3H, CH2), 1,50-2,15 (m, 9H, CH2), 6,50 (s, 2H, NH2), 7,41 (s, 1H, NH), 7,77 (s, 1H, NH), 10,05 (bs, 1H, NH) 30 255-257 68 1,60 (s, 3H, СН3), 1,65 (s, 3H, CH3), 6,38(s, 2H, NH2), 7,40 (s, 1H, NH), 7,75 (s, 1H, NH), 9,55 (bs, 1H, NH) 35 2,28 (s, 3H, СН3), 6,40 (s, 2H, NH2), 6,47 (s, 1H, 7-CH), 6,82 (d, 2H, Ar), 6,94 (d, 2H, Ar), 7,47 (s, 1H, NH), 7,82 (s, 1H, NH), 10,15 (bs, lH, NH) 42 6,32 (s, 2H, NH2), 6,35 (s, 1H, 7-CH), 7,12 (d, 2H, Ar), 7,28 (d, 2H, Ar), 7,42 (s, 1H, NH), 7,75 (s, 1H, NH), 9,35 (bs, 1H, NH) NH2 NH2 N N 4 Вихід, 1 Спектр ЯМР Н, δ (м. ч.) % CN N N H O Тпл., °C CN N 30 N H O 213-215 NH2 NH2 CH3 N 5 N N N H O 60 275-276 N NH2 NH2 Cl N 6 N N 281-282 N N H O 60 NH2 NH2 ФОРМУЛА ВИНАХОДУ 5 1. Похідні 4,7-дигідро-5-аміно-3-карбоксамідо-6-ціано[1,2,3]триазоло[1,5-a]піримідину 5 UA 107549 C2 R1 N N R2 CN N N H O 5 NH2 , де R1=H, CH3; R2=СН3, C6H5, С6Н4-СН3, С6Н4-ОСН3, С6Н4-Cl; R1-R2=циклогексил, циклопентил, циклогептил. 2. Спосіб одержання сполук загальної формули R1 N N R2 CN N N H O 10 15 NH2 NH2 NH2 , де R1=H, CH3; R2=СН3, C6H5, С6Н4-СН3, С6Н4-ОСН3, С6Н4-Cl; R1-R2=циклогексил, циклопентил, циклогептил, що включає конденсацію рівномолекулярних співвідношень амінотриазолу, малонодинітрилу та карбонільної сполуки в органічному розчиннику при мікрохвильовому опромінюванні, який відрізняється тим, що як амінотриазол використовують 4-аміно-5-карбоксамідо-1,2,3-триазолу, як карбонільну сполуку використовують відповідний кетон формули R 1COR2, як органічний розчинник - етанол, мікрохвильове опромінювання ведуть при 150 °C протягом 30-60 хвилин до утворення кінцевого продукту. Комп’ютерна верстка А. Крижанівський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 6
ДивитисяДодаткова інформація
Автори англійськоюHladkov Yevhenii Stanislavovych, Sirko Svitlana Mykolaivna, Chernenko Vitalii Mykolaiovych, Desenko Serhii Mykhailovych, Afanasiadi Liudmyla Mykhailivna
Автори російськоюГладков Евгений Станиславович, Сирко Светлана Николаевна, Черненко Виталий Николаевич, Дэсэнко Сергей Михайлович, Афанасиади Людмила Михайловна
МПК / Мітки
МПК: C07D 487/04
Мітки: одержання, спосіб, похідні, 4,7-дигідро-5-аміно-3-карбоксамідо-6-ціано[1,2,3]триазоло[1,5-а]піримідину
Код посилання
<a href="https://ua.patents.su/8-107549-pokhidni-47-digidro-5-amino-3-karboksamido-6-ciano123triazolo15-apirimidinu-i-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Похідні 4,7-дигідро-5-аміно-3-карбоксамідо-6-ціано[1,2,3]триазоло[1,5-а]піримідину і спосіб їх одержання</a>
Попередній патент: Осьовий вентилятор
Випадковий патент: Спосіб відтворення в соснових культурах свіжого субору балансів або копального стояку