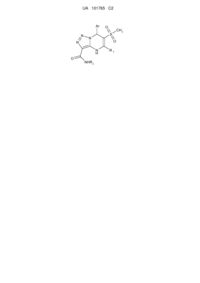
N-заміщені 5,7-діарил-6-(метилсульфоніл)-4,7-дигідро[1,2,3]триазоло[1,5-a]піримідин-3-карбоксаміди і спосіб їх одержання
Номер патенту: 101765
Опубліковано: 25.04.2013
Автори: Десенко Сергій Михайлович, Афанасіаді Людмила Михайлівна, Гладков Євгеній Станіславович, Сірко Світлана Миколаївна
Формула / Реферат
1. N-заміщені 5,7-діарил-6-(метилсульфоніл)-4,7-дигідро[1,2,3]триазоло[1,5-а]піримідин-3-карбоксаміди формули
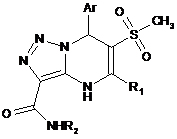 ,
,
де Аr=С6Н5, 4-СН3-С6Н4, 4-СН3О-С6Н4,
4-Вr-С6Н4, 4-Сl-С6Н4, 3-СН3-С6Н4,
2-СН3-С6Н4, 2,4-диСН3-С6Н3,
2-СН3О-С6Н4;
R1=С6Н5, 4-СН3-С6Н4;
R2=Н, 4-СН3-С6Н4, 2-СН3-С6Н4,
4-СН3О-С6Н4, 2-СН3О-С6Н4, 4-Сl-С6Н4.
2. Спосіб одержання N-заміщених 5,7-діарил-6-(метилсульфоніл)-4,7-дигідро[1,2,3]триазоло[1,5-a]піримідин-3-карбоксамідів формули
 ,
,
де Аr=С6Н5, 4-СН3-С6Н4, 4-СН3О-С6Н4,
4-Вr-С6Н4, 4-Сl-С6Н4, 3-СН3-С6Н4,
2-СН3-С6Н4, 2,4-диСН3-С6Н3,
2-СН3О-С6Н4;
R1=С6Н5, 4-СН3-С6Н4;
R2=Н, 4-СН3-С6Н4, 2-СН3-С6Н4,
4-СН3О-С6Н4, 2-СН3О-С6Н4, 4-Сl-С6Н4,
що включає конденсацію рівномолярних кількостей амінотриазолу і кетосульфону в диметилформаміді при мікрохвильовому опромінюванні, який відрізняється тим, що як амінотриазол використовують 4-аміно-5-карбоксамідо-1,2,3-триазол, як кетосульфон використовують 2-метилсульфоніл-1,3-дифенілпроп-2-ен-1-он, конденсацію проводять при 160 °C протягом 10-15 хвилин до утворення цільового продукту, який виділяють метанолом.
Текст
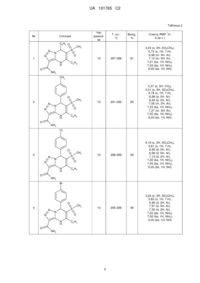
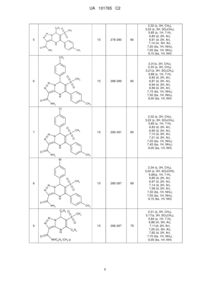
Реферат: Пропонуються нові N-заміщені 5,7-діарил-6-(метилсульфоніл)-4,7-дигідро[1,2,3]триазоло[1,5a]піримідин-3-карбоксаміди загальної формули І Ar N N CH3 S N O N H O O R1 де Аr=С6Н5, 4-СН3-С6Н4, 4-СН3О-С6Н4, 4-Вr-С6Н4, 4-СlС6Н4, 3-СН3-С6Н4, 2-СН3-С6Н4, 2,4-диСН3-С6Н3, 2-СН3О-С6Н4; R1=С6Н5, 4-СН3-С6Н4; R2=Н, 4-СН3-С6Н4, 2-СН3-С6Н4, 4-СН3О-С6Н4, 2-СН3О-С6Н4, 4-Сl-С6Н4 ,І і спосіб їх одержання, що включає конденсацію рівномолярних кількостей 4-аміно-5карбоксамідо-1,2,3-триазолу і 2-метилсульфоніл-1,3-дифенілпроп-2-ен-1-ону в диметилформаміді при мікрохвильовому опромінюванні при 160 °C протягом 10-15 хвилин до утворення цільового продукту, який виділяють метанолом. Технічне рішення дозволяє зменшити тривалість процесу, підвищити якість сполук і їх виходи реакцій, забезпечує створення широкого набору похідних триазолопіримідинів для медицини, фармації, препаративного органічного синтезу. NHR2 UA 101765 C2 (12) UA 101765 C2 Ar N N N NHR2 CH3 S O N H O O R1 UA 101765 C2 Винахід належить до області хімії і являє собою нові заміщені 5,7-діарил-6(метилсульфоніл)-4,7-дигідро[1,2,3]триазоло[1,5-a]піримідин-3-карбоксаміди загальної формули І Ar N N O N де Аr=С6Н5, 4-СН3-С6Н4, 4-СН3О-С6Н4, 4-Вr-С6Н4, 4-Сl-С6Н4, 3-СН3-С6Н4, 2-СН3-С6Н4, 2,4-диСН3-С6Н3, 2-СН3О-С6Н4; R1=С6Н5, 4-СН3-С6Н4; 2 R =Н, 4-СН3-С6Н4, 2-СН3-С6Н4, 4-СН3О-С6Н4, 2-СН3О-С6Н4, 4-Сl-С6Н4. O N H O CH3 S R1 NHR2 ,І 5 10 15 20 Сполуки формули І - складні азотовмісні гетероциклічні речовини, які є аналогами багатьох сучасних лікарських препаратів. Тому синтез сполук подібної структури з різними фармакофорними угрупуваннями є актуальним, бо вони грають важливу роль у біологічних процесах живих організмів. Азолопіримідини проявляють антиалергічну і гіпнотичну активність [G. Baziard-Mongsset et al., Eur. J. Med. Chem., 30, N3, 253 (1995)]; використовуються при лікуванні ангіни, відомі як антигіпертензивні засоби, що покращують серцевий і церебральний кровообіг [Пат. Японії N63-101383, C07D 487/04; А61K31/505]; високоефективні при лікуванні низки захворювань ендокринної і серцево-судинної системи [Заявка ЕР N203721, C07D 473/06; заявка ЕР N267607, C07D 473/06; А.Т. Солдатенков и др. "Основы органической химии лекарственных веществ", Изд. "Мир"; Москва, 2007]. Використання таких гетероциклічних сполук як біологічно активних речовин потребує постійного підвищення ступеня чистоти, доступності синтезу, удосконалення методів одержання. Відомий структурний аналог сполук, що заявляються, -4,7-дигідро-3-арил-4,4'-діоксо-9карбоксамідо-тіопірано-1,2,3-триазолопіримідини формули II R N N O O S N де R = С6Н5, 4-СН3-С6Н4, 4-Сl-С6Н4, 4-Br-C6H4, 4-F-C6H4, 4-CH3O-C6H4 і ін. N H O 25 NH2 , ІІ і спосіб їх одержання [Пат України N94674, C07D 513/16]. Можливість хімічної модифікації молекули сполук формули II обмежена тільки введенням функціональних груп в заміснику R піримідинового циклу. Спосіб одержання відомої сполуки формули II - багатокомпонентний одностадійний і здійснюється за схемою: O N N S NH + + NH2 O R O N RCHO N O O S N N H O O NH2 NH2 . 30 Рівномолярну кількість тетрагідротран-3-он-S, S-діоксиду розчиняють у льодяній оцтовій кислоті, додають рівномолярні кількості 4-карбоксамідо-5-аміно-1,2,3-триазолу і ароматичного 1 UA 101765 C2 5 10 альдегіду. Суміш витримують в ультразвуковій бані протягом 40-45 хвилин при температурі 3540 °C, додають холодну воду. Осад, що випав, відфільтровують, промивають етанолом, сушать. Час протікання реакції складає 40-45 хвилин. Вихід реакції складає 63-85 %. Недоліком способу одержання сполук формули II є використання як розчинника льодяної оцтової кислоти, яка викликає опіки шкіри і має сильну подразнювальну дію. Використання суміші трьох компонентів, з яких тільки одна сполука може модифікувати хімічну структуру молекули (ароматичний альдегід), здорожує кінцевий продукт. Тривалість технологічного процесу також можна віднести до недоліків способу одержання. Відомий аналог сполук формули І, що заявляються, -5-метил-4-феніл-6-метилсульфоніл-4,7дигідро-1,2,4-триазоло[1,5-а]піримідини загальної формули III де Аr = С6Н5, 4-СН3-С6Н4, 4-СН3О-С6Н4, 4-Вr-С6Н4, 4-Сl-С6Н4, 2-СН3О-С6Н4; R1 = С6Н5, СН3 , ІІІ 15 і спосіб їх одержання [Е. Gladkov, V. Chebanov et al., Heterocycles, 73, 469-480 (2007)]. Недоліком структури відомого аналога формули II є обмежена хімічна модифікація молекули тільки у піримідиновому фрагменті. Спосіб одержання сполук формули III одностадійний, багатокомпонентний і реалізується за схемою: DMF, MW ArCHO 135 oC, 30 min . 20 25 30 35 40 Суміш 3-амінотриазолу (1 ммоль), β-кетосульфону (1 ммоль) і ароматичного альдегіду (1 ммоль) в 1 мл диметилформаміду нагрівають протягом 30 хвилин при температурі 135 °C при мікрохвильовому опромінюванні. При охолодженні додають 10 мл ацетону, реакційну масу нагрівають 2-3 хвилини. Охолоджену до кімнатної температури суміш витримують при -5 °C протягом 10-12 годин. Осад, що випав, відфільтровують, промивають метанолом, сушать. У деяких випадках продукт перекристалізовують із суміші диметилформамід-метанол (1:2). Час реакції становить 12-14 годин (з урахуванням кристалізації). Вихід реакції - 27-97 %. До недоліків синтезу слід віднести тривалість технологічного процесу, витримування реакційної суміші протягом тривалого часу при температурі -5 °C, застосування перекристалізації для очистки цільових продуктів. Як карбонільна сполука, що є однією із складових речовин для утворення аналога формули III, є суміш двох карбонільних сполук βкетосульфону і ароматичного альдегіду, тому використання для реакції суміші трьох компонентів (3-аміно-1,2,4-триазолу, β-кетосульфону і ароматичного альдегіду) здорожує кінцевий продукт (затрати реактивів), що також є недоліком способу одержання відомого аналога формули III. Останній із наведених аналогів прийнятий нами як прототип. В основу винаходу поставлена задача синтезу нових сполук у низці N-заміщених 5,7-діарил6-(метилсульфоніл)-4,7-дигідро[1,2,3]триазоло[1,5-а]піримідин-3-карбоксамідів, а також розробка простого і доступного способу одержання таких сполук, який дозволяє підвищити якість кінцевих продуктів реакції, скоротити її тривалість. Рішення поставленої задачі забезпечується розробкою - N-заміщених 5,7-діарил-6(метилсульфоніл)-4,7-дигідро[1,2,3]триазоло[1,5-a]піримідин-3-карбоксамідів формули І 2 UA 101765 C2 Ar N N N 5 10 15 20 25 30 NHR2 CH3 S де Аr=С6Н5, 4-СН3-С6Н4, 4-СН3О-С6Н4, 4-Вr-С6Н4, 4-Сl-С6Н4, 3-СН3-С6Н4, 2-СН3-С6Н4, 2,4-диСН3-С6Н3, 2-СН3О-С6Н4; R1=С6Н5, 4-СН3-С6Н4; 2 R =Н, 4-СН3-С6Н4, 2-СН3-С6Н4, 4-СН3О-С6Н4, 2-СН3О-С6Н4, 4-Сl-С6Н4. O N H O O R1 ,І Рішення поставленої задачі забезпечується також тим, що в способі одержання сполук формули І, який включає конденсацію амінотриазолу з кетосульфоном в диметилформаміді при мікрохвильовому опромінюванні, згідно з винаходом, як амінотриазол використовують 4-аміно5-карбоксамідо-1,2,3-триазол, як кетосульфон - 2-метилсульфоніл-1,3-дифенілпроп-2-ен-1-он, реакцію конденсації ведуть при температурі 160 °C протягом 10-15 хвилин, цільовий продукт виділяють метанолом. Модифікація структури карбонільної сполуки шляхом заміни двох речовин - β-кетосульфону і ароматичного альдегіду - одним 2-метилсульфоніл-1,3-дифенілпроп-2-ен-1-оном і введення карбоксамідного замісника у положення 5 триазольного циклу дозволяє підвищити чистоту і вихід цільових продуктів реакції і скоротити тривалість технологічного процесу. Цьому сприяє також підвищення температури, при якій проходить реакція, від 135 °C (як у прототипі) до 160 °C (як у способі, що заявляється). В цих умовах швидкість реакції при мікрохвильовому опроміненні така, що дозволяє скоротити в 2-3 рази тривалість технологічного процесу, підвищити вихід цільових продуктів та не застосовувати додаткові процедури, такі як тривале охолодження при -5 °C та перекристалізація. Використання будь-якого із компонентів реакції в більшому або меншому співвідношенні приводить до утворення суміші вихідних і кінцевих продуктів, яку неможливо розділити. Введення карбоксамідного замісника в 5-положення 4-аміно-1,2,3-триазолу додає сполукам, що заявляються, подібність білкових структур, що може позитивно сказатися на появі нових фізіологічних властивостей у речовин. Сумарний час протікання реакції складає 10-15 хвилин, що встановлено експериментальним шляхом, причому зменшення часу призводить до значного зниження виходу цільових продуктів. Указаного часу достатньо для повного проходження реакції і утворення сполук формули І, що заявляються, тому нагрівання більше 15 хвилин недоцільно. Можливість модифікації хімічної структури сполук формули І варіюванням замісників як у триазольному циклі, так і у карбонільній складовій, що формує дигідропіримідиновий фрагмент, відкриває перспективу синтезу великої кількості нових корисних речовин з новими властивостями і застосуваннями. У таблиці 1 представлено порівняльні характеристики способу, що заявляється, і способіваналогів. У таблиці 2 надано характеристики деяких сполук, що заявляються. Спосіб, що заявляється, здійснюється за схемою: MW DMF I . 35 40 Рівномолярні кількості 4-аміно-5-карбоксамідо-1,2,3-триазолу і 2-метилсульфоніл-1,3дифенілпроп-2-ен-1-ону у 5 мл диметилформаміду нагрівають у закритому сосуді у мікрохвильовому реакторі протягом 10-15 хвилин при 160 °C. Реакційну суміш охолоджують до 20 °C, додають 5 мл метанолу. Осад, що випав, відфільтровують, промивають етанолом, сушать. Спосіб одержання сполук, що заявляються, ілюструється наступними прикладами. 3 UA 101765 C2 5 10 15 20 25 30 35 40 Приклад 1. Одержання 5,7-дифеніл-6-(метилсульфоніл)-4,7-дигідро-[1,2,3]триазоло[1,5a]піримідин-3-карбоксаміду. Суміш 1,27 г (0,01 моль) 4-аміно-5-карбоксамідо-1,2,3-триазолу, 2,86 г (0,01 моль) 2метилсульфоніл-1,3-дифенілпроп-2-ен-1-ону у 5 мл диметилформаміду нагрівають у закритому сосуді у мікрохвильовому реакторі протягом 10 хвилин при 160 °C. Реакційну суміш охолоджують до 20 °C, додають 15 мл метанолу. Осад, що випав, відфільтровують, промивають спиртом і сушать. Вихідні дані: Т. пл. 287-288 °C, вихід 3.19 г (81 %). 1 Спектр Н ЯМР (DMSO-d6, м.ч.): 3,23 (s, 3Н, SO2CH3), 5,73 (s, 1Н, 7-Н), 6,98 (m, 5H, Аr), 7,12 (m, 5H, Аr), 7,21 (bs, 1H, NH2), 7,53 (bs, 1H, NH2), 9,05 (bs, 1Н, NH). Приклад 2. Одержання 5-феніл-7-(4-метилфеніл)-6-(метилсульфоніл)-4,7-дигідро[1,2,3]триазоло[1,5-а]піримідин-3-карбоксаміду. Суміш 1,27 г (0,01 моль) 4-аміно-5-карбоксамідо-1,2,3-триазолу, 3,01 г (0,01 моль) 2метилсульфоніл-1-феніл-3-(4-метилфеніл)-проп-2-ен-1-ону у 5 мл диметилформаміду нагрівають у закритому сосуді у мікрохвильовому реакторі протягом 10 хвилин при 160 °C. Реакційну суміш охолоджують до 20 °C, додають 10 мл метанолу. Осад, що випав, відфільтровують, промивають спиртом і сушать. Вихідні дані: Т. пл. 291-292 °C, вихід 3.48 г (85 %). 1 Спектр Н ЯМР (DMSO-d6, м.ч.): 2,37 (s, 3Н, СН3), 3,21 (s, 3Н, SO2CH3), 5,78 (s, 1Н, 7-Н), 6,88 (d, 2H, Аr), 6,94 (d, 2H, Аr), 7,05 (m, 2H, Аr), 7,23 (bs, 1Н, NH2), 7,27 (т, 3Н, Аr), 7,55 (bs, 1Н, NH2), 9,20 (bs, 1Н, NH). Приклад 3. Одержання N-(4-метилфеніл)-5,7-дифеніл-6-(метилсульфоніл)-4,7-дигідро[1,2,3]триазоло[1,5-а]піримідин-3-карбоксаміду. Суміш 2,17 г (0,01 моль) N-(4-метилфеніл)-4-аміно-5-карбоксамідо-1,2,3-триазолу, 2,86 г (0,01 моль) 2-метилсульфоніл-1,3-дифенілпроп-2-ен-1-ону у 5 мл диметилформаміду нагрівають у закритому сосуді у мікрохвильовому реакторі протягом 15 хвилин при 160 °C. Реакційну суміш охолоджують до 20 °C, додають 10 мл метанолу. Осад, що випав, відфільтровують, промивають спиртом і сушать. Вихідні дані: Т. пл. 266-267 °C, вихід 3.83 г (79 %). 1 Спектр Н ЯМР (DMSO-d6, м.ч.): 2,31 (s, 3Н, СН3), 3,17 (s, 3Н, SO2CH3), 5,84 (s, 1Н, 7-Н), 6,88 (m, 5H, Аr), 7,11 (d, 2H, Аr), 7,25 (m, 5H, Аr), 7,62 (d, 2Н, Аr, 7,70 (bs, 1Н, NH2), 9,05 (bs, 1Н, NH). Решту прикладів зведено у таблиці 2. Як видно із опису матеріалів винаходу і даних таблиць 1 і 2, структура сполук, що заявляються, забезпечує одержання значної кількості N-заміщених 5,7-діарил-6(метилсульфоніл)-4,7-дигідро[1,2,3]триазоло[1,5-a]піримідин-3-карбоксамідів з покращеними характеристиками - високим ступенем чистоти і високим виходом реакції. Спосіб одержання сполук формули І дозволяє: - значно зменшити тривалість процесу; - підвищити якість сполук, що заявляються, їх виходи реакції; - широко варіювати замісники Аr і R. Переваги нових сполук формули І і способу їх одержання розширюють можливості їх потенційного використання як біологічно активних речовин, в медицині і фармакології - як лікарських препаратів, в препаративному органічному синтезі; а спосіб одержання - простий і доступний, який легко відтворюється як у лабораторії, так і у виробничій практиці. 45 Таблиця 1 Умови синтезу Спосіб, що заявляється Спосіб одержання сполуки формули II Спосіб одержання сполуки формули III (прототип) Тривалість процесу Мікрохвильове опромінювання, 160 °C 10-15 хвилин 75-98 Не потребується Диметилформамід Ультразвукове опромінювання, 35-40 °C 40-45 хвилин 63-85 Не потребується Льодяна оцтова кислота 27-97 Перекристалізація із суміші диметилформамідметанол (1:2) Диметилформамід Мікрохвильове опромінювання, 135 °C Вихід Очищення цільового Розчинник для реакції реакції, % продукту 12-14 годин 4 UA 101765 C2 Таблиця 2 № Час реакції, хв Сполука C6H5 O N N 1 10 O Спектр ЯМР Н, δ (м.ч.) 81 3,23 (s, 3Н, SO2CH3), 5,73 (s, 1H, 7-Н), 6,98 (m, 5H, Аr), 7,12 (m, 5Н, Аr), 7,21 (bs, 1H, NH2), 7,53 (bs, 1H, NH2), 9,05 (bs, 1H, NH) 85 2,37 (s, 3Н, СН3), 3,21 (s, 3H, SO2CH3), 5,78 (s, 1H, 7-H), 6,88 (d, 2H, Ar), 6,94 (d, 2H, Ar), 7,05 (m, 2H, Ar), 7,23 (bs, 1H, NH2), 7,27 (m, 3H, Ar), 7,55 (bs, 1H, NH2), 9,20 (bs, 1H, NH) 92 3,19 (s, 3H, SO2CH3), 5,81 (s, 1H, 7-H), 6,95 (d, 2H, Ar), 6,99 (d, 5H, Ar), 7,13 (d, 2H, Ar), 7,20 (bs, 1H, NH2), 7,55 (bs, 1H, NH2), 9,05 (bs, 1H, NH) 90 3,20 (s, 3H, SO2CH3), 5,83 (s, 1H, 7-H), 6,96 (d, 2H, Ar), 7,97 (d, 5H, Ar), 7,30 (d, 2H, Ar), 7,22 (bs, 1H, NH2), 7,50 (bs, 1H, NH2), 9,00 (bs, 1H, NH) O N H 287-288 1 Вихід, % CH3 S N Т. пл., °С C6H5 NH2 CH3 O 2 N N N 10 291-292 O N H O CH3 S C6 H5 NH2 Cl O 3 N N N 10 288-289 O N H O CH3 S C6 H5 NH2 Br O 4 N N N 10 295-296 O N H O CH3 S C6 H5 NH2 5 UA 101765 C2 C6 H5 O N N 5 80 82 2,31(s, 3H, CH3), 2,33 (s, 3H, CH3), 3,21(s, 3H, SO2CH3), 5,88 (s, 1H, 7-H), 6,83 (d, 2H, Ar), 6,87 (d, 2H, Ar), 6,94 (d, 2H, Ar), 6,99 (d, 2H, Ar), 7,15 (bs, 1H, NH2), 7,50 (bs, 1H, NH2), 9,00 (bs, 1H, NH) 85 2,32 (s, 3H, CH3), 3,22 (s, 3H, SO2CH3), 5,85 (s, 1H, 7-H), 6,83 (d, 2H, Ar), 6,95 (d, 2H, Ar), 7,13 (d, 2H, Ar), 7,21 (d, 2H, Ar), 7,25 (bs, 1H, NH2), 7,45 (bs, 1H, NH2), 9,05 (bs, 1H, NH) 89 2,34 (s, 3H, CH3), 3,20 (s, 3H, SO2CH3), 5,85(s, 1Н, 7-H), 6,85 (d, 2H, Ar), 6,97 (d, 2H, Ar), 7,14 (d, 2H, Ar), 7,28 (d, 2H, Ar), 7,30 (bs, 1H, NH2), 7,55 (bs, 1H, NH2), 9,15 (bs, 1H, NH) 79 2,31 (s, 3H, CH3), 3,17(s, 3H, SO2CH3), 5,84 (s, 1H, 7-H), 6,88 (m, 5H, Ar), 7,11(d, 2H, Ar), 7,25 (m, 5H, Ar), 7,62 (d, 2H, Ar), 7,70 (bs, 1H, NH2), 9,05 (bs, 1H, NH) CH3 S N 2,32 (s, 3Н, СН3), 3,25 (s, 3H, SO2CH3), 5,85 (s, 1H, 7-H), 6,83 (d, 2H, Ar), 6,91 (d, 2H, Ar), 7,14 (m, 5H, Ar), 7,20 (bs, 1Н, NH2), 7,55 (bs, 1H, NH2), 9,10 (bs, 1H, NH) O 15 278-280 N H O NH2 CH3 CH3 O 6 N N CH3 S N 15 288-289 O N H O NH2 CH3 Cl O 7 N N CH3 S N 15 290-291 O N H O NH2 CH3 Br O 8 N N CH3 S N 15 285-287 O N H O NH2 CH3 C6 H5 O N N 9 S N O 15 N H O CH3 266-267 C6 H5 NHC6H4-CH3-p 6 UA 101765 C2 C6H5 O N S N N 10 O 10 N H O CH3 258-259 C6H5 NHC6H4-OCH3-p 75 3,19 (s, 3H, SO2CH3), 3,76 (s, 3H, OCH3), 5,88 (s, 1H, 7-H), 6,75 (d, 2H, Ar), 6,91 (m, 5H, Ar), 7,17(m, 5H, Ar), 7,31(d, 2H, Ar), 7,85 (bs, 1H, NH2), 9,00 (bs, 1H, NH) ФОРМУЛА ВИНАХОДУ 5 1. N-заміщені 5,7-діарил-6-(метилсульфоніл)-4,7-дигідро[1,2,3]триазоло[1,5-а]піримідин-3карбоксаміди формули Ar де Аr=С6Н5, 4-СН3-С6Н4, 4-СН3О-С6Н4, O CH3 4-Вr-С6Н4, 4-Сl-С6Н4, 3-СН3-С6Н4, S 2-СН3-С6Н4, 2,4-диСН3-С6Н3, N N 2-СН3О-С6Н4; O N R1=С6Н5, 4-СН3-С6Н4; R2=Н, 4-СН3-С6Н4, 2-СН3-С6Н4, N R1 H O 4-СН3О-С6Н4, 2-СН3О-С6Н4, 4-Сl-С6Н4. , 2. Спосіб одержання N-заміщених 5,7-діарил-6-(метилсульфоніл)-4,7-дигідро[1,2,3]триазоло[1,5a]піримідин-3-карбоксамідів формули Ar де Аr=С6Н5, 4-СН3-С6Н4, 4-СН3О-С6Н4, O CH3 4-Вr-С6Н4, 4-Сl-С6Н4, 3-СН3-С6Н4, S 2-СН3-С6Н4, 2,4-диСН3-С6Н3, N N 2-СН3О-С6Н4; O N R1=С6Н5, 4-СН3-С6Н4; R2=Н, 4-СН3-С6Н4, 2-СН3-С6Н4, N R1 NHR2 H O 10 NHR2 4-СН3О-С6Н4, 2-СН3О-С6Н4, 4-Сl-С6Н4, , що включає конденсацію рівномолярних кількостей амінотриазолу і кетосульфону в диметилформаміді при мікрохвильовому опромінюванні, який відрізняється тим, що як амінотриазол використовують 4-аміно-5-карбоксамідо-1,2,3-триазол, як кетосульфон використовують 2-метилсульфоніл-1,3-дифенілпроп-2-ен-1-он, конденсацію проводять при 160 °C протягом 10-15 хвилин до утворення цільового продукту, який виділяють метанолом. Комп’ютерна верстка Л. Бурлак Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 7
ДивитисяДодаткова інформація
Назва патенту англійськоюN-substituted 5,7-diaryl-6-methylsulfonyl)-4,7-dihydro[1,2,3]triazolo[1,5-a]pyrimidine-3-carboxamides and process for the preparation thereof
Автори англійськоюHladkov Yevhenii Stanislavovych, Sirko Svitlana Mykolaivna, Desenko Serhii Mykhailovych, Afanasiadi Liudmyla Mykhailivna
Назва патенту російськоюN-замещенные 5,7-диарил-6-(метилсульфонил)-4,7-дигидро[1,2,3]триазоло[1,5-a]пиримидин-3-карбоксамиды и способ их получения
Автори російськоюГладков Евгений Станиславович, Сирко Светлана Николаевна, Дэсэнко Сергей Михайлович, Афанасиади Людмила Михайловна
МПК / Мітки
МПК: C07D 487/04
Мітки: одержання, n-заміщені, 5,7-діарил-6-(метилсульфоніл)-4,7-дигідро[1,2,3]триазоло[1,5-a]піримідин-3-карбоксаміди, спосіб
Код посилання
<a href="https://ua.patents.su/9-101765-n-zamishheni-57-diaril-6-metilsulfonil-47-digidro123triazolo15-apirimidin-3-karboksamidi-i-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">N-заміщені 5,7-діарил-6-(метилсульфоніл)-4,7-дигідро[1,2,3]триазоло[1,5-a]піримідин-3-карбоксаміди і спосіб їх одержання</a>
Попередній патент: Спосіб нанесення двокомпонентних хромоалюмінієвих покриттів на внутрішні порожнини охолоджуваних робочих лопаток газових турбін та пристрій для реалізації способу
Наступний патент: Спосіб очищення газових викидів виробництв і пристрій для його здійснення
Випадковий патент: Вдосконалений спосіб виробництва тригідрату глинозему по байєру, що містить етап, на якому пересичений розчин до декомпозиції піддають фільтрації при високій температурі