Біосенсор для визначення патуліну
Номер патенту: 115485
Опубліковано: 10.11.2017
Автори: Мельник Володимир Григорович, Солдаткін Олексій Петрович, Кукла Олександр Леонідович, Єльська Ганна Валентинівна, Архіпова Валентина Миколаївна, Солдаткін Олександр Олексійович, Величко Тарас Павлович, Дзядевич Сергій Вікторович, Степурська Катерина Володимирівна
Формула / Реферат
Біосенсор для визначення патуліну, який має дві пари кондуктометричних електродів, на одну з яких нанесена робоча ферментна мембрана на основі уреази, іммобілізована з сироватковим альбуміном бика в парах глутарового альдегіду і при такому співвідношенні компонентів (у мас. %): 3-6 - уреаза, 3-6 - сироватковий альбумін бика (БСА), 8-18 - гліцерин, в 20 мМ фосфатному буфері, рН 6,5, яка інгібується патуліном, на другу нанесена референтна мембрана, іммобілізована в парах глутарового альдегіду і при такому співвідношенні компонентів (у мас. %): БСА - 6-12, гліцерин - 8-18, в 20 мМ фосфатному буфері, рН 6,5, при цьому біосенсор виконаний з можливістю підключення до кондуктометричної установки, яка під'єднана до комп'ютера.
Текст
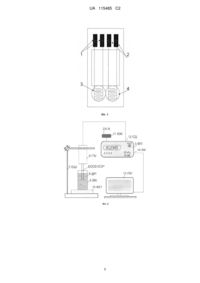
Реферат: UA 115485 C2 (12) UA 115485 C2 Біосенсор для визначення патуліну має дві пари кондуктометричних електродів, на одну з яких нанесена робоча ферментна мембрана на основі уреази, іммобілізована з сироватковим альбуміном бика в парах глутарового альдегіду при такому співвідношенні компонентів (у мас. %): 3-6 - уреаза, 3-6 - сироватковий альбумін бика (БСА), 8-18 - гліцерин, в 20 мМ фосфатному буфері, рН 6,5, яка інгібується патуліном, на другу нанесена референтна мембрана, іммобілізована в парах глутарового альдегіду і при такому співвідношенні компонентів (у мас. %): БСА - 6-12, гліцерин - 8-18, в 20 мМ фосфатному буфері, рН 6,5. Біосенсор виконаний з можливістю підключення до кондуктометричної установки, яка під'єднана до комп'ютера UA 115485 C2 5 10 15 20 25 30 35 40 45 50 55 Пропонований винахід належить до галузі екології і може бути використаний, зокрема, для експрес-аналізів овочів та фруктів, для оцінки наявності та визначення концентрації патуліну, а більш конкретно, до конструкції аналітичних систем для моніторингу токсичних речовин, а саме до біосенсора для визначення патуліну. Мікотоксини є низькомолекулярними вторинними метаболітами, що продукуються пліснявими грибами, вони завдають значної шкоди сільському господарству і харчовій промисловості оскільки забруднюють продукти харчування та корми на всіх стадіях виробництва, зберігання, транспортування та реалізації, і при потраплянні в організм людей і тварин викликають тяжкі отруєння - мікотоксикози. Патулін є мікотоксином, який продукується рядом мікроскопічних грибів, що належать до родів Penicillium, Aspergillus та Byssochlamys, основним представником цвілевих грибів, що синтезує патулін, є Penicillium expansum. Патулін виявляється у багатьох вражених гниллю овочах, фруктах та злаках, проте найхарактернішим його джерелом є яблука та продукти їх переробки, де вміст токсину може доходити до 17,5 мг/кг. [1, 2]. Патулін проявляє імунорепресуючу, мутагенну і нейротоксичну дію на деякі деяких видів свійських тварин і викликає ушкодження кишкового епітелію, дегенерації запалення, виразки і кровотечі [3, 4]. Всесвітня організація охорони здоров'я визначає допустиму добову дозу 0.4 мг патуліну на кілограм маси тіла [5]. Патулін часто міститься у гнилих фруктах, особливо яблуках, та продуктах їх переробки [6]. Патулін може викликати руйнування ДНК та має мутагенні, канцерогенні та тетрогенні властивості [7]. Було встановлено, що патулін викликає шлунково-кишкові ефекти, такі як здуття живота, утворення виразки та кровотечі. Виявлено, що патулін змінює кишкову бар'єрну функцію [8]. Небезпека, яку несе вміст патуліну в продуктах харчування потребує постійного його контролю. Визначення патуліну потребує чутливих, селективних і надійних методик. Поширеними і ефективними методиками аналізу патуліну є хроматографічні а саме, тонкошарова хроматографія, газова хроматографія, рідинна хроматографія-мас-спектрометрія, мікроемульсійна електрокінетична хроматографія, також капілярний електрофорез [6, 9, 10]. Але недоліки цих методів полягають у необхідності складного обладнання, наявності кваліфікованих спеціалістів, а також їх коштовність. Розробка та створення ферментного біосенсора для визначення патуліну найкраще вирішить проблеми, пов'язані з перерахованими вище недоліками. Біосенсорне визначення патуліну засноване на його інгібуючій дії на ферменти. Патулін має сильну афінність до сульфгідрильних груп за рахунок наявності лактон карбонільної групи мікотоксину, що призводить до інгібування багатьох тіолових ферментів, в тому числі уреази [11, 12]. На сьогодні є чимало повідомлень про розробку імунних біосенсорів для визначення патуліну, серед них більшість є оптичні біосенсори [13-15]. Також є повідомлення про імунний біосенсор на основі флуоресценції [16] та на основі кварцових кристалів [17]. Окрім імунних біосенсорів розроблені клітинні біосенсори, наприклад [18]. Відомий імунний біосенсор на основі силіконових наноструктурованих часток для визначення концентрації патуліну [19]. Як перетворювач використовували пластини 2 монокристалічного кремнію площею 100 см і товщиною 0,3 мкм та з опором 1 Ом/см. Специфічний сигнал реєстрували на основі зміни хемілюмінесценції та фотоструму. Недоліками описаного пристрою є, низька стабільність та селективність методу за рахунок використання силіконових наноструктурованих часток, що є гарними адсорбентами. Відповідно, при роботі з реальними зразками, ці силіконові наноструктуровані частки можуть адсорбувати різноманітні сполуки, що будуть давати не специфічний сигнал. Крім того, згаданий біосенсор характеризується високою собівартістю та тривалим часом аналізу за рахунок принципу роботи, а саме імунної взаємодії. В основу пропонованого винаходу поставлено задачу створення такого біосенсора для визначення патуліну, який був би більш швидким, стабільним, селективним при низькій собівартості. Поставлена задача вирішується пропонованим біосенсором для визначення патуліну, який має дві пари кондуктометричних електродів, на одну з яких нанесена робоча ферментна мембрана на основі уреази, іммобілізована з сироватковим альбуміном бика в парах глутарового альдегіду і такому співвідношенні компонентів (у мас. %): 3-6 - уреаза, 3-6 сироватковий альбумін бика (БСА), 8-18 - гліцерин, в 20 мМ фосфатному буфері, рН 6,5, яка інгібується патуліном, на другу нанесена референтна мембрана, іммобілізована в парах глутарового альдегіду і такому співвідношенні компонентів (у мас. %): БСА - 6-12, гліцерин - 818, в 20 мМ фосфатному буфері, рН 6,5, при цьому біосенсор виконаний з можливістю підключення до кондуктометричної установки, яка під'єднана до комп'ютера. 1 UA 115485 C2 5 Поставлена задача вирішується за рахунок застосування кондуктометричного методу вимірювання, ефекту інгібування іммобілізованого ферменту уреази патуліном. Необхідну селективність, стабільність та низьку собівартість аналізу, автори отримали завдяки використанню в складі біосенсора дешевого кондуктометричного перетворювача та високоселективного та стабільного ферменту - уреази. Швидкість аналізу досягалась за рахунок використання при визначення патуліну кондуктометричного методу аналізу. В основі роботи біосенсора для визначення патуліну лежить ефект інгібування уреази з наступною ферментутивною реакцією: + NH2CONH2 + Н + 2Н2О Уреаза → + 2NH4 + НСО3 10 15 20 25 30 35 40 45 50 55 В процесі проходження ферментативної реакції уреаза розщеплює сечовину, при цьому змінюється концентрація протонів у ферментній мембрані, відповідно, відбувається зміна провідності розчину, яку і можна реєструвати за допомогою кондуктометричного перетворювача. При потраплянні патуліну у ферментну мембрану, він починає інгібувати роботу ферменту. Відповідно, по ходу ферментативної реакції, при наявності інгібітору патуліну, генерується вже менше заряджених іонів, що призводить теж до зміни провідності розчину, але меншою мірою, ніж спочатку. залежно від цієї різниці і визначають концентрацію патуліну в досліджуваному зразку. Ферментативна система вибиралась авторами експериментально за умов отримання покращених аналітичних характеристик біосенсора, таких як селективність, операційна стабільність, та відтворюваність сигналу, а також мінімальної собівартості. Суть пропонованого винаходу пояснюється графічними матеріалами, де на фіг. 1 схематично показано біосенсор для визначення патуліну; на фіг. 2 показана блок-схема кондуктометричної установки; на фіг. 3 продемонстровано принцип роботи біосенсора на реальному прикладі проведення експерименту по визначенню патуліну; а на фіг. 4 наведено калібрувальні графіки залежності величини сигналу біосенсора від концентрації сечовини до та після інгібування патуліном. Біосенсор для визначення патуліну складається з двох пар електродів 1 та 2 (фіг. 1). На одну пару електродів 1 нанесена робоча мембрана 3. Робоча мембрана 3 містить у собі фермент уреазу, селективну до впливу патуліну. На другу пару електродів 2 нанесена референтна мембрана 4. Згаданий біосенсор підключений до кондуктометричної установки (фіг. 2). Кондуктометрична установка містить вимірювальний прилад (портативний кондуктометр "МСР-3") 5, що був, розроблений та виготовлений в Інституті електродинаміки НАН України [20]. Також кондуктометрична схема включала в себе тримач для біосенсора 6 і штатив 7. При проведенні вимірювань на основу штативу встановлюють робочу комірку 8 з досліджуваним розчином 9, а весь сенсорний блок встановлюють на магнітний перемішуючий пристрій 10. Портативний вимірювальний прилад "МСР-3" - 5 підключається до електромережі через адаптер мережі живлення 11, до біосенсора сполучними дротами через контакт 12, а до персонального комп'ютера 13 зі встановленим пакетом відповідного програмного забезпечення через контакт 14. Вимірювання проводили при частоті струму 37 кГц та амплітуді 14 мВ. Після підключення біосенсора до тримача одержували початкову базову лінію на графіку, а далі додавали досліджувану речовину. Відгук реєстрували на екрані персонального комп'ютера. Пропонований біосенсор для визначення патуліну працює так. На робочу поверхню однієї пари електродів 1 біосенсора наносили вихідну суміш для створення робочої мембрани 3 (об'єм 50 нл), яку вносили в пари глутарового альдегіду (ГА) на 20-30 хвилин. Цю робочу мембрану готували із 20 мМ фосфатного буфера, рН 6,5, і наступних інгредієнтів у такому їх співвідношенні (у мас. %): 3-6 уреази, 3-6 сироватковий альбумін бика (БСА), 8-18 гліцерин. На другу пару електродів 2 наносили вихідну суміш для створення референтної мембрани 4 (50 нл), яку вносили в пари ГА на 20-30 хвилин, цю мембрану формували з 20 мМ фосфатного буфера, рН 6,5, і наступних інгредієнтів у такому їх співвідношенні (у мас. %): 6-12 БСА, 8-18 гліцерин. 2 UA 115485 C2 5 10 15 20 25 30 35 40 45 50 55 Співвідношення компонентів біоселективних мембран біосенсора було отримано експериментально. Його підібрали для покращення аналітичних характеристик біосенсорів, таких як час відгуку, селективність, чутливість, операційна стабільність та ін. Після процесу іммобілізації біосенсори висушували 15 хв. на повітрі за кімнатної температури. Перед початком роботи, для видалення надлишку незв'язаного ферменту та інших компонентів мембран, біосенсори відмивали протягом 20 хв. у буфері, в якому і проводили подальші досліди. Пропоновану систему використовували так. Попередньо виготовляли біоселективні мембрани. Для створення ферментної мембрани 3 готували розчин з вмістом 5 % уреазу, 5 % БСА та 10 % гліцерину у 20 мМ фосфатному буфері, рН 6,5. Референтну мембрану 4 виготовляли таким же чином, але замість наважки ферменту брали лише 10 % БСА. Гліцерин у складі мембран 3, 4 використовувався для стабілізації ферменту при іммобілізації та запобігання передчасному підсиханню розчину, нанесеного на поверхню перетворювача. В свою чергу, БСА в складі робочої мембрани 3 відігравав роль стабілізуючого агента для ферменту. Для створення мембран біосенсора, відповідно, 3 та 4, краплю суміші уреаза-БСА (50 нл) наносили на одну частину чутливої поверхні перетворювача 1, а на іншу 2 - розчин БСА без ферменту (це був датчик порівняння). Для іммобілізації мембран датчики розміщували в атмосфері насичених парів глутарового альдегіду (ГА) на 20-30 хв. і потім підсушували на повітрі й відмивали від надлишку ГА у буферному розчині протягом 10-20 хв. Протокол аналізу патуліну в модельних розчинах. Біосенсор для визначення патуліну поміщали до вимірювальної комірки 1,5 мл, заповненої 5 мМ фосфатним буфером, рН 6,5, та витримували декілька хвилин для отримання стабільної базової лінії. Потім додавали певну аліквоту модельного розчину сечовини, отримували сигнал. Сигнал від біосенсора автоматично оброблявся комп'ютером і виводився у графічному вигляді на екран монітора. Далі біосенсор відмивався від субстрату та проводилось його інгібування в розчині з відповідною концентрацією патуліну. Далі знову отримували відгук біосенсора на ту ж саму концентрацію сечовини. Принцип роботи біосенсора наведено на фіг. 3. На фіг. 4 наведено калібрувальні криві біосенсора до та після його інкубації в розчині з патуліном. Після отримання кожного відгуку біосенсор відмивали від продукту, змінюючи робочий буфер мінімум 3 рази кожні 15-30 с, до виходу сигналу на базову лінію. Основні робочі характеристики запропонованого біосенсора для визначення патуліну та відомого імунного біосенсора на основі силіконових наноструктурованих часток [19] дуже відрізнялись. Наприклад, час одного аналізу за допомогою запропонованого біосенсора для визначення патуліну складав - 10-15 хв, що в три рази швидше, ніж у відомого біосенсора. Також, запропонований біосенсор характеризувався кращою селективністю та стабільністю з похибкою вимірювання в декілька разів меншою. Ціна аналізу біосенсором для визначення патуліну є щонайменше в 10 разів нижча, ніж у відомого аналога. Джерела інформації: 1. М.О. Moss. Fungi, quality and safety issues in fresh fruits and vegetables. Journal of Applied Microbiology. 2008, 104(5), 1239-1243. 2. Brian P.W., Elson G.W., Lowe D. Production of patulin in apple fruits by Penicillium expansum. Nature.1956, 178, 263-264. 3. Mahfoud, R., Maresca, Μ., Garmy, Ν., Fantini, J., Themycotoxin Patulin alters ehe barrier function of the intestinal epithelium: mechanism of action of the toxin and protective effects of glutathione. Toxicol. Appl. Pharmacol. 2002, 181, 209-218. 4. A. Wallace Hayes, Timothy D. Phillips, W. Lane Williams, Alex Ciegler. Acute toxicity of patulin in mice and rats. Toxicology. Volume 13, 1979, Pages 91-100. 5. JECFA, (1995). Evaluation of certain food additives and contaminants: forty-fourth report of the Joint FAO/WHO Expert Committee on Food Additives, WHO Technical Report Series No. 859, 9241208597, Geneva. 6. Gimeno A. Thin layer chromatographic determination of aflatoxins, ochratoxins, sterigmatocystin, zearalenone, citrinin, T-2 toxin, diacetoxyscirpenol, penicillic acid, patulin, and penitrem A. J Assoc Off Anal. Chem. 1979, 62(3), 579-585. 7. Patulin-Induced Suicidal Erythrocyte Death, Adrian Lupescu Kashif Jilani Mohanad Zbidah Florian Lang, Cell Physiol Biochem 2013; 32:291-299. 8. Occurrence of patulin in organic and conventional apple-based food marketed in Catalonia and exposure assessment, Ester Pique, Liliana Vargas-Murga, Jesus Gomez-Catalan, Joaquin de Lapuente, Joan Maria Llobet, Food and Chemical Toxicology 60 (2013) 199-204. 3 UA 115485 C2 5 10 15 20 25 30 35 9. Gordon S. Shephard, Norma L. Leggott. Chromatographic determination of the mycotoxin patulin in fruit and fruit juices.Journal of Chromatography A, 2000, 882, 17-22. 10. Takino M., Daishima S., Nakahara T. Liquid chromatography/mass spectrometric determination of patulin in apple juice using atmospheric pressure photoionization. Rapid Commun. Mass Spectrom.2003, 17, 1965-1972 11. Peraica M., B. Radic, A. Lucic, M. Pavlovic Toxic effects of mycotoxins in humans. Bulletin of the World Health Organization, 1999, 77 (9), 754-766. 12. Eduardo Beltran, Maria Ibanez, Juan Vicente Sancho, Felix Hernandez Determination of patulin in apple and derived products by UHPLC-MS/MS. Study of matrix effects with atmospheric pressure ionization sources. Food Chemistry 2014, 142, 400-407. 13. Control of mycotoxins by immune biosensor based on the structured nano-porous silicon, N.F. Starodub, N. F. Slishek, I.V. Pylypenko, Μ.Μ. Mel'nichenko, L. N. Pylypenko, Sensor Electronics and Microsystem Technologies 2013 – T. 10, № 2, p. 68-72 14. A surface plasmon resonance based biochip for the detection of patulin toxin, Anna Pennacchio, Giuseppe Ruggiero, Maria Staiano, Gennaro Piccialli, Giorgia Oliviero, Aneta Lewkowicz, Anna Synak, Piotr Bojarski, Sabato D'Auria, Optical Materials xxx (2014) xxx-xxx, article in press as: A. Pennacchio et al., Opt. Mater. (2014) 15. Biosensors and multiple mycotoxin analysis, Bram van der Gaag, Sabine Spath, Heidi Dietrich, Edwin Stigter, Gerben Boonzaaijer, Ton van Osenbruggen, Kees Koopal, Food Control 14(2003)251-254. 16. A near-infrared fluorescence assay method to detect patulin in food, Anna Pennacchio, Antonio Varriale, Maria Grazia Esposito, Maria Staiano, Sabato D'Auria, Analytical Biochemistry 481 (2015) 55-59. 17. Detection of parathion and patulin by quartz-crystal microbalance functionalized by the photonics immobilization technique, Riccardo Funari, Bartolomeo Delia Ventura, Raffaele Carrieri, Luigi Morra, Ernesto Lahoz, Felice Gesuele, Carlo Altucci, Raffaele Velotta, Biosensors and Bioelectronics, article in press 18. The ciliated protozoa Tetrahymena thermophila as a bionsensor to detect mycotoxins, L. Benitez, A. Martin-Gonzalez, P. Gilardi, T. Soto, J. Rodriguez de Lecea and J.C. Gutierrez, Letters in Applied Microbiology 1994, 19, 489-491. 19. N.F. Starodub, N.F. Slishek, I.V. Pylypenko, M.M. Mel'nichenko, L.N. Pylypenko, Control of mycotoxins by immune biosensor based on the structured nano-porous silicon. Sensor Electronics and Microsystem Technologies 2013 – T. 10, № 2, 68-72. 20. В.Г. Мельник, А.Д. Василенко, A.E. Дудченко, В.Д. Погребняк, Исследования подавления синфазной помехи в биосенсорной кондуктометрической системе с дифференциальными датчиками. Sensor Electronics and Microsystem Technologies 2014 - Т. 11, № 3, 49-61. ФОРМУЛА ВИНАХОДУ 40 45 Біосенсор для визначення патуліну, який має дві пари кондуктометричних електродів, на одну з яких нанесена робоча ферментна мембрана на основі уреази, іммобілізована з сироватковим альбуміном бика в парах глутарового альдегіду і при такому співвідношенні компонентів (у мас. %): 3-6 - уреаза, 3-6 - сироватковий альбумін бика (БСА), 8-18 - гліцерин, в 20 мМ фосфатному буфері, рН 6,5, яка інгібується патуліном, на другу нанесена референтна мембрана, іммобілізована в парах глутарового альдегіду і при такому співвідношенні компонентів (у мас. %): БСА - 6-12, гліцерин - 8-18, в 20 мМ фосфатному буфері, рН 6,5, при цьому біосенсор виконаний з можливістю підключення до кондуктометричної установки, яка під'єднана до комп'ютера. 4 UA 115485 C2 5 UA 115485 C2 Комп’ютерна верстка В. Мацело Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 6
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C12Q 1/25, G01N 33/02, G01N 27/26
Мітки: біосенсор, визначення, патуліну
Код посилання
<a href="https://ua.patents.su/8-115485-biosensor-dlya-viznachennya-patulinu.html" target="_blank" rel="follow" title="База патентів України">Біосенсор для визначення патуліну</a>
Попередній патент: Установка для дослідження впливу розчинів поверхнево-активних речовин і механічних навантажень на тріщинуватість низькопроникних нафтогазоносних колекторів
Наступний патент: Спосіб діагностики активізації запального процесу у дітей, хворих на бронхіальну астму
Випадковий патент: Спосіб синтезу івабрадину і його адитивних солей з фармацевтично прийнятною кислотою