Спосіб одержання ліпосомальної композиції, що має антитоксичну гепатозахисну дію
Номер патенту: 14596
Опубліковано: 20.01.1997
Автори: Теміров Юрій Павлович, Стефанов Олександр Вікторович, Григор'єва Ганна Савівна, Краснопольський Юрій Михайлович, Дроговоз Світлана Мефодіївна, Слишков Володимир Васильович, Конахович Наталія Филимонівна
Формула / Реферат
Способ получения липосомальной композиции, обладающей антитоксическим гепатозащитным действием, путем высушивания фосфатидилхолина, егоэмульгирования в воднойсреде, гомогенизации, стерилизующей фильтрации и лиофильной сушки, отличающийся тем, что высушивание проводят из раствора фосфатидилхолина, в который дополнительно вводят трис-[N-(2,3-диметилфенил)антранилато]алюминий в соотношении фосфатидилхолин:трис- [N-(2,3-диметилфенил)антранилато]алюминий (мас.д.) 1:(0,01-0,1).
Текст
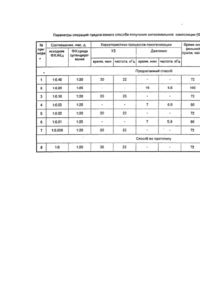
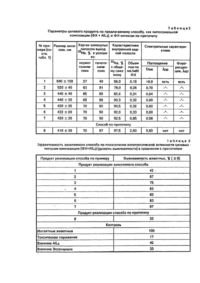
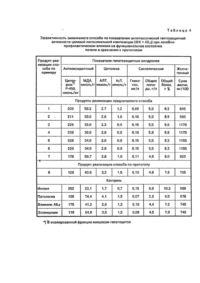
Изобретение касается способа получения лекарственного состава, представляющего собой липосомальную композицию двух веществ, взятых в определенных соотношениях: - природного фосфолипида - фосфатидилхолина - комплекса алюминия с N-2,3-диметил-фенилантраниловой диметилфенил)антранилато]алюминия кислотой: трис-[N-(2,3 обладающей антитоксическим гепатозащитным действием, и предназначено для использования в фармации и медицине. Проблема разработки новых способов получения эффективных гепатопротекторов актуализирована отсутствием ощутимого прогресса в стратегии и практике методов создания современных средств защиты и реабилитации печени в сравнении с другими фармакотерапевтическими областями. На фоне роста патологий печени токсического генеза, обусловленных распространяющимся токсикогенным воздействием на организм человека. Причины отставания запросов фармакотерапии печени от современных возможностей их удовлетворения связаны с тем, что известные способы получения большинства средств терапии печени не обеспечивают качества целевого продукта, адекватного полиморфному характеру гепатопоражений, в т.ч. не ориентированы на достижение направленного гепатоспецифического транспорта создаваемых субстанций, их сродства к мембранам гепатоцитов и участия в кислородзависимых процессах, вовлеченных в генез гепатопоражений. Эти недостатки характерны для большинства способов получения веществ и композиций, реализованных в виде гепатопротекторных препаратов (силибор, карсил, легалон, Лив-52, аспатофорт, гепатофолк и др,). Вследствие этого качество получаемых средства не соответствует оптимальному транспортирту и метаболизму в печени, а также их применению в острых патологических состояниях. Способы же получения кортикостероидов, используемых именно в активных стадиях патологий печени, обусловливают существование у целевых продуктов негативных побочных физиологических свойств, предрасполагающих печень к клинической эволюции в итоговый цирроз, Известен способ получения координационного соединения алюминия с N-2,3-диметилфенилантраниловой кислотой (АlL3), обладающего противоцирротическим действием, наряду с противовоспалительным, анальгезирующим и жаропонижающим [1]. Реализация этого способа создает такие физиологические качества продукта, которые обусловливают достаточно широкий ареал его антитоксических гепатозащитных свойств. В то же время элементы и приемы способа получения комплекса AIU обусловливают гидро-фобность и водонерастворимость целевого продукта, что определяет его использование исключительно per os в виде твердой лекарственной формы и существенно снижает его терапевтические возможности. Критериям эффективности в боздании оптимально транспортируемых и метабли-зируемых средств терапии печени в наибольшей степени адекватны способы получения продуктов с использованием фосфолипидов - основных компонентов липидного матрикса клеточных мембран. Известен способ предполагающий смешение фосфолипидов с витаминами при их суммарном массовом соотношении (7-9): 1, по которому получают широко используемый препарат "Эссенциале" (Natterman, Германия), [2]. Однако приемы реализации этого способа определяют присутствие в составе "Эссенциале" 4-12% лизокомпонентов, оказывающих агрессивное воздействие на мембраны, что снижает качество и стабильность целевого продукта. Известны способы получения фосфоли-пидных средств в липосомальной форме [3-5]. Реализация таких способов обеспечивает повышение стабильности и функционального качества получаемых продуктов - липосом за счет их высоких транспортной активности и сродства к кислороду. Способ получения липосомального средства из фосфатидилхолина (яичного лецитина), обладающего антигипоксическим действием, осуществляемый в соответствии с[3], выбран в качестве прототипа настоящего изобретения как наиболее близкий его аналог по совокупности признаков: сущности и последовательности осуществления операций и приемов способа, химической природе фосфолипидного элемента способа, создаваемой липосомальной организации целевого продукта и сочетания проявлений фармакологического эффекта. Способ по прототипу осуществляется путем высушивания фосфатидилхолина, его эмульгирования в водной среде, гомогенизации, стерилизующей фильтрации и лиофилизации. Однако способ по прототипу не обеспечивает качества целевого липосомального продукта, обусловливающего высокий уровень специфической антитоксической гепатозащитной активности. Это связано с тем, что использование в качестве элемента способа исходного только липидного материала (фосфатидилхолина) при осуществлении предусмотренных способом операций получения липосомальной формы не создает у целевого продукта выраженных антиоксидантних свойств, являющихся важнейшим звеном в механизме гепатопротекторного действия. Более того, реализация способа по прототипу может определить прооксидантные качества получаемой липосомальной формы вследствие частичного окисления чисто липидного материала [4]. Это снижает эффективность способа получения по прототипу в плане качества целевого липосомального продукта как гепатопротектора. Задачей изобретения является повышение качества липосомального средства, проявляющего антитоксическое гепатозащитное действие. Поставленная задача достигается реализацией предлагаемого способа получения липосомальиой композиции на основе фос-фатидилхолина и комплекса АlL3. Способ предполагает смешение растворов фосфа-тидилхолина и комплекса АlL3 в органическом растворителе, удаление растворителя высушиванием, эмульгирование полученной смеси в водной среде, гомогенизацию ультразвуковым воздействием или при высоком давлении, стерилизующей фильтрации и ли-офилизации. В литературе не описаны способы получения липосомальных композиций и липосомальных форм, содержащих координационные соединения металлов, и, соответртвенно, нет сведений о потенциально достижимом вследствие реализации таких способов положительном фармакологическом или ином эффекте целевых продуктов. Далее приводим конкретные примеры осуществления предлагаемого способа и прототипа. Пример 1 (заявляемый объект). Точную навеску 50,0 г фосфатидилхолина, ФХ, (яичного лецитина [6] растворяют в 250 мл хлороформа. 1С полученному растоору прибавляют раствор точной навески 20 г комплекса АlL3 в 250 мл хлороформа. Раствор смеси помещают о круглодонную стеклянную колбу объемом 2 л тщательно перемешивают и при температуре 3040°С на роторном испарителе "Ротатест" в вакууме удаляют растворитель. Для полного его удаления в конце процесса через систему пропускают инертный газ. К полученной на стенках тонкой липидной пленке добавляют 1000 мл очищенной и стерилизованной воды. Смесь перемешивают в течение 30 - 40 мин до полного перехода пленки в водную фазу с образованием суспензии. Далее полученную суспензию подвергают ультразвуковой обработке на аппарате УЗДН-А при частоте 22 кГц и температуре 22 -25°С в течение 30 мин. К полученной эмульсии липосом добавляют 32 г молочного сахара фармакопейного (лактозы), тщательно перемешивают, а затем осуществляют повторную обработку реакционной системы на аппарате УЗДН-А при 22-25°С о течение 20 мин. Полученную молочно-белую эмульсию подвергают стерилизующей фильтрации на фильтре Millipore, порционно разливают в асептических условиях во флаконы емкостью 25 - 100 мл, подвергают интенсивному замораживанию до -70°С в жидком азоте и осуществляют лиофильную (сублимационную сушку в аппарате ТГ-50 в течение 72 ч для полного удаления влаги. После сушки флаконы с липосомальной композицией продувают инертным газом, в атмосфере которого осуществляют также закупорку и герметизацию флаконов в асептических условиях. Пример 2 (заявляемый объект). Точную навеску 50,0 г фосфатидилхолина, ФХ, (яичного лецитина [6]) растворяют в 250 мл хлороформа. К полученному раствору прибавляют раствор точной навески 10 г комплекса АlL3 в 250 мл хлороформа. Раствор смеси помещают в круглодонную стеклянную колбу объемом 2 л тщательно перемешивают и при температуре 3040°С на роторном испарителе "Ротатест" в вакууме удаляют растворитель. Для полного его удаления в конце процесса через систему пропускают инертный газ. К полученной на стенках тонкой липидной пленке добавляют 1000 мл очищенной к стерилизованной воды. Смесь перемешивают в течение 30-40 мин до полного перехода пленки в водную фазу с образованием суспензии. Далее полученную суспензию подвергают двукратной гомогенизации в реакторе гомогенизатора высокого давления a-Laval при давлении 6,5 * 107 Па и температуре 30-35°С в течение 10 мин с пятиминутным перерывом между циклами гомогенизации, в течение которого система охлаждается до 22-25°С. К полученной эмульсии липосом добавляют 32 г молочного сахара фармакопейного, (лактозы), тщательно перемешивают, а затем осуществляют повторную обработку реакционной системы в гомогенизаторе a-Laval при 30-35°С и давлении 6,5 *107 Па в течение 5-7 мин. Полученную молочно-белую эмульсию подвергают стерилизующей фильтрации на фильтре Millipore, порционно разливают в асептических условиях во флаконы емкостью 25-100 мл, подвергают интенсивному замораживанию до -70°С в жидком азоте и осуществляют лиофильную (сублимационную сушку в аппарате ТГ-50 в течение 100 ч для полного удаления влаги. После сушки флаконы с липосомальной композицией продувают инертным газом, в атмосфере которого осуществляю г также закупорку и герметизацию флаконов в асептических условиях. В примерах 3-7 операции и приемы согласно заявляемому способу осуществляют в порядке, изложенном в примерах 1,2. Изменения отражены в табл.1. Целевой продукт представляют собой легкий пушистый блестящий порошок белого цвета. Пример 8 прототип по [3]. Раствор 50 г фосфатидилхолина (яичного лецитина) в 250 мл этилового спирта помещают в круглодонную стеклянную колбу и удаляют растворитель на роторном испарителе Ротадест в вакууме при 30 - 40°С. К образовавшейся на стенках липидной пленке добавляют 1000 мл очищенной и стерилизованной воды/перемешивают 30 мин до перехода пленки в водную фазу с образованием суспензии. Далее проводят ее ультразвуковую обработку на аппарате УЗДН-А при частоте 22 кГц и температуре 22 - 25°С в течение 40 мин. Полученную суспензию подвергают стерилизующей фильтрации на аппарате Milllpore, в асептических условиях разливают во флаконы и подвергают интенсивному замораживанию, помещая флаконы в жидкий азот. Затем проводят лиофильную (сублимационную) сушку а аппарате ТГ-50 в течение 72 ч для удаления влаги. После сушки флаконы с липосомами продувают инертным газом, в атмосфере которого осуществляют также закупорку и герметизацию флаконов в асептических условиях. В результате осуществления способа по прототипу получают липосомы из ФХ в виде легкого пушистого блестящего порошка белого цвета. Физико-химические характеристики, идентифицирующие целевой продукт, полученный согласно предлагаемому способу, в качестве липосомальной композиции ФХ+ФІІ_3, приведены о табл.1 и 2. Эффективность предлагаемого способа по уровню включения исходных ингредиентов в липосомы определяют методом гель-фильтрации на колонке с Сефадексом G-25 (Швеция), элюат-физиологический раствор Выход целевого липосомального продукта из колонки контролируют по характеристическому поглощению в области 540 нм, где существование узкого сигнала в спектре "мутности" отражает монодисперсный состав липосом; Доказательства получения вследствие реализации заявляемого способа целевого продукта как замкнутых липосом получены методом электронной спектроскопии на приборе "Hitachi H 600" (увеличение 105 тыс.). Электронномикроскопическая картина целевого продукта прямо идентифицирует замкнутые сферические липосомы и позволяет оценить их размер, а также отражает повышение контрастности границы между их мембранами в сравнении с чисто фосфатидилхолиновыми липосомами, полученными по способу-прототипу (пример 8). Последний факт указывает на повышение электронной плотности за счет включения комплекса металла в целевую липосомаль-ную композицию. Размер липосом в целевом продукте независимо определен также методом лазерной корреляционной спектроскопии (спектрограф "Малверн 4800). Получение по предлагаемому способу липосомальной композиции ФХ + AIU с внутренней водной полостью липосом показано радиоизотопным методом с маркером 22Na. Радиоактивность систем детектируют на g- счетчике Бэкман (США). Диализ липосомальной композиции проводят в аппарате "Вискинг туб 1 /32" (США) против физиологического раствора (норматонические условия) или дистиллированной воды (гипотонические условия). Обьем внутренней полости липосом в целевой липосомальной композиции, полученной по предлагаемому способу, рассчитан по разнице содержания метки 22Na в исходном растворе и после удаления не включившегося в липосомы 22Na (в единицах отношения объема внутриполостной водной фазы, мл, к содержанию ФХ d постоянном объеме липосом, мМ). Эффективность заявляемого способа по качественной и количественной идентификации в целевой липосомачыюй композиции липидного компонента (ФХ) оценена методом тонкослойной хроматографии (ГФ X, т.1, стр. 102) на ппастинках СИЛУФОЛ (Чехия) о сравнении в лецитинстандартом. Эффективность заявляемого способа по качественной и количественной идентификации в целевой липосомальной композиции компонента - комплекса АlL3 оценена о растворе целевого продукта в хлороформе после отделения водной фазы центрифугированием: - по характеристическому поглощению в УФ-области (282 нм) в сравнении со стандартом АlL3; - по содержанию алюминия, определенному после "мокрого озоления" образца целевого продукта атомно-адсорбционным методом; - по характеристической полосе испускания о спектре флуоресценции (457 нм) о сравнении со стандартом - АlL3. Спектры поглощения регистрировали на приборе Specord UV-VIs, спектры флуоресценции на приборе "Hitachi MPF-4". Согласно проведенной физико-химической идентификации заявляемый способ обеспечивает качества целевого продукта как липосомальной композиции .ФХ + А11_з (табл. 1-2): - вводимые согласно приемам предлагаемого способа компоненты композиции (примеры 2-7) полностью включаются в ли-посомальную структуру, чему соответствует их количественное совпадение до и после гельфильтрации; - количество метки 22Naадс. совпадает для исходных и переформированных липо-сом, скорость выхода 22Na возрастает в гипотонических условиях: - сферические липосомы прямо регистрируются методом электронной микроскопии, их средний внешний диаметр - 220 нм; - по данным химического анализа, УФ-и флуоресцентной спектроскопии мольное соотношение AI:L в целевом продукте по примерам 1-7 отвечает составу АlL3. Положение полос поглощения (D282) и испускания (А457), а также усиление контрастности границ между мембранами в электронномикро-скопической картине соответствуют липосомам ФХ + АlL3 с супрамолекулярными связями между компонентами. Приведенные результаты независимых физико-химических исследований свидетельствуют о том, что полученный по предлагаемому способу по примерам 2-6 целевой продукт представляет собой композицию замкнутых липосом с внутренней водной полостью при массовом соотношении ингредиентов фосфатидилхолин: АlL3 от 1:10 до Т:0,01. Реализация предлагаемого способа с изменением указанных пределов соотношения компонентов обуславливает снижение качества целевого продукта: - неоднородность дисперсного состава липосом (диаметр > 500 нм, примеры 1-2); - искажения соотношения ингредиентов в целевом продукте относительно исходно введенного (примеры 1 и 7). Для примера 7, где соотношение ФХ:А11_з100%). Это связано с тем, что при реализации предлагаемого способа по параметрам примера 7 исходное содержание AlLa сопоставимо с ошибкой определения. В соответствии с задачей изобретения проведена оценка качества целевого продукта липосомальной композиции ФХ + АlL3, полученной по предлагаемому способу (примеры 1-7), в сравнении с таковой для ФХ-липосом, полученных по прототипу, в отношении их антитоксического гепатозащитного действия. Для оценки уровня эффективности предлагаемого способа при сравнении функциональной активности создаваемого целевого продукта использованы также: - трис[N-2,3-диметилфенилантранила-то]алюминий - АlL3, как элемент реализации предлагаемого способа и ингредиент целевого продукта, обладающий собственной антицирротической активностью [1]; - препарат Эссенциале, содержащий фосфолипиды и реально применяемый в клинике гепатопоражений (Германия, Natterman). Функциональная эффективность заявляемого способа в сравнении с прототипом определена по качеству целевых продуктов: липосомальной композиции ФХ + АlL3 и ФХ-липосом при лечебном и лечебно-профилактическом использовании при пероральном и инъекционном способах введения. Перед применением указанных липосомальных средствах их суспендируют стерильным физиологическим раствором. В сравнительных экспериментах комплекс АlL3 применяют пероральио, препарат Эссенциале- внутрибрюшинно в растворе глюкозы. Лечебное действие целевой липосомальной композиции, полученной по предлагаемому способу, - ФХ-липосом по прототипу и препаратов сравнения определено на модели токсического поражения печени, вызванного введением гепатотропного ксенобиотика ССІ 4 и/или его комбинации с наркотическим токсином - этанолом [7]. Модель осуществляют по схеме: в течение 4 сут экспериментальным животным 1 раз в сутки подкожно вводят ССЦ (0,4 мл/100 г массы), затем через 3 ч - этанол (40% раствор по 1,2 мл/100 г массы). Испытуемые средства сводят за 1 ч до токсина в течение 4 сут и еще 3 сут после окончания затравки. Животных декапитируют на 7 сутки. Для корректной оценки эффективности предлагаемого способа по антитоксической активности целевого продукта учитывают фактор выживаемости в "жесткой" модели поражения: в течение 7 сут животным внут-рижелудочно вводят ССІ4 (10% раствор по 1,0 мл/кг массы в сутки). Испытуемое средство вводят после последнего введения токсинов в течение 14 сут. Гибель животных учитывают на протяжении всего периода наблюдения. В контрольной группе было по 6-12 животных (интактных), в группах, подвергшихся воздействию токсинов и леченных - не менее 12-ти. Использованы следующие дозы целевой липосомальной композиции и ФХ-липосом по прототипу (мг/кг): 15 (внутрибрюшинно), 88 (перорально). Комплекс АlL3 применен в дозе 8 мг Укг. Эссенциале -32 мг/кг. Эффективность предлагаемого способа в сравнении с прототипом оценивают по влиянию целевой липосомальной композиции и ФХ-липосом по прототипу структурно-функционального и морфологического состояния печени, а также на выживаемость животных. Комплекс указанных параметров корректно отражает антитоксическое гепатозащитное действие. Основные биохимические, морфологические и гистологические показатели определяют стандартными методами согласно [8-10]. Ультраструктура печени изучают в обезвоженых образцах на электронном микроскопе ЭМ-100 БР при 4 * 104-кратном увеличении. Оценка эффективности заявляемого способа по показателям антитоксической активности целевого продукта приведена в табл.3 и 4. Эксперимент показал, что в условиях токсического поражения печени в выбранных моделях происходит резкая гибель животных, возникают грубые искажения функционального состояния и морфологической картины печени. Лечебные мероприятия с применением всех исследованных средств улучшают практически ее аномально измененные показатели, однако только вследствие реализации предлагаемого способа качество целевого продукта - липосомальной композиции ФХ + AIL3 отвечает высокому уровню интегрального антитоксического гепатозащитного действия. Возникающее качество целевого продукта обусловливает в сравнении с ФХ-ли-посомами, полученными по прототипу, и объектами сравнения (АНз и Эссенциале), соответственно: - повышение выживаемости в (2,3 - 2,5) и (1,8 - 2,5) раза; - повышение показателей специфического антиоксидантного эффекта в (1.8 - 2,1) и (1,4-1,8) раза; - понижение специфической гиперферментемии и синдрома цитолиза в (1,6 - 2,0) и (1,4 т 2,0) раза; - активацию репаративных и синтетических процессов в печени в (1,3 - 1,6) и (1,3 -1,5) раза; - повышение желчегонной функции в 1,5 и 1,6 раза. При этом при реализации предлагаемого способа по примерам 2-6 целевой продукт обеспечивает достоверную нормализацию практически всех исследованных структурнофункциональных показателей, что соответствует качеству липосомальной композиции ФХ + АlL3, отвечающему высокому выраженному антитоксическому гепатозащитную эффекту. Этому выводу соответствуют результаты патоморфологических исследований. У животных, подвергшихся воздействию токсина, резко выражены аномальные изменения ультраструктуры и биоэнергетики печени, соответствующие картине распространенного гепатита: лизис мембран гепатоцитов, локальная некротизация, гипертрофия комплекса Гельджи, полнокровие центральных вен, микроциркуляторные расстройства, снижение содержания гликогена и СДГ, крупнокапельная жировая дистрофия цитоплазмы и др. Под влиянием ФХ-липосом, полученных по прототипу, а также комплекса А11_з и Эссенциале характерные патоморфологиче-ские признаки токсического гепатита сохраняются, хотя выражены слабее, чем в патологии: некротизация гепатоцитов, пери-васкулярная инфильтрация, частичная деструкция мембран. В содержании крупных липидных включений в цитоплазме, СДГ и гликолена, степени вакуолизации эндоплазматического ретикулума наблюдается лишь тенденция к нормализации, по-прежнему резко уменьшено число связанных рибосом. На фоне сохранения в целом аномальной морфологической картины, характерной для качества продукта по прототипу и объектов сравнения, выявлены существенные преимущества качества целевого продукта по предлагаемому способу, отражающие его способность влиять на глубокие структурные изменения печени токсического генеза; - лизис мембран отмечен лишь на отдельных участках: - митахондрии округлой формы равномерно распределены по всему объему гепатоцитов, их наружная оболочка не деструктурирована; - эндоплазматический ретикулум хорошо развит, в системе мембран большое число связанных рибосом; - количество липидных включений, содержание гликогена и СДГ характерны для нормы; - комплекс Грльджи и ультраструктура микроциркуляторного русла приобретают типичное строение. Таким образом, качество липосомальной композиции ФХ + АlL3, полученной по предлагаемому способу, отвечает достоверной активации репаративных процессов печени, вследствие чего практически исчезают явления токсического гепатита. Оптимальное качество целевого продукта по уровню интегрального антитоксического гепатозащитного эффекта обеспечивается при реализации предлагаемого способа согласно операциям и параметрам, описываемым примерами 2-6, т.е. - при совместном высушивании ФХ с АlL3 при их массовом соотношении 1:(0,01 -0,1). За пределами этих значений (примеры 1;*2 и 7) качество целевого продукта снижается: не обеспечивается стабильность физико-химических характеристик, идентифицирующих целевой продукт как липосомальную композицию (таблицы 1 и 2), а также снижается его специфическая активность (табл.3 и 4). Полученные данные позволяют сделать вывод о том, что осуществление предлагаемого способа решает задачу повышения качества эффективного липосомального средства, обладающего антитоксическим гепатозащитным действием. Созданная согласно предлагаемому способу липосомальная композиция фосфатидилхолина и трис-[N-(2,3диметилфенил)антранилато]алюминия . обладает ценными антитоксическими гепа-тозащитными свойствами, по уровню которых выгодно отличается от липосом на основе фосфатидилхолина, полученных по способу-прототипу, а также от индивидуального АlL3 и препарата Эссенциале. Это делает предлагаемый способ перспективным для получения современного липосомального средства терапии патологий печени токсического генеза.
ДивитисяДодаткова інформація
Автори англійськоюHryhorieva Hanna Savivna, Stefanov Oleksandr Viktorovych, Kokhanovych Natalia Fylymonivna, Drohovoz Svitlana Mefodiivna, Slyshkov Volodymyr Vasyliovych, Krasnopolskyi Yurii Mykhailovych, Krasnopolskii Yurii Mykhailovych, Temirov Yurii Pavlovych
Автори російськоюГригорьева Анна Саввовна, Стефанов Александр Викторович, Конахович Наталия Филимоновна, Дроговоз Светлана Мефодиевна, Слышков Владимир Васильевич, Краснопольский Юрий Михайлович, Краснопольский Юрий Михайлов, Краснопольський Юрий Михайлович, Темиров Юрий Павлович
МПК / Мітки
МПК: A61K 33/06, A61K 9/127
Мітки: композиції, спосіб, ліпосомальної, одержання, гепатозахисну, має, дію, антитоксичну
Код посилання
<a href="https://ua.patents.su/8-14596-sposib-oderzhannya-liposomalno-kompozici-shho-maeh-antitoksichnu-gepatozakhisnu-diyu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання ліпосомальної композиції, що має антитоксичну гепатозахисну дію</a>
Попередній патент: Спосіб кількісного визначення токсичності дифтерійного токсину
Наступний патент: Засіб для зниження тиску у легеневій артерії у хворих на хронічний обструктивний бронхіт
Випадковий патент: Пристрій для іридодіагностики