Спосіб кількісного визначення токсичності дифтерійного токсину
Номер патенту: 14595
Опубліковано: 20.01.1997
Автори: Винник Валентина Дмитрівна, Стопчанська Алла Григорівна, Долеско Юрій Валерійович
Формула / Реферат
Способ количественного определения токсичности дифтерийного токсина, заключающийся в установлении минимального разведения токсина, вызывающего цитопатический эффект в культуре клеток Hela, отличающийся тем, что для сокращения сроков исследования и повышения точности способа, разведения токсина в объеме 1 мл наносят на клетки 1-суточной культуры Hela, оставляют на 1 час и удаляют, клетки культивируют при 370C 24 часа, окрашивают гематоксилинэозином, выявляют поврежденные токсином клетки с эозинофильными ядрышками, агрегацией и маргинацией хроматина, грибовидными или удлиненными цитоплазматическими отростками и устанавливают минимальное количество токсина, вызывающее указанные изменения, что соответствует минимальной цитопатической дозе или 1 Dim для морских свинок.
Текст
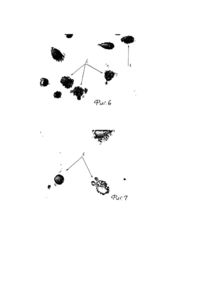
Изобретение относится к медицине, а именно иммунологии и бактериологии, и может быть использовано для измерения качества дифтерийного токсина и проверки полноты его инактивации в дифтерийном анатоксине. Разработанный способ может быть использован в производственных усло виях при получении дифтерийного токсина, анатоксина и противодифтерийной сыворотки, а также в научных исследованиях для изучения активности токсинообразования штаммов дифтерийной палочки и влияния инактивирующи х ве ществ на токсин. Проблема борьбы с дифтерией продолжает оставаться одной из наиболее актуальных в здравоохранении, что определяет исключительную важность получения качественных противодифтерийных препаратов, в частности, анатоксинов и антитоксической сыворотки, используемых для профилактики и лечения дифтерии. Одним из важных этапов получения указанных препаратов является измерение качества дифтерийного токсина и получаемого из него в результате инактивации формалином дифтерийного анатоксина. Измерение качества токсинов проводится in vivo на морских свинках и in vitro по способности связываться с антитоксинами [1,2,3]. Процесс токсинообразования и качество получаемого токсина контролируют в биологическом опыте, определяя минимальную смертельную дозу на морских свинках. По данным Левина Я.В. [1] для точного определения Діm требуется не менее 30 животных. Автор отмечает необходимость учета индивидуальных отклонений в чувствительности морских свинок к дифтерийному токсину. Продолжительность исследования составляет 8-16 дней. Определение безвредности очищенного концентрированного анатоксина проводят не менее чем на 2-х морских свинках, которые находятся под наблюдением 45 сут. В случае появления у них симптомов специфической интоксикации анатоксин дообезвреживают и повторно проверяют на безвредность [2]. Таким образом, методы биологического тестирования дифтерийного токсина и анатоксина дорогостоящи и продолжительны по времени. Для удешевления и ускорения контроля указанных препаратов были предприняты попытки использовать методы с применением клеточных культур. При этом токсичность препаратов оценивали по их цитопатическому действию (ЦПД) и влиянию на жизнеспособность клеток [4,5,6]. По мнению Советовой Г.П. и др. [5], методы клеточных культур имеют следующие неоспоримые преимущества перед способами биологического тестирования на животных: точность и быстрота получения ответов, малый разброс данных, меньшая стоимость. Титрование дифтерийного токсина [4] проводили на различных культурах клеток. Готовили 2кратные разведения в среде 199 без сыворотки и наносили по 1 мл на клетки, посевная доза последних зависела от индивидуальных особенностей клеточного штамма. Для культуры HeLa она составляла 7 х 104/мл. Использовали 3-суточную культур у. Изменения монослоя клеток при внесении больших количеств токсина наблюдали спустя 16-18 ч, максимальные повреждения отмечены спустя 72 - 96 ч. Клетки округлялись, разрущались и отслаивались от стекла, отмечали увеличение ядер, зернистость и вакуолизацию цитоплазмы. Авторы показали, что наиболее чувствительной к дифтерийному токсину {оказалась, культура HeLa. Субтоксическая доза первое разведение без видимых разрушений клеток - была равна разведению- токсина 1:512. Клеточные культуры были также использованы для выявления токсических, свойств коммерческих серий АКДС-вакцины и дифтерийного токсина [5]. Методика исследований была сходной с описанной выше однако срок наблюдения был удлинен до 1 недели. Авторы установили, что морфологические нарушения клеток под воздействием токсина и АКДС-вакцины были сходны. Субтоксическая доза вакцины была всего в 4 раза ниже, чем дифтерийного токсина. Высокая токсичность АКДС-вакцины и сходство видимых морфологических изменений с дифтерийным токсином может указывать на сложность дифференциации их с неспецифической дегенерацией при оценке токсичности по избранным Советовой Г.П. и др. [5] критериям: увеличение ядер, вакуолизация цитоплазмы, округление клеток. Авторы считают перспективным изыскание производственных методов контроля различных препаратов лечебного и профилактического значения. Известен способ титрования дифтерийного токсина по цитопатическому действию [6]. Камзолкина Н.Б. и др. использовали различные культуры клеток, в том числе HeLa. Посевная доза клеток была равна 150-200 тыс.клеток в 2 мл на 1 пробирку. 2-5-кратные разведения токсина в среде 199 с 10% бычьей сыворотки в объеме 2 мл наносили на клеточный монослой, клетки культивировали при 37°С в течение 3 сут с ежедневным просмотром и фиксацией в метиловом спирте с последующей окраской азур-эозином. ЦПД классифицировали: - повреждение и гибель 100% клеток,+++- >50%,++-~ 50%, ± < 50%. Действие токсина на культуры клеток HeLa, СОЦ и А наблюдали к концу первых суток, окончательный учет производили на 3 сутки. Пораженные клетки выглядели боле темными и округлыми. Минимальное количество токсина, вызывающее ЦПД на (±), колебалось от опыта к опыту в пределах 0,0003 - 0,07 мл. Недостатки известного способа: 1) вариабельность дозы токсина, вызывающей минимальное ЦПД в различных опытах; 2) продолжительный срок исследования - 7-9 дней (культивирование клеток в течение 4-6 дней до внесения токсина и 3 дня после); 3) трудность дифференциации минимального ЦПД, обусловленного длительным культивированием клеток, и действием токсина; 4) отсутствие четкого описания морфологических изменений поврежденных клеток. В основу изобретения поставлена задача сократить сроки исследования и повысить точность способа количественного определения токсичности дифтерийного токсина, который обеспечил бы раннее выявление характерных стр уктурных изменений клеток и постоянство в установлении минимального количества токсина, способного повреждать клетки. Поставленная задача достигается тем, что используют 1-суточную культуру клеток HeLa, контакт клеток с разведениями дифтерийного токсина осуществляют в течение 1 ч, клетки культивируют в питательной среде 24 ч и окрашивают гематоксилинэозином. Это позволяет выявлять четко дифференцируемые морфологические изменения поврежденных токсином клеток, заключающиеся в агрегации и маргинации хроматина, эозино-филии ядрышек, появлении грибовидных или удлиненных цитоплазматических отростков (фиг.1, стр.10, фиг.2, стр.11). Минимальное количество дифтерийного токсина, обуславливающее указанные изменения, является минимальной цитопатической дозой и соответствуе т 1 Д1т для морских свинок. Продолжительность предлагаемого способа составляет 2 дня. На фиг.1 показана 2-суточная культура клеток HeLa, контроль, где 1 - ядро, 2 - ядрышко, 3 цитоплазма. Окраска гематоксилин-эозином. Ув.40. На фиг.2 показаны цитоморфологиче-ские изменения клеток в культуре HeLa после воздействия дифтерийного токсина, где 1 - ядро, 2 - ядрышко, 3 - агрегация хроматина, 4 маргинация хроматина, 5 - грибовидные цитоплазматические отростки, 6 -удлиненные цитоплазматические отростки. Окраска гематоксилин-эозином. Ув.90. На фиг.3 показаны цитоморфологиче-ские изменения культуры клеток HeLa после воздействия 1 ДІт дифтерийного токсина, где 1 - крупный островок малоизмененных клеток, 2 поврежденные токсином клетки. Окраска гематоксилин-эозином. Ув.40. На фиг.4 показаны цитоморфологиче-ские изменения культуры клеток HeLa после воздействия 2 ДІт ди фтерийного токсина, где 1 - островок малоизмененных клеток, 2 - гнездное расположение поврежденных токсином клеток. Окраска гематоксилин-эозином. Ув.40. На фиг.5 показаны цитоморфологиче-ские изменения культуры клеток HeLa после воздействия 3 ДІт ди фтерийного токсина, где 1 - небольшие островки малоизмененных клеток, 2 гнездное расположение поврежденных токсином клеток. Окраска гематоксилинэозином. Ув.40. На фиг.6 показаны цитоморфологиче-ские изменения культуры клеток HeLa после воздействия 4 ДІт дифтерийного токсина, где 1 - малоизмененная клетка, 2 - поврежденные токсином клетки. Окраска гематоксилин-эозином. Ув.40. На фиг.7 показаны цитоморфологиче-ские изменения культуры клеток HeLa после воздействия 5 ДІm дифтерийного токсина, где 1 - поврежденные токсином клетки. Окраска гематоксилин-эозином. Ув.40. Способ осуществляют следующим способом Используют 1-суточн ую культуру клеток HeLa, выращенную на покровных стеклах в пенициллиновых флаконах при посевной дозе 1,5 - 2 х 10 клеток/мл. Разведения исследуемого дифтерийного токсина в 1 мл физиологического раствора вносят во флаконы с клетками после удаления ростовой среды. Для каждого разведения используют 4 флакона клеток. Контакт токсина с клетками осуществляют в течение 1 ч при комнатной температуре, затем токсин удаляют, клетки заливают питательной средой, культивируют при 37°С в течение 24 ч, фиксируют в растворе Буэна, окрашивают гематоксилин-эозином и устанавливают минимальную цитопатическую дозу для исследуемого токсина по наличию клеток с описанными выше морфологическими изменениями. Установлено, что при внесении токсина в количестве, соответствующем 0,5 ДІmдля морских свинок, на препарате обнаруживаются единичные пораженные клетки на фоне неизмененного монослоя. Увеличение дозы токсина до І ДІm приводит к разрежению монослоя и появлению отдельно лежащих поврежденных клеток по периферии крупных островков неповрежденных клеток (фиг.3, стр.12). Указанная картина морфологических изменений соответствует минимальной цитопатической дозе и не вызывает затруднений при ее определении, поскольку при дозе 2 ДІт появляются гнездо расположенные поврежденные клетки (фиг.4, стр.13), количество которых увеличивается с увеличением дозы токсина (фиг.5, стр.14). Пропорционально уменьшаются размеры островков неизмененных клеток. Резкое снижение числа последних и появление обширных областей поврежденных клеток или свободных от клеток наблюдается при дозе 4 ДІm (фиг.6, стр. 15) и 5 ДІm (фиг.7, стр. 16). Увеличение дозы токсина до 10 ДІm вызывает повреждение практически всех клеток. Минимальная цитопатическая доза для данного конкретного токсина, определяемая в различных опытах, величина малоизменяющаяся. При титровании производственных серий токсина, активность которых должна составлять примерно 10000 ДІm в 1 мл, готовят разведения токсина таким образом, чтобы в 1 мл физиологического раствора содержалось: Всего для определения токсичности исследуемого токсина используют 32 флакона клеток (28 - для испытания токсина и 4 контрольных), Если активность токсина ниже ожидаемой, производится дробное титрование в пределах 0,0005 - 0,001 мл. В случае исследования дифтерийного токсина с неизвестной активностью первоначально производят ориентировочное титрование, для чего используют следующие -разведения токсина: 1:10, 1:100, 1:1000, 1:10000. Для определения минимальной цитопатической дозы производят дробное титрование в интервалах, которые устанавливают на основании морфологического анализа ориентировочного титрования. Для подтверждения полученных in vitro данных о качестве дифтерийного токсина в случае необходимости используют морских свинок. Животным (по 4 в группе) вводят0,5,1, и 2 минимальных цитопатических доз. Гибель животных наблюдается при введении 1 и 2 указанных доз. Определение минимальной цитопати-ческой дозы дает возможность резко сократить число морских свинок (по крайней мере на 20), что позволяет получать существенный экономический эффект. Для сравнения - стоимость 1 морской свинки составляет 100000 крб. без расходов на содержание, а стоимость 1 флакона клеток - 600-800 крб. Предлагаемый нами способ может быть использован и для определения остаточной токсичности дифтерийного анатоксина. Нами исследовано цитопатическое действие на клетки HeLa 3 образцов дифтерийного анатоксина, содержащих в 1 мл соответственно 310, 330, 340 Lf. Установлено, что указанные препараты в дозе 30 Lf вызывают повреждения всех клеток, а дозы 5 Lf и ниже заметно не влияют на морфологию клеток. Различия между препаратами выявлены при добавлении к клеткам 15 Lf и 10 Lf. Первая доза вызывает повреждения всех клеток при использовании анатоксина с активностью 310 Lf и части клеток - анатоксина с активностью 330 Lf. 10 флокулирующи х единиц повре'ж дают часть клеток лишь при внесении анатоксина с активностью 310 Lf. Полученные данные свидетельствуют об отсутствии четкой корреляции между остаточной токсичностью и активностью препарата, выраженную во флокулирующи х единицах. Таким образом, предлагаемый способ титрования токсина имеет следующие преимущества перед прототипом: 1) сокращение времени контроля с 7-9 дней до 2 дней; 2) повышение точности определения токсичности за счет установления минимальной цитопатической дозы, соответствующей ІДІm для морских свинок; 3) постоянство результатов при повторных исследованиях. Использование предлагаемого способа позволяет получать существенный экономический эффект за счет резкого сокращения числа морских свинок при определении ДІm. Сведения, подтверждающие возможность осуществления изобретения. Пример 1. Культур у клеток HeLa рассеивают в пенициллиновые флаконы с покровными стеклами по 1,5 мл (150-200 тыс.клеток/мл). Через 24 ч роста питательную среду удаляют и вносят по 1 мл разведенного в физиологическом растворе дифтерийного токсина, полученного в производственных условиях. Готовят разведения с содержанием в 1 мл физиологического раствора следующи х количеств токсина: На каждое разведение используют 4 флакона клеток. Клетки с токсином оставляют на 1 ч при комнатной температуре, затем токсин удаляют, клетки заливают питательной средой и помещают в термостат (37°С) на 24 ч. После фиксации в растворе Буэна клетки окрашивают гематоксилинэозином и исследуют под световым микроскопом, начиная с минимальных доз. Определяют количество токсина, которое вызывает диффузное поражение отдельно лежащих клеток, например, 0,0001 мл. В этом случае при дозе 0,0002 мл и более обнаруживается гнездное поражение клеток, а при дозе 0,00005 мл выявляются единичные морфологически измененные клетки на препарате. При соблюдении точности в разведении и внесении токсина на всех 4 препаратах одной концентрации выявляются однотипные изменения. В данном случае минимальная цитопатическая доза составляет 0,0001 мл, что соответствует 1 ДІтm для морских свинок. Пример 2. Культур у клеток HeLa рассеивают в пенициллиновые флаконы с покровными стеклами по 1,5 мл (150-200 тыс. клеток/мл). Через 24 часа роста питательную среду удаляют и вносят по 1 мл разведенного в физиологическом растворе дифтерийного токсина, крепость которого неизвестна. Готовят разведения токсина 1:10, 1:100, 1:1000, 1:10000. На каждое разведение используют 4 флакона клеток. Клетки с токсином оставляют на 1 ч при комнатной температуре, затем токсин удаляют, клетки заливают питательной средой и помещают в термостат (37°С) на 24 ч, затем их фиксируют в растворе Буэна, окрашивают гематоксилинэозином и исследуют под световым микроскопом. Определяют наименьшее разведение токсина, которое вызывает поражение многочисленных клеток, например, 1:1000. Вновь готовят 1-суточ-ную к ультур у HeLa и разведения токсина с содержанием в 1 мл физиологического раствора следующи х количеств исследуемого препарата (если в разведении 1:10000 не выявляют поражений: Далее разведения токсина вносят во флаконы с клетками, контакт осуществляют при комнатной температуре в течение 1 часа, затем токсин удаляют, клетки заливают питательной средой и культивируют в термостате 24 ч, фиксируют в растворе Буэна, окрашивают гематоксилинэозином, исследуют в световом микроскопе и устанавливают количество токсина, вызывающее диффузное поражение отдельно лежащих клеток, например, 0,0006 мл. В этом случае дозы 0,0007 мл и выше вызывают гнездные поражения клеток, а доза 0,0005 мл не оказывает повреждающего действия. Минимальная цитопатическая доза в да н ном случае составляет 0,0006 мл и соответствует 1 ДІь.
ДивитисяДодаткова інформація
Автори англійськоюStopchanska Alla Hryhorivna
Автори російськоюСтопчанская Алла Григорьевна
МПК / Мітки
МПК: C12R 1/16, A61K 35/66, C12Q 1/04
Мітки: визначення, спосіб, токсину, токсичності, дифтерійного, кількісного
Код посилання
<a href="https://ua.patents.su/7-14595-sposib-kilkisnogo-viznachennya-toksichnosti-difterijjnogo-toksinu.html" target="_blank" rel="follow" title="База патентів України">Спосіб кількісного визначення токсичності дифтерійного токсину</a>
Попередній патент: Порошкова суміш для відпалу молібдену і вольфраму
Наступний патент: Спосіб одержання ліпосомальної композиції, що має антитоксичну гепатозахисну дію
Випадковий патент: Спосіб лікування ендогенної інтоксикації у хірургічних хворих із супутнім хронічним обструктивним захворюванням легень