Фармацевтична композиція з антипухлинною активністю
Номер патенту: 29466
Опубліковано: 15.11.2000
Автори: ФРІМЕН Азадех Елісон, ВОТСОН Аменда Джін, НЬЮЛЕНДС Едворд Стюарт, МЕРГІСОН Джофрі Пол, БЕР Джон Колін, РЕФФЕРТІ Джозеф Ентоні
Текст
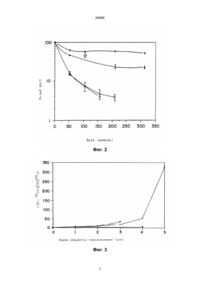
1. Фармацевтическая композиция с антиопухолевой активностью, содержащая 8-карбамоил-3-метилимидазо[5,1-d]-1,2,3,5-тетразин-4-(ЗН)-он и, по меньшей мере, один фармацевтически приемлемый носитель, отличающаяся тем, что она дополнительно содержит ингибитор О6-алкилгуанин-ДНК-алкилтрансферазы в соотношении от 1 : 1 до 1 : 20.000. 2. Фармацевтическая композиция по п. 1, отличающаяся тем, что ингибитор выбран из группы, включающей О6-алкилгуанины, О6-алкенилгуанины, О6-арилгуанины и О6-бензилированные гуанины, гуанозины и 2'-деоксигуанозины. 3. Фармацевтическая композиция по п. 2, отличающаяся тем, что ингибитор представляет собой О6-бензилгуанин. Ю (13) 29466 (11) UA путем использования ингибиторов АТазы, например, О6-бензилгуанина (далее: БГ), можно повысить токсичность темозоломида, например, в клеточной линии MAWI, до 300-кратной величины, если его используют в нижеуказанных дозах согласно настоящему изобретению, что позволяет использовать темозоломид для хемотерапии видов рака в человеке, которые до сих пор не были чувствительными в отношении такой терапии или лишь в незначительной степени. В ряде опухолевых клеточных линий человека токсичность темозоломида после воздействия в течение одного часа взаимосвязана с их содержанием АТазы. Таким образом, метилирование темозоломидом положения О6 гуанина в ДНК приводит к цитотоксичному повреждению. Чувствительность раковых клеток человека к темозоломиду можно определять путём исследования их относительного производства АТазы. При этом клетка, производящая большое количество АТазы, является менее чувствительной к темозоломиду, чем клетка, производящая минимальное количество АТазы. Путём предварительной обработки клеток одной дозой БГ можно достичь небольшого повышения (менее чем в 4 раза) токсичности темозоломида. В опытах на колониях выявилось, что человеческие фибробласты, трансфецированные к ДНК АТазы, после предварительной обработки с (19) Изобретение относится к области обработки раковых клеток человека с использованием производного тетразинона, в частности к фармацевтической композиции с антиопухолевой активностью. Известно применять темозоломид, представляющий собой 8-карбамоил-З-метилимидазо[5,1-d]-1,2,3,5-тетразин-4-(ЗН)-он, в качестве антиопухолевого активного вещества (см. Newlands и др., J. Cancer, 65, стр. 287, 1992 г.). Задача изобретения заключается в повышении антиопухолевой активности темозоломида. Указанная задача решается предлагаемой фармацевтической композицией с антиопухолевой активностью, содержащей темозоломид и дополнительно ингибитор О6-алкилгуанин-ДНК-алкилтрансферазы в отношении от 1 : 1 до 1 : 20 000, а также, по меньшей мере, один фармацевтически приемлемый носитель. Предлагаемую композицию получают путем смешивания темозоломида и указанного ингибитора в указанном соотношении по меньшей мере с одним фармацевтически приемлемым носителем. Согласно изобретению токсичность темозоломида можно значительно повысить путем его использования в сочетании с усилителем, представляющим собой ингибитор О6-алкилгуанин-ДНКалкилтрансферазы (далее: АТаза). В частности, C2 ______________________________ 29466 использованием БГ являются более устойчивыми к воздействию темозоломида, чем контрольные трансфецированные фибробласты, несмотря на удаление АТазы. Невероятно, что причина этого заключается в разном транспорте темозоломида. Данное явление может быть признаком ресинтеза АТазы рhАТ-фибробластами для снижения действия предварительной обработки ингибитором. Однако в клеточной линии MAWI неожиданно наблюдалась значительная потенциация токсичности темозоломида (примерно до 300-кратной величины) путём обработки с использованием БГ в течение пяти дней. Подобная степень повышения наблюдалась в клетках MCF-7, которые также содержат большое количество АТазы, но лишь небольшое действие показали клетки U373, содержащие небольшое количество АТазы. На основе исследований клеточных линий MAWI и MCF-7 можно полагать, что при длительном наличии ингибитора АТазы в растущей степени повреждается ДНК. Дачу ингибитора АТазы предпочтительно повторяют в течение нескольких или многих дней, и предпочтительно её осуществляют перед дачей темозоломида. Дозы можно дать в течение 1, 2, 3, 4 или 5 дней, причём предпочтительно терапию осуществляют в течение 4 или 5 дней. Кроме того, предпочтительно темозоломид дают пациенту повторно в течение нескольких дней, и перед дачей каждой дозы темозоломида дают ингибирующее АТазу количество ингибитора АТазы, чем достигается выраженное повышение токсичности темозоломида в отношении раковых клеток человека, например, примерно в 300 раз в случае клеточной линии MAWI. Согласно дальнейшему предпочительному варианту изобретения ингибитор АТазы дают в количестве, достаточном для сенсибилизации опухоли и живом организме, не вызывая нежелаемой сенсибилизации здоровой ткани, когда ингибитор АТазы используют вместе с темозоломидом. Количество ингибитора АТазы, даваемое в рамках настоящего изобретения, колеблется в зависимости от эффективного количества, требуемого для обработки опухолевых клеток. Пригодной дозой является доза, приводящая к концентрации ингибитора АТазы в обрабатываемых опухолевых клетках, вызывающей исчезновение активности АТазы, при этом доза может составлять, например, примерно 1 - 2000 мг на кг веса тела, предпочтительно примерно 10 - 800 мг на кг веса тела, если ингибитор дают перед хемотерапией. В качестве опухолей, для обработки которых темозоломид особенно пригоден, можно назвать карциномы, меланомы, саркомы, лимфомы и лейкозы, в частности, астроцитомы, глиомы, злокачественные меланомы, фунгоидную гранулёму, саркому Юингс, хронический лимфоцитный лейкоз, а также опухоли в лёгких и в груди. Особенно сильное повышение активности темозоломида путём использования ингибитора АТазы наблюдают в опухолевых клетках в груди, в клетках астроцитом, и в опухолях в толстой и прямой кишках. Обычно доза темозоломида составляет 0,1 200, предпочтительно 1 - 20 мг на кг веса тела в день, или, в отношении поверхности тела, пример но 40 - 400, предпочтительно примерно 150 - 300 мг на м2 в день. Степень потенциации ингибитором АТазы зависит от количества АТазы, обычно имеющегося в раковых клетках конкретного типа. Активность темозоломида в отношении раковых клеток, содержащих большее количество АТазы, потенцируется сильнее путём предварительной дачи ингибитора АТазы, чем в отношении клеток, содержащих меньшее количество АТазы. В рамках настоящего изобретения пригодны ингибиторы АТазы, которые обладают такой активностью, например, О6-алкилгуанины как, например, О6-метилгуанин, алкенилгуанины как, например, О6-аллилгуанин, О6-арилгуанины как, например, О6-бензилгуанин, и О6-бензилированные гуанин, гуанозин и 2'-дeoкcигyaнoзин. Для использования в рамках настоящего изобретения в частности пригоден О6-бензилгуанин. В конкретном случае доза ингибитора АТазы зависит от количества АТазы, обычно имеющегося в подлежащих обработке раковых клетках, возраста и состояния пациента и используемого ингибитора АТазы. Темозоломид особенно предпочительно дают в виде повторных доз в последовательных днях, причём эффекта сильной потенциации согласно изобретению достигают при предпочтительном режиме, согласно которому ингибирующую АТазу дозу ингибитора АТазы дают перед дачей каждой дозы темозоломида, или одновременно с ней. Предпочтительно в качестве ингибитора АТазы используют О6-бензилгуанин, который дают вместе с темозоломидом, причём последний дают в количестве 150 - 300 мг/м2 в день в четырёх или пяти дозах в течение четырёх или пяти дней (общая доза - 750 - 1500 мг/м2). Предпочтительно каждую дозу ингибитора АТазы дают 2-8 часов перед дачей очередной дозы темозоломида, чем достигают наиболее сильной потенциации токсичности темозоломида, что приводит к наиболее эффективной обработке опухоли пациента. Особенно предпочтительно такую обработку повторяют по истечении примерно четырёх недель. Альтернативный режим дачи темозоломида вместе с О6-бензилгуанином представляет собой непрерывный режим, причём оба активных вещества дают ежедневно в течение четырёх или больше дней. Такую комбинированную терапию можно продлить непрерывно по мере необходимости, до уменьшения опухоли. Кроме того, путём исследований производства АТазы в конкретной раковой клетке можно определять потенциацию токсичности темозоломида в данной клетке. Согласно предпочтительному варианту изобретения содержание АТазы в определённой клеточной линии определяют, например, путём метода, описанного Lee и др. (Cancer Res., 51, стр. 619, 1991 г.), и исследуют возможную чувствительность к темозоломиду. На основе такого исследования затем можно найти пригодное соотношение темозоломида и ингибитора АТазы, которое дают в рамках соответствующего режима. Предлагаемая фармацевтическая композиция может иметься в виде обычного жидкого или 2 29466 твёрдого препарата, который содержит по меньшей мере один инертный фармацевтически приемлемый носитель. В качестве твёрдых препаратов можно назвать, например, порошки, таблетки, поддающиеся диспергированию грануляты, капсулы, в том числе крахмальные капсулы, и суппозитории. Порошки и таблетки могут содержать примерно 5 - 70 % активного вещества. Пригодные твёрдые носители известны. В качестве таких носителей можно назвать, например, карбонат и стеарат магния, тальк, сахар и лактозу. Таблетки, порошки, крахмальные и прочие капсулы могут содержать по одной дозе активного вещества, и они пригодны для оральной дачи. Для получения суппозиториев сперва расплавляют воск с низкой точкой плавления, например, смесь глицеридов жирных кислот или какаовое масло, а затем в нём гомогенно диспергируют активное вещество путём размешивания. Расплавленную гомогенную смесь разливают в формы обычного размера, дают охлаждаться, причём препарат застывает. В качестве жидких препаратов можно назвать, например, растворы, суспензии и эмульсии как, например, растворы в воде или смеси воды и пропиленгликоля, пригодные для парентеральной инъекции. Также пригодны твёрдые препараты, предназначенные для перевода в жидкий препарат непосредственно перед дачей, в частности, оральной или парентеральной дачей. Твёрдые препараты можно переводить в растворы, суспензии или эмульсии. Предлагаемые соединения можно также дать трансдермально, причём в качестве препаратов, пригодных для трансдермальной дачи, можно назвать кремы, лосьоны, аэрозоли и эмульсии, которые также можно использовать в известных стандартных трансдермальных пластырях или трансдермальных пластырях продлённого действия. Предпочтительно фармацевтическая композиция имеется в виде дозировочных единиц. Каждая дозировочная единица включает отдельные дозы препарата, содержащие пригодное количество активного вещества, например, эффективное количество, обеспечивающее достижение желаемого эффекта. Количество активного вещества в отдельной дозе может составлять примерно 0,1 - 1000 мг, предпочтительно примерно 1 - 500 мг в зависимости от конкретного случая применения. Конкретную применяемую дозу можно варьировать в зависимости от пациента и серьёзности его состояния. Специалист в состоянии определять пригодную дозу в конкретном случае. При желании общую суточную дозу можно дать в виде нескольких отдельных доз. Темозоломид можно дать путём известных методов, описанных, например, Wassermann и др. (Cancer, 36, стр. 1258-1268, 1975г.). В случаях, где подходит оральная дача, предпочитают оральную дачу в количестве 40 - 400 мг/м2 в сутки, в частности 150 - 300 мг/м2, в 1 - 5 дозах, в частности, 45 дозах, предпочтительно в течение 4-5 последовательных дней. Для непрерывной терапии пригодна внутривенная дача 25 - 250 мг/м2 в сутки. Оральная дача пригодна в рамках схемы повторной дачи. Как уже указывалось, ингибитор АТазы можно дать или отдельно перед темозоломидом, или же одновременно с ним. В тех случаях, где желательна одновременная дача, ингибитор АТазы и темозоломид могут применяться в объединённом виде для облегчения дачи. При этом пригодны вышеприведённые препараты, причём предпочитают препараты, предназначенные для оральной или внутривенной дачи. Темозоломид и ингибитор АТазы можно включать в один набор, в котором темозоломид и ингибитор АТазы имеются в виде отдельных препаратов для дачи определённым путём, при этом приложены указания по применению содержащихся в наборе препаратов. Например, набор с препаратами, предназначенными для оральной дачи, содержит пригодный для оральной дачи препарат темозоломида, и, отдельно, пригодный для оральной дачи препарат ингибитора АТазы. Врач будет в состоянии варьировать размер дозы в рамках хемотерапии на конкретном пациенте. В нижеследующих примерах приведены несколько из возможных препаратов предлагаемой фармацевтической композиции, которые можно дать или отдельно, или одновременно. Пример 1 Предназначенный для оральной дачи препарат мг на капсулу Темозоломид 100 Лактоза 213 Микрокристаллическая целлюлоза 30 Лаурилсульфат натрия 20 Кукурузный крахмал 25 Стеарат магния 2 Размешивают темозоломид, лактозу, микрокристаллическую целлюлозу, лаурилсульфат натрия и кукурузный крахмал, полученную смесь пропускают через сито No 80, добавляют стеарат магния, повторно размешивают и подают в составные желатиновые капсулы пригодного размера. Пример 2 Предназначенный для оральной дачи препарат мг на капсулу О6-бензилгуанин 100 Лактоза 213 Микрокристаллическая целлюлоза 30 Лаурилсульфат натрия 20 Кукурузный крахмал 25 Стеарат магния 2 Размешивают О6-бензилгуанин, лактозу, микрокристаллическую целлюлозу, лауриловый сульфат натрия и кукурузный крахмал, полученную смесь пропускают через сито No 80, добавляют стеарат магния, повторно размешивают и подают в составные желатиновые капсулы пригодного размера. Пример 3 Предназначенный для оральной дачи препарат 3 29466 мг на капсулу Темозоломид 100 О6-бензилгуанин 100 Лактоза 213 Микрокристаллическая целлюлоза 30 Лаурилсульфат натрия 20 Кукурузный крахмал 25 Стеарат магния 2 Размешивают темозоломид, О6-бензилгуанин, лактозу, микрокристаллическую целлюлозу, лаурилсульфат натрия и кукурузный крахмал, полученную смесь пропускают через сито No 80, добавляют стеарат магния, повторно размешивают и подают в составные желатиновые капсулы пригодного размера. Пример 4 Предназначенный для внутривенной дачи препарат мг на мл Темозоломид 100 Бисульфит натрия 3,2 Динатриевая соль этилендиаминотетрауксусной кислоты 0,1 Вода для инъекции до 1 мл Пример 5 Предназначенный для внутривенной дачи препарат мг на мл Темозоломид 100 О6-бензилгуанин 100 Бисульфит натрия 3,2 Динатриевая соль этилендиаминотетрауксусной кислоты 0,1 Вода для инъекции до 1 мл Положительный эффект иллюстрируется нижеследующим примером. Пример 6 Материал и метод Используют культурную среду, продаваемую фирмой ICN Biochemicals Ltd. (г. High Wycombe, Объединённое Королевство), и фетальную телячью сыворотку фирмы Gibco Ltd. (г. Paisley, Объединённое Королевство). О6-бензилгуанин (БГ) поставил др. R. С. Moschel (NCIFrederick Cancer Research & Development Center, г. Frederick, Мэрилэнд, США). Темозоломид производили May and Baker Ltd. (г. Dagenham, Объединённое Королевство), и его хранили в качестве раствора в диметилсульфоксиде при температуре -70оС. Все остальные химические вещества произведены фирмой Sigma Chemical Co. Ltd. (г. Poole, Объединённое Королевство). Исследования по цитотоксичности Клеточные линии выращивали обычным методом в качестве монослоёв в буферной среде ДМЕМ,содержащей 10 % фетальной телячьей сыворотки, 25 ммоль HEPES, глутамин и пенициллин/стрептомицин. Цитотоксичность исследовали в свободной от HEPES среде в атмосфере 5 % двуокиси углерода. В 96 плитки, снабжённые углублениями, подали по 750 - 1000 клеток на углубление, инкубировали в течение ночи, в течение двух часов обрабатывали с 33 мкмоль БГ или без него. Затем в течение часа в той же среде добави ли темозоломид, причём конечная концентрация диметилсульфоксида не превышала 1 %. Клетки выращивали в течение 7 дальнейших дней в свежей среде, после чего содержание протеина определяли с помощью анализа согласно Skehan и др. (J. Natl. Cancer Inst., 82, стр. 1107, 1990 г.). Исследования роста выявили, что во время опыта клетки находились в фазе логарифмического роста. В рамках схемы повторной дачи темозоломида клетки обрабатывали последовательно в течение 24 часов в день, каждый день используя свежую среду. Опыты осуществляли по меньшей мере по два раза. В минимальной поддерживающей среде выращивали трансфецированные кДНК АТазы клетки человека соответственно контрольные клетки ХР (клетки xeroderma pigmentosa) [см. Fan и др., Nucleic Acid Res., 18, стр. 5723, 1990 г.], и в углубления плиток подали по 1000 клеткам. Инкубировали в течение трёх часов, затем добавляли темозоломид, свежерастворённый в минимальной поддерживающей среде, и плитки инкубировали в течение пяти дней. Клетки, которые переживали, исследовали путём опыта по Morten и др. (Carcinogenesis, 13, стр. 483, 1992 г.). В опытах с использованием БГ трижды подали по 300 клеток в углубления плиток, и оставили связываться в течение пяти часов. Затем три часа перед обработкой темозоломидом, свежеразбавленным в минимальной поддерживающей среде, содержащей 10 мкмоль БТ, добавили БГ (10 мкмоль в минимальной поддерживающей среде). По истечении семи дней колонии анализировали известными приёмами и подвергали считыванию. Опыт с использованием О6 -алкилгуанинДНК-трансферазы Данный опыт осуществляли согласно методу, описанному Lee и др. (Cancer Res., 51, стр. 619,1991 г.). При этом разные количества клеточных экстрактов при температуре 37°С в течение 2 часов инкубировали вместе с ДНК, содержащей О6 - метилгуанин, маркированный [3Н] в метильной группе, в 300 мкл буфера 1, содержащего 1 мг на мл бычьего сывороточного альбумина. После инкубации последовательно быстро добавляли бычий сывороточный альбумин (100 мкл раствора 10 мг на мл буфера 1) и надхлорную кислоту (100 мкл 4м. раствора). Добавляют ещё 2 мл 1м. надхлорной кислоты, и полученную смесь нагревают при температуре 75°С в течение 40 минут для превращения ДНК в растворимый в кислоте материал. Протеин, содержащий метилированную АТазу, затем собирают путём центрифугирования и промывают 4 мл 1м. надхлорной кислоты, после чего повторно суспендируют в 300 мкл 0,01м. гидроокиси натрия, растворяют в 3 мл водной сцинтиляционной среды (марки Ecosint Aфирмы National Diagnostics) и подвергают считыванию. Содержание протеина в клетках определяли с помощью набора BioRad с использованием в качестве стандарта бычьего сывороточного альбумина. Активность АТазы выражали в фмоль переведённого в протеин метила на мг общего содержания протеина в экстракте. Поглощение клетками маркированного [14С] темозоломида 8-карбамоил-3-[14С]метилимидазо [5,1-d]-1,2,3,5-тетразин-4-(3Н)-он (специфическая 4 29466 активность 26,3 мкюри/ммоль) было поставлено др. John Slack (Aston Molecules Ltd., г. Birmingham, Объединённое Королевство). Клеточные суспензии, содержащие клетки в концентрации 5 х 106 на мл, уравновешивали при температуре 4°С и обрабатывали с использованием 200 мкмоль маркированного лекарства. 106 клеток пипеткой подали в пробирки Эппендорфа и центрифугировали вместе с 250 мкл смеси силиконовых масел в соотношении 4 : 1 (торговый продукт "Three- in-One" фирмы Dow Corning). Водный слой аэрировали, и масляный слой осто рожно промывали с использованием 300 мкл соляного раствора. После центрифугирования аэрировали оба слоя, содержащий клетки остаток растворяли в пригодном солюбилизаторе, например, торговом продукте Protosol, представляющем собой гидроокись четвертичного аммония в толуоле, и подают в сцинтилляционные пробирки, содержащие Optiphase, представляющий собой 95 - 99 %-ный диизопропилнафталин. Результаты опытов по определению цитотоксичности Результаты приведены ниже в таблице 1. Таблица 1 Цитотоксичность отдельной дозы Темозоломид Клеточная линия Грудь ZR-75-1 MCF-7 Астроцитома U87MG U373 Толстая кишка/ прямая кишка LS174T LOVO MAWI ХР линии pZip phAT KT50 [-БГ] мкмоль АТаза КТ50 [+БГ] мкмоль Соотношение (фмоль на мг протеина) 32 325 23 171 1,4 1,9
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical composition with antitumour activity
Автори англійськоюBaer John Colin, Freeman Azadeh Alison, Newlands Edward Stuart, Watson Amanda Jean, Rafferty Joseph Anthony, Margison Geoffrey Paul
Назва патенту російськоюФармацевтическая композиция с антиопухолевой активностью
Автори російськоюБер Джон Колин, Фримен Азадех Элисон, Ньюлендс Эдворд Стюарт, Вотсон Аменда Джин, Рефферти Джозеф Энтони, Мергисон Джофри Пол
МПК / Мітки
МПК: A61K 31/53, A61K 31/41, A61K 31/52
Мітки: антипухлинною, активністю, композиція, фармацевтична
Код посилання
<a href="https://ua.patents.su/8-29466-farmacevtichna-kompoziciya-z-antipukhlinnoyu-aktivnistyu.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція з антипухлинною активністю</a>
Попередній патент: Спосіб обробітку вугільних або лігнітових шахтних полів
Наступний патент: Відстійник
Випадковий патент: Пристрій для ловлі риби