Спосіб діастереоселективного синтезу аналогів нуклеозиду та саліцилати, одержані за цим способом
Номер патенту: 43362
Опубліковано: 17.12.2001
Автори: Горнбі Рой, Вайтгед Ендрю Джонатан, Двайер П. Оуен, Гілл Малком Лейтгед, Гуд'єр Майкл Дейвід, Галлет Пітер
Формула / Реферат
1. Способ диастереоселективного синтеза соединений формулы (I)
(I)
где
W - S, S=O, SO2 или О;
Χ - S, S=O, SO2 или О;
r1 - водород или ацил и
R2 - желаемое пуриновое или пиримидиновое основание, или их аналог, или их производное, который включает реакцию пуринового или пиримидинового основания, или их аналога, или их производного с промежуточным реагентом формулы (IVa) или (IVb)
(IVa) (IVa)
где
R3 - замещенный карбонил или производное карбонила,
G - галогено-, циан- или R9SO2-гpyппy, где R9 - алкил, замещенный по выбору одним или более галогеном, или произвольно замещенным фенилом, отличающийся тем, что реакцию с пуриновым или пиримидиновым основанием, или их аналогом проводят без использования кислоты Льюиса в качестве катализатора.
2. Способ по п.1, отличающийся тем, что в нем R3 дополнительно восстанавливают до группы R1OCH2.
3. Способ по п.2, отличающийся тем, что восстановление проводят боргидридом натрия в присутствии боратного или фосфатного буфера.
4. Способ по любому из пп. 1-3, отличающийся тем, что r2 - пиримидиновое основание.
5. Способпо п.4, отличающийся тем, что r2 - цитозин или 5-фторцитозин.
6. Способ по любому из пп. 1-5, отличающийся тем, что R3 представляет собой группу -C(=O)OR4 где R4 - произвольно замещенный алкил.
7. Способ по п. 6, отличающийся тем, что R4 представляет собой хиральное дополнение.
8. Способ по п.7, отличающийся тем, что R4 выбирают из (d)-ментила, (l)-ментила, (d)-8-фенилментила, (l)-8-фенилментила, (+)-норэфедрина и (-)-норэфедрина.
9. Способ по любому из пп. 1-8, отличающийся тем, что W представляет собой О, а Х - S.
10. Способ по любому из пп. 1-9, отличающийся тем, что G представляет собой Сl, Вг или I.
11. Способ по любому из пп. 1-10, отличающийся тем, что соединение формулы (I) выделяют в виде водонерастворимой соли.
12. Способ по любому из пп. 1-11, отличающийся тем, что соединение формулы (I) представляет собой 4-амино-1-(2R-гидроксиметил-[1,3]оксатиолан-5S-ил)-1Н-пиримидин-2-он или его салицилат.
13. Способ по любому из пп. 1-12, отличающийся тем, что промежуточные реагенты формул (IVа) и (IVb) получают из соответствующих транс-спиртов формул (Va) и (Vb).
(Va) (Vb)
где R3, W и X определены как в п. 1 или получены из эпимерных цис-спиртов реакцией с пригодньм для введения группы G реагентом.
14. Способ по п. 13, отличающийся тем, что промежуточные реагенты формул (IVa) и (IVb) получают in situ.
15. Способ повышения выхода транс-изомеров (Va) и (Vb) из смеси транс- и цис-изомеров, включающий обработку указанной смеси, по меньшей мере частично в растворе, реагентом, способньм вызвать взаимное преобразование изомеров без полного подавления кристаллизации транс-изоиеров.
16. Способ повышения выхода единственного энантиомера формулы (Va) или (Vb) из смеси изомеров, включающий обработку смеси изомеров, по крайней мере частично в растворе, реагентом, способным вызвать взаимное преобразование изомеров без полного подавления кристаллизации единственного энантиомера формулы (Va) или (Vb).
17. Способ по п. 16, отличающийся тем, что проводят селективную кристаллизацию соединений формулы (Va), в которой R3 - группа -C(=O)OR4, где R4 - (l)-ментил из смеси стереоизомеров, содержащей спирты (Va), (Vb) и эпимерные цис-спирты.
18. Способ по п. 16, отличающийся тем, что проводят селективную кристаллизацию соединений формулы (Vb), в которой R3 - группа -C(=O)OR4, где R4 -(d)-ментил из смеси стереоизомеров, содержащей спирты (Va), (Vb) и эпимерные цис-спирты.
19. Способ по п. 17, отличающийся тем, что проводят селективную кристаллизацию 2S-изопропил-5R-метил-1R-циклогексилового эфира (2R,5R)-5-гидрокси-[1,3]оксатиолан-2-карбоновой кислоты.
20. Способ по п. 19, отличающийся тем, что в качестве реагента, способного вызвать взаимное преобразование изомеров без полного подавления кристаллизации единственного энантиомера, используют триэтиламин.
21. Салицилат соединения формулы (I) или его гидрат.
22. Соединение по п.21, отличающееся тем, что представляет собой салицилат 4-амино-1-(2R-гидроксиметил-[1,3]оксатиолан-5S-ил)-1Н-пиримидин-2-он и его гидраты.
Текст
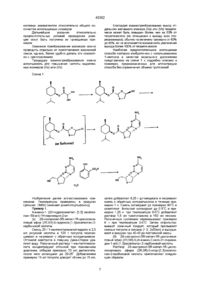
1 Способ диастереоселеісгивного синтеза соединений формулы (І) '(О где W - S, S=O, SO2 или О, X - S , S=O, SO2 или О, Ri - водород или ацил и R2 - желаемое пуриновое или пиримидиновое основание, или их аналог, или их производное, который включает реакцию пуринового или пиримидинового основания, или их аналога, или их производного с промежуточным реагентом формулы (IVa) или (IVb) (IVa) Y / ' (IVb) где F 3 - замещенный карбонил или производное ? карбонила, G - галогено-, циан- или R9SO2-rpynny, где R9 алкил, замещенный по выбору одним или более галогеном, или произвольно замещенным фени ю лом, отличающийся тем, что реакцию с пуриновым или пиримидиновым основанием, или их аналогом проводят без использования кислоты Льюиса в качестве катализатора 2 Способ по п 1, отличающийся тем, что в нем R3 дополнительно восстанавливают до группы RiOCH2 3 Способ по п 2, отличающийся тем, что восстановление проводят боргидридом натрия в присутствии боратного или фосфатного буфера 4 Способ по любому из пп 1-3, отличающийся тем, что R2 - пиримидиновое основание 5 Способ по п 4, отличающийся тем, что R2 цитозин или 5-фторцитозин 6 Способ по любому из пп 1-5, отличающийся тем, что R3 представляет собой группу -C(=O)OR4, где R4 - произвольно замещенный алкил 7 Способ по п 6, отличающийся тем, что R4 представляет собой хиральное дополнение 8 Способ по п 7, отличающийся тем, что R4 выбирают из (dj-ментила, (1)-ментила, (dJ-8-фенилментила, (1)-8-фенилментила, (+)-норэфедрина и (-)-норэфедрина 9 Способ по любому из пп 1-8, отличающийся тем, что W представляет собой О, а X - S 10 Способ по любому из пп 1-9, отличающийся тем, что G представляет собой CI, Вг или I 11 Способ по любому из пп 1-10, отличающийся тем, что соединение формулы (I) выделяют в виде водонерастворимой соли 12 Способ по любому из пп 1-11, отличающийся тем, что соединение формулы (I) представляет собой 4-амино-1-^-гидроксиметил-[1,3]оксатиолан53-ил)-1Н-пиримидин-2-он или егосалицилат 13 Способ по любому из пп 1-12, отличающийся тем, что промежуточные реагенты формул (IVa) и (IVb) получают из соответствующих транс-спиртов формул (Va) и (Vb) X '(Va) '(Vb) о (О го го 43362 где F?3, W и X определены как в п 1 или получены из эпимерных цис-спиртов реакцией с пригодным для введения группы G реагентом 14 Способ по п 13, отличающийся тем, что промежуточные реагенты формул (IVa) и (IVb) получают in situ 15 Способ повышения выхода транс-изомеров (Va) и (Vb) из смеси транс- и цис-изомеров, включающий обработку указанной смеси, по меньшей мере частично в растворе, реагентом, способным вызвать взаимное преобразование изомеров без полного подавления кристаллизации трансизоиеров 16 Способ повышения выхода единственного энантиомера формулы (Va) или (Vb) из смеси изомеров, включающий обработку смеси изомеров, по крайней мере частично в растворе, реагентом, способным вызвать взаимное преобразование изомеров без полного подавления кристаллизации единственного энантиомера формулы (Va) или (Vb) 17 Способ по п 16, отличающийся тем, что проводят селективную кристаллизацию соединений формулы (Va), в которой R3 - группа -C(=O)OR4, где R4 - (1)-ментил из смеси стереоизомеров, содержащей спирты (Va), (Vb) и эпимерные цисспирты 18 Способ по п 16, отличающийся тем, что проводят селективную кристаллизацию соединений формулы (Vb), в которой R3 - группа -C(=O)OR4, где R4 -(dj-ментил из смеси стереоизомеров, содержащей спирты (Va), (Vb) и эпимерные цисспирты 19 Способ по п 17, отличающийся тем, что проводят селективную кристаллизацию 2S-H3onponnn-5Rметил-1 R-циклогексилового эфира (2R, 5R)-5гидрокси-[1,3]оксатиолан-2-карбоновой кислоты 20 Способ по п 19, отличающийся тем, что в качестве реагента, способного вызвать взаимное преобразование изомеров без полного подавления кристаллизации единственного энантиомера, используют триэтиламин 21 Салицилат соединения формулы (I) или его гидрат 22 Соединение по п 21, отличающееся тем, что представляет собой салицилат 4-aMHHO-1-(2R-rnflроксиметил-[1,3]оксатиолан-53-ил)-1 Н-пиримидин2-он и его гидраты Изобретение относится к диастереоселективному процессу получения оптически активных аналогов цис-нуклеозидов и их производных Нуклеозиды и их аналоги и производные принадлежат к важному классу терапевтических средств Например, многие аналоги нуклеозидов проявили антивирусное действие против таких ретро-вирусов, как вирус иммунодефицита человека (ВИЧ), вирус гепатита В (ВГБ) и человеческий Т-лимфотропный вирус (ЧТЛВ) (РСТ-публикация WO 89/05662 и Европатент 0349242 А2) В частности, 4-AMHHO-1-(2R-rnflpoKCHMeTHn[1,3]оксатиолан-53-ил)-1 Н-пиримидин-2-он согласно формуле Большинство нуклеозидов, их аналогов и производных содержат по меньшей мере два хиральных центра (показанных в виде * в формуле (А)) и существуют в форме двух пар оптических изомеров (те два в цис- конфигурации и два в транс-конфигурации) Обычно, однако, только цис-изомеры проявляют полезную биологическую активность Следовательно, общий стереоселективный синтез аналогов цис-нуклеозидов представляет собой важную задачу пуриновое или пиримидиновое основание носн 2 N1 (А) носн (известный также как ЗТС или ламивудин) - и его фармацевтически приемлемые производные, предложенные в Международной заявке PCT/GB91/00706, публикация W091/17159, был описан как обладающий антивирусным действием, в частности, против таких ретровирусов, как вызывающий СПИД ВИЧ (W091/17159) и ВГБ (Европатент, публикация 0474119) Однако разную антивирусную активность могут иметь и различные энантиомерные формы какого-либо аналога цис-нуклеозида М М Mansun et al, "Preparation of The Geometric Isomers of DDC, DDA, D4C and D4T as Potential Anti-HIV Agents", Bioorg Med Chem Lett, 1(1), pp 65-68(1991) Следовательно, общий и экономически приемлемый синтез энантиомеров биологически активных аналогов цис-нуклеозидов является важной задачей В публикации Международной заявки W092/20669 описан диастереоселективный способ получения оптически активных аналогов и производных цис-нуклеозидов формулы (I) W R, (I) 43362 где W - S, S=0, S0 2 или О, X - S , 3=0, SO2 или О, Ri - водород или ацил и R2 - желаемое пуриновое или пиримидиновое основание, или их аналог, или производная Способ включает реакцию пуринового или пиримидинового основания или их аналога с промежуточным продуктом формулы (На) или (lib) W X т L la) /^ЧААЛА/ / тической чистотой, если исходные материалы оптически чистые (На) или (lib) Однако способ согласно W092/20669 предусматривает использование кислоты Льюиса формулы (III) Применение таких кислот имеет ряд недостатков В частности, они представляют собой нестабильные (и потому опасные) соединения с высокой реакционной способностью Кроме того, они дороги и довольно токсичны Эти недостатки особенно ощутимы при промышленном производстве аналогов нуклеозидов Мы установили, что при разумном выборе отщепляемой группы L в промежуточных соединениях (На) и (lib) реакция с пуриновым или пиримидиновым основанием или их аналогом может быть успешно проведена без добавления кислоты Льюиса в качестве катализатора и, в частности, без добавления кислоты Льюиса формулы (III) Соответственно, согласно изобретению предложен способ стереоселективного синтеза аналогов и производных цис-нуклеозида формулы (I) (lib) где R3 - замещенный карбонил или производная карбонила, а L - отщепляемая группа, с использованием кислоты Льюиса формулы (III) W. R X OCH 2 где W - S, S=O, SO2 или О, X - S , S=O, SO2 или О, Rr водород или ацил и R2 - желаемое пуриновое или пиримидиновое основание, или их аналог или производное, который основан на гликозилировании пуринового или пиримидинового основания или их аналога или производного промежуточным реагентом формулы (IVa) или (IVb) Si (III) где R5, R6 и R7 независимо друг от друга выбраны из группы, состоящей из водорода, Сі 20-алкила, замещенного по выбору фтором, бромом, хлором, иодом, Сі 6-алкоксилом или Сє 2о-арилоксилом, С? 2 аралкила, замещенного по выбору га0 логеном, Сі 20-алкилом или Сі 20-алкоксилом, Сє 2 0 арила, замещенного по выбору фтором, бромом, хлором, иодом, Сі 20-алкилом или Сі 20-алкоксилом, триалкилсилила, фтора, брома, хлора и иода, а Rs выбран из группы, состоящей из фтора, брома, хлора, иода, Сі 20-сульфонатов, замещенных по выбору фтором, бромом, хлором или иодом, Сі 20-алкилэфиров, замещенных по выбору фтор-, бром-, хлор- или иодполивалентными галогенидами, тризамещенных сил ильных групп общей формулы (R5) (Re) (RT)SI, где R5, R6 и R7 определены выше, насыщенного или ненасыщенного Сє 20селеноарила, замещенного или незамещенного Сб 2о-арилсульфенила, замещенного или незамещенного Сб 2о-алкоксиалкила и триалкилсилоксила Способ согласно W092/20669 позволяет вести управляемый стереосинтез рацемического аналога цис-нуклеозида из эквимолярной смеси реагентов (На) и (lib) и из данного энантиомера желаемого аналога цис-нуклеозида с высокой оп R-JMM X -< X (IVa) » 4 (IVb) где R3 - замещенный карбонил или производная карбонила, G - галогено-, циан- или R9S02-rpynna, в которой R9 - алкил, замещенный по выбору одним или более галогеном или произвольно замещенным фенилом (при этом реакцию гликозилирования проводят без добавления кислоты Льюиса в качестве катализатора) В предпочтительном воплощении изобретение включает стереоселективный способ получения аналогов и производных цис-нуклеозидов формулы (I), описанный выше, содержащий стадию гликозилирования пуринового или пиримидинового основания или их аналога или производной промежуточным реагентом формул (IVa) или (IVb), как это определена выше, от 43362 личающиися тем, что реакцию гликозилирования проводят без добавления кислоты Льюиса формулы (III) Si (III) где R5, R6 и R7 независимо друг от друга выбраны из группы, состоящей из водорода, Сі 20-алкила, замещенного по выбору фтором, бромом, хлором, иодом, Сі 6-алкоксилом или Сє 2о-арилоксилом, Сі 2оаралкила, замещенного по выбору галогеном, Сі 20-алкилом или Сі 2о-алкоксилом, Сє 2 арила, 0 замещенного по выбору фтором, бромом, хлором, иодом, Сі 2о-алкилом или Сі 2о-алкоксилом, триалкилсилила, фтора, брома, хлора и иода, а Rs выбран из группы, состоящей из фтора, брома, хлора, иода, С1 2о-сульфонатов, замещенных по выбору фтором, бромом, хлором или иодом, Сі 20-алкилэфиров, замещенных по выбору фтор-, бром-, хлор- или иод-поливалентными галогенидами, тризамещенных си-лильных групп общей формулы (R5) (Re) (RT)SI, где R5, R6 и R7 определены выше, насыщенного или ненасыщенного Сб 2о-селеноарила, замещенного или незамещенного Сб 2о-арилсульфенила, замещенного или незамещенного Сб 2о-алкоксиалкила и триалкилсилоксила Специалистам ясно, что при гликозилировании с использованием эквимолярной смеси промежуточных реагентов (IVa) или (IVb) будет получена рацемическая смесь аналогов цис-нуклеозидов Однако предпочтительно гликозилировать, используя оптически чистый реагент формулы (IVa) или (IVb) с получением желаемого аналога цис-нуклеозида высокой оптической чистоты Термин нуклеозид обозначает любое соединение, состоящее из связанного с пентозой пуринового или пиримидинового основания Термин аналог или производное нуклеозида обозначает соединение, содержащее 1,3-оксатиолан, 1,3-диоксолан или 1,3-дитиолан, связанные с пуриновым или пиримидиновым основанием или их аналогом, которые могут быть модифицированы любым из нижеследующих приемов или их сочетанием модификацией основания, например, введением заместителя (в частности, 5-фторцитозина) или замещением какой-либо группы изостерической группой (например, 7-деазааденина), модификацией сахара такой, как замещение гидроксильных групп любым заместителем или изменение места присоединения сахара к основанию (так пиримидиновые основания, обычно присоединяемые к сахару в позиции N-1, могут быть присоединены в позиции N-3 или С-6, а пурины, обычно присоединяемые к N-9 могут быть, например, присоединены к N-7) "Пуриновое или пиримидиновое основание" означает пуриновое или пиримидиновое основание, находящееся в нуклеозидах естественного происхождения Его аналог представляет собой основание, подобное таким естественным нуклеозидам по структуре (видам атомов и их расположению), но либо имеющее дополнительные функциональные свойства, либо не обладающее некоторыми из свойств нуклеозидов естественного происхождения К таким аналогам принадлежат полученные замещением группы СН атомом азота (например, 5-азапиримидины такие, как 5-азацитозин), или наоборот (например, 7-деазапурины такие, как 7-деазааденин или 7-деазагуанин, или оба (например, 7-деаза-8-азапурины) Под производными таких оснований или аналогов понимают основания, у которых цикл характеризуется либо присоединенными, либо отщепленными заместителями, либо модифицирован известными заместителями, например галогеном, гидроксилом, амином, Сі 6-алкилом Такие пуриновые или пиримидиновые основания, аналоги и производные хорошо известны специалистам в этой области Термином галоген здесь обозначены бром, хлор, фтор или иод Термин алкил означает (если он не определен иным образом) линейные, разветвленные или циклические насыщенные углеводородные радикалы или их сочетания Термин произвольно замещенный фенил означает незамещенный фенил, или фенил, замещенный одной или более Сі 6-алкил-, нитро-, амино-, галогено- или циано- группами R2 - предпочтительно пиримидиновое основание Более предпочтительно, когда R2 - цитозин или 5-фгорцитозин R3 - карбонил, связанный с водородом, гидроксилом, триал-килсилилом, триалкилсилоксилом, Сі зо-алкилом, С7 зо-аралкилом, Сі зо-алкоксилом, вторичным или третичным Сі зо-алкиламином, Сі зо-тиоалкилом, Сб 2о-арилом, C-z 20-алкенилом, Сг 2о-алкинилом, или R3- 1,2-дикарбонил, такой как О О СНз-С-Спроизвольно замещенный Сі є-алкилом или CQ 20арилом, или R3- ангидрид, такой, как О О СНз-С-О-Спроизвольно замещенный Сі є-алкилом или CQ 20арилом, или R3 - азометин, в котором азот связан с водородом, Сі ю-алкоксилом или Сі 20-Диалкиламином, а углерод - с водородом, Сі 20-алкилом или Сі 20-алоксилом, или R3-тиокарбонил (C=S), замещенный гидроксилом, С1-20-алкоксилом или Сі 20-тиолом Предпочтительно, чтобы радикал R3 был представлен группой -C(=O)OR4, где R4 - произвольно замещенный алкил Предпочтительно, чтобы R4 было хиральным дополнением Термин хиральное дополнение означает асимметричную молекулу, используемую для химического разделения рацемической смеси Такие 43362 хиральные дополнения могут иметь один хиральный центр, такой, как а-метилбензиламин, или несколько хиральных центров, таких, как ментол После того, как хиральное дополнение встроено в исходный материал, его функцией является простое разделение полученной смеси диастереомеров (см , например, J Jacques et al , Enantiomers, Racemates and Resolution, pp 251 369, John Wiley & Sons, New York (1981)) R4 предпочтительно выбран из (dj-ментила, (1)-ментила, (ф-8-фенилментила, (1)-8-фенилментила, (+)-норэфедрина и (-)-норэфедрина Более предпочтителен R4 - (1)-ментил или (dj-ментил, но наиболее предпочтителен R4 - (1)-ментил Предпочтительно, когда W - О, а X - S Предпочтительно, когда G - галоген, такой, как CI, Вг или J, а более предпочтительно - CI Промежуточные реагенты формул (IVa) и (IVb) могут быть изолированы или, если это удобно, получены in situ Промежуточные реагенты формул (IVa) и (IVb) удобно получать из соответствующих трансспиртов формул (Va) и (Vb) in < і т он (Va) (Vb) где R3, W и X определены ранее, или из эпимерных цис-спиртов формул (Vc) и (Vd) (Vd) реакцией с реагентом, пригодным для введения группы G Подходящие реагенты для введения группы G хорошо известны специалистам в данной области и включают, например такие галогенирующие агенты, как, оксалилбромид Предпочтительными галогенизаторами являются реагенты Вильсмайера, которые удобно получать in situ реакцией такого N.N-дизамещенного амида, как диметилформамид (ДМФ), с таким галогенизатором, как оксалилгалогенид, например, оксалилхлорид, тионилгалогенид (например, тионилхлорид), фосфоргалогенид (например, трихлорид или оксихлорид фосфора), алкил- или фенилсульфонилгалогенид, или ангидрид Реакцию галогенирования можно проводить при обычных условиях Промежуточные реагенты формул (IVa) и (IVb) удобно вводить в реакцию с силилированным пуриновым или пиримидиновым основанием в таком подходящем органическом растворителе, как углеводород (например, толуол), или такой галогенированный углеводород, как дихлорметан, или такой нитрил, как ацетонитрил, или такой амид, как диметилформамид, или такой сложный эфир, как этилацетат, или такой простой эфир, как тетрагидрофуран, или такой кетон, как ацетон, или их смесь, предпочтительно при повышенной температуре, такой, как температура выбранного растворителя в обратном холодильнике Силилированные пуриновые и пиримидиновые основания можно приготовить, как описано в публикации W092/20669, включенной сюда ссылкой, например, реакцией пуринового или пиримидинового основания с таким силилирующим реагентом, как t-бутилдиметилсилилтрифлат, 1,1,1,3,3,3-гексаметилдисилазан, триметилсилилтрифлат или триметилсилилхлорид в присутствии кислотного или щелочного катализатора Подходящие способы подробно описаны в прилагаемых примерах Аналоги цис-нуклеозидов, полученные реакцией соединения формулы (I) с пуриновым или пиримидиновым основанием или их аналогом, могут быть затем восстановлены для получения конкретного стереоизомера формулы (I) Подходящие восстановители хорошо известны специалистам в данной области и включают, например, такие гидридные восстановители, как литийалюмогидрид, литийборгидрид или натрийборгидрид Мы установили, что стереоспецифичность поддерживают использованием в качестве восстановителя натрийборгидрида в присутствии фосфатного или боратного буфера, например, динатрийгидрофосфата В соответствии со способом согласно изобретению и способом согласно WO92/20669 целевой продукт обычно получают в виде раствора в таком полярном растворителе, как водный растворитель На практике это - из-за высокой растворимости соединений формулы (І) в полярной среде - затрудняет их эффективное отделение от среды Мы установили, что соединения формулы (I) могут быть успешно выделены из раствора в полярном растворителе образованием плохо растворимой в воде соли При желании водонерастворимая соль может быть впоследствии обычными методами превращена в свободное основание или другую соль Далее, мы нашли, что наиболее подходящей для этого солью является салицилат Таким образом согласно изобретению предложен описанный выше способ, дополнительно предусматривающий выделение соединения формулы (I) в виде водонерастворимой соли, в частности, салицилата Салицилаты соединений формулы (I) входят в число фармацевтически приемлемых производных, описанных и заявленных в Евро-заявке 00382526 и публикации W091/17159, но не раскрытых здесь в достаточной степени Следовательно, 43362 такие соли являются новыми и составляют дополнительный объект изобретения Кроме того, согласно изобретению предложены салицилаты соединений формулы (I) или их гидраты В частности, мы установили, что образование салицилата 4-амино-1-(2Р-гидроксиметил[1,3]оксатиолан-53-ил)-1 Н-пиримидин -2-она (ламивудина, ЗТС™) дает существенные преимущества при отделении этого соединения от полярных растворителей В предпочтительном воплощении, следовательно, изобретением предусмотрен салицилат 4амино-1-(2Р-гидроксиметил-[1,3]окса-тиолан-53ил)-1Н-пиримидин-2-она или его гидраты Салицилат ламивудина представляет собой фармацевтически приемлемую соль, и как таковая она и ее гидраты могут быть использованы в качестве антивирусного препарата, описанного в заявке WO91/17159 и включенного сюда ссылкой Салицилат ламивудина или его гидраты могут служить для получения фармацевтических композиций, описанных в WO91/17159 Салицилаты соединений формулы (I) могут быть приготовлены обработкой салициловой кислотой раствора, содержащего соединение формулы (I) Подходящими растворителями могут быть, например, вода и такие полярные органические растворители, как эфиры, например, тетрагидрофуран или диоксан, и спирты, например, метанол и этанол, или смеси растворителей, в частности, смеси органического растворителя с водой При желании салицилаты удобно преобразовывать в соответствующие свободные основания обработкой основанием, для этого пригоден третичный амин, например, триэтиламин Специалисты в данной области легко могут подобрать другие водонерастворимые соли, способы их приготовления и превращения в свободные основания Промежуточные спирты (Va) и (Vb) и эпимерные цис-спирты (Vc) и (Vd) могут быть приготовлены способами, описанными в W092/20669, например, восстановлением соответствующих карбонильных соединений или конденсацией альдегида формулы R3-CHO или его производного с гидроксиацетальдегидом, или меркагтгоаце-тальдегидом, или их подходящими производными Прочие особенности получения таких спиртов можно найти в приводимых далее примерах Согласно изобретению соединения формул (Va) и (Vb) являются ключевыми промежуточными реагентами при получении энантиомерно чистых аналогов или производных цис-нуклеозидов В получаемых аналогах или производных цис-нуклеозидов формулы (I) сохраняется абсолютная стереохимия групп R3, W и X в (Va) или (Vb) В итоге реакций, используемых для получения спиртов формул (Va) и (Vb) и их цис-эпимеров (Vc) и (Vd), обычно образуются смеси изомеров При выделении соединений формул (Va) или (Vb) кристаллизацией из смесей, содержащих их энантиомеры и/или их цис-стереоизомеры, выход может быть ограничен пропорциональным содержанием желаемого изомера (Va) или (Vb) в растворе Мы также установили, что кристаллизация транс-изомеров (Va) и (Vb) предпочтительна по сравнению с кристаллизацией соответствующих цис-зомеров (Vc) и (Vd) В случаях, когда R3 - ахиральный компонент, смесь с соотношением трансизомеров (Va) и (Vb) 1 1 может быть выкристаллизована из смеси цис- и транс-изомеров (Va), (Vb), (Vc) и (Vd) Соответственно в другом или альтернативном варианте согласно изобретению предложен способ для повышения выхода трансизомеров (Va) и (Vb) из смеси цис- и транс-изомеров (Va), (Vb), (Vc) и (Vd), который предусматривает обработку смеси по меньшей мере частично растворенных цис- и транс-изомеров реагентом, способным вызвать взаимное преобразование изомеров без полного подавления кристаллизации транс-изомеров Далее, мы установили, что в случаях, когда F 3 - хиральный компонент, из смеси стереоизоме? ров можно селективно выкристаллизовать единственный транс-энантиомер формулы (Va) или (Vb) Например, соединения формулы (Va), в которых R3 -C(=O)R4, a R4 - 1-ментил, могут быть селективно выкристаллизованы из смеси стереоизомеров, в частности, из смеси, содержащей спирты (Va), (Vb) и эпимерные цис-спирты (Vc) и (Vd) Следовательно, в предпочтительном аспекте изобретения предложен способ улучшения выхода единственного энантиомера формулы (Va) или (Vb) из смеси изомеров, который включает обработку изомеров, по меньшей мере, частично в растворе, реагентом, способным вызвать взаимное преобразование изомеров без полного подавления кристаллизации желаемого единственного энантиомера (Va) или (Vb) Реагенты, способные вызвать взаимное преобразование изомеров без полного подавления кристаллизации транс-изомеров, включают, например, такие спирты, как, в частности, метанол, этанол, н-пропанол, і-пропанол, н-бутанол, і-бутанол, трет-бутанол, и органические основания, в частности, третичные амины, например, пиридин и триэтиламин и основание Хунига Предпочтителен триэтиламин Взаимопреобразование изомеров может быть проведено в любом подходящем растворителе или смеси растворителей, которые иначе не реагируют со спиртами формулы (Va) или (Vb) или их цис-изомерами при концентрации и температуре, допускающих кристаллизацию желаемого изомера или изомеров и не вызывающих значительной деградации желаемого изомера или изомеров Подходящие растворители могут, например, включать алифатические или ароматические углеводороды, сложные и простые эфиры и хлорированные углеводороды Взаимное преобразование предпочтительно проводить при температуре примерно от -20° до 120°С, более предпочтительно в пределах от -10° до 80°С, например, от 0° до 50°С Специалистам в данной области понятно, что выбор растворителя, температуры, преобразующего реагента и, особенно, количества преобразующего реагента лучше всего выполнять как интегральную процедуру, зависящую от природы групп R3, X и W, присутствующих в изомерах Однако, при использовании в качестве преобразующего реагента органического основания предпочтительное его количество обычно меньше двух 43362 молевых эквивалентов относительно общего количества используемых изомеров Дальнейшие указания относительно предпочтительных условий проведения реакции могут быть получены из приводимых примеров Взаимное преобразование изомеров можно проводить отдельно от приготовления изомерной смеси, однако, более удобно делать это совместно с приготовлением Процедуру взаимопреобразования можно использовать для повышения чистоты выделенных изомеров (Va) или (Vb) Благодаря взаимопреобразованию выход отдельного желаемого изомера (Va) или (Vb) теоретически может быть повышен более, чем на 50% от теоретического (по отношению к выходу всех стереоизомеров), обычно на величину примерно от 60% до 90%, но не исключается возможность увеличения выхода более 100% от теоретического Наиболее предпочтительное воплощение способа согласно изобретению с использованием 1-ментола в качестве хирального дополнения представлено на схеме 1 и подробно описано в примерах, предназначенных для иллюстрации способа без ограничения объема притязаний Схема 1 {не Выделено он со,н Изобретение далее иллюстрировано примерами Температуры приведены в градусах Цельсия DMSO означает диметилсульфоксид Пример 1. 4-амино-1- (2К-гидроксиметил- [1,3] оксатиолан- 5S-nn)-1 Н-пиримидин-2-он (а) 23-изопропил-5Р-метил-1Р-циклогексиловый эфир (2Р,5Р)-5-гидрокси-[1,3]оксатиолан-2карбоновой кислоты Смесь 25 г 1-ментилглиоксилатгидрата и 2,5 мл уксусной кислоты в 125 г толуола перемешивают и нагревают с обратным холодильником Отгонкой азеотропа в ловушку Дина-Старка удаляют воду Полученный раствор 1-ментилглиоксилата концентрируют отгонкой при пониженном давлении, отбирая примерно 70 мл дистиллята, после чего охлаждают до 20-25° Добавлением примерно 15 мл толуола доводят объем до 75 мл, затем добавляют 8,25 г дитиандиола и нагревают смесь с обратным холодильником в течение примерно 1 ч Смесь охлаждают до примерно 80°С и осветляют Фильтрат охлаждают до 0-5°С и примерно 1,25 ч при температуре 0-5°С добавляют раствор 1,5 мл триэтиламина в 150 мл гексана Полученную суспензию перемешивают примерно 6 ч при температуре 0-5°С Затем отфильтровывают конечный продукт, который промывают смесью толуола и гексана (1 3, 2х50мл) и высушивают в вакууме при 40-45 до постоянной массы (б) 23-изопропил-5Р-метил-1Р-циклогексиловый эфир (2Р,5Р)-5-(4-амино-2-оксо-2Н-пиримидин-1 -ил)-[1,3]оксатиолан-2-карбоновой кислоты Раствор 23-изопропил-5Р-метил-1Р-циклогексилового эфира (2R,5R)-5-xnop-[1,3]oKcaTHOлан-2-карбоновой кислоты приготовляют следующим образом 43362 Раствор 300 г 2S-H3onpormn-5R-MeTHn-1Rциклогексилового эфира (2R,5R)-5-rnflpoKCH[1,3]оксатиолан-2-карбоновой кислоты в 3000 мл дихлорметана с 0,7 мл метан сул ьфо кислоты обрабатывают 85 г диметилформамида, охлаждают примерно до 8° и в течение около 10 мин добавляют 80 мл тионилхлорида Полученный раствор перемешивают при 10-15°С около 1,5 ч и затем концентрируют отгонкой при атмосферном давлении около 1,5 ч, отбирая примерно 2,1 л дистиллята Раствор охлаждают до 20-25°С Раствор силилцитозина приготовляют следующим образом Суспензию 115,5 г цитозина, 0,7 мл метан сул ьфо кислоты и 242 мл гексаметилдисилазана в 290 мл толуола около 1,5 ч нагревают с обратным холодильником до получения прозрачного раствора Раствор силилцитозина обрабатывают 145 мл триэтиламина, добавляют раствор 2Э-изопроnHn-5R-MeTHn-1R^HM~ioreKCHnoBoro эфира (2R,5R)-5-xnopo-[1,3]оксатиолан-2-карбоновой кислоты и, промывая 300 г дихлорметана, осторожно нагревают с обратным холодильником Полученную смесь в течение 4 ч продолжают нагревать с обратным холодильником и добавляют к ней 73 мл триэтиламина и 1200 мл воды, выдержанной при 30-35°С в течение примерно 1 5 ч Полученную суспензию перемешивают примерно 45 мин, затем при 30-35°С в течение примерно 10 мин добавляют 1200 мл гексана Суспензию перемешивают при комнатной температуре в течение ночи и затем фильтруют Твердое вещество промывают водой (2x600 мл) и изопропилацетатом (2x600 мл) и высушивают в вакууме до постоянства массы 1Н ЯМР (D6-DMSO), 5H 0,75(3H,d), 0,89(d), 0,9(m), 0,91 (d), 1,0-1 2(m)(9H), (9H,m), 1,43, l,50(2H,m), 1,67(2H,m), 1,9-2,0(2H,m), 3,14(1H,dd), 3,55(1 H,dd), 4,69(1 H,dt), 5,70(1 H,s), 5,80(1 H,d), 6,36(1 H,dd), 7,28(brs), 7,33(brs)(2H), 7,97(1 H,d), (с)Моносалицилат 4-aMHHO-1-(2R-rnflpoKCHметил-[1,3]оксатио-лан-53-ил)-1 Н-пиримидин-2-она Раствор 137 г дикалийгидрофосфата в 150 мл воды перемешивают примерно при 20°С и добавляют 100 г 2S-H3onponnn-5R-MeTHn-1R^HKnoгексилового эфира (2R,5R)-5-(4-aMHHO-2-OKCo-2Hпиримидин-1 -ил)-[1,3]оксатиолан-2-карбоновой кислоты Добавляют 750 мл IMS (аббревиатура не определена - прим переводчика) и суспензию перемешивают 10 мин В течение 70 мин при поддержании температуры в пределах 15-20°С добавляют 20 г раствора боргидрида натрия в 200 мл воды, содержащей 2 мл 25%-го (по массе) едкого натра Воронку, через которую добавляли компоненты, промывают 50 мл воды, и смесь перемешивают при 15-30°С до тех пор, пока завершение реакции не будет зафиксировано с помощью ВЭЖХ Смесь отстаивают, нижний водный слой удаляют, рН оставшейся органической фазы доводят до 4-4,5 27 мл концентрированной соляной кислоты, поддерживая температуру в пределах 20-25°С Воронку, через которую добавляли компоненты, промывают 20 мл воды, и реакционную смесь перемещают в дистиллятор, промывают 50 мл воды и нагревают раствор с обратным холодильником Раствор упаривают примерно в 6,45 раза (по объему) при атмосферном давлении, затем охлаждают до 20-25°С Ментол экстрагируют толуолом (500 мл, 2x200 мл), водную фазу разбавляют 255 мл воды, затем обрабатывают 36 г салициловой кислоты, промытой 40 мл воды Смесь подогревают до 71 для получения раствора, затем охлаждают до 58°С вносят в раствор затравку чистого салицилата ламивудина и далее в течение примерно 4 ч охлаждают его до 5-10°С Суспензию перемешивают при этой температуре в течение 1 ч, затем фильтруют Конечный продукт промывают водой (1x100 мл, 2x200 мл) и высушивают в вакууме до постоянной массы 1Н ЯМР (D6-DMSO), 5Н 3,11(dd), 3,45(dd) (2H), 3,77(2H,m), 5,20(1 H,m), 5,82(1 H,d), 6,22(1 H,m), 6,91 (2H,m), 7,48(1 H,m), 7,62(2H,br), 7,80(1 H,dd), 7,92(1 H,d), (д) 4-aMHHO-1-(2R-rnflpoKCHMeTHn-[1,3]oKcaтиолан-5Э-ил)-1 Н-пиримидин-2-он 66,7 г моносалицилата 4-aMHHO-1-(2R-rnflроксиметил-[1,3]ок-сатиолан-58-ил)-1 Н-пиримидин-2-она перемешивают с 470 мл IMS и подогревают до 70-75°С до получения раствора, который осветляют в кристаллизаторе и промывают еще 170 мл IMS Добавляют 26 мл триэтиламина и отгонкой (растворителя) доводят объем раствора до 280 мл В течение 20 мин раствор охлаждают до 70°С, вносят затравку, затем в течение 2,25 ч добавляют 600 мл изопропилацетата с температурой 60°С, поддерживая температуру выше 55°С В течение ночи смесь охлаждают до комнатной температуры, затем охлаждают до 8-10°С и перемешивают в течение 1 ч Конечный продукт отфильтровывают (перенося на фильтр с 30 мл изопропилаце-тата), промывают изопропилацетатом (2x130) и высушивают в вакууме при 40-45°С до постоянной массы 1Н ЯМР (D6-DMSO), 5H 3,10 (1H,dd), 3,39(1H,dd), 3,72(2H,m), 5,15(1H,t), 5,29(1H,t), 5,72 (1H,d), 6,19(1H,dd), 7,17(1H,brs), 7,22(1 H.brs), 7,80(1 H,d), Тираж 50 екз Відкрите акціонерне товариство «Патент» Україна, 88000, м Ужгород, вул Гагаріна, 101 (03122) 3 - 7 2 - 8 9 (03122) 2 - 5 7 - 0 3
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C07D 473/00, C07D 473/18, C07D 339/00, C07D 327/00, C07D 473/34, C07D 411/00
Мітки: синтезу, способом, спосіб, цим, аналогів, одержані, саліцилати, нуклеозиду, діастереоселективного
Код посилання
<a href="https://ua.patents.su/8-43362-sposib-diastereoselektivnogo-sintezu-analogiv-nukleozidu-ta-salicilati-oderzhani-za-cim-sposobom.html" target="_blank" rel="follow" title="База патентів України">Спосіб діастереоселективного синтезу аналогів нуклеозиду та саліцилати, одержані за цим способом</a>
Попередній патент: Композиція для виготовлення теплоізоляційного волокнистого матеріалу
Наступний патент: Покрівля бірозпірної конструкції
Випадковий патент: Пружний елемент