Спосіб одержання 1-арил-5-метил-n-r2-1н-1,2,3-триазол-4-карбоксамідів
Номер патенту: 74234
Опубліковано: 25.10.2012
Автори: Матійчук Василь Степанович, Обушак Микола Дмитрович, Шийка Ольга Ярославівна, Походило Назарій Тарасович
Формула / Реферат
Спосіб одержання 1-арил-5-метил-N-R2-1H-1,2,3-триазол-4-карбоксамідів, що ґрунтується на взаємодії арилазидів з біфункціональними реагентами, який відрізняється тим, що арилазиди додають до розчину аміну, триетиламіну та дикетену в еквімолярних співвідношеннях в ацетонітрилі і нагрівають 10-45 хв. при 70-80 °C, охолоджують до кімнатної температури, розводять водою у 0¸2 рази до початку утворення осаду, осад відфільтровують і одержують сполуки загальної формули:
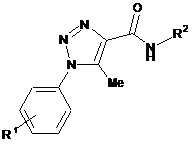 ,
,
де R1 = алкіл, алкокси, галоген; R2 = алкіл, арил.
Текст
Реферат: 2 Спосіб одержання 1-арил-5-метил-N-R -1H-1,2,3-триазол-4-карбоксамідів включає додавання арилазидів до розчину аміну, триетиламіну та дикетену, нагрівання, охолодження, розведення водою, утворення осаду, відфільтровування осаду. UA 74234 U 2 (54) СПОСІБ ОДЕРЖАННЯ 1-АРИЛ-5-МЕТИЛ-N-R -1H-1,2,3-ТРИАЗОЛ-4-КАРБОКСАМІДІВ UA 74234 U UA 74234 U 5 10 15 20 25 Корисна модель належить до органічної хімії, а саме до способів одержання практично корисних органічних сполук, які можуть бути використані у фармакології як біологічно активні сполуки. Відомий спосіб цілеспрямованого синтезу (TGS) амідів триазолокарбонової кислоти, які діють на протеїн сімейства Всl-2, за допомогою циклоприєднання азидів до алкінів [Пат. 105746 А2. Triazoles and processes for producing the same / Manetsch R.[US], Wang, H.-g. [US], Hu X. [US], Kulka-Mi S. [US], Sun J. G. [US]; University of South Florida; H. Lee Moffitt Cancer Center and Research Institute [US]. - № PCT/US2009/034845; Заявл. 23.02.09; Опубл. 27.08.09; - 89 с]. Сімейство протеїнів Bcl-2 пригнічує апоптоз у багатьох клітинних системах, відповідає за регуляції мітохондріального шляху апоптозу. Проте загальні виходи одержуваних сполук невисокі, а спосіб синтезу є багатостадійним. Найближчим аналогом є спосіб синтезу амідів триазолокарбонових кислот [Пат. 1867331 ЕР. Triazole derivative and the use thereof / Taniguchi T. [Japan], Kubo K. [Japan], Tobisu M. [Japan], Honda E. [Japan], Fukase Y. [Japan]; Kawamura M. [Japan], Nakayama M. [Japan]; Takeda Pharmaceutical Company Limited (JP) - № EP20060731733 20060406; Заявл. 06.04.06; Опубл. 19.12.07; - 395 с.], який полягає у взаємодії арилазидів з 3-кетоамідами. Недоліком способу є те, що вихідні реагенти необхідно синтезувати окремо у кілька стадій, що збільшує енерговитрати, трудомісткість процедур, час необхідний на одержання цільового продукту і знижує загальні виходи кінцевих сполук. В основу корисної моделі поставлена задача удосконалити спосіб одержання заміщених 12 арил-5-метил-N-R -1H-1,2,3-триазол-4-карбоксамідів шляхом використання комерційно доступних реагентів і реакцій, які проходять з високими виходами, що дасть змогу одержати здешевлені цільові сполуки та спростити процес їх одержання. Поставлена задача вирішується тим, що у способі одержання заміщених 1-арил-5-метил-N2 R -1H-1,2,3-триазол-4-карбоксамідів, який полягає у взаємодії арилазидів з біфункціональними реагентами, арилазиди додають до розчину аміну, триетиламіну та дикетену в еквімолярних співвідношеннях в ацетонітрилі і нагрівають 10-45 хв. при 70-80 °C, охолоджують до кімнатної температури, розводять водою у 02 рази до початку утворення осаду, осад відфільтровують і одержують сполуки загальної формули: 30 O N N N H N R 2 Me R 1 1 35 40 45 50 2 де R = алкіл, алкокси, галоген; R = алкіл, арил. З літературних джерел відомо, що похідні 1H-1,2,3-триазолу є привабливими сполуками для фармацевтичних досліджень завдяки біоізостеризму триазольного кільця з пептидним зв'язком і стійкості до метаболізму. Зокрема, представники 1,2,3-триазолу досліджені як інгібітори кінази-3 глікогенсинтетази (GSK 3) [Olesen, P.H.; Sorensen, A.R.; Ursoz, В.; Kurtzhals, P.; Bowler, A.N.; Ehrbar, U.; Hansen, B.F. J. Med. Chem. 2003, 46, 3333-3341.], антагоністи ГАМК рецепторів [Bascal, Z.; Holden-Dye, L.; Willis, R.J.; Smith, S.W.G.; Walker, R. J. Parasitology, 1996, 112, 253269; Biagi, G.; Giorgi, I.; Livi, O.; Lucacchini, A.; Martini, C; Scartoni, V. J. Pharm. Sci. 1993, 82, 893896.], агоністи мускаринових холінергічних рецепторів [Moltzen, Е.К.; Pedersen, H.; Bogeso, K.P.; Meier, E.; Frederiksen, K.; Sanchez, C; Lembol, K.L. J. Med. Chem. 1994, 37, 4085-4099.], нейролептики [Chakrabarti, J.K.; Hotten, T.M.; Pullar, I.A.; Steggles, D.J. J. Med. Chem. 1989, 32, 2375-2381.]. Для цих сполук виявлена антиретровірусна [Alvarez, R.; Velazquez, S.; San-Felix, A.; Aquaro, S.; De Clercq, E.; Perno, C.-F.; Karlsson, A.; Balzarini, J.; Camarasa, M. J. J. Med. Chem. 1994, 37, 4185-4194.], цитотоксична [Sanghvi, Y.S.; Bhattacharya, B.K.; Kini, G.D.; Matsumoto, S.S.; Larson, S.B.; Jolley, W.B.; Robins, R.K.; Revankar, G.R. J. Med. Chem. 1990, 33, 336-344.] та антигістамінна [Buckle, D.R.; Rockell, C.J.M.; Smith, H.; Spicer, B.A. J. Med. Chem. 1986, 29, 22622267] дія. Триазольний фрагмент є в антибіотику Cefatricin [Fass, R. J.; Prior, R. B. Curr. Ther. Res. 1978, 24, 352-365.] та препараті протисудомної дії, який застосовують для лікування епілепсії Rufinamide [Пат. 056773 WO. Crystal modification of 1-(2,6-difluorobenzyl)-1h-1, 2,3triazole-4-carboxamide and its use as antiepileptic / Portmann, R.; Hofmeier, U. C; Burkhard, A.; 1 UA 74234 U 5 10 15 20 Scherrer, W.; Szelagiewicz, M.; Novartis AG [CH] - № PCT/EP1998/003428; Заявл. 08.06.1998; Опубл. 17.12.1998;-25 с]. Відоме застосування нових похідних триазолу, що є антагоністами рецептора тромбіну [Пат. 1867331 ЕР. Triazole derivative and the use thereof/ Taniguchi T. [Japan], Kubo K. [Japan], Tobisu M. [Japan], Honda E. [Japan], Fukase Y. [Japan]; Kawamura M. [Japan], Nakayama M. [Japan]; Takeda Pharmaceutical Company Limited (JP) - № EP20060731733 20060406; Заявл. 06.04.06; Опубл. 19.12.07; - 395 c.], які можуть бути використані для профілактики чи лікування тромбозу, судинного рестенозу, ішемічного інсульту, серцевих хвороб, ДВС-синдром (дисеміноване внутрішньосудинне згортання), неврологічних захворювань та для лікування злоякісних пухлин. Відоме застосування амідів триазолокарбонової кислоти в терапії хвороб, пов'язаних з антагонізмом метаботропних глутаматних рецепторів (mGluR) [Пат. 115486 WO. Triazole amide derivatives for use in therapy / Garzya, V. [IT], Watson S. P [GB]; Glaxo Group Limited [GB]. - № PCT/EP2009/053070; Заявл. 16.03.09; Опубл. 24.09.09; - 71 с]. Відоме застосування похідних триазолокарбонілгуанідинів для лікування захворювань, пов'язаних з інгібіторами натрій-водневого обміну (NHE-1), що використовують для відновлення пошкоджених у результаті ішемії тканин [Пат. 006492401 В1 US. N-[(Substituted five-membered di- or triaza diunsaturated ring) carbonyl] guanidine derivatives for the treatment of ischemia / Hamanaka E.S. (US), Guzman-Perez A. (US), Ruggeri, R.B. (US), Webster R.T. (US), Mularski CJ. (US); Pfizer, Inc. - № 09/367,731; Заявл. 05.02.99; Опубл. 02.09.99; - 84 с]. Автори вперше розробили одностадійну схему перетворень: встановлено, що доступні арилазиди 1, аміни 3, та дикетен 2 в еквімолярних співвідношеннях при нагріванні в ацетонітрилі упродовж 10-45 хв. при 70-80 °C у присутності триетиламіну як каталізатора 2 утворюють з високими виходами 1-арил-5-метил-N-R -1H-1,2,3-триазол-4-карбоксаміди 4 (табл. 1): 25 O N O N3 + R + O R 2 NH2 Et3N 2 Me MeCN 3 {1-8} 2 R 1 4 Спосіб можна проілюструвати прикладом. Фенілазид (1.19 г; 10 ммоль), додають до розчину циклопентанаміну (0.85 г; 10 ммоль), триетиламіну (1.4 мл; 10 ммоль) та дикетену (0.84 г; 10 ммоль) в ацетонітрилі (10 мл) і нагрівають 30 хв. при 80 °C, охолоджують до кімнатної температури. Осад, що утворився, відфільтровують і одержують N-циклопентил-5-метил-1-феніл-1Н-1,2,3-триазол-4-карбоксамід. 1 2 Розшифровка замісників R , R та приклади сполук, одержаних за цим способом: O N N N H N R 2 Me 35 N H N R 1 1 {1-15} 30 N R 1 2 UA 74234 U 1 {1-15} R 1 1 H 3 {1-8} 2 3 4 5 6 7 8 9 10 11 12 13 14 15 23-Ме 4-Ме 4-Bu 4-iPr 2-F 4-F 2-Cl 3-Cl 4-І 2-MeO 3-MeO 4-MeO 4-PrO Me 1 2 3 4 5 Me R 2 NH2 NH2 Me O HN Me 6 7 NH2 O H2 N 3 {1-8} NH2 NH2 Me S O 8 NH2 R 2 NH2 O 5 N N S O NH2 NH2 Будову одержаних сполук підтверджують дані ЯМР спектроскопії записані на приладі Varian 1 Unity+400 (400 МГц для H) у ДМСО-d6 (табл. 2), та мас-спектри одержані на хромато-масспектрометрі Agilent 1100 LC/MSD зі способом іонізації API-ES/APCI (табл. 1). Таблиця 1 Характеристики одержаних сполук Номер сполуки 4{1,1} 4{5,1} 4{10,1} 4{1,2} 4{9,2} 4{11,2} 4{15,2} 4{1,3} 4{12,3} 4{13,3} 4{1,4} 4{1,5} 4{4,5} 4{13,5} 4{4,5} 4{1,6} 4{4,6} 4{7,6} 4{8,6} 4{1,7} 4{2,7} 4{3,7} 4{6,7} 4{12,7} 4{1,8} 4{2,8} 4{8,8} 4{10,8} Мас-спектр, + m/z [M ] 270 326 304 286 320 412 344 341 371 371 336 312 326 342 342 320 334 338 338 293 307 307 335 323 293 307 311 327 1 IЧ спектр, v (cm' ) Т.пл., °C Вихід, % Чистота, % 1662 (CO); 3350 (NH) 1655 (CO); 3348 (NH) 1680 (CO); 3365 (NH) 1660 (CO); 3330 (NH) 1655 (CO); 3338 (NH) 1685 (CO); 3370 (NH) 1657 (CO); 3310 (NH) 1692 (CO); 3140, 3390 (NH) 1675 (CO); 3138, 3371 (NH) 1688 (CO); 3130, 3385 (NH) 1680 (CO); 3370 (NH) 1645 (CO); 3302 (NH) 1633 (CO); 3312 (NH) 1640 (CO); 3300 (NH) 1638 (CO); 3298 (NH) 1670 (CO); 3385 (NH) 1665 (CO); 3372 (NH) 1685 (CO); 3395 (NH) 1690 (CO); 3399 (NH) 1655 (CO); 3348 (NH) 1652 (CO); 3340 (NH) 1662 (CO); 3350 (NH) 1665 (CO); 3348 (NH) 1654 (CO); 3288 (NH) 1648 (CO); 3298 (NH) 1655 (CO); 3305 (NH) 1630(CO);3320(NH) 1628 (CO); 3283 (NH) 134 125 107 83 68 79 89 132 122 109 171 111 102 101 123 218 200 234 183 112 101 117 119 116 133 101 127 76 85 71 75 69 86 94 80 84 58 74 89 91 91 74 85 72 60 53 69 77 56 69 74 68 88 65 79 91 100 99 100 97 100 100 99 100 100 99 100 99 100 98 100 98 99 100 98 99 100 99 100 98 100 98 100 100 3 UA 74234 U Таблиця 2 1 Спектри ЯМР Н одержаних сполук Номер сполуки 4{1,1} 4{5,1} 4{10,1} 4{1,2} 4{9,2} 4{11, 2} 4{15,2} 4{1,3} 4{12,3} 4{13,3} 4{1,4} 4{1,5} 4{4,5} 4{13,5} 4{14,5} 4{1,6} Хімічні зміщення, , м.ч. 1.57-1.67 (4Н, м, НсРn), 1.74-1.81 (2Н, м, НсРn), 1.90-1.98 (2Н, м, НсРn), 2.57 (3Н, с, Me), 3 3 4.25-4.32 (1H, м, НсРn), 7.56 (2Н, д, J7.8, HPh-3,5), 7.60 (1Н, м, HPh-4), 7.62 (2Н, д, J7.8, 3 HPh-2,6), 8.03 (1Н, д, J7.8, NH) 3 0.96 (3Н, т, J7.8, HBu), 1-39 (2H, м, HBu), 1.57-1.63 (4H, м, HcPn), 1.65 (2H, м, HBu), 1.733 1.79 (2H, m, HcPn), 1.88-1.96 (2H, м, HcPn), 2.54 (3H, c, Me), 2.71 (2H, т, J7.8, HBu), 4.233 3 4.30 (1H, м, HcPn), 7.40 (2H, д, J7.8, НAr-3,5), 7.43 (2H, д, 77.8,HAr-2,6), 8.02 (1Н, д, V 8.8, NH) 1.55-1.65 (4Н, м, НсРn), 1.77-1.78 (2Н, м, НсРn), 1.88-1.95 (2Н, м, НсРn), 2.57 (3Н, с, Me), 4 4.22-4.29 (1Н, м, НсРп), 7.54 (1Н, дд, V7.8, J2.0, НАr-6), 7.60-7.64 (2Н, м, НAr-4,5), 7.67 3 (1H, с, НAr-2), 8.06 (1Н, д, J7.8, NH) 1.61-1.69 (1Н, м, HFur), 1.83-1.97 (3Н, м, HFur), 2.56 (3Н, с, Me), 3.29-3.41 (2Н, м, СН2), 3 3.63-3.70 (1Н, м, HFur), 3.80-3.86 (1H, м, HFur), 3.97-4.04 (1Н, м, HFur), 7.54 (2Н, дд, J7.8, 4 3 J2.0, HPh-2,6), 7.57-7.64 (3Н, м, HPh-3,4,5), 8.12 (1Н, т, J5.9, NH) 1.64-1.71 (1H, m, HFur), 1.84-1.99 (3Н, м, HFur), 2.39 (3H, c, Me), 3.33-3.39 (2H, м, CH2), 3.65-3.71 (1H, м, HFur), 3.81-3.87 (1H, м, HFur), 3.98-4.05 (1H, м, HFur), 7.59-7.62 (2H, м, 3 3 НAr-3,4), 7.65-7.71 (1H, м, НAr-5), 7.73 (1H, д, У7.8, НAr-6), 8.19(1H, t, J5.9,NH) 1.61-1.69 (1H, m, HFur), 1.81-2.00 (3H, m, HFur), 2.56 (3H, c, Me), 3.30-3.41 (2H, м, CH2), 3 3.63-3.71 (1H, м, HFur), 3.79-3.87 (1H, м, HFur), 3.96-4.05 (1H, м, HFur), 7.38 (2H, д, J7.8, 3 3 НAr-3,5), 7.42 (2H, д, J8.8, HAr-2,6), 8.08 (1H, т, J 5.9, NH) 3 1.06 (3H, t, J7.8, CH3), 1.61-1.69 (1H, м, HFur), 1-81 (2H, м, СН2), 1.85-1.98 (3H, м, HFur), 2.51 (3H, c, Me), 3.31-3.40 (2H, м, CH2), 3.64-3.71 (1H, м, HFur), 3.80-3.87 (1H, m, HFur), 3 3 3 3.99 (1H, м, HFur), 4.01 (2H, т, /6.8, CH2O), 7.08 (2H, д, У8.8, НAr 3, 5), 7.94 (2H, д, J8.8, 3 HAr-2,6), 8.07 (1Н, т, J5.9, NH) 2 3 1.10 (6Н, с, Me), 1.22 (2Н, д, J12.7, СН2), 1.24 (6Н, с, Me), 1.73 (2Н, дд, J3.9, V12.7, 3 4 СН2), 2.57 (3Н, с, Me), 4.26-4.36 (1Н, м, СН), 7.57 (1H, дт, J6.8, J2.0, HPh-4), 7.60 (2Н, 3 м, НPh-3,5), 7.64 (2Н, дд, V6.8, V2.0, HPh-2,6), 7.89 д (1Н, J8.8,NH) 2 3 2 1.07 (6Н, с, Me), 1.18 (2Н, д, J 12.7, СН2), 1.21 (6Н, с, Me), 1.72 (2Н, дд, J3.9, J2.7, 3 СН2), 2.34 (3Н, с, Me), 3.82 (3Н, с, МеО), 4.24-4.34 (1H, м, СН), 7.13 (1Н, т, J7.8, НAr-4), 3 3 3 7.26 (1H, д, J7.8, HAr-3), 7.35 (1Н, д, J7.8, НAr-6), 7.58 (1H, т, J7.8, НAr-5), 7.80 (1H, д, 3 J7.8, NH) 2 3 2 1.07 (6Н, с, Me), 1.19 (2Н, д, J12.7, СН2), 1.22 (6Н, с, Me), 1.71 (2Н, дд, J3.9, J12.7, СН2), 2.55 (3Н, с, Me), 3.85 (3Н, с, МеО), 4.25-4.34 (1H, м, СН), 7.07 (1Н, д, V7.8, НAr4), 3 3 3 7.08 (1H, д, J7.8, НAr-6), 7.12 (1H, с, НAr-2), 7.49 (1H, т, J7.8, НAr-5), 7.84 (1H, д, J7.8, NH) 3 3 3 2.61 (3Н, с, Me), 4.22 (4Н, дд, J4.9, J8.8, СН2), 6.73 (1Н, д, J8.8, HAr-5), 7.26 (1H, дд, 3 4 3 J8.8, J2.9, НAr6), 7.44 (1Н, д, J2.0, НAr-2), 7.57-7.66 (5Н, м, HPh), 10.1c(1H, NH) 3 3 3 2.58 (3Н, с, Me), 3.11 (2Н, т, J7.8, СН2), 3.57 (2Н, дт, /7.8, J5.9, CH2), 6.90 (1Н, д, 3 3 3 4 J2.9, НTh-3), 6.94 (1Н, м, HTh-4), 7.20 (1H, д, J4.9, HTh-5), 7.55 (2Н, дд, J7.8, J2.0, HPh3 2,6), 7.59-7.66 (3Н, м, HPh-3,4,5), 8.55 т (1H, J5.9, NH) 3 3 2.45 (3Н, с, Me), 2.54 (3Н, с, Me), 3.08 (2Н, т, J6.8, СН2), 3.55 (2Н, q, J6.8, СН2), 6.88 3 3 3 3 (1H, д, J2.9, НTh-3), 6.92 (1H, дд, J2.9, J4.9, HTh-4), 7.20 (1Н, д, J4.9, НTh-5), 7.39 (2Н, 3 3 3 д, J8.8, НАг-3,5), 7.41 (2Н, д, J8.8, НAr2,6), 8.50 (1H, т, J5.9,NH) 3 3 2.59 (3Н, с, Me), 3.11 (2Н, т, J6.8, СН2), 3.57 (2Н, q, J6.8, CH2), 3.87 (3Н, с, Me), 6.90 3 (1Н, д, J2.9, НTn-3), 6.94 (1Н, м, HTh-4), 7.12 (3Н, м, НAr-2,3,4), 7.20 (1H, д, V3.9, НTh-5), 3 4 3 7.51 (1Н, дд, J7.8, J2.0, НAr-2), 8.53 (1Н, т, J5.9, NH) 3 2.51 (3Н, с, Me), 3.08 (2Н, т, J6.8, СН2), 3.55 (2Н, q, V6.8, СН2), 3.86 (3Н, с, МеО), 6.88 3 3 3 (1H, д, J2.9, НTh-3), 6.91 (1H, м, HTh-4), 7.10 (2Н, д, J8.8, НAr-3,5), 7.19 (1Н, д, J4.9, 3 3 НTh-5), 7.44 (2Н, д, J8.8, НАг-2,6), 8.48 (1Н, т, /5.9, NH) 2.30-2.39 (1H, м, HTh), 2.40-2.48 (1H, м, HTh), 2.57 (3Н, с, Me), 3.13-3.26 (2Н, м, НTh), 3.30-3.41 (2Н, м, HTh), 4.71-4.79 ПН, м, HTh), 7.54-7.60 (3Н, м, HPh-3,4,5), 7.62 (2Н, д, 3 J7.8, HPh-2,6), 8.98 (1H, д, 1/7.8, NH) 4 UA 74234 U Продовження таблиці 2 Номер сполуки Хімічні зміщення, , м.ч. 2.30-2.38 (1H, м, HTh), 2.40-2.45 (1H, м, HTh), 2.46 (3Н, с, Me), 2.54 (3Н, с, Me), 3.13-3.25 3 (2Н, м, HTh), 3.31-3.40 (2Н, м, HTh), 4.71-4.79 (1Н, м, HTh), 7.40 (2Н, д, J8.8, НAr-3,5), 3 3 7.42 (2Н, д, J8.8, НAr-2,6), 8.96 (1H, д, J7.8, NH) 2.30-2.39 (1Н, м, НTh), 2.40-2.48 (1Н, м, HTh), 2.46 (3Н, с, Me), 3.15-3.25 (2Н, м, НTh), 3 3.31-3.40 (2Н, м, НTh), 4.70-4.80 (1H, м, HTh), 7.47 (1Н, м, НAr5), 7.52 (1H, д, J8.8, НAr-6), 4{7,6} 3 3 3 4 7.62 (1Н, дт, J7.8, V2.0, НАг-4), 7.70 (1Н, ддд, J7.8, J6.8, J2.0, НAr-3), 9.02 (1Н, д, V7.8, NH) 2.31-2.39 (1Н, м, HTh), 2.41-2.48 (1Н, м, HTh), 2.55 (3Н, с, Me), 3.12-3.25 (2Н, м, HTh), 3 4{8,6} 3.31-3.40 (2Н, м, HTh), 4.71-4.80 (1H, м, HTh), 7.40 (2Н, т, J8.8, Ндг-3,5), 7.63 (2Н, дд, 3 3 3 J8.8, J4.9, HAr-2,6), 8.99 (1Н, д, J7.8, NH) 3 3 3 2.59 (3Н, с, Me), 4.63 (2Н, д, J5.8, СН2), 7.22 (1Н, дд, J6.8, J4.9, HPy-5), 7.36 (1Н, д, 3 3 3 3 4{1,7} J7.8, НPy-3), 7.57-7.67 (5Н, м, HPh), 7.72 дт (1Н, J7.8, J2.0, HPy-4), 8.52 (1H, д, J4.9, 3 НPy-6), 8.96 (1H, т, J5.8, NH) 3 3 2.04 (3Н, с, Me), 2.37 (3Н, с, Me), 4.61 (2Н, д, J5.8, СН2), 7.21 (1Н, дд, V6.8, J4.9, НPy3 3 5), 7.33 (1Н, д, J7.8, НРу-3), 7.37 (1Н, д, V7.8, НPy-3), 7.42 (1H, дд, J7.8, V6.8, НAr-4), 4{2,7} 3 3 7.48 (1Н, т, J6.8, НAr-5), 7.54 (1Н, д, 1/6.8, НAr-6), 7.71 (1Н, т, J7.8, НРу-4), 8.50 (1Н, д, 3 V4.9, НРу-6), 8.94 (1H, т, J5.8, NH) 3 2.46 (3Н, с, Me), 2.57 (3Н, с, Me), 4.60 (2Н, д, J5.8, СН2), 7.21 (1H, м, НРу-5), 7.34 (1Н, 3 3 3 д, J7.8, НAr4), 7.35 (1H, д, J7.8, НАr-2), 7.37 (1Н, с, НАr-2), 7.38 (1Н, д, J7.8, НPy-3), 7.48 4{3,7} 3 3 4 3 (1H, т, J7.8, НАr-5), 7.70 (1Н, дт, J7.8, J2.0, HPy-4), 8.50 д (1Н, J4.9, НРу-6), 8.92 (1Н, т, 3 J5.8, NH) 3 3 1.31 (6Н, д, J6.8, Me), 2.56 (3Н, с, Me), 3.03 (1Н, м, СН), 4.60 (2Н, д, J5.8, СН2), 7.21 3 3 4{6,7} (1Н, м, НPy-5), 7.34 (1H, д, J7.8, НРу-3), 7.45 (4Н, с, НАr), 7.70 (1Н, т, J7.8, НPy-4), 8.50 3 3 (1Н, д, J4.9, НРу-6), 8.90 т (1H, J5.8, NH) 3 3 4 2.38 (3Н, с, Me), 3.84 (3Н, с, МеО), 4.60 (2Н, д, J5.8, СН2), 7.15 (1Н, дт, J7.8, J 1.0, 3 3 3 Наг-4), 7.22 (1Н, дд, J7.8, J4.9, НРу-5), 7.27 (1H, д, J7.8, HPy-3), 7.37 (2Н, м, НAr-3,4), 4{12,7} 3 4 3 3 3 7.57 (1H, тд, J 8.8, J 1.0, НAr -6), 7.70 (1Н, дт, J7.8, J2.0, НРу-4), 8.50 (1Н, д, J 4.9, Ру 3 НРу-6), 8.90 (1H, т, J 5.8, NH) 3 3 3 3 2.57 (3Н, с, Me), 4.49 (2Н, д, J5.8, СН2), 7.27 (1Н, дд, J7.8, J4.9, HPy-5), 7.55 (2Н, дд, J 3 3 4{1,8} 7.8, J 2.0, HPh-2,6), 7.57-7.64 (3Н, м, HPh-3,4,5), 7.74 (1H, дд, J 7.8, V2.0, НPy -4), 8.40 3 3 (1Н, д, J4.9, Ру НРу-6), 8.55 (1H, д, V2.0, НPy -2), 9.15 (1Н, т, J5.8,NH) 3 3 2.03 (3Н, с, Me), 2.37 (3Н, с, Me), 4.50 (2Н, д, J5.8, СН2), 7.29 (1Н, дд, V7.8, J4.9, НPy3 3 4{2,8} 5), 7.31 (1Н, д, J 7.8, НАг-3), 7.42 (1Н, т, J 7.8, НAr -4), 7.45-7.54 (2Н, м, НAr -5,6), 7.76 3 3 3 (1Н, д, J7.8, НРу-4), 8.41 (1Н, д, J4.9, НРу-6), 8.56 (1Н, с, НРу-2), 9.15(1H, t, J5.8,NH) 3 3 3 2.59 (3Н, с, Me), 4.49 (2Н, д, J5.8, СН2), 7.28 (1Н, дд, J 7.8, J4.9, HPy-5), 7.55 (1Н, д, 3 3 4{8,8} J6.8, НAr -4), 7.62 (2Н, м, НAr -5,6), 7.67 (1H, с, НAr -2), 7.74 (1Н, д, J7.8, НРу-4), 8.40 3 (1Н, д, J4.9, НРу-6), 8.55 (1H, с, НРу-2), 9.15 (1H, br.c, NH) 3 3 3 2.56 (3Н, с, Me), 4.49 (2Н, д, J5.8, СН2), 7.28 (1Н, дд, J7.8, J 4.9, НРу-5), 7.38 (2Н, т, 3 3 3 3 4{10,8} J7.8, НAr -3.5), 7.62 (2Н, дд, J 8.8, J4.9, НAr -2,6), 7.74 (1Н, д, J7.8, HPy-4), 8.40 (1H, д, 3 V4.9, НPy -6), 8.55 (1H, с, НРу-2), 9.14 (1H, т, J5.8, NH) 4{4,6} 2 5 Спосіб дає змогу одержувати 1-арил-5-метил-N-R -1H-1,2,3-триазол-4-карбоксаміди за одну стадію, з високими виходами і високої чистоти з комерційно доступних вихідних речовин, що вигідно відрізняє його від відомого способу і підтверджує передбачуваний технічний результат. 5 UA 74234 U ФОРМУЛА КОРИСНОЇ МОДЕЛІ 2 5 Спосіб одержання 1-арил-5-метил-N-R -1H-1,2,3-триазол-4-карбоксамідів, що ґрунтується на взаємодії арилазидів з біфункціональними реагентами, який відрізняється тим, що арилазиди додають до розчину аміну, триетиламіну та дикетену в еквімолярних співвідношеннях в ацетонітрилі і нагрівають 10-45 хв. при 70-80 °C, охолоджують до кімнатної температури, розводять водою у 02 рази до початку утворення осаду, осад відфільтровують і одержують сполуки загальної формули: O N N N H N R 2 Me R 10 1 , 1 2 де R = алкіл, алкокси, галоген; R = алкіл, арил. Комп’ютерна верстка M. Мацело Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 6
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of 1-aryl-5-mehyl-n-r2-1h-1,2,3-triazol-4-carboxamides
Автори англійськоюPokhodylo Nazarii Tarasovych, Obushak Mykola Dmytrovych, Matiichuk Vasyl Stepanovych, Shyika Olha Yaroslavivna
Назва патенту російськоюСпособ получения 1-арил-5-метил-n-r2-1н-1,2,3-триазол-4-карбоксамидов
Автори російськоюПоходило Назарий Тарасович, Обушак Николай Дмитриевич, Матийчук Василий Степанович, Шийка Ольга Ярославовна
МПК / Мітки
МПК: C07D 249/06, C07D 403/12, C07D 401/12
Мітки: спосіб, 1-арил-5-метил-n-r2-1н-1,2,3-триазол-4-карбоксамідів, одержання
Код посилання
<a href="https://ua.patents.su/8-74234-sposib-oderzhannya-1-aril-5-metil-n-r2-1n-123-triazol-4-karboksamidiv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 1-арил-5-метил-n-r2-1н-1,2,3-триазол-4-карбоксамідів</a>
Попередній патент: Двотактний симетричний підсилювач струму
Наступний патент: Фурма для нанесення шлакового гарнісажу на футерівку конвертера
Випадковий патент: Спосіб визначення модуля пружності матеріалів












